一种精子核dna完整性检测方法及检测试剂盒
技术领域
1.本发明涉及体外诊断试剂技术领域,尤其涉及一种精子核dna完整性检测方法及检测试剂盒。
背景技术:
2.精子染色体是一种由dna缠绕组蛋白所形成的高度折叠结构。成熟精子染色体不容易被各种致畸因子影响,难以发生dna链的断裂。有研究显示,成熟精子中染色体的包裹程度并不能完全避免dna损伤的发生,在射出精子中亦可以检测到dna碎片。
3.dna作为人类遗传信息的重要载体,其重要性不言而喻。精子dna碎片检测可反应精子dna的完整程度,是精子内在质量判断的有效依据。精子dna缺乏完整性会影响到精子的活性,进而影响受精过程。因此,进行精子dna完整性检测是意义非凡的。
4.现有技术下的精子核dna完整性检测试剂盒具有以下缺点:1)产品未在流式细胞仪下验证检测,无法与流式细胞仪配套使用;大部分已有产品只能通过荧光显微镜进行染色观察,只能对核受损的精子数量进行观察计数,无法分析碎片程度和未成熟精子的比例,最终导致在临床检测中十分的不方便。
技术实现要素:
5.本发明的目的在于提供一种精子核dna完整性检测方法及检测试剂盒,能够直观、高敏感性的检测精子核的完整性,可为实际的临床检测工作带来较大的便利。
6.为实现上述目的,第一方面,本发明提供了一种精子核dna完整性检测方法,包括以下步骤:
7.基于采集标准获取精液样本,并在20℃~37℃下,对收集的所述精液样本进行保温以及液化;
8.利用精液稀释液将液化后的所述精液样本进行稀释,并加入流式管底部后,加入酸化液进行涡旋混匀;
9.将避光染色后的混合液置于校准后的流式细胞仪中进行检测,得到核完整的精子区域及指数。
10.其中,所述方法还包括:
11.利用精液冻存液将流式细胞仪检测之后所剩的精液样本或者未经检测的液化后的所述精液样本进行保存。
12.其中,利用精液稀释液将液化后的所述精液样本进行稀释,并加入流式管底部后,加入酸化液进行涡旋混匀之后,所述方法还包括:
13.涡旋混匀30s后,加入600μl染色液,并涡旋混匀,避光染色5分钟。
14.其中,将避光染色后的混合液置于校准后的流式细胞仪中进行检测,得到核完整的精子区域及指数,包括:
15.基于流式细胞仪获取的数据,建立前项和侧向流式图,除去碎片,得到精子细胞;
16.根据得到的精子细胞建立红光通道和绿光通道的双参数散点图,通过分析和设置不同圈门,得到核完整的发绿色荧光的精子以及对应的碎片指数。
17.其中,通过分析和设置不同圈门,得到核完整的发绿色荧光的精子以及对应的碎片指数,包括:
18.根据得到的精子细胞建立红光通道和绿光通道的双参数散点图,分析第一圈门中的精子细胞,设置第二圈门除去碎片,得到具有被荧光染色的精子细胞群;
19.再次建立红光通道和绿光通道的双参数散点图,分析第二圈门中的细胞群,设置第三圈门获取未成熟精子,设置第四圈门获取核受损的精子,未圈门的即是核完整的发绿色荧光的精子。
20.其中,每个流式管中的混合液连续测试两次,每次记录5000个精子细胞。
21.第二方面,本发明提供一种精子核dna完整性检测试剂盒,适用于如第一方面所述的一种精子核dna完整性检测方法,所述精子核dna完整性检测试剂盒包括:精液冻存液、精液稀释液、酸化液、染色液。
22.本发明的一种精子核dna完整性检测方法及检测试剂盒,包括利用精液冻存液保存精液样本方法,以及基于流式细胞术的圈门及结果分析步骤,精液冻存液的使用可以大大延长精液样本稳定保存的时间,为实际临床检测提供了便利;另一方面,本技术提供了基于流式细胞术检测精子核dna完整性试剂盒,包括:精液冻存液、精液稀释液、酸化液、染色液。为临床检测提供了一种直接、客观、敏感性高、操作方便、检测时间短的人类精子核dna完整性分析方法,可及时存储已检测完剩余的或未检测的精液样本,也有利于对同一样本进行复测,可为实际的临床检测工作带来较大的便利。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
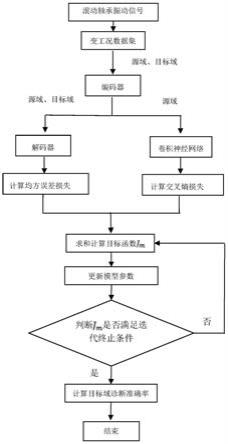
24.图1是本发明提供的一种精子核dna完整性检测方法的流程示意图。
25.图2是本发明提供的fsc/ssc散点图圈出精子细胞。
26.图3是本发明提供的percp-cy5.5/fitc双参数散点图分析r1门结果。
27.图4是本发明提供的percp-cy5.5/fitc双参数散点图分析p2门结果。
28.图5是本发明提供的scsa和scd两种方法检测dfi数值pearson相关性分析结果。
具体实施方式
29.下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
30.在本发明的描述中,需要理解的是,术语“长度”、“宽度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装
置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
31.请参阅图,本发明提供一种精子核dna完整性检测方法,包括以下步骤:
32.s101、基于采集标准获取精液样本,并在20℃~37℃下,对收集的所述精液样本进行保温以及液化。
33.具体的,首先,获取的精液样本可以来自于现场采集或者冻存精液的复溶后的精液样本,新鲜或冻存的精液标本,采样前禁欲时间为2~7天;精液样本应使用专用或指定清洁干燥、广口带刻度容器收集,采集后精液样本20℃~37℃条件下保温;室温下精液会凝固,随后发生液化,液化后的样本正常情况下应质地均匀、呈灰白色,液化的精液可立即检测,也可利用精液冻存液保存精液样本,延后检测。
34.s102、利用精液稀释液将液化后的所述精液样本进行稀释,并加入流式管底部后,加入酸化液进行涡旋混匀。
35.具体的,液化的精液用精液稀释液稀释至精子浓度为1~2
×
106个/ml,最低浓度不低于0.5
×
106个/ml;在流式管底部加入100μl稀释后的精液样本;然后,加入200μl酸化液,并轻轻涡旋混匀;准确计时30s后,加入600μl染色液,并轻轻涡旋混匀,避光染色5分钟后上机检测。
36.s103、将避光染色后的混合液置于校准后的流式细胞仪中进行检测,得到核完整的精子区域及指数。
37.具体的,流式细胞仪经过校准后,将流式管上机,每个标本连续测试两次,每次记录5000个精子细胞加以统计分析;具体为:
38.所述的基于流式细胞术的圈门及结果分析步骤,其特征在于,包括以下步骤:
39.建立fsc(前项)和ssc(侧向)流式图,除去碎片,圈出精子细胞,如下图2所示。
40.建立percp-cy5.5(红光通道)和fitc(绿光通道)的双参数散点图,分析r1门(第一圈门)中的精子细胞,设置p2门(第二圈门)除去碎片,圈出高荧光强度的精子细胞群,如下图3所示;再次建立percp-cy5.5(红光通道)和fitc(绿光通道)的双参数散点图,分析p2门中的细胞群,设置r3门(第三圈门)圈出缺乏鱼精蛋白的未成熟精子(高绿区),设置p4门(第四圈门)圈出核受损的精子(高红区),未圈门的即核完整的发绿色荧光的精子(正常区),如下图4所示。
41.以此种圈门方法,r3门中显示的百分比即是hds(high green stainability,高绿色荧光可染性精子),反映的是缺乏鱼精蛋白的不成熟精子率;p4门中显示的百分比即是dna碎片指数dfi(dna fragmentation index),反映的是精子核dna的完整程度,dfi值越小表明精子核dna的完整程度越高,其中dfi是预测妊娠成败的最佳指标。分析检测完毕后的样本,如需留样复测,可利用精液冻存液保存所剩的未经配制的样本。
42.测定完毕后,分别用漂白剂、进样管清洗剂和灭菌后的蒸馏水依次清洗流式细胞仪5分钟,彻底清除残留于流式细胞仪进样管中的细胞碎片及荧光染料。
43.其中,利用精液冻存液将流式细胞仪检测之后所剩的精液样本或者未经检测的液化后的所述精液样本进行保存,具体包括如下步骤:
44.⑴
、采集的精液样本经过液化后,按照精液样本:精液冻存液等于1:3的形式混合;
45.⑵
、将混合后的精液样本装入细胞冻存管中,并置于液氮罐中保存,保证液氮罐中
的液氮完全没过细胞冻存管;
46.⑶
、精液样本在液氮罐中可保存30天以上,如需检测,将细胞冻存管从液氮中取出,于37℃水浴复溶,1000rpm左右离心1分钟除去精液冻存液后,重复步骤s102-s103,完成冻存样本的检测。
47.一种精子核dna完整性检测试剂盒,包括:精液冻存液、精液稀释液、酸化液、染色液,所述精液冻存液为以下混合物:0.1-0.5%的氯化钠(优选0.35%)、10-30%的甘油(优选25%)、10-30%的tween 20(优选15%)的水溶液,并且所述精液冻存液的ph值为7.2-7.4。
48.所述精液稀释液为以下混合物:0.01-0.03mol/l的tris base(优选0.015mol/l)、0.1-0.2mol/l的氯化钠(优选0.17mol/l)、1-3mmol/l的edta-2na(优选1mmol/l)、5-10mmol/l的浓盐酸(优选9mmol/l)的水溶液,并且所述精液稀释液的ph值为7.2-7.4。
49.所述酸化液为以下混合物:0.1-1%tween 20的(优选0.3%)、0.1-0.2mol/l的氯化钠(优选0.15mol/l)、50-100mmol/l的浓盐酸(优选70mmol/l)的水溶液,并且所述酸化液的ph值为1.2-1.5。
50.所述染色液为以下混合物:5-10μg/ml的吖啶橙(优选5.8μg/ml)、0.1-0.2mol/l的十二水合磷酸氢二钠(优选0.13mol/l)、0.01-0.03mol/l的一水合柠檬酸(优选0.01mol/l)、0.1-0.2mol/l的氯化钠(优选0.15mol/l)、1-3mmol/l的edta-2na(优选1mmol/l)、0.1-0.5%proclin 300的(优选0.1%)的水溶液,并且所述精液稀释液的ph值为7.2-7.4。
51.实施例一:
52.本实施例提供了本发明的精子核dna完整性检测试剂盒精液冻存液的具体实施方法,包括以下步骤:
53.1.物品的准备
54.tween 20、甘油、氯化钠、纯化水、细胞冻存管、流式管、流式细胞仪、光学显微镜、精液稀释液、酸化液、染色液
55.2.精液冻存液的配制
56.①
所述的精液冻存液为以下混合物:0.1-0.5%的氯化钠、10-30%的甘油、10-30%的tween 20的水溶液;
57.②
取0.35g氯化钠于烧杯中,分别加入25ml甘油及15ml tween 20,加除菌后的蒸馏水定容至100ml,以此方法配制成精液冻存液,于2℃~8℃冷藏条件下存储,备用。
58.3.精液样本的冻存
59.①
采集的精液样本经过液化后,按照精液样本:精液冻存液等于1:3的形式混合;
60.②
将混合后的精液样本装入细胞冻存管中,并置于液氮罐中保存,保证液氮罐中的液氮完全没过细胞冻存管。
61.4.冻存样本的复溶与测试
62.①
将细胞冻存管从液氮中取出,于37℃水浴复溶,1000rpm左右离心1分钟除去精液冻存液;
63.②
用精液稀释液稀释至精子浓度为1~2
×
106个/ml,最低浓度不低于0.5
×
106个/ml;
64.③
在流式管底部加入100μl步骤
②
中稀释后的精液样本;
65.④
加入200μl酸化液,并轻轻涡旋混匀;
66.⑤
准确计时30s后,加入600μl染色液,并轻轻涡旋混匀,避光染色5分钟后上机检测;
67.⑥
流式细胞仪经过校准后,将流式管上机,每个标本连续测试两次,每次记录5000个精子细胞加以统计分析;
68.⑦
测定完毕后,分别用漂白剂、进样管清洗剂和灭菌后的蒸馏水依次清洗流式细胞仪5分钟,彻底清除残留于流式细胞仪进样管中的细胞碎片及荧光染料。
69.实施例二:
70.本实施例提供了本发明基于流式细胞术的精子核dna完整性检测试剂盒(scsa法)与基于手工染色的精子染色质扩散法(sperm chromatin dispersion,scd)对精子核碎片率检测步骤及结果的对比,包括以下步骤:
71.1.物品的准备
72.①
精子dna碎片检测试剂(精子染色质扩散法)
‑‑‑
生产厂家:深圳市博锐德生物科技有限公司;
73.②
本发明提供的精子核dna完整性检测试剂。
74.2.基于手工染色的精子染色质扩散法(scd法)检测,按照精子dna碎片检测试剂(精子染色质扩散法)说明书中提供的步骤:
75.2.1试剂准备
76.①
将装有易熔凝胶的样品管(管中有0.14ml易熔凝胶)置于80℃孵育20分钟,待完全融化后,将易熔凝胶管置于37℃待用(至少平衡5分钟);
77.②
检测前将室温调整至20~28℃左右。
78.2.2标本准备
79.①
以生理盐水调整液化的新鲜精子(或液氮冻存的精子或经提取后的活动精子)浓度至5~10
×
106/ml。
80.2.3检测步骤
81.①
取已准备好的待测标本60μl,加入上述易熔凝胶已熔化的样品管中(注意37℃持续保温),充分混匀,得到悬液,37℃孵育待用。
82.②
将包被载玻片(规格为76.2
×
25.4mm)置于2~8℃冰箱预冷5分钟后取出,迅速于载玻片包被区域加入步骤
①
)制备的悬液30μl。
83.③
迅速盖上盖片,避免产生气泡;置2~8℃冰箱5分钟,使其凝固。
84.④
从冰箱中取出载玻片,小心移去覆盖在上面的盖片。
85.⑤
将载玻片立即垂直浸入盛有反应液a(a液)的反应池内,20~28℃反应7分钟。
86.⑥
取出载玻片,用滤纸吸去残存于载玻片背面及侧缘的液体(勿接触标本区);将载玻片垂直浸入盛有反应液b(b液)的反应池内,20~28℃准确反应25分钟。
87.⑦
取出载玻片,用滤纸吸去残存于载玻片背面及侧缘的液体(勿接触标本区);将载玻片水平浸入大量的纯化水中5分钟,其间换水1~2次。
88.⑧
取出载玻片,用滤纸吸去残存于载玻片背面及侧缘的液体(勿接触标本区);将载玻片垂直浸入盛有70%乙醇的反应池内,2分钟。
89.⑨
取出载玻片,用滤纸吸去残存于载玻片背面及侧缘的液体(勿接触标本区);将
载玻片垂直浸入盛有90%乙醇的反应池内,2分钟。
90.⑩
取出载玻片,用滤纸吸去残存于载玻片背面及侧缘的液体(勿接触标本区);将载玻片垂直浸入盛有100%乙醇的反应池内,2分钟;
91.空气中自然干燥。
92.每张载玻片以瑞氏染液15~20滴覆盖,等1min后再缓慢地加入瑞氏缓冲液30~40滴,以洗耳球轻轻吹打混合染液(注意勿破坏染液形成的表面张力),室温静置15min后以流水轻轻冲洗染片。
93.自然干燥或吹干。
94.40
×
显微镜下观察500个精子,计数存在dna碎片的精子数量。
95.2.4结果观察与计算:
96.①
精子dna碎片判定标准:精子头部仅产生较小的光晕或无光晕,单侧光晕的厚度不超过精子头部最小直径的1/3。
97.3.本发明的基于流式细胞术的精子核dna完整性检测(scsa法)步骤:
98.3.1试剂准备
99.本发明提供的精液冻存液、精液稀释液、酸化液、染色液
100.3.2检测步骤
101.①
液化的精液用精液稀释液稀释至精子浓度为1~2
×
106个/ml,最低浓度不低于0.5
×
106个/ml;
102.②
在流式管底部加入100μl步骤
①
中稀释后的精液样本;
103.③
加入200μl酸化液,并轻轻涡旋混匀;
104.④
准确计时30s后,加入600μl染色液,并轻轻涡旋混匀,避光染色5分钟后上机检测;
105.⑤
流式细胞仪经过校准后,将流式管上机,每个标本连续测试两次,每次记录5000个精子细胞加以统计分析;
106.4.本发明的基于流式细胞术的精子核dna完整性检测(scsa法)与基于手工染色的精子染色质扩散法(scd法)对精子核碎片率(dfi)检测结果的对比,如下:
107.scsa和scd两种方法检测精子dna碎片率的相关性
108.样本采用scsa和scd两种方法检测dfi的结果如下表1所示:
109.表1统计的40个样本scsa和scd两种方法检测dfi的结果
110.样本1234567891011121314scsa法检测dfi27.3816.6816.198.437.6918.1523.677.4417.559.271.435.7612.2416.04scd法检测dfi35.5417.1919.929.368.9617.8521.5910.3018.8611.501.506.8415.8914.21样本1516171819202122232425262728scsa法检测dfi12.259.5410.283.6021.7110.6017.0341.1746.4518.6421.414.187.3413.68scd法检测dfi15.639.9513.254.0025.3710.6718.6342.0047.6819.1725.364.468.5013.23样本293031323334353637383940
ꢀꢀ
scsa法检测dfi52.4712.6519.0414.8912.9737.6815.2010.0513.9741.8617.1234.13
ꢀꢀ
scd法检测dfi54.1413.3621.1517.3915.3833.4914.7010.3812.9538.6019.2732.51
ꢀꢀ
111.图5是用spss 19.0数据处理软件进行pearson相关性分析,结果显示scsa和scd两种方法检测dfi的相关系数r=0.983,scsa法检测dfi的均值为(17.69
±
12.03)%,scd检测
dfi的均值为(18.76
±
11.87)%,scd法测得的dfi均值较scsa法略高。现有数据表明精子染色质结构分析法(scsa)检测dfi值与scd法检测dfi值呈显著线性正相关性。
112.有益效果
113.本发明的精子核完整性检测试剂盒可借助流式细胞术分析人精子核dna的受损程度,与手工染色的精子染色质扩散法(sperm chromatin dispersion,scd)检测结果有很高的相关性,同时还可通过染色液与蛋白结合的程度分析未成熟精子的比例;
114.本发明通过两种精子核dna完整性检测方法的实例,验证了本发明中精子核完整性检测试剂盒与流式细胞仪搭配使用检测结果的准确性,为临床检测提供了一种直接、客观、敏感性高、操作方便、检测时间短的人类精子核dna完整性分析方法;
115.本发明的精子核dna完整性检测试剂提供的精液冻存液及发明中提到的精液冻存方法,可及时存储已检测所剩余的或未检测的精液样本,也有利于对同一样本进行复测,可为实际的临床检测工作带来较大的便利。
116.以上所揭露的仅为本发明一种较佳实施例而已,当然不能以此来限定本发明之权利范围,本领域普通技术人员可以理解实现上述实施例的全部或部分流程,并依本发明权利要求所作的等同变化,仍属于发明所涵盖的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。