含可裂解连接基的抗体药物缀合物
发明领域
1.本发明涉及包含连接基的前药,所述连接基包含五元或六元环状缩醛和相邻的特异性裂解位点,并且涉及用于合成所述前药的前体化合物。在一个方面,本发明涉及包含所述连接基的抗体靶向的鹅膏毒素缀合物、其合成方法以及所述抗体靶向的鹅膏毒素缀合物的用途。在另一个方面,本发明涉及包含所述缀合物的药物组合物,以及所述缀合物或组合物用于治疗目的的用途,特别是用于肿瘤治疗和肿瘤学的用途。
2.背景
3.前药是药理学上无活性的药物,其必须通过生物化学或化学反应(如水解或磷酸化)转化为活性形式。癌症治疗中前药的目的是通过设计与特异性靶点相互作用的化合物来减少不期望的副作用。这些前药包含与治疗或毒性组分连接(通常通过连接基组分)的靶点结合部分。
4.包含用于释放治疗或毒性组分的酸不稳定组分的前药常用于药学研究和应用。在抗体药物缀合物(adc)领域,通过靶点特异性抗体将构建体靶向肿瘤细胞后,酸不稳定连接基能够释放毒性有效载荷。该概念涉及adc的受体介导内吞作用(细胞摄取),随后在细胞内转运至溶酶体。adc一旦与其表面肿瘤抗原结合,就会内化到随后成熟的内体中,并与溶酶体融合;在溶酶体中,通过特异性蛋白酶(如组织蛋白酶b)裂解连接基或通过adc降解,对药物进行释放。溶酶体的特征在于4-5的酸性ph(chalouni和doll,2018),被认为其酸性足以水解酸不稳定键。酸不稳定连接基(如酰腙)成功地用于获得上市许可的adc(chalouni和doll,2018)。
5.其他酸不稳定基团(如缩醛)已被考虑作为用于adc的连接基组分。虽然包含基于脂肪族醛或酮的无环状缩醛的分子在ph为5时显示可裂解,但脂肪族羰基化合物的环状缩醛尚未在这一方面得以研究;这些结构可能具有高稳定性,并且通过酸性细胞内环境释放似乎是可疑的。
6.wo2014/135282公开了制备包含环状碳酸酯和环状缩醛的鹅膏毒素的方法,所述鹅膏毒素具有可用作adc的改善特性,但并未教导具有可控释放机制的化合物。
7.gillies等人(2004)描述了包含在低分子量前药中的基于苯甲醛衍生物的五元或六元环状缩醛。除脂肪族缩醛外,在缩醛碳原子上引入芳族取代基能够通过其它取代基来调节酸性稳定性。hammett规则允许预测苄基缩醛关于芳族环取代模式的反应性。通过遵循这一原理,可以合成半衰期为17.6h(在ph 5.0下)和数周(在ph 7.4下)的环状缩醛。
8.wo2015/152182(nof公司)描述了具有环状亚苄基缩醛连接基的亲水性聚合物衍生物,其在生物体内弱酸性环境的ph值下的水解速率可以通过苄基结构上取代基的位置和性质进行控制;特别是公开了用于基于苯甲醛衍生物的五元或六元环状缩醛的聚合物药物缀合物的可能的酸不稳定连接基。该文件未公开任何细胞毒有效载荷的具体实例和生物学数据。此外,wo2015/152182的教导需要环状缩醛与药物化合物的共价连接的额外部分。这些连接基结构不参与酸性裂解,并保持与所释放有效载荷的连接,推测对其药效学活性有负面影响。
9.由于现有技术中公开的环状缩醛裂解需要酸性环境,因此构建体被细胞摄取并转运至溶酶体(仅在此发现合适的酸性条件)是至关重要的。因此,现有技术中公开的环状缩醛仅限于导致受体结合后有效摄取的靶点结合部分。
10.然而,其他有前景的靶向结构在结合靶点结合部分后保留在细胞表面和/或在摄取后不转运至晚期内体和溶酶体,因此可能不适合该技术。
11.靶点结合抗体和adc药物之间的可裂解肽结构和触发自降解(self-immolative)间隔基的组合已被描述适用于携带伯胺或仲胺的有效载荷。jeffrey等人(2005)和wo2016/142049公开了适用于酚类基团的对氨基苄基醚连接基。有效载荷的羧酸可以通过类似的对氨基苄基酰胺进行处理(wo2017/149077)。
12.tranoy-opalinski等人(2014)已经公开了另一种经常用于小分子前药的相关触发自降解部分,其中特定侧链包含β-葡糖苷酸,并且在通过β-葡糖醛酸糖苷酶的酶促裂解后,从末端酚部分开始其发生自发断裂。该类型的连接基也用于adc领域,例如在jeffrey等人(2006)中所述。
13.发明概述
14.因此鉴于现有技术,本发明的一个目的是提供在受控条件下药物由前药的高效释放机制,其能够使药物无残留释放,从而提高治疗效率并避免由于所释放的治疗剂上保留的化学残基导致的药物活性损失。
15.本发明的一个目的是提供靶点结合部分鹅膏毒素缀合物,其包含用于高活性鹅膏毒素无残留释放的有效、非ph依赖性释放机制。
16.本发明的另一个目的是提供用于合成所述缀合物的修饰的鹅膏毒素。
17.本发明的又一个目的是提供改善的靶点结合部分鹅膏毒素缀合物,其用于治疗用途,特别是用于肿瘤治疗和肿瘤学。
18.这些目的是通过根据本发明的独立权利要求的方法和手段实现的。从属权利要求涉及优选实施方案。
附图说明
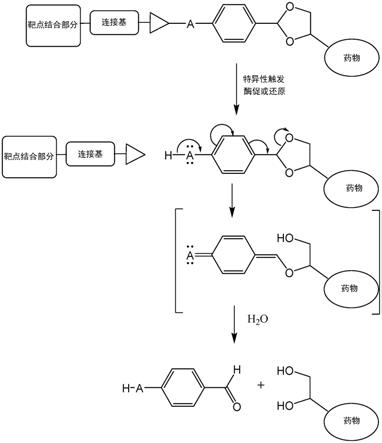
19.图1.本发明的连接基系统中的药物释放机制的示意图。三角形代表酶促可裂解结构,优选肽结构。a是可以选自但不限于o、nh或s的给电子基团。
20.图2. 96小时孵育后,brdu试验中skbr-3细胞的细胞毒性研究结果
21.图3. 96小时孵育后,brdu试验中nci-n87细胞的细胞毒性研究结果
22.图4. 96小时孵育后,brdu试验中jimt-l细胞的细胞毒性研究结果
23.图5.在skov-3异种移植肿瘤小鼠体内模型中,缩醛连接基缀合物的效力研究结果
24.图6.在nod/scid小鼠体内模型中,缀合物t-d265c-30.2669和t-d265c-30.2684的体内耐受性研究结果
25.本发明目的的其他细节、特征、性质和优点在从属权利要求中所公开,并且以下各附图和实施例的描述以示例的方式表明本发明的优选实施方案。然而,这些附图绝不应理解为限制本发明的范围。
26.发明详述
27.在详细描述本发明之前,应当理解,本发明不限于所描述的设备的特定组成部分
或所描述的方法的过程步骤,因为这样的设备和方法可以变化。还应理解,本文所使用的术语仅出于描述特定实施方案的目的,而无意于进行限制。必须注意,如说明书和所附权利要求书中所使用的,单数形式“a”,“an”和“the”包括单数和/或复数所指对象,除非上下文另外明确指出。此外要理解的是,在给出由数值界定的参数范围的情况下,该范围被认为包括这些限制值。
28.还应理解,本文中所公开的实施方案并不意味着应理解为彼此不相关的单个实施方案。关于一个实施方案讨论的特征也旨在公开结合本文中所示的其他实施方案。如果在一种情况下,特定特征没有被一个实施方案公开,但是被另一个实施方案公开,则本领域技术人员会理解这不一定意味着所述特征没有意图被所述其他实施方案公开。本领域技术人员会理解,针对其他实施方案也公开所述特征是本技术的主旨,但是仅仅为了清楚的目的并且将说明书保持在可管理的大小,这尚未进行。
29.此外,本文中引用的现有技术文件的内容通过援引加入。尤其是对于公开标准或常规方法的现有技术文件而言。在那种情况下,通过援引加入的主要目的是提供足够的使能公开,并避免冗长的重复。
30.关于药物从前药,特别是从抗体药物缀合物(adc)中可控、无残留地释放,本发明提供上述限制的解决方案。
31.本发明涉及用于改善应用于靶向治疗(如抗体药物缀合物或肽药物缀合物)中的前药系统的具体药物释放机制。根据本发明的前药包含与给电子基团结合的苄基五元或六元环状缩醛以及包含和/或代表特定裂解侧的侧链。所述裂解位点的裂解触发了缩醛的辅助释放,导致无残留药物的释放(图1)。
32.多种细胞毒性药物,如鹅膏毒素、阿非科林、凋亡素(apoptolidin)、卡奇霉素、洋地黄毒苷、地高辛、依托泊苷、糖杀蝶菌素a(glucopiericidin a)、寄端霉素、原黄醇酮a(isatropolone a)、乳胞素、粘膜毒素a(muscotoxin a)、水鬼蕉碱、鬼笔毒环肽、苯丙抑素(phenpanstatin)、植物鞘氨醇、poscillaridin a、假凝集素a(pseurotin a)、蝴蝶霉素、西奈芬净、g-毒毛旋花子苷、苦马豆素、涡轮他汀1-4等,包含可以用于形成环状缩醛的1,2-二醇和1,3-二醇结构。当药物从根据本发明的化合物中释放时,该至少一个1,2-二醇或1,3-二醇基团得以恢复。
33.本发明涉及包含苄基环状缩醛的化合物和引入苄基环状缩醛的方法,所述苄基环状缩醛在特定侧链裂解后具有增强的水解,导致缩醛碳1-2-(邻)或1-4(对)位中的基团具有强的正电荷中介效应。包含和/或代表特定裂解侧(例如肽)的侧链的酶促裂解释放了具有强的给电子性质的给电子基团(例如2-氨基或4-氨基),导致亚苄基连接基和二醇通过邻苯醌或对苯醌中间体自发断裂,以释放游离的有效载荷。
34.酶促裂解由特异性蛋白酶进行,例如组织蛋白酶(优选组织蛋白酶b)、弹性蛋白酶或基质金属蛋白酶。在一些实施方案中,所述蛋白酶是细胞外基质中的肿瘤特异性酶,如基质金属蛋白酶或α-葡糖醛酸糖苷酶。
35.本发明人出乎预料地发现,可裂解的连接基元件和触发自降解基团的组合可以成功地应用于前药,特别是包含鹅膏毒素的adc中的环状缩醛。本发明的化合物和方法能够实现有效、可控、非ph依赖性地在环状缩醛处以以下的方式从前药(特别是包含鹅膏毒素的adc)中释放药物:释放的药物部分不含来自间隔基、连接基或靶点结合部分的剩余残基或
结构元件,所述剩余残基或结构元件可能会带来降低药物活性和治疗效率的风险。
36.根据一个方面,本发明涉及包含细胞毒性药物部分的式i或ii的化合物
[0037][0038]
其中
[0039]
d是细胞毒性药物部分,其在从所述化合物释放后包含至少一个1,2-或1,3-二醇部分;
[0040]
z为ch2、ch
2-ch2或chr3-chr3,其中r3独立地为h或任选地被杂原子取代的烷基;
[0041]
r1为h或c
1-c6烷基;
[0042]
a为给电子基团;
[0043]
e为裂解位点;
[0044]
r2独立地为h或者吸电子基团或给电子基团;
[0045]
根据本发明的细胞毒性药物可以选自例如但不限于鹅膏毒素、阿非科林、凋亡素、卡奇霉素、洋地黄毒苷、地高辛、依托泊苷、糖杀蝶菌素a、寄端霉素、原黄醇酮a、乳胞素、粘膜毒素a、水鬼蕉碱、鬼笔毒环肽、苯丙抑素、植物鞘氨醇、poscillaridin a、假凝集素a、蝴蝶霉素、西奈芬净、g-毒毛旋花子苷、苦马豆素和涡轮他汀1-4。
[0046]
鹅膏毒素是包含8个氨基酸的环状肽。它们可例如由鬼笔鹅膏(amanita phalloides)蘑菇分离或者合成制备。鹅膏毒素特异性地抑制哺乳动物细胞的dna依赖性rna聚合酶ii,从而还抑制受影响细胞的转录和蛋白质生物合成。细胞中转录的抑制导致生长和增殖的停止。尽管没有共价键合,但鹅膏蕈碱和rna聚合酶ii之间的络合非常紧密(kd=3nm)。鹅膏蕈碱从酶上解离是一个非常缓慢的过程,因此使受影响细胞不太可能恢复。当转录的抑制持续太长时间时,所述细胞会经历程序性细胞死亡(细胞凋亡)。
[0047]
如本文中所使用,术语“鹅膏毒素”包括包含8个氨基酸的所有环状肽,如从鹅膏属中分离并描述于wieland t,faulstich h.,crc crit rev biochem.1978dec;5(3):185-260)中的,并且还包括其所有化学衍生物;还包括其所有半合成类似物;还包括由根据天然化合物的主结构(环状,8个氨基酸)的合成砌块构造的其所有合成类似物,还包括包含非羟基化氨基酸而不是羟基化氨基酸的所有合成或半合成类似物,还包括所有合成或半合成类似物,其中硫醚亚砜部分被硫化物、砜代替,或被与硫不同的原子(例如鹅膏蕈碱的碳类似物(carba-analogue)中的碳原子)代替,在每种情况下,其中任何这样的衍生物或类似物通过抑制哺乳动物rna聚合酶ii而是功能上有活性的。
[0048]
如本文中所使用,化合物的“衍生物”是指化学结构与该化合物相似,但含有该化合物中不存在的至少一个化学基团和/或缺少该化合物中存在的至少一个化学基团的种类。衍生物与其比较的化合物被称为“母体”化合物。通常,在一个或多个化学反应步骤中,“衍生物”可以由母体化合物产生。
[0049]
如本文中所使用,化合物的“类似物”在结构上相关,但与该化合物不完全相同,并表现出该化合物的至少一种活性。类似物与其比较的化合物被称为“母体”化合物。上述活性包括但不限于:与另一种化合物的结合活性;抑制活性,例如酶抑制活性;毒性效应;活化活性,例如酶活化活性。不需要该类似物表现出与母体化合物相同程度的活性。如果化合物的相关活性为母体化合物活性的至少1%(更优选至少5%、更优选至少10%、更优选至少20%、更优选至少30%、更优选至少40%和更优选至少50%),则在本技术上下文中将其视为类似物。因此,本文中使用的“鹅膏毒素类似物”是指在结构上与α-鹅膏蕈碱、β-鹅膏蕈碱、γ-鹅膏蕈碱、ε-鹅膏蕈碱、三羟鹅膏毒肽、三羟鹅膏毒肽酰胺、一羟鹅膏毒肽酰胺和一羟鹅膏毒肽羧酸中任何一种相关的,并且与α-鹅膏蕈碱、β-鹅膏蕈碱、γ-鹅膏蕈碱、ε-鹅膏蕈碱、三羟鹅膏毒肽、三羟鹅膏毒肽酰胺、一羟鹅膏毒肽酰胺和一羟鹅膏毒肽羧酸中至少一种相比显示对哺乳动物rna聚合酶ii至少1%(更优选至少5%、更优选至少10%、更优选至少20%、更优选至少30%、更优选至少40%和更优选至少50%)抑制活性的化合物。适用于本发明的“鹅膏毒素类似物”甚至可以显示出比α-鹅膏蕈碱、β-鹅膏蕈碱、γ-鹅膏蕈碱、ε-鹅膏蕈碱、三羟鹅膏毒肽、三羟鹅膏毒肽酰胺、一羟鹅膏毒肽酰胺和一羟鹅膏毒肽羧酸中任何一种对哺乳动物rna聚合酶ii更强的抑制活性。通过测定50%抑制发生时的浓度(ic
50
值),可以测量抑制活性。通过测定对细胞增殖的抑制活性,可以间接测定对哺乳动物rna聚合酶ii的抑制活性。
[0050]“半合成类似物”是指以天然来源(如植物材料、细菌培养物、真菌培养物或细胞培养物)的化合物为原料,通过化学合成获得的类似物。通常,本发明的“半合成类似物”是从鹅膏菌科蘑菇中分离的化合物开始合成的。相反,“合成类似物”是指通过所谓全合成从小(通常是石油化工)合成砌块合成的类似物。通常,这一全合成是在没有生物过程辅助的情况下进行的。
[0051]
在功能上,鹅膏毒素定义为抑制哺乳动物rna聚合酶ii的肽或缩肽。优选的鹅膏毒素是具有能够与如上定义的连接基分子或靶点结合部分反应的官能团(例如,羧基、氨基、羟基、硫醇或硫醇捕获基团)的那些。特别适于本发明的缀合物的鹅膏毒素为α-鹅膏蕈碱、β-鹅膏蕈碱、γ-鹅膏蕈碱、ε-鹅膏蕈碱、三羟鹅膏毒肽、三羟鹅膏毒肽酰胺、一羟鹅膏毒肽酰胺和一羟鹅膏毒肽羧酸,以及它们的盐、化学衍生物、半合成类似物和合成类似物。特别优选在本发明中使用的鹅膏毒素为α-鹅膏蕈碱、β-鹅膏蕈碱和三羟鹅膏毒肽酰胺。
[0052]
根据本发明的一个方面,所述鹅膏毒素可选自α-鹅膏蕈碱、β-鹅膏蕈碱、三羟鹅膏毒肽、三羟鹅膏毒肽酰胺及其类似物、衍生物和盐。
[0053]
如本文中所使用,术语“给电子基团”是指氮、氧、硫或具有可以给芳族π-电子系统提供孤对电子的取代基,如胺(nh2、nhr、nr2)、苯酚(oh)及其共轭碱o-、烷氧基(or)、苯酯(ocor)或硫醇,以及具有正诱导效应的烷基。
[0054]
术语“吸电子基团”是指对芳族π-系统表现出负中介效应的取代基(如卤素、硝基、羰基、氰基和磺酰基)或具有负诱导效应的基团(如三氟甲基或三烷基铵基)。
[0055]
根据本发明的一个方面,所述给电子基团a选自o、nh和s。
[0056]
如本文中所使用,术语“裂解位点”是指在特定条件下特定位置对特异性裂解敏感的部分。例如,所述条件是特异性身体或细胞房室中的特异性的酶或还原性环境。
[0057]
根据本发明的一个方面,所述裂解位点e是包含两个或更多个氨基酸的酶促可裂
解部分。优选地,所述酶促可裂解部分包含缬氨酸-丙氨酸(val-ala)、缬氨酸-瓜氨酸(val-cit)、缬氨酸-赖氨酸(val-lys)、缬氨酸-精氨酸(val-arg)二肽、苯丙氨酸-赖氨酸-甘氨酸-脯氨酸-亮氨酸-甘氨酸(phe lys gly pro leu gly)或丙氨酸-丙氨酸-脯氨酸-缬氨酸(ala ala pro val)肽或β-葡糖苷酸或β-半乳糖苷。
[0058]
根据一个实施方案,所述裂解位点可以被选自半胱氨酸蛋白酶、金属蛋白酶、丝氨酸蛋白酶、苏氨酸蛋白酶和天冬氨酸蛋白酶的至少一种物质裂解。
[0059]
半胱氨酸蛋白酶(也称为硫醇蛋白酶)是具有共同的催化机制的蛋白酶,所述机制涉及催化三联体或二联体中的亲核半胱氨酸硫醇。
[0060]
金属蛋白酶是其催化机理涉及金属的蛋白酶。大多数金属蛋白酶需要锌,但有些使用钴。金属离子经由三个配体与蛋白质配位。配位金属离子的配体可随组氨酸、谷氨酸、天冬氨酸、赖氨酸和精氨酸而变化。第四配位位置由不稳定的水分子占据。
[0061]
丝氨酸蛋白酶是裂解蛋白质中的肽键的酶,丝氨酸在(酶的)活性位点充当亲核氨基酸。丝氨酸蛋白酶根据其结构分为两大类:胰凝乳蛋白酶样(胰蛋白酶样)或枯草杆菌蛋白酶样。
[0062]
苏氨酸蛋白酶是在活性位点内携带苏氨酸(thr)残基的蛋白水解酶家族。这类酶的原型成员是蛋白酶体的催化亚单位,然而,酰基转移酶趋同地演化出相同的活性位点几何结构和机理。
[0063]
天冬氨酸蛋白酶是一种催化类型的蛋白酶,其使用与一个或多个天冬氨酸残基结合的活化水分子来催化其肽底物。通常,它们在活性位点中具有两个高度保守的天冬氨酸,并且在酸性ph下具有最佳活性。胃蛋白酶抑制剂抑制几乎所有已知的天冬氨酰蛋白酶。
[0064]
在特定的实施方案中,所述裂解位点被选自以下中的至少一种物质裂解:组织蛋白酶a或b、基质金属蛋白酶(mmp)、弹性蛋白酶、β-葡糖醛酸糖苷酶和β-半乳糖苷酶。
[0065]
在本发明的另一个方面,所述裂解位点e是二硫键,并且通过还原性环境(例如细胞内还原性环境)进行特异性的裂解。
[0066]
在另一个方面,本发明涉及包含本发明的化合物和t-l部分的缀合物,其中所述t-l部分被式i或ii中的至少一个残基r2所取代,并且其中
[0067]
l为连接基,并且
[0068]
t为靶点结合部分。
[0069]
如本文中所使用,术语“连接基”是指可以将靶点结合部分共价连接至包含细胞毒性药物部分的根据本发明化合物上的双官能化基团。
[0070]
根据本发明的连接基l可包括或可由以下组成:亚烷基、亚杂烷基、亚烯基、亚杂烯基、亚炔基、亚杂炔基、亚环烷基、亚杂环烷基、亚芳基、亚杂芳基、亚芳烷基或亚杂芳烷基,其含有选自n、o和s的1至4个杂原子,其中所述连接基任选地被取代。所述连接基也可以只是共价键。
[0071]
在根据本发明的一个方面,所述连接基l包含选自以下部分中至少一种的部分:二硫化物、醚、硫醚、胺、酯、甲酰胺、氨基甲酸酯和脲部分。
[0072]
本技术上下文中的“连接基”是指增加两种组分之间距离的分子,例如缓解靶点结合部分与本发明化合物(例如鹅膏毒素或鹅膏毒素衍生物)之间空间干扰的分子,其可以其他方式降低鹅膏毒素与rna聚合酶ii相互作用的能力。连接基可以用于另一目的,因为它可
以在被靶点结合部分靶向的细胞中特异性促进鹅膏毒素的释放。优选的是,所述连接基,和优选连接基与本发明的化合物之间的键,优选一侧的鹅膏毒素以及另一侧的连接基与抗体之间的键,在细胞外(例如血液)的生理条件下是稳定的,同时它可以在细胞内裂解,特别是在靶细胞内裂解,例如癌细胞或免疫细胞。为了提供这一选择性稳定性,所述连接基可以包含优选ph敏感或蛋白酶敏感的官能团。作为另外的选择,连接连接基与靶点结合部分的键可以提供选择性稳定性。所述连接基优选具有至少1个原子的长度,优选1-30个原子的长度(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30个原子),其中所述连接基的一侧已与鹅膏毒素反应,且另一侧已与靶点结合部分反应。在本发明的上下文中,所述连接基优选为c1-30-烷基、c1-30-杂烷基、c2-30-烯基、c2-30-杂烯基、c2-30-炔基、c2-30-杂炔基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基,其任选被取代。所述连接基可以含有一个或多个结构元件,如酰胺、酯、醚、硫醚、二硫化物、烃部分等。所述连接基还可以含有两个或更多个这些结构元件的组合。这些结构元件中的每一个都可以存在于所述连接基中多于一次,例如两次、三次、四次、五次或六次。在一些实施方案中,所述连接基可以含有二硫键。应当理解的是,所述连接基必须在一个步骤或两个或更多个后续步骤中连接至鹅膏毒素和靶点结合部分上。为此,会成为连接基的基团携带两个基团(优选在近端和远端),所述基团可以(i)与鹅膏毒素或靶点结合肽上的基团,优选活化基团形成共价键,或(ii)被活化或者可以被活化以与鹅膏毒素上的基团形成共价键。因此,如果存在所述连接基,优选的是化学基团在所述连接基的远端和近端,这是此类偶联反应的结果,例如酯、醚、氨基甲酸酯、肽键等。
[0073]
如本文中所使用,术语“靶点结合分子”是指可以与靶分子或靶表位特异性结合的任何分子或分子部分。适用于本发明的靶点结合部分通常具有40000da(40kda)或更大的分子量。
[0074]
如本文中所使用,术语“靶分子”和“靶表位”分别是指抗原和抗原表位,其与靶点结合部分特异性结合。优选地,所述靶分子是肿瘤相关抗原,特别是与非肿瘤细胞表面相比,以升高浓度和/或不同空间构型存在于一种或多种肿瘤细胞类型或肿瘤相关细胞的表面的抗原或表位。优选地,所述抗原或表位存在于一种或多种肿瘤或肿瘤基质细胞类型的表面,但不存在于非肿瘤细胞的表面。在其他实施方案中,所述抗原或表位优先在自身免疫性疾病涉及的细胞上表达。在其他实施方案中,所述抗原或表位优先在炎症性疾病涉及的细胞上表达。
[0075]
根据本发明的一个方面,所述靶点结合部分t选自
[0076]
(i)抗体或其抗原结合片段;
[0077]
(ii)抗体样蛋白,和
[0078]
(iii)核酸适配子。
[0079]
如本文中所使用,术语“抗体或其抗原结合片段”是指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即,包含特异性结合抗原的抗原结合位点的分子。还包含通过包括例如噬菌体展示技术选择的特异性结合至靶分子,例如结合至靶蛋白her-2/neu或epcam的免疫球蛋白(ig)样蛋白。本发明的免疫球蛋白分子可以是任何类型(例如igg、ige、igm、igd、iga和igy)、类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或亚类的免疫球蛋白分子。适于在本发明中使用的抗体和其抗原结合片段包括但不限于多克隆抗体、单克隆抗体、单
价抗体、双特异性抗体、异源缀合抗体、多特异性抗体、人抗体、人源化抗体(特别是cdr移植的)、去免疫的抗体或嵌合抗体、单链抗体(例如scfv)、fab片段、f(ab
′
)2片段、由fab表达文库产生的片段、双抗体或四抗体(tetrabody)(poljak r.j.,1994)、纳米抗体、抗独特型(抗-id)抗体(包括例如针对本发明的抗体的抗-id抗体)以及上述任一种的表位结合片段。
[0080]
根据本发明的一个方面,所述抗体或其抗原结合片段选自双抗体、四抗体、纳米抗体、嵌合抗体、去免疫化抗体、人源化抗体或人抗体。
[0081]
根据本发明的一个方面,所述抗原结合片段选自fab、f(ab
′
)2、fd、fv、单链fv、二硫化物连接的fvs(dsfv)和包含至少一个vl和/或vh结构域的片段。
[0082]
如本文中所使用,术语“抗体样蛋白”是指经工程改造(例如,通过诱变ig环)后与靶向分子特异性结合的蛋白。通常,此类抗体样蛋白包含至少一个在两端与蛋白骨架连接的可变肽环。该双结构约束大大增加了抗体样蛋白的结合亲和力,使其水平与抗体的相当。所述可变肽环的长度通常由10-20个氨基酸组成。所述骨架蛋白可以是任何具有良好溶解度特性的蛋白。优选地,所述骨架蛋白为小的球状蛋白。抗体样蛋白包括但不限于亲和体、抗运载蛋白(anticalin)和设计的锚蛋白重复蛋白(binz等人,2005)。抗体样蛋白可以来源于大型的突变文库,例如通过从大型噬菌体展示文库中淘选,并且可以类似于常规抗体进行分离。同时,通过对球状蛋白中表面暴露残基的组合诱变,可以获得抗体样结合蛋白。
[0083]
如本文中所使用,术语“核酸适配子”是指通过多轮体外筛选或selex(通过指数富集对配体进行系统进化)工程改造的与靶分子结合的核酸分子(wang等人,2019)。所述核酸适配子可以为dna或rna分子。所述适配子可以含有修饰,例如修饰的核苷酸,如2
′‑
氟取代的嘧啶。
[0084]
在一个方面,本发明涉及式iii或iv的缀合物
[0085]
[0086][0087]
其中
[0088]
x为s、so或so2;
[0089]
r1为h或c
1-c6烷基;
[0090]
r2独立地为h或者吸电子基团或给电子基团;
[0091]
r4为h、oh、o-c
1-c
8-烷基、no2、nh2、f、cl、br或sh;
[0092]
r5为oh、nh2或nhoh;
[0093]
r6、r7为天然或非天然氨基酸的侧链;
[0094]
l为连接基,并且
[0095]
t为靶点结合部分。
[0096]
通过肽酶(诸如但不限于组织蛋白酶、弹性蛋白酶或基质金属蛋白酶),在苯胺位点进行肽裂解后,式iii或iv的缀合物释放其有效载荷(细胞毒性药物)。
[0097]
在另一个方面,本发明涉及式v的缀合物
[0098][0099]
其中
[0100]
x为s、so或so2;
[0101]
y为ch2或co;
[0102]
r1为h或c
1-c6烷基;
[0103]
r2独立地为h或者吸电子基团或给电子基团;其中至少一个r2基团被所述t-l部分取代,
[0104]
r4为h、oh、o-c
1-c
8-烷基、no2、nh2、f、cl、br或sh;
[0105]
r5为oh、nh2或nhoh;
[0106]
l为连接基,并且
[0107]
t为靶点结合部分。
[0108]
通过酶(诸如但不限于β-葡糖醛酸糖苷酶或β-半乳糖苷酶)进行糖苷裂解后,式v的缀合物释放其有效载荷(细胞毒性药物)。
[0109]
在另一个方面,本发明涉及式vi的缀合物
[0110][0111]
其中
[0112]
x为s、so或so2;
[0113]
r1为h或c
1-c6烷基;
[0114]
r2独立地为h或者吸电子基团或给电子基团,除了如果r8不是t-l部分则一个r2被所述t-l部分取代;
[0115]
r4为h、oh、o-c
1-c
8-烷基、no2、nh2、f、cl、br或sh;
[0116]
r5为oh、nh2或nhoh;
[0117]
r8为直链或支链烷基,或者,如果没有r2是t-l部分,则r8是t-l部分;
[0118]
l为连接基,并且
[0119]
t为靶点结合部分。
[0120]
在通过还原性环境(例如还原性细胞内环境)进行二硫化物裂解后,式vi的缀合物释放其有效载荷(细胞毒性药物)。
[0121]
在另一个方面,本发明涉及式vii的缀合物
[0122][0123]
其中
[0124]
x为s、so或so2;
[0125]
r1为h或c
1-c6烷基;
[0126]
r2独立地为h或者吸电子基团或给电子基团,除了如果r9不是t-l部分则一个r2被所述t-l部分取代;
[0127]
r4为h、oh、o-c
1-c
8-烷基、no2、nh2、f、cl、br或sh;
[0128]
r5为oh、nh2或nhoh;
[0129]
r9为h或者直链或支链烷基,或者,如果没有r2是t-l部分,则r9是t-l部分;
[0130]
l为连接基,并且
[0131]
t为靶点结合部分。
[0132]
在磷酸酯的酶促裂解后,式vii的缀合物释放其有效载荷(细胞毒性药物)。
[0133]
在另一个方面,本发明涉及式viii的缀合物
[0134][0135]
在又一个方面,本发明涉及式ix或x的化合物
[0136][0137][0138]
在另一个方面,本发明涉及本发明的缀合物,其用作药物。
[0139]
在另一个方面,本发明涉及合成本发明的缀合物的方法,其通过使1,2-二醇或1,3-二醇与二甲基亚苄基缩醛在酸性条件下在非质子溶剂中反应来进行。
[0140]
本发明优选涉及合成本发明的缀合物的方法,其通过使鹅膏毒素与二甲基亚苄基缩醛在酸性条件下在非质子溶剂中反应来进行。所述鹅膏毒素优选选自α-鹅膏蕈碱、β-鹅膏蕈碱、三羟鹅膏毒肽、三羟鹅膏毒肽酰胺及其各自的硫醚。
[0141]
在优选的实施方案中,根据本发明的所述方法涉及一种方法,其中所述非质子溶剂为dmf和/或所述酸为三氟乙酸。
[0142]
如本文中所使用,术语“在酸性条件下”应指5.0或更低的ph。特别优选的,所述方法在约5.0、4.5、4.0、3.5、3.0、2.5、2.0、1.5或1.0的ph下进行。
[0143]
通过在酸性条件下,醛或酮与二醇化合物反应可以形成环状缩醛。通常,这些反应需要升高的温度,并通过共沸蒸馏或水结合剂(如硫酸钙或分子筛)移除作为副产物形成的水。当使用敏感和有价值的原料时,此类方法通常不实际。在此类情况下,预活化较不敏感和较便宜的组分作为酰基缩醛是有利的。然后,在从无环化合物形成环的过程中,熵效应优选的酸的催化量可以实现环状缩醛的形成。
[0144]
对于本发明的环状缩醛,所述二醇通常是更有价值且较不稳定的化合物。因此,芳族羰基优选用低沸点醇(如甲醇、乙醇、丙醇、丁醇或三氟乙醇)在水结合剂存在下,转化为无环缩醛。更优选地,所述水结合剂是原酸酯,且所述溶剂是低沸点醇。优选的原酸酯为原甲酸三甲酯、原乙酸三乙酯、原甲酸三乙酯、原乙酸三乙酯或原甲酸三丙酯。最优选的是使用原甲酸三甲酯。
[0145]
酸性催化剂优选为无水酸(如浓硫酸)、有机溶剂中的氯化氢(如hcl/etoh、hcl/meoh、hcl/1,4-二氧杂环己烷等)、4-甲苯磺酸、三氟乙酸或聚合磺酸(如质子化形式的强阳离子交换剂,例如50wx8、ir-120等)。最优选的是使用1,4-二氧杂环己烷中的氯化氢和4-甲苯磺酸。
[0146]
无环缩醛与二醇化合物的反应优选在高沸点的非质子溶剂(如dmso、dmf、dma、nmp、1,4-二氧杂环己烷二甲苯或甲苯)中进行。优选的是使用dmf。该反应中的酸性催化剂可以选自上述列表。优选的是低沸点酸,如hcl/1,4-二氧杂环己烷或三氟乙酸。最优选的是使用三氟乙酸。
[0147]
在另一方面,本发明涉及本发明的缀合物,其用于治疗患者中的癌症,特别地其中所述癌症选自乳腺癌、胰腺癌、胆管上皮癌、结直肠癌、肺癌、前列腺癌、卵巢癌、胃癌、肾癌、恶性黑色素瘤、白血病和恶性淋巴瘤。
[0148]
在另一方面,本发明涉及药物组合物,其包含本发明的缀合物,任选地进一步包含一种或多种药学上可接受的稀释剂、载体、赋形剂、填充剂、粘合剂、润滑剂、崩解剂、吸附剂;和/或防腐剂。
[0149]
在具体的实施方案中,药物组合物以全身给药药物的形式使用。这包括肠胃外药剂,其包括注射剂和输注剂等。注射剂配制成安瓿或所谓的即用型注射剂形式,例如即用型注射器或一次性注射器,除此之外还有用于多次拔出的可刺入小瓶形式。注射剂的给药可以是皮下(s.c)、肌肉内(i.m.)、静脉内(i.v.)或皮内(i.e)应用的形式。特别地,可以制备分别合适的注射制剂,如晶体混悬剂、溶液剂、纳米颗粒或胶体分散体系,例如水溶胶。
[0150]
上述详细实施方案中元件和特征的特定组合仅为示例性的;还明确考虑将这些启示与本文中的其他启示以及援引加入的专利/申请的互换和替代。正如本领域技术人员会认识到:本领域普通技术人员会想到不偏离本发明所要求保护的主旨和范围的本文描述的内容的变化、修改和其他实施。因此,上述描述仅为示例,并不作为限制。本发明的范围在所附权利要求及其等价物中进行了限定。此外,说明书和权利要求中使用的参考标志并不限制本发明的范围。
实施例
[0151]
尽管已经在附图和前面的描述中详细地说明和描述了本发明,但是这样的说明和描述应被认为是说明性或示例性的而不是限制性的;本发明不限于所公开的实施方案。通过研究附图、公开内容和所附权利要求书,本领域技术人员在实施所要求保护的发明时可以理解和实现所公开的实施方案的其他变体。在权利要求书中,单词“包含/包括”不排除其他元素或步骤,并且不定冠词“a”或“an”不排除多个。在互不相同的从属权利要求中记载某些方案的事实并不表示不能有利地使用这些方案的组合。权利要求中的任何参考标志都不应被解释为限制范围。
[0152]
实施例1:4-二甲氧基甲基-苯酚(hdp 30.2628)
[0153][0154]
将4-羟基苯甲醛(1.221g,10mmol)溶解在30ml甲醇中,加入10.9ml(100mmol)原甲酸三甲酯和250μl(1mmol)盐酸溶液(4m,在二氧杂环己烷中),并将溶液在回流下加热1h。tlc控制(正己烷/乙酸乙酯1∶1)表明醛(rf=0.36)完全转化为二甲基缩醛(rf=0.45)。旋
4.11(m,2h),3.91-3.84(m,2h),3.80(t,j=6.3hz,2h),3.76-3.71(m,2h),3.71-3.66(m,6h),3.46(t,j=6.3hz,2h),3.31(s,6h).
[0168]
13
c nmr(126mhz,cdcl3)d 158.85,130.53,127.88,114.21,102.99,71.19,70.84,70.70,70.64,70.53,69.73,67.42,52.59,30.33.
[0169]
ms(esi
)实测值:429.17;计算值[m na]
:429.09(c
17h27
brnao6)
[0170]
实施例6:1-[11-溴-3,6,9-三氧杂十一烷基氧基]-3-二甲氧基甲基-苯(hdp 30.2641)
[0171][0172]
通过在实施例2的粗品产物上应用实施例5的操作,得到2.079g(51%)油形式的标题化合物(hdp 30.2641)。
[0173]1h nmr(500mhz,cdcl3)d 7.30-7.23(m,1h),7.06-7.00(m,2h),6.88(ddd,j=8.3,2.5,1.1hz,1h),5.35(s,1h),4.17-4.12(m,2h),3.88-3.84(m,2h),3.81(t,j=6.3hz,2h),3.77-3.71(m,2h),3.71-3.66(m,6h),3.46(t,j=6.3hz,2h),3.32(s,6h).
[0174]
13
c nmr(126mhz,cdcl3)d 158.92,139.76,129.32,119.38,115.01,112.74,103.06,71.31,70.95,70.82,70.76,70.65,69.87,67.54,52.84,30.44.
[0175]
ms(esi
)实测值:375.17/377.17;计算值[mh-ome]
:375.08/377.08(c
16h24
bro5)
[0176]
实施例7:1-(11-溴-3,6,6-三氧杂十一烷基)-4-二甲氧基甲基-2-氟-苯(hdp 30.2642)
[0177][0178]
通过在实施例3的粗品产物上应用实施例5的操作,得到2.032g(67%)油形式的标题化合物(hdp 30.2642)。
[0179]
ms(esi
)实测值:393.17/395.17;计算值[mh-ome]
:393.07/395.07(c
16h23
brfo5)
[0180]1h nmr(500mhz,cdcl3)d 7.18(dd,j=12.0,2.1hz,1h),7.13(ddt,j=8.4,1.9,0.8hz,1h),6.97(t,j=8.4hz,1h),5.33(s,1h),4.23-4.17(m,2h),3.90-3.86(m,2h),3.81(t,j=6.3hz,2h),3.76-3.72(m,2h),3.68(d,j=9.6hz,6h),3.46(t,j=6.3hz,2h),3.30(s,6h).
[0181]
13
c nmr(126mhz,,cdcl3)d 152.60(d,j=246.1hz),146.92(d,j=10.9hz),131.90(d,j=5.7hz),122.61(d,j=3.6hz),114.93(d,j=4.0hz),114.79,102.20(d,j=1.6hz),71.31,71.06,70.80,70.74,70.65,69.71,69.21,52.67,30.44.
[0182]
实施例8:1-溴-4-[11-溴-3,6,9-三氧杂十一烷基氧基]-2-二甲氧基甲基-苯(hdp 30.2643)
[0183][0184]
通过在实施例4的粗品产物上应用实施例5的操作,得到2.757g(57%)油形式的标题化合物(hdp 30.2643)。
[0185]1h nmr(500mhz,cdcl3)d 7.42(d,j=8.7hz,1h),7.18(d,j=3.2hz,1h),6.79(dd,j=8.7,3.1hz,1h),5.50(s,1h),4.16-4.09(m,2h),3.87-3.83(m,2h),3.81(t,j=6.3hz,2h),3.74-3.71(m,2h),3.70-3.66(m,6h),3.47(t,j=6.3hz,2h),3.38(s,6h).
[0186]
13
c nmr(126mhz,cdcl3)d 158.22,137.89,133.57,117.11,114.31,113.52,102.99,71.34,70.99,70.83,70.77,70.67,69.77,67.89,54.08,30.44.
[0187]
ms(esi
)实测值:502.00/504.00/506.00;
[0188]
计算值[m nh4]
:502.04/504.04/506.04(c
17h30
br2no6)
[0189]
实测值:453.08/455.08/457.08;
[0190]
计算值[mh-ome]
:452.99/454.99/456.99(c
16h23
br2o5)
[0191]
实施例9:1-[11-fmoc-氨基-3,6,9-三氧杂十一烷基氧基]-4-二甲氧基甲基-苯(hdp30.2640)
[0192][0193]
将实施例5中的产物hdp 30.2637(1.725g,4.24mmol)溶于30ml的干燥dmf中,加入叠氮化钠975mg(12.7mmol,3eq.),并在环境温度下过夜搅拌该悬浮液。然后蒸发溶剂,将残留物溶于50ml的叔丁基甲醚(mtbe)中,并用碳酸氢钠和盐水洗涤(各50ml)。在mgso4上干燥有机相,并蒸发为含有中间体1-[11-叠氮基-3,6,9-三氧杂十一烷基氧基]-4-二甲氧基甲基-苯的澄清油(1.435g,收率92%)。
[0194]
然后将叠氮化物中间体溶于thf中,并加入2.038mg(2eq.)的三苯基膦,然后加入2ml的水。在室温下过夜搅拌该混合物,直至停止放出气体。21h后,将挥发物蒸发,将剩余的膦和中间体1-[11-氨基-3,6,9-三氧杂十一烷基氧基]-4-二甲氧基甲基-苯混合物溶于20ml的dmf中。
[0195]
加入fmoc-n-羟基琥珀酰亚胺酯1.57g(1.2eq.)和n-乙基二异丙胺(1320μl;2eq.)。在室温下搅拌17h后,再加入785mg的fmoc-osu。中间体胺完全转化后,蒸发溶剂,并将残渣溶于100ml的二氯甲烷中,用水(2x100ml)和盐水(100ml)洗涤,干燥(mgso4)并减压干燥。粗品在在硅胶上用梯度为含0至100%的mtbe的正己烷纯化,以得到617mg(28%)粘油状的标题化合物。
[0196]1h nmr(500mhz,cdcl3)d 7.75(dt,j=7.6,0.9hz,2h),7.60(d,j=7.5hz,2h),7.39(tt,j=7.4,0.9hz,2h),7.35-7.28(m,4h),6.90-6.84(m,2h),5.42(t,j=5.7hz,1h),5.33(s,1h),4.40(d,j=6.9hz,2h),4.21(t,j=6.9hz,1h),4.08(t,j=4.9hz,2h),3.80(t,j=4.9hz,2h),3.72-3.58(m,8h),3.55(t,j=5.1hz,2h),3.37(q,j=5.4hz,2h),3.29
(s,6h).
[0197]
13
c nmr(126mhz,cdcl3)d 158.77,156.47,143.97,141.26,127.84,127.69,127.60,126.98,125.02,119.90,114.14,102.95,70.79,70.55,70.30,69.99,69.85,69.67,67.32,66.44,52.55,47.24,40.90.
[0198]
ms(esi
)实测值:588.33;计算值[m na]
:588.26(c
32h39
nnao8)
[0199]
实测值:534.33;计算值[mh-ome]
:534.25(c
31h36
no7)
[0200]
实施例10:1-[11-fmoc-氨基-3,6,9-三氧杂十一烷基氧基]-3-二甲氧基甲基-苯(hdp 30.2650)
[0201][0202]
通过在1.082g实施例6的粗品产物上应用实施例9的操作,得到106mg(7%)油形式的标题化合物(hdp 30.2650)。
[0203]
ms(esi
)实测值:588.33;计算值[m na]
:588.26(c
32h39
nnao8)
[0204]
实施例11:1-(11-fmoc-氨基-3,6,6-三氧杂十一烷基)-4-二甲氧基甲基-2-氟-苯(hdp 30.2651)
[0205][0206]
通过在1.900g实施例7的粗品产物上应用实施例9的操作,得到112mg(4%)油形式的标题化合物(hdp 30.2651)。
[0207]
ms(esi
)实测值:606.33;计算值[m na]
:606.25(c
32h38
fnnao8)
[0208]
实测值:552.33;计算值[mh-ome]
:552.24(c
31h35
fno7)
[0209]
实施例12:1-溴-4-[11-fmoc-氨基-3,6,9-三氧杂十一烷基氧基]-2-二甲氧基甲基-苯(hdp 30.2652)
[0210][0211]
通过在2.625g实施例8的粗品产物上应用实施例9的操作,得到193mg(6%)油形式的标题化合物(hdp 30.2652)。
[0212]
ms(esi
)实测值:666.17/668.17
[0213]
计算值[m na]
:666.17/668.17(c32h38brnnao8)
[0214]
实施例13:fmoc-val-ala-pap-cho(hdp 30.2623)
[0215][0216]
在配有温度计、滴液漏斗和橡胶隔膜的三颈烧瓶中,用草酰氯(446μl,5.2mmol)处理20ml的干燥二氯甲烷,并在氩气气氛下将该溶液冷却至-80℃。
[0217]
通过橡胶隔膜的注射器,逐滴加入dmso(739μl,10.4mmol),保持温度低于-70℃。搅拌15min后,通过滴液漏斗在30min内逐滴加入溶于20ml二氯甲烷的fmoc-val-ala-pab-oh(hdp 30.1419,2.062g,4.0mmol),并将该混合物再搅拌30min。
[0218]
随后通过注射器加入三乙胺(2.634ml,19.0mmol),5min后移除冷却浴,并使反应升温至室温。然后加入25ml的水和25m1的二氯甲烷,使相分离。用20ml的二氯甲烷萃取水相,并用20ml的0.2m柠檬酸、3x20ml的水和20ml的盐水洗涤合并的有机相。干燥(mgso4)后,蒸发溶剂,并将粗品(965mg)在硅胶上用梯度为含0-20%乙酸乙酯的二氯甲烷纯化,以得到631mg(31%)无定形固体形式的产物。
[0219]1h nmr(500mhz,d
6-dmso)d 10.36(s,1h),9.89(s,1h),8.22(d,j=6.8hz,1h),7.91-7.79(m,6h),7.74(t,j=8.6hz,2h),7.45-7.29(m,5h),4.47(p,j=7.0hz,1h),4.37-4.28(m,1h),4.28-4.19(m,2h),3.95(dd,j=8.9,7.0hz,1h),2.02(h,j=6.7hz,1h),1.35(d,j=7.1hz,3h),0.92(d,j=6.7hz,3h),0.88(d,j=6.7hz,3h).
[0220]
13
c nmr(126mhz,d
6-dmso)d 191.35,171.75,171.03,156.05,144.40,143.79,143.69,140.61,131.30,130.68,127.52,127.50,126.93,125.22,119.96,119.95,118.76,65.63,59.86,49.20,46.64,30.32,19.06,18.12,17.70.
[0221]
ms(esi
)实测值:536.25计算值[m na]
:536.22(c
30h31
n3nao5)
[0222]
实施例14:fmoc-val-ala-pap-ch(ome)2(hdp 30.2677)
[0223][0224]
将步骤13的产物hdp 30.2623(514mg,1.00mmol)溶于20ml的甲醇中。加入原甲酸三甲酯(5.47ml,50mmol)和4-甲苯磺酸一水合物(21mg,0.1mmol)和20ml的二氯甲烷,并在氩气气氛下将混合物进行回流。5h后,加入更多的原甲酸三甲酯(5.47ml)和4-甲苯磺酸(210mg),并继续加热另外2h。冷却该反应混合物,并在剧烈搅拌下倒入50ml的饱和碳酸氢钠中。停止放气后,加入100ml的二氯甲烷,并在4000x g下,以40ml分批离心浑浊的混合物。除去澄清的上层,并用15ml的水洗涤有机层,然后离心。蒸发合并的有机相,并用2x20ml的甲醇共同蒸发残留物,以除去痕量水。用100ml的二氯甲烷溶解残留物,滤除不溶性物质。蒸发滤液,并将残留物用50ml的mtbe在40℃研磨1h,然后冷却至室温,并抽滤。用20ml的mtbe洗涤该沉淀物,并真空干燥,以得到445mg(79%)无定形固体形式的标题产物。
[0225]
实施例15:fmoc-val-ala-oab-oh(hdp 30.2761)
[0226][0227]
将二肽fmoc-val-ala-oh(4.105g,10.0mol)和4-氨基苄醇(1.293g,1.05eq.)溶于60ml的无水四氢呋喃(thf)中。加入2-乙氧基-n-(乙氧羰基)-1,2-二氢喹啉(eedq,2.597g,1.05eq.),并在室温下避光搅拌该混合物。
[0228]
3天后,用140m1的mtbe稀释形成胶状物的反应混合物,并搅拌,直至形成细的沉淀物,将其抽滤,用50m1的mtbe洗涤,并干燥得到4.480g(87%)无色固体形式的标题产物hdp 30.2761。
[0229]1h nmr(500mhz,d
6-dmso)d 9.40(s,1h),8.20(d,j=7.0hz,1h),7.89(d,j=7.5hz,2h),7.74(t,j=7.6hz,2h),7.53(d,j=8.0hz,1h),7.46-7.36(m,4h),7.32(tt,j=7.5,1.3hz,2h),7.23(td,j=7.6,1.7hz,1h),7.15(td,j=7.4,1.3hz,1h),5.24(t,j=5.6hz,1h),4.56-4.42(m,3h),4.36-4.28(m,1h),4.28-4.20(m,2h),3.96(dd,j=9.1,6.8hz,1h),2.04(h,j=6.8hz,1h),1.35(d,j=7.1hz,3h),0.90(d,j=6.7hz,3h),0.87(d,j=6.8hz,3h).
[0230]
13
c nmr(126mhz,d
6-dmso)d 171.09,170.90,156.09,143.83,143.72,140.65,140.63,135.08,134.74,127.55,127.54,127.23,126.97,126.87,125.27,124.64,123.66,120.00,119.98,65.65,60.03,59.86,48.90,46.65,40.01,39.84,39.67,39.50,39.34,39.17,39.00,31.23,30.33,19.15,18.04,17.89.
[0231]
ms(esi
)实测值:538.25计算值[m na]
:538.23(c
30h33
n3nao5)
[0232]
实施例16:fmoc-val-ala-oap-ch(ome)2(hdp 30.2769)
[0233][0234]
向步骤15的苄醇hdp 30.2761(4.48g,8.69mmol)中加入18m1的dmso和36m1的无水二氯甲烷,随后加入3.66g,1.0eq.的戴斯-马丁高碘烷,搅拌2h后,用90m1的氯仿稀释所得棕色溶液,并用90m1的水洗涤。用2x40ml的氯仿反萃取水相,并用90ml的饱和碳酸氢钠洗涤合并的有机相,直至ph达到7-8。然后加入30m1的20%硫代硫酸钠溶液,并继续振摇2min。分离后,用额外的90ml水洗涤有机层,干燥(mgso4),并移除挥发物。用150ml的mtbe搅拌剩余的4.875g,直至形成细的沉淀物,将其抽滤,用50ml的mtbe洗涤,并干燥得到4.307g(97%)无色固体形式的中间体醛。
[0235]
ms(esi
)实测值:536.25计算值[m
na]
:536.22(c
30h31
n3nao5)
[0236]
然后将4.187g(8.152mmol)醛fmoc-val-ala-oap-cho悬浮于80ml的甲醇中,加入原甲酸三甲酯(45ml,50eq.)和4-甲苯磺酸一水合物(1.551g,1eq.),并在氩气气氛下将该
混合物回流1h。冷却至室温后,在剧烈搅拌下将反应混合物加入100ml的饱和碳酸氢钠中。
[0237]
加入100ml的氯仿以溶解胶状物,并使相分离。用2x50ml的氯仿反萃取水相,并用50ml的半饱和盐水洗涤合并的有机层,干燥(mgso4)并蒸发。将粗品在硅胶上用梯度为含0至20%乙酸乙酯的二氯甲烷纯化,以得到3.279g(72%)无定形固体形式的标题产物hdp 30.2769。
[0238]1h nmr(500mhz,d
6-dmso)d 9.27(s,1h),8.30(d,j=7.0hz,1h),7.89(d,j=7.5hz,2h),7.75(t,j=7.2hz,2h),7.70(d,j=8.1hz,1h),7.48-7.38(m,4h),7.32(ddd,j=8.7,6.7,1.4hz,3h),7.18(td,j=7.6,1.3hz,1h),5.45(s,1h),4.46(p,j=7.0hz,1h),4.37-4.29(m,1h),4.28-4.20(m,2h),3.99(dd,j=9.2,6.8hz,1h),3.26(s,3h),3.26(s,3h),2.05(h,j=6.7hz,1h),1.35(d,j=7.1hz,3h),0.89(d,j=6.8hz,3h),0.87(d,j=6.7hz,3h).
[0239]
13
c nmr(126mhz,d
6-dmso)d 176.52,176.05,161.32,149.06,148.95,145.89,145.87,140.68,134.89,133.97,132.82,132.80,132.38,132.23,130.56,130.55,129.58,129.11,125.27,106.40,70.84,65.01,58.68,58.37,54.27,51.85,35.65,24.41,23.26,22.69.
[0240]
ms(esi
)实测值:582.33计算值[m na]
:582.26(c
32h37
n3nao6)
[0241]
实施例17:bmp-val-ala-oap-ch(ome)2(hdp 30.2776)
[0242][0243]
将实施例16的产物hdp 30.2769(3.236g,5.782mmol)悬浮于30ml的dmf中。加入二乙胺(8ml),并在室温下搅拌30min,以形成澄清溶液。蒸发该挥发物,并用30ml的新鲜dmf共蒸发残留物,然后在高真空下干燥。粗品产物含有中间体胺h-val-ala-oap-ch(ome)2,并将其在未经进一步纯化使用。
[0244]
ms(esi
)实测值:360.25计算值[m
na]
:360.19(c
17h27
n3nao4)
[0245]
将中间体游离胺溶于30ml的dmf,并加入1.539g(1eq.)的3-(马来酰亚胺基)丙酸n-羟基琥珀酰亚胺酯(bmps)和1.967ml(2eq.)n-乙基二异丙胺(dipea),并搅拌该溶液1h。蒸发溶剂,并用100ml的mtbe搅拌该残留物。滤出所形成的细的沉淀物,用mtbe(20ml)洗涤并真空干燥。将粗品在硅胶上用梯度为含0至10%甲醇的二氯甲烷纯化,以得到2.164g(77%)无定形固体形式的标题产物。
[0246]1h nmr(500mhz,d
6-dmso)d 9.20(s,1h),8.27(d,j=6.8hz,1h),8.00(d,j=9.0hz,1h),7.69(d,j=7.5hz,1h),7.43(dd,j=7.7,1.6hz,1h),7.33(td,j=7.8,1.7hz,1h),7.16(td,j=7.5,1.3hz,1h),6.99(s,2h),5.44(s,1h),4.41(p,j=7.1hz,1h),4.22(dd,j=8.8,6.6hz,1h),3.61(dq,j=17.1,6.6hz,2h),3.27(s,3h),3.26(s,3h),2.48-2.40(m,2h),2.01(dh,j=20.3,6.8hz,1h),1.33(d,j=7.2hz,3h),0.84(d,j=6.8hz,3h),0.81(d,j=6.8hz,3h).
[0247]
13
c nmr(126mhz,d
6-dmso)d 171.03,170.78,170.63,169.50,135.51,134.47,
129.50,128.70,127.15,124.23,123.70,101.33,57.27,53.46,53.18,49.08,33.99,33.64,30.32,19.10,17.91.17.28.1
[0248]
ms(esi
)实测值:511.25计算值[m na]
:511.22(c
24h32
n4nao7)
[0249]
实施例18:fmoc-val-ala-mab-oh(hdp 30.2767)
[0250][0251]
通过用3-氨基苄醇进行实施例15的操作,得到4.698g(91%)无定形固体形式的标题产物hdp 30.2767。
[0252]1h nmr(500mhz,d
6-dmso)d 9.95(s,1h),8.17(d,j=7.0hz,1h),7.88(d,j=7.5hz,2h),7.75(t,j=7.8hz,2h),7.59(d,j=1.9hz,1h),7.50-7.37(m,4h),7.32(tt,j=7.5,1.6hz,2h),7.24(t,j=7.8hz,1h),6.99(d,j=7.8hz,1h),5.19(t,j=5.7hz,1h),4.45(dd,j=14.7,6.5hz,3h),4.36-4.28(m,1h),4.28-4.19(m,2h),3.93(dd,j=9.0,7.1hz,1h),2.01(h,j=6.8hz,1h),1.32(d,j=7.0hz,3h),0.91(d,j=6.7hz,3h),0.87(d,j=6.7hz,3h).
[0253]
13
c nmr(126mhz,d
6-dmso)d 170.93,156.08,143.80,143.72,143.16,140.63,140.62,138.78,128.29,127.57,127.54,126.98,125.29,121.21,120.02,120.00,117.41,117.11,65.63,62.77,59.92,48.95,46.61,30.32,19.13,18.19,18.07,3.26.
[0254]
ms(esi
)实测值:538.33计算值[m na]
:538.23(c
30h33
n3nao5)
[0255]
实施例19:fmoc-val-ala-map-ch(ome)2(hdp 30.2778)
[0256][0257]
通过用实施例18的化合物(hdp 30.2767)进行实施例16的操作(省略最终的硅胶色谱法纯化),得到6.28g无定形固体形式的粗品标题产物hdp 30.2778,其纯度足以用于下一步骤。
[0258]
实施例20:bmp-val-ala-map-ch(ome)2(hdp 30.2776)
[0259][0260]
通过用实施例19的化合物(hdp 30.2778)进行实施例17的操作,以95%的收率(基于hdp 30.2767)得到无定形固体形式的标题产物hdp 30.2781。
[0261]1h nmr(500mhz,d
6-dmso)d 9.89(s,1h),8.16(d,j=6.9hz,1h),8.02(d,j=
8.4hz,1h),7.66(t,j=1.9hz,1h),7.64-7.54(m,1h),7.30(t,j=7.9hz,1h),7.06(dt,j=7.6,1.4hz,1h),7.00(s,2h),5.35(s,1h),4.38(p,j=7.1hz,1h),4.14(dd,j=8.4,6.8hz,1h),3.68-3.57(m,2h),3.24(s,6h),2.50-2.40(m,2h),2.00-1.90(m,j=6.8hz,1h),1.32(d,j=7.1hz,3h),0.87(d,j=6.8hz,3h),0.83(d,j=6.8hz,3h).
[0262]
13
c nmr(126mhz,d
6-dmso)d 171.09,170.77,170.71,169.76,138.90,138.79,134.52,128.46,121.42,118.99,117.25,102.42,57.71,52.44,52.42,49.08,34.02,33.70,30.26,19.11,18.17,17.83.
[0263]
ms(esi
)实测值:511.25计算值[m na]
:511.22(c
24h32
n4nao7)
[0264]
环状缩醛的一般操作a
[0265]
向二醇化合物的干燥dmf(100μl/mg)溶液中加入二甲基缩醛化合物(10eq.)。用三氟乙酸(10μl/mg)酸化该混合物,并在环境温度,在氩气气氛下搅拌,直至形成澄清溶液。随后,在高真空下蒸发溶剂,并将剩余物重新溶于新鲜dmf中。在含1%三乙胺的甲醇中淬灭样品,并通过hplc进行分析,显示原料完全转化。
[0266]
将dmf溶液滴入10倍体积的含0.1%三乙胺的叔丁基甲醚(mtbe)的冰冷溶液中,并离心分离所得沉淀物。弃去上清液,并将团块重悬于相同体积的含0.1%三乙胺的mtbe中,并再次离心。通过制备hplc进一步纯化真空干燥的粗品产物。
[0267]
环状缩醛的一般操作b
[0268]
将二醇化合物(1eq.)和二甲基缩醛化合物(8eq.)置于离心管中,并溶于dmf/tfa 4:1(v/v,20μl/μmol的二醇化合物)中。在室温下振摇该管,直至hplc控制显示二醇化合物的完全转化(1-18h)。然后加入20倍体积的冰冷mtbe,并离心分离沉淀物。将第一团块重悬于相同体积的含2v%三乙胺的mtbe溶液中,并再次离心。将干燥的团块在未进一步纯化下用于下一步反应。
[0269]
实施例21:α-鹅膏蕈碱-(fmoc-val-ala-4-氨基-亚苄基缩醛)hdp 30.2681
[0270][0271]
根据一般操作a,使α-鹅膏蕈碱(30.98mg)与hdp 30.2677反应。在phenomenex luna-c18(2)(10μm,250x21.2mm)上用梯度为含5至100%乙腈的水在15min内纯化粗品产物。将含有10.40-11.08min流分的产品冻干,以得到37.07mg(78%)的冷冻干产物。
[0272]
ms(esi
)实测值:1414.67;计算值[mh]
:1414.58(c
69h84n13o18
s)
[0273]
实施例22:α-鹅膏蕈碱-[4-(11-fmoc-氨基-3,6,9-三氧杂十一烷基氧基)-亚苄基缩醛]hdp 30.2665
[0274][0275]
根据一般操作a,使α-鹅膏蕈碱(20.51mg)和来自实施例9的hdp 30.2640反应,以得到20.96mg(65%)冻干粉末形式的标题产物。
[0276]
实施例23:α-鹅膏蕈碱-[3-(11-fmoc-氨基-3,6,9-三氧杂十一烷基氧基)-亚苄基缩醛]hdp 30.2666
[0277][0278]
根据一般操作b,使α-鹅膏蕈碱(20.51mg)和来自实施例10的hdp 30.2650反应,并将粗品标题化合物在未纯化下进一步使用。
[0279]
实施例24:α-鹅膏蕈碱-[4-(11-fmoc-氨基-3,6,9-三氧杂十一烷基氧基)-3-氟-亚苄基缩醛]hdp 30.2667
[0280][0281]
根据一般操作b,使α-鹅膏蕈碱(20.51mg)和来自实施例11的hdp 30.2651反应,并将粗品标题化合物在未纯化下进一步使用。
[0282]
实施例25:α-鹅膏蕈碱-[2-溴-3-(11-fmoc-氨基-3,6,9-三氧杂十一烷基氧基)-亚苄基缩醛]hdp 30.2668
[0283][0284]
根据一般操作b,使α-鹅膏蕈碱(20.51mg)和来自实施例11的hdp 30.2652反应,并
将粗品标题化合物在未纯化下进一步使用。
[0285]
实施例26:α-鹅膏蕈碱-(bmp-val-ala-4-氨基-亚苄基缩醛)hdp 30.2684
[0286][0287]
将环状缩醛hdp 30.2681(37.07mg,26.21μmol)溶于2m1的干燥dmf中。加入二乙胺(92μl,891μmol),并在环境温度下搅拌混合物15min。在真空中蒸发挥发物,并将残留物再溶解于干燥dmf中。hplc和ms分析显示完全脱保护为游离胺。
[0288]
(ms-esi
)实测值:1192.67;计算值[mh]
:1192.51(c
54h74n13o16
s)
[0289]
加入溶于500μl干燥dmf的3-(马来酰亚胺基)丙酸n-羟基琥珀酰亚胺酯(bmps,14mg,52.42μmol=2eq.),随后加入8.92μl(52.42μmol=2eq.)的n,n-二异丙基乙胺。在室温下搅拌2h后,将反应混合物滴入10ml的冰冷mtbe中,并通过离心分离沉淀物。通过制备hplc(在phenomenex luna-c18(2)上用梯度为含5-50%乙腈的水,15min)纯化粗品团块。将11.9-12.8min的产物流分冻干,以得到20.85mg(59%)的无色冷冻干产物。
[0290]
ms(esi
)实测值:1343.58;计算值[mh]
:1343.54(c
61h79n14o19
s)
[0291]
实施例27:α-鹅膏蕈碱-[4-(11-(3-马来酰亚胺基丙酰胺基)-3,6,9-三氧杂十一烷基氧基)-亚苄基缩醛]hdp 30.2669
[0292][0293]
通过在20.96mg来自实施例22的hdp 30.2665上应用实施例26的操作,得到冻干粉末形式的标题产物hdp 30.2669(13.00mg,65%)。
[0294]
ms(esi
)实测值:1371.58;计算值[mh]
:1371.52(c
61h80n12
nao
21
s))
[0295]
实施例28:α-鹅膏蕈碱-[3-(11-(3-马来酰亚胺基丙酰胺基)-3,6,9-三氧杂十一烷基氧基)-亚苄基缩醛]hdp 30.2670
[0296][0297]
通过在来自实施例23的粗品hdp 30.2666上应用实施例26的操作,得到冻干粉末形式的标题产物hdp 30.2670(4.39mg,15%基于α-鹅膏蕈碱)
[0298]
ms(esi
)实测值:1371.50;计算值[mh]
:1371.52(c
61h80n12
nao
21
s))
[0299]
实施例29:α-鹅膏蕈碱-[4-(11-(3-马来酰亚胺基丙酰胺基)-3,6,9-三氧杂十一烷基氧基)-3-氟-亚苄基缩醛]hdp 30.2671
[0300][0301]
通过在来自实施例24的粗品hdp 30.2667上应用实施例26的操作,得到冻干粉末形式的标题产物hdp 30.2671(5.82mg,19%基于α-鹅膏蕈碱)。
[0302]
ms(esi
)实测值:1389.50;计算值[mh]
:1389.51(c
61h79
fn
12
nao
21
s)
[0303]
实施例30:α-鹅膏蕈碱-[2-溴-3-(11-(3-马来酰亚胺基丙酰胺基)-3,6,9-三氧杂十一烷基氧基)-亚苄基缩醛]hdp 30.2672
[0304][0305]
通过在来自实施例24的粗品hdp 30.2668上应用实施例26的操作,得到冻干粉末形式的标题产物hdp 30.2672(2.43mg,8%基于α-鹅膏蕈碱)。
[0306]
ms(esi
)实测值:1449.42/1451.42;
[0307]
计算值[mh]
:1449.43/1451.43(c
61h79
brn
12
nao
21
s)
[0308]
实施例31:α-鹅膏蕈碱-(bmp-val-ala-2-氨基-亚苄基缩醛)hdp 30.2792
[0309][0310]
可通过使α-鹅膏蕈碱与来自实施例17的化合物hdp 30.2776反应来制备标题化合物。
[0311]
实施例32:α-鹅膏蕈碱-(bmp-val-ala-3-氨基-亚苄基缩醛)hdp 30.2793
[0312][0313]
可通过使α-鹅膏蕈碱与来自实施例20的化合物hdp 30.2781反应来制备标题化合物。
[0314]
实施例33:鹅膏毒素抗体缀合物的合成
[0315]
曲妥珠单抗的衍生物(一种抗her2neu-特异性抗体,具有d265c突变(“thiomab”,在ig重链265位氨基酸处天冬氨酸突变为半胱氨酸)),缀合至鹅膏毒素-连接基衍生物hdp 30.2669、hdp 30.2670、hdp 30.2671、hdp 30.2672和hdp 30.2684。
[0316]
对于每次缀合反应,使用10mg的thiomab的pbs缓冲液(调节至1mm edta)。在振荡器上于37℃下,通过抗体与40eq.的tcep反应3h,并在slide-a-lyzer透析盒中,在1x pbs、
1mm edta(ph 7.4)中,于4℃下进行两次连续透析,打开半胱氨酸。在振荡器上于室温下,通过抗体与20eq.的脱氢抗坏血酸(dhaa)的孵育,进行氧化。
[0317]
通过在室温下孵育1h,加入25eq.n-乙酰基-l-半胱氨酸淬灭,并在室温下孵育15min或4℃下孵育过夜,分别使用溶于dmso中的4eq.的hdp 30.2669、hdp 30.2670、hdp 30.2671、hdp 30.2672和hdp 30.2684,进行鹅膏毒素-连接基衍生物的缀合。通过用pbs(ph 7.4)平衡的sephadex g-25凝胶过滤(pd-10柱,ge healthcare life sciences),纯化各反应混合物。用bradford试剂在封口膜上鉴别含蛋白的流分,并合并。在slide-a-lyzer透析盒(thermo scientific,20.000mwco)中,在4℃下相对于pbs(ph 7.4)过夜透析缀合物溶液。使用rotiquant-assay(carlroth,德国)来测定蛋白浓度。将缀合物溶液调节至蛋白浓度为5mg/ml(~3.44
×
10-5
m),无菌下过滤,并存储在4℃下。缀合物命名为“t-d265c-30.2669”、“t-d265c-30.2670”、“t-d265c30.2671”、“t-d265c-30.2672”和“t-d265c-30.2684”。
[0318]
在还原条件下的考马斯亮蓝染色中,鹅膏毒素抗体缀合物和裸抗体的轻链和重链具有预期的约25和50kda的表观质量。对于鹅膏毒素抗体缀合物,与裸抗体相比,观察到重链的蛋白信号上移,表明毒素缀合至重链。在还原条件下的抗鹅膏蕈碱免疫印迹中,thiomab缀合物显示了在约55kda处重链的信号,而没有轻链的信号。这表明毒素仅在重链处缀合。
[0319]
实施例34:her2阳性肿瘤细胞系的体外细胞毒性研究
[0320]
采用化学发光brdu-elisa掺入测定(roche),在体外her2阳性肿瘤细胞系skbr-3(乳腺癌)、nci-n87(胃癌)和jimt-1(乳腺癌)中,评价曲妥珠单抗(抗her2neu-特异性抗体)-鹅膏蕈碱缀合物的细胞毒性活性。检测的缀合物包括一个具有与鹅膏毒素的aa3连接的根据本发明二肽裂解位点的芳族环状缩醛的缀合物(t-d265c-30.2684)、一个具有与鹅膏毒素的aa4连接的二肽裂解位点的对氨基苄基醚连接基的缀合物(t-d265c-30.1699),和4个具有分别与鹅膏毒素的aa3连接的聚乙二醇(peg)连接基的芳族环状缩醛的缀合物(t-d265c-30.2669具有p-peg3连接基,-30.2670具有m-peg3连接基,-30.2671具有p-peg3连接基和芳基氟化物部分,-30.2672具有
o-peg3连接基和芳基溴化物部分)。
[0321]
[0322]
[0323][0324]
skbr-3细胞的细胞毒性研究结果如图2中所示,nci-n87细胞的细胞毒性研究结果如图3中所示,并且jimt-1细胞的结果入图4中所示。
[0325]
不同曲妥珠单抗-鹅膏蕈碱缀合物对不同her2阳性细胞系的ec
50
值如表1中所示:
[0326][0327]
[(),>50%细胞生存力;-,无细胞毒性;v-a,缬氨酸-丙氨酸二肽;peg,聚乙二醇]
[0328]
本发明的缀合物t-d265c-30.2684的细胞毒性与缀合物t-d265c-30.1699的细胞毒性相当。与包含具有peg连接基的芳族环状缩醛的缀合物t-d265c-30.2669相比,本发明的缀合物t-d265c-30.2684对skbr-3细胞的细胞毒性略高,但对nci-n87细胞和jimt-1细胞的细胞毒性显著更高。
[0329]
adc t-d265c-30.2684和t-d265c-30.1699均具有可裂解的val-ala连接基,在所测试的细胞系中显示出全面的细胞毒性潜力。酸不稳定adc t-d265c-30.2670、t-d265c-30.2671和t-d265c-30.2672仅显示生长抑制,在skbr-3细胞上的残留细胞生存力分别为约65%、50%和60%,在jimt-1细胞上完全没有细胞毒性。
[0330]
在体外,鹅膏毒素衍生物hdp 30.2684与hdp 30.1699同样有效,但合成更快。在hdp 30.1699的合成中,需要进行三次hplc纯化,而hdp 30.2684的合成仅需要一次。
[0331]
实施例35:缩醛连接基缀合物在skov-3异种移植物肿瘤小鼠体内模型中的效力
[0332]
该研究由7个实验组组成,每组10只雌性nod scid小鼠,各自皮下携带有her2阳性skov-3(人卵巢)肿瘤。将两种具有鹅膏毒素aa3-键的芳族环状缩醛缀合物(t-d265c-30.2684、t-d265c-30.2669)在递增剂量下的效力与t-d265c-30.1699(具有与鹅膏毒素aa4连接的二肽裂解位点的对氨基苄基连接基)和未处理对照进行比较。小鼠单次静脉给药处理。
[0333]
实验设置如表2中所示:
[0334][0335]
研究结果如图5中所示。
[0336]
在环状缩醛鹅膏毒素药物缀合物处理组中,所有动物均是无瘤的。在用1mg/kg的t-d265c-30.1699治疗的动物组中,未获得无瘤动物。在用2mg/kg的t-d265c-30.1699治疗的动物组中,10只动物中有4只无瘤。
[0337]
实施例36:缩醛连接基缀合物在体内小鼠模型中的耐受性
[0338]
在nod/scid小鼠单次静脉内给药后,分别评价了鹅膏毒素adc t-d265c-30.2669和t-d265c-30.2684的耐受性。总共使用了21只动物。t-d265c-30.2669和t-d265c-30.2684在高达6mg/kg的有效剂量下耐受良好。结果如图6中所示。
[0339]
参考文献
[0340]
binz h.k.等人(2005).engineering novel binding proteins from non-immunoglobulin domains.nat.biotechnol.vol.10:1257-1268.
[0341]
chalouni c.和doll s.(2018).fate of antibody-drug conjugates in cancer cells.journal of experimental&clinical cancer research.vol.37:20.
[0342]
gillies e.r.等人(2004).acetals as ph-sensitive linkages for drug delivery.bioconjugate chem.vol.15:1254-1263.
[0343]
jeffrey等人(2005).design,synthesis,and in vitro evaluation of dipeptide-based antibody minor groove binder conjugates.j.med.chem.vol.48:1344-1358.
[0344]
jeffrey等人(2006).development and properties of β-glucuronide linkers for monoclonal antibody-drug conjugates.bioconjugate chem.vol.17:831-840.
[0345]
poljak r.j.(1994).production and structure of diabodies.structure vol.2:1121-1123.
[0346]
tranoy-opalinski等人(2014).β-glucuronidase-responsive prodrugs for selective cancer chemotherapy:an update.european journal of medicinal chemistry vol.74:302-313.
[0347]
wang等人(2019).three decades of nucleic acid aptamer technologies:lessons leamed,progress and opportunities on aptamer development.biotechnology advances vol.37:28-50.
[0348]
wieland t.和faulstich h.(1978).amatoxins,phallotoxins,phallolysin,and antamanide:the biologically active components of poisonous amanita mushrooms.crc crit rev biochem.vol.5(3):185-260.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。