1.本发明涉及调节肠道微生态的微胶囊,具体涉及一种用于治疗肠炎的益生元和后生元复合微胶囊及其制备方法。
背景技术:
2.肠炎等疾病与肠道微生态失衡密切相关,提示通过调节肠道微生态具有预防和治疗肠炎的临床潜能。目前研究主要通过口服益生菌和粪便微生物群移植来实现肠道微生态调节,然而从这些治疗方法中获得的外源性肠道微生物往往伴随严重的副作用,包括腹胀,腹痛和致死性感染等风险。因此,为避免引入活菌相关风险,更安全的调节肠道微生态的方法仍然需要进一步开发。
3.目前,研究发现益生元作为一种不能由人体消化的膳食纤维,同样具有调节肠道健康的能力,但是单纯通过益生元口服对肠炎的控制效果仍然欠佳。此外,研究发现后生元作为益生元经细菌代谢后产生的活性代谢物,也具备调节肠道免疫、营养肠上皮等重要作用。然而,单纯口服给予后生元对肠炎的总体治疗效果同样有限,这可能与单一后生元治疗无法重建肠道微生态,同时口服给药后在下消化道的药物浓度较低有关。根据益生元和后生元对肠炎治疗的研究基础,提示益生元和后生元的组合给药可以通过协同效应提高治疗结肠炎的疗效,从而避免引入活菌的相关风险。
4.因此,为了构建协同递送益生元和后生元的有效载体,本发明通过微流控电喷技术制备益生元和后生元复合微胶囊,口服后可使后生元到达下消化道后开始释放,同时通过增加微胶囊的表面皱纹,延长其在胃肠道中的停留时间,有助于增强益生元和后生元的递送功效。益生元和后生元协同递送微胶囊制备简单有效,口服治疗方便、安全性高,对治疗结肠炎等肠道疾病具有良好的应用前景。
技术实现要素:
5.本发明针对现有技术中的不足,提供一种用于治疗肠炎的益生元和后生元复合微胶囊,其特征在于,包括胶囊外壳和胶囊内核,胶囊外壳包裹胶囊内核;胶囊外壳的材料为壳聚糖,胶囊内核的材料为益生元和后生元的混合物。
6.进一步地,所述益生元包括海藻酸钠。
7.进一步地,所述益生元还包括抗性淀粉、壳聚糖、透明质酸和果胶中的一种或多种,抗性淀粉、壳聚糖、透明质酸和果胶能够与海藻酸钠形成交联网络,提高益生元交联后网络密度以减缓后生元的释放速度。
8.进一步地,所述后生元为吲哚丙酸、吲哚乙酸、丙酸和丁酸中的一种或多种。
9.为制备出上述的复合微胶囊,本发明采用以下技术方案制备一种用于治疗肠炎的益生元和后生元复合微胶囊,其特征在于,包括以下步骤:
10.s1.胶囊内核的制备:
11.a.后生元溶液的配制:取后生元加入双蒸水中,调节溶液的ph值至7,待充分溶解得到后生元溶液;后生元为上述的后生元材料,可用于调节微胶囊的表面褶皱程度。
12.b.益生元与后生元的混合溶液的配制:称取益生元加入到步骤s1.a中所述的后生元溶液中,充分溶解后得到益生元与后生元的混合溶液;益生元为上述的任意一种益生元材料;
13.c.氯化钙溶液的配制:称取氯化钙加入双蒸水中,充分溶解得到氯化钙溶液;氯化钙的质量体积浓度为0.5~3%;
14.d.采用微流控电喷技术将s1.b中所述的益生元与后生元的混合溶液喷射到s1.c中所述的氯化钙溶液中,含有海藻酸钠的益生元在含有钙离子的环境中凝固,经洗涤后得到含有后生元和益生元的胶囊内核;
15.s2.复合微胶囊的制备:
16.a.壳聚糖溶液的配制:将壳聚糖加入双蒸水中,并向其中加入冰醋酸溶液,充分溶解得到壳聚糖溶液;
17.b.胶囊外壳包裹胶囊内核:将步骤s1所制备的胶囊内核添加到s2.a中所述的壳聚糖溶液中,缓慢搅拌10~30分钟后得到益生元和后生元复合微胶囊。
18.为优化上述技术方案,采取的具体措施还包括:
19.进一步地,步骤s1.a中每种后生元在双蒸水中的质量体积浓度均为0.5~3%。
20.进一步地,步骤s1.b中每种益生元在混合溶液中的质量体积浓度均为1~3%。
21.进一步地,步骤s1.d中微流控电喷工艺的参数为喷头直径50~500μm,溶液流程为1ml/h~10ml/h,电场强度为4kv~10kv。
22.进一步地,壳聚糖的质量体积浓度为0.5~3%,冰醋酸的质量体积溶度为0.5~1%。
23.进一步地,本发明还提供了一种用于治疗肠炎的益生元和后生元复合微胶囊在制备改善肠道微生态相关疾病的药物中的应用,其特征在于,所述的肠道微生态相关疾病包括肠炎。
24.本发明的有益效果是:
25.(1)微胶囊由具备ph值双相响应的益生元构成,可减缓后生元在酸性的上消化道释放速度,同时通过微胶囊形成的褶皱结构增强对肠道的粘附力、延长益生元和后生元在肠道的滞留时间,进而提高后生元在下消化道的浓度和利用效率;
26.(2)本发明提供的微胶囊结构稳定,粒径分布均一,可显著增加益生元和后生元的对下消化道的靶向递送和作用时间;
27.(3)本发明提供的微胶囊的原材料生物相容性好,可通过调节肠道微生物态,满足治疗不同肠道相关疾病的需求,具有预防和治疗肠炎及其它肠道微生态相关疾病的前景;
28.(4)本发明提供的用于治疗肠炎的益生元和后生元复合微胶囊的制备方法,通过微流控电喷获得微胶囊,制备方法稳定,条件简单、安全可靠。
附图说明
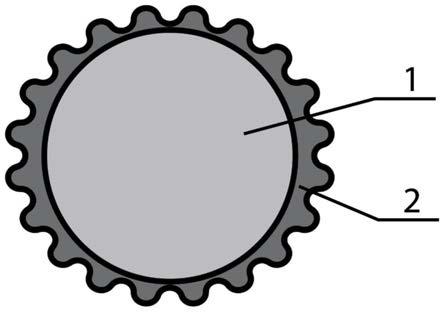
29.图1为本发明的益生元和后生元复合微胶囊的结构示意图;其中1为胶囊内核,2为胶囊外壳。
30.图2为微胶囊对dss诱导的小鼠肠炎的体重变化趋势图。
31.图3为微胶囊对dss诱导的小鼠肠炎的结肠照片。
32.图4为实施例1、3、4和对比例1制备的微胶囊的扫描电镜照片。
具体实施方式
33.现在结合附图对本发明作进一步详细的说明。
34.实施例1
35.本实施例提供如图1所示的一种用于治疗肠炎的益生元和后生元复合微胶囊,包括胶囊外壳和胶囊内核,所述的胶囊外壳为壳聚糖涂层,所述的胶囊内核为溶解于海藻酸钠和抗性淀粉水凝胶中的后生元成份,具体制备步骤如下。
36.步骤1、胶囊内核的制备。
37.a.后生元溶液的配制:将吲哚丙酸加入双蒸水中,调节溶液的ph值至7,使吲哚丙酸充分溶解,吲哚丙酸的质量体积浓度为2%;后生元可用于调节微胶囊的表面褶皱程度。
38.b.益生元与后生元的混合溶液的配制:将海藻酸钠和抗性淀粉加入到步骤1.a中所述的2%吲哚丙酸溶液中,搅拌充分溶解后得到益生元与后生元的混合溶液,其中,海藻酸钠及抗性淀粉的在混合溶液中的质量体积浓度均为2%。
39.c.氯化钙溶液的配制:称取氯化钙加入双蒸水中,充分溶解得到氯化钙溶液;氯化钙的质量体积浓度为2%。
40.d.微流控电喷技术制备胶囊内核:微流控电喷设备包括微流控芯片、喷射单元(包括玻璃毛细管、点样针头,并通过速干胶组装;玻璃毛细管的管径为100μm,即喷射单元的喷头直径)、注射器、微量泵、高压直流电源和接收容器(容器内装有步骤1.c中得到的氯化钙溶液);将步骤1.b中的含有吲哚丙酸的海藻酸钠和抗性淀粉溶液转移到注射器中,再经过微量泵控制连接到喷射单元,控制流程为6ml每小时,在8kv的高压电的作用下将溶液喷射到含有氯化钙的接收容器中,含有海藻酸钠的益生元在含有钙离子的环境中凝固,经洗涤后得到含有后生元和益生元的胶囊内核。
41.步骤二、复合微胶囊的制备。
42.a.壳聚糖溶液的配制:将壳聚糖加入双蒸水中,并向其中加入1%的冰醋酸溶液,充分溶解得到壳聚糖溶液,壳聚糖溶液的质量体积浓度为1%。
43.b.胶囊外壳包裹胶囊内核:将步骤1.d所制备的胶囊内核添加到步骤2.a中所述的壳聚糖溶液中,缓慢搅拌20分钟后得到益生元和后生元复合微胶囊。
44.对比例1益生元微胶囊的制备
45.步骤1、胶囊内核的制备。
46.将海藻酸钠和抗性淀粉加入双蒸水中,海藻酸钠和抗性淀粉在双蒸水中的质量体积浓度均为2%,按照实施例1步骤1.d中所述的微流控电喷工艺制备出益生元微胶囊内核。
47.步骤2、复合微胶囊的制备。
48.a.壳聚糖溶液的配制:将壳聚糖加入双蒸水中,并向其中加入1%的冰醋酸溶液,充分溶解得到壳聚糖溶液,壳聚糖溶液的质量体积浓度为1%。
49.b.胶囊外壳包裹胶囊内核:将步骤1所制备的胶囊内核添加到步骤2.a中所述的壳聚糖溶液中,缓慢搅拌20分钟后得到益生元复合微胶囊。
50.实施例2复合微胶囊对葡聚糖硫酸钠(dss)诱导的小鼠肠炎模型的治疗应用
51.本实施例采用实施例1制备出的益生元和后生元复合微胶囊预防和治疗小鼠由dss诱导引起的肠炎,给药方式为口服灌胃给药。
52.选取6-8周龄的雄性c57bl/6j小鼠为实验对象,给予小鼠含有3%dss饮用水7天以诱导小鼠肠炎建立小鼠肠炎模型,并将其随机分为4组,分别为微胶囊组(即ipa@mc组,采用实施例1所制备的益生元和后生元微胶囊治疗小鼠肠炎,每天2.5mg/10g体重)、益生元组(即ipa组,采用对比例1制备的益生元微胶囊治疗小鼠肠炎,每天2.5mg/10g体重)、后生元组(即mc组,采用吲哚丙酸治疗小鼠肠炎,每天0.5mg/10克体重)和对照组(即dss组,采用pbs溶液治疗小鼠肠炎,每天0.2ml/20g体重)。此外,对小鼠采用每天0.1ml/10g体重的pbs溶液作为空白组(即control组)。所有小鼠在建立肠炎模型后的前五天接受上述治疗,持续到实验终点,每天收集体重等指标监测炎症的严重程度。
53.实验结果如图2所示,微胶囊组(ipa@mc组)与空白组(control)的体重变化趋势没有统计学差异,同时其它接受dss干预的小鼠表现出明显的体重下降,证明益生元和后生元复合微胶囊具有明显预防和治疗肠炎的能力。
54.在炎症症状最严重时,处死小鼠,进一步观察结肠等内脏炎症情况,结果如图3所示。微胶囊组(ipa@mc)与空白组(control)的结肠长度没有统计学差异,同时其它接受dss干预的小鼠表现出明显的结肠长度下降,进一步证明益生元和后生元复合微胶囊具有明显预防和治疗肠炎的能力。
55.实施例3
56.本对比例与实施例1的区别在于步骤1.b中吲哚丙酸的浓度为1%。
57.实施例4
58.本对比例与实施例1的区别在于步骤1.b中吲哚丙酸的浓度为3%。
59.如图4所示为不同吲哚丙酸浓度(0%、1%、2%和3%)调节制备的微胶囊的形貌,从图中可以看出随着吲哚丙酸浓度不断提高,微胶囊表面的褶皱程度不断加深,因此可以通过调节吲哚丙酸的浓度来调节微胶囊表面褶皱程度。
60.实施例5
61.本实施例提供如图1所示的一种用于治疗肠炎的益生元和后生元复合微胶囊,包括胶囊外壳和胶囊内核,所述的胶囊外壳为壳聚糖涂层,所述的胶囊内核为溶解于海藻酸钠和抗性淀粉水凝胶中的后生元成份,具体制备步骤如下。
62.步骤1、胶囊内核的制备。
63.a.后生元溶液的配制:将吲哚乙酸加入双蒸水中,调节溶液的ph值至7,使吲哚乙酸充分溶解,吲哚乙酸的质量体积浓度为2%;后生元可用于调节微胶囊的表面褶皱程度。
64.b.益生元与后生元的混合溶液的配制:将海藻酸钠和抗性淀粉加入到步骤1.a中所述的2%吲哚乙酸溶液中,搅拌充分溶解后得到益生元与后生元的混合溶液,其中,海藻酸钠及抗性淀粉的在混合溶液中的质量体积浓度分别为1%和3%。
65.c.氯化钙溶液的配制:称取氯化钙加入双蒸水中,充分溶解得到氯化钙溶液;氯化钙的质量体积浓度为1%。
66.d.微流控电喷技术制备胶囊内核:微流控电喷设备包括微流控芯片、喷射单元(包括玻璃毛细管、点样针头,并通过速干胶组装;玻璃毛细管的管径为250μm,即喷射单元的喷
头直径)、注射器、微量泵、高压直流电源和接收容器(容器内装有步骤1.c中得到的氯化钙溶液);将步骤1.b中的含有吲哚丙酸的海藻酸钠和抗性淀粉溶液转移到注射器中,再经过微量泵控制连接到喷射单元,控制流程为10ml每小时,在10kv的高压电的作用下将溶液喷射到含有氯化钙的接收容器中,含有海藻酸钠的益生元在含有钙离子的环境中凝固,经洗涤后得到含有后生元和益生元的胶囊内核。
67.步骤二、复合微胶囊的制备。
68.a.壳聚糖溶液的配制:将壳聚糖加入双蒸水中,并向其中加入0.5%的冰醋酸溶液,充分溶解得到壳聚糖溶液,壳聚糖溶液的质量体积浓度为0.5%。
69.b.胶囊外壳包裹胶囊内核:将步骤1.d所制备的胶囊内核添加到步骤2.a中所述的壳聚糖溶液中,缓慢搅拌10分钟后得到益生元和后生元复合微胶囊。
70.实施例6
71.本实施例提供如图1所示的一种用于治疗肠炎的益生元和后生元复合微胶囊,包括胶囊外壳和胶囊内核,所述的胶囊外壳为壳聚糖涂层,所述的胶囊内核为溶解于海藻酸钠和抗性淀粉水凝胶中的后生元成份,具体制备步骤如下。
72.步骤1、胶囊内核的制备。
73.a.后生元溶液的配制:将丙酸加入双蒸水中,调节溶液的ph值至7,使丙酸充分溶解,丙酸的质量体积浓度为0.5%。
74.b.益生元与后生元的混合溶液的配制:将海藻酸钠和壳聚糖以及果胶加入到步骤1.a中所述的2%丁酸溶液中,搅拌充分溶解后得到益生元与后生元的混合溶液,其中,海藻酸钠、壳聚糖以及果胶在混合溶液中的质量体积浓度分别为2%、1%和1%。
75.c.氯化钙溶液的配制:称取氯化钙加入双蒸水中,充分溶解得到氯化钙溶液;氯化钙的质量体积浓度为2%。
76.d.微流控电喷技术制备胶囊内核:微流控电喷设备包括微流控芯片、喷射单元(包括玻璃毛细管、点样针头,并通过速干胶组装;玻璃毛细管的管径为500μm,即喷射单元的喷头直径)、注射器、微量泵、高压直流电源和接收容器(容器内装有步骤1.c中得到的氯化钙溶液);将步骤1.b中的含有吲哚丙酸的海藻酸钠和抗性淀粉溶液转移到注射器中,再经过微量泵控制连接到喷射单元,控制流程为8ml每小时,在6kv的高压电的作用下将溶液喷射到含有氯化钙的接收容器中,含有海藻酸钠的益生元在含有钙离子的环境中凝固,经洗涤后得到含有后生元和益生元的胶囊内核。
77.步骤二、复合微胶囊的制备。
78.a.壳聚糖溶液的配制:将壳聚糖加入双蒸水中,并向其中加入0.5%的冰醋酸溶液,充分溶解得到壳聚糖溶液,壳聚糖溶液的质量体积浓度为3%。
79.b.胶囊外壳包裹胶囊内核:将步骤1.d所制备的胶囊内核添加到步骤2.a中所述的壳聚糖溶液中,缓慢搅拌20分钟后得到益生元和后生元复合微胶囊。
80.实施例7
81.本实施例提供如图1所示的一种用于治疗肠炎的益生元和后生元复合微胶囊,包括胶囊外壳和胶囊内核,所述的胶囊外壳为壳聚糖涂层,所述的胶囊内核为溶解于海藻酸钠和抗性淀粉水凝胶中的后生元成份,具体制备步骤如下。
82.步骤1、胶囊内核的制备。
83.a.后生元溶液的配制:将吲哚乙酸和吲哚丙酸加入双蒸水中,调节溶液的ph值至7,使其充分溶解,吲哚乙酸和吲哚丙酸的质量体积浓度分别为2%和3%。
84.b.益生元与后生元的混合溶液的配制:将海藻酸钠加入到步骤1.a中所述的2%丁酸溶液中,搅拌充分溶解后得到益生元与后生元的混合溶液,其中,海藻酸钠在混合溶液中的质量体积浓度分别为1.5%。
85.c.氯化钙溶液的配制:称取氯化钙加入双蒸水中,充分溶解得到氯化钙溶液;氯化钙的质量体积浓度为1%。
86.d.微流控电喷技术制备胶囊内核:微流控电喷设备包括微流控芯片、喷射单元(包括玻璃毛细管、点样针头,并通过速干胶组装;玻璃毛细管的管径为500μm,即喷射单元的喷头直径)、注射器、微量泵、高压直流电源和接收容器(容器内装有步骤1.c中得到的氯化钙溶液);将步骤1.b中的含有吲哚丙酸的海藻酸钠和抗性淀粉溶液转移到注射器中,再经过微量泵控制连接到喷射单元,控制流程为8ml每小时,在6kv的高压电的作用下将溶液喷射到含有氯化钙的接收容器中,含有海藻酸钠的益生元在含有钙离子的环境中凝固,经洗涤后得到含有后生元和益生元的胶囊内核。
87.步骤二、复合微胶囊的制备。
88.a.壳聚糖溶液的配制:将壳聚糖加入双蒸水中,并向其中加入0.5%的冰醋酸溶液,充分溶解得到壳聚糖溶液,壳聚糖溶液的质量体积浓度为3%。
89.b.胶囊外壳包裹胶囊内核:将步骤1.d所制备的胶囊内核添加到步骤2.a中所述的壳聚糖溶液中,缓慢搅拌20分钟后得到益生元和后生元复合微胶囊。
90.此外,实施例中的益生元除海藻酸钠以外还包括抗性淀粉、壳聚糖、透明质酸和果胶中的一种或多种,益生元可以为吲哚丙酸、吲哚乙酸、丙酸、丁酸中的一种或多种。
91.需要注意的是,发明中所引用的如“上”、“下”、“左”、“右”、“前”、“后”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
92.以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。