msi2-numb结合代谢分子测定胰腺癌进展的方法
技术领域
1.本发明属于医疗器械技术领域,具体涉及一种msi2-numb结合代谢分子测定胰腺癌进展的方法。
背景技术:
2.胰腺癌是一种恶性程度极高且诊断和治疗都很困难的消化道恶性肿瘤,约90%的胰腺癌起源于胰腺管上皮的导管胰腺癌,是预后最差的恶性肿瘤之一。胰腺癌早期的临床确诊率很低,手术死亡率较高,并且其治愈率很低。胰腺癌的临床特点是发现疾病晚期、病程治疗短、病情发展快和迅速恶化。目前临床上缺乏胰腺癌早期筛查和诊断的技术,导致胰腺癌发现皆是晚期,诊疗效果极度有限。
3.其中,musashi2(msi2)和numb在细胞不对称分裂,造血细胞及神经细胞系功能维持上起着重要作用。musashi2(msi2)和numb在胰腺癌组织中表达存在显著相关性,两者联合能够客观反映胰腺癌患者的病情进展以及评估胰腺癌患者的预后。
4.为了提高胰腺癌的精准诊疗水平以及治愈率,如何对胰腺癌患者的病情进展及预后状态进行测定就显得尤为重要。
技术实现要素:
5.针对现有技术中缺乏精确有效的胰腺癌肿瘤临床进展筛查和预后测定方法,本发明提供msi2-numb结合代谢分子测定胰腺癌进展的方法,能够通过测定musashi2(msi2)和numb在胰腺癌组织中表达结合血液检测来进行胰腺癌病情进展筛查以及评估胰腺癌患者的预后,提高检测精度和准确率。其具体技术方案如下:
6.msi2-numb结合代谢分子测定胰腺癌进展的方法,包括如下步骤:
7.一、肿瘤组织切除阶段检测:
8.步骤1,肿瘤组织预处理:
9.将肿瘤组织用depc水冲洗,置于冻存管中-80℃冻存待测;取30~50mg肿瘤组织置1.5ml离心管中,加入1.5ml trizol充分匀浆,室温静置10min;每管加入300μl氯仿,剧烈混匀30sec,静置20min,4℃,10000rpm离心15min;轻轻吸取上层液体400μl至另一新离心管中,加入等体积异丙醇,轻轻颠倒混匀,4℃10000rpm离心15min;弃上清,加入2ml 75%酒精洗涤沉淀物,4℃10000rpm离心15min;弃掉上清,室温下晾干10min,每管加入10μl无rna酶水,在65℃溶解10~15min;
10.步骤2,测定肿瘤组织musashi2:
11.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
12.所述的荧光染料sypro的工作浓度为0.3
×
~1
×
,所述热启动htaq酶的工作浓度为0.03~0.1u/μl;
13.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
14.所述pcr反应体系还包括8μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
15.所述pcr反应体系还包括8μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
16.所述的datp溶液的工作浓度为50~80μmol/l;所述dgtp溶液的工作浓度为50~90μmol/l;所述dctp溶液的工作浓度为60~80μmol/l;所述荧光标记cy5的工作浓度为0.2
×
~0.8
×
;
17.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
18.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒5~10ng,钙离子浓度为3~8mmol/l;
19.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
20.步骤3,测定肿瘤组织numb:
21.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
22.所述的荧光染料ruby的工作浓度为0.5
×
~1
×
,所述热启动htaq酶的工作浓度为0.04~0.1u/μl;
23.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
24.所述pcr反应体系还包括10μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
25.所述pcr反应体系还包括10μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
26.所述的dutp溶液的工作浓度为60~80μmol/l;所述dgtp溶液的工作浓度为40~70μmol/l;所述dctp溶液的工作浓度为50~70μmol/l;所述荧光标记cy3的工作浓度为0.4
×
~0.7
×
;
27.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
28.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒6~12ng,钙离子浓度为3~8mmol/l;
29.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
30.步骤4,测定血液代谢分子:
31.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
32.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和
所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
33.步骤5,综合判定:
34.根据肿瘤组织中的musashi2含量高于正常值的程度,以及肿瘤组织中的numb含量低于正常值的程度,并结合血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于正常值的程度,判定肿瘤恶化程度;
35.二、预后阶段检测:
36.步骤1,测定血液musashi2:
37.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
38.所述的荧光染料sypro的工作浓度为0.35
×
~1
×
,所述热启动htaq酶的工作浓度为0.04~0.1u/μl;
39.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
40.所述pcr反应体系还包括9μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
41.所述pcr反应体系还包括9μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
42.所述的datp溶液的工作浓度为90~95μmol/l;所述dgtp溶液的工作浓度为100~120μmol/l;所述dctp溶液的工作浓度为100~120μmol/l;所述荧光标记cy5的工作浓度为0.6
×
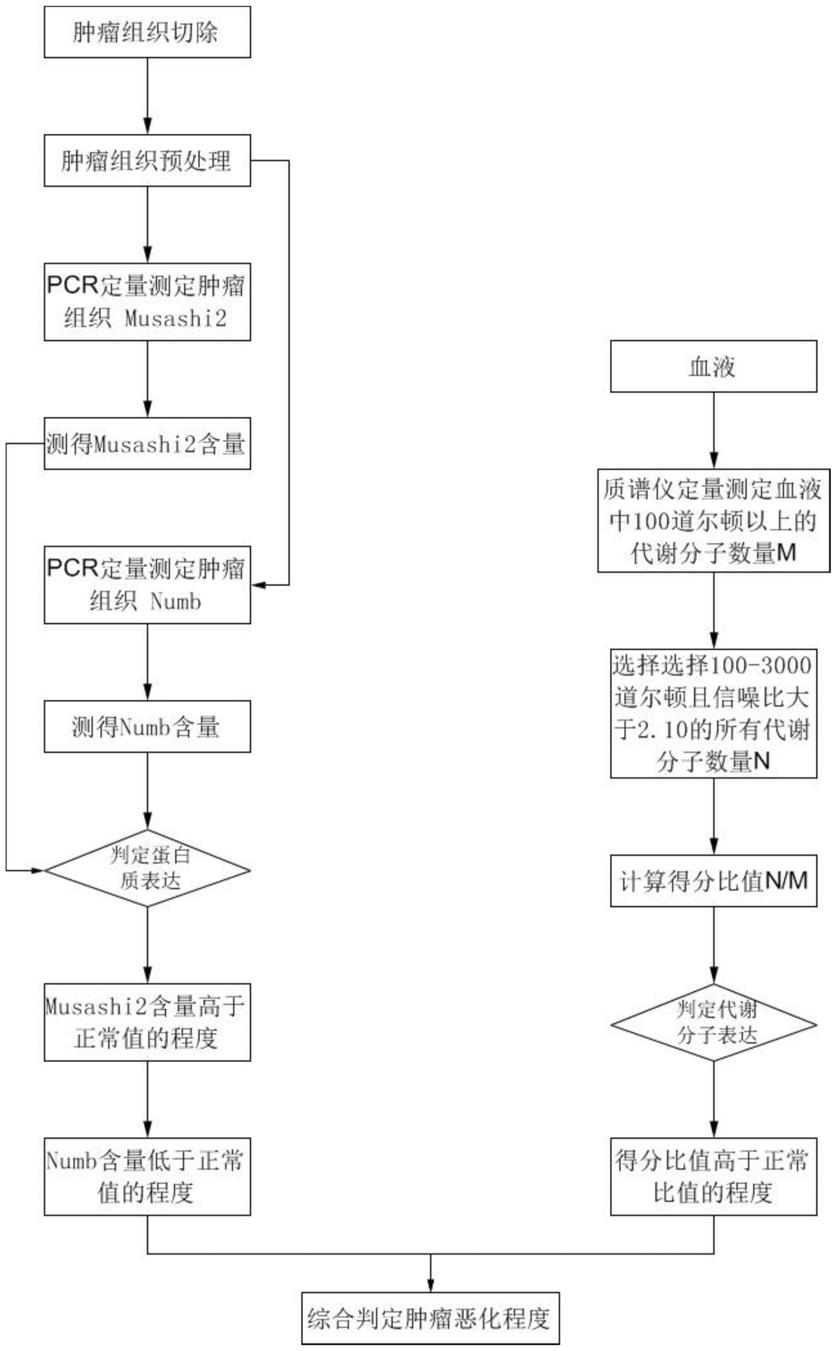
~0.8
×
;
43.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
44.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒5~10ng,钙离子浓度为6~8mmol/l;
45.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
46.步骤2,测定血液numb:
47.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
48.所述的荧光染料ruby的工作浓度为0.8
×
~1
×
,所述热启动htaq酶的工作浓度为0.06~0.1u/μl;
49.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
50.所述pcr反应体系还包括12μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
51.所述pcr反应体系还包括12μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
52.所述的dutp溶液的工作浓度为100~120μmol/l;所述dgtp溶液的工作浓度为80~
100μmol/l;所述dctp溶液的工作浓度为80~100μmol/l;所述荧光标记cy3的工作浓度为0.5
×
~0.8
×
;
53.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
54.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒6~12ng,钙离子浓度为5~10mmol/l;
55.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
56.步骤3,测定血液代谢分子:
57.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
58.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
59.步骤4,预后判定:
60.预后阶段进行多次血液检测,每一次检测结果与上一次检测结果进行对比;
61.测定术后患者的血液中musashi2含量高于上一次测定的血液中musashi2含量,且测定术后患者的血液中numb的含量低于上一次测定的血液中numb含量,以及且测定术后患者的血液中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于上一次测定值,则表明该患者的病情有所发展或者进一步恶化;反之则表明该患者的病情好转。
62.本发明msi2-numb结合代谢分子测定胰腺癌进展的方法,与现有技术相比,有益效果为:
63.一、本发明方法将musashi2(msi2)和numb在胰腺癌组织中水平结合血液代谢分子数综合测定病情进展,评估胰腺肿瘤恶化程度更加准确。
64.二、本发明预后测定患者血液中的musashi2和numb表达,以及结合血液代谢分子综合判定术后病情进展情况:测定术后患者的血液中musashi2含量高于上一次测定的血液中musashi2含量,且测定术后患者的血液中numb的含量低于上一次测定的血液中numb含量,以及且测定术后患者的血液中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于上一次测定值,则表明该患者的病情有所发展或者进一步恶化;反之则表明该患者的病情好转。
65.三、三种指标综合测定更加准确,其中,msi2-numb依赖p53途径调控胰腺癌细胞的增殖及耐药。本发明测定方法能够客观评估肿瘤临床进展、耐药性及不良预后,有助于拟定最佳治疗方案,检测精度比现有单纯依靠代谢分子检测方法能够提高20%。
66.四、本发明提供的musashi2定量pcr方法,使用热启动htaq酶,合适的钙离子浓度,能很好地抑制非特异性扩增,避免假阳性和高背景的结果,溶解曲线能获得单一峰,使荧光染料sypro发挥效果更好,灵敏度非常高。
67.五、本发明的numb定量pcr方法采用合适的钙离子浓度,能很好地抑制非特异性扩
增,避免假阳性和高背景的结果,溶解曲线能获得单一峰,使荧光染料ruby发挥效果更好,灵敏度高,检测低表达numb,影响患者预后。
68.综上,本发明提供特定的musashi2和numb定量pcr方法,检测更精确;且通过musashi2和numb表达差异,以及代谢分子含量,检测胰腺癌状况,判断预后更加准确。
附图说明
69.图1为本发明的肿瘤组织切除阶段检测流程图;
70.图2为本发明的预后阶段检测流程图。
具体实施方式
71.下面结合具体实施案例和附图1-2对本发明作进一步说明,但本发明并不局限于这些实施例。
72.实施例1
73.msi2-numb结合代谢分子测定胰腺癌进展的方法,包括如下步骤:
74.一、肿瘤组织切除阶段检测,如图1所示:
75.步骤1,肿瘤组织预处理:
76.将肿瘤组织用depc水冲洗,置于冻存管中-80℃冻存待测;取30mg肿瘤组织置1.5ml离心管中,加入1.5ml trizol充分匀浆,室温静置10min;每管加入300μl氯仿,剧烈混匀30sec,静置20min,4℃,10000rpm离心15min;轻轻吸取上层液体400μl至另一新离心管中,加入等体积异丙醇,轻轻颠倒混匀,4℃10000rpm离心15min;弃上清,加入2ml 75%酒精洗涤沉淀物,4℃10000rpm离心15min;弃掉上清,室温下晾干10min,每管加入10μl无rna酶水,在65℃溶解10min;
77.步骤2,测定肿瘤组织musashi2:
78.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
79.所述的荧光染料sypro的工作浓度为0.3
×
,所述热启动htaq酶的工作浓度为0.03u/μl;
80.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
81.所述pcr反应体系还包括8μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
82.所述pcr反应体系还包括8μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
83.所述的datp溶液的工作浓度为50μmol/l;所述dgtp溶液的工作浓度为50μmol/l;所述dctp溶液的工作浓度为60μmol/l;所述荧光标记cy5的工作浓度为0.2
×
;
84.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
85.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒5ng,钙离子浓度为3mmol/l;
86.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
87.步骤3,测定肿瘤组织numb:
88.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
89.所述的荧光染料ruby的工作浓度为0.5
×
,所述热启动htaq酶的工作浓度为0.04u/μl;
90.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
91.所述pcr反应体系还包括10μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
92.所述pcr反应体系还包括10μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
93.所述的dutp溶液的工作浓度为60μmol/l;所述dgtp溶液的工作浓度为40μmol/l;所述dctp溶液的工作浓度为50μmol/l;所述荧光标记cy3的工作浓度为0.4
×
;
94.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
95.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒6ng,钙离子浓度为3mmol/l;
96.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
97.步骤4,测定血液代谢分子:
98.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
99.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
100.步骤5,综合判定:
101.根据肿瘤组织中的musashi2含量高于正常值的程度,以及肿瘤组织中的numb含量低于正常值的程度,并结合血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于正常值的程度,判定肿瘤恶化程度;
102.二、预后阶段检测,如图2所示:
103.步骤1,测定血液musashi2:
104.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
105.所述的荧光染料sypro的工作浓度为0.35
×
~1
×
,所述热启动htaq酶的工作浓度为0.04~0.1u/μl;
106.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
107.所述pcr反应体系还包括9μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
108.所述pcr反应体系还包括9μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
109.所述的datp溶液的工作浓度为90~95μmol/l;所述dgtp溶液的工作浓度为100~120μmol/l;所述dctp溶液的工作浓度为100~120μmol/l;所述荧光标记cy5的工作浓度为0.6
×
~0.8
×
;
110.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
111.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒5~10ng,钙离子浓度为6~8mmol/l;
112.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
113.步骤2,测定血液numb:
114.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
115.所述的荧光染料ruby的工作浓度为0.8
×
~1
×
,所述热启动htaq酶的工作浓度为0.06~0.1u/μl;
116.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
117.所述pcr反应体系还包括12μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
118.所述pcr反应体系还包括12μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
119.所述的dutp溶液的工作浓度为100~120μmol/l;所述dgtp溶液的工作浓度为80~100μmol/l;所述dctp溶液的工作浓度为80~100μmol/l;所述荧光标记cy3的工作浓度为0.5
×
~0.8
×
;
120.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
121.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒6~12ng,钙离子浓度为5~10mmol/l;
122.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
123.步骤3,测定血液代谢分子:
124.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
125.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和
所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
126.步骤4,预后判定:
127.预后阶段进行多次血液检测,每一次检测结果与上一次检测结果进行对比;
128.测定术后患者的血液中musashi2含量高于上一次测定的血液中musashi2含量,且测定术后患者的血液中numb的含量低于上一次测定的血液中numb含量,以及且测定术后患者的血液中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于上一次测定值,则表明该患者的病情有所发展或者进一步恶化;反之则表明该患者的病情好转。
129.本实施例中所用荧光染料sypro、ruby购自上海吉泰远成生物科技有限公司;热启动htaq酶购自new england biolabs(neb)公司;pcr缓冲液、datp溶液、dutp溶液、dgtp溶液、dctp溶液均购自上海吉泰远成生物科技有限公司;正向引物、反向引物、pcr保护剂等均购自上海吉泰远成生物科技有限公司。
130.本实施例对某胰腺癌肿瘤患者进行评估,在切除手术时检测一次肿瘤组织细胞中的musashi2和numb含量,以及血液中代谢分子数据,评判肿瘤恶化程度。之后,间隔1个月测定一次手术患者血液中的musashi2、numb和代谢分子数据,进行预后,第二次测定血液中musashi2含量高于第一次测定的血液中musashi2含量,测定血液中numb的含量低于第一次测定的血液中numb含量,以及血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于第一次测定值,因此,表明该患者的病情进一步恶化,改换其它治疗方案。
131.实施例2
132.msi2-numb结合代谢分子测定胰腺癌进展的方法,包括如下步骤:
133.一、肿瘤组织切除阶段检测,如图1所示:
134.步骤1,肿瘤组织预处理:
135.将肿瘤组织用depc水冲洗,置于冻存管中-80℃冻存待测;取35mg肿瘤组织置1.5ml离心管中,加入1.5ml trizol充分匀浆,室温静置10min;每管加入300μl氯仿,剧烈混匀30sec,静置20min,4℃,10000rpm离心15min;轻轻吸取上层液体400μl至另一新离心管中,加入等体积异丙醇,轻轻颠倒混匀,4℃10000rpm离心15min;弃上清,加入2ml 75%酒精洗涤沉淀物,4℃10000rpm离心15min;弃掉上清,室温下晾干10min,每管加入10μl无rna酶水,在65℃溶解12min;
136.步骤2,测定肿瘤组织musashi2:
137.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
138.所述的荧光染料sypro的工作浓度为0.5
×
,所述热启动htaq酶的工作浓度为0.06u/μl;
139.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
140.所述pcr反应体系还包括8μmol/l正向引物,核苷酸序列为:
aggttgagccatgcagtcat;
141.所述pcr反应体系还包括8μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
142.所述的datp溶液的工作浓度为60μmol/l;所述dgtp溶液的工作浓度为60μmol/l;所述dctp溶液的工作浓度为70μmol/l;所述荧光标记cy5的工作浓度为0.3
×
;
143.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
144.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒6ng,钙离子浓度为4mmol/l;
145.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
146.步骤3,测定肿瘤组织numb:
147.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
148.所述的荧光染料ruby的工作浓度为0.6
×
,所述热启动htaq酶的工作浓度为0.05u/μl;
149.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
150.所述pcr反应体系还包括10μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
151.所述pcr反应体系还包括10μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
152.所述的dutp溶液的工作浓度为65μmol/l;所述dgtp溶液的工作浓度为45μmol/l;所述dctp溶液的工作浓度为50μmol/l;所述荧光标记cy3的工作浓度为0.5
×
;
153.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
154.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒8ng,钙离子浓度为5mmol/l;
155.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
156.步骤4,测定血液代谢分子:
157.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
158.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
159.步骤5,综合判定:
160.根据肿瘤组织中的musashi2含量高于正常值的程度,以及肿瘤组织中的numb含量低于正常值的程度,并结合血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于
2.10的代谢分子的数量之间的比例高于正常值的程度,判定肿瘤恶化程度;
161.二、预后阶段检测,如图2所示:
162.步骤1,测定血液musashi2:
163.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
164.所述的荧光染料sypro的工作浓度为0.6
×
,所述热启动htaq酶的工作浓度为0.06u/μl;
165.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
166.所述pcr反应体系还包括9μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
167.所述pcr反应体系还包括9μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
168.所述的datp溶液的工作浓度为92μmol/l;所述dgtp溶液的工作浓度为110μmol/l;所述dctp溶液的工作浓度为110μmol/l;所述荧光标记cy5的工作浓度为0.6
×
;
169.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
170.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒8ng,钙离子浓度为6mmol/l;
171.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
172.步骤2,测定血液numb:
173.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
174.所述的荧光染料ruby的工作浓度为0.8
×
,所述热启动htaq酶的工作浓度为0.08u/μl;
175.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
176.所述pcr反应体系还包括12μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
177.所述pcr反应体系还包括12μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
178.所述的dutp溶液的工作浓度为110μmol/l;所述dgtp溶液的工作浓度为90μmol/l;所述dctp溶液的工作浓度为90μmol/l;所述荧光标记cy3的工作浓度为0.6
×
;
179.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
180.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒8ng,钙离子浓度为8mmol/l;
181.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
182.步骤3,测定血液代谢分子:
183.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
184.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
185.步骤4,预后判定:
186.预后阶段进行多次血液检测,每一次检测结果与上一次检测结果进行对比;
187.测定术后患者的血液中musashi2含量高于上一次测定的血液中musashi2含量,且测定术后患者的血液中numb的含量低于上一次测定的血液中numb含量,以及且测定术后患者的血液中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于上一次测定值,则表明该患者的病情有所发展或者进一步恶化;反之则表明该患者的病情好转。
188.本实施例中所用荧光染料sypro、ruby购自上海吉泰远成生物科技有限公司;热启动htaq酶购自new england biolabs(neb)公司;pcr缓冲液、datp溶液、dutp溶液、dgtp溶液、dctp溶液均购自上海吉泰远成生物科技有限公司;正向引物、反向引物、pcr保护剂等均购自上海吉泰远成生物科技有限公司。
189.本实施例对某胰腺癌肿瘤患者进行评估,在切除手术时检测一次肿瘤组织细胞中的musashi2和numb含量,以及血液中代谢分子数据,评判肿瘤恶化程度。之后,间隔半个月测定一次手术患者血液中的musashi2、numb和代谢分子数据,进行预后,第二次测定血液中musashi2含量低于第一次测定的血液中musashi2含量,测定血液中numb的含量高于第一次测定的血液中numb含量,以及血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例低于第一次测定值,因此,表明该患者的病情有所好转,继续观察。
190.实施例3
191.msi2-numb结合代谢分子测定胰腺癌进展的方法,包括如下步骤:
192.一、肿瘤组织切除阶段检测,如图1所示:
193.步骤1,肿瘤组织预处理:
194.将肿瘤组织用depc水冲洗,置于冻存管中-80℃冻存待测;取45mg肿瘤组织置1.5ml离心管中,加入1.5ml trizol充分匀浆,室温静置10min;每管加入300μl氯仿,剧烈混匀30sec,静置20min,4℃,10000rpm离心15min;轻轻吸取上层液体400μl至另一新离心管中,加入等体积异丙醇,轻轻颠倒混匀,4℃10000rpm离心15min;弃上清,加入2ml 75%酒精洗涤沉淀物,4℃10000rpm离心15min;弃掉上清,室温下晾干10min,每管加入10μl无rna酶水,在65℃溶解15min;
195.步骤2,测定肿瘤组织musashi2:
196.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,
从而保证荧光信号的增加与pcr产物的增加完全同步;
197.所述的荧光染料sypro的工作浓度为0.8
×
,所述热启动htaq酶的工作浓度为0.08u/μl;
198.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
199.所述pcr反应体系还包括8μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
200.所述pcr反应体系还包括8μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
201.所述的datp溶液的工作浓度为75μmol/l;所述dgtp溶液的工作浓度为80μmol/l;所述dctp溶液的工作浓度为75μmol/l;所述荧光标记cy5的工作浓度为0.7
×
;
202.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
203.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒7ng,钙离子浓度为6mmol/l;
204.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
205.步骤3,测定肿瘤组织numb:
206.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
207.所述的荧光染料ruby的工作浓度为0.9
×
,所述热启动htaq酶的工作浓度为0.07u/μl;
208.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
209.所述pcr反应体系还包括10μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
210.所述pcr反应体系还包括10μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
211.所述的dutp溶液的工作浓度为75μmol/l;所述dgtp溶液的工作浓度为45μmol/l;所述dctp溶液的工作浓度为65μmol/l;所述荧光标记cy3的工作浓度为0.55
×
;
212.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
213.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒7ng,钙离子浓度为6mmol/l;
214.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
215.步骤4,测定血液代谢分子:
216.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
217.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
218.步骤5,综合判定:
219.根据肿瘤组织中的musashi2含量高于正常值的程度,以及肿瘤组织中的numb含量低于正常值的程度,并结合血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于正常值的程度,判定肿瘤恶化程度;
220.二、预后阶段检测,如图2所示:
221.步骤1,测定血液musashi2:
222.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
223.所述的荧光染料sypro的工作浓度为0.35
×
,所述热启动htaq酶的工作浓度为0.04u/μl;
224.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
225.所述pcr反应体系还包括9μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
226.所述pcr反应体系还包括9μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
227.所述的datp溶液的工作浓度为90μmol/l;所述dgtp溶液的工作浓度为100μmol/l;所述dctp溶液的工作浓度为100μmol/l;所述荧光标记cy5的工作浓度为0.6
×
;
228.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
229.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒5ng,钙离子浓度为6mmol/l;
230.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
231.步骤2,测定血液numb:
232.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
233.所述的荧光染料ruby的工作浓度为0.8
×
,所述热启动htaq酶的工作浓度为0.06u/μl;
234.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
235.所述pcr反应体系还包括12μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
236.所述pcr反应体系还包括12μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
237.所述的dutp溶液的工作浓度为100μmol/l;所述dgtp溶液的工作浓度为80μmol/l;
所述dctp溶液的工作浓度为80μmol/l;所述荧光标记cy3的工作浓度为0.5
×
;
238.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
239.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒6ng,钙离子浓度为5mmol/l;
240.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
241.步骤3,测定血液代谢分子:
242.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
243.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
244.步骤4,预后判定:
245.预后阶段进行多次血液检测,每一次检测结果与上一次检测结果进行对比;
246.测定术后患者的血液中musashi2含量高于上一次测定的血液中musashi2含量,且测定术后患者的血液中numb的含量低于上一次测定的血液中numb含量,以及且测定术后患者的血液中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于上一次测定值,则表明该患者的病情有所发展或者进一步恶化;反之则表明该患者的病情好转。
247.本实施例中所用荧光染料sypro、ruby购自上海吉泰远成生物科技有限公司;热启动htaq酶购自new england biolabs(neb)公司;pcr缓冲液、datp溶液、dutp溶液、dgtp溶液、dctp溶液均购自上海吉泰远成生物科技有限公司;正向引物、反向引物、pcr保护剂等均购自上海吉泰远成生物科技有限公司。
248.本实施例对某胰腺癌肿瘤患者进行评估,在切除手术时检测一次肿瘤组织细胞中的musashi2和numb含量,以及血液中代谢分子数据,评判肿瘤恶化程度。之后,间隔1个月测定一次手术患者血液中的musashi2、numb和代谢分子数据,进行预后,第二次测定血液中musashi2含量高于第一次测定的血液中musashi2含量,测定血液中numb的含量低于第一次测定的血液中numb含量,以及血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于第一次测定值,因此,表明该患者的病情进一步恶化,改换其他治疗方案。
249.实施例4
250.msi2-numb结合代谢分子测定胰腺癌进展的方法,包括如下步骤:
251.一、肿瘤组织切除阶段检测,如图1所示:
252.步骤1,肿瘤组织预处理:
253.将肿瘤组织用depc水冲洗,置于冻存管中-80℃冻存待测;取50mg肿瘤组织置1.5ml离心管中,加入1.5ml trizol充分匀浆,室温静置10min;每管加入300μl氯仿,剧烈混匀30sec,静置20min,4℃,10000rpm离心15min;轻轻吸取上层液体400μl至另一新离心管
中,加入等体积异丙醇,轻轻颠倒混匀,4℃10000rpm离心15min;弃上清,加入2ml 75%酒精洗涤沉淀物,4℃10000rpm离心15min;弃掉上清,室温下晾干10min,每管加入10μl无rna酶水,在65℃溶解15min;
254.步骤2,测定肿瘤组织musashi2:
255.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
256.所述的荧光染料sypro的工作浓度为1
×
,所述热启动htaq酶的工作浓度为0.1u/μl;
257.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
258.所述pcr反应体系还包括8μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
259.所述pcr反应体系还包括8μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
260.所述的datp溶液的工作浓度为80μmol/l;所述dgtp溶液的工作浓度为90μmol/l;所述dctp溶液的工作浓度为80μmol/l;所述荧光标记cy5的工作浓度为0.8
×
;
261.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
262.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒10ng,钙离子浓度为8mmol/l;
263.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
264.步骤3,测定肿瘤组织numb:
265.将肿瘤组织进行预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
266.所述的荧光染料ruby的工作浓度为1
×
,所述热启动htaq酶的工作浓度为0.1u/μl;
267.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
268.所述pcr反应体系还包括10μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
269.所述pcr反应体系还包括10μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
270.所述的dutp溶液的工作浓度为80μmol/l;所述dgtp溶液的工作浓度为70μmol/l;所述dctp溶液的工作浓度为70μmol/l;所述荧光标记cy3的工作浓度为0.7
×
;
271.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
272.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒12ng,钙离子浓度为8mmol/l;
273.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
274.步骤4,测定血液代谢分子:
275.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
276.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
277.步骤5,综合判定:
278.根据肿瘤组织中的musashi2含量高于正常值的程度,以及肿瘤组织中的numb含量低于正常值的程度,并结合血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于正常值的程度,判定肿瘤恶化程度;
279.二、预后阶段检测,如图2所示:
280.步骤1,测定血液musashi2:
281.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料sypro和热启动htaq酶,所述的荧光染料sypro能特异性地结合musashi2而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
282.所述的荧光染料sypro的工作浓度为1
×
,所述热启动htaq酶的工作浓度为0.1u/μl;
283.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy5、datp溶液、dgtp溶液、dctp溶液、pcr保护剂、钙离子和无菌双蒸水;
284.所述pcr反应体系还包括9μmol/l正向引物,核苷酸序列为:aggttgagccatgcagtcat;
285.所述pcr反应体系还包括9μmol/l反向引物,核苷酸序列为:aggttgagccatgcagtagc;
286.所述的datp溶液的工作浓度为95μmol/l;所述dgtp溶液的工作浓度为120μmol/l;所述dctp溶液的工作浓度为120μmol/l;所述荧光标记cy5的工作浓度为0.8
×
;
287.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
288.所述pcr反应体系中musashi2模板量为:以20μl反应体系计,质粒10ng,钙离子浓度为8mmol/l;
289.定量pcr反应条件为:90℃4min,95℃15s,50℃35s,40个循环。
290.步骤2,测定血液numb:
291.将术后患者的血液预处理后,置于pcr反应体系,在pcr反应体系中加入荧光染料ruby和热启动htaq酶,所述的荧光染料ruby能特异性地结合numb而发出荧光信号,从而保证荧光信号的增加与pcr产物的增加完全同步;
292.所述的荧光染料ruby的工作浓度为1
×
,所述热启动htaq酶的工作浓度为0.1u/μl;
293.所述的pcr反应体系还包括pcr缓冲液、荧光标记cy3、dutp溶液、dgtp溶液、dctp溶
液、pcr保护剂、钙离子和无菌双蒸水;
294.所述pcr反应体系还包括12μmol/l正向引物,核苷酸序列为:ggcacccagcacaatgaaga;
295.所述pcr反应体系还包括12μmol/l反向引物,核苷酸序列为:actcctgcttgctgatccac;
296.所述的dutp溶液的工作浓度为120μmol/l;所述dgtp溶液的工作浓度为100μmol/l;所述dctp溶液的工作浓度为100μmol/l;所述荧光标记cy3的工作浓度为0.8
×
;
297.所述的pcr保护剂为明胶、tween20或二硫苏糖醇;
298.所述pcr反应体系中numb模板量为:以20μl反应体系计,质粒12ng,钙离子浓度为10mmol/l;
299.定量pcr反应条件为:94℃3min,94℃20s,50℃30s,40个循环。
300.步骤3,测定血液代谢分子:
301.测定患者血液中分子量为100~3000道尔顿的代谢分子的数量,计算信噪比高于最佳阈值的分子数与所检测代谢分子数的比值:血液与纳米硅进行混合,将混合后的血液在质谱的靶板上制样,用质谱仪获得数据(精度为0.001-0.1道尔顿),获得的数据为100道尔顿以上的代谢分子的相对数量值m,然后选择100~3000道尔顿,且信噪比大于2.10的所有代谢分子的数量值n;
302.所述血液与纳米硅混合质量比例为1:0.6;所述信噪比高于最佳阈值的分子数和所选取检测代谢分子数的比值计算采用下组的公式为:得分比值=信噪比高于最佳阈值的分子数/所检测代谢分子数,即得分比值=n/m;
303.步骤4,预后判定:
304.预后阶段进行多次血液检测,每一次检测结果与上一次检测结果进行对比;
305.测定术后患者的血液中musashi2含量高于上一次测定的血液中musashi2含量,且测定术后患者的血液中numb的含量低于上一次测定的血液中numb含量,以及且测定术后患者的血液中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例高于上一次测定值,则表明该患者的病情有所发展或者进一步恶化;反之则表明该患者的病情好转。
306.本实施例中所用荧光染料sypro、ruby购自上海吉泰远成生物科技有限公司;热启动htaq酶购自new england biolabs(neb)公司;pcr缓冲液、datp溶液、dutp溶液、dgtp溶液、dctp溶液均购自上海吉泰远成生物科技有限公司;正向引物、反向引物、pcr保护剂等均购自上海吉泰远成生物科技有限公司。
307.本实施例对某胰腺癌肿瘤患者进行评估,在切除手术时检测一次肿瘤组织细胞中的musashi2和numb含量,以及血液中代谢分子数据,评判肿瘤恶化程度。之后,每间隔半个月测定一次手术患者血液中的musashi2、numb和代谢分子数据,进行预后,第二次测定血液中musashi2含量低于第一次测定的血液中musashi2含量,测定血液中numb的含量高于第一次测定的血液中numb含量,以及血浆中所有检出的分子量为100~3000道尔顿,且信噪比大于2.10的代谢分子的数量之间的比例低于第一次测定值,因此,表明该患者的病情有所好转。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
