一种心叶牛舌草jackfrost的组织培养方法
技术领域
1.本技术涉及植物离体培养的技术领域,更具体地说,它涉及一种心叶牛舌草jackfrost的组织培养方法。
背景技术:
2.心叶牛舌草jack frost(brunnera macrophyllajack frost),属于紫草科牛舌草属植物,为多年生草本,丛生,呈半球型;叶片为卵圆状心型,叶色为有绿色叶脉的霜银色;叶面及叶背密被白色柔毛。该品种植株具有较高的观赏价值,适用于林荫地花境前景布置、溪流水景配植、路边丛植、私家花园庭院栽植以及盆栽观赏,应用范围广泛,具备良好的市场前景。
3.心叶牛舌草jack frost性喜凉爽、湿润的气候,喜疏松、排水良好的沙壤土,耐半荫,在树下等荫蔽条件下生长良好。目前,心叶牛舌草jack frost的繁殖方式主要为播种繁殖和分株繁殖,上述繁殖方式较为传统,其繁殖效率较低。且心叶牛舌草jack frost 忌高温、高湿,忌强光长时间直射,故心叶牛舌草jack frost的繁殖效率同时还受到季节更替变化的影响,导致心叶牛舌草jack frost在高温季节的繁殖效率更低。
4.针对上述中的相关技术,发明人认为,一方面,目前心叶牛舌草jack frost所依赖的传统繁殖技术,使得心叶牛舌草jack frost的繁殖效率较低,故依赖心叶牛舌草jackfrost目前的繁殖技术,很明显限制了心叶牛舌草jack frost的应用;另一方面,在季节更替变化的影响下,心叶牛舌草jack frost的繁殖效率变得更低,从而进一步限制了心叶牛舌草jack frost的应用。
技术实现要素:
5.为了提高心叶牛舌草jack frost的繁殖效率,促进心叶牛舌草jack frost的应用,本技术提供一种心叶牛舌草jack frost的组织培养方法。
6.本技术提供的一种心叶牛舌草jack frost的组织培养方法采用如下的技术方案:
7.一种心叶牛舌草jack frost的组织培养方法,所述组织培养方法包括以下步骤:外植体的获取和消毒、诱导外植体形成愈伤组织和不定芽、不定芽增殖以及诱导不定芽生根;其中,
8.所述外植体的获取和消毒步骤中,外植体选取生长健壮且无病虫害的母株的新叶片;
9.所述诱导外植体形成愈伤组织和不定芽步骤中,所用的培养基配方为:ms培养基,6-ba 1.0-2.0mg/l,naa 0.1-0.5mg/l,蔗糖25-30g/l,琼脂4.5-5g/l,ph值在5.8-6.0;培养温度23-27℃,光照强度1500-1800lux,光照时长8-10h/d;
10.所述不定芽增殖步骤中,所用的培养基配方为:ms培养基,6-ba 1.0-2.0mg/l, iba 0.1-0.5mg/l,蔗糖25-30g/l,琼脂4-4.5g/l,ph值在5.8-6.0;培养温度23-27℃,光照强度1500-1800lux,光照时长8-10h/d;
的增殖率较低。因此,将诱导外植体形成愈伤组织和不定芽的培养基中6-ba的添加量控制在1.0-2.0mg/l为宜。
18.诱导不定芽增殖的培养基中,利用6-ba和iba作为植物激素。诱导不定芽增殖的培养基中加入细胞分裂素6-ba,能够促进植物细胞的分裂和增殖,加入iba,能够刺激植物生长,促进细胞增殖和扩大,因此,在不定芽增殖的培养基中加入6-ba和iba,能够促进不定芽的增殖。诱导不定芽生根的培养基中,没有额外加入植物激素。不定芽在生根培养基及自身合成的各类激素的共同作用下,促进增殖后的不定芽生根形成小苗。在诱导不定芽生根的培养基中,还加入了活性炭。活性炭能够吸附不定芽的代谢产物,增强培养基的通透性。
19.优选的,所述新叶片为母株上生长期为20-50天的新叶片。
20.在一个具体的实施方案中,所述新叶片在母株上的生长期可以为20天、35天、50 天。
21.在一个具体的实施方案中,所述新叶片在母株上的生长期可以为20-35天。
22.在一个具体的实施方案中,所述新叶片在母株上的生长期可以为35-50天。
23.优选的,所述新叶片为母株上生长期为20-35天的新叶片。
24.通过采用上述技术方案,在心叶牛舌草jack frost的组织培养中,选择生长期较短的新叶片作为外植体。由于生长期较短的新叶片的组织细胞分裂活动旺盛、发育良好,可有效提高心叶牛舌草jack frost的诱导成功率。另外,较生长时间较长的植物器官而言,生长期较短的新叶片本身存在的时间较短,受到外界的干扰较小,故可有效降低心叶牛舌草jack frost组织培养的污染率。
25.本技术选择生长期为20-50天的新叶片作为外植体,且新叶片完全展开。较生长期小于20d的未完全展开的幼嫩叶片,完全展开的新叶片组织厚实,对各类消毒剂的耐受能力较强。因此,可通过延长消毒时间来降低外植体的污染率,且延长消毒时间对新叶片造成的负面影响较小,存活率明显升高。较生长期大于50d的老叶片,老叶片纤维化加重,叶片细胞代谢活动减弱,诱导成功率显著下降,在诱导过程中需在培养基中添加较高浓度的细胞分裂素和生长素,容易造成植物生理紊乱失调,并增加了生产成本。生长期为20-50天的新叶片细胞代谢活动旺盛、分裂能力强,叶片内各类激素浓度较高,使用较低浓度的细胞分裂素和生长素即可成功诱导出愈伤组织和不定芽,可有效避免因各类激素过高引起的玻璃化及其他不良反应。
26.综上所述,本技术选择生长期为20-50天的新叶片作为外植体,来进行心叶牛舌草jack frost的组织培养。
27.优选的,所述外植体的获取和消毒步骤中,消毒处理包括:冲洗、酒精消毒、氯化汞溶液处理。
28.优选的,所述氯化汞溶液处理中利用0.1%的氯化汞溶液进行处理。
29.优选的,所述氯化汞溶液的处理时间为5-9min。
30.优选的,所述氯化汞溶液的处理时间为7min。
31.通过采用上述技术方案,用酒精浸泡消毒后,可杀灭少量附着在材料表面的病原体,有效排除外植体表面可能附带的污染源的干扰,并可有效增加消毒剂对外植体材料表面的浸透性,进一步提高外植体消毒的成功率。氯化汞能够杀死繁殖体、亲脂性病毒等,在植物组织培养外植体消毒时,汞是高效消毒剂,对外植体携带的病原体等具有很强的杀灭
作用,进一步提高外植体消毒的成功率。先用75%酒精消毒,再用消毒剂消毒,酒精具有较强的浸润作用,能够排除外植体表面的空气,利于消毒剂的渗入,从而提高消毒剂对外植体材料表面的浸透性,提高消毒剂的消毒效果,在酒精消毒和消毒剂消毒的配合下,提高外植体消毒的成功率。氯化汞对植物杀伤作用较大,若浸泡时间较长,植物器官的生长会受到影响,甚至会被杀死,因此,利用氯化汞对外植体消毒时要严格控制浸泡时间,经过试验,本技术中将外植体浸泡在氯化汞溶液中的时间控制在7-9min范围内。
32.综上所述,本技术具有以下有益效果:
33.本技术选择心叶牛舌草jack frost母株上生长健壮且无病虫害的新叶片作为外植体,进行心叶牛舌草jack frost的组织培养,较选择心叶牛舌草jack frost的其他部位作为外植体进行组织培养,本技术能够有效缩短组织培养过程中的诱导周期,提高心叶牛舌草jack frost的增殖系数和生根率,从而提高心叶牛舌草jack frost的繁殖效率,降低季节对该品种生产的限制,从而促进心叶牛舌草jack frost的应用。
34.在诱导外植体形成愈伤组织和不定芽的培养基中,利用6-ba和naa作为植物激素。相对于利用2,4-d或iba代替naa的培养基,本技术提供的培养基能够有效提高获得的愈伤组织质量以及不定芽的分化情况,从而提高心叶牛舌草jack frost的繁殖效率。
35.本技术选择母株上生长期为20-50天的新叶片作为外植体,进行心叶牛舌草jackfrost的组织培养,其组织细胞分裂活动旺盛、发育良好,可提高心叶牛舌草的诱导成功率;且新叶片生长的时间较短,受到外界的干扰较小,可降低心叶牛舌草组织培养的污染率。
附图说明
36.图1是本技术中诱导外植体形成愈伤组织和不定芽的示意图。
37.图2是本技术中不定芽增殖分化形成丛生不定芽的示意图。
38.图3是本技术中不定芽生根的示意图。
具体实施方式
39.本技术中用到的酒精为欧洁75%消毒酒精500ml,购自杭州欧拓普生物技术有限公司;氯化汞为购自天津市光复精细化工研究所的氯化汞标准溶液;预防性消毒剂为国光50%多菌灵,购自四川润尔科技有限公司。
40.本技术中用到的心叶牛舌草jack frost母株选自北京花乡花卉科技研究所有限公司。
41.本技术提供了一种心叶牛舌草jack frost的组织培养方法,具体包括以下步骤:
42.1.外植体的获取和消毒
43.(1)外植体的获取:将母株置于温室中培养30-60天,过程中去除枯、病叶,且每15天喷洒一次预防性杀菌剂;选择生长健壮、性能表现良好、无病虫害的母株,选取母株上完全展开且无病虫害的新叶片;
44.(2)外植体的消毒:
45.冲洗:将步骤(1)获取的新叶片于流动的自来水下冲洗10min,晾干;
46.酒精消毒:晾干后,置于75%的酒精中浸泡震荡消毒30-60s,后用无菌水震荡清洗 1-2遍,每次1-2min;
47.0.1%的氯化汞溶液:再将新叶片置于0.1%的氯化汞溶液中浸泡震荡5-9min,后用无菌水震荡清洗3-5遍,每次1-2min;
48.裁剪:将消毒后的叶片边缘切除,并将叶片裁剪成边长为1cm的正方形,获得待诱导的外植体。
49.2.诱导外植体形成愈伤组织和不定芽
50.将步骤1获得的待诱导的外植体平铺接种至诱导外植体形成愈伤组织和不定芽的培养基中,诱导外植体形成愈伤组织和不定芽,获得与愈伤组织一体的不定芽。
51.其中,该步骤中用到的培养基配方为:ms培养基,6-ba(6-苄氨基腺嘌呤) 1.0-2.0mg/l,naa(萘乙酸)0.1-0.5mg/l,蔗糖25-30g/l,琼脂4-4.5g/l,ph值在5.8-6.0;培养温度为23-27℃,光照强度为1500-1800lux,光照时长为8-10h/d。
52.3.不定芽增殖
53.将步骤2获得的与愈伤组织一体的不定芽从愈伤组织上分离出来,并将分离出来的不定芽剥离成单个的不定芽,分别将单个不定芽接种到诱导不定芽增殖的培养基中,获得增殖后的丛生不定芽。
54.其中,该步骤中用到的培养基配方为:ms培养基,6-ba 1.0-2.0mg/l,iba 0.1-0.5mg/l,蔗糖25-30g/l,琼脂4-4.5g/l,ph值在5.8-6.0;培养温度为23-27℃,光照强度为1500-1800lux,光照时长为8-10h/d。
55.4.诱导不定芽生根
56.将步骤3获得的增殖后的丛生不定芽相互分离,获得单独的不定芽,并将单独的不定芽接种到诱导不定芽生根的培养中。
57.其中,该步骤中用到的培养基配方为:1/2ms培养基,ac(活性炭)0-0.5g/l,蔗糖25-30g/l,琼脂4-4.5g/l,ph值在5.8-6.0;培养温度为23-27℃,光照强度为 1500-1800lux,光照时长为8-10h/d。
58.以下结合实施例1-5、对比例1-7、附图1-3以及检测试验对本技术作进一步详细说明。
59.实施例
60.实施例1
61.本实施例提供了一种心叶牛舌草jack frost的组织培养方法,具体包括以下步骤:
62.1.外植体的获取和消毒
63.(1)外植体的获取:将母株置于温室中培养35天,过程中去除枯、病叶,且每 15天喷洒一次预防性杀菌剂;选择生长健壮、性能表现良好、无病虫害的母株,选取母株上完全展开且无病虫害的新叶片;
64.(2)外植体的消毒:
65.冲洗:将步骤(1)获取的新叶片于流动的自来水下冲洗10min,晾干;
66.酒精消毒:晾干后,将新叶片置于75%的酒精中浸泡震荡消毒30s,后用无菌水震荡清洗1遍,每次1-2min;
67.0.1%的氯化汞处理:再将新叶片置于0.1%的氯化汞溶液中浸泡震荡5min,后用无菌水震荡清洗3遍,每次1-2min;
68.裁剪:将消毒后的叶片边缘切除,并将叶片裁剪成边长为1cm的正方形,获得待诱导的外植体。
69.2.诱导外植体形成愈伤组织和不定芽
70.将步骤1获得的待诱导的外植体平铺接种至诱导外植体形成愈伤组织和不定芽的培养基中,诱导外植体形成愈伤组织和不定芽,获得与愈伤组织一体的不定芽。
71.3.不定芽增殖
72.将步骤2获得的与愈伤组织一体的不定芽从愈伤组织上分离出来,并将分离出来的不定芽剥离成单个的不定芽,分别将单个不定芽接种到诱导不定芽增殖的培养基中,获得增殖后的丛生不定芽。
73.4.诱导不定芽生根
74.将步骤3获得的增殖后的丛生不定芽相互分离,获得单独的不定芽,并将单独的不定芽接种到诱导不定芽生根的培养中。
75.参考图1-图3。
76.图1是诱导外植体形成愈伤组织和不定芽的示意图。
77.图2是不定芽增殖分化形成丛生不定芽的示意图。
78.图3是不定芽生根的示意图。
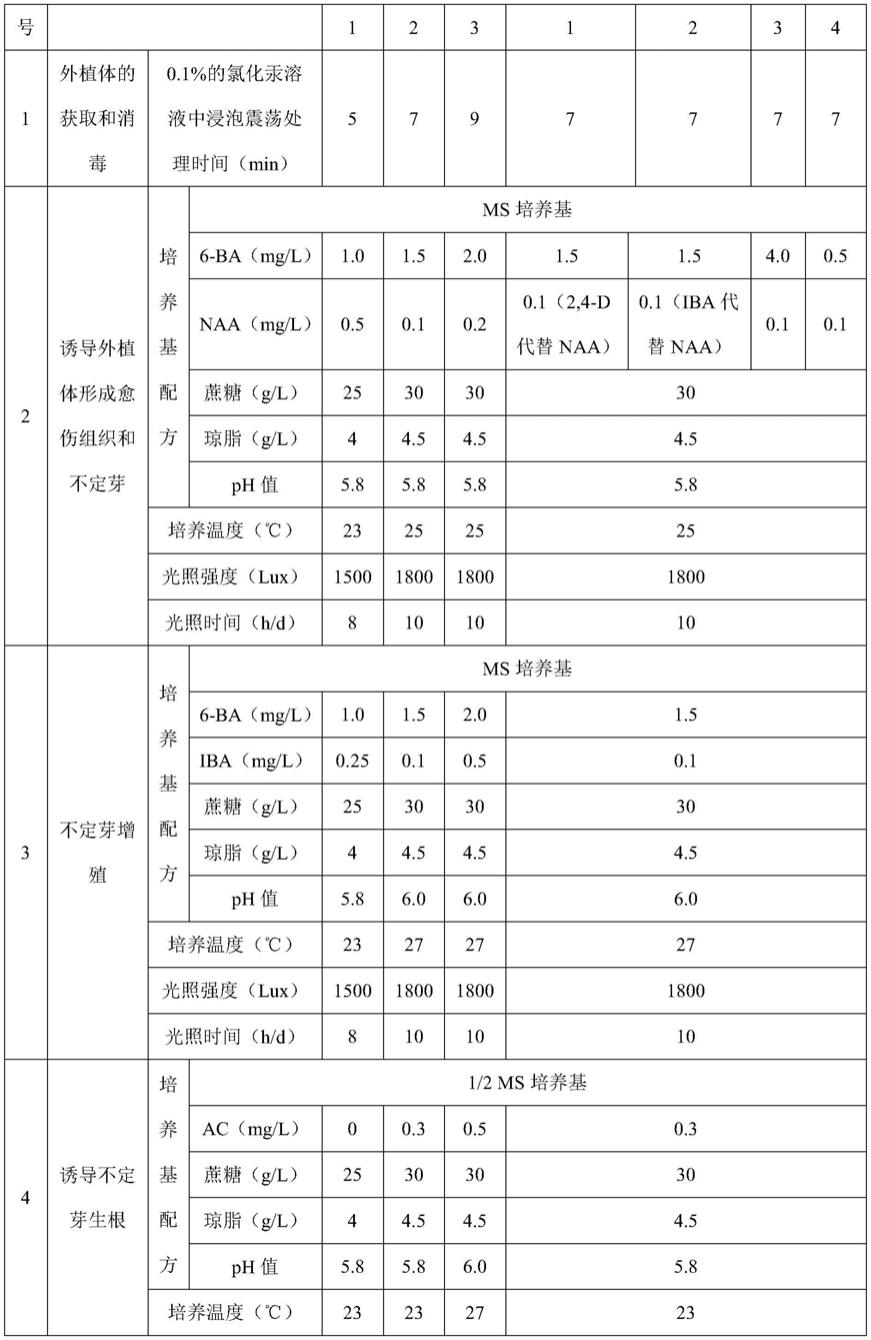
79.各步骤涉及的参数和用到的培养基配方如表1所示。
80.表1各步骤涉及的参数和用到的培养基配方
81.[0082][0083]
[0084]
实施例2-3
[0085]
实施例2-3分别提供了一种心叶牛舌草jack frost的组织培养方法,其与实施例1 的区别之处在于各步骤中的参数和用到的培养基配方,具体如表1所示。
[0086]
对比例
[0087]
对比例1-4
[0088]
对比例1-4分别提供了一种心叶牛舌草jack frost的组织培养方法,上述对比例与实施例2的区别之处在于诱导外植体形成愈伤组织和不定芽步骤中的参数和用到的培养基配方,具体如表1所示。
[0089]
实施例4-5
[0090]
实施例4-5分别提供了一种心叶牛舌草jack frost的组织培养方法,其与实施例2 的区别之处在于作为外植体的新叶片在母株上的生长期,具体如表2所示。
[0091]
对比例5-7
[0092]
对比例5-7分别提供了一种心叶牛舌草jack frost的组织培养方法,上述对比例与实施例2的区别之处在于外植体的选材以及外植体的获取和消毒步骤,具体如表2所示。
[0093]
表2实施例2、实施例4-5、对比例5-7的外植体的选材及获取和消毒
[0094][0095][0096]
检测试验
[0097]
利用实施例1-5以及对比例1-7提供的植物组织培养方法对心叶牛舌草jack frost 进行培养,并记录各阶段培养物在相应培养过程中的考察参数,并计算心叶牛舌草
jackfrost的污染率和死亡率,具体的考察参数和记录结果如表3所示。同时,记录心叶牛舌草jack frost的培养过程中外植体的消毒效果、愈伤组织质量以及形成不定芽的情况,具体记录结果如表4所示。
[0098]
表3实施例1-5以及对比例1-7——心叶牛舌草jack frost的组织培养的结果(一)
[0099][0100]
表4实施例1-5以及对比例1-7——心叶牛舌草jack frost的组织培养的结果(二)
[0101][0102]
结合实施例1-5以及对比例1-7的组织培养方法以及表3和表4的内容,本技术选择母株上生长期为20-50d且完全展开的新叶片作为外植体,同时在各组织培养阶段选择合适的培养基配方和培养条件,进行心叶牛舌草jack frost的组织培养,不仅提高了心叶牛舌草外植体的消毒成功率,而且缩短了诱导周期,提高了不定芽增殖倍率,同时,心叶牛舌草的生根效果较好,进而提高了心叶牛舌草jack frost的繁殖效率,降低季节对该品种生产的限制,从而促进心叶牛舌草jack frost的应用。
[0103]
首先,选择合适的母株部位作为外植体来进行心叶牛舌草jack frost的组织培
养,能够直接影响心叶牛舌草jack frost组织培养的最终结果。对比实施例2、实施例4-5 和对比例5-7的培养结果,在相同组织培养条件和无病虫害的要求下,本技术实施例2 选择的外植体为母株上生长期为35d且完全展开的新叶片,而对比例5-7选择的外植体分别为母株上生长期为35d的新叶片的叶柄、母株上新生长出未8d、未完全展叶的嫩叶片、母株上生长期为55d的老叶片。通过表3和表4可知,利用实施例2、实施例4-5 的组织培养方法获得的污染率分别为5%、5%、15%,死亡率分别为10%、15%、5%,诱导获得大量不定芽,不定芽生长迅速,无玻璃化现象,且分化苗长势较好,植株茁壮,增殖率正常;而利用对比例5-7的组织培养方法获得的污染率分别为5%、0%、20%,死亡率分别为20%、100%、0%,但对比例5有蓬松愈伤组织形成,愈伤组织未分化成不定芽,对比例6消毒后叶片全部褐化死亡,无愈伤组织和不定芽形成,对比例7有少量不定芽分化、不定芽生长速度稍慢、无玻璃化现象,虽然分化苗长势较好,植株茁壮,但增殖率较低,其增殖倍数仅为2-3倍,且诱导率较低,诱导时间较长。
[0104]
由上述可知,外植体的选择对植物组织培养的效果影响较大,选择合适的母株部位作为外植体来进行植物组织培养,能够提高心叶牛舌草jack frost组织培养的效果。本技术选择母株上生长期为20-50d且完全展开的新叶片做为心叶牛舌草jack frost的组织培养的外植体,能够有效降低植物组织培养过程中心叶牛舌草jack frost的污染率和死亡率,提高心叶牛舌草jack frost的诱导率、增殖系数和生根率,缩短心叶牛舌草jackfrost形成愈伤组织和不定芽的诱导时间。
[0105]
另外,心叶牛舌草jack frost组织培养各阶段选择的培养基配方和培养条件也能够影响心叶牛舌草jack frost组织培养的结果,尤其是诱导外植体形成愈伤组织和不定芽步骤中植物激素的选择。对比实施例2和对比例1-2的培养结果,实施例2诱导外植体形成愈伤组织和不定芽中采用的植物激素是6-ba和naa的组合,而对比例1-2诱导外植体形成愈伤组织和不定芽中采用的植物激素分别是6-ba和2,4-d的组合、6-ba和 iba的组合。通过表3和表4可知,利用实施例2的组织培养方法获得的污染率和死亡率分别为5%、10%,诱导大量不定芽形成,不定芽生长迅速,无玻璃化现象,且分化苗长势较好,植株茁壮,增殖率正常;而利用对比例1-2的组织培养方法获得的污染率分别为5%、5%,死亡率分别为10%、10%,但对比例1有紧实深绿色愈伤组织形成,愈伤组织未分化成不定芽,对比例2愈伤组织有少量不定芽分化,且长势较弱,分化苗长势也较差,植株细弱,增殖率低,其增殖倍数仅为2-3倍,同时诱导率较低,诱导时间较长。
[0106]
由上述可知,诱导外植体形成愈伤组织和不定芽步骤中植物激素的选择对植物组织培养的效果也有较大影响,本技术选择6-ba和naa的组合作为诱导外植体形成愈伤组织和不定芽中所用培养基的植物激素,能够提高心叶牛舌草jack frost组织培养中诱导形成的愈伤组织质量,且能诱导出大量不定芽,同时提高心叶牛舌草jack frost的诱导率和增殖系数,缩短心叶牛舌草jack frost形成愈伤组织和不定芽的诱导时间。可知,在诱导外植体形成愈伤组织和不定芽步骤中,naa起到了2,4-d、iba均无法替代的作用,提高了心叶牛舌草jack frost的繁殖效率,降低季节对心叶牛舌草生产的限制。
[0107]
再者,外植体的获取和消毒步骤中,消毒时长对外植体的消毒效果有较大的影响,选择合适的外植体消毒时长对心叶牛舌草jack frost的组织培养效果有较大影响。对比实施例1-3的培养结果,实施例1-3的消毒时长分别为5min、7min、9min。通过表3 和表4可知,
实施例1-3的污染率分别为20%、5%、0%,死亡率分别为0%、10%、20%,实施例1有较多不定芽形成,不定芽生长迅速,无玻璃化现象,分化苗长势较好,植株茁壮,但增殖率稍低,实施例3有大量不定芽形成,不定芽生长迅速,但约10%的不定芽有轻微玻璃化现象,分化苗长势一般,植株长势稍弱,而实施例2有大量不定芽形成,不定芽生长迅速,无玻璃化现象,且分化苗长势较好,植株茁壮,增殖率正常。
[0108]
由上述可知,利用0.1%氯化汞对外植体进行消毒时,将消毒时长控制在5-9min内,消毒后外植体表现正常。当消毒时长较长时,组织培养过程中的污染率越低,消毒效果较佳,但会导致外植体死亡率升高,表明外植体不能长时间处于氯化汞溶液中;当消毒时间越短时,外植体基本不会死亡,但外植体的污染率会显著升高,显然低于消毒时间较长时的消毒效果。因此,本技术最终将外植体的消毒时长控制在5-9min的范围内,最佳的消毒时长为7min。
[0109]
进一步地,在诱导外植体形成愈伤组织和不定芽步骤中,6-ba的添加量也对植物组织培养的效果也有较大影响。对比实施例2和对比例3-4的培养结果,实施例2中6-ba 的添加量为1.5mg/l,而对比例3-4中6-ba的添加量分别为0.5mg/l、4.0mg/l。通过表3和表4可知,利用实施例2的组织培养方法获得的诱导率为100%,诱导时间为15-18 天,诱导获得大量不定芽形成,不定芽生长迅速,无玻璃化现象,且分化苗长势较好,植株茁壮,增殖率正常;而利用对比例3-4的组织培养方法获得的诱导率分别为100%、80%,诱导时间分别为15-18d、20-25d;虽然对比例3有大量不定芽形成,不定芽生长迅速,无玻璃化现象,增殖率高,但对比例3的分化苗长势一般,植株稍弱;虽然对比例3有大量不定芽形成,不定芽生长迅速,无玻璃化现象,分化苗长势较好,植株茁壮,但对比例4的增殖率低,增殖系数仅为2-3倍。
[0110]
由上述可知,在诱导外植体形成愈伤组织和不定芽步骤中,6-ba的添加量对植物组织培养的效果也有较大影响。本技术选择naa的添加量为1.0-2.0mg/l,能够提高心叶牛舌草jack frost组织培养中的诱导率,缩短心叶牛舌草jack frost形成愈伤组织和不定芽的诱导时间,同时培养出茁壮的分化苗。
[0111]
综上所述,本技术提供的心叶牛舌草jack frost的组织培养方法,外植体选择母株上生长期为20-50d且完全展开的新叶片,新叶片取材容易,不受季节限制,且对母株伤害较小。外植体诱导成功率高,且能够直接诱导出愈伤组织和不定芽,缩短了诱导周期,提高了不定芽增殖系数,同时,心叶牛舌草jack frost的生根效果较好,生根率达百分之百,提高了心叶牛舌草jack frost的移栽率,从而促进了心叶牛舌草jack frost 的应用。
[0112]
本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
