1.本发明涉及利用了基于软骨成分的3d打印生物墨水、及利用上述生物墨水的、治疗小耳症目的的结构体制造方法。更详细地说,涉及如下的用于治疗小耳症的结构体的制造方法,利用将同种源及异种源性的软骨脱细胞化而将免疫反应诱发因子的残留最小化的软骨组织微粒化,并与一种以上的生物相容性高分子和微粒化的高分子物理混合制造的3d打印生物墨水组合物,来治疗小耳症的结构体的制造方法。
背景技术:
2.软骨组织重建手术是为了先天畸形的小耳症,或者外伤、烧伤等导致耳朵缺损的患者的恢复而实施的。对于从出生时就没有耳朵或只有痕迹的先天畸形小耳症而言,到了小儿或青少年时期由于对外貌不满,而会引发人际恐惧症,形成异性关系和就业等社会关系困难,因此需要手术治疗。
3.目前适用的耳朵重建手术方法是通过采取自体肋骨软骨,用刀制作耳朵模样,用铁丝连接的方式。但是,上述方法存在如下缺点:需要在软骨生长后10岁左右进行手术,可采取的肋骨软骨有限,肋骨软骨很难呈现耳朵模样,采取肋骨后伴随胸廓变形等副作用和疼痛。
4.虽然有使用同种软骨或合成物质等人工移植材料的方法,但上述方法不仅有供求困难和高费用的限制因素,当采用人工移植材料的情况下,存在移植后有可能发生突出等副作用的顾虑。
5.为了解决上述现有治疗方法的局限性,我们将利用3d打印来制作和应用小耳症患者定制型结构体。
6.3d打印是通过患者信息打印组织和器官,生产定制的组织和器官的有未来希望的新技术。特别是,如果像小耳症那样,一只耳朵有缺损的情况下,镜像(mirroring)正常耳朵的ct资料,可以实现缺损部位。而且,像耳朵这样的软骨组织,微细血管较少,每个人都有不同的弯曲和曲面,因此3d打印嫁接比较合适。
7.生物墨水是通过3d打印使组织或器官能够打印的材料,是3d打印的核心要素之一。从合成高分子到生物高分子,可以使用多种材料,须具有生物相容性。可以构成生物墨水的生物相容性高分子有琼脂糖(argarose)、海藻酸盐(alginate)、壳聚糖(chitosan)、胶原蛋白(collagen)、脱细胞化细胞外基质(decellularized extracellular matrix)、纤维蛋白/纤维蛋白原(fibrin/fibrinogen)、明胶(gelatin)、石墨烯(graphene)、透明质酸(hyaluronic acid)、羟基磷灰石(hydroxyapatite)、聚己内酯(polycaprolactone,pcl)、聚乳酸(poly lactic acid,pla)、聚乳酸-羟基乙酸共聚物((poly-d,l-lactic-co-glycolic acid,plga)和普朗尼克(pluronic f 127)等。其中,海藻酸盐(alginate)具有通过二价阳离子(divalent cation)的螯合作用(chelation)而交联凝胶化的特征,这种性质满足了生物墨水的打印功能(printability)和打印后的机械物性。但是,单独的海藻酸盐
细胞亲和度低,不能提供适合细胞附着生长的环境。
8.微粒化的高分子适用于药物传递、精密探测、分子影像及再生工学等医疗领域。可微粒化的高分子有聚己内酯(polycaprolactone,pcl),聚乳酸-羟基乙酸共聚物(poly-d,l-lactic-co-glycolic acid,plga),聚乙二醇(polyethylene glocol,peg)等。这些材料都是被fda认可的生物降解性高分子,特别是,聚己内酯(pcl)几乎没有毒性,能被体内酵素水解,生物相容性高,目前在临床上广泛使用。另外,由于机械强度较高,与其他高分子的兼容性优秀,在骨再生领域与其他骨再生目的材料混合,用于骨形成诱导研究(非专利文献[1]及[2])。
[0009]
因此,本发明使用基于软骨成分的生物墨水组合物,提出治疗小耳症目的的结构体制造方法。
[0010]
非专利文献
[0011]
[1]malikmammadov、elbay等,生物医学应用中的pcl和基于pcl的材料,journal of biomaterials science,polymer edition 29.7-9(2018):863-893(malikmammadov,elbay,et al."pcl and pcl-based materials in biomedical applications."journal of biomaterials science,polymer edition 29.7-9(2018):863-893).
[0012]
[2]徐宁等,通过用于骨修复的计算机断层扫描引导的融合沉积建模制备的用于骨修复的3d人造骨,acs应用材料与界面6.17(2014):14952-14963(xu,ning,et al."3d artificial bones for bone repair prepared by computed tomography-guided fused deposition modeling for bone repair."acs applied materials&interfaces 6.17(2014):14952-14963).
技术实现要素:
[0013]
解决的技术问题
[0014]
本发明的目的是提供一种含有微粒化的软骨成分的生物墨水组合物和利用上述生物墨水组合物的治疗小耳症目的的结构体制造方法。
[0015]
技术方案
[0016]
本发明提供一种3d打印用生物墨水组合物,其包含微粒化的软骨成分、微粒化的高分子及生物相容性高分子。
[0017]
本发明还提供一种结构体的制造方法,该方法包括挤出3d打印用生物墨水组合物来制造结构体的步骤,所述组合物包含微粒化的软骨成分、微粒化高分子及生物相容性高分子。
[0018]
发明效果
[0019]
根据本发明,生物墨水组合物含有微粒化的软骨成分,可以诱导软骨组织安全有效地再生,容易用于治疗小耳症目的的结构体制作。
[0020]
在本发明中,与上述微粒化的软骨成分一起,物理混合生物相容性高分子和微粒化的高分子,可以提高生物墨水组合物的粘弹性和强度,从而提高输出的结构体的粘弹性和强度。
[0021]
另外,本发明的生物墨水组合物是凝胶形态,解决了现有的3d打印不能积层2~3mm以上、形态消失的现象。
附图说明
[0022]
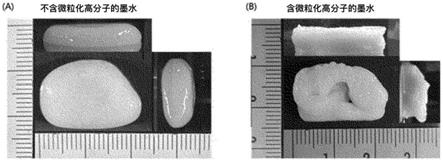
图1是使用(a)不包括微粒化高分子的生物墨水组合物和(b)包含微粒化高分子的生物墨水组合物,利用3d打印制作的耳朵结构体的图。将上述(a)和(b)的生物墨水组合物按照同一条件输出,其输出物在没有交联过程的情况下,示出其俯视图和侧视图。
[0023]
图2显示了(a)不含微粒化高分子的生物墨水组合物和(b)包含微粒化高分子的生物墨水组合物内部的扫描电子显微镜(sem)的照片。
[0024]
图3中,图3a表示,使用含有同种源(a)或异种源(b)软骨成分的生物墨水组合物制造的结构体中培养细胞,确认细胞存活的结果。具体而言,图3中死亡的细胞用箭头表示。图3b是通过cck 8试验(cck 8assay)对各条件下的细胞增殖利用吸光度进行分析的结果。
[0025]
图4是在含有异种源性软骨成分的生物墨水组合物所制作的结构体中培养细胞,确认细胞存活的结果。
[0026]
具体来说,图4a是为了确认软骨成分的效能,利用含有微粒化的软骨成分的生物墨水组合物和不包含微粒化的软骨成分的生物墨水组合物制作的结构体中,培养人皮肤源性纤维细胞(human dermal fibroblast,hdf),确认细胞存活的结果。死亡的细胞用箭头表示。图4b通过cck 8试验(cck 8assay)测定吸光度分析了不同时间段的细胞增殖。
[0027]
图5a是为了确认软骨成分的作用,在利用含有微粒化的软骨成分的生物墨水组合物和不含微粒化的软骨成分的生物墨水组合物制作的结构体中培养人源性软骨细胞(human chondrocyte),确认细胞存活的结果。图5b通过cck 8试验(cck 8assay)测定吸光度分析了不同时间段的细胞增殖。
[0028]
图6的(a)表示将耳朵结构体模型文件应用于3d打印,并用含有同种及异种源性软骨成分的生物墨水组合物输出的耳朵结构体。(b)示出了各种耳朵结构体模型文件和通过调节文件的耳朵结构体尺寸的文件以多种样式输出的耳朵结构体。根据耳朵结构体模型,可以调节文件大小,进行多种输出。
[0029]
图7是将制作的结构体直接插入动物的图。
具体实施方式
[0030]
本发明涉及一种3d打印用生物墨水组合物,其包含微粒化的软骨成分、微粒化高分子及生物相容性高分子。
[0031]
本发明实施例中,制备了包含微粒化的软骨成分、微粒化的高分子及生物相容性高分子的3d打印用生物墨水组合物,分析上述生物墨水组合物的细胞接合性,确认细胞亲和性。另外,通过上述生物墨水组合物制作耳朵结构体,确认到上述生物墨水组合物在3d生物打印中的适用可能性,将上述制作的结构体移植到动物中,确认到移植的结构体维持耳朵形态。
[0032]
以下,详细说明本发明的3d打印用生物墨水组合物。
[0033]
根据本发明的生物墨水组合物(或可称为生物墨水)包含微粒化的软骨成分、微粒化高分子以及生物相容性高分子。
[0034]
本发明中微粒化的软骨成分是指,软骨被粉碎成10到1000μm的大小。微粒化的软骨成分可以用于提高生物相容性、细胞附着性、生物墨水的物理特性。特别是,上述微粒化的软骨成分提供了与原来软骨组织相似的微环境的条件。其不是人为生成的物质,而是通
过人体内与细胞的相互作用而形成的结构,因此对软骨组织具有特有的构成成分和相位,可以提供有利于细胞生长和分化的环境。
[0035]
在一具体例子中,微粒化的软骨成分可能是同种或异种源性的微粒化的软骨成分。上述同种源性软骨是指人源性软骨;异种源软骨是指,人类以外的动物,即猪、牛、马等哺乳类源性的软骨。
[0036]
在一具体例子中,微粒化的软骨成分平均粒径为10到1000um、10到700um或10到500um。在上述粒径范围内,生物墨水可以通过微米级的3d打印喷嘴实现输入的形态,并赋予能够维持结构体结构的强度。另外,软骨组织的原结构得到保存,可以形成与原来软骨组织相似的微环境。
[0037]
在一具体例中,微粒化的软骨成分通过以下方法制备得到:
[0038]
(s1)冷冻干燥软骨成分的冷冻干燥步骤;
[0039]
(s2)粉碎经上述冷冻干燥步骤的软骨的粉碎步骤;以及
[0040]
(s3)通过将上述粉碎步骤的软骨进行筛分的筛分步骤。
[0041]
在本发明中,在执行冷冻干燥步骤前可进行清洗步骤,作为清洗溶剂可以使用灭菌蒸馏水。通过上述步骤可以去除软骨内的杂质。
[0042]
另外,在本发明中,在进行冷冻干燥步骤之前,可以在软骨中进行去除软组织和软骨膜的步骤。
[0043]
在一具体例子中,可以使用刀片(blade)和骨钳(rongeur)去除软骨组织和软骨膜。具体来说,可以通过如下方法去除软骨膜:用刀片将软骨和软骨的边界面垂直切断后,在灭菌蒸馏水浸湿组织表面使其不干燥的状态下,使用骨钳咬住切断面的棱角来去除软骨膜。
[0044]
本发明中,(s1)冷冻干燥步骤是冷冻干燥软骨的步骤。
[0045]
在一具体例子中,上述软骨可能是上述清洗的、软骨组织及软骨膜被去除的软骨。
[0046]
在一具体例中,冷冻干燥是在组织(软骨)冷冻的状态下,将其快速冷却后通过真空吸收水分的方法,可以进行上述冷冻干燥来调节软骨内水分。
[0047]
在一具体例子中,冷冻干燥可在-50至-80℃进行24至96小时。
[0048]
在本发明中,步骤(s2)粉碎步骤是粉碎上述冷冻干燥的软骨的步骤。
[0049]
在一具体例子中,粉碎可以用组织粉碎机进行。这时,粉碎时间可能是30秒到5小时。在一具体例子中,粉碎后软骨的粒径可能是10到1000μm。
[0050]
上述粉碎可以进行一次以上。
[0051]
在本发明中,步骤(s3)筛分步骤是经上述粉碎步骤粉碎的软骨实施筛分的步骤。
[0052]
在一具体例中,可使用刻度为100至1000μm之筛子来执行筛分。
[0053]
上述筛分可以至少进行一次。
[0054]
在本发明中,在执行筛分步骤后,可以进一步执行对未粉碎的微粒化的软骨成分进行(s4)脱脂肪化的脱脂肪化步骤;以及(s5)可以进一步执行脱细胞化的脱细胞化步骤。
[0055]
在本发明中,(s4)脱脂肪化步骤是从脂肪组织中去除脂质的步骤。
[0056]
在一具体例子中,脱脂肪化(delipidation)是指从组织中去除脂质成分。
[0057]
上述脂质成分的去除可以通过化学处理法执行。
[0058]
在一具体例子中,对于化学处理的类型没有特别限制,并且可以使用脱脂溶液来
实施。上述脱脂溶液包含极性溶剂、非极性溶剂或其混合物溶剂。上述极性溶剂可以使用水、醇或其混合溶液,上述醇可以使用甲醇、乙醇或异丙醇。非极性溶剂可使用己烷、庚烷、辛烷或其混合溶液。具体而言,在本发明中,作为脱脂溶液可以使用异丙醇和己烷的混合溶液。在这里,异丙醇与己烷的混合比可为40:60至60:40。
[0059]
上述脱脂溶液的处理时间可为1至30小时、1至20小时或10至20小时。
[0060]
在本发明中,(s5)脱细胞化步骤是从通过上述脱脂肪化步骤去除了脂质成分的、微粒化的软骨成分中去除细胞的步骤。
[0061]
在一具体例子中,脱细胞化(decellularization)是指从组织中去除细胞外基质以外的其他细胞成分,如细胞核、膜和核酸等。
[0062]
在一具体例子中,脱细胞化可以使用碱性溶液进行,上述碱性溶液可以使用氢氧化钠、氢氧化钾、氢氧化铵、钙碳酸盐、氢氧化镁、氢氧化钙和氨组成的一个以上。本发明中,碱性溶液可使用氢氧化钠(naoh)。
[0063]
在一具体例子中,碱性溶液的浓度可为0.01至1n、0.06至0.45n、0.06至0.2n或0.08至1.02n。在上述浓度范围内容易去除细胞。
[0064]
此外,在一具体例子中,脱细胞化步骤可执行40至60分钟、70至200分钟或90至150分钟。在上述时间范围内很容易去除细胞。
[0065]
本发明进一步包括选自以下步骤中的一种以上步骤:
[0066]
经过脱细胞化步骤后,根据需要中和酸性溶液的中和步骤;
[0067]
清洗上述已中和的微粒化的软骨成分的清洗步骤;
[0068]
离心分离上述已清洗的微细颗粒化软骨成分;以及
[0069]
冷冻干燥步骤。
[0070]
在一具体例子中,通过离心分离步骤,可以去除脱脂肪化步骤及脱细胞化步骤的杂质,还可以获得高纯度微粒化的软骨成分(沉淀物)。
[0071]
另外,清洗步骤时,清洗溶液可使用灭菌蒸馏水及/或70%乙醇。
[0072]
在一具体例子中,相对于生物墨水组合物的总重量(100重量份),微粒化的软骨组分的含量在1重量份到20重量份之间。此外,上述微粒化的软骨组分占生物墨水组合物的1-10%(w/v)。
[0073]
在本发明中,微粒化的高分子可以调节生物墨水组合物的粘度,3d打印时可实现更精密结构的结构体。
[0074]
在一具体例子中,微粒化的高分子使用可微粒化的高分子进行粒子化,这种高分子选自聚己内酯(polycaprolactone,pcl)、聚乳酸-羟基乙酸共聚物(poly-d,l-lactic-co-glycolic acid,plga)和聚乙二醇(polyethylene glocol,peg)组成的组中选择的一个以上。在本发明中,高分子使用聚己内酯(pcl),上述聚己内酯几乎没有毒性,可由体内酵素进行水解,具有生物相容性高、机械强度高的优点。
[0075]
在一具体例子中,微粒化的高分子平均粒径为1nm到200um。在上述粒径范围内,生物墨水可以通过微米级的3d打印喷嘴实现输入的形态,并赋予能够维持结构体的结构的强度。
[0076]
在一具体例子中,微粒化的高分子通过以下方法制备:
[0077]
步骤(a),将高分子溶解于有机溶剂中以制备高分子溶液;和
[0078]
步骤(b),将上述高分子溶液与表面活性剂和生物相容性高分子溶液的混合溶液混合后,通过超声波处理。
[0079]
在步骤(a)中,可以通过在有机溶剂中增溶(solubilizing)高分子来制备高分子溶液。
[0080]
上述高分子可以使用以上所述的任意高分子,没有特别的限定,作为有机溶剂可以使用氯仿、氯甲烷或丙酮。
[0081]
步骤(b)是将高分子溶液与表面活性剂和生物相容性高分子的混合溶液混合后进行超声处理的步骤,通过超声处理可以将混合有上述两个溶液的混合液进行微粒化,制备球形的微粒化的高分子。
[0082]
在上述混合溶液中,表面活性剂降低了溶液的表面张力,从而可以制备微细颗粒,也可以形成稳定的颗粒。
[0083]
作为上述表面活性剂,可以使用如甲基纤维素(mc)、聚乙烯醇(pva)、聚氧乙烯山梨醇酐(polyoxyethylene sorbitans)和普朗尼克(pluronicstm)等聚山梨醇酯。具体而言,可以使用选自聚氧乙烯山梨醇酐单油酸酯(polyoxyethylene sorbitan monooleate)、聚氧乙烯山梨醇酐三油酸酯(polyoxyethylene sorbitan trioleate)、聚氧乙烯山梨醇酐单硬脂酸酯(polyoxyethylene sorbitan monostearate)、聚氧乙烯山梨醇酐单硬脂酸酯(polyoxyethylene sorbitan tristearate)、聚氧乙烯山梨醇酐单棕榈酸酯(polyoxyethylene sorbitan monopalmitate),或者包含聚氧乙烯脱水山梨糖醇单油酸酯(polyoxyethylene sorbitan monooleate)的聚氧乙烯失水山梨醇单月桂酸酯(polyoxyethylene sorbitan monolaurate)(ween 80(tm))及聚氧乙烯山梨醇酐单硬脂酸酯(polyoxyethylene sorbitan monostearate)(t ween 60(tm))组成的群中选择的一种以上。
[0084]
另外,生物相容性高分子可以给微粒化高分子赋予亲水性,提高与生物墨水内组合物的混合率,并赋予细胞相容性。上述生物相容性高分子的种类不受特别限制,例如,可以选自由琼脂糖(argarose)、海藻酸盐(alginate)、壳聚糖(chitosan)、胶原蛋白(collagen)、无细胞化细胞外基质(decellularized extracellular matrix)、纤维蛋白/纤维蛋白原(fibrin/fibrinogen)、明胶(gelatin)、石墨烯(graphene)、透明质酸(hyaluronic acid)、羟基磷灰石(hydroxyapatite)、聚己内酯(polycaprolactone,pcl)、聚乳酸(poly lactic acid,pla)、聚乳酸-羟基乙酸共聚物((poly-d,l-lactic-co-glycolic acid,plga)和普朗尼克(pluronic f 127)组成的组中选择的一个以上。
[0085]
在一具体例子中,将上述高分子溶液与上述混合溶液混合后,通过超声处理制备球形高分子粒子。此时,球形可以用来表示除了完整的球形外,实质上为球形的情况,也包括截面具有椭圆形的情况。此外,可以根据所属技术领域的技术人员的已知条件来执行超声波条件。
[0086]
上述球形高分子可由提取蒸发法(extraction evaration)形成。
[0087]
在一具体例子中,微粒化的高分子的含量为总生物墨水组合物的1至50%(w/v)。在上述范围内,制造得到的支撑体材料可以满足目标物性。
[0088]
在本发明中,生物相容性高分子使所制造的结构体具有生物相容性。
[0089]
在一具体例子中,对于生物相容性高分子的种类没有特别的限制,例如,可以选自
由琼脂糖(argarose)、海藻酸盐(alginate)、壳聚糖(chitosan)、胶原蛋白(collagen)、无细胞化细胞外基质(decellularized extracellular matrix)、纤维蛋白/纤维蛋白原(fibrin/fibrinogen)、明胶(gelatin)、石墨烯(graphene)、透明质酸(hyaluronic acid)、羟基磷灰石(hydroxyapatite)、聚己内酯(polycaprolactone,pcl)、聚乳酸(poly lactic acid,pla)、聚乳酸-羟基乙酸共聚物(poly-d,l-lactic-co-glycolic acid,plga)和普朗尼克(pluronic f 127)组成的组中选择的一个以上。
[0090]
在一具体例子中,上述生物相容性高分子可以使用海藻酸盐。上述海藻酸盐可包括钙、镭、钾、铵或镁海藻酸盐。上述海藻酸盐生物分解性优异,提高生物墨水的物理特性,具有容易交联的特征。具体来说,海藻酸盐通过二价阳离子(divalent cation))的螯合(chelation)作用交联而凝胶化,从而满足生物墨水的打印适性(printability)和打印后机械物性。
[0091]
在一具体例子中,相对于生物墨水组合物的总重量(100重量份),生物相容性高分子的含量可为0.5重量份至10重量份。上述生物相容性高分子可存在于1-12%(w/v)的生物墨水组合物中。在上述重量份范围内,制造得到的支撑体材料可以满足目标物性。
[0092]
另外,本发明的生物墨水组合物还可以含有水。
[0093]
在一具体例子中,本发明用于生物墨水组合物3d打印,适用于以治疗小耳症为目的的耳朵结构体的制作。
[0094]
另外,本发明还提供上述生物墨水组合物的制造方法。
[0095]
本发明的生物墨水组合物可通过混合上述组分,即,微粒化的软骨组分微粒化的高分子;生物相容性高分子制备得到,。细颗粒软骨成分是纳米级或微米级颗粒的形态,因此,当与生物源性高分子水合时,可以均匀进行物理混合,而无需单独的混合过程。此外,在本发明中,生物墨水的机械强度可根据微粒化的软骨成分和细粒高分子含量来调节。
[0096]
另外,本发明是提供一种结构体的制造方法,该方法包括挤出3d打印用生物墨水组合物制造结构体的步骤,所述组合物包含微粒化的软骨成分、微粒化高分子及生物相容性高分子。
[0097]
在本发明中,通过含有微粒化的软骨成分、微粒化高分子及生物相容性高分子的3d打印用生物墨水组合物,可以制作治疗小耳症的耳朵构造体。
[0098]
在一具体例子中,本发明的生物墨水组合物可应用于三维生物打印。
[0099]
上述3d生物打印是指,将目标结构物以三维进行扫描并获得图像之后,通过生物墨水将扫描的图像制作成三维结构形态的工艺。在本发明中,其可应用于基于挤出的工艺。
[0100]
在本发明中,将3d打印用生物墨水组合物的挤出物可表示为结构体、输出物或者支撑体(scaffold)。根据本发明的生物墨水组合物,对细胞的生长及分化起到支撑体作用,具有生物亲和性和生物相容性。因此,可便于移植到体内,并且在体外培养或者体内移植环境下可调整细胞的生长和分化。
[0101]
在本发明中,利用3d打印机挤出生物墨水组合物可制造结构体。具体地,可根据由3d计算机预设计的程序打印三维图数据并制造结构体。
[0102]
根据本发明所要制造的目的,可适当地调整挤出力以及挤出速度制造结构体。
[0103]
在本发明中,还可包括对挤出的结构体进行的交联步骤。
[0104]
所述交联可通过本领域通常使用的工艺来执行。
[0105]
在一具体示例中,作为生物相容性高分子使用海藻酸盐时,所述海藻酸盐通过二价阳离子(divalent cation)的螯合作用(chelation)被交联而凝胶化,因此,利用此特性可执行交联。
[0106]
通过本发明提供用于3d生物打印的生物墨水组合物,从而通过生物打印完成的结构体,即,耳朵结构体可用于治疗小耳症。具体地,由生物墨水制造的结构体具有生物亲和性,在支撑体内含有细胞并附着在表面,可诱导组织再生,因此,对于生物组织再生、组织工学、再生医学很有用。
[0107]
最佳实施方式
[0108]
以下,通过实施例更具体地说明本发明。但是,本发明的范围不限定于以下实施例,本领域的技术人员应该理解在不超过权利要求记载事项所导出的技术思想的范围内,可进行多种变形、修改或者应用。
[0109]
实施例
[0110]
实施例1.用于制造3d打印耳朵结构体的生物墨水组合物的制备及耳朵结构体的制造
[0111]
(1)同种源性微粒化的软骨成分的制备
[0112]
软骨组织(从组织库捐赠的尸体中收集,且用于非盈利目的的患者治疗)用微型粉碎机粉碎。在上述粉碎过程中,通过100-1000um口径的筛子获得1000um以下的软骨组织粉末。
[0113]
上述得到的软骨组织粉末进行无细胞化(脱细胞化)。
[0114]
首先,利用酒精和己烷对软骨组织进行脱脂过程。之后,利用氢氧化钠去除细胞,利用酒精和蒸馏水进行清洗。进行冷冻干燥,去除水分。
[0115]
(2)制造微粒化高分子
[0116]
进行了高分子的微粒化过程。
[0117]
首先,将聚己内酯(pcl)溶解在氯仿中,制备出高分子溶液。之后,在表面活性剂和生物相容性高分子的混合溶液中缓慢滴入上述高分子溶液,利用超声波进行分散。
[0118]
具体来说,将高分子溶解在有机溶剂中,制备出1到50%(10mg/ml到500mg/ml(w/v)的高分子溶液。然后,将10mg/ml到500mg/ml的表面活性剂溶液和10mg/ml到500mg/ml的生物相容性高分子溶液混合,制备混合溶液。这时,表面活性剂溶液和生物相容性高分子溶液以1:1体积比进行混合。
[0119]
在上述混合溶液中缓慢滴入高分子溶液,通过超声波处理分散的溶液中挥发有机溶剂,用蒸馏水清洗后进行冷冻干燥,得到微粒化高分子。
[0120]
这时,获得的微粒化的高分子的平均粒径为1nm到200um。
[0121]
(3)制造生物墨水组合物
[0122]
通过将(1)中制备的微粒化的软骨组分与(2)中制备的微粒化的高分子和海藻酸盐水溶液混合,制备水凝胶型生物墨水组合物。
[0123]
准备海藻酸盐1-2%(w/v)水溶液。由0.22μm注射器式过滤器过滤之后使用藻酸盐水溶液。
[0124]
制备了1-50%(w/v)的微粒化的高分子水溶液。
[0125]
在海藻酸盐水溶液和微粒化的高分子水溶液中水合1-10%(w/v)的微粒化的软骨
成分。将两个注射器连接到鲁尔适配器上并水合以制备组合物。
[0126]
(4)用3d打印机制作用于治疗小耳症的耳结构体
[0127]
准备好要打印的耳朵软骨模型的stl文件并输入到3d打印机中。通过设置适当的墨水输出条件来进行3d打印。
[0128]
具体来说,按照以下条件进行打印,喷嘴18-22g,温度4-40℃,压力10-200kpa,打印速度1-5mm/s,打印高度0.2-1.0mm。根据stl文件进行输出后,以便完全硬化,将其沉浸于离子溶液(1%氯化钙溶液)中进行交联。
[0129]
实施例2.基于3d打印的耳朵结构体制作用生物墨水组合物的制备及耳朵结构体的制造
[0130]
在制造生物墨水组合物时,除了使用马源性软骨(农业组合提供)代替同种源性的软骨外,用实施例1的方法制作了生物墨水组合物和耳朵结构体。
[0131]
比较例1
[0132]
在制备生物墨水组合物时,除了不使用实施例1的(2)中制造的微粒化高分子外,采用实施例1的方法制造生物墨水组合物及耳朵结构体。
[0133]
比较例2
[0134]
在制备生物墨水组合物的时,除了没有使用在实施例1的(1)中制造的微粒化的软骨成分及实施例1的(2)中制造的微粒化的高分子外,还采用实施例1的方法制造了生物墨水组合物和耳朵结构体。
[0135]
在本发明中,图1示出,将(a)比较例1的不包括微粒化高分子的生物墨水组合物和(b)实施例1制备的包含微粒化高分子的生物墨水组合物,设置在3d打印机上,按照相同条件输出的耳朵结构体。使用不包含微粒化的高分子的比较例1的墨水组合物的情况下,可以看出挤出的生物墨水组合物不能实现耳朵结构体。相反,可以看到基于本发明的含有微粒化的高分子的墨水组合物的情况下,实现了精细的耳朵形状。
[0136]
另外,图2示出,利用扫描电子显微镜确认(a)比较例1的不包括微粒化高分子的生物墨水组合物和(b)实施例1制备的包含微粒化高分子的生物墨水组合物的内部的样子。如图2所示,可以确认含有微粒化的高分子而言,生物墨水组合物内含有球形微粒。实验例1.生物墨水组合物的细胞相容性分析
[0137]
在插入有实施例及比较例中制作的结构体时,为了确认插入环境中与周边细胞的适配性,在上述实施例及比较例中制造的生物墨水组合物中培养了人源性软骨细胞,确认了细胞相容性。
[0138]
实验例1-1.3.1基于同种及异种源性微粒化软骨成分的生物墨水组合物的细胞相容性分析(1)方法
[0139]
将含有同种及异种源性微粒化的软骨成分的生物墨水组合物,即,实施例1及实施例2中制造的生物墨水组合物安装在3d打印机上,制作结构体后,将1~3
×
105的脂肪源性干细胞喷射到结构体上培养。为了确认结构体表面的细胞附着及存活,培养7天后进行了活/死细胞活力测定(live/dead cell viability assay(life technology,usa))。具体地说,溶解有0.5μl/ml钙黄绿素-am(calcein-am)和2ul/ml乙锭同二聚体-1(ethidium homodimer-1)的培养液沉入结构体中,反应30分钟后,通过共聚焦显微镜确认。
[0140]
另外,在培养1天、4天后,利用cck-8试剂盒(cck-8kit)测量吸光度,确认细胞增殖
程度。(2)结果
[0141]
分析结果示于图3中。
[0142]
图3a中表示了对(a)实施例1中制造的基于同种源性微粒化的软骨成分的生物墨水组合物、(b)实施例2中制造的基于异种源性微粒化的软骨成分的生物墨水组合物进行分析的结果。在上述附图中用箭头表示死亡的细胞。
[0143]
如上图3所示,确认到基于含有同种及异种源性微粒化的软骨成分的生物墨水组合物中,细胞均附着在结构体的表面并增殖。
[0144]
此外,图3b为分析细胞增殖率的结果,确认到通过使用生物墨水组合物打印的结构体上附着有细胞,并且细胞可以存活并繁殖。
[0145]
实验例1-2.基于微粒化的软骨成分的生物墨水组合物的耳朵软骨组织相关细胞相容性分析
[0146]
(1)方法
[0147]
为了确认按照实施例2制备的基于含有细粒软骨的生物墨水组合物制成的结构体与软骨组织相关细胞的适配性,在上述结构体中培养人皮肤源性成纤维细胞和软骨细胞。
[0148]
具体而言,将含有1
–3×
105的人源性成纤维细胞的细胞混浊液喷射到实施例2和比较例2中制造的结构体上进行培养。为了明确细胞在结构体表面的附着和增殖,将其在细胞培养基中培养1天、7天和14天。
[0149]
细胞相容性分析如下。1天、7天、14天或28天后,用共聚焦显微镜(lsm 700,卡尔蔡司,德国)进行活/死细胞活力测定(live/dead cell viability assay(life technology,usa)),以确定细胞附着和存活与否。
[0150]
此外,在结构体的表面培养细胞,并在1天、7天和14天后使用cck-8试剂盒测量吸光度以确认细胞增殖的程度。
[0151]
(2)结果
[0152]
分析结果示于图4和5中。
[0153]
图4a示出随着培养时间,在含有微粒化的软骨成分的生物墨水组合物(实施例2)和不含微粒化的软骨成分的生物墨水组合物(比较例2)上的、人源性成纤维细胞的附着和增殖结果。上述图中的死细胞用箭头表示。
[0154]
如上述图4a所示,从培养初期开始,多数细胞可以附着在使用含有微粒化的软骨成分的生物墨水输出的结构体上生存并增殖。
[0155]
而且,图4b是由含有微粒化的软骨成分的生物墨水组合物制作的结构体(实施例2)和不包含微粒化的软骨成分的生物墨水组合物制作的结构体(比较例2)中培养人皮肤源性纤维细胞,确认细胞增殖率的结果。
[0156]
正如上述图4b所示,从细胞培养初期到2周的期间,含有微粒化的软骨成分的生物墨水组合物与不含微粒化的软骨成分的生物墨水组合物相比,细胞增殖更加优异。
[0157]
另一方面,图5a示出了在含有微粒化的软骨成分的生物墨水组合物(实施例2)和不包含微粒化的软骨成分的生物墨水组合物(比较例2)中培养人源性软骨细胞,并确认细胞附着和生存的结果。
[0158]
如上图5a所示,两组中的细胞增殖率随时间增加,但可以看出,与不含微粒化的软骨成分的生物墨水组合物相比,含有微粒化的软骨成分的生物墨水组合物中有大量细胞附
着、存活和繁殖。
[0159]
此外,图5b表示相对于含有微粒化的软骨成分的生物墨水组合物(实施例2)和不含微粒化的软骨成分的生物墨水组合物(比较例2)的,人源性软骨细胞的增殖率。
[0160]
如上图5b所示,可以看出从培养开始含有微粒化的软骨成分的生物墨水组合物比不含细粒软骨成分的生物墨水组合物,细胞增殖率高出两倍以上。
[0161]
通过上述图4和图5,可以确认到含有微粒化的软骨成分的生物墨水组合物在与耳朵软骨相关的细胞中具有良好的细胞相容性和细胞亲和性。实验例2.通过利用生物墨水组合物的3d打印机制造耳朵结构体
[0162]
按照实施例1及实施例2所示的耳朵结构体的制造方法制作了耳朵结构体。
[0163]
在本发明中,图6示出制造的耳朵的结构体。
[0164]
如图6(a)所示,根据相同的stl文件,由含有同种源(左图)和异种源(右图)微粒化的软骨成分的生物墨水组合物打印并制造的结构体是相同的。
[0165]
另外,图6(b)表示了将含有异种源微粒化的软骨成分的生物墨水组合物根据不同的stl文件输出制作的结构体。
[0166]
如上述图6(b)所示,确认了可以通过基于微粒化的软骨成分的生物墨水组合物制作多种stl文件的结构体,即便为相同的文件也可以调节大小相同的条件,可以制作结构体。
[0167]
实验例3.将制造的结构体移植到动物体内
[0168]
使用实施例1中制造的生物墨水组合物,通过3d打印制造耳朵结构体,对其进行灭菌后,将其直接移植到动物皮肤下。
[0169]
图7中(a)是将实际耳朵大小的70%的结构体插入裸鼠背部的样子,(b)是实际耳朵大小的50%的结构体插入裸鼠背部的样子。
[0170]
从上述图7可以看出,插入动物体内的结构体保留了耳朵的形状。
[0171]
工业利用性
[0172]
根据本发明,生物墨水组合物含有微粒化的软骨成分,可以诱导软骨组织安全而有效地再生,容易用于治疗小耳症目的的结构体制造。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。