用
α-2b肾上腺素能受体激动剂活化调节t细胞的方法
1.发明人:daniel w.gil、john e.donello、
2.veena viswanath和lauren m.b.luhrs
3.本技术是申请日为2011年8月11日、申请号为“201180049427.5(201810086420.4)”且发明名称为“用α-2b肾上腺素能受体激动剂活化调节t细胞的方法”的发明专利申请的分案申请。
4.相关申请的交叉引用
5.本技术要求2010年8月16日提交的美国临时专利申请序列no.61/374,124的权益,该临时申请以引用的方式整体并入本文。
6.发明背景
7.本文所公开的是以下发现:t细胞亚型上存在α-2b肾上腺素能受体,并且α-2受体激动剂可用于调节此类t细胞的活性,从而治疗其中t细胞功能障碍起作用的疾病,包括神经炎、格林-巴利综合征(guillan-barre syndrome)、类风湿性关节炎、i型糖尿病、多发性硬化症(ms)、移植物抗宿主病(gvhd)、自身免疫性葡萄膜炎、眼部炎症、干性角膜结膜炎(干眼综合征)、斯耶格伦综合征(sjogren’s syndrome)、特应性皮炎、银屑病、炎性肠病、肠易激综合征、哮喘和再生障碍性贫血。
8.发明概述
9.本发明提供了上调患者的调节t细胞功能的方法,所述方法包括向需要此类上调的患者施用α-2b受体激动剂。
10.在另一个实施方案中,本发明提供了上调患者的调节t细胞功能的方法,所述方法包括向需要此类上调的患者施用缺乏显著α-2a受体激动剂活性的α-2受体激动剂。
11.在另一个实施方案中,前两个段落中提及的调节t细胞为cd25 、foxp3 t细胞。
12.在另一个实施方案中,本发明提供了通过向需要此类治疗的患者施用α-2b受体激动剂来治疗疾病的方法,所述疾病选自神经炎、格林-巴利综合征、类风湿性关节炎、i型糖尿病、多发性硬化症、移植物抗宿主病、自身免疫性葡萄膜炎、眼部炎症、干眼病、特应性皮炎、银屑病、炎性肠病、哮喘和再生障碍性贫血。
13.在另一个实施方案中,本发明提供了本发明提供了通过向需要此类治疗的患者施用缺乏显著α-2a受体激动剂活性的α-2受体激动剂来治疗疾病的方法,所述疾病选自神经炎、格林-巴利综合征、类风湿性关节炎、i型糖尿病、多发性硬化症、移植物抗宿主病、自身免疫性葡萄膜炎、眼部炎症、干眼病、特应性皮炎、银屑病、炎性肠病、哮喘和再生障碍性贫血。
14.在另一个实施方案中,将本发明的α-2受体拮抗剂进行初期施用,然后在停药期结束后再进行二期施用。
15.在另一个实施方案中,将本发明的α-2受体拮抗剂进行初期施用,然后在停药期结束后再进行二期施用,其中初期、二期和停药期为一天、两天、三天、四天、五天、六天、七天、八天、九天、十天、十一天、十二天、十三天或十四天,或一周、两周、三周或四周。
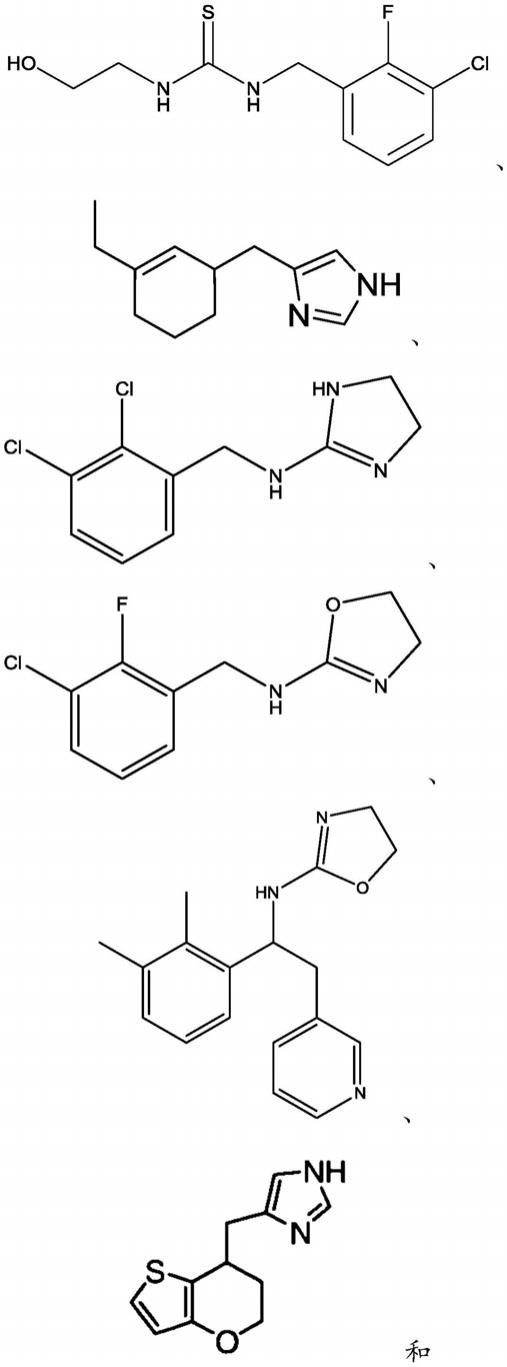
16.在另一个实施方案中,本发明的α-2受体拮抗剂选自:
17.[0018][0019]
或其药学上可接受的盐。
[0020]
在另一个实施方案中,α-2激动剂选自硫脲、咪唑、咪唑啉、噁唑和噁唑啉;或其药学上可接受的盐。
[0021]
在另一个实施方案中,α-2激动剂选自硫脲、咪唑、咪唑啉和噁唑啉;或其药学上可接受的盐。
[0022]
在另一个实施方案中,α-2激动剂硫脲为下式的化合物
[0023][0024]
或其药学上可接受的盐。
[0025]
在另一个实施方案中,α-2-激动剂咪唑啉为下式的化合物
[0026][0027]
或其药学上可接受的盐。
[0028]
在另一个实施方案中,α-2-激动剂咪唑为选自以下的化合物:
[0029][0030]
或其药学上可接受的盐。
[0031]
在另一个实施方案中,α-2-激动剂噁唑啉为下式的化合物
[0032][0033]
或其药学上可接受的盐。
[0034]
在另一个实施方案中,本发明的α-2-激动剂为式i的化合物
[0035][0036]
或其药学上可接受的盐,其中:
[0037]
r和r1独立地为卤素或烷基;
[0038]
r2为h或烷基,其未经取代或被杂芳基或芳基取代;且
[0039]
het为选自咪唑啉基和噁唑啉基的杂环基。
[0040]
在另一个实施方案中,在式i中:
[0041]
r和r1独立地为卤素或甲基;且
[0042]
r2烷基为甲基,其被杂芳基取代,所述杂芳基为吡啶基。
[0043]
附图简述
[0044]
图1经由qpcr示出人t细胞亚群中的α
2b-受体而非α
2a-受体的表达。
[0045]
图2示出化合物b在异常神经性疼痛(allodynic neuropathic pain)的snl大鼠模型中导致为cd4 /cd25 treg细胞的脾cd4 t细胞的频率的持续增加。
[0046]
图3示出α
2b-受体激动剂化合物b对已确认的ms疼痛具有止痛作用并且示出对treg细胞的调节。
[0047]
图4示出化合物b在蛋白脂质诱导的复发缓解型eae模型中对临床病程具有显著作用。
[0048]
图5示出化合物b在plp诱导的复发缓解型eae模型中显著减少了cns中免疫细胞的存在。
[0049]
图6示出化合物c在蛋白脂质诱导的复发缓解型eae模型中对临床病程具有显著作用。
[0050]
图7示出化合物c在plp诱导的复发缓解型eae模型中显著增加了脊髓中调节t细胞的频率。
[0051]
图8示出化合物b对临床疾病和eaau大鼠房水中的炎性细胞数量具有显著作用。
[0052]
图9示出化合物b对eiu大鼠房水中蛋白质浓度具有显著作用。
modified eagle's medium)中保存。一天后,将细胞通过磷酸钙沉淀以编码p-sv-β-半乳糖苷酶(5-10μg)、受体(1-2μg)和g蛋白(1-2μg)的哺乳动物表达质粒进行共转染。还可纳入载体dna例如40μg鲑精dna以提高转染效率。第二天加入新鲜培养基;一至两天后,将细胞收获并冰冻于50测定等分试样中。例如在96孔板中,解冻转染细胞,并将100μl细胞添加到100μl待测化合物的等分试样中,其中各种测定浓度一式三份。孵育在37℃下持续72至96小时。用磷酸盐缓冲盐水洗涤之后,通过添加200μl显色底物(磷酸盐缓冲盐水中3.5mm o-硝基苯基-β-d-吡喃半乳糖苷/0.5%np-40),在30℃下孵育过夜并在420nm下测量光密度,以此测定β-半乳糖苷酶活性。吸光度是酶活性的量度,其取决于细胞数量并反映受体介导的细胞增殖。测定每种药物在每种受体上的ec
50
最大效应(即,功效)。
[0064]
α-2b和-2c受体激动剂(包括缺乏显著α-2a受体活性的那些)是本领域中已知的。关于α-2激动剂(包括其结构、合成和活性)的详细信息,可参见美国专利no.6,329,369、no.6,534,542、no.6,545,182、no.6,787,517、no.6,841,684和no.7,091,232;美国专利申请公开no.2003/0092766、no.2004/0132824、no.2004/0220402、no.2005/0075366和no.2005/0267186;和美国专利申请no.11/172,229、no.11/232,323、no.11/232,341、no.60/613,870、no.60/695,650、no.60/747,444、no.60/884,718、no.60/917,828、no.60/911,422、no.60/911,478和no.60/948,389,所有专利申请的公开内容以引用方式并入本文。
[0065]
在本发明的方法中可使用任何α-2受体激动剂的任何药学上可接受的盐、前药、异构体或外消旋物。
[0066]“烷基”意指可为直链或支链的并且在链中包含约1至约20个碳原子的脂族烃基团。优选的烷基在链中包含约1至约12个碳原子。更优选的烷基在链中包含约1至约6个碳原子。支链的意指一个或多个低级烷基(例如甲基、乙基或丙基)连接至直链烷基链。“低级烷基”意指在链中具有约1至约6个碳原子的基团,其可为直链或支链的。“烷基”可为未取代的或任选地被一个或多个可相同或不同的取代基取代,每个取代基独立地选自卤代、烷基、芳基、杂环基、杂芳基、环烷基、氰基、羟基、烷氧基、烷硫基、氨基、肟(例如,=n-oh)、-nh(烷基)、-nh(环烷基)、-n(alkyl)2、-o-c(o)-烷基、-o-c(o)-芳基、-o-c(o)-环烷基、-sf5、羧基和-c(o)o-烷基。合适的烷基的非限制性实例包括甲基、乙基、正丙基、异丙基和叔丁基。
[0067]“烯基”意指包含至少一个碳-碳双键并且可为直链或支链的并且在链中包含约2至约15个碳原子的脂族烃基团。优选的烯基在链中具有约2至约12个碳原子;更优选约2至约6个碳原子。支链的意指一个或多个低级烷基(例如甲基、乙基或丙基)连接至直链烯基链。“低级烯基”意指在链中具有约2至约6个碳原子的基团,其可为直链或支链的。“烯基”可为未取代的或任选地被一个或多个可相同或不同的取代基取代,每个取代基独立地选自卤代、烷基、芳基、环烷基、氰基、烷氧基和
–
s(烷基)。合适的烯基的非限制性实例包括乙烯基、丙烯基、正丁烯基、3-甲基丁-2-烯基、正戊烯基、辛烯基和癸烯基。
[0068]“亚烷基”意指通过从上文所定义的烷基中移除氢原子获得的双官能团。亚烷基的非限制性实例包括亚甲基、亚乙基和亚丙基。
[0069]
"炔基"意指包含至少一个碳-碳三键并且可为直链或支链的并且在链中包含约2至约15个碳原子的脂族烃基团。优选的炔基在链中具有约2至约12个碳原子;更优选约2至约4个碳原子。支链的意指一个或多个低级烷基(例如甲基、乙基或丙基)连接至直链炔基
链。“低级炔基”意指在链中具有约2至约6个碳原子的基团,其可为直链或支链的。合适的炔基的非限制性实例包括乙炔基、丙炔基、2-丁炔基和3-甲基丁炔基。“炔基”可为未取代的或任选地被一个或多个可相同或不同的取代基取代,每个取代基独立地选自烷基、芳基和环烷基。
[0070]“芳基”意指包含约6至约14个碳原子,优选约6至约10个碳原子的芳族单环或多环环系。芳基可任选地被一个或多个可相同或不同并且如本文所定义的“环系取代基”取代。合适的芳基的非限制性实例包括苯基和萘基。
[0071]“杂芳基”意指包含约5至约14个环原子,优选约5至约10个环原子的芳族单环或多环环系,其中一个或多个环原子为非碳元素,例如单独或组合的氮、氧或硫。优选的杂芳基包含约5至约6个环原子。“杂芳基”可任选地被一个或多个可相同或不同并且如本文所定义的“环系取代基”取代。杂芳基根名之前的前缀氮杂、氧杂或硫杂分别意指存在至少一个氮、氧或硫原子作为环原子。杂芳基的氮原子可任选地被氧化成相应的n-氧化物。“杂芳基”还可包括与如上文所定义的芳基稠合的如上文所定义的杂芳基。合适的杂芳基的非限制性实例包括吡啶基、吡嗪基、呋喃基、噻吩基、嘧啶基、吡啶酮(包括n-取代的吡啶酮)、异噁唑基、异噻唑基、噁唑基、噻唑基、吡唑基、呋咱基、吡咯基、吡唑基、三唑基、1,2,4-噻二唑基、吡嗪基、哒嗪基、喹噁啉基、酞嗪基、羟吲哚基、咪唑并[1,2-a]吡啶基、咪唑并[2,1-b]噻唑基、苯并呋咱基、吲哚基、氮杂吲哚基、苯并咪唑基、苯并噻吩基、喹啉基、咪唑基、噻吩并吡啶基、喹唑啉基、噻吩并嘧啶基、吡咯并吡啶基、咪唑并吡啶基、异喹啉基、苯并氮杂吲哚基、1,2,4-三嗪基、苯并噻唑基等。术语“杂芳基”还指部分饱和的杂芳基部分,例如四氢异喹啉基、四氢喹啉基等。
[0072]“芳烷基”或“芳基烷基”意指其中芳基和烷基如先前所述的芳基-烷基-基团。优选的芳烷基包含低级烷基。合适的芳烷基的非限制性实例包括苄基、2-苯乙基和萘基甲基。经由烷基与母体部分键合。
[0073]“烷基芳基”意指烷基和芳基如先前所述的烷基-芳基-基团。优选的烷基芳基包含低级烷基。合适的烷基芳基的非限制性实例为甲苯基。经由芳基与母体部分键合。
[0074]“环烷基”意指包含约3至约10个碳原子,优选约5至约10个碳原子的非芳族单环或多环环系。优选的环烷基环包含约5至约7个环原子。环烷基可任选地被一个或多个可相同或不同且如上文所定义的“环系取代基”取代。合适的单环环烷基的非限制性实例包括环丙基、环戊基、环己基、环庚基等。合适的多环环烷基的非限制性实例包括1-十氢萘基、降冰片基、金刚烷基等。
[0075]“环烷基烷基”意指经由烷基部分(如上文所定义)与母核连接的如上文所定义的环烷基部分。合适的环烷基烷基的非限制性实例包括环己基甲基、金刚烷基甲基等。
[0076]“环烯基”意指包含约3至约10个碳原子,优选约5至约10个碳原子的非芳族单环或多环环系,该环系包含至少一个碳-碳双键。优选的环烯基环包含约5至约7个环原子。环烯基可任选地被一个或多个可相同或不同且如上文所定义的“环系取代基”取代。合适的单环环烯基的非限制性实例包括环戊烯基、环己烯基、环庚-1,3-二烯基等。合适的多环环烯基的非限制性实例为降冰片烯基。
[0077]“环烯基烷基”意指经由烷基部分(如上文所定义)与母核连接的如上文所定义的环烯基部分。合适的环烯基烷基的非限制性实例包括环戊烯基甲基、环己烯基甲基等。
[0078]“卤素”意指氟、氯、溴或碘。优选的为氟、氯和溴。
[0079]“环系取代基”意指与芳族或非芳族环系连接的取代基,该取代基(例如)取代环系上的有效氢。环系取代基可相同或不同,各自独立地选自:烷基、烯基、炔基、芳基、杂芳基、芳烷基、烷基芳基、杂芳烷基、杂芳基烯基、杂芳基炔基、烷基杂芳基、羟基、羟基烷基、烷氧基、芳氧基、芳烷氧基、酰基、芳酰基、卤代、硝基、氰基、羧基、烷氧羰基、芳氧羰基、芳烷氧羰基、烷基磺酰基、芳基磺酰基、杂芳基磺酰基、烷硫基、芳硫基、杂芳硫基、芳烷硫基、杂芳烷硫基、环烷基、杂环基、-sf5、-osf5(对于芳基而言)、-o-c(o)-烷基、-o-c(o)-芳基、-o-c(o)-环烷基、-c(=n-cn)-nh2、-c(=nh)-nh2、-c(=nh)-nh(烷基)、肟(例如=n-oh)、-ny1y2、-烷基-ny1y2、-c(o)ny1y2、-so2ny1y2和-so2ny1y2,其中y1和y2可相同或不同且独立地选自氢、烷基、芳基、环烷基和芳烷基。“环系取代基”也可意指同时取代环系上两个相邻碳原子上的两个有效氢(每个碳上一个h)的单个部分。该部分的实例为亚甲二氧基、亚乙二氧基、-c(ch3)
2-等,其形成诸如以下的部分:
[0080][0081]“杂芳基烷基”意指经由烷基部分(如上文所定义)与母核连接的如上文所定义的杂芳基部分。合适的杂芳基的非限制性实例包括2-吡啶基甲基、喹啉基甲基等。
[0082]“杂环基”意指包含约3至约10个环原子,优选约5至约10个环原子的非芳族饱和单环或多环环系,其中环系中的一个或多个原子为非碳元素,例如单独或组合的氮、氧或硫。环系中不存在相邻氧和/或硫原子。优选的杂环基包含约5至约6个环原子。杂环基根名之前的前缀氮杂、氧杂或硫杂分别意指存在至少一个氮、氧或硫原子作为环原子。杂环基环中的任何-nh均可以例如-n(boc)、-n(cbz)、-n(tos)基团等的经保护形式存在;此类保护也被视作本发明的部分。杂环基可任选地被一个或多个可相同或不同且如本文所定义的“环系取代基”取代。杂环基的氮或硫原子可任选地被氧化成相应n-氧化物、s-氧化物或s,s-二氧化物。合适的单环杂环基环的非限制性实例包括哌啶基、吡咯烷基、哌嗪基、吗啉基、硫代吗啉基、噻唑烷基、1,4-二噁烷基、四氢呋喃基、四氢硫代苯基、内酰胺、内酯等。“杂环基”还包括如上文所述的杂环基环,其中=o取代同一环碳原子上的两个有效氢。此类部分的实例为吡咯烷酮:
[0083][0084]“杂环基烷基”意指经由烷基部分(如上文所定义)与母核连接的如上文所定义的杂环基部分。合适的杂环基烷基的非限制性实例包括哌啶基甲基、哌嗪基甲基等。
[0085]“杂环烯基”意指包含约3至约10个环原子、优选约5至约10个环原子的非芳族单环或多环环系,其中环系中的一个或多个原子为非碳元素,例如单独或组合的氮、氧或硫原子,且其包含至少一个碳-碳双键或碳-氮双键。环系中不存在相邻氧和/或硫原子。优选的
基团。经由羰基与母体部分键合。优选的酰基包含低级烷基。合适的酰基的非限制性实例包括甲酰基、乙酰基和丙酰基。
[0097]“芳酰基”意指其中芳基如先前所述的芳基-c(o)-基团。经由羰基与母体部分键合。合适的基团的非限制性实例包括苯甲酰基和1-萘甲酰基。
[0098]“烷氧基”意指其中烷基如先前所述的烷基-o-基团。合适的烷氧基的非限制性实例包括甲氧基、乙氧基、正丙氧基、异丙氧基和正丁氧基。经由醚氧与母体部分键合。
[0099]“芳氧基”意指其中芳基如先前所述的芳基-o-基团。合适的芳氧基的非限制性实例包括苯氧基和萘氧基。经由醚氧与母体部分键合。
[0100]“芳烷氧基”意指其中芳烷基如先前所述的芳烷基-o-基团。合适的芳烷氧基的非限制性实例包括苯甲氧基和1-或2-萘甲氧基。经由醚氧与母体部分键合。
[0101]“烷硫基”意指其中烷基如先前所述的烷基-s-基团。合适的烷硫基的非限制性实例包括甲硫基和乙硫基。经由硫与母体部分键合。
[0102]“芳硫基”意指其中芳基如先前所述的芳基-s-基团。合适的芳硫基的非限制性实例包括苯硫基和萘硫基。经由硫与母体部分键合。
[0103]“芳烷硫基”意指其中芳烷基如先前所述的芳烷基-s-基团。合适的芳烷硫基的非限制性实例为苯甲硫基。经由硫与母体部分键合。
[0104]“烷氧羰基”意指烷基-o-co-基团。合适的烷氧羰基的非限制性实例包括甲氧羰基和乙氧羰基。经由羰基与母体部分键合。
[0105]“芳氧羰基”意指芳基-o-c(o)-基团。合适的芳氧羰基的非限制性实例包括苯氧羰基和萘氧羰基。经由羰基与母体部分键合。
[0106]“芳烷氧羰基”意指芳烷基-o-c(o)-基团。合适的芳烷氧羰基的非限制性实例为苯甲氧羰基。经由羰基与母体部分键合。
[0107]“烷基磺酰基”意指烷基-s(o2)-基团。优选的基团是其中烷基为低级烷基的基团。经由磺酰基与母体部分键合。
[0108]“芳基磺酰基”意指芳基-s(o2)-基团。经由磺酰基与母体部分键合。
[0109]
术语“被取代”意指指定原子上的一个或多个氢被选自指定基团的基团取代,前提条件是在现有状况下不超过指定原子的正常价且取代产生稳定化合物。仅当取代基和/或变量的组合产生稳定化合物时,才可允许此类组合。所谓“稳定化合物”或“稳定结构”意指足够稳定从而可在从反应混合物分离至有用纯度时存在并且配制为有效治疗剂的化合物。
[0110]
术语“任选地被取代”意指经规定基团、基或部分的任选取代。
[0111]
关于化合物的术语“纯化的”、“纯化形式”或“分离和纯化形式”是指经合成方法(例如,从反应混合物)或天然来源或其组合中分离之后所述化合物的物理状态。因此,关于化合物的术语“纯化的”、“纯化形式”或“分离和纯化”是指通过本文所述或技术人员熟知的一或多种纯化方法(例如色谱、重结晶等)获得之后所述化合物的物理状态,其纯度足以使其可以本文所述或技术人员熟知的标准分析技术进行表征。
[0112]
还应注意,在本文正文、方案、实施例和表中任何具有不饱和价态的碳以及杂原子均假定具有足够数量的氢原子以使价态饱和。这些氢原子中的任何一个或多个可为氘。
[0113]
当化合物中的官能团称为“受保护”时,是指该基团呈修饰形式,以在化合物进行反应时防止受保护位点发生不期望的副反应。本领域的普通技术人员可参考标准教科书
(例如t.w.greene等,protective groups in organic synthesis(1991),wiley,new york)来识别合适的保护基。
[0114]
当任何变量(例如芳基、杂环、r2等)在任何组成或在式i中出现不止一次时,其每次出现时的定义均与其它每次出现时的定义无关。
[0115]
如本文所用的术语“组合物”意欲涵盖规定量的规定成分的产品,以及直接或间接源于规定量的规定成分的组合的任何产品。
[0116]
药学上可接受的盐
[0117]
α-2受体激动剂可以其药学上可接受的盐使用。
[0118]“药学上可接受的盐”是保留了母体化合物的活性,并且与母体化合物相比,不对被施用其的患者产生任何另外的有害作用或不利作用的任何盐。药学上可接受的盐还指在施用酸、另一种盐或可转化为酸或盐的前药后在体内形成的任何盐。
[0119]
酸性官能团的药学上可接受的盐可衍生自有机碱或无机碱。所述盐可含有一价或多价离子。特别受关注的是无机离子锂、钠、钾、钙和镁。有机盐可由胺类制备,特别是铵盐,例如单烷基胺、二烷基胺和三烷基胺或乙醇胺。盐也可由咖啡因、氨基丁三醇和类似的分子形成。盐酸或一些其它药学上可接受的酸可与包含碱性基团(例如胺或吡啶环)的化合物形成盐。
[0120]
前药
[0121]
可在本发明的组合物和方法中使用任何α-2受体激动剂的前药。
[0122]“前药”为在施用后可转化为有治疗活性化合物的化合物,该术语在本文中应被解释为本领域中通常所理解的含义。并非旨在限制本发明的范围,转化可通过酯基或其它生物不稳定基团的水解而发生。通常但非必须的是,前药为无活性的或者比其转化成的有治疗活性的化合物的活性低。特别考虑的是本文公开的化合物的酯前药。酯可衍生自c1羧酸(即天然前列腺素的末端羧酸),或者酯可衍生自所述分子的另一部分上(例如苯环上)的羧酸官能团。并非旨在进行限制,酯可为烷基酯、芳基酯或杂芳基酯。关于这点(“前药”的定义),术语烷基具有本领域技术人员通常所理解的含义并且是指直链烷基、支链烷基或环烷基部分。c
1-6
烷基酯特别有用,其中所述酯的烷基部分具有1至6个碳原子,包括但不限于甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、戊基异构体、己基异构体、环丙基、环丁基、环戊基、环己基,及其具有1-6个碳原子的组合等。
[0123]
本发明的α-2受体激动剂可通过合成制备,或在施用前药后在体内生成。因此,术语“α-2受体激动剂”同时涵盖通过制备方法制备的化合物以及仅在施用另一种药物后在体内生成的那些化合物。
[0124]
异构体和外消旋物
[0125]
在本发明的组合物和方法中可使用α-2受体激动剂的对映异构体、立体异构体或其它异构体。可在本发明的组合物和方法中以任何比例使用外消旋混合物或一种或两种外消旋物。
[0126]
剂量
[0127]
施用的精确剂量和频率取决于患者病症的严重程度和性质、施用的方式、采用的具体化合物的效力和药效以及处方医师的判断。确定剂量是本领域普通技术人员能力范围内的常规事项。通常,以治疗有效剂量,即,以足以产生所需疗效的剂量来施用α-2受体激动
剂。
[0128]
在一个实施方案中,本发明的化合物(α-2b受体激动剂;缺乏显著α-2a活性的α-2b受体激动剂;α-2c受体激动剂;缺乏显著α-2a活性的α-2c受体激动剂;α2b/2c受体激动剂;和缺乏显著α-2a活性的α2b/2c受体激动剂)提供长期缓解—即,在化合物停用后持续一日或多日。因此,在一个实施方案中,本发明的方法包括将本发明的化合物向患者初期施用,然后将化合物在停药期结束后再进行二期施用。初期、二期和停药期为一天、两天、三天、四天、五天、六天、七天、八天、九天、十天、十一天、十二天、十三天或十四天,或一周、两周、三周或四周,并且可以相同或不同。因此,例如,可将本发明的化合物施用三天,然后在上次施用化合物之后三天立即将化合物再施用三天;或可将本发明的化合物施用两周,然后在上次施用化合物之后一周立即将化合物再施用一周。
[0129]
在另一个实施方案中,初期和二期是可变的,而停药期是固定的。在此类实施方案中,初期和二期为一天、两天、三天、四天、五天、六天、七天、八天、九天、十天、十一天、十二天、十三天或十四天,或一周、两周、三周或四周。因此,例如,可将本发明的化合物施用三天,然后在上次施用化合物之后六天立即将化合物再施用三天;或可将本发明的化合物施用一周,然后在上次施用化合物之后一周立即将化合物再施用一周。
[0130]
赋形剂和剂型
[0131]
本领域技术人员将容易理解,α-2受体激动剂可与本领域熟知的药学上可接受的赋形剂混合。
[0132]
全身性施用的药物组合物可以配制为适于口服或肠胃外施用、吸入或局部施用于眼或皮肤的粉剂、丸剂、片剂等,或为溶液剂、乳剂、悬浮剂、气雾剂、糖浆剂或酏剂。
[0133]
对于固体剂型或药剂,无毒的固体载体包括但不限于药物级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、聚亚烷基二醇、滑石、纤维素、葡萄糖、蔗糖和碳酸镁。固体剂型可以是未包衣的,或可以通过已知的技术进行包衣以延迟在胃肠道中的崩解和吸收,从而在较长时段提供持续作用。例如,可采用诸如甘油单硬脂酸酯或甘油二硬脂酸酯的延时材料。也可以通过美国专利no.4,256,108、no.4,166,452和no.4,265,874中描述的技术来对这些固体剂型进行包衣以形成用于控制释放的渗透治疗片剂。药学上可施用的液体剂型可以(例如)包含一种或多种目前有用的化合物和任选的药物佐剂在载体(例如水、盐水、右旋糖水溶液、甘油、乙醇等)中的溶液或悬浮液,从而形成溶液剂或悬浮剂。如果需要,待施用的药物组合物也可含有微量的无毒辅助物质,如润湿剂或乳化剂、ph缓冲剂等。此类辅助剂的典型实例是醋酸钠、失水山梨醇单月桂酸酯、三乙醇胺、醋酸钠、三乙醇胺油酸酯等。制备此类剂型的实际方法对本领域的技术人员是已知的或明显的;例如,参见remington's pharmaceutical sciences,mack publishing company,easton,pa.,第16版,1980。待施用制剂的组成在任何情况下均含有可有效提供所需治疗效果的量的一种或多种目前有用的化合物。
[0134]
肠胃外施用通常以皮下注射、肌内注射或静脉内注射为特征。注射剂可以常规的形式制备,如作为液体溶液或悬浮液、适于注射前的液体形式的溶液或悬浮液的固体形式或作为乳液。例如,合适的赋形剂例如是水、盐水、右旋糖、甘油、乙醇等。此外,如果需要,待施用的可注射药物组合物也可含有微量的无毒辅助物质,例如湿润剂或乳化剂、ph缓冲剂等。
[0135]
活化t细胞
[0136]
t细胞是一类淋巴细胞,其具有由于基因重排结果而产生的特异性t细胞受体(tcr)。t细胞具有各种作用,这些作用由t细胞的不同亚群的分化来完成,可由基因表达的离散模式来识别。几种主要t细胞亚群基于受体表达而被识别,如tcr-α/β和tcrγ/δ以及未变异的自然杀伤细胞。其它t细胞亚群由表面分子和由其分泌的细胞因子来定义。例如,t辅助细胞(cd4细胞)分泌细胞因子,并且帮助b细胞和细胞毒性t细胞存活并实现效应因子功能。细胞毒性t细胞(ctl)通常为cd8细胞,它们专门杀伤靶细胞,例如受感染细胞或肿瘤细胞。自然杀伤(nk)细胞涉及t细胞,尽管它们确实与t细胞共有一些功能并能够分泌细胞因子并杀伤某些种类的靶细胞,但是它们没有tcr且生命期较短。
[0137]
人和小鼠的外周血液包含一小群t细胞淋巴细胞,其表达t调节性表型(“treg”),即,对cd4和cd25抗原均呈阳性(即,也明显对cd25呈阳性的那些cd4
t细胞)。这些细胞首先在小鼠中得到鉴定,其在小鼠体内构成淋巴结和脾cd4
t细胞群体的6-10%,该cd4
cd25
细胞群体占人外周血液单核细胞(pbmc)的大约仅5-10%,或占cd4
t细胞的2-7%,尽管一些供体表现出更加不同的cd4
和cd25
细胞群体。约1-2%的人外周血液pbmc同时是cd4阳性(cd4
)和cd25明显阳性(cd25
)的细胞。
[0138]
存在几种treg细胞的亚群(bluestone等,nature rev.immunol.,3:253(2003))。调节细胞的一种亚群产生于胸腺。胸腺产生的treg细胞通过细胞因子非依赖性机制起作用,该机制涉及细胞与细胞的接触(shevach,nature rev.immunol.2:389(2002))。它们对自身耐受性的诱导和维持以及对自身免疫的预防而言是必需的(shevach,annu.rev.immunol.18:423-449(2000);stephens等,2001;taams等,2001;thornton等,1998;salomon等,immunity 12:431-440(2000);sakaguchi等,immunol.rev.182:18-32(2001))。这些专门的调节细胞防止那些避过胸腺清除的自身反应性t细胞的活化和繁殖或者识别胸腺外抗原,因此它们对内环境稳定和免疫调节至关重要,并且保护宿主以防止自身免疫的发展(suri-payer等,j.immunol.157:1799-1805(1996);asano等,j.exp.med.184:387-396(1996);bonomo等,j.immunol.154:6602-6611(1995);willerford等,immunity 3:521-530(1995);takahashi等,int.immunol.10:1969-1980(1998);salomon等,immunity12:431-440(2000);read等,j.exp.med.192:295-302(2000))。因此,免疫调节性cd4
cd25
t细胞往往被称为“专业抑制细胞”。
[0139]
然而,treg细胞也可通过成熟的外周cd4
t细胞的活化而生成。研究表明外周产生的treg细胞通过生成免疫抑制性细胞因子来介导其抑制活性,例如转化生长因子-β(tgf-β)和il-10(kingsley等,j.immunol.168:1080(2002);nakamura等,j.exp.med.194:629-644(2001))。抗原特异性活化之后,这些treg细胞可非特异性地抑制cd4
或cd25
t细胞的增殖(baecher-allan等在小剂量固定的抗-cd3mab基共培养抑制测定中通过facs分选证实,j.immunol.167(3):1245-1253(2001))。
[0140]
最近,riley等,(“human t regulatory cell therapy:take a billion or so and call me in the morning,”immunity,30(5),656-665(2009))已证实调节t细胞在涉及免疫活化的若干病理状态中至关重要(riley等,2009)。cd25 ,foxp3 treg能够通过一系列细胞类型,包括常规的cd4 辅助t细胞、b细胞抗体生产、cd8 细胞毒活性和抗原呈递细胞功能和成熟来阻断免疫反应炎症和组织破坏(tang&bluestone,2008)。treg的频率降低或
功能障碍已在许多人类疾病中有所报道(tran&shevach,2009)。
[0141]
在一个实施方案中,本发明的方法包括施用α-2激动剂以上调患者的调节t细胞功能,在所述患者中此类上调将是有益的。在另一个实施方案中,调节t细胞为cd25 、foxp3 t细胞。在另一个实施方案中,本发明的方法包括施用α-2激动剂来治疗诸如以下的疾病:神经炎、格林-巴利综合征、类风湿性关节炎、i型糖尿病、多发性硬化症(ms)、移植物抗宿主病(gvhd)、自身免疫性葡萄膜炎、眼部炎症、干眼病、特应性皮炎、银屑病、炎性肠病、哮喘和再生障碍性贫血。
实施例
[0142]
通过以下实施例对本发明进行阐述。提供实施例仅用于进行阐述;可采用更多的实施方案。
[0143]
α-2b对调节t细胞具有作用的证据
[0144]
发明人已测试α
2b
选择性化合物是否经由免疫相关机制调节神经性疼痛状态。用α
2b
激动剂(化合物a)进行治疗减弱了脊神经结扎手术诱导的il-2水平的增加(表1)。il-2是一种促炎性细胞因子,其对于调节t-淋巴细胞增殖而言是必要的。这一发现表明α
2b
激动剂对急性和慢性异常性疼痛逆转的作用(如美国专利no.7,345,065所述,其公开内容以引用方式并入本文)可经由免疫细胞特别是t细胞来介导。发明人还观察到α
2b
受体而非α
2a
受体经由qpcr在人t淋巴细胞的不同亚型中的表达。就发明人所知,这是α
2b-受体亚型在t细胞表达的首次例证(图1)。α
2b-受体激动剂介导的持续性疼痛缓解机制中具有作用的其它证据通过以下事实获得:具有不同结构的第二α
2b
激动剂(化合物b)的镇痛作用可被免疫抑制药物fk506阻断(表2)。这一发现表明α
2b-受体诱导的长期异常性疼痛逆转需要存在活化的淋巴细胞,因为已经证实fk506是t-淋巴细胞活化的强力阻断物(small等,1996)。这一发现得到另一种具有不同结构的α
2b
激动剂(化合物c)的证实,其中fk506能够在脊神经结扎模型中阻断化合物的长期镇痛活性(表3)。
[0145]
另外,发明人还探究了涉及α
2b-受体介导作用的t细胞亚型并且观察到患有神经性疼痛的动物的淋巴器官中调节t细胞(treg)数量的显著和持续的增加,所述神经性疼痛已用α
2b-受体激动剂治疗(图2)。发明人未观察到化合物对未治疗动物( animal)中treg细胞数量的作用。这表明α
2b-受体激动剂对treg细胞的作用依赖于抗原剌激并且可能存在treg细胞的抗原选择性扩增。
[0146]
α-2b激动剂在多发性硬化症模型中的作用
[0147]
发明人已证实该α
2b-受体激动剂机制可推及第二病理性t细胞活化模型、多发性硬化症模型和第二类机制。在用引起复发缓解型实验性自身免疫脑脊髓炎的蛋白脂质蛋白免疫的小鼠中,化合物b(经渗透性微泵,3mg/kg/天)选择性地增加了treg数量并减轻了疼痛[图3]。
[0148]
表1:得自用化合物a(经渗透性微泵,2.4mg/kg/天)或用媒介物治疗的snl大鼠的各种组织中的il-2水平的减弱
[0149][0150]
数据表示为平均pg/ml
±
平均值标准误差。在所有组中n=3-4。
[0151]
相对于媒介物的显著性值:*p《0.05;**p《0.01。
[0152]
表2:化合物b /-fk506在异常神经性疼痛的snl大鼠模型中导致的疼痛逆转
[0153][0154]
表3:化合物c /-fk506在异常神经性疼痛的snl大鼠模型中导致的疼痛逆转
[0155][0156]
数据表示为平均mpe%(其表示从给药前基线的异常性疼痛逆转%)
±
平均值标准误差。在所有组中n=6。对比媒介物的显著性值:*p《0.05;**p《0.01。
[0157]
下面的表4示出化合物a、b和c的结构:
[0158][0159]
其它t细胞介导的疾病模型的研究
[0160]
对神经性疼痛的chung模型和ms诱导的疼痛模型中α
2b-受体激动剂介导作用机制的研究显示淋巴器官中推定的调节t细胞(treg)数量的显著和持续的增加。发明人探究了α
2b-受体激动剂进一步在ms模型以及在自身免疫性葡萄膜炎、内毒素诱导性葡萄膜炎和干眼病中对临床病程的作用。在用引起复发缓解型实验性自身免疫脑脊髓炎(eae)的蛋白脂质蛋白免疫的小鼠中,用化合物b进行治疗在临床疾病发展期间对减轻ms症状具有显著作用(图4)。从第7-10天的治疗降低了第14天(p《0.01)和第24天期间的临床评分。当对小鼠继续进行治疗时获得类似的结果。在eae中,促炎性cd4 t细胞和其它炎性细胞在周边增殖,浸润中枢神经系统(cns),这导致以进行性麻痹为特征的脱髓鞘作用。在研究结束时经由流式细胞术对cns中的免疫细胞浸润进行的分析显示用化合物b进行治疗显著减少了免疫细胞的存在(图5)。这表明化合物b防止了cns中病原性t细胞的存在,这导致脑脊髓炎减轻。化合
物c在eae中也显示出类似的功效。从第7-13天进行tid口服给药(3mg/kg/天)后,与从13-24天进行媒介物治疗的小鼠相比,临床评分显著降低(图6)。在第37天经由流式细胞术对cns中的免疫细胞进行的分析显示化合物c增加了脊髓中调节t细胞(cd4 cd25hifoxp3 )的频率(图7)。发明人还进行研究已探究α2b激动剂在眼部t细胞介导的炎症模型中的效用。实验性自身免疫性葡萄膜炎(eaau)表示一种导致眼前段疾病的抗原特异性、t细胞介导的自身免疫反应。从eaau诱导后第1-18天或第7-18天,将化合物b以1mg/kg/天给药(3天口服tid给药,然后经由渗透性微泵给药)可有效地部分消除前段炎症。
[0161]
化合物b降低了前葡萄膜炎的临床评分并减少了房水中炎性细胞的数量(图8)。此外,正如通过血液中减少的嗜中性粒细胞计数、血液中正常化的淋巴细胞群和脾脏中正常化的cd4
t细胞群所看出,化合物b似乎可有效地使免疫反应正常化。在急性内毒素诱导性葡萄膜炎(eiu)模型中也观察到化合物b的类似作用。与未治疗的或媒介物治疗的(盐水)对照相比,化合物b(1mg/kg/天,经由渗透性微泵递送)显著抑制了eiu大鼠房水中的蛋白渗出(图9)。通过化合物b而非媒介物进行治疗使得lps刺激所导致的血液嗜中性粒细胞的增加和血液淋巴细胞群的减少显著正常化(图10)。在干眼病模型中的过继性转移研究显示α
2b
激动剂对眼部炎症的作用涉及t细胞。在10天的鼓风机诱导的干燥应激之后,在用3mg/kg/天化合物b或媒介物治疗(3天口服tid给药,然后经由渗透性微泵给药)的小鼠中,收获cd4 t细胞并转移至同系裸小鼠。接受来自化合物b治疗的小鼠的t细胞的受体小鼠(在暴露于鼓风机期间持续10天)显著降低了细胞因子il-17和tnfα(促成干眼病的关键细胞因子)的水平(图11)。同样以治疗模式来测试化合物b,其中对先前已暴露于鼓风机的小鼠施用治疗(3mg/kg/天,经由渗透性微泵)。在此模式中,化合物b与环孢霉素a相比同样显著防止了杯形细胞损失和t细胞向结膜中的浸润(图12)。这些研究均支持化合物b、化合物c和其它α
2b
激动剂的机制涉及免疫调节这一假设。
[0162]
方法
[0163]
大鼠的脊神经结扎模型
[0164]
大鼠的snl(或chung)模型是神经性疼痛的公认标准动物模型,并且认为其在症状(保护行为、机械性异常性疼痛)和通过药理学药剂进行缓解方面与人灼痛病症相似。例如,吗啡不会缓解触觉异常性疼痛,而加巴喷丁(gabapentin)(30mg/kg,经口)使得异常性疼痛缓解50%。通过对l-5和l-6脊神经进行紧紧结扎来完成snl模型,紧紧结扎产生所述的触觉异常性疼痛或或轻触敏感性(kim和chung,1992)。通过吸入异氟烷/氧气混合物来对雄性sprague-dawley大鼠(100-120克;charles river,wilmington,ma)进行麻醉。对手术部位剃毛并用聚维酮碘准备好。从胸椎xiii向下切开至骶骨。将肌肉与位于l4-s2节段处的脊椎骨(左侧)分离。找出l6椎骨,然后用小修骨钳小心除去横突,以便可目视辨识l4-l6脊神经。将l5和l6脊神经分离并用6-0丝线紧紧结扎。确认完全止血,然后缝合伤口。手术持续大约20分钟。将少量抗生素软膏涂敷到切开区域并将动物转移至调热-温灯下的塑料恢复笼中。手术后不对动物采用任何外用或局部麻醉剂,因为麻醉剂会抑制疼痛综合征的发展(这是要研究的现象)。
[0165]
通过用一系列共8根von frey毛以从上到下的方式在手术后爪的跖肌中部区域进行刺激来定量接受chung手术的动物的异常性疼痛,如文献中所述(dixon,1980)。根据反应以从上到下的方式施加von frey毛,直至确立50%阈值。将von frey毛用足以使其弯曲的
力施加至手术爪子的跖面。如果爪子立即缩回,则记录为阳性反应。使用8根von frey毛(3.61、3.84、4.08、4.31、4.56、4.74、4.93和5.18),产生0.25
–
15克的克力。
[0166]
von frey分析:
[0167][0168]
平均值 sem:
[0169]
平均值=异常性疼痛逆转的平均值
[0170]
sem=stdev/n的sq root(平方根)
[0171]
在手术确立稳定的异常性疼痛之后,用化合物进行2-3周的测试。在所有实验动物中,在施用药物之前,然后在用alzet渗透性微泵给药24小时和5-23天后记录基线测量值。研究人员对药物组的种类不知情。按下式计算异常性疼痛逆转%:[(给药后阈值-给药前阈值)/(15-给药前阈值)]
×
100。
[0172]
小鼠的蛋白脂质诱导的实验性自体免疫脑脊髓炎
[0173]
实验性自体免疫脑脊髓炎(eae)的小鼠模型已广泛用于理解ms免疫病理的潜在机制。用髓磷脂蛋白,如髓磷脂结合蛋白(mbp)、蛋白脂质蛋白(plp)和髓磷脂少突胶质细胞糖蛋白(mog)免疫的小鼠表现出许多与ms患者的相似性(friese等,2006)。包括t细胞、巨噬细胞和抗体在内的免疫系统组分是破坏eae小鼠的髓磷脂的重要因素。另外,炎症也导致多病灶区域发生脱髓鞘作用,最终导致神经功能障碍的临床征象,包括尾部张力消失、步态异常和部分至完全后肢瘫痪。plp诱导的eae模型能够同时研究cns炎症的致病机制和脱髓鞘作用以及ms相关疼痛,即我们在allergan已优化的多靶概念。使用无菌技术,将蛋白脂质蛋白髓磷脂肽(plp)(139-159:chclgkwlghpdkfvgityal)与弗氏不完全佐剂(ifa)1:1混合(终浓度为2mg/ml plp)。使用26g针在8-10周大的雌性sjl小鼠(taconic)的右后胁腹和左后胁腹(0天)经皮下注射100μl plp/ifa(200μg plp/注射)。使用此方案免疫的小鼠历经复发缓解的临床过程,伴随运动损伤发作,期间穿插缓解/临床改善期。此外,这些小鼠表现出稳定的疼痛表型,其在临床缓解期过程中最为明显。
[0174]
使用此方案,在sjl小鼠中plp诱导的eae以一定的发病率(~90-100%)发作,并且通常在免疫后~12天变得明显,在14-21天达到疾病峰值。plp-eae小鼠表现出以下体症:神经功能缺损、从尾部张力部分消失发展到部分至完全后肢瘫痪。最多75%的小鼠将历经复发缓解的临床过程,同时伴随有运动损伤发作的缓解期(后肢无力和瘫痪)。在组织学上,小鼠在大脑和脊髓的白质道(包含有髓鞘的轴突的区域)内表现出广泛性炎症、进行性浸润和炎性细胞累积、脱髓鞘作用和轴突丧失。患有严重eae的小鼠表现出广泛的细胞浸润、泛发的脱髓鞘病灶。plp诱导的小鼠通常在神经功能缺损首次发作(第14-21天)期间表现出最严重的临床疾病。通常,疼痛表型在从初始脱髓鞘事件缓解之后明显地开始,并且一直持续到对小鼠实施安乐死。
[0175]
按照0-5级对小鼠的行为异常进行常规视觉评分:0-无异常;1-尾部张力部分消失(尾部局部无力);2-尾部张力丧失、后肢无力;3-步态不稳、后肢部分瘫痪;4-后肢完全瘫痪;5-濒死或死亡。从免疫后第7天起每隔一天至每隔两天进行评分,直至小鼠被处死。按照早先所述通过von frey毛法测量异常性疼痛。在研究结束时,收集颈淋巴结、脊髓和大脑以
进行流式细胞术。
[0176]
小鼠中干燥的干燥应激(ds)
[0177]
c57bl/6(c57bl/6ntac)和b6.cg/ntac-foxn1nune9购自taconic,inc.(germantown,ny)。使用6-10周龄的小鼠。动物研究获得allergan动物护理和使用委员会(allergan animal care and use committee)的批准。所有研究均遵守视觉与眼科学研究协会(association for research in vision and ophthalmology)关于眼科和视觉研究动物使用(use of animals in ophthalmic and vision research)的声明。如文献中所述,干眼病是通过在左右胁腹上一日三次地交替皮下注射氢溴酸东莨菪碱(0.5mg/0.2ml;sigma-aldrich,st.louis,mo)对小鼠进行治疗而诱发(neiderkorn等,2006)。将小鼠置于笼子中,笼子的每一侧均具有带孔的塑料筛网,以使得在防护罩内16小时/天的风扇(笼子一侧具有一个风扇)气流通过(airclean systems,raleigh,nc)。室内湿度保持低于40%。连续10天引发干燥应激(ds)。收集进行ds和ns的小鼠的脾和颈淋巴结(cln),并将一供体当量的脾或cln cd4 细胞经腹膜内转移至同系裸小鼠。一脾脏当量的t细胞等于5
×
107个细胞。三天后收集样品以供分析。对于泪液收集,将1.5μl pbs放置在每只眼上,然后从两只眼睛收集1μl泪液并置于8μl细胞因子测定缓冲液中(beadlyte;millipore,billerica,ma)。使用置于外眦泪液新月面(tear meniscus)中的1-μl体积的玻璃毛细管(drummond scientific,broomhall,pa)通过毛细管作用收集缓冲液和泪液。将样品在-80℃下冰冻直至测定时间。通过对含有cd4抗体的泪腺样品染色以及h&e染色以定量结膜中的杯形细胞和t细胞来进行组织学分析。为了测试处于治疗模式的化合物,将动物在干燥应激下暴露两周,然后使其在正常圈养笼中休息7天。然后将动物在干燥应激下再次暴露另外7天以模拟复发型慢性干眼病。在干燥应激下再次暴露的前两天开始用化合物b进行药物治疗。在两项研究中,化合物b以3mg/kg/天施用。按上述进行过继性转移、泪液细胞因子分析和组织学分析。
[0178]
大鼠的实验性自身免疫性前葡萄膜视网膜炎
[0179]
通过在左后脚掌注射单一注射150μg(以100μl计)纯化的来自牛眼的maa复合物来免疫雄性lewis大鼠(180-200g)。将maa蛋白悬浮于磷酸盐缓冲盐水(pbs,ph7.2)中并在含有1μg/100μl百日咳毒素(ptx)乳液混合物的完全弗氏佐剂(cfa,vwr scientific)中乳化(1:1v/v)。向对照动物注射用cfa和ptx乳化的pbs。
[0180]
免疫后第7天进行眼内炎症评价,在第7天和19天之间每隔一天用裂隙灯显微镜检术检查动物的临床征象和葡萄膜炎症状。收集房水以评估炎性细胞数量和蛋白水平。用血球计在光学显微镜下进行10ul的细胞计数。将bsa用作蛋白标准液,通过来自bio-rad的蛋白测定溶液来测量蛋白浓度。在luminex(biosource-invitrogen,carlsbad,ca)上测量促炎性细胞因子和趋化因子水平。在第11天、14天和19天收集血液、脾脏和眼睛以经由流式细胞术确定血液白细胞分化、脾t细胞活化状态,以及组织病理学。
[0181]
大鼠的内毒素诱导性葡萄膜炎:
[0182]
雌性lewis大鼠(180-200克)购自charles river laboratory。向大鼠的脚掌注射(后肢左侧)100μl 1mg/ml lps(sigma)溶液(在无菌无热原盐水中)或150μl无菌无热原盐水。在注射lps后24小时处死动物。收集房水并分析以确定炎性细胞计数、细胞因子水平和趋化因子浓度以及总蛋白浓度。如果需要的话,确定血液白细胞分化和组织病理学。
[0183]
配制:
[0184]
将化合物a在50%dmso(sigma,st.louis,mo)中配制。将此溶液载入渗透性微泵(型号1007d,alzet corp.,palo alto,ca),该渗透性微泵被设定为以0.5ul/hr的速率递送药物,产生2.4mg/kg/天的终剂量。这些研究的媒介物为50%dmso,其经由渗透性微泵以0.5ul/hr/kg的速率施用。
[0185]
将化合物b在50%dmso(二甲基亚砜;sigma,st.louis,mo)中配制。将此溶液以0.3或1mg/kg的剂量经口服tid给药。对于渗透性微泵(型号1007d,alzet corp.,palo alto,ca)中给药,将化合物装载到被设定为递送1或3mg/kg/天终剂量的泵上。这些研究的媒介物为50%dmso。
[0186]
首先将化合物c在100%dmso(sigma,st.louis,mo)中配制,然后在30%dmso中稀释成10mg/ml溶液;在水中制备15%dmso的3mg/ml溶液和其它稀释液。将该化合物分别以0.3或1mg/kg的剂量经口服tid给药,总日剂量为1或3mg/kg/天。
[0187]
流式细胞术
[0188]
通过轻度机械处理获得颈浅淋巴结细胞和脾细胞。根据制造商的方案使用cd4 分离柱(miltenyi biotech,auburn,ca)来分离cd4
细胞。将大脑和脊髓以机械方式解聚,并使用37.5%percoll(sigma-aldrich)来分离cns的单核细胞。
[0189]
为测定cd4(辅助t细胞)、cd8(杀伤性t细胞)、cd25(活化的辅助t细胞和调节t细胞)、cd45(巨噬细胞和小胶质细胞)和f4/80(巨噬细胞和小胶质细胞)的表面表达,将5
×
105个细胞/100μl facs缓冲液(pbs,0.02%叠氮化钠[sigma-aldrich]和2%牛血清白蛋白)与来自bd biosciences,mountain view,ca的适当抗体一起孵育。针对各抗体使用同种型对照抗体。将细胞在facs缓冲液中洗涤两次并以5
×
105个细胞/100μl缓冲液重悬。含有生物素标记抗体的管接纳1.5μl辅助染色颜料(streptavidin percp;bd-pharmingen)并在黑暗中于冰上放置20分钟。对表达进行分析(具有cellquest软件的facscalibur;bd biosciences,mountain view,ca)。
[0190]
细胞因子的luminex分析
[0191]
用敏感型荧光多重免疫珠测定(luminex;biosource-invitrogen,carlsbad,ca)来测量细胞因子的水平。使用来自millipore的9plex大鼠细胞因子/趋化因子(rcyto-80k-09)模板。样品中的细胞因子水平通过使用对应的millipore cytokine beadmate对进行分析。对于luminex测定,用25μl beadlyte细胞因子测定缓冲液预先润湿96孔滤板(millipore)。使用真空歧管(millipore,billerica,ma)从孔中抽吸缓冲液。将25μl样品置于每个孔中。将小珠(25μl)吸移到孔中。通过放置25μl购自millipore的适当标准物稀释液来一式两份地产生各细胞因子的标准曲线。在黑暗中于4℃下伴随轻缓摇动将板孵育过夜。将小珠用beadlyte细胞因子测定缓冲液(millipore)洗涤,并使用真空歧管消除洗涤缓冲液。在室温下,将25μl适当生物素共轭的二级抗体(millipore)加入各孔中并保持90分钟,同时轻缓搅拌。将小珠与beadlyte链霉亲和素-藻红蛋白(beadlyte测定缓冲液中1:25稀释)一起孵育30分钟,同时轻缓搅拌。将小珠洗涤,重悬于125μl beadlyte缓冲液中,并通过luminex 100仪器(luminex corporation,austin,tx)进行分析。使用upstate beadview软件对来自每个细胞因子最少50个小珠的平均荧光强度进行分析。使用四或五参数逻辑曲线产生标准曲线(包括零标准点在内的8个数据点进行两次)。r平方值介于0.99和1之间。数据
以pg/ml或ng/ml值表示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。