结合人cd38的抗体、其制备方法和用途
技术领域
1.本发明属于肿瘤治疗领域,涉及一种结合人cd38的抗体、其制备方法和用途。
背景技术:
2.多发性骨髓瘤(mm)是一种浆细胞恶性肿瘤,约占所有癌症的1%,易累及骨骼和肾脏,易致病理性骨折、骨痛、脊髓压迫和肾功能衰竭。对于多发性骨髓瘤的治疗,传统的化疗、放疗等治疗方法,难以取得令人满意的疗效。在过去的十年里,针对骨髓瘤生物学的深入研究揭示了许多新的潜在的治疗靶点。
3.cd38是一种46kda的ii型跨膜糖蛋白,cd38已被发现具有多种功能,包括胞外酶活性以及受体介导的细胞粘附和信号转导的调节。cd3的酶活性涉及烟酰胺腺嘌呤二核苷酸(nad )和烟酰胺腺嘌呤二核苷酸磷酸(nadp )转化为环腺苷二磷酸核糖(cadpr)、adpr和烟酸腺嘌呤二核苷酸磷酸(naadp),这是调节细胞内钙信号所必需的底物。在对cd38受体功能的初步研究中,人们发现cd38介导细胞与内皮细胞的结合,在淋巴细胞迁移中发挥作用,并与t、b和自然杀伤(nk)细胞的表面分子有功能联系。cd38仅在祖细胞骨髓、生发中心的b淋巴细胞、终末分化的浆细胞和活化的扁桃体中高水平表达,而成熟和记忆b淋巴细胞表达低水平的cd38。在多发性骨髓瘤细胞上cd38强表达,使其成为治疗多发性骨髓瘤的理想靶点。目前,已上市的daratumumab、isatuximab在多发性骨髓瘤治疗上表现出色。目前国内还没有相关产品,针对抗体疗法的需求仍未得到满足。
技术实现要素:
4.为了解决上述技术问题,本发明的发明人进行了大量试验,从抗原免疫、杂交瘤制备和筛选、抗体表达纯化到生物活性鉴定,筛选获得了特异性结合人cd38的鼠源抗体,并在此基础上,进一步构建获得其嵌合抗体以及人源化抗体。
5.因此,本发明的目的在于提供一种结合人cd38的抗体或其抗原结合片段;提供编码所述结合人cd38的抗体或其抗原结合片段的核苷酸分子;提供包含所述核苷酸分子的表达载体;提供所述表达载体的宿主细胞;提供所述结合人cd38的抗体或其抗原结合片段制备方法;提供包含所述结合人cd38的抗体或其抗原结合片段药物组合物;提供所述结合人cd38的抗体或其抗原结合片段在制备药物中的应用。
6.为了实现上述目的,本发明采用了如下技术方案:
7.本发明一方面提供了一种结合人cd38的抗体或其抗原结合片段,其特征在于,包括:
8.(a)重链互补决定区h-cdr1、h-cdr2、h-cdr3,所述的h-cdr1的氨基酸序列如seq id no:1所示,所述的h-cdr2的氨基酸序列如seq id no:2所示,所述的h-cdr3的氨基酸序列如seq id no:3所示,和
9.(b)轻链互补决定区l-cdr1、l-cdr2、l-cdr3,所述的l-cdr1的氨基酸序列如seq id no:4所示,所述的l-cdr2的氨基酸序列如seq id no:5所示,所述的l-cdr3的氨基酸序
列如seq id no:6所示。
10.本发明“抗体(ab)”是约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。本发明的抗体包括单克隆抗体、多克隆抗体、由至少两种抗体形成的多特异性抗体(例如双特异性抗体)等。
11.本发明“单克隆抗体”指从一类基本均一的群体获得的抗体,即该群体中包含的单个抗体是相同的,除少数可能存在的天然发生的突变外。单克隆抗体高特异性地针对单个抗原位点。而且,与常规多克隆抗体制剂(通常是具有针对不同决定簇的不同抗体)不同,各单克隆抗体是针对抗原上的单个决定簇。除了它们的特异性外,单克隆抗体的好处还在于它们是通过杂交瘤培养来合成的,不会被其它免疫球蛋白污染。修饰语“单克隆”表示了抗体的特性,是从基本均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来生产抗体。
12.本发明“抗原结合片段”是指能够与人cd38特异性结合的抗体的片段。本发明的抗原结合片段的例子包括fab片段、f(ab’)2片段、fv片段等。fab片段是用木瓜蛋白酶消化抗体产生的片段。f(ab’)2片段是用胃蛋白酶消化抗体产生的片段。fv片段是由抗体的重链可变区和轻链可变区紧密非共价关联的二聚物组成。
13.作为优选的方案,所述的抗体为鼠源抗体、嵌合抗体或人源化抗体。
14.本发明“鼠源抗体”是指来源于大鼠或小鼠的抗体,优选小鼠。本发明的鼠源抗体为使用人cd38为抗原免疫小鼠并进行杂交瘤细胞筛选获得。
15.本发明“嵌合抗体”是指包含来源于一个物种的重和轻链可变区序列以及来源于另一个物种的恒定区序列的抗体,例如具有与人恒定区连接的鼠重和轻链可变区的抗体。优选的,本发明的嵌合抗体是由鼠源抗体50g12重链可变区和轻链可变区序列与人的恒定区拼接获得。更优选的,本发明的嵌合抗体选自50g12-chimeric。
16.本发明“人源化抗体”是指其cdr来源于非人物种(优选小鼠)抗体,抗体分子中残余的部分(包括框架区和恒定区)来源于人抗体。此外,框架区残基可被改变以维持结合亲和性。优选的,本发明的人源化抗体由鼠源抗体50g12的cdr区和来源自人抗体的非cdr区重组,增加第四个框架区并对部分有重要影响的残基进行突变获得。更优选的,本发明的人源化抗体选自50g12-humanized。
17.作为优选的方案,所述的抗原结合片段包括fab片段、f(ab’)2片段、fv片段。
18.作为优选的方案,所述的结合人cd38的抗体或其抗原结合片段的重链可变区的氨基酸序列如seq id no:7所示,轻链可变区的氨基酸序列如seq id no:8所示。
19.作为优选的方案,所述的结合人cd38的抗体或其抗原结合片段的重链可变区的氨基酸序列如seq id no:9所示,轻链可变区的氨基酸序列如seq id no:10所示。
20.作为优选的方案,所述的结合人cd38的抗体或其抗原结合片段的重链的氨基酸序列如seq id no:11所示,轻链的氨基酸序列如seq id no:12所示。
21.本发明另一方面提供了一种核苷酸分子,所述核苷酸分子编码上述结合人cd38的
抗体或其抗原结合片段。
22.作为优选的方案,所述核苷酸分子编码重链可变区的核苷酸序列如seq id no:13所示,编码轻链可变区的核苷酸序列如seq id no:14所示。
23.作为优选的方案,所述核苷酸分子编码重链可变区的核苷酸序列如seq id no:15所示,编码轻链可变区的核苷酸序列如seq id no:16所示。
24.作为优选的方案,所述核苷酸分子编码重链的核苷酸序列如seq id no:17所示,编码轻链的核苷酸序列如seq id no:18所示。
25.本发明所述核苷酸分子的制备方法为本领域常规的制备方法,较佳地包括以下制备方法:通过基因克隆技术例如pcr方法等,获得编码上述单克隆抗体的核苷酸分子,或者通过人工全序列合成的方法得到编码上述单克隆抗体的核苷酸分子。
26.本领域技术人员知晓,编码上述结合人cd38的抗体或其抗原结合片段的氨基酸序列的核苷酸序列可以适当引入替换、缺失、改变、插入或增加来提供一个多聚核苷酸的同系物。本发明中多聚核苷酸的同系物可以通过对编码该结合人cd38的抗体或其抗原结合片段基因的一个或多个碱基在保持抗体活性范围内进行替换、缺失或增加来制得。
27.本发明另一方面提供了一种表达载体,所述表达载体含有上述的核苷酸分子。
28.其中所述表达载体为本领域常规的表达载体,是指包含适当的调控序列,例如启动子序列、终止子序列、多腺苷酰化序列、增强子序列、标记基因和/或序列以及其他适当的序列的表达载体。所述表达载体可以是病毒或质粒,如适当的噬菌体或者噬菌粒,更多技术细节请参见例如sambrook等,molecular cloning:a laboratory manual,第二版,cold spring harbor laboratory press,1989。许多用于核酸操作的已知技术和方案请参见current protocols in molecular biology,第二版,ausubel等编著。本发明所述表达载体较佳地为pdr1,pcdna3.1( ),pcdna3.1/zeo( ),pdhfr,pcdna4,pdhff,pgm-csf或pcho 1.0。
29.本发明另外提供了一种宿主细胞,所述宿主细胞含有上述的表达载体。
30.本发明所述的宿主细胞为本领域常规的各种宿主细胞,只要能满足使上述重组表达载体稳定地自行复制,且所携带所述的核苷酸可被有效表达即可。其中所述宿主细胞包括原核表达细胞和真核表达细胞,所述宿主细胞较佳地包括:cos、cho(中国仓鼠卵巢,chinese h amster ovary)、ns0、sf9、sf21、dh5α、bl21(de3)或tg1,更佳地为e.coli tg1、bl21(de3)细胞(表达单链抗体或fab抗体)或者cho-k1细胞(表达全长igg抗体)。将前述表达载体转化至宿主细胞中,即可得本发明优选的重组表达转化体。其中所述转化方法为本领域常规转化方法,较佳地为化学转化法,热激法或电转法。
31.本发明另一方面提供了上述的结合人cd38的抗体或其抗原结合片段的方法,其特征在于,所述方法包括以下步骤:
32.a)在表达条件下,培养上述的宿主细胞,从而表达所述的结合人cd38的抗体或其抗原结合片段;
33.b)分离并纯化a)所述的结合人cd38的抗体或其抗原结合片段。
34.本发明所述的宿主细胞的培养方法、所述抗体的分离和纯化方法为本领域常规方法,具体操作方法请参考相应的细胞培养技术手册以及抗体分离纯化技术手册。本发明中公开的结合人cd38的抗体或其抗原结合片段的制备方法包括:在表达条件下,培养上述的
宿主细胞,从而表达所述的结合人cd38的抗体或其抗原结合片段;分离和纯化所述的所述的结合人cd38的抗体或其抗原结合片段。利用上述方法,可以将重组蛋白纯化为基本均一的物质,例如在sds-page电泳上为单一条带。
35.可以利用亲和层析的方法对本发明公开的所述的结合人cd38的抗体或其抗原结合片段进行分离纯化,根据所利用的亲和柱的特性,可以使用常规的方法例如高盐缓冲液、改变ph等方法洗脱结合在亲和柱上的所述的结合人cd38的抗体或其抗原结合片段。本发明的发明人对所得所述的结合人cd38的抗体或其抗原结合片段进行了检测实验,实验结果表明该所述的结合人cd38的抗体或其抗原结合片段能很好地与抗原结合,具有较高的亲和力。
36.本发明另一方面提供了一种组合物,所述组合物含有上述的结合人cd38的抗体或其抗原结合片段和药学上可接受的载体。
37.本发明提供的结合人cd38的抗体或其抗原结合片段,可以和药学上可以接受的载体一起组成药物制剂组合物从而更稳定地发挥疗效,这些制剂可以保证本发明公开的结合人cd38的抗体或其抗原结合片段的构像完整性,同时还保护蛋白质的多官能团防止其降解(包括但不限于凝聚、脱氨或氧化)。通常情况下,对于液体制剂,通常可以在2℃-8℃条件下保存至少稳定一年,对于冻干制剂,在30℃至少六个月保持稳定。所述双特异性抗体制剂可为制药领域常用的混悬、水针、冻干等制剂。
38.对于本发明公开的结合人cd38的抗体或其抗原结合片段水针或冻干制剂,药学上可以接受的载体较佳地包括但不限于:表面活性剂、溶液稳定剂、等渗调节剂和缓冲液之一或其组合。其中表面活性剂较佳地包括但不限于:非离子型表面活性剂如聚氧乙烯山梨醇脂肪酸酯(吐温20或80);poloxamer(如poloxamer188);triton;十二烷基硫酸钠(sds);月桂硫酸钠;十四烷基、亚油基或十八烷基肌氨酸;pluronics;monaquattm等,其加入量应使结合人cd38的抗体或其抗原结合片段的颗粒化趋势最小。溶液稳定剂较佳地包括但不限于以下列举之一或其组合:糖类,例如,还原性糖和非还原性糖;氨基酸类,例如,谷氨酸单钠或组氨酸;醇类,例如:三元醇、高级糖醇、丙二醇、聚乙二醇等,溶液稳定剂的加入量应该使最后形成的制剂在本领域的技术人员认为达到稳定的时间内保持稳定状态。等渗调节剂较佳地包括但不限于氯化钠、甘露醇之一或其组合。缓冲液较佳地包括但不限于:tris、组氨酸缓冲液、磷酸盐缓冲液之一或其组合。
39.本发明另一方面提供了上述的结合人cd38的抗体或药物组合物在制备治疗多发性骨髓瘤、白血病、b淋巴细胞瘤、自身免疫性疾病药物中的应用。作为优选的方案,所述自身免疫性疾病选自系统性红斑狼疮、自身免疫性溶血性贫血、免疫性血小板减少性紫癜和重症肌无力。
40.本发明结合人cd38的抗体或其抗原结合片段及其组合物在对包括人在内的动物给药时,给药剂量因病人的年龄和体重,疾病特性和严重性,以及给药途径而异,可以参考动物实验的结果和种种情况,总给药量不能超过一定范围。具体讲静脉注射的剂量是1-1800mg/天。
41.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
42.本发明所用试剂和原料均市售可得。
43.本发明的积极进步效果在于:
44.目前临床上亟待开发新型、特异、高效的cd38强表达疾病的治疗药,从而能够改善患有此类疾病人群的生活质量,为患者提供更多、更有效的治疗方案。本发明的50g12-humanized对人cd38具有很高的亲和力,能够有效地中和人cd38,与细胞膜表面相应抗原结合后能够诱导细胞凋亡,延长受试动物的生存时间,具有良好的临床应用前景。
附图说明
45.图1:鼠源抗体对靶抗原人cd38-fc的结合活性
46.图2:鼠源抗体阻断cd38环化酶活性
47.图3a:鼠源抗体对重组高表达细胞系chos-cd38细胞的结合活性
48.图3b:鼠源抗体对肿瘤细胞系dnd-41细胞的结合活性
49.图4a:鼠源抗体在chos-cd38细胞上的cdc活性
50.图4b:鼠源抗体在raji细胞上的cdc活性
51.图4c:鼠源抗体在dnd-41细胞上的cdc活性
52.图4d:鼠源抗体在ramos细胞上的cdc活性
53.图4e:鼠源抗体在daudi细胞上的cdc活性
54.图5:人源化抗体50g12-humanized对daudi细胞的结合活性
55.图6:人源化抗体50g12-humanized抑制人cd38环化酶活性
56.图7:人源化抗体50g12-humanized的adcc活性
57.图8a:人源化抗体50g12-humanized在daudi细胞上的cdc活性
58.图8b:人源化抗体50g12-humanized在dnd-41细胞上的cdc活性
59.图9:人源化抗体50g12-humanized诱导细胞凋亡的能力
60.图10:人源化抗体50g12-humanized在ramos淋巴瘤动物模型上的抗肿瘤活性
具体实施方式
61.以下实施例是对本发明进行进一步的说明,不应理解为是对本发明的限制。实施例不包括对传统方法的详细描述,如那些用于构建载体和质粒的方法,将编码蛋白的基因插入到这样的载体和质粒的方法或将质粒引入宿主细胞的方法.这样的方法对本领域中具有普通技术的人员是众所周知的,并且在许多出版物中都有所描述,包括sambrook,j.,fritsch,e.f.and maniais,t.(1989)molecular cloning:a laboratory manual,2
nd edition,cold spring harbor laboratory press.
62.以下实施例中使用的实验材料和来源以及实验试剂的配制方法具体说明如下。
63.实验材料:
64.cho-s细胞:购自thermo fisher scientific。
65.重组细胞系chos-cd38:将人全长cd38稳定转染到cho-s细胞中,通过克隆筛选获得稳定表达cd38的单克隆细胞株。
66.raji细胞:购自atcc,ccl-86。
67.小鼠骨髓瘤细胞sp2/0:购自atcc,货号crl-1581。
68.balb/c小鼠:购自上海灵畅生物科技有限公司。
69.cb-17scid小鼠:购自上海灵畅生物科技有限公司。
70.ramos细胞:购自atcc,货号crl-1596。
71.daudi细胞:购自atcc,货号ccl-213。
72.dnd-41细胞:购自丰晖生物。
73.人外周血单个核细胞pbmc:购自澳赛尔斯生物技术(上海)有限公司。
74.逆转录试剂盒:购自takara。
75.羊抗鼠二抗:购自millipore,货号ap181p。
76.驴抗鼠pe荧光二抗:购自jackson,货号715-116-150。
77.羊抗人pe荧光二抗:购自jackson,货号109-115-098
78.f16black maxisorp plate:购自nunc,货号475515。
79.实验试剂:
80.pbs缓冲液:上海生工生物工程股份有限公司,货号b548117-0500。
81.sfm培养基:购自thermo fisher scientific公司,货号12045-076。
82.tmb:购自bd公司,货号555214。
83.ngd:购自sigma,货号n5131-25mg。
84.牛血清白蛋白(bsa):购自fetal bovine serum。
85.β-巯基乙醇、胎牛血清、谷氨酰胺、丙酮酸钠、mem-neaa、1%penicillin-streptomycin均购自gibco公司。
86.无酚红rpmi-1640:购自gibco,货号11835055。
87.cytotox 96non-radioactive cytotoxicity assay反应液:购自promega,货号:g1780。
88.hat:购自sigma-alhrich,货号h0262-10vl。
89.cck-8:购自同仁化学,货号ck04。
90.trizol:购自thermo fisher scientific,货号15596018。
91.实验仪器:
92.电融合仪:购自btx。
93.流式细胞仪上(cytoflex cytometer system):购自beckman coulter)。
94.实施例1阳性对照抗体的制备
95.本发明实施例中所述的daratumumab的重链和轻链可变区氨基酸序列来自《who drug information,vol.24,no.1,2010》,即本发明的seq id no 19和20。本发明实施例中所述的isatuximab的重链和轻链可变区氨基酸序列来自《who drug information,vol.29,no.3,2015》,即本发明的seq id no 21和22。
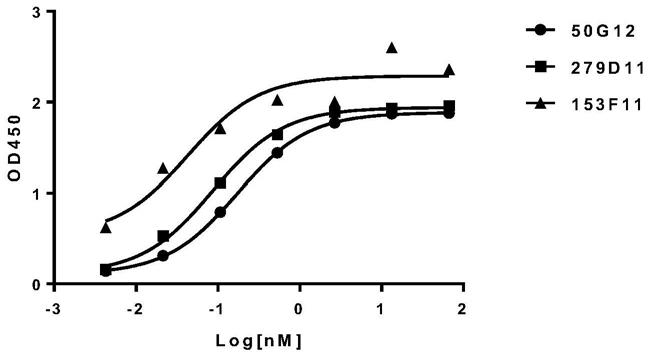
96.由上海生工生物工程有限公司合成上述重链可变区和轻链可变区的dna。将合成的daratumumab重链可变区基因与人igg1重链恒定区基因相连,获得全长的重链基因,命名为daratumumab-hc-igg1;将daratumumab轻链可变区基因与人kappa链恒定区基因相连,获得全长的轻链基因,命名为daratumumab-lc。将daratumumab-hc-igg1和daratumumab-lc基因分别构建到pcdna4表达载体中,利用pei转染法将所得重链和轻链表达载体一起转入hek293f细胞中以表达抗体,hek293f细胞用free style 293expression medium培养。转染后的hek293f细胞置于co2振荡培养箱中培养5天,离心收集细胞上清,利用protein a亲和
层析法纯化上清中的抗体,所得抗体命名为daratumumab。此外,用相似的实验方法获得抗体isatuximab。
97.人cd38胞外段序列信息来源于https://www.uniprot.org/uniprot/p28907。由上海生工生物工程有限公司合成cd38胞外段的dna,将重组基因构建到pcdna4表达载体中。his标签融合表达的重组蛋白利用金属螯合亲和层析柱对培养上清中的重组蛋白进行一步纯化;fc标签融合表达的重组蛋白用proteina/g亲和层析柱进行一步纯化。最终所得蛋白命名为cd38-his/cd38-fc。
98.实施例2抗原免疫动物以及杂交瘤的制备和筛选
99.步骤1:抗原免疫小鼠
100.用重组过表达细胞系chos-cd38或肿瘤细胞系raji细胞常规腹腔免疫balb/c小鼠。第一天,用弗氏完全佐剂100μl对balb/c小鼠进行腹腔注射;第二天,用重组细胞系chos-cd38或raji细胞腹腔免疫balb/c小鼠,5*106细胞/只小鼠;第十四天,用重组细胞系chos-cd38或raji细胞腹腔加强免疫balb/c小鼠,5*106细胞/只小鼠,在第三十六天,用重组细胞系chos-cd38或raji细胞同上次一样加强免疫小鼠,三周以后腹腔内注射cd38-his抗原蛋白激发,3-4天后,取小鼠脾脏进行细胞融合实验。
101.步骤2:杂交瘤的制备和筛选
102.在小鼠末次免疫后3-4天,使用常规的杂交瘤技术方案,将小鼠脾细胞与小鼠骨髓瘤细胞sp2/0通过电融合仪进行电融合。融合后的细胞在完全培养基中悬浮均匀,完全培养基为将rpmi1640和dmem f12培养基1:1混匀后加入1%的glutmine(谷氨酰胺),1%sodium pyruvate(丙酮酸钠),1%mem-neaa(最小基本培养基-非必需氨基酸溶液),1%penicillin-streptomycin(青霉素-链霉素),50μm的β-巯基乙醇及20%fbs(胎牛血清)组成的培养基。融合后的细胞按105个细胞/100μl/孔,分入共36块96孔培养板中培养过夜,次日,每孔加入100μl孔含有2
×
hat的完全培养基,使96孔板内培养液为200μl/孔(含1
×
hat)。在7-12天后,收获上清液,通过cell based elisa方法筛选人cd38结合活性阳性的杂交瘤孔。
103.其中,cell based elisa方法筛选人cd38结合活性阳性的杂交瘤孔的方法如下:将重组细胞系chos-cd38以pbs缓冲液稀释至2*106细胞/ml,100μl/孔加入细胞培养板中,37℃培养过夜。次日甩掉上清,加入100μl/孔细胞固定液室温固定一小时,然后甩掉上清加入5%脱脂奶粉37℃封闭2小时,pbst洗板1次待用。将收取的杂交瘤上清液依次加入封闭后的板中,100μl/孔,37℃放置1h。pbst洗板3次,加入hrp标记的羊抗鼠igg二抗,37℃放置30min;pbst洗板5次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb,室温(20
±
5℃)避光放置5min;每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,分析待测抗体与靶抗原cd38结合能力。通过筛选共计拿到30株杂交瘤细胞株。在含血清完全培养基中扩增筛选获得的30株杂交瘤细胞株,离心换液至无血清培养液sfm培养基,使细胞密度为1~2
×
107/ml,在8%co2、37℃条件下培养1周,离心获取培养上清,通过protein g亲和层析进行纯化,得到3株抗人cd38单克隆抗体蛋白,分别命名为50g12、279d11、153f11,其中50g12为最优活性抗体。
104.实施例3鼠源抗体50g12对人cd38-fc蛋白的结合能力
105.间接酶联免疫吸附测定法(elisa)测定鼠源抗体对人cd38-fc蛋白的结合能力。具
体方法如下:
106.cd38-fc蛋白以包被液(50mm的碳酸盐包被缓冲液,ph 9.6)稀释至1μg/ml包板4℃,过夜;再用5%的脱脂奶粉封闭,37℃孵育2小时;pbst洗板3次后,将实验室制备的抗人cd38抗体50g12蛋白以1%bsa缓冲液梯度稀释,100μl/孔加入预包被的cd38-fc的板子中,37℃孵育一小时;pbst洗板3次,加入hrp标记的羊抗鼠igg二抗,37℃放置30min;pbst洗板3次后,在吸水纸上尽量拍干残留液滴,每孔加入100μl的tmb,室温(20
±
5℃)避光放置5min,每孔加入50μl 2m h2so4终止液终止底物反应,酶标仪450nm处读取od值,分析待测抗体与靶抗原人cd38-fc的结合能力,结果如图1所示。
107.由图1可知,鼠源抗体50g12、279d11、153f11与靶抗原cd38-fc都有很好的结合活性,50g12结合活性最优,ec
50
为0.1727nm。
108.实施例4鼠源抗体抑制cd38酶活性的能力
109.cd38是一种酶,可以催化烟酰胺鸟嘌呤二核苷酸(ngd)转化为环状gdp核糖(cyclic gdp-ribose),后者能够激发出荧光。在此用荧光法测定了鼠源抗体50g12、279d11、153f11与对照抗体daratumumab、isatuximab、igg control对cd38酶活性的抑制作用。具体方法如下:
110.待测鼠源抗体50g12、279d11、153f11与对照抗体daratumumab、isatuximab、igg control用tris-hcl稀释至600μg/ml,并按照3倍进行梯度稀释,共10孔;cd38-his抗原用tris-hcl稀释至5μg/ml,将抗原与样品抗体等体积加入反应板中,各50μl,振摇10min,37℃孵育30min。设置背景孔:(1)稀释液孔:200μl稀释液;(2)ngd孔:100μl稀释液;(3)抗原孔:50μl抗原,150μl稀释液。孵育完成后,ngd用tris-hcl稀释至250μg/ml,除稀释液孔与抗原孔外,每孔100μl,振摇5min,37℃孵育90min。用多功能酶标仪在ex:300,em:410读板,收集并处理数据,结果如图2所示。
111.由图2可知,只有鼠源抗体50g12和isatuximab能有效阻断cd38环化酶活性。
112.实施例5鼠源抗体对重组高表达细胞系chos-cd38细胞和肿瘤细胞系dnd-41细胞的结合能力
113.采用流式细胞术检测鼠源抗体对重组高表达细胞系chos-cd38细胞和肿瘤细胞系dnd-41细胞的结合活性,具体方法如下:
114.分别收集细胞chos-cd38和dnd-41细胞,离心去除细胞培养液,用pbs缓冲液洗2遍;计数并用1%bsa facs缓冲液稀释至2*106细胞/ml,铺细胞至96孔圆底板中待用;待测抗体以1%bsa缓冲液稀释8个梯度加入到上述细胞圆底板中,4℃孵育1小时;离心后,甩掉上清,用1%bsa facs缓冲液洗涤3遍,按1:300比例(详见荧光二抗说明书)每孔加入100μl的驴抗鼠pe荧光二抗或羊抗人pe荧光二抗,4℃,孵育1小时;1%bsa facs缓冲液洗涤3遍,再用1%bsa facs缓冲液重悬,200μl/孔,使用facscalibur bd来测定分析样品,所示抗体结合细胞结果见图3a、图3b。
115.由图3a、图3b可知,鼠源抗体50g12、279d11、153f11在chos-cd38和dnd-41细胞上都有很好的结合活性。在chos-cd38细胞上,ec
50
分别为686.9ng/ml,84.9ng/ml,488.9ng/ml;在dnd-41细胞上,分别为133.8ng/ml,84.44ng/ml,96.89ng/ml。
116.实施例6鼠源抗体cdc活性测定
117.特异性抗体与细胞膜表面相应抗原结合后能够激活补体经典途径,从而形成的攻
膜复合物裂解靶细胞,这叫做cdc作用。我们分别在chos-cd38、raji、dnd-41、ramos、daudi细胞上测定了cdc活性,具体方法如下:
118.以细胞培养基作为缓冲液将抗人cd38单抗稀释至起始浓度20μg/ml,然后以3倍浓度梯度进行稀释,共获得8个浓度的稀释液。将表达cd38的靶细胞(daudi细胞等)计数后重悬至3*105个细胞/ml。将100μl抗人cd38单抗的各种浓度稀释液和80μl高表达cd38的靶细胞预先孵育15min,然后加入20μl 50%的新鲜人血清(志愿者捐赠)混匀。阳性对照孔为单独靶细胞加血清、阴性对照孔为无细胞的培养基。培养箱中孵育12-18h,加入20μl cck-8,4h后使用酶标仪在450nm处测定吸光值,根据450nm处的读数计算杀伤率。杀伤率计算公式为:
119.杀伤率(killing%)=(阳性对照吸光值-实验组吸光值)/(阳性对照吸光值-阴性对照吸光值)*100。
120.结果如图4a、图4b、图4c、图4d、图4e所示,在不同细胞模型上,鼠源抗体50g12和279d11都有很强的cdc活性,153f11相对较弱。
121.实施例7鼠源抗人cd38单克隆抗体的人源化
122.步骤1:鼠源抗人cd38单克隆抗体可变区序列的确定
123.使用trizol从50g12杂交瘤单克隆细胞株中提取总rna,用逆转录试剂盒将mrna逆转录成cdna,通过文献报道的组合引物(《antibody engineering》volume 1,edited by roland kontermann and stefan d
ü
bel,组合引物的序列来自第323页)用pcr扩增50g12的轻链可变区和重链可变区基因,然后将pcr产物克隆入pmd18-t载体,测序并分析可变区基因序列。鼠源抗体50g12可变区序列信息如下:重链可变区基因序列全长357bp,编码119个氨基酸残基,核苷酸序列如seq id no:13所示,氨基酸序列如seq id no:7所示;轻链可变区基因序列全长321bp,编码107个氨基酸残基,核苷酸序列如seq id no:14所示,氨基酸序列如seq id no:8所示。
124.步骤2:鼠源抗人cd38单克隆抗体的人源化
125.通对鼠源抗体50g12抗体的重链可变区和轻链可变区氨基酸序列进行分析,依据kabat规则分别确定鼠源抗体50g12单抗重链和轻链的抗原互补决定区(cdr)和框架区(fr)。鼠源抗体50g12抗体重链cdr的氨基酸序列为h-cdr1:seq id no:1、h-cdr2:seq id no:2和h-cdr3:seq id no:3,轻链cdr的氨基酸序列为l-cdr1:seq id no:4、l-cdr2:seq id no:5和l-cdr3:seq id no:6。
126.在https://www.ncbi.nlm.nih.gov/igblast/,将鼠源50g12单抗的重链可变区与人igg胚系序列进行同源性比较,选择ighv1-46*01为重链cdr移植模板,将鼠源抗体50g12的重链cdr移植入ighv1-46*01骨架区,并在h-cdr3之后加入wgqgtlvtvss作为第四个框架区,获得cdr移植重链可变区序列。同样地,将鼠源抗体50g12的轻链可变区与人igg胚系序列同源性比较,选择igkv1-39*01为轻链cdr移植模板,将鼠源抗体50g12的轻链cdr移植入igkv1-39*01的骨架区,并在l-cdr3之后加入fgqgtkveik作为第四个框架区,获得cdr移植轻链可变区序列。在cdr移植可变区的基础上,对一些框架区的氨基酸位点进行回复突变。回复突变就是将cdr移植可变区的框架区内的某些氨基酸(对维持抗体结构和亲和力比较重要的氨基酸)突变成鼠源框架区对应位置上的氨基酸。
127.在进行突变时,将氨基酸序列进行kabat编码,位点的位置由kabat码指示。优选
的,对于cdr移植重链可变区,根据kabat编码,将第30位的t突变为n,将第69位的m突变为l,将第71位的r突变为a,将第73位的t突变为k。对于cdr移植轻链可变区,将第47位的l突变为w,将第48位的i突变为m,将第71位的f突变为y。上述带有突变位点的重链可变区和轻链可变区分别定义为人源化的重链可变区和轻链可变区,分别命名为50g12-hu-vh和50g12-hu-vl,50g12-hu-vh的氨基酸序列为seq id no:9,50g12-hu-vl的氨基酸序列为seq id no:10。
128.由上海生工生物工程有限公司合成编码上述人源化的重链和轻链可变区的dna。将合成的人源化重链可变区dna与人igg1重链恒定区dna相连,获得全长的人源化重链dna,命名为50g12-hu-hc,人源化重链可变区dna序列如seq id no:15所示,全长的人源化重链dna序列如seq id no:17所示;将人源化轻链可变区dna与人kappa链恒定区dna相连,获得全长的人源化轻链dna,命名为50g12-hu-lc,人源化轻链可变区dna序列如seq id no:16所示,全长的人源化轻链dna序列如seq id no:18所示。将50g12-hu-hc和50g12-hu-lc基因分别构建到pcdna4表达载体中,利用上述实施例中描述的方法表达并纯化抗体,其重链氨基酸序列如seq id no:11所示,轻链氨基酸序列如seq id no:12所示,所得抗体命名为50g12-humanized。
129.另外,将鼠源抗体50g12重链可变区与人igg1重链恒定区相连,获得嵌合重链基因,命名为50g12-chi-hc;将鼠源50g12轻链可变区与人kappa链恒定区相连,获得嵌合轻链基因,命名为50g12-chi-lc。将50g12-chi-hc和50g12-chi-lc基因分别构建到pcdna4表达载体中,利用上述实施例中描述的方法表达并纯化抗体,所得抗体命名为50g12-chimeric。
130.实施例8 50g12-humanized对cd38的结合能力
131.用流式细胞法检测50g12-chimeric和50g12-humanized对daudi细胞表面cd38的结合能力。具体方法如下:
132.计数daudi细胞后,用含有1%bsa的pbs溶液接种至96孔圆底培养板中,每孔2
×
105个细胞;在上述96孔板中加入50μl用pbs溶液梯度稀释的抗cd38抗体;置于室温孵育1小时,然后离心弃上清,再用pbs洗涤细胞两遍;加入用fitc标记的羊抗人(fc-speicific)抗体(用含1%bsa的pbs以1:1000稀释),室温孵育半小时;离心并洗涤细胞后在流式细胞仪上检测fitc通道的平均荧光强度(mean fluorescence intensity,mfi);用流式细胞仪自带软件处理实验数据并计算平均荧光强度;用graphpad prism6进行数据分析和作图,计算ec
50
。
133.结果如图5所示,50g12-chimeric、50g12-humanized、daratumumab和isatuximab均能有效结合daudi细胞,它们的ec
50
分别是0.5285nm、0.6047nm、0.4596nm和0.3234nm。上述结果显示50g12-humanized结合daudi细胞的能力基本相当。其中isotype control为不结合daudi细胞的人igg1抗体。
134.实施例9 50g12-humanized抑制cd38环化酶活性
135.用荧光法测定了50g12-humanized对cd38环化酶活性的抑制作用。具体方法如下:
136.配制ph6.5的50mm mes缓冲液,用mes缓冲液配制200μm的烟酰胺鸟嘌呤二核苷酸(ngd)溶液;用mes缓冲液将cd38-his稀释到2μg/ml,然后再加入终浓度为10μg/ml的抗cd38抗体;在f16black maxisorp plate中加入50μl ngd溶液,然后再加入50μl含有cd38-his和抗cd38抗体的溶液;用多功能酶标仪spectramax m5在动态模式(kinetic mode)下读取荧
光值(relative fluorescence unit,rfu),激发和发射波长分别设定在300nm和410nm;用graphpad prism6进行数据分析和作图。
137.结果如图6所示,50g12-humanized、daratumumab和isatuximab均能有效抑制cd38-his的酶活性,它们的斜率分别为155931、331046和93316,斜率越小说明抑制作用越强,所以三者抑制cd38环化酶活性由强到弱的顺序为isatuximab、50g12-humanized和daratumumab。
138.实施例10 50g12-humanized adcc活性测定
139.抗体的fab段结合细胞表面的抗原表位,其fc段与效应细胞(nk细胞、巨噬细胞等)表面的fc受体结合,能够介导效应细胞直接杀伤靶细胞,这就是adcc作用。在此测定了抗cd38抗体的adcc活性。具体方法如下:
140.在无酚红rpmi-1640中加入2%的胎牛血清;用该培养基将靶细胞daudi细胞和人外周血单个核细胞(peripheral blood mononuclear cell,pbmc)按照1:25的比例混匀,接种到圆底96孔板中,每孔150μl,最终使每孔含有2
×
104个daudi细胞和5
×
105个pbmc;加入50μl梯度稀释的抗cd38抗体;置于37℃、5%co2细胞培养箱中孵育过夜;取50μl细胞培养上清,加入50μl cytotox 96non-radioactive cytotoxicity assay反应液,30min后加入终止液终止反应,酶标仪读od490;用graphpad prism6进行数据分析和作图,计算ec
50
。
141.结果如图7所示,50g12-humanized、daratumumab和isatuximab均能有效杀伤靶细胞,它们的ec
50
分别为0.1058nm、0.08876nm和0.0694nm,三者的adcc活性基本相当。
142.实施例11 50g12-humanized cdc活性测定
143.在daudi、dnd-41细胞模型测定人源化抗体50g12-humanized cdc活性。详细实验方法如下:以细胞培养基作为缓冲液将抗人cd38单抗稀释至起始浓度20μg/ml,然后以3倍浓度梯度进行稀释,共获得8个浓度的稀释液。将表达cd38的靶细胞(daudi细胞等)计数后重悬至3*105个细胞/ml。将100μl抗人cd38单抗的各种浓度稀释液和80μl高表达cd38的靶细胞预先孵育15min,然后加入20μl 50%的新鲜人血清(志愿者捐赠)混匀。阳性对照孔为单独靶细胞加血清、阴性对照孔为无细胞的培养基。培养箱中孵育12-18h,加入20μl cck-8,4h后使用酶标仪在450nm处测定吸光值,根据450nm处的读数计算杀伤率。杀伤率计算公式为:
144.杀伤率(killing%)=(阳性对照吸光值-实验组吸光值)/(阳性对照吸光值-阴性对照吸光值)*100。
145.实验结果如图8a、8b所示,在daudi细胞模型上,人源化抗体50g12-humanized cdc活性与daratumumab和isatuximab相当;在dnd-41细胞模型上,人源化抗体50g12-humanized cdc活性优于daratumumab和isatuximab。
146.实施例12 50g12-humanized诱导细胞凋亡的能力
147.抗cd38抗体与细胞膜表面相应抗原结合后能够诱导细胞凋亡(deckert j,wetzel m,bartle l m,et al.sar650984,a novel humanized cd38-targeting antibody,demonstrates potent antitumor activity in models of multiple myeloma and other cd38 hematologic malignancies[j].clinical cancer research,2014,20(17):4574-4583.)。在凋亡细胞中,膜磷脂磷脂酰丝氨酸(phosphatidylserine,ps)从细胞膜内侧转移到外侧,从而使ps暴露于外部细胞环境。annexin v是一种35-36kda钙离子依赖性磷
脂结合蛋白,对ps具有高亲和力,能与暴露的ps结合。在此用fitc标记的annexin v凋亡检测试剂盒测定了抗cd38抗体诱导细胞凋亡的活性。具体方法如下:
[0148]
在rpmi-1640中加入2%的胎牛血清;用该培养基将daudi细胞接种到96孔板中,每孔1
×
105个细胞/150μl;加入50μl梯度稀释的抗cd38抗体;置于37℃、5%co2细胞培养箱中孵育24h;用fitc标记的annexin v凋亡检测试剂盒对凋亡细胞进行染色;离心并洗涤细胞后在流式细胞仪上检测fitc通道的平均荧光强度;用流式细胞仪自带软件处理实验数据并计算染色细胞占总细胞的比例;用graphpad prism6进行数据分析和作图,计算ec
50
。
[0149]
结果如图9所示,50g12-humanized、daratumumab和isatuximab均能有效诱导细胞凋亡,它们的ec
50
分别为0.5675nm、0.3059nm和0.302nm。尽管三者的ec
50
基本相当,但是50g12-humanized、daratumumab和isatuximab最高能够诱导发生凋亡的细胞比例分别为28.4%、13.4%和49.0%。因此,所以三者诱导细胞凋亡的能力由强到弱的顺序为isatuximab、50g12-humanized和daratumumab。
[0150]
实施例13 50g12-humanized体内药效评价
[0151]
在人ramos淋巴瘤细胞系cb-17scid小鼠移植瘤模型上验证抗cd38人源化抗体50g12-humanized的体内抗肿瘤活性。具体方法如下:
[0152]
体外培养ramos细胞,收获后调整细胞浓度至5
×
107个/ml,通过尾静脉注射的方法,接种200μl/只细胞悬液到雌性cb-17scid小鼠体内,建立移植瘤模型。接种后第7天,将小鼠随机分为对照组,daratumumab治疗组,isatuximab治疗组和50g12-humanized治疗组,每组10只小鼠。按照抗体40mg/kg的剂量开始给药治疗,每周给药两次,连续给药三周。观察荷瘤小鼠的生存时间。以荷瘤小鼠的单侧后肢或双侧后肢瘫痪,或体重下降超过20%,或严重身体状况差导致不能自由采食和饮水为动物人道主义终点,安乐死受试动物,记录生存时间。结果如图10显示,对照组的中位生存时间为25天,与对照组相比,50g12-humanized和阳性对照抗体daratumumab,isatuximab均能够显著延长受试动物的生存时间,中位生存时间分别为38天,35.5天和38.5天。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。