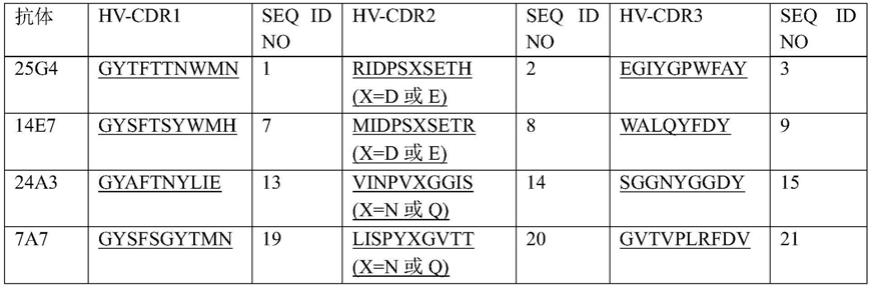
抗pd-l2抗体
技术领域
1.本发明属于生物技术领域,具体涉及特异性结合pd-l2的抗体和其抗原结合片段,并且涉及使用这类抗体和抗原结合片段的方法。
背景技术:
2.肿瘤免疫治疗是一种重要的抗肿瘤治疗手段,其核心是激活肿瘤患者t淋巴细胞的抗肿瘤反应,提高其对肿瘤细胞的杀伤功能。程序性死亡受体1(pd-1)是在免疫细胞(包括t细胞和b细胞)上表达的蛋白受体,具有两个配体,分别是程序性死亡-1配体1(pd-l1,b7-h1或cd274)和程序性死亡-1配体2(pd-l2,b7-dc或cd273),pd-1与配体结合后可以传导抑制信号,负调节t细胞免疫应答,抑制tcr介导的t细胞活化、细胞因子产生和t细胞增殖。因而,pd-1/pd-l1和pd-1/pd-l2信号通路在肿瘤免疫逃逸中的作用及肿瘤免疫治疗中的应用成为研究热点。
3.pd-l2和pd-l1都是由igv样结构域、igc样结构域、跨膜区和尾部胞质区组成的i型跨膜蛋白,编码人pd-l2和pd-l1的基因均定位于染色体9p24.2,但pd-l2和pd-l1的序列、组织分布、受体-配体结合特异性和亲和力以及参与的信号通路都表现出较大的差异。pd-l1在淋巴和非淋巴组织中的白细胞和非造血细胞以及各种癌细胞上广泛分布,在肿瘤发生时pd-l1上调;pd-l2一般在抗原呈递细胞上表达,包括树突状细胞,巨噬细胞和骨髓衍生的肥大细胞(zhong等(2007)eur.j.immunol 37:2405-2410)。在特定微环境的刺激下,pd-l2在多种免疫细胞和非免疫细胞中均可被诱导表达,例如头颈部鳞状细胞癌、乳腺癌、胃癌等肿瘤细胞(zou等(2015)nat rev immunol 8:467-477)。说明阻断pd-1/pd-l2相互作用,亦能增强肿瘤特异性t细胞免疫性,帮助免疫系统清除肿瘤细胞。更重要的是,在多种不表达或低表达pd-l1的人类肿瘤样本中,检测到pd-l2的高表达(baptista等(2016)human pathology 47:78-84;yearley等(2017)clin cancer research 23:3158-3167)。此外,在172例接受keytruda治疗的复发或转移性颈部鳞状细胞癌患者中,pd-l1和pd-l2均表达为阳性患者的orr为27.5%,而pd-l1阳性pd-l2阴性患者的orr仅为11.4%,前者是后者的2倍(yearley等(2017)clin cancer research 23:3158-3167),说明同时抑制pd-l1和pd-l2可能会提高临床应答率,同时pd-l2可以作为预测pd-1抑制剂临床疗效的补充指标。
4.自2010年以来,多种针对pd-1或pd-l1的抗体已进入临床试验或获得上市批准,这些抗体在体外和体内均显示出显著的抗肿瘤活性,如pembrolizumab,atezolizumab,durvalumab,但到目前为止还没有针对pd-l2的抗体药物进入临床研究。因此,研制一种与人pd-l2特异性结合的治疗性抗体具有重要的意义。此外,pd-l2作为一种分子标志物在各种肿瘤的靶向治疗和预后诊断中发挥着重要的作用,因此有必要制备一种高特异性结合人pd-l2的单克隆抗体,来指导肿瘤的诊断和治疗。
技术实现要素:
5.一方面,本发明提供一种分离的抗体或其抗原结合片段,其特异性结合程序性死
亡-1配体2(pd-l2)。在一些实施方案中,本发明的分离的抗体或其抗原结合片段是鼠类抗体、嵌合抗体、人源化抗体或人抗体。在一些实施方案中,本发明的分离的抗体或其抗原结合片段是单克隆抗体、fab片段、f(ab')2片段、fd片段、fv片段、dab、分离的cdr、单链fv分子,以及重组多肽、融合蛋白、双特异性分子或其组合。在一些实施方案中,本发明的分离的抗体或其抗原结合片段结合人pd-l2;在另一些实施方案中,本发明的分离的抗体或其抗原结合片段结合人pd-l2并结合食蟹猴(cynomolgous)pd-l2。在另一个实施方案中,本发明的分离的抗体或其抗原结合片段阻断pd-l2与其受体pd-1的结合。
6.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链cdr1,重链cdr2和重链cdr3,其中,(1)重链cdr1,重链cdr2和重链cdr3分别包含seq id nos:1,2,3所示的氨基酸序列或与seq id nos:1,2,3所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(2)重链cdr1,重链cdr2和重链cdr3分别包含seq id nos:7,8,9所示的氨基酸序列或与seq id nos:7,8,9所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(3)重链cdr1,重链cdr2和重链cdr3分别包含seq id nos:13,14,15所示的氨基酸序列或与seq id nos:13,14,15所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;或(4)重链cdr1,重链cdr2和重链cdr3分别包含seq id nos:19,20,21所示的氨基酸序列或与seq id nos:19,20,21所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;
7.其中,seq id no:2的氨基酸序列是ridpsxseth,x=d或e;seq id no:8的氨基酸序列是midpsxsetr,x=d或e;seq id no:14的氨基酸序列是vinpvxggis,x=n或q;seq id no:20的氨基酸序列是lispyxgvtt,x=n或q。
8.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含轻链cdr1,轻链cdr2和轻链cdr3,其中,(1)轻链cdr1,轻链cdr2和轻链cdr3分别包含seq id nos:4,5,6所示的氨基酸序列或与seq id nos:4,5,6所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(2)轻链cdr1,轻链cdr2和轻链cdr3分别包含seq id nos:10,11,12所示的氨基酸序列或与seq id nos:10,11,12所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(3)轻链cdr1,轻链cdr2和轻链cdr3分别包含seq id nos:16,17,18所示的氨基酸序列或与seq id nos:16,17,18所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;或(4)轻链cdr1,轻链cdr2和轻链cdr3分别包含seq id nos:22,23,24所示的氨基酸序列或与seq id nos:22,23,24所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;
9.其中,seq id no:22的氨基酸序列是kssqsllxsgnqknylt,x=n或q。
10.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链cdr1,重链cdr2和重链cdr3,和轻链cdr1,轻链cdr2和轻链cdr3,其中重链cdr1包含seq id nos:1,7,13,或19所示的氨基酸序列或与seq id nos:1,7,13,或19所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;重链cdr2包含seq id nos:2,8,14,或20所示的氨基酸序列或与seq id nos:2,8,14,或20所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;重链cdr3包含seq id nos:3,9,15,或21所示的氨基酸序列或与seq id nos:3,9,15,或21所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;和轻链cdr1包含seq id nos:4,10,16,或22所示的氨基酸序列或与seq id nos:4,10,16,或22所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;轻链cdr2包含seq id nos:5,11,17,或23所示的氨基酸序列或与seq id nos:5,11,17,或23所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;轻链cdr3包含seq id nos:6,12,18,或24所示的氨基酸序列或与seq id nos:6,12,18,或24所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;
11.其中,seq id no:2的氨基酸序列是ridpsxseth,x=d或e;seq id no:8的氨基酸序列是midpsxsetr,x=d或e;seq id no:14的氨基酸序列是vinpvxggis,x=n或q;seq id no:20的氨基酸序列是lispyxgvtt,x=n或q;seq id no:22的氨基酸序列是kssqsllxsgnqknylt,x=n或q。
12.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链cdr1,重链cdr2和重链cdr3,和轻链cdr1,轻链cdr2和轻链cdr3,其中重链cdr1,重链cdr2和重链cdr3分别包含seq id nos:1,2,3所示的氨基酸序列或与seq id nos:1,2,3所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;并且,轻链cdr1,轻链cdr2和轻链cdr3分别包含seq id nos:4,5,6所示的氨基酸序列或与seq id nos:4,5,6所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;
13.其中,seq id no:2的氨基酸序列是ridpsxseth,x=d或e。
14.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链cdr1,重链cdr2和重链cdr3,和轻链cdr1,轻链cdr2和轻链cdr3,其中重链cdr1,重链cdr2和重链cdr3分别包含seq id nos:7,8,9所示的氨基酸序列或与seq id nos:7,8,9所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、
91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;并且,轻链cdr1,轻链cdr2和轻链cdr3分别包含seq id nos:10,11,12所示的氨基酸序列或与seq id nos:10,11,12所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;
15.其中,seq id no:8的氨基酸序列是midpsxsetr,x=d或e。
16.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链cdr1,重链cdr2和重链cdr3,和轻链cdr1,轻链cdr2和轻链cdr3,其中重链cdr1,重链cdr2和重链cdr3分别包含seq id nos:13,14,15所示的氨基酸序列或与seq id nos:13,14,15所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;并且,轻链cdr1,轻链cdr2和轻链cdr3分别包含seq id nos:16,17,18所示的氨基酸序列或与seq id nos:16,17,18所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;
17.其中,seq id no:14的氨基酸序列是vinpvxggis,x=n或q。
18.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链cdr1,重链cdr2和重链cdr3,和轻链cdr1,轻链cdr2和轻链cdr3,其中重链cdr1,重链cdr2和重链cdr3分别包含seq id nos:19,20,21所示的氨基酸序列或与seq id nos:19,20,21所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;并且,轻链cdr1,轻链cdr2和轻链cdr3分别包含seq id nos:22,23,24所示的氨基酸序列或与seq id nos:22,23,24所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;
19.其中,seq id no:20的氨基酸序列是lispyxgvtt,x=n或q;seq id no:22的氨基酸序列是kssqsllxsgnqknylt,x=n或q。
20.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链可变区,所述重链可变区包含seq id nos:25,27,29,31,33,35,36,38,39,41,42,或44所示的氨基酸序列,或与seq id nos:25,27,29,31,33,35,36,38,39,41,42,或44所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
21.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含轻链可变区,所述轻链可变区包含seq id nos:26,28,30,32,34,37,40,43,或45所示的氨基酸序列,或与seq id nos:26,28,30,32,34,37,40,43,或45所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
22.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链可变区和轻链可变区,其中重链可变区包含seq id nos:25,27,29,31,33,35,36,38,
39,41,42,或44所示的氨基酸序列,或与seq id nos:25,27,29,31,33,35,36,38,39,41,42,或44所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;并且,轻链可变区包含seq id nos:26,28,30,32,34,37,40,43,或45所示的氨基酸序列,或与seq id nos:26,28,30,32,34,37,40,43,或45所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
23.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链可变区和轻链可变区,其中,(1)重链可变区和轻链可变区分别包含seq id no:25和26所示的氨基酸序列或与seq id no:25和26所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(2)重链可变区和轻链可变区分别包含seq id no:27和28所示的氨基酸序列或与seq id no:27和28所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(3)重链可变区和轻链可变区分别包含seq id no:29和30所示的氨基酸序列或与seq id no:29和30所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(4)重链可变区和轻链可变区分别包含seq id no:31和32所示的氨基酸序列或与seq id no:31和32所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(5)重链可变区和轻链可变区分别包含seq id no:33和34所示的氨基酸序列或与seq id no:33和34所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(6)重链可变区和轻链可变区分别包含seq id no:35和34所示的氨基酸序列或与seq id no:35和34所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(7)重链可变区和轻链可变区分别包含seq id no:36和37所示的氨基酸序列或与seq id no:36和37所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(8)重链可变区和轻链可变区分别包含seq id no:38和37所示的氨基酸序列或与seq id no:38和37所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(9)重链可变区和轻链可变区分别包含seq id no:39和40所示的氨基酸序列或与seq id no:39和40所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(10)重链可变区和轻链可变区分别包含seq id no:41和40所示的氨基酸序列或与seq id no:41和40所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(11)重链可变区和轻链可变区分别包含seq id no:42和
43所示的氨基酸序列或与seq id no:42和43所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(12)重链可变区和轻链可变区分别包含seq id no:44和43所示的氨基酸序列或与seq id no:44和43所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(13)重链可变区和轻链可变区分别包含seq id no:42和45所示的氨基酸序列或与seq id no:42和45所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;或(14)重链可变区和轻链可变区分别包含seq id no:44和45所示的氨基酸序列或与seq id no:44和45所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
24.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链,所述重链包含seq id nos:46,50,54,58,62,64,68,70,74,76,80,或82所示的氨基酸序列,或与seq id nos:46,50,54,58,62,64,68,70,74,76,80,或82所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
25.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含轻链,所述轻链包含seq id nos:47,51,55,59,63,69,75,81,或83所示的氨基酸序列,或与seq id nos:47,51,55,59,63,69,75,81,或83所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
26.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,并且包含重链和轻链,其中重链包含seq id nos:46,50,54,58,62,64,68,70,74,76,80,或82所示的氨基酸序列,或与seq id nos:46,50,54,58,62,64,68,70,74,76,80,或82所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;并且,轻链包含seq id nos:47,51,55,59,63,69,75,81,或83所示的氨基酸序列,或seq id nos:47,51,55,59,63,69,75,81,或83所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
27.在一个实施方案中,本发明的分离的抗体或其抗原结合片段结合pd-l2,包含重链和轻链,其中,(1)重链和轻链分别包含seq id no:46和47所示的氨基酸序列或与seq id no:46和47所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(2)重链和轻链分别包含seq id no:50和51所示的氨基酸序列或与seq id no:50和51所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(3)重链和轻链分别包含seq id no:54和55所示的氨基酸序列或与seq id no:54和55所示的氨基
酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(4)重链和轻链分别包含seq id no:58和59所示的氨基酸序列或与seq id no:58和59所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(5)重链和轻链分别包含seq id no:62和63所示的氨基酸序列或与seq id no:62和63所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(6)重链和轻链分别包含seq id no:64和63所示的氨基酸序列或与seq id no:64和63所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(7)重链和轻链分别包含seq id no:68和69所示的氨基酸序列或与seq id no:68和69所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(8)重链和轻链分别包含seq id no:70和69所示的氨基酸序列或与seq id no:70和69所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(9)重链和轻链分别包含seq id no:74和75所示的氨基酸序列或与seq id no:74和75所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(10)重链和轻链分别包含seq id no:76和75所示的氨基酸序列或与seq id no:76和75所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(11)重链和轻链分别包含seq id no:80和81所示的氨基酸序列或与seq id no:80和81所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(12)重链和轻链分别包含seq id no:82和81所示的氨基酸序列或与seq id no:82和81所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;(13)重链和轻链分别包含seq id no:80和83所示的氨基酸序列或与seq id no:80和83所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列;或(14)重链和轻链分别包含seq id no:82和83所示的氨基酸序列或与seq id no:82和83所示的氨基酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列。
28.本发明的抗体在一些实施方案中还包含重链和轻链,所述重链包含重链可变区和重链恒定区,所述轻链包含轻链可变区和轻链恒定区,其中,重链可变区和轻链可变区分别包含上述重链可变区和轻链可变区的氨基酸序列,重链恒定区可以是人igg1,igg2或igg4恒定区,优选igg1恒定区;轻链恒定区可以是人κ恒定区或人λ恒定区。
29.本发明的抗体在一些实施方案中包含两条重链(h)和两条轻链(l),或由两条重链
和两条轻链组成,重链和轻链通过二硫键相互连接,其中每条重链包含上述重链可变区(hv),和重链恒定区,其中重链可变区(hv)包含框架区(fr)和上述重链互补决定区(cdr),每条轻链包含上述轻链可变区(lv),和轻链恒定区,其中轻链可变区(lv)包含fr和上述轻链cdr,其中重链可变区的c-末端连接至重链恒定区的n-末端,轻链可变区的c-末端连接至轻链恒定区的n-末端。本发明的抗体可以是例如igg1,igg2或igg4同种型的全长抗体。在另一个实施方案中,本发明的抗体可以是单链抗体(scfv),或抗体片段,例如fab,f(ab')2片段,fd片段、fv片段、dab或分离的cdr。
30.本发明的抗体或其抗原结合片段特异性结合pd-l2(例如,人pd-l2和猴pd-l2),并阻断pd-l2与其受体pd-1的结合。在一些实施方案中,本文提供的抗pd-l2抗体或其抗原结合片段联合抗pd-l1抗体,能够阻断pd-l2/pd-1和pd-l1/pd-1相互作用,促进t细胞活化、增殖和/或细胞因子产生,所述细胞因子包括但不限于:il-2、ifnγ、tnf-α、il-1、il-4、il-5、il-6、il-12、il-17和gm-csf中的一种或多种。因此,在另一方面,本发明提供了用于调节免疫应答的方法,其包括使t细胞和抗原呈递细胞与本文提供的抗pd-l2抗体或其抗原结合片段和抗pd-l1抗体接触。在一个实施方案中,可以在混合淋巴细胞(mlr)反应中测量本文提供的抗pd-l2抗体或其抗原结合片段联合抗pd-l1抗体对免疫应答的调节。在一个实施方案中,本文提供的抗pd-l2抗体联合抗pd-l1抗体增加mlr中淋巴细胞的细胞因子产生的水平。在一个实施方案中,本文提供的抗pd-l2抗体联合抗pd-l1抗体增加mlr中il-2和/或ifn-γ产生的水平。
31.一方面,本发明提供一种结合pd-l2的分离的抗体或其抗原结合片段,所述的抗体或其抗原结合片段由杂交瘤产生,所述的杂交瘤选自本文称为25g4、14e7、24a3和7a7的杂交瘤组成的组。因此,本发明还包括杂交瘤25g4、14e7、24a3和7a7以及产生本文公开的抗体的任何杂交瘤产生的抗体或其抗原结合片段。
32.一方面,本发明提供与本发明任何示例性pd-l2抗体或其抗原结合片段结合pd-l2上相同表位的抗体或其抗原结合片段。在一个实施方案中,本发明提供与本发明任何示例性pd-l2抗体或其抗原结合片段竞争结合pd-l2的抗体或其抗原结合片段。
33.另一方面,本发明还提供重组多肽和融合蛋白,其包含一种或多种本发明的抗体或其抗原结合片段与至少一种其他功能片段,所述其他功能片段包括但不限于另一种肽、蛋白质或细胞因子。在另一方面,本发明还提供一种双特异性分子,其包含一种或多种本发明的抗体或其抗原结合片段与至少一种其他的抗体或其抗原结合片段,所述双特异性分子能够与至少两个不同结合位点或靶点结合。本文所用的“双特异性分子”涵盖具有两种(即双特异性分子)、三种(即三特异性分子)、四种(即四特异性分子)或更多种的特异性的分子。
34.在一方面,本发明还提供一种药物组合物,其包含本发明的抗pd-l2抗体或其抗原结合片段,和一种或多种药学上可接受的载体。可选地,所述药物组合物还可以进一步包括一种或多种其他抗体,例如pd-l1抗体。在另一个实施方案中,本发明还提供了包含本发明的重组多肽、融合蛋白或双特异性分子,以及药学上可接受的载体的药物组合物。
35.在一方面,本发明还提供编码本发明的抗pd-l2抗体或其抗原结合片段的分离的核酸。本发明还提供包括所述核酸的表达载体,以及包含所述表达载体的宿主细胞。
36.在一方面,本发明还提供一种制备抗pd-l2抗体或其抗原结合片段的方法,其包括
以下步骤:(i)在宿主细胞中表达抗体或其抗原结合片段,和(ii)从宿主细胞或其细胞培养物中分离抗体或其抗原结合片段。
37.在其他方面,本发明提供用于在受试者中调节免疫应答的方法,所述方法包括向受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在另一个实施方案中,本发明提供用于在受试者中治疗、缓解或预防癌症的方法,所述方法包括向受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。
38.在一个实施方案中,本发明提供用于在受试者中增强抗肿瘤免疫应答的方法,包括向所述受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在一个实施方案中,本发明提供用于在受试者中减少肿瘤大小或抑制肿瘤细胞生长的方法,包括向所述受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在一个实施方案中,本发明提供用于在受试者中治疗癌症的方法,包括向所述受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在另一些实施方案中,该方法包括向所述受试者施用治疗有效量的编码本发明的抗pd-l2抗体或其抗原结合片段的核酸。在另一些实施方案中,该方法包括向所述受试者施用治疗有效量的本发明的重组多肽、融合蛋白或双特异性分子。
39.在一些实施方案中,至少一种另外的抗体可以与本发明抗pd-l2抗体或其抗原结合部分一起施用,例如pd-l1抗体、pd-1抗体和/或ctla-4抗体,优选pd-l1抗体。在一些实施方案中,至少一种另外的治疗可以与本发明的抗pd-l2抗体或其抗原结合片段一起施用,所述另外的治疗包括放疗、化疗、生物制品、化学制品、疫苗等其他肿瘤治疗方式。在某些实施方式中,受试者是人。
40.所述的肿瘤或癌症包括但不限于:结直肠癌、乳腺癌、卵巢癌、胰腺癌、胃癌、肾癌、前列腺癌、宫颈癌、骨髓瘤、淋巴瘤、白血病、甲状腺癌、子宫内膜癌、子宫癌、膀胱癌、神经内分泌恶性肿瘤、头颈癌、唾液腺癌、胸腺癌、肝癌、鼻咽癌、睾丸癌、小细胞肺癌、非小细胞肺癌、黑色素瘤、基底细胞皮肤癌、鳞状细胞皮肤癌、隆突性皮肤纤维肉瘤、梅克尔细胞癌、成胶质细胞瘤、胶质瘤、肉瘤、间皮瘤和骨髓增生异常综合征,或其组合;并且任选地,所述肿瘤是原位的,转移性的,复发性的,和/或难治性的。
41.在另一个实施方案中,本发明提供用于在受试者中治疗传染病的方法,该方法包括向所述受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在另一些实施方案中,该方法包括向所述受试者施用治疗有效量的编码本发明的抗pd-l2抗体或其抗原结合片段的核酸。所述的传染病包括但不限于:念珠菌病、念珠菌血症、曲霉菌病、链球菌性肺炎、链球菌性皮肤和口咽病、革兰氏阴性脓毒症、结核病、单核细胞增多症、流行性感冒、呼吸道合胞病毒引起的呼吸道疾病、疟疾、血吸虫病和锥虫病。
42.另一方面,本发明还提供一种检测样品中pd-l2表达的方法,其包括在允许本发明的抗pd-l2抗体或抗原结合片段和pd-l2之间形成复合物的条件下,使所述样品与本发明的抗pd-l2抗体或抗原结合片段接触,和检测所述复合物的形成。
43.基于以下具体描述和实施例,当前公开内容的其他特征和优势之处将会更加明晰,具体描述和实施例不应解读为限制性的。在本技术中引用的所有文献、genbank记录、专利和已公开专利申请的内容通过引用的方式明确地包含在本文中。
附图说明
44.图1示出流式细胞仪分析不同浓度的抗pd-l2人源化抗体(hz25g4-1.1)对dc/t细胞的结合
45.图2a示出在mlr中响应于不同浓度的抗体的ifn-γ(pg/ml)的产生,图2b示出在mlr中响应于不同浓度的抗体的il-2(pg/ml)的产生。对于图2a和图2b,测试的抗体从左到右是:抗pd-l2抗体(hz25g4-1.1) 抗pd-l1抗体、抗pd-l1抗体 抗pd-l2抗体(hz25g4-1.1)、抗pd-l2抗体(hz25g4-1.1)、抗pd-l1抗体和空白对照(igg1),其中抗pd-l1抗体参见cn107001463中的人源化5g11-igg1,重链和轻链的氨基酸序列如本技术seq id no:88和seq id no:89所示。
46.发明详述
47.应当理解,本文所用的术语只是为了描述具体实施例,并非旨在进行限制。除非另有定义,否则本文使用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常所理解的含义相同。
48.术语“pd-l2”包括pd-l2变体,同源物,直系同源物和旁系同源物。例如,在一些实施例中,对人pd-l2蛋白特异的抗体可以在某些情况下与另一物种(例如猴)的pd-l2蛋白交叉反应。在另一些实施方案中,对人pd-l2蛋白特异的抗体可以完全地对人pd-l2蛋白特异而不与其他物种或其他类型的蛋白交叉反应,或者仅与某些其他物种而非所有其他物种的pd-l2蛋白交叉反应。
49.术语“人pd-l2”、“hpd-l2”或“human pd-l2”等在本文中可以互换,是指具有人pd-l2氨基酸序列的蛋白,例如genbank登录号为aai13679的氨基酸序列。术语“猴pd-l2”或“cyno pd-l2”等在本文中可以互换,是指具有猴pd-l2氨基酸序列的蛋白,例如uniprot登录号为g7pse6的氨基酸序列。
50.如本文所用的术语“抗体”是指具有至少一个抗原结合结构域的结合蛋白。本发明的抗体或其抗原结合片段可以是整个抗体或其任何片段,包括单克隆抗体或其片段和抗体变体或其片段。抗体片段的实例包括fab片段、f(ab’)2片段、fv片段、分离的cdr区、单链fv(scfv)和本领域任何已知的抗体片段。抗体或其片段还包括重组多肽、融合蛋白和双特异性分子。本文公开的抗pd-l2抗体或其抗原结合片段可以是igg1、igg2、igg3或igg4同种型。术语“同种型”是指由重链恒定区基因编码的抗体种类。在一些实施方案中,本文公开的抗pd-l2抗体或其抗原结合片段是igg1同种型。本发明公开的抗pd-l2抗体或其抗原结合片段可以衍生自任何物种,包括但不限于小鼠、大鼠、兔、灵长类动物、美洲驼和人。本发明的抗pd-l2抗体或其抗原结合片段可以是鼠类抗体、嵌合抗体、人源化抗体或完整的人抗体。
51.抗体的“抗原结合片段”或“抗体结合部分”是指抗体的一个或多个片段,其保留特异性结合抗原(例如,pd-l2蛋白)的功能。已证实,抗体的抗原结合功能可以通过全长抗体的片段来实施。涵盖在术语抗体的“抗原结合部分/片段”中的实例包括:(i)fab片段:由v
l
、vh、cl和ch1结构域组成的单价片段;(ii)f(ab')2片段,包含在铰链区通过二硫桥连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的vl和vh结构域组成的fv片段;(v)由vh结构域组成的dab片段(参见ward et al.,nature.341:544-546(1989));(vi)分离的互补决定区(cdr);以及(vii)纳米抗体,一种包含单个可变结构域和两个恒定结构域的重链可变区。此外,尽管fv片段的两个结构域vl和vh由不同基因编码,
但可以采用重组的方法通过接头将vh和vl连接成单蛋白链,其中vl和vh配对形成单价分子称单链fv(scfv);参见bird et al.,science.242:423-426(1988);huston et al.,proc.natl.acad.sci.85:5879-5883(1988),这些单链抗体也涵盖在术语抗原结合部分/片段中。这些抗体片段可以由本领域技术人员已知的常规技术获得,且片段可以通过与全长抗体相同的方法进行功能筛选。
[0052]“小鼠抗体”或“鼠类抗体”是指可变区中框架区(fr)和cdr区均来自小鼠种系免疫球蛋白序列的抗体。此外,如果抗体包含恒定区,则恒定区也来自小鼠种系免疫球蛋白序列。本发明的小鼠/鼠类抗体可以包括不由小鼠种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机突变、点突变或通过体细胞突变引入的突变),但不包括在小鼠框架序列中插入来自其他哺乳动物种系的cdr序列的抗体。
[0053]“嵌合抗体”是指抗体具有衍生自一种物种的重链可变区的至少一部分和轻链可变区的至少一部分;以及衍生自另一物种的恒定区的至少一部分。例如,在一些实施方案中,嵌合抗体可以包含鼠类可变区和人恒定区。
[0054]“人源化抗体”是指抗体含有衍生自非人抗体的cdr和衍生自人抗体的框架区以及恒定区。例如,本文提供的抗pd-l2抗体可以包含衍生自一种或多种鼠类抗体的cdr以及人框架区和恒定区。因此,在一些实施方案中,本文提供的人源化抗体与所述抗体的cdr所衍生自的鼠类抗体结合pd-l2上的相同表位。本文提供了示例性人源化抗体。本发明所提供的人源化抗体,包含本文提供的重链cdr和轻链cdr以及任何其他人框架区序列的抗pd-l2抗体或其变体。本发明所提供的人源化抗体,包含本文提供的重链cdr和轻链cdr以及在结构上与本文提供的框架区序列类似的框架区的抗pd-l2抗体或其变体。还可以在框架区进行另外的修饰以改进本发明提供的抗体的特性,所述修饰包括化学修饰、点突变、或突变回复为原始种系序列中的残基。例如,在一些实施方案中,本文提供的人源化抗体的vh和/或vl的人框架区中的一个或多个氨基酸被回复突变为亲本鼠类抗体中对应的氨基酸。
[0055]
本文所述的“衍生的”,在用于相对于参考抗体或其他结合蛋白的分子或多肽时,意指能够与参考抗体或其他结合蛋白特异性地结合相同表位的分子或多肽。
[0056]“分离的”是指已经从其天然环境中分离的目标化合物(例如,抗体、抗原结合片段或核酸)。
[0057]“特异性结合抗原的抗体”和“对抗原特异的抗体”在本文中与术语“与抗原特异性结合的抗体”可互换使用。“特异性结合人pd-l2”的抗体是指与人pd-l2蛋白(还可能是其他非人物种的pd-l2蛋白)结合但基本上不结合非pd-l2蛋白的抗体。优选地,抗体以“高亲和力”结合人pd-l2,即kd为5.0
×
10-8
m或更小,1.0
×
10-8
m或更小,优选为5.0
×
10-9
m或更小,更优选为1.0
×
10-9
m或更小。
[0058]
术语“基本上不结合”蛋白质或细胞是指不与蛋白质或细胞结合,或不以高亲和力与其结合,即结合蛋白质或细胞的kd为1.0
×
10-6
m或更高,优选为1.0
×
10-5
m或更高,1.0
×
10-4
m或更高,更优选为1.0
×
10-3
m或更高,1.0
×
10-2
m或更高。
[0059]
术语“高亲和力”对igg而言,是指结合抗原的kd为1.0
×
10-6
m或更小,1.0
×
10-7
m或更小,优选1.0
×
10-8
m或更小,5.0
×
10-9
m或更小,更优选为1.0
×
10-9
m或更小。但对于其他抗体同种型,“高亲和力”结合可能有所不同。例如,igm同种型的“高亲和力”结合,是指结合抗原的kd为1.0
×
10-6
m或更小,优选1.0
×
10-7
m或更小,更优选1.0
×
10-8
m或更小。
[0060]“同一性”是指两个核酸序列之间或两个多肽序列之间的相似性。本发明的序列同一性至少为85%,90%或95%,优选为至少95%。非限制性实施例包括:85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,100%。两个序列之间的序列比较和同一性百分比测定可以通过national center for biotechnology institute网站上的blastn/blastp算法的默认设置来进行。
[0061]“竞争结合”的抗体指部分或完全阻断其他抗体与靶标结合的抗体。两种抗体是否彼此竞争结合靶标,即一种抗体是否阻断另一抗体结合靶标且至何种程度,可以使用本领域已知的竞争实验来确定,例如固相直接或间接放射免疫测定(ria),固相直接或间接酶免疫测定(eia),夹心式竞争测定等。在某些实施方案中,抗体与另一抗体竞争结合靶标并使另一抗体与靶标的结合阻断至少10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。
[0062]
两种或多种抗体“结合相同表位”意指抗体结合氨基酸残基的相同区段,如通过给定方法测定。用于确定抗体是否与本文所述抗体结合“pd-l2上相同的表位”的技术包括例如表位作图方法,诸如,抗原:抗体复合物的晶体的x射线分析和氢/氘交换质谱法(hdx-ms)。
[0063]
术语“ec50”,又称半数有效浓度,是指在特定暴露时间后,能达到50%最大效应的抗体浓度。术语“ic50”,又称半数抑制浓度,是指相对于不存在抗体的情况,将特异性生物学或生化功能抑制50%的抗体浓度。ec50和ic50两者均可以通过elisa或facs分析或本领域已知的任何其他方法进行测量。
[0064]“kd”指平衡解离常数,其获自kd比ka(即,kd/ka)的比率并且表示为摩尔浓度(m)。抗体的kd值可以使用本领域充分建立的方法来测定。用于测定抗体的kd的优选方法是通过使用表面等离子共振技术,优选使用生物传感器系统诸如表面等离子共振系统分析。
[0065]“患者”或“受试者”包括任何人或非人动物。术语“非人动物”包括所有脊椎动物,例如哺乳动物及非哺乳动物,优选哺乳动物,例如非人的灵长类动物,绵羊,狗,猫,牛和马。
[0066]“有效剂量”或“有效量”是指足以实现或至少部分实现期望效果的量。药物或治疗剂的治疗“有效量”或“有效剂量”是指当单独或与另一治疗剂组合使用时,所述的量使疾病症状的严重度降低、无疾病症状的频率或持续时间增加、或防止或改善由于疾病导致的损伤或抑制疾病的发展或复发。
[0067]“癌症”是指以异常方式增殖的细胞的集合,包括实体瘤和非实体瘤。
[0068]
除特别声明外,本发明中的“约”是指在所给定的具体数值范围
±
5%范围内波动,优选在
±
2%范围内波动,更优选在
±
1%范围内波动。例如ph值为约5.5表示ph为5.5
±
5%,优选ph为5.5
±
2%,更优选ph为5.5
±
1%。除非另外特别说明,否则单数的使用包括复数。除非另外特别说明,否则词语“一个”或“一种”意指“至少一个”或“至少一种”,短语“至少一个”的含义等同于“一个或多个”的含义,“和/或”的使用意指“和”或者“或”。
[0069]
本发明的多个方面在以下更加具体地加以描述。
[0070]
抗pd-l2单克隆抗体
[0071]
优选地,本发明的抗体是结构和化学特性如下文所述的抗体。
[0072]
抗pd-l2抗体或其抗原结合片段包含重链cdr区和轻链cdr区,其中示例性重链cdr
序列和轻链cdr序列分别提供于下表1和表2中;抗pd-l2抗体或其抗原结合片段包含重链可变区和轻链可变区,其中示例性重链可变区和轻链可变区提供于下表3中。一些抗体具有相同的cdr,一些抗体具有相同的vh或vl。抗体的重链恒定区可以是人igg1重链恒定区,抗体的轻链恒定区可以是人κ轻链恒定区。这些抗体还可包含鼠igg1重链恒定区,或人或鼠igg2或igg4重链恒定区,和/或人或鼠λ轻链恒定区。
[0073]
表1重链cdr区的氨基酸序列表
[0074][0075]
表2轻链cdr区的氨基酸序列表
[0076][0077]
表3重链/轻链可变区的氨基酸序列表(下划线依次表示cdr区)
[0078]
[0079][0080]
表4重链/轻链的氨基酸序列表(下划线表示可变区)
[0081]
[0082]
[0083]
[0084][0085]
与人pd-l2结合的其他抗pd-l2抗体的vh和/或vl序列(或cdr序列)可以与本发明的抗体的vh和/或vl序列(或cdr序列)“混合并配对”。优选地,当vh和vl链(或其cdr)混合并配对时,特定vh/vl对中的vh序列可以由结构相似的vh序列取代。同样,优选地将特定vh/vl对中的vl序列取代为结构相似的vl序列。
[0086]
因此,在一个实施方案中,本发明的抗体或其抗原结合片段包括:
[0087]
(a)重链可变区,其包含列于表3中的氨基酸序列;和
[0088]
(b)轻链可变区,其包含列于表3中的氨基酸序列,或另一种pd-l2抗体的vl,其中该抗体特异性结合人pd-l2。
[0089]
在另一个实施方案中,本发明的抗体或其抗原结合片段包括:
[0090]
(a)列于表1的重链可变区的cdr1,cdr2和cdr3区;和
[0091]
(b)列于表2的轻链可变区的cdr1,cdr2和cdr3区,或另一种pd-l2抗体的轻链可变区cdr,其中该抗体特异性结合人pd-l2。
[0092]
在另一个实施方案中,本发明的抗体或其抗原结合片段包括列于表1的重链可变cdr2区以及其他pd-l2抗体的cdr,例如其他pd-l2抗体的重链可变区的cdr1和/或cdr3,和/或其他pd-l2抗体轻链可变区的cdr1,cdr2和/或cdr3。
[0093]
此外,本领域内公知,cdr3结构域独立于cdr1和/或cdr2结构域,可以单独确定抗体对同种抗原的结合特异性,并且可以预测到基于该cdr3序列可产生具有相同结合特异性的多种抗体。
[0094]
在另一个实施方案中,本发明的抗体或其抗原结合片段包含列于表1的的重链可变区的cdr2;以及列于表1的重链可变区的cdr3和/或列于表2的轻链可变区的cdr3,或另一种pd-l2抗体的重链可变区的cdr3和/或轻链可变区的cdr3,其中该抗体特异性结合人pd-l2。这些抗体优选(a)竞争结合pd-l2;(b)保留功能特征;(c)结合相同的表位;和/或(d)具有与本发明的pd-l2抗体具有相似的结合亲和力。在另一个实施方案中,本发明的抗体还包含列于表2的轻链可变区的cdr2,或另一种pd-l2抗体的轻链可变区的cdr2,其中该抗体特异性结合人pd-l2。在另一个实施方案中,本发明的抗体还包括列于表1的重链可变区的cdr1和/或列于表2的轻链可变区的cdr1,或另一种pd-l2抗体的重链可变区的cdr1和/或轻链可变区的cdr1,其中该抗体特异性结合人pd-l2。
[0095]
保守的修改
[0096]
在另一个实施方案中,本发明的抗体包含与本发明的pd-l2抗体存在一个或多个保守修饰的重链可变区和/或轻链可变区或cdr1,cdr2和cdr3序列。本领域应理解,一些保守序列修饰不会使抗原结合性消失。
[0097]
因此,在一个实施方式中,抗体包含重链可变区和/或轻链可变区,重链可变区和轻链可变区分别包含cdr1、cdr2和cdr3,其中:
[0098]
(a)重链可变区cdr1序列包含表1列出的序列,和/或其保守修饰;和/或
[0099]
(b)重链可变区cdr2序列包含表1列出的序列,和/或其保守修饰;和/或
[0100]
(c)重链可变区cdr3序列包含表1列出的序列,和/或及其保守修饰;和/或
[0101]
(d)轻链可变区cdr1和/或cdr2和/或cdr3序列包含表2列出的序列;和/或其保守修改;且
[0102]
(e)抗体特异性结合人pd-l2。
[0103]
本发明的抗体具有上述一种或多种以下功能特性,例如对人pd-l2具有高亲和力,以及阻断pd-l2/pd-1的结合。
[0104]
本文所用的术语“保守序列修饰”是指不显著影响或改变抗体结合特性的氨基酸修饰。这样的保守修饰包括氨基酸取代、添加和删除。可以通过本领域已知的标准技术将修
饰引入本发明的抗体中,例如点突变和pcr介导的突变。保守氨基酸取代是指氨基酸残基被具有类似结构或化学特性(例如,相似侧链)的氨基酸残基取代。具有相似侧链的氨基酸残基家族在本领域中已知。这些氨基酸残基家族包括具有碱性侧链(例如,赖氨酸,精氨酸,组氨酸),酸性侧链(例如,天冬氨酸,谷氨酸),不带电极性侧链(例如,甘氨酸,天冬酰胺,谷氨酰胺,丝氨酸,苏氨酸,酪氨酸,半胱氨酸,色氨酸),非极性侧链(例如,丙氨酸,缬氨酸,亮氨酸,异亮氨酸,脯氨酸,苯丙氨酸,甲硫氨酸),β支链侧链(例如,苏氨酸,缬氨酸,异亮氨酸)和芳香族侧链(例如,酪氨酸,苯丙氨酸,色氨酸,组氨酸)的氨基酸。因此,本发明的抗体的cdr区中一个或多个氨基酸残基可以被同一侧链家族的其他氨基酸残基取代,且得到的抗体可以使用本文所述的功能检测对其进行保留功能(即,上述的功能)的测试。
[0105]
基因工程抗体和修饰抗体
[0106]
本发明的抗体可以用具备本发明抗pd-l2抗体的一个或多个vh/vl序列的抗体作为起始材料,制备成基因工程抗体。可以对一个或两个可变区(即vh和/或vl)内(例如,在一个或多个cdr区和/或一个或多个框架区)的一个或多个残基进行修饰。或者,可以对恒定区中的残基进行修饰,例如改变抗体的效应功能。
[0107]
在某些实施方案中,cdr移植可用于基因工程抗体的可变区。抗体主要通过位于六个重链和轻链cdr中的氨基酸残基与靶抗原相互作用。因此,各个抗体cdr内的氨基酸序列比cdr外的序列更具有多样性。由于cdr序列负责主要的抗体-抗原相互作用,因此可以通过构建含有特定天然抗体的cdr序列移植到不同特性的不同抗体的框架序列的表达载体,来表达模拟特定天然抗体的特性的重组抗体。
[0108]
因此,本发明的另一个实施方案涉及分离的单克隆抗体或其抗原结合片段,其包含重链可变区和/或轻链可变区,重链可变区包含具有本发明上述序列的cdr1、cdr2和cdr3,轻链可变区包含具有本发明上述序列的cdr1、cdr2和cdr3。尽管这些抗体包含本发明单克隆抗体的cdr序列,它们可以含有不同的框架序列。这样的框架序列可以从包括种系抗体基因序列的公开dna数据库或公开参考文献中获得。这样的框架序列优选地是与本发明的抗体所用的框架序列在结构上相似的那些。可以将cdr1,cdr2和cdr3序列移植到与该框架序列的种系免疫球蛋白基因具有相同序列的框架区中,或者可以将cdr序列移植到与种系序列相比具有一个或多个突变的框架区中。例如,在一些情况下,对框架区中的残基进行突变是有益的,可以维持或增强抗体的抗原结合能力(参见,例如,u.s.pat.nos.5,530,101;5,585,089;5,693,762和6,180,370)。
[0109]
另一种类型的可变区修饰是将cdr1,cdr2和/或cdr3区内的氨基酸残基进行突变,从而改善目标抗体的一种或多种特性(例如,亲和力,理化性质)。可以通过定突变或pcr介导的突变引入突变,并可通过本领域已知的体外或体内测定评估突变对抗体结合或其他功能特性的影响。可以是对氨基酸进行取代、添加或删除,优选为取代。此外,通常改变每个cdr区内不多于一个、两个、三个、四个或五个的残基。
[0110]
此外,在另一个实施方案中,本发明提供分离的pd-l2单克隆抗体或其抗原结合片段,其包含重链可变区和轻链可变区,其包含:(a)vh cdr1区,包含本发明的序列,或具有1、2、3、4或5个氨基酸取代,删除或添加的氨基酸序列;(b)vh cdr2区,其包含本发明的序列,或具有1、2、3、4或5个氨基酸取代,删除或添加的氨基酸序列;(c)vh cdr3区,其包含本发明的序列,或具有1、2、3、4或5个氨基酸取代,删除或添加的氨基酸序列;(d)vl cdr1区,其包
含本发明的序列,或具有1、2、3、4或5个氨基酸取代,删除或添加的氨基酸序列;(e)vl cdr2区,其包含本发明的序列,或具有1、2、3、4或5个氨基酸取代,删除或添加的氨基酸序列;和(f)vl cdr3区,其包含本发明的序列,或具有1、2、3、4或5个氨基酸取代,删除或添加的氨基酸序列。
[0111]
本发明的修饰抗体包括在vh和/或vl的框架区残基进行修饰以改善抗体特性的那些抗体。通常,此类框架区修饰可以降低抗体的免疫原性。例如,将一个或多个框架残基“回复突变”为相应的种系序列。这些残基可以通过将抗体框架序列与得到抗体的种系序列相比较而识别出来。
[0112]
另一种类型的框架修饰涉及对框架区、或者甚至一个或多个cdr区的一个或多个残基进行突变,以去除t细胞表位,从而减少抗体可能导致的免疫原性。该方法也称为“去免疫原性”,在美国专利公开号20030153043中有更详细描述。
[0113]
此外,还包括对本发明的抗体fc区进行修饰,通常用来改变抗体的一种或多种功能特性,例如血清半衰期,补体结合,fc受体结合,和/或抗原依赖性细胞毒性。此外,本发明的抗体还可以进行化学修饰(例如,连接一个或多个化学功能基团),或修饰以改变其糖基化,来改变抗体的一种或多种功能特性。在其他实施方案中,通过聚乙二醇化(例如,通过使抗体或其片段与聚乙二醇(peg)反应来修饰fc区。
[0114]
药物组合物
[0115]
另一方面,本发明提供了药物组合物,其包含本发明的抗体或其抗原结合片段,与药学上可接受的载体配制在一起。药物组合物可以任选地包含一种或多种其他药学上的有效成分,例如另一种抗体或药物,例如另一抗pd-l2抗体,抗pd-l1抗体,抗pd-1抗体,另一抗癌药,优选地包含另一抗pd-l1抗体。
[0116]
如本文中所用,“药学上可接受的载体”包括生理上相容的任一和所有溶剂、分散介质、涂料、抗菌剂、等渗剂及其组合。合适的“药学上可接受的载体”的选择和使用在gennaro,ed.,remington:the science and practice of pharmacy,20th ed.(lippincott williams&wilkins 2003)中有教导。
[0117]
在一些实施方案中,药物组合物适合于静脉内,肌内,皮下,肠道外,脊柱或表皮施用(例如,通过注射或输注)。基于施用途径的不同,可以将有效成分包在材料中以保护其不受酸和可能使其失活的其他自然条件的影响。“肠道外施用”是指不同于肠道和局部外用的方式,通常通过注射,包括但不限于静脉内、肌内、动脉内、膜内、囊内、眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬脑膜上和胸骨内注射和推注。或者,本发明的抗体或其抗原结合片段可以通过非肠道外路径施用,例如外用、表皮施用或粘膜施用,例如鼻内、经口、阴道、直肠、舌下、或局部外用。
[0118]
已知各种递送系统且其可用于施用一种或多种本发明的抗体或其抗原结合片段,或一种或多种本发明的抗体或其抗原结合片段与一种或多种其他药学上的有效成分,例如另一种抗体或药物,例如另一pd-l2抗体,抗pd-l1抗体,另一抗癌药的组合。
[0119]
本发明的用途和方法
[0120]
本发明的抗体或其抗原结合片段(编码本发明的抗体或其抗原结合片段的核酸、药物组合物、重组多肽、融合蛋白或双特异性分子)具有多种体外和体内应用,例如用于在受试者中调节免疫应答,增强抗肿瘤免疫应答,减少肿瘤大小或抑制肿瘤细胞生长,和/或
治疗(例如治愈、抑制、改善、延迟或阻止反复)肿瘤或癌症。因此,本发明还提供一种在受试者中增强抗肿瘤免疫应答的方法,包括向所述受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在一个实施方案中,本发明还提供一种在受试者中减少肿瘤大小或抑制肿瘤细胞生长的方法,包括向所述受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在一个实施方案中,本发明还提供一种在受试者中治疗癌症的方法,包括向所述受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在另一些实施方案中,该方法包括向所述受试者施用治疗有效量的编码本发明的抗pd-l2抗体或其抗原结合片段的核酸。
[0121]
在另一些实施方案中,该方法包括向所述受试者施用治疗有效量的本发明的重组多肽、融合蛋白或双特异性分子。本文所述的抗pd-l2抗体或其抗原结合片段,可单独或联合一种或多种其他抗体施用给人受试者,例如抗pd-l1抗体、抗pd-1抗体和/或抗ctla-4抗体,优选抗pd-l1抗体。本文所述的抗pd-l2抗体或其抗原结合片段,可单独或联合至少一种其他形式的治疗施用给人受试者,所述其他形式的治疗包括放疗、化疗、生物制品、化学制品和疫苗等。
[0122]
本文讨论的肿瘤或癌症包括但不限于:结直肠癌、乳腺癌、卵巢癌、胰腺癌、胃癌、肾癌、前列腺癌、宫颈癌、骨髓瘤、淋巴瘤、白血病、甲状腺癌、子宫内膜癌、子宫癌、膀胱癌、神经内分泌恶性肿瘤、头颈癌、唾液腺癌、胸腺癌、肝癌、鼻咽癌、睾丸癌、小细胞肺癌、非小细胞肺癌、黑色素瘤、基底细胞皮肤癌、鳞状细胞皮肤癌、隆突性皮肤纤维肉瘤、梅克尔细胞癌、成胶质细胞瘤、胶质瘤、肉瘤、间皮瘤和骨髓增生异常综合征,或其组合;并且任选地,所述肿瘤是原位的,转移性的,复发性的,和/或难治性的。
[0123]
在另一个实施方案中,本发明还提供一种在受试者中治疗传染病的方法,该方法包括向所述受试者施用治疗有效量的本发明的抗pd-l2抗体或其抗原结合片段或其药物组合物。在一些实施方案中,该方法包括向所述受试者施用治疗有效量的编码本发明的抗体或其抗原结合片段的核酸。所述的传染病包括但不限于:念珠菌病、念珠菌血症、曲霉菌病、链球菌性肺炎、链球菌性皮肤和口咽病、革兰氏阴性脓毒症、结核病、单核细胞增多症、流行性感冒、呼吸道合胞病毒引起的呼吸道疾病、疟疾、血吸虫病和锥虫病。
[0124]
本文讨论的治疗剂的“组合”或“联合”可以作为在药学可接受载体中的单一组合物同时施用,或者作为分开的组合物同时施用,其中各药剂处于药学可接受载体中。在另一个实施方案中,治疗剂的组合可以按序施用。此外,如进行多次联合疗法施用,且药剂按序施用,则在各时间点的按序施用的次序可以反转或保持相同,按序施用可以与同时施用或其任何组合相结合。
[0125]
另一方面,本发明还提供了一种检测样品中pd-l2表达的方法,其包括在允许本发明的抗pd-l2抗体或其抗原结合片段和pd-l2之间形成复合物的条件下,使所述样品与本发明的pd-l2抗体或其抗原结合片段接触,和检测所述复合物的形成。
[0126]
尽管为了清楚理解的目的,已经通过举例说明和实施例相当详细地描述了前述发明,但是根据本发明的教义,本领域的普通技术人员将显而易见的是,可另外对本发明进行某些改变和修改而不背离所附权利要求的精神和范围。本发明通过以下实施例进一步说明,并非旨在进行限制。本领域的技术人员将容易地识别多种非关键性参数,所述参数可发生改变或修改以产生基本上类似的结果。
[0127]
除非另外指出,否则本发明的实践将采用本领域技术范围内的蛋白质化学、生物化学、重组dna技术和药理学的常规方法。
实施例
[0128]
实施例1:抗pd-l2单克隆抗体的产生
[0129]
为了产生针对人pd-l2的抗体,使用等体积的完全弗氏佐剂乳化的重组体hpd-l2-his蛋白(acrobiosystems,目录号:pd2-h5220)进行首次免疫,500μg蛋白/小鼠。使用等体积的不完全弗氏佐剂乳化的重组体hpd-l2-mfc蛋白(acrobiosystems,目录号:pd2-h52a5)进行加强免疫,500μg蛋白/小鼠,每2周皮下免疫balb/c小鼠,持续6周。再通过肌肉注射hpdl2-mfc蛋白(20μg/只)进行第四次免疫。融合前3天,通过皮下注射不含佐剂的抗原来加强免疫。使用polyethylene glycol 1500(roche,目录号:7181)将来自免疫小鼠的脾细胞(1
×
108)与sp2/0骨髓瘤细胞(1.5
×
107)融合。融合后,将细胞以0.1ml/孔分配到96孔板中,并在37℃,5%co2的培养箱中进行孵育。通常在饲养的第9-15天之间,通过elisa方法检测培养物的上清液与hpd-l2-his(acrobiosystems,目录号:pd2-h5220)的结合,操作步骤可参见实施例4。
[0130]
将筛选的能结合hpd-l2的混合克隆进行有限稀释,一株阳性混合克隆分配到多块96孔板中,培养在含有10%胎牛血清的rpmi 1640(hyclone,目录号:sh30809.01)中。10天后,待有限稀释后的亚克隆同样经过elisa实验以检测培养物上清与hpd-l2-his(acrobiosystems,目录号:pd2-h5220)的结合,然后挑取能结合hpd-l2的阳性亚克隆。
[0131]
实施例2:抗pd-l2抗体cdna序列克隆和人源化
[0132]
免疫球蛋白cdna的克隆
[0133]
使用rna提取试剂盒(takara,目录号:9767)从产生人pd-l2抗体的杂交瘤细胞系中分离的总rna作为模板,根据制造商的说明书使用逆转录试剂盒(thermo fisher,目录号:k1652)合成第一链cdna。然后在50ml体积的反应体系中,使用简并小鼠igg引物,通过pcr反应对抗体相关序列进行体外扩增。pcr反应在t100tm热循环仪(bio-rad,目录号:184-2000)中进行。
[0134]
将pcr混合物在1%琼脂糖/tris-醋酸盐凝胶中进行电泳,并从凝胶上切下具有预期大小的dna片段并对其进行纯化。将纯化的pcr产物克隆到pmd-19t载体(takara,目录号:6013)中,然后转化到dh5a感受态大肠杆菌细胞(takara,目录号:9057)中。通过菌落pcr筛选克隆,并挑选克隆进行dna测序。得到抗体的重链可变区序列和轻链可变区序列:25g4(seq id no:25-26)、14e7(seq id no:27-28)、24a3(seq id no:29-30)、7a7(seq id no:31-32),示于表3中。
[0135]
嵌合7a7、14e7、24a3和25g4抗体的构建和表达
[0136]
通过对小鼠可变区的基因进行化学合成,其中vl区的cdna分别连接到人κ轻链恒定区来构建嵌合25g4(seq id no:47,49)、14e7(seq id no:51,53)、24a3(seq id no:55,57)和7a7(seq id no:59,61)的轻链;vh区的cdna分别连接到人igg1恒定区来构建嵌合25g4(seq id no:46,48)、14e7(seq id no:50,52)、24a3(seq id no:54,56)和7a7(seq id no:58,60)的重链。
[0137]
将100μg的每种嵌合重链表达质粒和嵌合轻链表达质粒转染expi-cho细胞
(200ml,密度106个/ml),培养6天。然后用蛋白a柱(genscript,目录号:l00695-16)纯化上清液中的嵌合抗体。本发明的“xi”表示嵌合抗体,例如xi7a7表示嵌合7a7抗体。
[0138]
抗体人源化设计
[0139]
使用cdr移植方法进行抗体人源化(参见,例如,美国专利号5225539),分别将小鼠25g4、14e7、24a3和7a7抗体的vh和vl氨基酸序列输入到国际免疫遗传信息系统相关工具网站(http://www.imgt.org/3dstructure-db/cgi/domaingapalign.cgi),从中筛选出与小鼠25g4、14e7、24a3和7a7抗体具有高度同源性的人胚系抗体序列,作为小鼠25g4、14e7、24a3和7a7抗体的vh和vl中互补决定区(cdr)嫁接的人抗体模板。对于25g4,所选择的人vh模板是ighv1-46*01和ighj4*01的组合,所选择的人vl模板是igkv1-39*01和igkj1*01的组合。对于14e7,所选择的人vh模板是ighv1-46*01和ighj4*01的组合,所选择的人vl模板是igkv1-5*01和igkj1*01的组合。对于24a3,所选择的人vh模板是ighv1-46*01和ighj4*01的组合,所选择的人v模板l是igkv4-1*01和igkj1*01的组合。对于7a7,所选择的人vh模板是ighv1-46*01和ighj4*01的组合,所选择的人vl模板是igkv1-39*01和igkj1*01的组合。
[0140]
上述人抗体模板的cdr氨基酸序列被小鼠25g4(seq id no:1-6)、14e7(seq id no:7-12)、24a3(seq id no:13-18)和7a7(seq id no:19-24)抗体的cdr取代,并将小鼠25g4、14e7、24a3和7a7抗体的vh和vl的必需氨基酸序列嫁接到上述人胚系抗体模板vh和vl中,以得到功能性人源化抗体。对于25g4、14e7、24a3和7a7抗体的vh和vl,上述人抗体模板的框架氨基酸的几个位点被回复突变为小鼠25g4、14e7、24a3和7a7抗体中对应的氨基酸序列。部分cdr在此基础上进行突变,以改善抗体的性质,例如改善理化性质或成药性。获得人源化抗体hz25g4-1.1、hz25g4-1.2、hz14e7-1.1、hz14e7-1.2、hz24a3-1.1、hz24a3-1.2、hz7a7-1.1、hz7a7-1.2、hz7a7-2.1、hz7a7-2.2,其中hz25g4-1.1的重链可变区和轻链可变区的氨基酸序列分别是seq id no:33和seq id no:34;hz25g4-1.2的重链可变区和轻链可变区的氨基酸序列分别是seq id no:35和seq id no:34;hz14e7-1.1的重链可变区和轻链可变区的氨基酸序列分别是seq id no:36和seq id no:37;hz14e7-1.2的重链可变区和轻链可变区的氨基酸序列分别是seq id no:38和seq id no:37;hz24a3-1.1的重链可变区和轻链可变区的氨基酸序列分别是seq id no:39和seq id no:40;hz24a3-1.2的重链可变区和轻链可变区的氨基酸序列分别是seq id no:41和seq id no:40;hz7a7-1.1的重链可变区和轻链可变区的氨基酸序列分别是seq id no:42和seq id no:43;hz7a7-1.2的重链可变区和轻链可变区的氨基酸序列分别是seq id no:44和seq id no:43;hz7a7-2.1的重链可变区和轻链可变区的氨基酸序列分别是seq id no:42和seq id no:45;hz7a7-2.2的重链可变区和轻链可变区的氨基酸序列分别是seq id no:44和seq id no:45。
[0141]
人源化25g4、14e7、24a3和7a7抗体的构建和表达
[0142]
合成编码人源化25g4、14e7、24a3和7a7抗体vl和vh的dna,将人源化vl区基因合成片段通过双酶切反应连接到人κ轻链恒定区来构建人源化25g4-1.1和25g4-1.2(seq id no:63,67)、14e7-1.1和14e7-1.2(seq id no:69,73)、24a3-1.1和24a3-1.2(seq id no:75,79)、7a7-1.1和7a7-1.2(seq id no:81,86)、7a7-2.1和7a7-2.2(seq id no:83,87)的轻链;将人源化vh区的基因合成片段通过双酶切反应连接到人igg1恒定区来构建人源化25g4-1.1(seq id no:62,65)、25g4-1.2(seq id no:64,66)、14e7-1.1(seq id no:68,71)、14e7-1.2(seq id no:70,72)、24a3-1.1(seq id no:74,77)、24a3-1.2(seq id no:
76,78)、7a7-1.1和7a7-2.1(seq id no:80,84)、7a7-1.2和7a7-2.2(seq id no:82,85)的重链。
[0143]
将100μg的每种人源化重链表达质粒和人源化轻链表达质粒转染expi-cho细胞(200ml,密度106个/ml),培养6天。然后用蛋白a柱(genscript,目录号:l00695-16)纯化上清液中的人源化抗体。本发明的“hz”表示人源化抗体,例如hz7a7-1.1表示人源化7a7-1.1抗体。
[0144]
实施例3:抗pd-l2抗体与pd-l2的结合亲和力分析
[0145]
通过biacore t200(ge)检测抗pd-l2抗体与pd-l2的结合动力学,实验步骤如下:将anti-human igg抗体通过氨基偶联的方法连接到cm5芯片的参考流动池和实验流动池上。在每个循坏的开始,将抗pd-l2抗体注射到实验流动池上,以被捕获。然后采用运行缓冲液稀释pd-l2蛋白,并将pd-l2蛋白连续注射在在参考池和实验池上。利用biacore实时检测反应信号,以获得结合和解离曲线。最后使用biaevaluation software 2.0软件以1:1(langmuir)结合模型分析实验所得数据,来测定缔合速率常数ka(kon)和解离速率常数kd(koff),通过kd=kd/ka计算解离常数kd。抗pd-l2抗体对人pd-l2抗原(hpd-l2-his:acrobiosystems,目录号:pd2-h5220)、食蟹猴pd-l2抗原(cyno pd-l2-his:义翘神州,目录号:90249-c08h)的亲和力数据如表5和表6所示。
[0146]
表5抗pd-l2嵌合抗体与pd-l2的结合亲和力
[0147][0148]
表6抗pd-l2人源化抗体与pd-l2的结合亲和力
[0149][0150]
na:未达检测线
[0151]
实施例4:抗pd-l2抗体的基于elisa的结合分析
[0152]
基于elisa方法,使用pd-l2-his作为抗原分析抗pd-l2抗体与pd-l2的结合能力,实验步骤如下:含2μg/ml的hpd-l2-his(acrobiosystems,目录号:pd2-h5220)的pbs缓冲液以100μl/孔包被于96孔板中,4℃孵育过夜。除去96孔板中的液体,每孔添加100μl阻断缓冲液(含1%(w/v)牛血清蛋白的pbs缓冲液),并在37℃下孵育1小时。用洗涤缓冲液(含0.01%(w/v)吐温20的pbs缓冲液)洗涤96孔板3次后,加入100μl/孔的抗pd-l2抗体(初始浓度为30μg/ml,按照1:4连续稀释;即浓度为约30μg/ml,约7.5μg/ml,约1.875μg/ml,约0.469μg/ml,约0.117μg/ml,约0.029μg/ml等),并在室温下孵育2小时。洗涤缓冲液洗涤96孔板3次后,加入100μl/孔含生物素(thermo,目录号:21336)的阻断缓冲液,室温标记1小时。洗涤缓冲液洗涤96孔板3次后,再加入第二抗体avidin-hrp避光孵育20分钟。洗涤96孔板3次后,添加100μl/孔的底物溶液tmb(tiangen,目录号:pa107-01),并将所述96孔板在室温下温育10分钟,然后添加100μl/孔的终止溶液(1m h2so4)以停止反应。使用多功能酶标仪(perkinelmer,envision)在450nm处读取产生的比色信号,将实验数据采用graphpad prism5进行分析,并计算ec50。抗pd-l2人源化抗体在elisa试验中与pd-l2的结合ec50见表7。
[0153]
表7抗pd-l2人源化抗体在elisa试验中与pd-l2的结合ec50
[0154]
抗体hz7a7-1.1hz7a7-1.2hz7a7-2.1hz7a7-2.2hz14e7-1.1ec50(ng/ml)308.2679.61125na115.4抗体hz14e7-1.2hz24a3-1.1hz24a3-1.2hz25g4-1.1hz25g4-1.2ec50(ng/ml)33.28166.522368.9387.4
[0155]
na:未达检测线
[0156]
实施例5:抗pd-l2抗体的基于流式的细胞结合分析
[0157]
通过与稳定表达人pd-l2的u2os细胞系(pd-l2-u2os)的结合实验,分析抗pd-l2抗体与表达pd-l2的细胞的结合能力。将8x103个u2os-pd-l2细胞添加到96孔u型板(corstar,目录号:3799)的各孔中,并将抗pd-l2抗体(初始浓度为50μg/ml,按照1:5连续稀释)添加到细胞悬浮液中,室温孵育1~2小时。将细胞用pbs缓冲液洗涤3次后,按照100μl/孔加入1:200稀释的alexa fluor 488标记山羊抗人二抗(jackson immunoresearch inc,目录号:109-545-088),并在室温下孵育30分钟。pbs洗涤3次后通过流式细胞仪(bd,accuri c6)分析检测荧光信号。通过染色的平均荧光强度(mfi)来测量抗pd-l2抗体与pd-l2-u2os细胞上的pd-l2的结合能力。使用graphpad prism5分析数据,并计算ec50值。抗pd-l2嵌合抗体和抗pd-l2人源化抗体与pd-l2基于流式细胞的结合ec50分别见表8和表9。
[0158]
表8抗pd-l2嵌合抗体与pd-l2基于流式的细胞结合ec50
[0159]
抗体xi7a7xi14e7xi24a3xi25g4ec50(ng/ml)429.61125967540
[0160]
表9抗pd-l2人源化抗体与pd-l2基于流式的细胞结合ec50
[0161]
抗体hz7a7-1.1hz7a7-1.2hz7a7-2.1hz7a7-2.2hz14e7-1.1ec50(ng/ml)613.1832.7924.31735442.8抗体hz14e7-1.2hz24a3-1.1hz24a3-1.2hz25g4-1.1hz25g4-1.2ec50(ng/ml)na1048619.8482.8na
[0162]
na:未达检测线
[0163]
实施例6:抗pd-l2抗体基于细胞的抗体阻断分析
[0164]
pd-l2是pd-1的配体,抗pd-l2抗体可阻断pd-l2与其受体pd-1的结合。取处于指数生长期状态良好的受体细胞(稳定表达人pd-1的pd-1-jurkat悬浮细胞),调整细胞密度至6.4x105个/ml,按照12.5μl/孔接种于384孔板上,于37℃,5%co2培养箱中培养15分钟。加入2.5μl/孔的抗pd-l2抗体(初始浓度为50μg/ml,按照1:5连续稀释),置37℃恒温,5%co2培养箱孵育60分钟。取处于指数生长期状态良好的配体细胞(稳定表达人pd-l2的u2os细胞系,pd-l2-u2os),调整细胞密度至9.6x105个/ml,按照12.5μl/孔接种于上述384孔板,摇床室温孵育2小时。每孔加入2.5μl bioassay reagent(discoverx,目录号:12604-021),摇床室温避光孵育15分钟,然后每孔加入10μl bioassay reagent 2(discoverx,目录号:12604-021),摇床室温避光孵育60分钟。多功能酶标仪envision(perkinelmer,mnr0643,)读取化学发光信号,使用graphpad prism5分析数据,并计算ic50值。抗pd-l2嵌合抗体阻断pd-l2与pd-1结合的ic50见表10,抗pd-l2人源化抗体阻断pd-l2与pd-1结合的ic50见表11。
[0165]
表10抗pd-l2嵌合抗体阻断pd-l2和pd-1结合的ic50
[0166]
抗体xi7a7xi14e7xi24a3xi25g4ic50(ng/ml)na342220.8679.8
[0167]
表11抗pd-l2人源化抗体阻断pd-l2和pd-1结合的ic50
[0168]
抗体hz7a7-1.1hz7a7-1.2hz7a7-2.1hz7a7-2.2hz14e7-1.1ic50(ng/ml)585.4373.5144.3na111.7抗体hz14e7-1.2hz24a3-1.1hz24a3-1.2hz25g4-1.1hz25g4-1.2ic50(ng/ml)2663195314231005700.4
[0169]
na:未达检测线
[0170]
实施例7:抗pd-l2人源化抗体对dc/t细胞的结合
[0171]
采用facs分析抗pd-l2抗体与dc/t细胞的结合,使用cd4
t细胞分离试剂盒(mitenyi biotech,目录号:130-094-131)从人pbmc中分离人cd4
t细胞。未成熟的树突细胞(dc)衍生自使用人单核细胞分离试剂盒(stemcell,目录号:19319)从人pbmc中分离的单核细胞,将细胞用树突状细胞诱导分化培养基(stemcell,目录号:10985)培养5天,然后用树突状细胞诱导成熟培养基(stemcell,目录号:10985)诱导2天获得成熟dc。将成熟的dc细胞与cd4
t细胞细胞按细胞数量1:4的比例进行混合,然后加入浓度分别为4μg/ml、0.8μg/ml、0.16μg/ml、0.032μg/ml、0.0064μg/ml的抗pd-l2抗体,37℃恒温,5%co2培养箱孵育96小时后,收集上清,细胞中加入按1:200稀释的山羊抗人488标记的荧光二抗,通过流式细胞仪(bd,accuri c6)分析检测荧光信号,以检测抗体与细胞上免疫检查点的结合情况。结果如图1所示,抗pd-l2抗体hz25g4-1.1可以与细胞上免疫检查点结合。
[0172]
实施例8:抗pd-l2人源化抗体对混合淋巴细胞反应中t细胞活化的影响
[0173]
采用混合淋巴细胞反应(mlr)来证明抗pd-l2人源化抗体,或抗pd-l2人源化抗体联合pd-l1抗体在阻断淋巴细胞效应细胞中pd-1与其配体结合的作用,并测定t细胞的ifn-γ和il-2的分泌。使用cd4
t细胞分离试剂盒(mitenyi biotech,目录号:130-094-131)从人pbmc中纯化人cd4
t细胞。未成熟的树突细胞(dc)衍生自使用人单核细胞分离试剂盒(stemcell,目录号:19319)从人pbmc分离的单核细胞。将细胞用树突状细胞诱导分化培养基(stemcell,目录号:10985)培养5天,然后用树突状细胞诱导成熟培养基(stemcell,目录号:10985)诱导2天获得成熟dc。为了建立mlr,对于每个反应,添加105个纯化的cd4
t细胞和104个同种异体成熟dc细胞,总体积为200μl。分别加入实验样品,将细胞在37℃恒温,5%co2的培养箱中培养96小时。实验样品分为:(1)hz25g4-1.1 抗pd-l1抗体(其中,hz25g4-1.1浓度分别为4μg/ml、0.8μg/ml、0.16μg/ml、0.032μg/ml、0.0064μg/ml,抗pd-l1抗体浓度为0.16μg/ml);(2)抗pd-l1抗体 hz25g4-1.1(其中,抗pd-l1抗体浓度分别为4μg/ml、0.8μg/ml、0.16μg/ml、0.032μg/ml、0.0064μg/ml,hz25g4-1.1浓度为4μg/ml);(3)hz25g4-1.1(浓度分别为4μg/ml、0.8μg/ml、0.16μg/ml、0.032μg/ml、0.0064μg/ml);(4)抗pd-l1抗体(浓度分别为4μg/ml、0.8μg/ml、0.16μg/ml、0.032μg/ml、0.0064μg/ml);(5)空白对照igg1(浓度分别为4μg/ml、0.8μg/ml、0.16μg/ml、0.032μg/ml、0.0064μg/ml)。使用il-2elisa检测试剂盒(r&d,目录号:dy202-05)和hifn-γ检测elisa试剂盒(r&d,目录号:dy285)测量培养基中ifn-γ和il-2的水平。本实施例中的pd-l1抗体参见cn107001463中的人源化5g11-igg1,重链和轻链的氨基酸序列如本技术seq id no:88和seq id no:89所示。结果如图2a和2b所示,抗pd-l2人源化抗体hz25g4-1.1联合pd-l1抗体促进t细胞分泌ifn-γ和il-2,表现出协同作用,且剂量依赖性较明显。
[0174]
实施例9:基于nanodsf检测抗pd-l2抗体的热稳定性
[0175]
高通量蛋白稳定性分析仪prometheus nt.48(nanotemper),是基于差示扫描荧光(nanodsf)技术,用来检测蛋白分子结构稳定性、聚集稳定性、胶体分散稳定性等多种类型数据的设备。利用该设备检测抗pd-l2嵌合抗体和抗pd-l2人源化抗体的熔解温度(tm)和聚合温度(tagg),结果见表12和表13,表明抗pd-l2抗体具有良好的热稳定性。
[0176]
表12抗pd-l2嵌合抗体的热稳定性
[0177]
抗体xi7a7xi14e7xi24a3xi25g4tm(℃)65.665.6160.7165.85tagg(℃)66.9467.7661.2667.53
[0178]
表13抗pd-l2人源化抗体的热稳定性
[0179]
抗体hz7a7-1.1hz7a7-1.2hz7a7-2.1hz7a7-2.2hz14e7-1.1tm(℃)69.2268.4568.5968.4865.89tagg(℃)70.0969.1669.2669.1484.11抗体hz14e7-1.2hz24a3-1.1hz24a3-1.2hz25g4-1.1hz25g4-1.2tm(℃)66.7766.2966.0269.8369.78tagg(℃)83.8279.6576.9170.8671.20
[0180]
虽然,上文中已经用一般性说明及具体实施方案对本发明做了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。