抗c9orf72寡核苷酸及相关方法
1.相关申请的交叉引用
2.本技术要求于2019年5月6日提交的美国临时申请序列号62/843,740的权益,其全部公开内容在此通过引用并入本文。
背景技术:
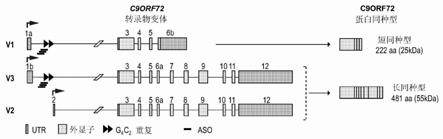
3.肌萎缩侧索硬化(amyotrophic lateral sclerosis,als)是以局灶性无力开始并且通常在3至4年内导致几乎完全瘫痪和死亡的进行性、一致致命性的运动神经元疾病。约10%的病例是家族性的(fals)。fals的最常见原因是基因c9orf72的第一内含子中六核苷酸重复基序的扩增。虽然正常个体的这些c4g2重复少于30个,但患有als的一些个体具有数百或甚至数干个这些重复。c9orf72基因表达涉及三个前mrna有义转录物(v1、v2、v3)。其中两个,v1和v3,涵盖扩增的六核苷酸重复,而v2则不包含。还存在由c9orf72基因表达的反义转录物,其包含反义扩增重复。
4.这种内含子扩增不仅可导致als,还可导致额颞痴呆(fronto-temporal dementia,ftd);这些病症可独立发生或一起发生。c9orf72扩增也可导致其他神经表型。在美国,约40%的fals病例由c9orf72扩增引起。尚不清楚为什么该扩增是毒性的。可能的机制包括:(1)c9orf72基因表达降低;(2)扩增重复区段聚集体形成,通常在细胞核内(rna病灶);(3)神经元和其他细胞类型的核膜中正常梯度的破坏;(4)所有可能的阅读框中扩增的六核苷酸基序的翻译,导致可检测水平的五种不同聚二肽的潜在毒性物质,包括甘氨酸-脯氨酸二肽重复蛋白(gp二肽重复蛋白)和精氨酸-脯氨酸二肽重复蛋白质(pr二肽重复蛋白)。至关重要的是,这些重复二肽由有义和反义转录物二者表达。本领域中存在对以下的需求:使毒性c9orf72有义和反义转录物以及来源于c9orf72有义和反义转录物的二肽重复蛋白的表达或活性有效地沉默或抑制。
5.发明概述
6.在一个方面中,本公开内容提供了反义寡核苷酸,其包含与在一个方面中,本公开内容提供了反义寡核苷酸,其包含与或或的c9orf72反义转录物序列互补的区域。在一个实施方案中,反义寡核苷酸的长度为8至80个核苷酸。在另一个实施方案中,反义寡核苷酸的长度为10至30个核苷酸。
7.反义寡核苷酸可包含一个或更多个经修饰核苷酸。在一个实施方案中,一个或更多个经修饰核苷酸各自独立地包含核糖基团、磷酸基团、核碱基、或其组合的修饰。
8.核糖基团的每个修饰可独立地选自:2
’‑
o-甲基、2
’‑
氟、2
’‑
h、2
’‑
o-(2-甲氧基乙基)(moe)、2
’‑
o-烷基、2
’‑
o-烷氧基、2
’‑
o-烷基氨基、2
’‑
nh2或约束的核苷酸(constrained nucleotide)。约束的寡核苷酸可以是锁核酸(locked nucleic acid,lna)、乙基-约束的核
苷酸、2
’‑
(s)-约束的乙基(s-cet)核苷酸、约束的moe、2
’‑
o,4
’‑
c-氨基亚甲基桥接核酸(2’,4
’‑
bna
nc
)、α-l-锁核酸、三环-dna、或其任意组合。在一个实施方案中,核糖基团的修饰是2
’‑
o-(2-甲氧基乙基)(moe)。
9.磷酸基团的每个修饰可独立地选自:硫代磷酸酯、膦酰基乙酸酯(phosphonoacetate,pace)、硫代膦酰基乙酸酯(thiophosphonoacetate,thiopace)、酰胺、三唑、膦酸酯或磷酸三酯修饰。在一个实施方案中,磷酸基团的修饰是硫代磷酸酯。
10.核碱基基团的每个修饰可以是2-硫尿苷、4-硫尿苷、n
6-甲基腺苷、假尿苷、2,6-二氨基嘌呤、肌苷、胸苷、5-甲基胞嘧啶、5-取代的嘧啶、异鸟嘌呤、异胞嘧啶或卤代芳族基团。在一个实施方案中,核碱基基团的修饰是5-甲基胞嘧啶。
11.在一些代表性实施方案中,反义核苷酸包含式a-b-c,其中:a包含约0至约8个经修饰核苷酸;b包含约4至约18个脱氧核糖核酸(deoxyribonucleic acid,dna)核苷酸和/或dna样核苷酸;并且c包含约0至约8个经修饰核苷酸;并且反义寡核苷酸的总长度为约10至约30个核苷酸。在一个实施方案中,a包含约2至约6个经修饰核苷酸,b包含约6至约12个dna核苷酸和/或dna样核苷酸,并且c包含约2至约6个经修饰核苷酸。在另一个实施方案中,a包含约5个经修饰核苷酸,b包含约8个dna核苷酸和/或dna样核苷酸,并且c包含约5个经修饰核苷酸。在另一个实施方案中,a包含约2至约6个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约6至约12个dna样核苷酸,并且c包含约2至约6个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸(locked 2
’‑
o-(2-methoxyethyl)(moe)modified nucleotide)。在又一个实施方案中,a包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约8个dna样核苷酸,并且c包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸。在另一个实施方案中,a包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约10个dna样核苷酸,并且c包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸。
12.在一个示例性实施方案中,反义寡核苷酸与配体缀合。在另一个实施方案中,反义寡核苷酸包含与seq id no:5至8
13.中任一个所示核酸序列具有至少90%序列同一性的核酸序列。在另一个实施方案中,反义寡核苷酸包含的序列修饰模式,其中s表示硫代磷酸酯核苷酸间键(phosphorothioate internucleotide linkage);o表示磷酸二酯核苷酸间键(phosphodiester internucleotide linkage);并且x是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷、鸟苷、胞苷或胸腺嘧啶,并且每个胞嘧啶可以是5-甲基胞嘧啶。
14.在第二个方面中,本公开内容提供了反义核苷酸,其包含序列cstocogoascsgscsastststststsascotototsc,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;
15.a是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷;g是包含2
’‑
o-(2-甲氧基乙基)修饰的鸟苷;c是包含2
’‑
o-(2-甲氧基乙基)修饰的胞苷;t是包含2
’‑
o-(2-甲氧基乙基)修饰的胸
腺嘧啶;并且每个胞嘧啶是5-甲基胞嘧啶。
16.在第三个方面中,本公开内容提供了反义寡核苷酸,其包含与的c9orf72有义转录物序列互补的区域,其中反义寡核苷酸包含从5’至3’为sooosssssssssooos的核苷酸间键,其中每个s是硫代磷酸酯键,并且每个o是磷酸二酯键。在一个实施方案中,反义寡核苷酸的长度为18至80个核苷酸。在另一个实施方案中,反义寡核苷酸的长度为18至30个核苷酸。
17.反义寡核苷酸可包含一个或更多个经修饰核苷酸。一个或更多个经修饰核苷酸可各自独立地包含核糖基团的修饰、磷酸基团的修饰、核碱基的修饰、或其组合。
18.在一个实施方案中,核糖基团的每个修饰独立地选自:2
’‑
o-甲基、2
’‑
氟、2’,2
’‑
o-(2-甲氧基乙基)(moe)、2
’‑
o-烷基、2
’‑
o-烷氧基、2
’‑
o-烷基氨基、2
’‑
nh2或双环核苷酸。双环核苷酸可选自:锁核酸(lna)、乙基-约束的核苷酸、2
’‑
(s)-约束的乙基(s-cet)核苷酸、约束的moe、2
’‑
o,4
’‑
c-氨基亚甲基桥接核酸(2’,4
’‑
bna
nc
)、α-l-锁核酸、三环-dna、或其任意组合。在一个实施方案中,核糖基团的修饰是2
’‑
o-(2-甲氧基乙基)(moe)。
19.在另一个实施方案中,磷酸基团的每个修饰可以是硫代磷酸酯、膦酰基乙酸酯(pace)、硫代膦酰基乙酸酯(thiopace)、酰胺、三唑、膦酸酯或磷酸三酯修饰。
20.在另一个实施方案中,核碱基基团的每个修饰可以是2-硫尿苷、4-硫尿苷、n
6-甲基腺苷、假尿苷、2,6-二氨基嘌呤、肌苷、胸苷、5-甲基胞嘧啶、5-取代的嘧啶、异鸟嘌呤、异胞嘧啶或卤代芳族基团。
21.在一些代表性实施方案中,反义核苷酸包含式a-b-c,其中:a包含约0至约8个经修饰核苷酸;b包含约4至约18个脱氧核糖核酸(dna)核苷酸和/或dna样核苷酸;并且c包含约0至约8个经修饰核苷酸;并且反义寡核苷酸的总长度为约10至约30个核苷酸。在一个实施方案中,a包含约2至约6个经修饰核苷酸,b包含约6至约12个dna核苷酸和/或dna样核苷酸,并且c包含约2至约6个经修饰核苷酸。在另一个实施方案中,a包含约5个经修饰核苷酸,b包含约8个dna核苷酸和/或dna样核苷酸,并且c包含约5个经修饰核苷酸。在另一个实施方案中,a包含约2至约6个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约6至约12个dna样核苷酸,并且c包含约2至约6个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸。在又一个实施方案中,a包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约8个dna样核苷酸,并且c包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸。在另一个实施方案中,a包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约10个dna样核苷酸,并且c包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸。
22.在一个示例性实施方案中,反义寡核苷酸与配体缀合。在另一个实施方案中,反义寡核苷酸包含与seq id no:10听示核酸序列具有至少90%序列同一性的核酸序列。在另一个实施方案中,反义寡核苷酸包含的序列修饰模式,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;并且x是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷、鸟苷、胞苷或胸腺嘧啶,并且每个胞嘧啶可以是5-甲基胞嘧啶。
23.在第四个方面中,本公开内容提供了反义寡核苷酸,其包含序列gscocococstsas
gscsgscsgscsgoaocotsc,其中s表示硫代磷酸酯核苷酸间键o表示磷酸二酯核苷酸间键;
24.a是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷;g是包含2
’‑
o-(2-甲氧基乙基)修饰的鸟苷;c是包含2
’‑
o-(2-甲氧基乙基)修饰的胞苷;t是包含2
’‑
o-(2-甲氧基乙基)修饰的胸腺嘧啶;并且每个胞嘧啶是5-甲基胞嘧啶。
25.在第五个方面中,提供了组合(combination),其包含含有与c9orf72反义转录物序列互补的区域的一种或更多种反义寡核苷酸和含有与c9orf72有义转录物序列互补的区域的一种或更多种反义寡核苷酸。
26.在一个实施方案中,反义寡核苷酸包含与
[0027]027]
或的c9orf72反义转录物序列互补的区域。在另一个实施方案中,反义寡核苷酸包含与5
′
gagtcgcgcgctaggggc3
′
(seq id no:9)的c9orf72有义转录物序列互补的区域。在一个实施方案中,一种或更多种反义寡核苷酸的长度为8至80个核苷酸。在另一个实施方案中,一种或更多种反义寡核苷酸的长度为10至30个核苷酸。
[0028]
所述组合的一种或更多种反义寡核苷酸可包含一个或更多个经修饰核苷酸。在一个实施方案中,一个或更多个经修饰核苷酸各自独立地包含核糖基团、磷酸基团、核碱基、或其组合的修饰。
[0029]
核糖基团的每个修饰可以是2
’‑
o-甲基、2
’‑
氟、2
’‑
h、2
’‑
o-(2-甲氧基乙基)(moe)、2
’‑
o-烷基、2
’‑
o-烷氧基、2
’‑
o-烷基氨基、2
’‑
nh2或约束的核苷酸。约束的寡核苷酸可以是锁核酸(lna)、乙基-约束的核苷酸、2
’‑
(s)-约束的乙基(s-cet)核苷酸、约束的moe、2
’‑
o,4
’‑
c-氨基亚甲基桥接核酸(2’,4
’‑
bna
nc
)、α-l-锁核酸、三环-dna、或其任意组合。在一个实施方案中,核糖基团的修饰是2
’‑
o-(2-甲氧基乙基)(moe)。
[0030]
磷酸基团的每个修饰可以是硫代磷酸酯、膦酰基乙酸酯(pace)、硫代膦酰基乙酸酯(thiopace)、酰胺、三唑、膦酸酯或磷酸三酯修饰。在一个实施方案中,磷酸基团的修饰是硫代磷酸酯。
[0031]
核碱基基团的每个修饰是2-硫尿苷、4-硫尿苷、n
6-甲基腺苷、假尿苷、2,6-二氨基嘌呤、肌苷、胸苷、5-甲基胞嘧啶、5-取代的嘧啶、异鸟嘌呤、异胞嘧啶或卤代芳族基团。在一个实施方案中,核碱基基团的修饰是5-甲基胞嘧啶。
[0032]
在一些代表性实施方案中,所述组合包含式a-b-c,其中:a包含约0至约8个经修饰核苷酸;b包含约4至约18个脱氧核糖核酸(dna)核苷酸和/或dna样核苷酸;并且c包含约0至约8个经修饰核苷酸;并且反义寡核苷酸的总长度为约10至约30个核苷酸。在一个实施方案中,a包含约2至约6个经修饰核苷酸,b包含约6至约12个dna核苷酸和/或dna样核苷酸,并且c包含约2至约6个经修饰核苷酸。在另一个实施方案中,a包含约5个经修饰核苷酸,b包含约8个dna核苷酸和/或dna样核苷酸,并且c包含约5个经修饰核苷酸。在另一个实施方案中,a包含约2至约6个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约6至约12个dna样核苷酸,并且c包含约2至约6个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸。在又一个实施方案中,a包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约8个dna样核苷酸,并且c
包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸。在另一个实施方案中,a包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰核苷酸,b包含约10个dna样核苷酸,并且c包含约5个经2
’‑
o-(2-甲氧基乙基)(moe)修饰锁核苷酸。
[0033]
在一个示例性实施方案中,反义寡核苷酸与配体缀合。在另一个实施方案中,所述组合包含与seq id no:10听示核酸序列具有至少90%序列同一性的核酸序列。在另一个实施方案中,所述组合包含xsxoxoxoxsxsxsxsxsxsxsxsxsxsxsxoxoxoxsx的序列修饰模式,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;并且x是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷、鸟苷、胞苷或胸腺嘧啶,并且每个胞嘧啶可以是5-甲基胞嘧啶。
[0034]
在一个实施方案中,所述组合的两个或更多个反义寡核苷酸通过接头连接在一起。接头可以是可切割接头,例如在被切割时降解的可切割接头。在一个实施方案中,可切割接头是包含磷酸二酯键的核酸酶可切割接头。可切割接头可包含约2至约8个核苷酸,例如约6个核苷酸。在一些示例性实施方案中,可切割接头在还原条件或改变的ph条件下被切割。在另一个实施方案中,可切割接头被胞内或内体核酸酶切割。在另一个实施方案中,可切割接头被胞内或内体蛋白酶切割。
[0035]
在第六个方面中,提供了用于在细胞中抑制c9orf72基因表达的方法,所述方法包括:(a)将上述实施方案中任一个的合适的反义寡核苷酸引入到细胞中;以及(b)将步骤(a)中产生的细胞维持足以获得c9orf72基因的转录物降解的时间,从而在细胞中抑制c9orf72基因表达。
[0036]
在第七个方面中,提供了治疗或控制(managing)肌萎缩侧索硬化(als)的方法,其包括向需要这样的治疗或控制的患者施用治疗有效量的上述实施方案中任一个的合适的反义寡核苷酸。可将反义寡核苷酸施用于患者的脑。施用的一些示例性方法包括鞘内、脑室内或纹状体内注射或输注,例如通过使用奥马耶储器(ommaya reservoir)或鞘内导管进行。在某些实施方案中,反义寡核苷酸以约0.5mg/ml至约5.0mg/ml的剂量施用。
[0037]
在第八个方面中,提供了用于在细胞中抑制c9orf72基因表达的方法,所述方法包括:(a)将上述实施方案中任一个的合适的反义寡核苷酸的组合引入到细胞中;以及(b)将步骤(a)中产生的细胞维持足以获得c9orf72基因的有义和反义转录物的降解的时间,从而在细胞中抑制c9orf72基因表达。
[0038]
在第九个方面中,提供了治疗或控制肌萎缩侧索硬化(als)的方法,其包括向需要这样的治疗或控制的患者施用治疗有效量的上述实施方案中任一个的合适的反义寡核苷酸的组合。可将反义寡核苷酸施用于患者的脑。施用的一些示例性方法包括鞘内、脑室内或纹状体内注射或输注,例如通过使用奥马耶储器或鞘内导管进行。所述组合的反义寡核苷酸可依次或同时施用。
[0039]
在第十个方面中,提供了在患者中降低二肽重复蛋白的水平的方法,其包括向需要这样的降低的患者施用治疗有效量的上述实施方案中任一个的反义寡核苷酸。在某些实施方案中,将反义寡核苷酸施用于患者的脑。在某些实施方案中,反义寡核苷酸通过鞘内、脑室内或纹状体内注射或输注来施用。在某些实施方案中,注射或输注包括使用奥马耶储器或鞘内导管进行施用。在某些实施方案中,二肽重复蛋白包含以下中的一种或更多种:聚(gp)、聚(gr)、聚(ga)、聚(pa)和聚(pr)。在某些实施方案中,二肽重复蛋白是聚(gp)。
[0040]
附图简述
[0041]
通过以下结合附图对举例说明性实施方案的详细描述,将更全面地理解本发明的前述和其他特征和优势。本专利或申请文件包含至少一幅彩色绘制的附图。在请求并且支付必要的费用之后,官方将提供带有彩色附图的本专利或专利申请公开的副本。
[0042]
图1a示出了c9orf72转录物变体和如pubmed中命名的两种蛋白质同种型的示意图,以及aso结合位点的示意图。位于第一内含子中的重复扩增(三角形)在变体1和3(v1-v3)中表达。最丰富的变体2(v2),从不同的转录起始位点(黑色箭头)开始,并且不包含重复扩增。v2和v3编码主要的c9orf72蛋白同种型。深灰色框表示非翻译区(untranslated region,utr);浅灰色框表示编码外显子;黑色线表示内含子。本研究中使用的aso(灰色条)靶向侧翼为重复扩增的内含子区域。
[0043]
图1b示出了本实施例中使用的aso及其化学修饰的示意图:绿色圆圈,锁核酸(lna);蓝色圆圈,2
’‑
o-2-甲氧基乙基rna(2
’‑
o-moe);空心圆圈,dna;深绿色三角形,硫代磷酸酯核苷酸键(ps)。
[0044]
图2a示出了克隆到双萤光素酶测定系统中的包含两个重复基序的c9orf72非编码区的示意图。
[0045]
图2b示出了验证c9载体来源成纤维细胞中g4c2重复扩增的southern印迹和rna fish数据。左图,用5’dig-(g4c2)
5-dig-3’dna探针探测的从来自两个c9载体的成纤维细胞中提取的基因组dna的southern印迹显示出约10kbp的条带,代表约1000个重复的扩增。相比之下,来自健康对照成纤维细胞(非c9载体)的dna未显示出条带。右图,在成纤维细胞中使用重复特异性经cy3标记的dna探针进行的rna fish示出了以红色显示的多个rna病灶(白色箭头)。
[0046]
图3a示出了在患者来源成纤维细胞中在脂质介导的递送之后72小时,lna和2
’‑
o-moe aso二者在100nm的剂量下均显著降低了含有重复的转录物水平,如通过qrt-pcr所测量的。
[0047]
图3b示出了在患者来源成纤维细胞(左图)和用c9luc报道测定转染的hek293细胞(右图)中aso的剂量响应。数据根据五点非线性拟合剂量响应曲线绘制。
[0048]
图4a示出了在未经处理或用aso处理72小时的患者来源成纤维细胞中通过fish显现的rna病灶的代表性图像(左图);以及当细胞未用aso处理、用非靶向对照aso(ntc)处理、用经lna修饰aso(aso1至3)处理或用经2
’‑
o-moe修饰aso(aso 4至5)处理时,每50个无病灶(浅灰色)、具有1至4个病灶(深灰色)或具有多于5个病灶(黑色)的细胞的细胞核的百分比(右图)。
[0049]
图4b示出了在来源于c9bac小鼠的原代皮质神经元中在无脂质辅助的情况下递送(剥裸性递送(gymnotic delivery))之后两周,lna和2
’‑
o-moe aso二者在100nm的剂量下均显著降低含有重复的转录物的水平,如通过qrt-pcr所测量的。
[0050]
图5a示出了aso序列及其在icv推注注射之后在4至6月龄的野生型小鼠中的体内响应:粗体绿色,lna;粗体蓝色,moe;斜体黑色,dna。
[0051]
图5b示出了杂合c9bac小鼠中的实验设计示意图(上图),并且aso3和aso5(绿色)被神经元(红色)吸收——细胞核复染为蓝色。在上图中,将载剂对照(pbs)、非靶向对照aso(ntc)以及25至200nmol的aso3和aso5输注到5至6月龄的c9bac小鼠的右侧脑室中,历经7
天。在移除泵之后两周收获并解剖脑和脊髓进行rna和dpr分析(脊髓和同侧脑半球)以及aso染色(对侧脑半球)。
[0052]
图6a至图6b示出了在以指定剂量输注pbs(深灰色)、ntc aso(浅灰色)、aso3(绿色)或aso5(蓝色)的小鼠中通过qrt-pcr量化的皮质和脊髓中的v1-v3含有重复的转录物(图6a)和所有转录物(图6b)的表达。对于每个剂量水平,n=5至7,而ntc组(n=3)除外。
[0053]
图7a示出了通过夹心免疫测定测定的用aso3(绿色)和aso5(蓝色)处理的小鼠的皮质中聚gp的相对表达。数据表示为平均值
±
sem(上图)和相对于处理之前在终点时体重损失的百分比(下图)。
[0054]
图7b示出了在推注注射之后三周在野生型c57bl6小鼠中完全经ps修饰的aso的分布。图a至b:注射了pbs(a)或aso(b)的小鼠半脑的矢状视图。绿色表示aso分布,蓝色表示细胞核。图c:注射了aso的小鼠的冠状视图。
[0055]
图8a示出了aso5及其衍生物(aso5-1和aso5-2)以及它们的化学结构。左图:aso5及其衍生物(aso5-1和aso5-2)-化学式以及在icv推注注射之后在5至6月龄的野生型c57bl/6小鼠中体内评价的以nmol计的最大耐受剂量(maximum tolerated dose,mtd)。右图:绿色三角形,硫代磷酸酯键(ps);
[0056]
图8b示出了100nm的混合ps/po对aso5在患者来源成纤维细胞中对v1-v3(左)或所有表达水平(右图)的效力的作用。
[0057]
图9a示出了在72小时时对aso5、aso5-1和aso5-2的剂量响应,如通过萤光素酶测定所测量的。
[0058]
图9b示出了在杂合c9bac小鼠中的实验设计结果的示意图。左图,将载剂对照(pbs)、aso5、aso5-1或aso5-2注射到5至6月龄的c9bac小鼠的右侧脑室中。在处理之后八周收获并解剖脑和脊髓进行rna和dpr分析。右图,当小鼠用aso处理时,在处理之后八周未观察到体重的显著变化。
[0059]
图10a示出了在施用30nmol的每种aso之后八周,在用pbs(深灰色)、aso5(浅蓝色)、aso5-1(中蓝色)和aso5-2(深蓝色)处理的小鼠中通过qrt-pcr量化的皮质和脊髓中的v1-v3含有重复的转录物的表达。对于每个aso组,n=5至7。
[0060]
图10b示出了在脑和脊髓中v1-v3转录物对aso5和aso5-1的剂量响应,如通过qrt-pcr所测量的。
[0061]
图11示出了在脑室内注射aso5-2之后3周时的血液化学的图。
[0062]
图12a示出了在施用30nmol的每种aso之后八周,在用pbs(深灰色)、aso5(浅蓝色)、aso5-1(中蓝色)和aso5-2(深蓝色)处理的小鼠中通过qrt-pcr量化的皮质和脊髓中的所有转录物的表达。对于每个aso组,n=5至7。
[0063]
图12b示出了在脑和脊髓中所有转录物对aso5和aso5-1的剂量响应。
[0064]
图13a至图13b示出了在施用30nmol的每种aso之后八周,在用pbs(深灰色)、aso5(浅蓝色)、aso5-1(中蓝色)和aso5-2(深蓝色)处理的小鼠的皮质和脊髓中聚二肽聚gp(图13a)和聚pr(图13b)的表达。对于每个aso组,n=5至7。
[0065]
图14a示出了在杂合c9bac小鼠中的时间进程实验的实验设计示意图。在5至6月龄的杂合c9bac小鼠中施用载剂对照(pbs)和单次注射的1、5、15、30、60或80nmol的aso5-2。在处理之后24小时、3、8、12或20周收集并分析脑和脊髓。
[0066]
图14b示出了在用pbs,1、5、15、30或60nmol的aso5-2注射到右侧脑室中之后3周,在小鼠中通过qrt-pcr测量的v1-v3含有重复的转录物(左上)和所有转录物(左下)的表达。右图:使用希尔方程(hill equation)非线性回归模型之后的剂量响应曲线。
[0067]
图15a示出了在用pbs,1、5、15、30或60nmol的aso5-2注射到右侧脑室中之后3周,在小鼠中通过qrt-pcr测量的聚-gp(左)和聚-pr(右)的表达。右图:使用希尔方程非线性回归模型之后的剂量响应曲线。
[0068]
图15b示出了在用aso5-2处理的小鼠中进行的时间进程实验。在处理之后24小时、3周、8周、12和20周收集并分析组织。在单次推注注射aso5-2(30nmol剂量,除非另有说明)之后24小时、3、8、12或20周,在皮质中分析v1-v3(含有重复)转录物的表达。
[0069]
图16a示出了皮质中的v1-v3(含有重复)转录物和所有转录物的表达。在单次剂量注射30nmol的aso5、aso5-1和aso5-2之后8周进行分析。对于每组,n=5至7。
[0070]
图16b示出了在用30nmol的aso5-2处理的小鼠中进行的时间进程实验。在处理之后24小时、3周、8周、12和20周收集并分析组织。在单次剂量注射aso5-2之后24小时、3、8、12或20周在皮质中分析聚-gp的表达。
[0071]
图17a示出了皮质中的聚-gp和聚-pr的表达。在单次剂量注射30nmol的aso5、aso5-1和aso5-2之后8周进行分析。对于每组,n=5至7。
[0072]
图17b示出了在处理之后在全身(左)、脾(中)、肝(右)或形态中未观察到显著重量变化。
[0073]
图18a示出了在处理进程期间aso处理在5分钟加速旋转仪任务(rotarod task)中未改变运动表现。
[0074]
图18b示出了在用载剂对照或靶向c9反义转录物的aso处理72小时之后,每100个无反义病灶(浅灰色)、具有1至9个反义病灶(深灰色)或具有多于10个反义病灶(黑色)的成纤维细胞的细胞核的百分比。红色星表示在体内测试的aso。
[0075]
图19a至图19b示出了对c9orf72的有义和反义转录物表达的组合抑制作用。示出了来源于baloh实验室的杂合c9小鼠中的实验设计示意图(图19a左)。在注射载剂对照(pbs)、60nmol的非靶向对照(ntc)、30nmol的aso5-2或as aso6以及30nmol aso5-2和30nmol aso6的组合之后3周,分析了如通过qrt-pcr测定的v1-v3(含有重复)转录物(图19a,中)和所有转录物(图19a,右)、如通过quantigene支链dna测定测定的有义的含有重复的转录物(图19b,左)和反义的含有重复的转录物(图19b,右)的表达。
[0076]
图20示出了用靶向有义和反义的含有重复的转录物的aso组合处理可同时降低聚-gp(左)和聚-pr(右)的表达。在注射载剂对照(pbs)、60nmol的非靶向对照(ntc)、30nmol的aso5-2或as aso6以及30nmol aso5-2和30nmol aso6的组合之后3周分析小鼠。
[0077]
图21示出了在患有c9orf72 als的患者中aso5-2处理的剂量递增研究。递增剂量的aso5-2(条,右侧y轴)和随时间推移递增数目的剂量(x轴)与聚gp水平(点和线,左侧y轴)的降低相关。
[0078]
图22示出了在开始用aso5-2处理之后聚(gp)的csf水平随时间推移的一致下降。
[0079]
发明详述
[0080]
本公开内容提供了用于沉默c9orf72转录物的反义化合物、方法和组合物。本文中所述主题主要基于以下发现:某些rnase h依赖性反义化合物在安全性和沉默c9orf72转录
物方面提供了出乎意料的改进。本公开内容提供了用于在有此需要的对象中治疗、预防或减轻与c9orf72相关的疾病、障碍和病症的反义化合物、方法和组合物。还考虑了用于制备用于治疗、预防或减轻与c9orf72相关的疾病、障碍或病症的药物的反义化合物和方法。c9orf72相关的疾病、障碍和病症包括但不限于神经系统疾病和障碍,例如家族性额颞痴呆(familial frontotemporal dementia,ftd)和肌萎缩侧索硬化(als)。
[0081]
应理解,本公开内容中描述的方法不限于本文中公开的特定方法和实验条件,因为这样的方法和条件可以变化。还应理解,本文中使用的术语仅出于描述特定实施方案的目的,并不旨在进行限制。
[0082]
此外,除非另有说明,否则本文中描述的实验使用本领域技术范围内的常规分子和细胞生物学和免疫学技术。这样的技术是技术工作者公知的,并且在文献中进行了充分解释。参见,例如ausubel,et al.,ed.,current protocols in molecular biology,john wiley&sons,inc.,ny,n.y.(1987-2008),包括所有补充,mr green和j.sambrook和harlow等人的molecular cloning:a laboratory manual(第四版),antibodies:a laboratory manual,chapter 14,cold spring harbor laboratory,cold spring harbor(2013,第二版)。
[0083]
除非在本文中另有定义,否则本文中使用的科学和技术术语具有本领域普通技术人员通常所理解的含义。在任何潜在歧义的情况下,本文中提供的定义优先于任何字典或外在定义。除非上下文另外需要,否则单数术语应包括复数形式,并且复数术语应包括单数形式。除非另有说明,否则“或”的使用意指“和/或”。术语“包括”以及其他形式例如“包含”和“含有”的使用不是限制性的。
[0084]
通常来说,本文中所述的与细胞与组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白质与核酸化学以及杂交结合使用的命名是本领域公知和通常使用的那些。除非另有说明,否则本文中提供的方法和技术通常根据本领域公知并且如本说明书通篇引用和讨论的多种一般性和更具体的参考文献中所述的常规方法进行。酶促反应和纯化技术根据制造商说明进行,如本领域中通常实施的或如本文中所述。本文中所述的与分析化学、合成有机化学以及药物和药物化学结合使用的命名及所述分析化学、合成有机化学以及药物和药物化学的实验室操作和技术是本领域公知和通常使用的那些。使用标准技术进行化学合成、化学分析、药物制备、配制和递送以及患者的治疗。
[0085]
为了使本发明可以更容易地理解,首先定义了某些术语。
[0086]
术语“核苷”是指具有与核糖或脱氧核糖糖共价连接的嘌呤或嘧啶碱基的分子。一些示例性核苷包括腺苷、鸟苷、胞苷、尿苷和胸苷。另外的示例性核苷包括肌苷、1-甲基肌苷、假尿苷、5,6-二氢尿苷、核糖苷、2n-甲基鸟苷和2,2n,n-二甲基鸟苷(也被称为“罕用”核苷)。术语“核苷酸”是指具有以酯键与糖部分连接的一个或更多个磷酸基团的核苷。一些示例性核苷酸包括核苷单磷酸、二磷酸和三磷酸。术语“多核苷酸”和“核酸分子”在本文中可互换使用,并且是指通过5’与3’碳原子之间的磷酸二酯或硫代磷酸酯键连接在一起的核苷酸聚合物。
[0087]
术语“rna”或“rna分子”或“核糖核酸分子”是指核糖核苷酸(例如2、3、4、5、10、15、20、25、30或更多个核糖核苷酸)的聚合物。rna核苷酸是指单个核糖核苷酸。术语“dna”或“dna分子”或“脱氧核糖核酸分子”是指脱氧核糖核苷酸的聚合物。dna核苷酸是指单个脱氧
核糖核苷酸。本文中使用的术语“dna样”是指与对应的未经修饰dna单元的构象类似的例如经修饰核苷或核苷酸的构象。例如,dna样核苷酸可以是指与相应的未经修饰脱氧核糖核苷酸类似的经修饰脱氧核糖核苷酸的构象。dna样核苷酸的一些实例包括但不限于,例如2
’‑
脱氧核糖核苷酸、2
’‑
脱氧-2
’‑
取代的阿拉伯糖核苷酸(例如,2
’‑
脱氧-2
’‑
氟阿拉伯糖核苷酸,在本领域中也被称为2’f-ana或fana),以及相应的硫代磷酸酯类似物。本文中使用的术语“rna样”是指与对应的未经修饰rna单元的构象类似的例如经修饰核苷或核苷酸的构象。rna样构象可采用a型螺旋,而dna样构象采用b型螺旋。rna样核苷酸的一些实例包括但不限于,例如2
’‑
取代的-rna核苷酸(例如,2
’‑
氟-rna核苷酸,在本领域中也被称为2’f-rna)、锁核酸(lna)核苷酸(在本领域也被称为桥接核酸或双环核苷酸)、2
’‑
氟-4
’‑
硫代阿拉伯糖核苷酸(在本领域也被称为4’s-fana核苷酸)、2
’‑
o-烷基-rna,以及相应的硫代磷酸酯类似物。
[0088]
可天然合成dna和rna(例如,分别通过dna复制或dna转录)。rna可经转录后修饰。也可以化学合成dna和rna。dna和rna可以是单链(即分别为ssrna和ssdna)或多链(例如,双链,即分别为dsrna和dsdna)。“mrna”或“信使rna”是指定一个或更多个多肽链的氨基酸序列的单链rna。当核糖体与mrna结合时,该信息在蛋白质合成期间被翻译。
[0089]
本文中使用的术语“小干扰rna(small interfering rna)”(“sirna”)(在本领域中也被称为“短干扰rna”)是指能够指导或介导rna干扰的包含约10至50个核苷酸(或核苷酸类似物)的rna(或rna类似物)。优选地,sirna包含约15至30个核苷酸或核苷酸类似物,更优选约16至25个核苷酸(或核苷酸类似物),甚至更优选约18至23个核苷酸(或核苷酸类似物),甚至更优选约18至23个核苷酸(或核苷酸类似物),并且甚至更优选19至22个核苷酸(或核苷酸类似物)(例如,19、20、21或22个核苷酸或核苷酸类似物)。术语“短”sirna是指包含约21个核苷酸(或核苷酸类似物),例如19、20、21或22个核苷酸的sirna。术语“长”sirna是指包含约24至25个核苷酸,例如23、24、25或26个核苷酸的sirna。在一些情况下,短sirna可包含少于19个核苷酸,例如16、17或18个核苷酸,前提是更短的sirna保留了介导rnai的能力。同样,在一些情况下,长sirna可包含多于26个核苷酸,前提是更长的sirna保留了在无需进一步加工(例如酶促加工为短sirna)的情况下介导rnai的能力。
[0090]
术语“核苷酸类似物”或“改变的核苷酸”或“经修饰核苷酸”是指非标准核苷酸,包括非天然存在的核糖核苷酸或脱氧核糖核苷酸。一些示例性经修饰核苷酸在任何位置被修饰,以便改变核苷酸的某些化学特性而保留经修饰核苷酸执行其预期功能的能力。可进行衍生的核苷酸位置的一些实例包括5位,例如5-(2-氨基)丙基尿苷、5-溴尿苷、5-丙炔尿苷、5-丙烯基尿苷等;6位,例如,6-(2-氨基)丙基尿苷;腺苷和/或鸟苷的8-位,例如,8-溴鸟苷、8-氯鸟苷、8-氟鸟苷等。经修饰核苷酸还包括脱氮核苷酸,例如,7-脱氮-腺苷;经o-和n-修饰的(例如,烷基化的,例如,n6-甲基腺苷,或如本领域已知的其他方式)核苷酸;以及其他经杂环修饰的核苷酸,例如在herdewijn,antisense nucleic acid drug dev.,2000aug.10(4):297-310中描述的那些。
[0091]
经修饰核苷酸还可包括对核苷酸的糖部分的修饰。例如,2’oh-基团可被选自h、or、r、f、cl、br、i、sh、sr、nh2、nhr、nr2、coor或or的基团替代,其中r是经取代或未经取代的c
1-c6烷基、烯基、炔基、芳基等。又例如,核糖糖可被双环或三环部分替代,例如在锁核酸、约束的乙基、三环dna或者其他桥接或双环修饰中。其他可以的修饰包括在美国专利no.5,
858,988和6,291,438中描述的那些。
[0092]
核苷酸的磷酸基团也可以被修饰,例如,通过用硫取代磷酸基团的一个或更多个氧(例如,硫代磷酸酯),或通过进行允许核苷酸执行其预期功能的其他取代,例如描述于,例如eckstein,antisense nucleic acid drug dev.2000apr.10(2):117-21,rusckowski et al.antisense nucleic acid drug dev.2000oct.10(5):333-45,stein,antisense nucleic acid drug dev.2001oct.11(5):317-25,vorobjev et al.antisense nucleic acid drug dev.2001apr.11(2):77-85和美国专利no.5,684,143中。某些上述修饰(例如磷酸基团修饰)在体内或体外降低了例如包含所述类似物的多核苷酸的水解速率。
[0093]
本文中使用的术语“未经修饰核苷酸”或“非修饰核苷酸”是指由天然存在的核碱基、糖部分和核苷酸间键构成的核苷酸。在一些实施方案中,非修饰核苷酸是rna核苷酸(即β-d-核糖核苷)或dna核苷酸(即β-d-脱氧核糖核苷)。
[0094]
术语“寡核苷酸”是指核苷酸和/或经修饰核苷酸的短聚合物。如上所述,与用磷酸二酯键连接的寡核苷酸相比,寡核苷酸可用导致较低水解速率的键连接。例如,寡核苷酸的核苷酸可包含三唑、酰胺、氨基甲酸酯、亚甲基二醇、乙二醇、氧基甲硫基、氧基乙硫基、氧基羰基氧基、二酰胺磷酸酯、氨基磷酸酯、膦酸酯和/或硫代磷酸酯键。寡核苷酸的改变或修饰还可包括添加非核苷酸物质,例如添加至寡核苷酸的末端或内部(在寡核苷酸的一个或更多个核苷酸处)。
[0095]
本文中使用的术语“反义化合物”是指能够抑制或“沉默”靶基因表达的化合物。在某些实施方案中,反义化合物能够通过转录后沉默机制阻止转录物分子的完全加工(例如,完全翻译和/或表达)。反义化合物包括但不限于反义寡核苷酸、间隔体(gapmer)分子和双功能寡核苷酸,以及其前体。在一些实施方案中,反义化合物指导核糖核酸酶h(rnase h)切割靶核酸。例如,本公开内容的反义化合物可以是指导rnase h切割c9orf72转录物的反义寡核苷酸。rnase h是通过水解机制催化rna/dna底物中rna切割的非序列特异性内切核酸酶酶家族。
[0096]
术语“间隔体”意指其中具有支持rnase h切割的多个核苷的内部区域位于具有一个或更多个核苷的外部区域之间的嵌合反义化合物,其中包含内部区域的核苷在化学上不同于包含外部区域的一个或更多个核苷。内部区域可被称为“间隔区段”,而外部区域可被称为“翼区段(wing segment)”。“嵌合反义化合物”意指具有至少两个在化学上不同的区域的反义化合物。
[0097]
本文中使用的术语“靶基因”是其表达待被显著抑制或“沉默”的基因。这种沉默可通过rna沉默来实现,例如,通过切割对应于靶基因的转录物或靶基因的翻译抑制。术语“非靶基因”是其表达不被显著沉默的基因。例如,本发明的靶基因为c9orf72,并且本发明的非靶基因为不是c9orf72的基因。在一个实施方案中,靶基因和非靶基因的多核苷酸序列(例如,靶基因和非靶基因编码的mrna)可因一个或更多个核苷酸而不同。在另一个实施方案中,靶基因和非靶基因可因一个或更多个多态性(例如,单核苷酸多态性(single nucleotide polymorphism)或snp)而不同。在另一个实施方案中,靶基因和非靶基因可共有小于100%序列同一性。在另一个实施方案中,非靶基因可以是靶基因的同源物(例如,直系同源物或旁系同源物)。
[0098]
术语“反义活性”意指可归因于反义化合物与其靶核酸杂交的任何可检出或可测
量的活性。在一些实施方案中,反义活性是靶核酸或由这样的靶核酸编码的蛋白质的量或表达的降低。“反义化合物”意指能够通过氢键合与靶核酸经历杂交的寡聚化合物。本文中使用的“反义寡核苷酸”意指具有允许与靶核酸的对应区域或片段杂交的核碱基序列的单链寡核苷酸。
[0099]
术语“反义抑制”意指与在不存在反义化合物的情况下的靶核酸水平或靶蛋白水平相比,在存在具有与靶核酸充分互补的序列的反义寡核苷酸的情况下的靶核酸水平或靶蛋白水平的降低。靶核酸可以是任何核酸。例如,本发明的靶核酸可以是c9orf72转录物。
[0100]
术语“靶识别序列”是指识别靶核酸的反义化合物的部分。靶识别序列具有允许与靶核酸的对应区域或区段杂交的核碱基序列。
[0101]
术语“保守区”是指核酸序列的保守的一个或更多个部分,即核酸序列的具有物种间相似或相同的序列的一个或更多个部分。例如,可使用本领域可用的任何序列比对软件来经计算地鉴定保守区。
[0102]
本文中使用的术语“充分互补”意指rna沉默剂具有足以结合所期望的靶转录物(例如c9orf72转录物)并触发靶转录物的rna沉默(例如,通过rnase h直接切割靶mrna)的序列(例如,具有靶识别序列的反义寡核苷酸)。例如,与靶核酸序列(例如,c9orf72转录物的一部分)具有至少90%互补性的靶识别序列可充分互补以触发c9orf72转录物的沉默。术语“完全互补”是指例如与靶核酸序列具有100%互补性的靶识别序列。互补的核酸分子彼此杂交。术语“杂交”意指互补核酸分子的退火。在某些实施方案中,互补核酸分子包括反义化合物和靶核酸。
[0103]
术语“约”或“大约”意指在给定值或范围的20%以内,例如在10%以内、5%以内或1%以内或更少。
[0104]
本文中使用的“施用”是指将如存在于身体之外的物质(例如,本文中提供的反义化合物)注射或以其他方式物理递送到患者中的动作。本文中所述的反义寡核苷酸可施用于患者的中枢神经系统。中枢神经系统包括脑和脊髓。中枢神经系统的施用方法包括但不限于鞘内、脑室内或纹状体内输注或递送和/或本文中所述或本领域已知的任何其他物理递送方法。脑室内输注可包括使用奥马耶储器进行施用。
[0105]
当控制或治疗疾病或其症状时,物质的施用通常发生在疾病或其症状发作之后。当预防疾病或其症状时,物质的施用通常发生在疾病或其症状发作之前,并且可长期持续以推迟或降低疾病相关症状(例如,所涉组织和气道的损害)的出现或程度。
[0106]
本文中使用的术语“组合物”旨在涵盖以任选地指定量包含指定成分(例如,本文中提供的反义化合物)的产品,以及由任选地指定量的指定成分的组合直接或间接产生的任何产品。
[0107]“有效量”意指足以在需要药剂的个体中实现所期望的生理结果的活性药物药剂(例如,本公开内容的反义化合物)的量。根据待治疗个体的健康和身体状况、待治疗个体的分类组、组合物的制剂、个体医学状况的评估和其他相关因素,有效量可因个体而不同。
[0108]
本文中使用的术语“对象”和“患者”可互换使用。本文中使用的对象可以是哺乳动物,例如非灵长类(例如,牛、猪、马、猫、狗、大鼠等)或灵长类(例如,猴和人)。在某些实施方案中,本文中使用的术语“对象”是指脊椎动物,例如哺乳动物。哺乳动物包括但不限于人、非人灵长类、野生动物(wild animal)、野生动物(feral animal)、农场动物、运动性动物和
宠物。在一个实施方案中,对象是患有c9orf72相关病症(例如,als)的哺乳动物,例如人。在另一个实施方案中,对象是处于发展为c9orf72相关病症的风险的哺乳动物,例如人。
[0109]
本文中使用的术语“治疗”是指可用于预防、控制、治疗和/或减轻疾病或与其相关的症状(例如c9orf72相关病症,例如als)的任何方案、方法和/或药剂。在一些实施方案中,术语“治疗”是指可用于在对象中调节针对感染或与其相关的症状的免疫应答的任何方案、方法和/或药剂。在一些实施方案中,术语“治疗”是指生物治疗、支持治疗和/或本领域技术人员例如医务人员已知的可用于预防、控制、治疗和/或减轻疾病或与其相关的症状(例如c9orf72相关病症)的其他治疗。在另一些实施方案中,术语“治疗”是指生物治疗、支持治疗和/或本领域技术人员例如医务人员已知的可用于在对象中调节针对感染或与其相关的症状的免疫应答的其他治疗。
[0110]
本文中使用的术语“治疗”是指由施用一种或更多种治疗(包括但不限于施用一种或更多种预防或治疗剂,例如本文中提供的反义寡核苷酸)引起的疾病或与其相关的症状(例如c9orf72相关病症)的进展、严重程度和/或持续时间的降低或改善。本文中使用的术语“治疗”还可以是指改变被治疗的对象的疾病进程。治疗的治疗性作用包括但不限于预防疾病的发生或复发、减轻症状、减弱疾病的直接或间接病理后果、降低疾病进展的速度、减轻或缓解疾病状态,以及缓解或改善预后。
[0111]
反义化合物
[0112]
本公开内容提供了能够介导至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更多的c9orf72转录物的切割的反义化合物。在一个实施方案中,反义化合物能够介导至少80%的c9orf72转录物的切割。在一个实施方案中,反义化合物能够介导至少90%的c9orf72转录物的切割。
[0113]
在某些实施方案中,能够介导c9orf72转录物或其部分的切割的反义化合物具有以模式或基序排列的经化学修饰亚基,以赋予反义化合物特性,例如增强的抑制活性、对靶核酸的提高的结合亲和力、或对体内核酸酶降解的抗性。
[0114]
在一些实施方案中,本公开内容的反义化合物是反义寡核苷酸。嵌合反义寡核苷酸通常含有至少一个经修饰区域,以赋予对核酸酶降解的提高的抗性、提高的细胞摄取、对靶核酸的提高的结合亲和力和/或提高的抑制活性。嵌合反义化合物的第二区域可用作切割rna:dna双链体的rna链的细胞内切核酸酶rnase h的底物。在一些实施方案中,本公开内容的反义化合物是具有间隔体基序的嵌合反义寡核苷酸。在间隔体中,具有支持rnase h切割的多个核苷酸的内部区域位于具有在化学上不同于内部区域的核苷的多个核苷酸的外部区域之间。
[0115]
在一些实施方案中,本公开内容提供了具有与c9orf72转录物或其部分充分互补以指导rnase h切割c9orf72转录物的靶识别序列的合成反义寡核苷酸。反义寡核苷酸的靶识别序列可以是反义寡核苷酸的全长或其一部分。在一些实施方案中,反义寡核苷酸包含间隔体基序。
[0116]
在具有间隔体基序的反义化合物的情况下,间隔区段通常用作内切核酸酶切割的底物,而翼区段包含经修饰核苷。在某些实施方案中,间隔体的区域由包含每个独特区域的糖部分的类型区分。在一些实施方案中,用于区分间隔体区域的糖部分的类型可包括β-d-核糖核苷、β-d-脱氧核糖核苷、2
’‑
修饰的核苷(这样的2
’‑
修饰的核苷可包括2
’‑
moe和2
’‑
o-ch3(即ome)等)和经双环糖修饰核苷(这样的经双环糖修饰核苷可包括具有4
’‑
(ch2)
n-o-2’桥的那些,其中n=1或n=2)。在一些实施方案中,每个独特区域包含一致的糖部分。
[0117]
间隔体基序可以使用式“a-b-c”来描述,其中“a”表示5’翼区域的长度,“b”表示间隔区域的长度,并且“c”表示3’翼区域的长度。因此,在一些实施方案中,本公开内容的反义寡核苷酸具有下式:
[0118]
a-b-c。
[0119]
如本文中所用,被描述为“a-b-c”的间隔体具有的构型使得间隔区段紧临近于5’翼区段和3’翼区段中的每一个定位。因此,在5’翼区段与间隔区段之间,或间隔区段与3’翼区段之间不存在中间核苷酸。
[0120]
在一些实施方案中,由“a”表示的5’翼区域包含约0至约8个经修饰核苷酸,例如约1至约6个经修饰核苷酸。例如,由“a”表示的5’翼区域的长度可以是0、1、2、3、4、5、6、7或8个核苷酸。在一些实施方案中,由“c”表示的3’翼区域包含约0至约8个经修饰核苷酸,例如约1至约6个经修饰核苷酸。例如,由“c”表示的3’翼区域的长度可以是0、1、2、3、4、5、6、7或8个核苷酸。在一些实施方案中,“a”和“c”相同,在一些实施方案中,“a”和“c”不同。
[0121]
在一些实施方案中,由“b”表示的间隔区域包含约4至约18个dna核苷酸和/或dna样核苷酸,例如,约4至约12个dna核苷酸和/或dna样核苷酸。例如,由“b”表示的间隔区域的长度可以是4、5、6、7、8、9、10、11、12、13、14、15、16、17或18个dna核苷酸和/或dna样核苷酸。因此,本公开内容的具有靶识别序列为式“a-b-c”的反义寡核苷酸包括但不限于以下间隔体形式,例如1-4-1(即,一个核苷酸-四个核苷酸-一个核苷酸)、1-5-1、1-6-1、1-7-1、1-8-1、1-9-1、1-10-1、1-11-1、1-12-1、2-4-2、2-5-2、2-6-2、2-7-2、2-8-2、2-9-2、2-10-2、2-11-2、2-12-2、3-4-3、3-5-3、3-6-3、3-7-3、3-8-3、3-9-3、3-10-3、3-11-3、3-12-3、4-4-4、4-5-4、4-6-4、4-7-4、4-8-4、4-9-4、4-10-4、4-11-4、4-12-4、5-4-5、5-5-5、5-6-5、5-7-5、5-8-5、5-9-5、5-10-5、5-11-5、5-12-5、6-4-6、6-5-6、6-6-6、6-7-6、6-8-6、6-9-6、6-10-6、6-11-6或6-12-6。翼也可具有不同的长度,例如1-10-6、3-9-5、7-9-2、4-10-5,或侧翼为中央dna间隔的翼长度的其他不对称组合。本领域技术人员将能够确定另外的翼长度的不对称组合。
[0122]
在某些实施方案中,靶向c9orf72核酸的反义化合物具有5-8-5或5-10-5间隔体形式。在一些实施方案中,反义化合物是具有与c9orf72转录物或其部分充分互补以指导rnase h切割c9orf72转录物的靶识别序列为5-8-5或5-10-5形式的反义寡核苷酸。在一些实施方案中,靶识别序列具有式“a-b-c”,其中“a”包含约5个经修饰核苷酸,“b”包含约8至10个dna核苷酸和/或dna样核苷酸,并且“c”包含约5个经修饰核苷酸。在一些实施方案中,靶识别序列具有式“a-b-c”,其中“a”包含5个锁核苷酸,“b”包含8至10个dna核苷酸和/或dna样核苷酸,并且“c”包含5个锁核苷酸。在一些实施方案中,靶识别序列具有式“a-b-c”,其中“a”包含5个锁核苷酸,“b”包含8至10个dna样核苷酸,并且“c”包含5个锁核苷酸。
[0123]
在一些实施方案中,靶向c9orf72核酸的反义化合物具有“翼体(wingmer)”基序。翼体基序可使用式“x-y”或“y-x”来描述,其中“x”表示翼区域的长度,并且“y”表示间隔区域的长度。因此,在一些实施方案中,本公开内容的反义寡核苷酸具有下式:
[0124]
x-y,或
[0125]
y-x。
[0126]
如本文中所用,被描述为“x-y”或“y-x”的翼体具有的构型使得间隔区段紧临近于
翼区段定位。因此,在翼区段与间隔区段之间不存在中间核苷酸。本公开内容的反义化合物的翼体构型的一些非限制性实例包括,例如,1-15、1-17、1-19、2-15、2-17、2-19、2-22、3-13、3-17、3-20、3-21、3-22、4-12、4-14、4-16、4-18、4-19、4-21、5-11、5-13、5-14、5-15、5-16、5-18或5-20。
[0127]
在一些实施方案中,靶向c9orf72核酸的反义化合物具有间隔加宽基序(gap-widened motif)。本文中使用的“间隔加宽”是指具有临近于翼区域的12个或更多个连续dna核苷酸和/或dna样核苷酸的间隔区段的反义化合物。在间隔加宽间隔体的情况下,间隔体包含具有位于5’与3’翼区段之间以及紧临近于5’与3’翼区段的12个或更多个连续dna核苷酸和/或dna样核苷酸的间隔区域的间隔体。
[0128]
核苷是碱基-糖的组合。核苷的核碱基(也被称为碱基)部分通常是杂环碱基部分。核苷酸是还包含与核苷的糖部分共价连接的磷酸基团的核苷。对于包含呋喃戊糖的那些核苷,磷酸基团可与糖的2’、3’或5’羟基部分连接。寡核苷酸通过彼此临近核苷之间的共价键形成,以形成线性聚合寡核苷酸。在寡核苷酸结构内,磷酸基团通常被称为形成寡核苷酸的核苷酸间键。
[0129]
对反义化合物的修饰涵盖对核苷酸间键、糖部分或核碱基的取代或改变。经修饰反义化合物通常优于天然形式,这是因为存在所期望的特性,例如,如增强的细胞摄取、对核酸靶标的增强的亲和力、在核酸酶存在下提高的稳定性或提高的抑制活性。
[0130]
经化学修饰核苷也可用于提高缩短或截短的反义寡核苷酸对其靶核酸的结合亲和力。因此,用具有这样的经化学修饰核苷的较短反义化合物通常可获得相当的结果。
[0131]
rna和dna的天然存在的核苷酸间键是3’至5’磷酸二酯键。相比于具有天然存在的核苷酸间键的反义化合物,通常选择具有一个或更多个经修饰(即非天然存在的)核苷酸间键的反义化合物,这是因为存在所期望的特性,例如,如增强的细胞摄取、对靶核酸的增强的亲和力、和在核酸酶存在下提高的稳定性。
[0132]
具有经修饰核苷酸间键的寡核苷酸包括保留磷原子的核苷酸间键,以及不具有磷原子的核苷酸间键。代表性的含磷核苷酸间键包括但不限于磷酸二酯、磷酸三酯、甲基膦酸酯、氨基磷酸酯和硫代磷酸酯。制备含磷和不含磷的键的方法是公知的。
[0133]
在某些实施方案中,靶向c9orf72核酸的反义化合物包含一个或更多个经修饰核苷酸间键。在某些实施方案中,经修饰核苷酸间键是硫代磷酸酯键。在某些实施方案中,反义化合物的每个核苷酸间键是硫代磷酸酯核苷酸间键。
[0134]
本发明的反义化合物可任选地包含其中糖基已被修饰的一个或更多个核苷。这样的经糖修饰的核苷可赋予反义化合物增强的核酸酶稳定性、提高的结合亲和力或一些其他有益的生物学特性。在某些实施方案中,核苷包含经化学修饰的呋喃核糖环部分。经化学修饰呋喃核糖环的一些实例包括但不限于,添加取代基(包括5’和2’取代基,环原子桥接以形成双环核酸(bicyclic nucleic acid,bna),用s、n(r)或c(r1)(r2)(r=h、c
1-c
12
烷基或保护基),及其组合取代核糖基环氧原子。经化学修饰糖的一些实例包括2
’‑
f-5
’‑
甲基取代的核苷(关于其他公开的5’,2
’‑
双取代核苷,参见2008年8月21日公布的pct国际申请wo 2008/101157)或用s替代核糖基环氧原子并在2
’‑
位进一步取代(参见2005年6月16日公布的公开的美国专利申请us2005-0130923)或作为替代地5
’‑
取代bna(参见2007年11月22日公布的pct国际申请wo 2007/134181,其中lna被例如5
’‑
甲基或5
’‑
乙烯基取代)。
[0135]
具有经修饰糖部分的核糖核苷的一些实例包括但不限于包含5
’‑
乙烯基、5
’‑
甲基(r或s)、4
’‑
s、2’h、2
’‑
f(即2
’‑
氟)、2
’‑
och3(即2
’‑
o-甲基)和2
’‑
o(ch2)2och3(即2
’‑
o-甲氧基乙基)取代基的核苷。2’位的取代基还可选自烯丙基、氨基、叠氮基、硫代、o-烯丙基、o-c1-c10烷基、ocf3、o(ch2)2sch3、o(ch2)
2-o-n(rm)(rn)和o-ch
2-c(=o)-n(rm)(rn),其中每个rm和rn独立地为h或者经取代或未经取代的c1-c10烷基。2
’‑
修饰的核苷酸可用于本发明,例如2
’‑
o-甲基rna、2
’‑
o-甲氧基乙基rna、2
’‑
氟rna和本领域普通技术人员所设想的其他核苷酸。
[0136]
双环核酸(bna)的一些实例包括但不限于包含在4’与2’核糖基环原子之间的桥的核苷。包含在4’与2’核糖基环原子之间的桥的bna可被称为锁核酸(lna),并且通常被称为不可及rna(inaccessible rna)。本文中使用的术语“锁核苷酸”或“锁核酸(lna)”包括其中2’脱氧核糖糖部分通过引入含有从2’到4’碳原子桥接的杂原子的结构来修饰的核苷酸。术语“非锁核苷酸”包括在核糖糖部分中不包含桥接结构的核苷酸。因此,该术语包括dna和rna核苷酸单体(磷酸化腺苷、鸟苷、尿苷、胞苷、脱氧腺苷、脱氧鸟苷、脱氧胸苷、脱氧胞苷)及其衍生物以及具有2
’‑
脱氧-赤型-戊呋喃糖基糖部分或核糖-戊呋喃糖基部分的其他核苷酸。在某些实施方案中,本文中提供的反义化合物包含一种或更多种bna核苷,其中桥包含下式之一:4
’‑
(ch2)-o-2’(lna);4
’‑
(ch2)-s-2’;4
’‑
(ch2)-o-2’(lna);4
’‑
(ch2)2-o-2’(ena);4
’‑
c(ch3)2-o-2’(参见pct/us2008/068922);4
’‑
ch(ch3)-o-2’和4
’‑
ch(ch2och3)-o-2’(参见2008年7月15日发布的美国专利no.7,399,845);4
’‑
ch
2-n(och3)-2’(参见pct/us2008/064591);4
’‑
ch
2-o-n(ch3)-2’(参见2004年9月2日公布的公布的美国专利申请us2004-0171570);4
’‑
ch
2-n(r)-o-2’(参见2008年9月23日公布的美国专利no.7,427,672);4
’‑
ch
2-c(ch3)-2’和4
’‑
ch
2-c(=ch2)-2’(参见pct/us2008/066154);并且其中r独立地为h、c1-c12烷基或保护基。前述bna中的每一个均包括多种立体化学糖构型,包括例如α-l-呋喃核糖和β-d-呋喃核糖(参见1999年3月25日作为wo 99/14226公布的pct国际申请pct/dk98/00393)。
[0137]
在一些实施方案中,本文中提供的反义化合物包括一个或更多个2’,4
’‑
约束的核苷酸。例如,本公开内容提供的反义化合物包括具有一个或更多个约束的乙基(cet)或约束的甲氧基乙基(cmoe)核苷酸的那些。在一些实施方案中,本文中提供的反义化合物是包含一个或更多个约束的乙基(cet)核苷酸的反义寡核苷酸。术语“约束的乙基”和“乙基约束的”可互换使用。
[0138]
在某些实施方案中,核苷通过用糖替代物替代核糖基环来修饰。这样的修饰包括但不限于用替代环体系(有时被称为dna类似物)例如吗啉环、环己烯基环、环己基环或四氢吡喃基环,例如具有下式之一的环来替代核糖基环:
[0139][0140]
可用于修饰核苷以并入到反义化合物中的许多其他双环和三环糖替代环体系也是本领域已知的(参见例如综述文章:leumann,j.c,bioorganic&medicinal chemistry,
2002,10,841-854;ito,k.r.;obika,s.,recent advances in medicinal chemistry of antisense oligonucleotides.in comprehensive medicinal chemistry,第3版,elsevier:2017)。这样的环体系可进行多种另外的取代以增强活性。
[0141]
用于制备经修饰糖的方法是本领域技术人员公知的。在具有经修饰糖部分的核苷酸中,保留核碱基部分(天然的、经修饰的,或其组合)以与合适的核酸靶标杂交。
[0142]
在某些实施方案中,靶向c9orf72核酸的反义化合物包含一种或更多种经修饰核苷酸。在一个实施方案中,靶向c9orf72核酸的反义化合物包含2
’‑
修饰的核苷酸。在一个实施方案中,靶向c9orf72核酸的反义化合物包含2
’‑
o-甲基rna、2
’‑
o-甲氧基乙基rna或2
’‑
氟rna。在一个实施方案中,靶向c9orf72核酸的反义化合物包含三环dna。三环dna属于一类约束的dna类似物,其显示出与互补rna的杂交能力提高,参见,例如,ittig et al.,nucleicacids res.32:346-353(2004);ittig et al.,prague,academy of sciences of the czech republic.7∶21-26(coll.symp.series,hocec,m.,2005);ivanova et al.,oligonucleotides 17:54-65(2007);renneberg et al.,nucleic acids res.30:2751-2757(2002);renneberg et al.,chembiochem.5:1114-1118(2004);和renneberg et al.,jacs.124:5993-6002(2002)。在一个实施方案中,靶向c9orf72核酸的反义化合物包含锁核苷酸、乙基约束的核苷酸或α-l锁核酸。多种α-l-锁核酸是本领域普通技术人员已知的,并且描述于例如sorensen et al.,j.am.chem.soc.(2002)124(10):2164-2176中。
[0143]
在某些实施方案中,靶向c9orf72核酸的反义化合物包含具有经修饰糖部分的一种或更多种经修饰核苷酸。在一些实施方案中,经修饰核苷酸是锁核苷酸。在某些实施方案中,锁核苷酸以间隔体基序排列,例如3-9-3间隔体形式,其中9个非锁核苷酸的侧翼为在各侧的3个锁核苷酸。
[0144]
核碱基(或碱基)修饰或取代与天然存在或合成的未经修饰核碱基在结构上可区分,但在功能上可互换。天然和经修饰的核碱基二者都能够参与氢键合。这样的核碱基修饰可赋予反义化合物核酸酶稳定性、结合亲和力或一些其他有益的生物学特性。经修饰核碱基包括合成的和天然的核碱基,例如5-甲基胞嘧啶(5-me-c)。某些核碱基取代,包括5-甲基胞嘧啶取代,对于提高反义化合物对靶核酸的结合亲和力特别有用。例如,5-甲基胞嘧啶取代已显示出将核酸双链体稳定性提高0.6至1.2℃(sanghvi,y.s.,crooke,s.t.and lebleu,b.,eds.,antisense research and applications,crc press,boca raton,1993,pp.276-278)。
[0145]
另外的经修饰核碱基包括5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-甲基和其他烷基衍生物,腺嘌呤和鸟嘌呤的2-丙基和其他烷基衍生物,2-硫尿嘧啶,2-硫代胸腺嘧啶和2-硫代胞嘧啶,5-卤尿嘧啶和胞嘧啶,5-丙炔基(-c≡c-ch3)尿嘧啶和胞嘧啶以及嘧啶碱基的其他炔基衍生物,6-偶氮尿嘧啶、胞嘧啶和胸腺嘧啶,5-尿嘧啶(假尿嘧啶),4-硫尿嘧啶,8-卤、8-氨基、8-硫醇、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤,5-卤(例如5-溴)、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶、7-甲基鸟嘌呤和7-甲基腺嘌呤、2-f-腺嘌呤、2-氨基-腺嘌呤、8-氮杂鸟嘌呤和8-氮杂腺嘌呤、7-脱氮鸟嘌呤和7-脱氮杂腺嘌呤以及3-脱氮鸟嘌呤和3-脱氮杂腺嘌呤。
[0146]
杂环碱基部分还可包括其中嘌呤或嘧啶碱基被其他杂环,例如7-脱氮腺嘌呤、7-脱氮鸟苷、2-氨基吡啶和2-吡啶酮替代的那些。特别可用于提高反义化合物的结合亲和力
的核碱基包括5-取代的嘧啶,6-氮杂嘧啶和n-2、n-6和o-6取代的嘌呤,包括2氨基丙基腺嘌呤、5-丙炔基尿嘧啶和5-丙炔基胞嘧啶。
[0147]
在某些实施方案中,靶向c9orf72核酸的反义化合物包含具有经修饰糖部分的一个或更多个经修饰核苷酸。在一些实施方案中,经修饰核苷酸是锁核苷酸。在某些实施方案中,锁核苷酸以间隔体基序排列,例如3-9-3间隔体形式,其中9个非锁核苷酸的侧翼为各侧的3个锁核苷酸。在某些实施方案中,靶向c9orf72核酸的反义化合物包含一个或更多个经修饰核苷酸。在一些实施方案中,经修饰核苷酸是5-甲基胞嘧啶。在某些实施方案中,每个胞嘧啶是5-甲基胞嘧啶。
[0148]
在一些实施方案中,本公开内容的反义化合物指导rnase h切割c9orf72转录物。在这样的实施方案中,反义化合物可被称为rnase h依赖性反义化合物。在一些实施方案中,反义化合物是rnase h依赖性反义寡核苷酸。在一些实施方案中,本公开内容的反义寡核苷酸是rnase h依赖性反义寡核苷酸,并且可以是与靶转录物(例如,c9orf72转录物)中的互补序列结合的单链、经化学修饰的寡核苷酸。本公开内容的rnase h依赖性反义寡核苷酸通过rnase h介导的靶转录物的切割以及通过核糖体的空间阻断抑制翻译来降低靶基因的表达。在一些实施方案中,本公开内容的反义化合物能够介导rnase-h切割至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或更多的c9orf72转录物。在一个实施方案中,反义化合物能够介导rnase-h切割至少80%的c9orf72转录物。在一个实施方案中,反义化合物能够介导rnase-h切割至少90%的c9orf72转录物。
[0149]
在某些实施方案中,靶向c9orf72转录物的反义化合物的长度为约6至约24个亚基。在另一些实施方案中,靶向c9orf72转录物的反义化合物的长度为约8至约80个亚基。例如,反义化合物的长度为8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79或80个连接的亚基,或由上述值中的任意两个限定的范围。在一些实施方案中,反义化合物的长度小于40个连接的亚基。在一些实施方案中,反义化合物的长度为约12至约25个连接的亚基。在一些实施方案中,反义化合物的长度为约15至约20个连接的亚基。在一些实施方案中,反义化合物是靶向c9orf72转录物的反义寡核苷酸,并且连接的亚基是连接的核苷酸。
[0150]
在某些实施方案中,靶向c9orf72转录物的反义化合物可被缩短或截短。例如,单亚基可从5’端(5’截短),或作为替代地从3’端(3’截短)缺失。靶向c9orf72转录物的缩短或截短的反义化合物可具有从反义化合物的5’端缺失的两个亚基,或作为替代地可具有从反义化合物的3’端缺失的两个亚基。或者,缺失的核苷可分散在整个反义化合物中,例如,在具有从5’端缺失的一个核苷和从3’端缺失的一个核苷的反义化合物中。
[0151]
当加长的反义化合物中存在单个另外的亚基时,另外的亚基可位于反义化合物的5’或3’端。当存在两个或更多个另外的亚基时,添加的亚基可彼此临近,例如,在具有添加至反义化合物的5’端(5’添加)或作为替代地添加至反义化合物的3’端(3’添加)的两个亚基的反义化合物中。或者,添加的亚基可分散在整个反义化合物中,例如,在具有添加至5’端的一个亚基和添加至3’端的一个亚基的反义化合物中。
[0152]
可提高或减少反义化合物(例如反义寡核苷酸)的长度,和/或引入错配碱基而不消除活性。例如,在woolf et al.(proc.natl.acad.sci.usa 89:7305-7309,1992)中,在卵母细胞注射模型中测试了一系列长度为13至25个核碱基的反义寡核苷酸其诱导靶rna切割的能力。长度为25个核碱基、在反义寡核苷酸末端附近具有8或11个错配碱基的反义寡核苷酸能够指导靶mrna的特异性切割,尽管程度低于不含错配的反义寡核苷酸。类似地,使用13个核碱基的反义寡核苷酸(包括具有1或3个错配的那些)实现了靶特异性切割。
[0153]
支链反义化合物
[0154]
本公开内容还提供了包含靶向c9orf72核酸的一部分的两个或更多个靶识别序列的支链反义化合物。本公开内容的支链反义化合物可以是例如支链反义寡核苷酸化合物。
[0155]
本文中使用的术语“支链反义化合物”或“支链反义寡核苷酸”是指连接在一起的两个更多个反义化合物或反义寡核苷酸。
[0156]
在一个实施方案中,支链寡核苷酸化合物包含两个或更多个靶识别序列,其中靶识别序列通过选自接头、间隔子和分支点的一个或更多个部分彼此连接。本文中描述了靶识别序列。在一些实施方案中,支链寡核苷酸化合物包含2、3、4、5、6、7、8或更多个靶识别序列,其中每个靶识别序列包含5’端和3’端,并且每个靶识别序列在5’端或3’端独立地与接头、间隔子或分支点连接。在一些实施方案中,每个靶识别序列在5’端与接头、间隔子或分支点连接。在一些实施方案中,每个靶识别序列在3’端与接头、间隔子或分支点连接。在另一个实施方案中,每个靶识别序列与接头、间隔子或分支点连接。在一些实施方案中,每个靶识别序列是靶向c9orf72核酸的一部分的反义化合物和/或寡核苷酸。
[0157]
在一些实施方案中,本公开内容的支链寡核苷酸化合物具有下式
[0158]
l-(n)n[0159]
其中n表示本公开内容的靶识别序列;n表示整数,例如2、3、4、5、6、7或8;并且l表示选自以下的接头:乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑,及其任意组合。
[0160]
在一些实施方案中,本公开内容的支链寡核苷酸化合物具有下式
[0161]
l-(n)n[0162]
其中化合物任选地还包含一个或更多个分支点b,并且其中化合物任选地还包含一个或更多个间隔子s。在这样的实施方案中,一个或更多个分支点b各自独立地表示多价有机物质或其衍生物,并且一个或更多个间隔子s各自独立地选自乙二醇链、烷基链、肽、rna、dna、磷酸酯、膦酸酯、氨基磷酸酯、酯、酰胺、三唑及其任意组合。例如,具有式l-(n)n的本公开内容的支链寡核苷酸化合物具有不以任何方式限制的结构,例如,
[0163]
n-l-n、
[0164]
n-s-l-s-n、
[0165]
[0166][0167]
靶识别序列
[0168]
本公开内容提供了包含靶向9号染色体开放阅读框72(chromosome 9open reading frame 72,c9orf72)核酸(例如,c9orf72转录物)的一部分的靶标识别序列的反义寡核苷酸。在某些实施方案中,反义寡核苷酸具有当以5’至3’方向书写时包含c9orf72核酸的一部分的反向互补的核碱基序列。在一些实施方案中,反义寡核苷酸是反义寡核苷酸。在某些这样的实施方案中,反义寡核苷酸具有当以5’至3’方向书写时包含c9orf72核酸的一部分的反向互补的核碱基序列。
[0169]
在某些实施方案中,靶区域是c9orf72核酸的结构限定区域。例如,靶区域可涵盖3’非翻译区(utr)、5’非翻译区(utr)、外显子、内含子、外显子/内含子连接、编码区、翻译起始区、翻译终止区,或其他限定的核酸区域,例如,开放阅读框,或开放阅读框与非翻译区之间的连接,及其任何组合。c9orf72的结构限定区域可通过从序列数据库例如ncbi的登录号获得,并且这样的信息通过引用并入本文。在某些实施方案中,靶区域可涵盖从靶区域内一个靶区段的5’靶位点到同一靶区域内另一个靶区段的3’靶位点的序列。
[0170]
靶向包括确定与反义寡核苷酸杂交的至少一个靶区段,使得产生期望的作用。在某些实施方案中,期望的作用是转录物靶核酸水平的降低,即c9orf72转录物水平的降低。在某些实施方案中,期望的作用是由靶核酸编码的蛋白质或与靶核酸相关的表型变化的水平的降低,例如c9orf72蛋白或二肽重复蛋白的水平的降低。
[0171]
靶区域可包含一个或更多个靶区段。靶区域内的多个靶区段可重叠。或者,其可以不重叠。在某些实施方案中,靶区域内的靶区段被不超过约300个核苷酸隔开。在某些实施方案中,靶区域内的靶区段被靶核酸上的为、为约、为不超过、为不超过约250、200、150、
100、90、80、70、60、50、40、30、20或10个核苷酸,或者由前述值中的任意两个限定的范围的许多核苷酸隔开。在某些实施方案中,靶区域内的靶区段被靶核酸上的不超过或不超过约5个核苷酸隔开。在某些实施方案中,靶区段是连续的。
[0172]
合适的靶区段可存在于5’utr、编码区、3’utr、内含子、外显子和/或外显子/内含子连接中。含有起始密码子或终止密码子的靶区段也是合适的靶区段。合适的靶区段可特异性地排除某个结构上限定的区域,例如起始密码子或终止密码子。
[0173]
合适的靶区段的确定可包括将靶核酸(例如,c9orf72)的序列与整个基因组中的其他序列进行比较。例如,blast算法可用于鉴定不同核酸之间的相似性区域。这种比较可防止选择可以以非特异性方式与除了所选择靶核酸以外的序列(即非靶序列或脱靶序列)杂交的反义寡核苷酸序列。合适的靶区段的确定可包括比较数个物种中的靶核酸(例如,c9orf72转录物)的序列。例如,多种序列比对软件是本领域已知的并且可用于鉴定跨物种的相似或相同序列的区域。
[0174]
活性靶区域内的反义寡核苷酸的活性(例如,由靶核酸水平的降低百分比限定)可存在变化。在某些实施方案中,c9orf72转录物水平的降低表明c9orf72表达受到抑制。c9orf72蛋白水平的降低也表明靶转录物表达受到抑制。c9orf72相关二肽重复蛋白水平的降低也表明靶转录物表达受到抑制。此外,表型变化表明c9orf72表达受到抑制。在一些实施方案中,在c9orf72遗传途径内起作用的基因的转录水平的降低可表明c9orf72表达受到抑制。例如,c9orf72遗传途径下游组分转录水平的降低表明c9orf72受到抑制。
[0175]
当反义寡核苷酸的足够数目的核碱基可与靶核酸的对应核碱基氢键合时,反义寡核苷酸和靶核酸(例如,c9orf72转录物或其部分)彼此互补,使得期望的作用将发生(例如,靶核酸(例如c9orf72转录物或其部分)的反义抑制)。
[0176]
可容忍反义寡核苷酸与c9orf72核酸之间的非互补核碱基,前提是该反义寡核苷酸保持能够与靶核酸特异性杂交。此外,反义寡核苷酸可在c9orf72核酸的一个或更多个区段上杂交,使得插入或临近区段不参与杂交事件(例如,环结构、错配或发夹结构)。
[0177]
在某些实施方案中,本文中提供的反义寡核苷酸或其特定部分与c9orf72核酸、靶区域、靶区段,或其特定部分具有以下或具有至少以下互补性:70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%。可使用常规方法确定反义寡核苷酸与靶核酸的互补性百分比。
[0178]
例如,其中反义寡核苷酸的20个核碱基中的18个与靶区域(例如,c9orf72转录物的等长部分)互补并将因此特异性杂交的反义寡核苷酸将代表90%的互补性。在这一实例中,剩余的非互补核碱基可与互补核碱基成簇或散布并且不需要彼此临近或与互补核碱基临近。因此,长度为18个核碱基且具有侧翼为与靶核酸完全互补的两个区域的4个非互补核碱基的反义寡核苷酸将具有与靶核酸77.8%的总体互补性,并且因此将落入本发明的范围内。反义寡核苷酸与靶核酸区域的互补性百分比可常规地使用本领域已知的blast程序(基本局部比对搜索工具)和powerblast程序来确定(altschul et al.,j.mol.biol.,1990,215,403 410;zhang and madden,genome res.,1997,7,649 656)。同源性百分比、序列同一性或互补性可通过例如使用smith和waterman的算法(adv.appl.math.,1981,2,482 489)的gap程序(wisconsin序列分析包,unix第8版,genetics computer group,university research park,madison wis.)使用默认设置来确定。
[0179]
在某些实施方案中,本文中提供的反义寡核苷酸或其特定部分与靶核酸或其特定部分完全互补(即100%互补)。例如,反义寡核苷酸可与c9orf72核酸或其靶区域或靶区段或靶序列完全互补。本文中使用的“完全互补”或“完美互补”意指反义寡核苷酸的每个核碱基均能够与靶核酸的对应核碱基进行精确的碱基配对。例如,20个核碱基的反义寡核苷酸与400个核碱基长的靶序列完全互补,只要靶核酸的对应20个核碱基部分与反义寡核苷酸完全互补即可。完全互补也可用于提及第一和/或第二核酸的特定部分。例如,30个核碱基反义寡核苷酸的20个核碱基部分可与400个核碱基长的靶序列“完全互补”。如果靶序列具有对应的20个核苷碱基部分,其中每个核苷碱基与反义寡核苷酸的20个核苷碱基部分互补,则30个核苷碱基的寡核苷酸的20个核苷碱基部分与靶序列完全互补。同时,整个30个核碱基反义寡核苷酸可以与或可以不与靶序列完全互补,这取决于反义寡核苷酸的剩余10个核碱基是否也与靶序列互补。
[0180]
在一些实施方案中,本公开内容提供了具有与5
′
gaaaguaaaaaugcgucgag3
′
(seq id no:1)的c9orf72反义转录物序列互补的区域的反义寡核苷酸。在一些实施方案中,反义寡核苷酸包含与c9orf72反义转录物序列互补的区域,其与c9orf72反义转录物具有至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的互补性。在一些实施方案中,反义寡核苷酸包含与c9orf72反义转录物序列互补的区域,其与c9orf72反义转录物完全互补。
[0181]
在一些实施方案中,本公开内容提供了具有与5
′
cuccuuguuuucuucugguu3
′
(seq id no:2)的c9orf72反义转录物序列互补的区域的反义寡核苷酸。在一些实施方案中,反义寡核苷酸包含与c9orf72反义转录物序列互补的区域,其与c9orf72反义转录物具有至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的互补性。在一些实施方案中,反义寡核苷酸包含与c9orf72反义转录物序列互补的区域,其与c9orf72反义转录物完全互补。
[0182]
在一些实施方案中,本公开内容提供了具有与5
′
caggucuuuucuuguucacc3
′
(seq id no:3)的c9orf72反义转录物序列互补的区域的反义寡核苷酸。在一些实施方案中,反义寡核苷酸包含与c9orf72反义转录物序列互补的区域,其与c9orf72反义转录物具有至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的互补性。在一些实施方案中,反义寡核苷酸包含与c9orf72反义转录物序列互补的区域,其与c9orf72反义转录物完全互补。
[0183]
在一些实施方案中,本公开内容提供了具有与5
′
ccuccuuguuuucuucuggu3
′
(seq id no:4)的c9orf72反义转录物序列互补的区域的反义寡核苷酸。在一些实施方案中,反义寡核苷酸包含与c9orf72反义转录物序列互补的区域,其与c9orf72反义转录物具有至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的互补性。在一些实施方案中,反义寡核苷酸包含与c9orf72反义转录物序列互补的区域,其与c9orf72反义转录物完全互补。
[0184]
在一些实施方案中,本公开内容提供了具有与5
′
gagucgcgcgcuaggggc3
′
(seq id no:9)的c9orf72有义转录物序列互补的区域的反义寡核苷酸。在一些实施方案中,反义寡核苷酸包含与c9orf72有义转录物序列互补的区域,其与c9orf72有义转录物具有至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的互补性。在一些实施方案中,反义寡核苷酸包含与c9orf72有义转录物序列互补的区域,其与c9orf72有义转录物完全互补。
[0185]
在一些实施方案中,本公开内容提供了具有与5
′
gagucgcgcgcuaggggc3
′
(seq id no:9)的c9orf72有义转录物序列互补的区域的反义寡核苷酸,其中所述反义寡核苷酸包含从5’至3’为sooosssssssssooos的核苷酸间键,其中每个s是硫代磷酸酯键,并且每个o是磷酸二酯键。在一些实施方案中,反义寡核苷酸包含与c9orf72有义转录物序列互补的区域,其与c9orf72有义转录物具有至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%的互补性。在一些实施方案中,反义寡核苷酸包含与c9orf72有义转录物序列互补的区域,其与c9orf72有义转录物完全互补。
[0186]
在某些实施方案中,本公开内容提供了靶向c9orf72反义转录物的反义寡核苷酸,其具有与以下任一个的核酸序列具有至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的核酸序列:
[0187][0188]
在某些实施方案中,本公开内容提供了靶向c9orf72有义转录物的反义寡核苷酸,其具有与5
′
gcccctagcgcgcgactc3
′
(seq id no:10)的核酸序列具有至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的核酸序列。
[0189]
在一些实施方案中,本公开内容提供了反义寡核苷酸,其具有序列修饰模式为xsxoxoxoxsxsxsxsxsxsxsxsxsxsxsxoxoxoxsx的与c9orf72反义转录物序列互补的区域,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;并且x是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷、鸟苷、胞苷或胸腺嘧啶。
[0190]
在一些实施方案中,本公开内容提供了反义寡核苷酸,其具有序列修饰模式为xsxoxoxoxsxsxsxsxsxsxsxsxsxsxsxoxoxoxsx的与c9orf72有义转录物序列互补的区域,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;并且x是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷、鸟苷、胞苷或胸腺嘧啶。
[0191]
在某些实施方案中,本公开内容提供了靶向c9orf72反义转录物的反义寡核苷酸,其包含序列cstocogoascsgscsastststststsascotototsc,其中s表示硫代磷酸酯核苷酸间
键;o表示磷酸二酯核苷酸间键;a是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷;g是包含2
’‑
o-(2-甲氧基乙基)修饰的鸟苷;c是包含2
’‑
o-(2-甲氧基乙基)修饰的胞苷;t是包含2
’‑
o-(2-甲氧基乙基)修饰的胸腺嘧啶;并且每个胞嘧啶是5-甲基胞嘧啶。
[0192]
在某些实施方案中,本公开内容提供了靶向c9orf72反义转录物的反义寡核苷酸,其包含序列asaococoasgsasasgsasasasascsasaogogoasg,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;a是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷;g是包含2
’‑
o-(2-甲氧基乙基)修饰的鸟苷;c是包含2
’‑
o-(2-甲氧基乙基)修饰的胞苷;t是包含2
’‑
o-(2-甲氧基乙基)修饰的胸腺嘧啶;并且每个胞嘧啶是5-甲基胞嘧啶。
[0193]
在某些实施方案中,本公开内容提供了靶向c9orf72反义转录物的反义寡核苷酸,其包含序列gsgotogoasascsasasgsasasasasgsaococotsg,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;a是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷;g是包含2
’‑
o-(2-甲氧基乙基)修饰的鸟苷;c是包含2
’‑
o-(2-甲氧基乙基)修饰的胞苷;t是包含2
’‑
o-(2-甲氧基乙基)修饰的胸腺嘧啶;并且每个胞嘧啶是5-甲基胞嘧啶。
[0194]
在某些实施方案中,本公开内容提供了靶向c9orf72反义转录物的反义寡核苷酸,其包含序列ascocoaogsasasgsasasasascsasasgogoaogsg,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;a是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷;g是包含2
’‑
o-(2-甲氧基乙基)修饰的鸟苷;c是包含2
’‑
o-(2-甲氧基乙基)修饰的胞苷;t是包含2
’‑
o-(2-甲氧基乙基)修饰的胸腺嘧啶;并且每个胞嘧啶是5-甲基胞嘧啶。
[0195]
在某些实施方案中,本公开内容提供了靶向c9orf72有义转录物的反义寡核苷酸,其包含序列gscocococstsasgscsgscsgscsgoaocotsc,其中s表示硫代磷酸酯核苷酸间键;o表示磷酸二酯核苷酸间键;a是包含2
’‑
o-(2-甲氧基乙基)修饰的腺苷;g是包含2
’‑
o-(2-甲氧基乙基)修饰的鸟苷;c是包含2
’‑
o-(2-甲氧基乙基)修饰的胞苷;t是包含2
’‑
o-(2-甲氧基乙基)修饰的胸腺嘧啶;并且每个胞嘧啶是5-甲基胞嘧啶。
[0196]
二肽重复区(dipeptide repeat region,dpr)蛋白
[0197]
本文中使用的“二肽重复区蛋白”或“二肽重复蛋白”或“dpr蛋白”或“扩增的重复蛋白”或“聚二肽”或“重复相关的非atg(ran)二肽”是指从与重复扩增疾病或病症相关的转录物的核苷酸重复区域表达的蛋白质。一些示例性的dpr蛋白包括但不限于由位于c9orf72的内含子1中的六核苷酸g4c2重复表达的dpr蛋白。这些dpr蛋白是从在g4c2核苷酸重复的有义或反义方向上所有六个开放阅读框翻译的。dpr蛋白包括聚甘氨酸-丙氨酸或聚(ga)、聚甘氨酸-精氨酸或聚(gr)、聚脯氨酸-丙氨酸或聚(pa)、聚脯氨酸-精氨酸或聚(pr)和聚甘氨酸-脯氨酸或聚(gp)。聚(gp)由c9orf72有义转录物和c9orf72反义转录物二者产生。聚(gr)和聚(ga)由c9orf72有义转录物产生。聚(pa)和聚(pr)由c9orf72反义转录物产生。在freibaum et al.2017.front.mol.neurosci.10∶35中进一步描述了c9orf72 dpr蛋白。
[0198]
缀合的反义寡核苷酸
[0199]
反义寡核苷酸可与增强所得反义寡核苷酸的活性、细胞分布或细胞摄取的一个或更多个部分、配体或缀合物共价连接。反义寡核苷酸可与增强和/或优化药代动力学参数的一个或更多个部分、配体或缀合物共价连接。本领域普通技术人员已知多种药代动力学参数,例如吸光度、化合物在身体中的浓度、化合物渗透至身体的程度、化合物的消除/清除率、每单位时间清除化合物的血浆体积等。
[0200]
典型的缀合物基团包括疏水部分,例如胆固醇和脂质部分。这样的部分包括但不限于脂质部分,例如胆固醇部分(letsinger et al.,proc.natl.acad.sci.usa,1989,86,6553-6556),胆酸(manoharan et al.,bioorg.med.chem.let.,1994,4,1053-1060),硫醚,例如己基-s-三苯甲基硫醇(manoharan etal,ann.n.y.acad.sci.,1992,660,306-309;manoharan et al.,bioorg.med.chem.let.,1993,3,2765-2770),硫胆固醇(oberhauser et al.,nucl.acids res.,1992,20,533-538),脂族链,例如,十二烷二醇或十一烷基基团(kabanov et al.,febs lett.,1990,259,327-330;svinarchuk et al.,biochimie,1993,75,49-54),磷脂,例如二-十六烷基-rac-甘油或三乙基铵1,2-二-o-十六烷基-rac-甘油-3-h-膦酸酯(manoharan et al.,tetrahedron lett.,1995,36,3651-3654;shea et al.,nucl.acids res.,1990,18,3777-3783),多胺或聚乙二醇链(mancharan et al.,nucleosides&nucleotides,1995,14,969-973),或金刚烷乙酸(manoharan et al.,tetrahedron lett.,1995,36,3651-3654),棕榈基部分(mishra et al.,biochim.biophys.acta,1995,1264,229-237),不饱和脂肪酸,例如二十二碳六烯酸(nikan et al,mol ther nucleic acids.2016,5,e344),或十八胺或己基氨基-羰基-t氧基胆固醇部分(crooke et al.,j.pharmacol.exp.ther.,1996,277,923-937)。不同的脂质缀合物可优先驱动寡核苷酸被摄取到不同组织中(biscans et al,nucleic acids res.2019,47,1082-1096)。例如,基于1-o-六-癸氧基-1,3-丙二醇的脂质部分可与本公开内容的反义寡核苷酸缀合。这样的脂质部分先前已显示出提高小分子摄取并改善核苷药物的经口生物利用度(参见,例如,aldern et al.,mol.pharmacol.2003,63:678-681;和hostetler,antiviral res.2009,82:a84-a98)。另外的缀合基团包括碳水化合物、磷脂、生物素、吩嗪、叶酸、菲啶、蒽醌、吖啶、荧光素、罗丹明、香豆素和染料。在一些实施方案中,配体与反义寡核苷酸的缀合允许被细胞表面受体识别(参见,例如wolfrum et al.,nat.biotechnol.2007,25:1149-1157;hostetler et al.,antiviral chem.chemother.2001,12:61-70;和prakash et al.,nucleic acids res.2014,42:8796-807)。连接一个或更多个部分或缀合物的方法是本领域公知的。
[0201]
还可修饰反义寡核苷酸以具有一个或更多个稳定基团,其通常与反义寡核苷酸的一个或两个末端连接以增强特性,例如,如核酸酶稳定性。包括在稳定基团中的是帽结构。这些末端修饰保护具有末端核酸的反义寡核苷酸免于外切核酸酶降解,并且可有助于细胞内的递送和/或定位。帽可存在于5’端(5
’‑
帽)或3’端(3
’‑
帽),或者可存在于两个末端。帽结构是本领域公知的并且包括例如倒置脱氧无碱基帽(inverted deoxy abasic cap)。可用于在反义寡核苷酸的一端或两端加帽以赋予核酸酶稳定性的另外的3’和5
’‑
稳定基团包括在2003年1月16日公布的wo 03/004602中公开的那些。
[0202]
在一些实施方案中,本公开内容的反义寡核苷酸包含缀合物。在一个实施方案中,本公开内容的反义寡核苷酸包含反义寡核苷酸序列和缀合物,其中缀合物与反义寡核苷酸序列连接。在一些实施方案中,缀合物选自本文中所述的任何缀合物,例如疏水性缀合物、组织靶向缀合物或设计用于优化药代动力学参数的缀合物。可用于与本公开内容的反义寡核苷酸缀合的疏水性缀合物包括十六烷氧基丙基缀合物、胆固醇缀合物、多不饱和脂肪酸缀合物和本领域已知的可提高缀合物反义寡核苷酸细胞摄取的其他缀合物。在一些实施方案中,缀合物可以是组织靶向缀合物,例如碳水化合物缀合物或肽缀合物,或本领域已知的
可将本公开内容的反义寡核苷酸靶向特定组织的任何缀合物。在一些实施方案中,本公开内容的反义寡核苷酸与聚乙二醇缀合物缀合。在一个实施方案中,聚乙二醇缀合物反义寡核苷酸优化了反义寡核苷酸的药代动力学特性。
[0203]
在一些实施方案中,本公开内容提供了本文中所述的反义寡核苷酸的生物可切割类似物。在这样的情况下,生物可切割类似物包含导致与细胞膜和接头更强的缔合的疏水性缀合物。在一个实施方案中,接头是可切割的接头,其当在被切割时释放反义寡核苷酸,例如将反义寡核苷酸释放到内体中。在一些实施方案中,反义化合物包含可切割接头,其中可切割接头在被切割时降解。在一些实施方案中,接头是包含磷酸二酯键的核酸酶可切割接头。在一些实施方案中,包含磷酸二酯键的核酸酶可切割接头为约2至约8个核苷酸。例如,核酸酶可切割磷酸二酯接头的长度可以是3、4、5、6、7、8个核苷酸或更长,例如长度是9、10、11、12、13、14、15、16、17、18个核苷酸或更长。在一个实施方案中,核酸酶可切割接头包含约6个核苷酸。在一些实施方案中,可切割接头在细胞内化之后被切割。在一些实施方案中,可切割接头在内体内被切割。在一些实施方案中,可切割接头在还原条件下被切割。在一些实施方案中,可切割接头在改变的ph条件下被切割,例如可切割接头在ph降低时或在ph提高时被切割。在一些实施方案中,可切割接头被胞内核酸酶或蛋白酶切割。在一些实施方案中,可切割接头被内体核酸酶或蛋白酶切割。
[0204]
药物组合物和制剂
[0205]
本文中提供了包含本文中所述的反义化合物的药物组合物和制剂。例如,本文中所述的反义寡核苷酸可与其他分子、分子结构或化合物混合物混合、包封、缀合或以其他方式缔合。将本文中所述的药物组合物配制成与其预期施用途径相容。施用途径的一些实例包括鞘内施用、脑室内施用或纹状体内施用。在一些实施方案中,施用可采用植入装置,例如奥马耶储器或植入的鞘内导管。用于施用的溶液剂或混悬剂可包含以下组分:无菌稀释剂,例如注射用水、盐水溶液、乳酸林格液、elliotts b溶液、不挥发性油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂,例如苄醇或对羟基苯甲酸甲酯;抗氧化剂,例如抗坏血酸或亚硫酸氢钠;螯合剂,例如乙二胺四乙酸;缓冲剂,例如乙酸盐、柠檬酸盐、碳酸盐或磷酸盐,以及调节张力的试剂,例如氯化钠或右旋糖。ph可用酸或碱调节,例如盐酸或氢氧化钠。药物组合物可封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
[0206]
适合于可注射使用的药物组合物包括无菌水溶液(在水溶性时)或分散体,以及用于即时制备无菌可注射溶液或分散体的无菌粉末。在所有情况下,组合物必须是无菌的并且在一定程度上应是存在易注射性的流体。药物组合物在制备和储存的条件下必须是稳定的,并且必须针对微生物(例如细菌和真菌)的污染作用进行防腐。载体可以是溶剂或分散体介质,其包含例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等),及其合适混合物。合适的流动性可例如通过使用包衣(例如卵磷脂)来维持,在分散体的情况下通过维持所需的颗粒尺寸来维持,以及通过使用表面活性剂来维持。通过多种抗细菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、酚、抗坏血酸、硫柳汞等)可实现防止微生物的作用。在许多情况下,组合物中可包含等张剂,例如糖、多元醇(例如甘露糖醇、山梨糖醇)、氯化钠。可注射组合物的延长吸收可通过在组合物中包含延迟吸收的药剂(例如单硬脂酸铝和明胶)来实现。
[0207]
无菌可注射溶液可通过将所需量的活性化合物与上面列举的成分之一或组合(根
据需要)一起并入合适的溶剂中,随后过滤灭菌来制备。通常来说,分散体通过将活性化合物并入到包含基础分散体介质以及来自上面列举那些的所需其他成分的无菌载剂中来制备。在用于制备无菌可注射溶液的无菌粉末的情况下,一些制备方法是真空干燥和冷冻干燥,其产生活性成分加上来自其先前经无菌过滤的溶液的任何另外的期望成分的粉末。
[0208]
在一些实施方案中,本文中提供的药物组合物和制剂可方便地以单位剂型存在并且可根据药物工业中公知的常规技术来制备。这样的技术可包括使活性成分与药物载体或赋形剂缔合。通常来说,可通过使活性成分与液体载体、精细的固体载体或二者均匀且紧密地缔合,并然后如果需要的话,使产品成型(例如,形成用于递送的特定颗粒尺寸)来制备制剂。在一个实施方案中,在合适的溶剂(例如,水或生理盐水)中制备用于鞘内、脑室内或纹状体内施用的药物制剂。
[0209]
本公开内容的药剂,例如靶向c9orf72转录物的反义化合物也可使用本领域已知的方法通过转染或感染来施用,所述方法包括但不限于描述于以下中的方法:mccaffrey et al.(2002),nature,418(6893),38-9(hydrodynamic transfection);xia et al.(2002),nature biotechnol.,20(10),1006-10(viral-mediated delivery);或putnam(1996),am.j.health syst.pharm.53(2),151-160,erratum at am.j.health syst.pharm.53(3),325(1996)。
[0210]
本公开内容的药剂,例如靶向c9orf72转录物的反义化合物也可通过适合于施用核酸药剂(例如dna疫苗)的任何方法来施用。这些方法包括基因枪、生物注射器和皮肤贴剂,以及无针方法,例如美国专利no.6,194,389中公开的微粒dna疫苗技术和美国专利no.6,168,587中公开的使用粉末形式疫苗对哺乳动物经皮无针疫苗接种。另外,鼻内递送也是可以的,如尤其是hamajima et al.(1998),clin.immunol.immunopathol.,88(2),205-10中所述。也可使用脂质体(例如,如美国专利no.6,472,375中所述)和微囊化。也可使用可生物降解的可靶向微粒递送系统(例如,如美国专利no.6,471,996中所述)。
[0211]
在一个实施方案中,活性剂与将保护化合物免于从身体迅速消除的载体一起制备,例如控释制剂,包括植入物和微囊化递送系统。可使用可生物降解的生物相容性聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备这样的制剂的方法对本领域技术人员来说是明显的。材料也可从alza corporation和nova pharmaceuticals,inc.商业上获得。脂质体混悬剂(包括靶向感染细胞的脂质体,具有针对病毒抗原的单克隆抗体)也可以用作可药用载体。这些可根据本领域技术人员已知的方法,例如,如美国专利no.4,522,811中所述的方法来制备。
[0212]
这样的化合物的毒性和治疗效力可通过细胞培养或实验动物中的标准药物操作来确定,例如,针对确定ld50(对50%的群体致死的剂量)和ed50(在50%的群体中治疗有效的剂量)。毒性与治疗作用之间的剂量比为治疗指数,其可表示为比率ld50/ed50。可使用表现出大治疗指数的化合物。虽然可使用表现出毒性副作用的化合物,但应注意设计将这样的化合物靶向至受影响组织部位以便使对未感染细胞的潜在损害最小化,从而降低副作用的递送系统。
[0213]
从细胞培养测定和动物研究中获得的数据可用于配制一系列用于人的剂量。这样的化合物的剂量在包括ed50的循环浓度范围内,毒性很小或没有毒性。根据所采用的剂型和所使用的施用途径,剂量可在此范围内变化。对于本发明方法中使用的任何化合物,治疗
有效剂量可最初从细胞培养测定中估计。可在动物模型中配制剂量以达到包含在细胞培养中确定的ec50(即,实现半数最大响应的受试化合物的浓度)的循环血浆浓度范围。这样的信息可用于更准确地确定人中的可用剂量。例如,可通过高效液相色谱来测量血浆中的水平。在某些实施方案中,化合物(例如,反义寡核苷酸)以约0.5mg/ml至约5.0mg/ml的剂量施用。在某些实施方案中,化合物(例如,反义寡核苷酸)以约0.5mg/ml、1.0mg/ml、1.5mg/ml、2.0mg/ml、2.5mg/ml、3.0mg/ml、3.5mg/ml、4.0mg/ml、4.5mg/ml或5.0mg/ml的剂量施用。
[0214]
药物组合物可与施用说明一起包含在容器、包装或分配器中。
[0215]
靶向c9orf72核酸的反义化合物可通过将反义化合物与合适的可药用稀释剂或载体组合而用于药物组合物中。可药用稀释剂包括磷酸缓冲盐水(phosphate-buffered saline,pbs)。pbs是适用于肠胃外递送的组合物的稀释剂。因此,在一个实施方案中,用于本文中所述方法中的是包含靶向c9orf72核酸的反义化合物和可药用稀释剂的药物组合物。在某些实施方案中,可药用稀释剂是pbs。在某些实施方案中,反义化合物是反义寡核苷酸。
[0216]
在某些实施方案中,可药用稀释剂被设计为模拟脑脊液的组成。因此,其可含有二价盐,例如mg
2
和ca
2
。elliotts b溶液是适用于待被递送到脑脊液中的组合物的稀释剂。本领域技术人员将能够看到具有不同的一价和二价离子浓度变化的其他缓冲溶液也可适合作为可药用稀释剂。
[0217]
包含反义化合物的药物组合物涵盖在施用于动物(包括人)之后能够(直接或间接)提供生物活性代谢物或其残余物的任何可药用盐、酯或这样的酯的盐,或任何其他寡核苷酸。因此,例如,本公开内容还涉及反义化合物的可药用盐、前药、这样的前药的可药用盐和其他生物等效物。合适的可药用盐包括但不限于钠盐和钾盐。前药可包括在反义化合物的一端或两端并入另外的核苷,其在体内被内源性核酸酶切割以形成活性反义化合物。
[0218]
治疗方法
[0219]
本公开内容提供了治疗患有c9orf72相关病症的对象的方法。治疗方法包括向有此需要的对象施用有效量的本文中所述的反义化合物。在一些实施方案中,反义化合物包含与c9orf72核酸(例如,c9orf72转录物)充分互补以指导rnase h切割c9orf72核酸的靶识别序列。
[0220]
治疗患有c9orf72相关病症的对象的方法可用于治疗本领域普通技术人员已知的任何c9orf72相关病症。例如,c9orf72相关病症包括但不限于例如家族性额颞痴呆(ftd)、肌萎缩侧索硬化(als)或其组合。
[0221]
本文中提及或引用的文章、专利和专利申请的内容,以及所有其他文件和电子可用信息均通过引用整体并入本文,其程度如同每个单独的出版物被具体地且单独地指示通过引用并入一样。申请人保留将来自任何这样的文章、专利、专利申请或其他物理和电子文件的任何和所有材料和信息实际并入本技术的权利。
[0222]
虽然已经参照本发明的具体实施方案对本发明进行了描述,但是本领域技术人员应理解,在不脱离本发明的真实精神和范围的情况下,可进行多种改变并且并且可替换成等同方案。对于本领域技术人员将明显的是,在不脱离本文中公开的实施方案的范围的情况下,可使用合适的等同方案对本文中所述的方法进行其他合适的修改和改编。另外,可进行许多修改以使特定情况、材料、物质组成、工艺、工艺步骤适应本发明的目的、精神和范
围。所有这样的修改均旨在落入所附权利要求书的范围内。现已经详细描述了某些实施方案,通过参考以下实施例将更清楚地理解这些实施方案,所述实施例仅出于举例说明的目的而被包括在内,并且不旨在进行限制。
实施例
[0223]
通过以下实施例对本公开内容进行进一步举例说明,所述实施例不应被解释为进行进一步限制。
[0224]
实施例1:材料和方法
[0225]
研究设计
[0226]
实验方法结合c9患者来源样品来在体外评价选择性效力,并且结合c9bac转基因小鼠来在体内评估安全性、效力和作用持续时间。每个实验中,所有小鼠均是年龄匹配的并随机分配到对照组或实验组。以盲法收集、处理和量化样品和数据。分子和生理读出包括v1v3含有重复的转录物、所有转录物和肽的表达水平、身体和器官的重量以及运动功能。所有异常值都包含在数据分析中。对每个基因型至少五只小鼠进行了探索性实验。基于测量了样品内变异性的先前限定的效应量(effect size)和标准偏差,使用g-power分析方法计算样本量(sample size)。
[0227]
所有数据均以平均值sem绘制并使用graphpad prism软件(第7版)进行分析。两组之间的检验使用双尾student-t检验。多组之间的检验使用单因素方差分析(one-way analysis of variance,anova),用bonferroni多重比较事后检验进行校正。
[0228]
反义寡核苷酸
[0229]
lna亚磷酰胺是通过使用标准方法(koshkin et al.,1998,am.chem.soc.,120,13252-13253)从3
’‑
羟基前体(rasayan)自制的。所有其他亚磷酰胺均购自chemgenes。将0.1m ddtt(chemgenes)用作硫化剂,并且将0.25m btt(aic)用作活化剂。根据所需规模,在dr.oligo 48,abi394,akta oligopilot10或akta oligopilot 100合成仪上合成aso。将lna和moe亚磷酰胺偶联8分钟。将寡核苷酸在浓氨水中在55℃下脱保护18小时,并使用离子交换色谱对其进行纯化(用在包含提高的naclo4梯度的水中的30%乙腈洗脱)。通过在amicon离心式滤器中渗滤进行最终的纯化、脱盐、浓缩和ph调节。所有寡核苷酸均通过lcms表征。
[0230]
双萤光素酶报道测定系统
[0231]
使用以下正向和反向引物5’acgtatgcggccgcacgtaacctacggtgtc3’、5’atacgtgcggccgctaccatcagtcaagtgatg3’从血液基因组dna中扩增包含两个g2c2基序的c9-内含子1(g4c2重复基序5’的334个核苷酸和3’端的769个核苷酸)并将其克隆在到psichecktm-2载体(promega)中。用双萤光素酶报道测定系统(dual luciferase reporter assay system)(promega)根据制造商说明测量c9-内含子1表达。
[0232]
细胞培养
[0233]
hek293t细胞。在t25瓶中,使用lipofectamine 3000用p3000试剂根据制造商说明(thermoscientific)用6.5μg的含有c9内含子1的psichecktm-2载体(promega)转染hek293t细胞。在转染之后一天,将细胞以补充有10%fbs的dmem平板接种到96孔板中,并在第二天使用lipofectamine rnaimax试剂(thermoscientific)用指定剂量的反义寡核苷酸
进行处理。在反义寡核苷酸处理之后48小时将细胞裂解并量化萤光素酶信号。
[0234]
c9患者来源成纤维细胞。将从两个不相关c9载体获得的皮肤活检物切成小块,并放置于含有补充有15%胎牛血清的dmem的培养皿上以允许成纤维细胞扩增。使用lipofectamine rnaimax试剂(thermoscientific)对平板接种在10cm皿中的细胞进行反义寡核苷酸处理。在处理之后72小时分离总rna。
[0235]
c9bac来源原代皮质神经元。在e15.5从与纯合c9bac雄性杂交的妊娠野生型c57bl/6雌性中取出胚胎。在冰冷的hank’s平衡盐溶液(thermoscientific)上解剖每个胚胎的皮质组织。将合并的组织切碎并用0.05%胰蛋白酶-edta(life technology)在37℃下消化12分钟。通过添加10%fbs/dmem停止消化。将细胞研磨,重悬在补充有glutamax(thermoscientific)、2%青霉素/链霉素和b27补充剂(thermoscientific)的神经基础培养基中,并以0.5
×
10e6个细胞/孔接种在预包被有聚鸟氨酸(sigma)的6孔板中。将神经元在培养之后5天用指定剂量的反义寡核苷酸进行处理,并在处理之后15天收集。
[0236]
c9orf72bac转基因小鼠
[0237]
如前所述(peters et al.,neuron,2015,88,902-909)产生c9bac小鼠,并与c57bl/6回交。所有实验方案和操作均获得了马萨诸塞大学医学院机构动物护理和使用委员会(university of massachusetts medical school institutional animal care and use committee)的批准。
[0238]
在小鼠脑中的立体定位泵植入和推注注射aso
[0239]
对于反义寡核苷酸或pbs载剂通过微渗透泵(与alzet脑输注套件3连接的alzet泵模型1007d)的脑室内(icv)输注,将野生型c57bl/6或c9bac转基因小鼠麻醉并通过立体定位框架下的鼻锥维持在2.5%异氟烷中。如前所述(devos et al,2013,j vis exp,e50326-e50326)进行植入操作,用3mm套管植入前囟点后0.2mm和前囟点右侧侧面1.0mm处。
[0240]
对于icv推注注射,将小鼠用异氟烷麻醉并置于立体定位框架中。使用以下坐标将10μl无菌pbs或反义寡核苷酸注射到右侧脑室中:前囟点后0.2mm和前囟点右侧侧面1.0mm,并向下至3mm的深度。
[0241]
小鼠行为监测
[0242]
在处理进程中和即将处死之前,由经训练的观察者每周对每只动物进行盲法称重并评价不良事件,其被限定为在初始匹配的对照动物中不典型的任何行为,包括但不限于:肢抱握(limb clasping)、震颤、呼吸异常、瘫痪、痉挛、反射受损、多动和嗜睡。
[0243]
旋转法
[0244]
使用如前所述(peters et al,同上)的旋转法测试在对照和经处理小鼠中评估协调的运动功能。简言之,在反义寡核苷酸/载剂施用之前两周开始每周对小鼠进行测试,并在处死的那周结束。使每只动物在4至40rpm加速旋转仪上进行3次试验,持续5分钟,试验间间隔为间距1分钟。每只动物掉落的等待时间(latency to fall)由计算机自动记录并绘制为平均值 /-sem。
[0245]
血液生物化学
[0246]
在心脏穿刺(终末操作)之后收集全血样品。使用vetscan综合诊断谱(abaxis,union city,ca)进行血液生物化学。
[0247]
southern印迹
[0248]
对使用gentra puregene tissue试剂盒(qiagen)分离的10μg基因组dna进行southern印迹。将dna用alui和ddei在37℃下消化过夜,并通过在0.6%琼脂糖凝胶上电泳来进行分离,转移至带正电荷的尼龙膜(roche applied science),通过uv进行交联,并在杂交混合缓冲液(easyhyb,roche)中与经地高辛标记的g2c4 dna探针在55℃下杂交过夜。用抗地高辛抗体和cdp-star试剂按照制造商(roche)建议,检测经地高辛标记的探针。
[0249]
rna提取和定量实时pcr
[0250]
使用trizol(thermoscientific)从速冻的皮质或脊髓组织中分离总rna,并随后用dnasei(qiagen)处理。使用随机六聚体和multiscribe逆转录酶(thermoscientific)按照制造商说明将1μg总rna逆转录成cdna。使用sybr green master mix(applied biosystems)和0.2μm的正向和反向引物在steponeplus实时pcr系统上进行定量pcr,如(jiang et al.,neuron,2016,90,535-550;tran et al,2015,neuron,87,1207-1214)中所述。每个样品和基因的ct值都相对于gapdh进行归一化。使用2
(-δδct)
方法确定各靶基因的相对表达。
[0251]
荧光原位杂交(fluorescence in situ hybridization,fish)
[0252]
在55℃下在含有甲酰胺40%/2xssc/0.1%吐温20/dna鲑鱼精的杂交缓冲液中使用5’端cy3缀合的(g2c4)4寡核苷酸dna探针如前所述(jiang et al.,同上;tran et al,同上)进行fish。然后将样品在预温的洗涤缓冲液(甲酰胺40%/2xssc/0.1%吐温20)和在严格洗涤缓冲液(0.2xssc/0.1%tween20)中在55℃下洗涤两次。然后将样品用dapi(thermoscientific)在prolong gold antifade试剂中封固。用leica tcs sp5 ii激光扫描共焦显微镜拍摄共焦图像,并用leica las af软件处理。
[0253]
聚(gp)和聚(pr)的检测
[0254]
由new england肽产生针对重复基序(gp8、pr8)的兔多克隆抗聚gp和pr抗体。使用利用meso scale discovery(msd)电化学发光检测技术的夹心免疫测定来测量裂解物中的聚(gp)或聚(pr)水平。使用tissuelyserii(qiagen)在补充有1
×
roche完全蛋白酶抑制剂和1
×
halt蛋白酶抑制剂混合物(thermoscientific)的ripa缓冲液中裂解组织样品,随后在冰上进行声处理。将样品在摇杆(rocker)上在4℃下温和均质30分钟。通过离心(15分钟,14000g,4℃)去除碎片并收集上清液。使用bca蛋白质测定试剂盒(thermo scientific)确定总蛋白质浓度。以复孔的方式每孔加载稀释在补充有10%胎牛血清的pbs-吐温中的50μg总蛋白。将在野生型c57bl/6脑蛋白提取物中掺入的重组(gp)8或(pr)8的系列稀释物用于制备标准曲线。获得与使用msd quickplex sq120对测定板进行电化学刺激时发射光强度相对应的响应值,并使用来自从野生型c57bl/6脑提取物获得的裂解物的平均响应进行背景校正。
[0255]
免疫组织化学
[0256]
从安乐死的动物中迅速取出脑。将对侧半脑在10%甲醛中后固定。将经石蜡包埋或经冷冻保护的块切成10μm厚的矢状切片。用triton 0.1%使载片透化10分钟。通过与pbs/吐温0.01%中的10%山羊血清孵育1小时来阻断非特异性抗体结合。将一抗在封闭溶液中稀释,并将切片在4℃下孵育过夜。在pbs/吐温0.01%中洗涤3次之后,将切片与稀释在pbs中的与alexa fluor-488或-546缀合的二抗一起在室温下孵育1小时。通过将载片浸入70%乙醇中的0.5%苏丹黑b(sudan blackb)来淬灭自发荧光,并用dapi对细胞核进行染
色。使用的一抗:小鼠抗neun(1∶500,millipore),兔抗p/s反义寡核苷酸(1∶500,自制)。简言之,兔多克隆抗体是通过用完全经ps修饰的、klh缀合的反义寡核苷酸接种两只雌性新西兰白兔在内部培养的。在一年内以规则的间隔进行加强和放血,并使用抗血清进行组织学。
[0257]
苏木精和伊红(he)染色
[0258]
从经福尔马林固定的经石蜡包埋的块中切下8至10μm厚的小鼠肝和肾的切片。进行标准he染色。
[0259]
统计学分析
[0260]
所有数据均以平均值
±
sem绘制,并使用graphpad prism软件(第7版)进行分析。两组之间的检验使用双尾student-t检验。多组之间的检验使用单因素方差分析(anova),用bonferroni多重比较事后检验进行校正。*p<0.05,**p<0.01,***p<0.001,****p<0.0001,ns不显著
[0261]
实施例2:g4c2靶向反义寡核苷酸在患者来源成纤维细胞和c9bac小鼠来源神经元中降低含有重复的c9orf72转录物
[0262]
优化g4c2靶向反义寡核苷酸
[0263]
由于c9orf72的单倍体不足被认为是不利的,因此开发了反义寡核苷酸,使得其仅靶向带有g4c2重复扩增的v1和v3转录物的5’端,而免去(spare)了v2转录物。由于含有重复的内含子是保留的还是被剪接掉的尚不完全清楚,因此在其核苷酸序列和糖部分2’位的化学修饰(锁核酸(lna)或2
’‑
o-甲氧基乙基(moe)取代)上不同的反义寡核苷酸序列被改造为靶向内含子-重复连接(图1a)。如图1a中所示,位于第一内含子中的重复扩增(三角形)在变体1和3(v1-v3)中表达。最丰富的变体2(v2),从不同的转录起始位点(黑色箭头)开始,并且不包含重复扩增。v2和v3编码主要的c9orf72蛋白同种型。深灰色框表示非翻译区(utr);浅灰色框表示外显子;黑色线表示内含子。本研究中使用的反义寡核苷酸(指定为“aso”的灰色条)靶向侧翼为重复扩增的内含子区域。其他人先前已在患者来源样品中成功测试了这种特定设计(jiang et al.,同上;donnelly et al.,2013,neuron,80,415-428;lagier-tourenne et al.,2013,proc.natl.acad.sci.u.s.a,110,e4530-9)。
[0264]
为了与需要未经修饰中心区域的rnase h介导的降解保持相容,将反义寡核苷酸设计为“间隔体”,其中只有5’和3’端核糖核苷酸携带这些取代(图1b)。在图1b中,绿色圆圈是锁核酸(lna);蓝色圆圈是2
’‑
o-2-甲氧基乙基rna(2
’‑
o-moe);空心圆圈是dna;深绿色三角形是硫代磷酸酯核苷酸键(ps)。lna取代在2’和4’位之间包含亚甲基桥,其将核糖骨架“锁定”在有利于与其rna靶标互补碱基配对的构象中。moe取代提高了反义寡核苷酸的稳定性和效力,并且是两种fda批准的药物的组分(finkel et al.,2017,n.engl.j.med.,377,1723-1732;raal et al.,2010,lancet,375,998-1006)。除了这些糖修饰之外,每个磷酸二酯(po)核苷间键都被取代为硫代磷酸酯(ps)键,其中一个非桥接氧原子被硫原子替代,这通过阻断核苷降解大大提高了稳定性(eckstein et al.,2014,nucleic acid ther,24,374-387)(图1b)。此外,每个胞嘧啶在5’位都连接了甲基,已表明该修饰减轻了对反义寡核苷酸在体内的潜在免疫应答(krieg et al.,2002,annu.rev.immunol.20,709-760)。
[0265]
为了筛选抑制转录物v1、v2和v3表达的反义寡核苷酸,开发了双萤光素酶测定(图2a)。对大量反义寡核苷酸候选物进行了初步测试筛选,之后将其缩小到了五个。
[0266]
在培养的细胞中测试g4c2靶向反义寡核苷酸
[0267]
为了在培养的细胞中测试g4c2靶向反义寡核苷酸,我们首先验证了来源于两名c9-als/ftd患者的原代成纤维细胞携带多于1000个g4c2重复并显示出g4c
2 rna病灶(图2b)。如图2b左图中所示,用5’dig-(g4c2)
5-dig-3’dna探针探测的从两个非c9载体和两个c9载体来源成纤维细胞中提取的基因组dna的southern印迹显示出约10kbp的条带,代表约1000个重复的扩增。在图2b的右图中,在成纤维细胞中使用重复特异性cy3 dna探针进行的rna fish示出了以红色显示的多个rna病灶(白色箭头)。然后在存在阳离子脂质的情况下以100nm剂量用反义寡核苷酸1至5处理来源于上述两名c9-als/ftd患者的原代成纤维细胞。反义寡核苷酸1至5(aso1至5)的序列示于下表1中。
[0268]
表1-在培养的细胞中使用的反义寡核苷酸(aso)
[0269][0270]
其中加下划线的序列表示2
’‑
o-(2-甲氧基乙基)修饰,并且粗体序列表示lna修饰。
[0271]
在72小时之后,我们通过qrt-pcr测定了v1-v3含有重复的转录物的水平。尽管与未经处理的培养物(ut)相比,非靶向对照(ntc)序列对v1-v3水平没有显著作用,但所有五种aso都将患者成纤维细胞中的v1-v3表达显著降低至几乎不可检出的水平(图3a)。如图3a中所示,在患者来源成纤维细胞中在脂质介导的递送之后72小时,lna和2
’‑
o-moe aso二者在100nm的剂量下均显著降低了含有重复的转录物水平,如通过qrt-pcr所测量的。对每种化合物在患者来源细胞中和在表达双报道测定的hek293人细胞系中的更深入表征(图2a)显示出v1-v3或c9内含子靶rna的表达呈剂量依赖性降低(图3b)。在图3b的左图中,示出了aso 2至5在成纤维细胞中的剂量响应;在右图中,示出了aso 1至5在用c9luc报道测定转染的hek293细胞中的剂量响应。所有数据均根据五点非线性拟合剂量响应曲线绘制。为了确定aso处理是否也影响rna病灶(c9-als/ftd的标志)(dejesus-hernandez et al.,2011,neuron,72,245-256;gendron et al.,2013,acta neuropathol.126,829-844;zu etal.,2013,proc.natl.acad.sci.u.s.a.110,e4968-77;donnelly et al.,同上;lagier-tourenne et al.,同上;almeida et al.,2013,acta neuropathol.126,385-399;mizielinska et al.,2013,acta neuropathol.126,845-857;sareen et al.,2013,sci transl med 5,208ra149),我们通过fish标记这些rna病灶,然后量化具有病灶的细胞数和每个细胞的病灶数。在100nm aso处理之后72小时,具有病灶的细胞数从未经处理条件下的80%显著降低至经处理条件下的20至40%;此外,每个细胞检出的病灶较少,表明所有五种
aso都是g4c
2 rna病灶的强效抑制剂(图4a)。在图4a的左图中示出了在未经aso处理或用aso处理72小时的患者来源成纤维细胞中通过fish显现的rna病灶的代表性图像。右图示出了当细胞未用aso处理、用非靶向对照aso(ntc)处理、用经lna修饰aso(aso 1至3)处理或用经2
’‑
o-moe修饰aso(aso 4至5)处理时,每50个无病灶(浅灰色)、具有1至4个病灶(深灰色)或具有多于5个病灶(黑色)的细胞的细胞核百分比。为了确定这五种aso的体内cns递送是否可行,我们评价了每种aso“自我递送(self-deliver)”(在没有转染试剂的情况下被剥裸性摄取)并在神经元中保持活性的能力。原代皮质神经元来源于e15.5c9bac胚胎,并在体外天数(day in vitro,div)为5天时用1μm的每种as进行处理。在处理之后15天(20div),与非靶向对照或未经处理条件相比,在所有经处理条件下,人v1、v3(含重复)转录物的表达均显著降低(从用aso1的40%降低至用aso3的80%)(图4b)。如图4b中所示,在来源于c9bac小鼠的原代皮质神经元中在无脂质辅助的情况下100nm递送(剥裸性递送)之后两周,lna和2
’‑
o-moe aso二者均显著降低了含有重复的转录物的水平。
[0272]
从这些体外实验中,我们得出结论,在多种细胞模型(表达c9内含子1报道测定的hek293细胞、c9-als/ftd患者来源成纤维细胞、c9bac小鼠来源皮质神经元)中,aso 1至5(图1b)全部都强效地抑制了v1和v3(含有重复)转录物的表达,同时免去抑制v2,并且全部都在无辅助的情况下被神经元有效地摄取。
[0273]
实施例3:g4c2靶向aso在c9bac小鼠中在cns输注之后选择性地降低c9orf72含有重复的转录物和多肽
[0274]
接下来,我们在野生型(wt)和c9orf72转基因小鼠中体内评价了这些aso的特性。aso不能有效地穿过血脑屏障(geary et al.,2015,adv.drug deliv.rev.87,46-51)。然而,其可通过脑室内(icv)推注注射或渗透泵输注通过周围脑脊液(cerebral spinal fluid,csf)递送至脑组织和脊髓(rigo et al.,2014,j.pharmacol.exp.ther.350,46-55)。在确定我们的aso是否能在c9bac小鼠中在体内有效降低含有重复的转录物的表达之前,我们首先评估了其在野生型c57bl/6小鼠中的耐受性。
[0275]
每只动物都接受了我们的五种aso的单次icv推注剂量。每个处理组由2至4只小鼠组成。虽然这些wt小鼠耐受30nmol的经moe修饰aso 4至5,但多于5nmol的经lna修饰aso 1至3是致命的。注射aso 1、2和4的小鼠在从麻醉中恢复之后出现严重癫痫发作(seizure)或在注射之后24小时内未能存活,而用aso 3和5(共有相同的核苷酸序列但因其糖修饰不同)处理的小鼠保持警觉并对刺激做出响应,在注射之后多至一周没有明显的归咎于处理的有害作用(图5a)。图5a总结了aso序列及其在icv推注注射之后在4至6月龄的野生型小鼠中的体内响应:粗体绿色,lna;粗体蓝色,moe;斜体黑色,dna。
[0276]
受到aso 3和5在wt小鼠中的安全性谱的鼓舞,我们然后通过icv施用比较了其在c9bac转基因小鼠中的耐受性和效力。我们实验室产生的c9bac转基因小鼠在截短的人c9orf72基因(来自外显子1至6)内表达了约600个g4c2重复基序。虽然这些小鼠没有发展出运动表型,但它们充分概括了独特的疾病标志,包括含有重复的rna病灶和dpr(peters et al.,同上),并因此是用于评估aso 3和5在体内活性的效力的合适c9-als/ftd小鼠模型。
[0277]
在cns之外,观察到一些经lna修饰aso是更强效的,但与经moe修饰aso相比也可能更具毒性(swayze et al.,2007,nucleic acids research 35,687-700)。实际上,在我们的c9bac小鼠中,我们无法安全地用多于10nmol的这三种经lna修饰化合物中的任一种使用
推注注射进行脑室内输注。为了克服这个限制,接下来我们使用渗透泵,其允许随着时间的推移输注更高量的经lna修饰aso(aso3),并允许将其效力与经moe修饰的形式(aso5)进行比较。通过套管使用植入的alzet渗透泵,将递增剂量的每种aso连续输注到年龄匹配的杂合c9bac小鼠的右侧脑室中,历经7天(图5b,上部)。图5b的上图示出了杂合c9bac小鼠中的实验设计示意图。将载剂对照(pbs)、非靶向对照aso(ntc)以及25至200nmol的aso3和aso5输注到5至6月龄c9bac小鼠的右侧脑室中,历经7天。在泵移除之后两周收获并解剖脑和脊髓以进行rna和dpr分析(脊髓和同侧脑半球)以及aso染色(对侧脑半球)。下图示出了aso3和aso5(绿色)被神经元(红色)摄取——细胞核复染为蓝色。每组条件使用5至7只动物,并且输注pbs或非靶向aso的动物用作对照。在7天输注之后两周处死的动物的脑表现出与神经元摄取相关的在整个脑中广泛的aso分布(图5b,下部)。
[0278]
与经pbs输注的动物相比,用aso3和aso5处理的动物的皮质和脊髓区域显示出在皮质和脊髓区域二者中v1和v3含有重复的转录物强效、剂量依赖性的降低;在用非靶向aso处理的对照动物中未看到这样的降低(图6a)。图6a示出了在以指定剂量输注pbs(深灰色)、ntc aso(浅灰色)、aso3(绿色)或aso5(蓝色)的小鼠中通过qrt-pcr量化的皮质和脊髓中的v1-v3含有重复的转录物的表达。除ntc组(n=3)之外,对于每个剂量水平,n=5至7。重要的是,尽管它们对v1和v3有影响,但aso3或aso5都没有导致v2转录物(并因此总c9orf72转录物变体)水平的任何显著性降低(图6b)。图6b示出了在以指定剂量输注pbs(深灰色)、ntc aso(浅灰色)、aso3(绿色)或aso5(蓝色)的小鼠中通过qrt-pcr量化的皮质和脊髓中的所有转录物的表达。除ntc组(n=3)之外,对于每个剂量水平,n=5至7。在用aso3和5二者处理的小鼠皮质中,聚-gp dpr也降低(图7a,上部)。图7a的上图示出了通过夹心免疫测定测定的用aso3(绿色)和aso5(蓝色)处理的小鼠的皮质中聚gp的相对表达。数据表示为平均值
±
sem。
[0279]
在长期输注的情况下,经lna和经moe修饰的aso在所有受试剂量下总体耐受性良好。在整个aso施用进程中未观察到不良的行为副作用,并且所有动物直至其在21天被处死时都保持健康。在he染色之后的常规临床血液化学以及肝和肾形态均未显示出异常(数据未示出)。从处理开始到处死时的体重监测显示出与处理之前的初始体重相比平均损失了10%;这可能与泵植入手术有关,因为这也发生在输注pbs的小鼠中。在100nmol剂量下,接受lna化合物aso3的小鼠显示出更多的体重损失(18%)(图7a,下部)。图7a的下图示出了相对于处理之前在终点时体重损失的百分比。
[0280]
c9bac小鼠体内的这些结果表明,尽管在缓慢长期泵输注之后具有相当的效力,但经moe修饰的aso5比经lna修饰的aso3耐受性更好。这种差异在推注注射之后是显著的,但在长期施用输注之后也很明显。
[0281]
实施例4:降低aso5的硫代磷酸酯含量在c9bac小鼠中单次cns施用之后提高其安全性谱而不影响其生物活性
[0282]
为了研究aso5在推注注射之后在c9bac小鼠神经系统中的药效学特性(并限定最佳给药方案),我们首先进行了体内实验,其表明通过推注注射递送的aso5广泛分布于整个小鼠cns中(图7b)。这一发现与先前显示出在推注注射之后优异的aso组织分布(并且与长期施用相比,肝和脑组织中改善的药效学活性(rigo et al,同上;geary et al.,同上))的报道一致。然后,我们鉴定了aso5在野生型c57bl/6小鼠中的最大耐受剂量,我们将其限定
为注射之后一周内不会引起癫痫发作或不可接受的副作用(参见材料和方法)的最高剂量。没有小鼠在50nmol的aso5的推注注射中存活下来,而注射了30nmol的所有8只小鼠在整个处理进程中均保持警觉和良好(图8a,左)。在图8a的左图中:绿色三角形,硫代磷酸酯键(ps);绿色线,磷酸二酯键(po);蓝色,2
’‑
o-moe;黑色,dna:红色星突出显示了aso 5-1与aso 5-2之间ps/po差异的位置。右图示出了po和ps键的化学结构。这种低mtd显著限制了给药方案并缩短了治疗窗口。为了实现安全性和效力的更好平衡,我们试图提高aso5的效力和耐受性,所述aso5具有完全经修饰的骨架,其中所有核苷酸间键均为硫代磷酸酯(ps)(图8a)。
[0283]
尽管其具有优势(对核酸酶的抗性提高和细胞摄取提高),但ps修饰还显示出提高的蛋白质结合,这可导致毒性(eckstein et al.,同上;agrawal et al.,1999,biochim.biophys.acta 1489,53-68)。因为csf具有相对低的核酸酶活性(whitesell et al.,1993,proc.natl.acad.sci.u.s.a.90,4665-4669;campbell et al.,1990,j.biochem.biophys.methods 20,259-267),我们推断我们可降低ps键的数目以产生毒性较小的aso,而不会影响在神经系统中的活性。我们的第一次尝试的是由仅每隔一个核苷酸引入ps键组成。注射50nmol这种“跳过(skipped)”aso是耐受的,但仍不能令人满意,因为小鼠在处理之后前24小时内显示出异常行为(运动缓慢,对刺激没那么具有反应性)(数据未示出)。aso5还在五个末端核苷酸或翼核苷酸的核糖上携带了moe翼修饰,这提高了靶杂交和核酸酶抗性。因此,我们仅在未经moe修饰的末端和中央“间隔”核苷酸区域引入了ps键。aso5-1和aso5-2的区别仅在于核苷酸5至6和13至14之间存在或不存在ps键。这一修饰模式显著提高了aso5的耐受性。aso5-1的最大耐受剂量(mtd)为60nmol。aso5-2以比aso5高2.5倍的80nmol的剂量安全注射在非转基因小鼠中,没有不良事件(图8a,左)。
[0284]
为了进一步研究其生物活性,我们在c9-als/ftd成纤维细胞中测试了这些经修饰aso。在脂质介导的处理之后72小时,如用aso5所观察到的,aso5-1和aso5-2均显著降低了v1和v3含有重复的转录物的水平,而没有改变c9转录物的总水平(图8b)。图8b的左图示出了100nm的混合ps/po对aso5在患者来源成纤维细胞中对v1-v3的效力的作用。右图全部示出了100nm的混合ps/po对aso5在患者来源成纤维细胞中对所有表达水平的效力的作用。此外,体外剂量响应研究显示出在aso5、aso5-1与aso5-2之间的效力没有显著差异(图9a)。图9a示出了在72小时时aso5、aso5-1和aso5-2对c9-als/ftd成纤维细胞的剂量响应。
[0285]
为了确定这些结果是否会在体内转化,我们首先在c9bac小鼠中通过推注icv注射来施用30nmol的每种aso,并在注射之后八周分析每种aso的效力(图9b,左)。图9b的左图示出了在杂合c9bac小鼠中的实验设计示意图。将载剂对照(pbs)、aso5、aso5-1或aso5-2注射到5至6月龄的c9bac小鼠的右侧脑室中。在处理之后八周收获并解剖脑和脊髓以进行rna和dpr分析。中图示出了在aso处理之后八周未观察到体重的显著变化。右图示出了在3周时,aso5-2未引起重量损失。这些结果表明,每种处理都具有良好的耐受性,没有观察到不良副作用或显著的重量损失(图9b,中,右)。常规血液化学测试未显示出异常(图11)。图11示出了在脑室内注射aso5-2之后3周时的血液化学的图。与经pbs处理的组相比,用30nmol的aso5和aso5-2处理的小鼠在皮质和脊髓中的v1和v3(含有重复)转录物水平显著降低(图10a)。图10b的左图示出了通过qrt-pcr量化的皮质和脊髓中的v1和v3(含有重复)转录物的表达。右图示出了30nmol的aso5和aso5-2处理对总转录物的作用最小(图12)。图12a示出了
通过qrt-pcr量化的皮质和脊髓中的所有转录物(i,m)的表达。图12b示出了脑和脊髓中所有转录物对aso5和aso5-1的剂量响应。该结果表明,在处理之后八周,两种经moe修饰的核苷酸之间没有ps核苷酸间键不会损害体内生物活性(图13)。相比之下,在经moe修饰的与未经修饰的dna核苷酸之间的连接处缺乏ps键的aso5-1在30nmol剂量下仅实现了v1-v3约25%的敲低(图1ob)。此外,在本实验中测试的aso5-1的最高剂量(60nmol)下,皮质和脊髓中的最大效力为仅约60%(图10b)。
[0286]
基于其效力和耐受性谱二者,本研究将aso5-2限定为我们的系列中最好的化合物,以推进更深入的表征。
[0287]
实施例5:混合骨架aso5-2在两种c9bac小鼠模型的cns中的持续和强效的作用
[0288]
我们在杂合c9bac小鼠中进行了研究,以研究aso5-2的完整体内剂量响应(图14a)。如图14a中所示,在5至6月龄的杂合c9bac小鼠中施用载剂对照(pbs)和单次注射1、5、15、30、60或80nmol的aso5-2。在处理之后24小时、3、8、12或20周收集并分析脑和脊髓。结果显示出在处理之后三周c9bac小鼠皮质中的ic50为4.75nmol(图14b)。在图14b的左图中,将pbs,1、5、15、30或60nmol的aso5-2注射到小鼠的右侧脑室中,并在注射之后3周分析v1和v3(含有重复)转录物和所有转录物的表达。右图示出了在使用希尔方程非线性回归模型之后的剂量响应曲线。所有转录物的相对表达用黑色虚线表示,v1和v3(含有重复)转录物用蓝色线表示。ic50估计为4.75nmol。对于每个剂量组,n=6至7。在4.75nmol时,聚gp也存在显著的剂量依赖性降低(图15a,左)。相比之下,聚pr没有检出变化,所述聚pr是从反义链合成的肽(图15a,右)。在图15a的左图中,将pbs,1、5、15、30或60nmol的aso5-2注射到小鼠的右侧脑室中,分析聚-gp的表达。在图15a的右图中,从同一组样品中分析聚-pr的表达。
[0289]
前述研究表明,在aso5中在两个moe核苷酸之间没有ps键(aso5-2)在处理之后三周在体外和在体内并不会损害生物活性。然而,由于ps键也保护aso免于核酸酶降解,我们想知道aso5-2的作用持续时间是否与其完全经ps修饰的亲本aso5相当。为了解决这一问题,我们向c9bac转基因小鼠注射了30nmol的aso5-2,并在注射之后24小时、3、8或20周分析了v1和v3转录物的水平(图14a)。在注射之后24小时未观察到对v1和v3靶rna的作用(图15b)。在图15b中,在用30nmol的aso5-2处理的小鼠中进行了时间进程实验,在处理之后24小时、3周、8周、12和20周收集并分析组织。在单次剂量注射aso5-2之后24小时、3、8、12或20周,在皮质中分析v1和v3(含有重复)转录物的表达。如前所述,在注射之后三周观察到v1和v3(含有重复)转录物显著且特异性降低约80%,但未观察到总c9转录物的显著且特异性降低(图14b),其在皮质中持续长达20周(图15b,图16a)。在图16a中,图16a示出了用30nmol的aso5、aso5-1和aso5-2处理8周的小鼠皮质中v1和v3(含有重复)转录物和所有转录物的表达,对于每组,n=5至7。类似地,在注射之后8周时,我们还观察到聚gp蛋白水平降低了约80%(图16b),但由内含子1的反义链产生的聚pr没有降低(图17a,图15a,右)。在图16b中,在用30nmol的aso5-2处理的小鼠中进行了时间进程实验,在处理之后24小时、3周、8周、12和20周收集并分析组织。在单次剂量注射aso5-2之后24小时、3、8、12或20周在皮质中分析聚-gp的表达。图17a示出了在单次剂量注射30nmol的aso5、aso5-1和aso5-2之后8周在小鼠中的皮质中聚-gp和聚-pr的表达。对于每组,n=5至7。在单次剂量之后20周时对v1和v3(含有重复)转录物的抑制(图15b)与注射之后8周用30nmol的aso5观察到的抑制(图10a)相当。
[0290]
在即将处死之前,在用aso5-2或pbs对照处理的动物中未检出显著的体重损失或
行为不良事件(如实施例1中所限定)(图17b)。同样,未观察到肝、肾和脾重量或形态的变化(图17b)。如图17b中所示,在处理之后未观察到体重、脾或肝的显著变化。也没有观察到明显的形态变化。最后,为了进一步测定aso5-2处理的耐受性,我们分析了用aso5-2处理或注射载剂pbs或ntc的小鼠的协调运动功能。在处理19周之后每周对每组7只小鼠以盲法方式测试其旋转法表现。在经处理组中未观察到运动缺陷,这增强了aso处理的耐受性(图18a)。图18a示出了在处理进程期间aso处理在5分钟加速旋转仪任务中未改变运动表现。
[0291]
实施例6:对c9orf72有义和反义转录物的表达的组合抑制
[0292]
数据表明由c9orf72基因的反义转录物产生的pr聚二肽具有细胞毒性。因此,如果多肽与由该基因介导的神经病理有关,则c9orf72的最佳抑制治疗将需要沉默有义和反义转录物二者。因此,我们产生了降低c9orf72反义转录物(即从与c9orf72内含子1相同区域但相反链表达的反义转录物)水平的另外的aso。通过在患者成纤维细胞中杂交筛选了26种候选aso(图18b)。图18b示出了在用载剂对照或靶向c9反义转录物的aso 72小时处理之后,每100个无病灶(浅灰色)、具有1至9个病灶(深灰色)或具有多于10个病灶(黑色)的成纤维细胞的细胞核百分比。使用c9orf72小鼠的两个系在体内测试了三周的这些中的两种,as-aso2和as-aso6(由红色星表示)(peters et al.,同上;o
′
rourke et al.,2015,neuron,88,892-901),单独的和与aso5-2组合(图19a)。图19a的左图示出了来源于baloh实验室的杂合c9小鼠中的实验设计示意图。右图示出了通过qrt-pcr测定的v1和v3(含有重复)转录物和所有转录物的表达。as-aso6不抑制v1-v3或总转录水平,而正如预期的那样,aso5-2再次选择性地靶向v1-v3(图19a,右图)。我们还使用支链dna测定了有义和反义转录物。图19b示出了在注射载剂对照(pbs)、60nmol非靶向对照(ntc)、30nmol的aso5-2或as aso6以及30nmol aso5-2和30nmol aso6的组合之后3周,有义的含有重复的转录物(左图)和反义的含有重复的转录物(右图)的表达。有义转录物被aso5-2以及aso5-2和as-aso6的组合抑制,但不被单独的as-aso6抑制(图19b,左图)。反义转录物不仅被as-aso6以及as-aso6和aso5-2的组合抑制,而且还被单独的aso5-2抑制到了出人意料的程度(图19b,右图)。单独或与as-aso6组合的aso5-2抑制聚gp水平,而单独的as-aso6不抑制(图20,左)。as-aso6以及aso6和aso5-2的组合显示出对聚pr的部分抑制,而正如预期的那样,aso5-2并没有(图20,右)。如图20中所示,在注射载剂对照(pbs)、60nmol非靶向对照(ntc)、30nmol的aso5-2或as aso6以及30nmol aso5-2和30nmol aso6的组合之后3周分析聚-gp(左图)和聚-pr(右图)的表达。
[0293]
实施例7:向患有als的患者施用aso5-2
[0294]
为了进一步表明本公开内容的反义寡核苷酸的效力,将aso5-2施用于诊断患有als的人患者。所有患者研究均在fda和irb批准下进行。将aso5-2溶解在usp级乳酸林格溶液中至浓度为11mg/ml。将溶液在无菌条件下无菌过滤到无菌注射器中,并以图21中所示的递增剂量通过鞘内注射立即施用于患者。剂量为0.5mg/ml至2.0mg/ml。在注射之后监测患者24小时。在所示的随后时间点,通过腰椎穿刺对患者脑脊液(csf)进行取样,并使用elisa评价聚(gp)的csf水平(图22)。数据表明,患者中的aso5-2处理导致聚(gp)的csf水平呈剂量依赖性降低,表明其抑制了带有引起als的突变体扩增的c9orf72rna同种型的表达。虽然在本例中测量了聚(gp)水平,但应理解,其他二肽重复蛋白,例如聚(gr)、聚(ga)、聚(pa)和聚(pr),也可在csf中降低。
[0295]
聚(gp)elisa方案
[0296]
通过以下制备蛋白质样品:1)收获期望的组织或细胞,2)添加1xripa缓冲液和蛋白酶抑制剂,3)向样品添加金属珠并在qiagen组织裂解仪中裂解30秒,并且频率为30,4)将样品以12,000rpm在4℃下离心15分钟,5)收集上清液并添加至新的管,6)进行bca测定以确定蛋白质浓度,7)用ripa缓冲液在储板(stock plate)中稀释样品,其中每个样品的终浓度为1.6μg/μl,总体积为150至200μl。通过在pbs中将捕获抗体稀释至2μg/ml并在每个板中心的小圆圈中的每个孔添加5μl来制备包被抗体。然后将板在4℃下孵育过夜。然后通过用150μl的pbs 0.1%吐温(pbs-t)洗涤板3次来进行洗涤和封闭。在室温下用150μl的pbs-t 10%fbs进行封闭至少1小时。然后去除封闭缓冲液并添加样品。然后进行检测。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
