1.本发明涉及一种双特异性抗体的纯化方法。
背景技术:
2.宿主蛋白残留(hcp)通常是指例如cho细胞等宿主细胞在培养过程中分泌的一些胞外蛋白和在澄清过滤时细胞破碎释放的一些胞内蛋白,为工艺相关杂质。监管部门对生物制品中hcp残留有严格要求,需要hcp残留降低到一个可接受的范围内。即使最终产品中含有很低剂量的hcp,也可能会导致抗体蛋白不稳定或者在病人体内产生免疫原性。因此,在下游纯化工艺中,hcp残留通常为关键质量属性。现有技术中常通过多个工艺步骤来降低hcp,例如絮凝、层析和吸附深层过滤。而面对不同性质的蛋白分子进行纯化时,需要选择合适的纯化方法以及纯化条件,以达到符合工艺要求的hcp去除效果。
技术实现要素:
3.为了解决现有的双特异性抗体(如本发明所述)经蛋白纯化后hcp残留量高的技术问题,本发明提供了一种本发明所述的双特异性抗体的纯化方法。使用本发明所述的纯化方法纯化所述的双特异性抗体时,可以将hcp控制在工艺可接受范围内,收集液残留hcp的含量低于约7000ppm。
4.发明人在纯化本发明所述的双特异性抗体时,首先尝试过使用常规的蛋白纯化技术(高盐和低ph冲洗缓冲液)进行纯化,结果发现所得残留液中hcp(宿主蛋白)残留显著高于常规的含量。针对该现象,发明人经过大量实验,发现不同冲洗缓冲液对hcp的去除效果有很大的影响,发明人进一步尝试调整亲和冲洗缓冲液的不同组合,最终发现当使用含有cacl2的冲洗缓冲液进行纯化时,可以将hcp控制在工艺可接受范围内,收集液残留hcp的含量低于约7000ppm。进一步地,发明人对包含cacl2的冲洗缓冲液浓度配比进行优化,发现了更适合本发明双特异性抗体的冲洗缓冲液的种类和浓度范围。
5.为了解决上述技术问题,本发明提供了一种双特异性抗体的纯化方法,其包括使用亲和层析来纯化所述双特异性抗体的步骤;其中在所述双特异性抗体上样后,使用含有cacl2的冲洗缓冲液冲洗层析柱;
6.其中,所述双特异性抗体包含以下部分或由其组成:
7.(a)式(i)的多肽链:vh-ch1-fc-x-vhh;和
8.(b)式(ii)的多肽链:vl-cl;
9.其中:
10.vh表示重链可变区;ch表示重链恒定区;fc包含ch2、ch3,以及任选的ch4;ch1、ch2、ch3和ch4分别表示重链恒定区的结构域1、2、3和4;x为接头或不存在;vhh表示单结构域抗原结合蛋白;vl表示轻链可变区;cl表示轻链恒定区;
11.其中,所述vhh包含seq id no:6中所含的三个互补决定区域(vhh cdr);和/或,所述vh包含如seq id no:2所示的重链可变区vh的3个互补决定区hcdr;和/或,所述vl包含如
seq id no:8所示的重链可变区vl的3个互补决定区lcdr。
12.较佳地,所述的冲洗缓冲液的ph为6.0-8.0,例如为6.4、6.5、6.7、6.8、6.9、7.0或7.2。本发明人在实验过程中发现,当ph低于6或高于8时,会对最终纯化的抗体的性质产生影响。
13.较佳地,所述cacl2的浓度可为本领域常规,例如为0.2-2m,优选0.4-2m,例如0.4、0.5、0.8、1.0、1.2、1.6或2.0m。
14.本发明中,所述的冲洗缓冲液或冲洗液通常是指在所述的亲和层析过程中,上样之后进行冲洗时所使用的缓冲液,本领域人员应当知晓其含义。在某一较佳实施例中,所述的亲和层析可以为protein a亲和层析。所述protein a亲和层析使用的柱子可以为本领域常规使用的柱子,例如可以使用柱高为5-7.5cm的柱子,还可以是使用体积为4.7-8ml的柱子。所述protein a亲和层析还可以是例如使用mabselect sure lx填料装填的柱子或使用mabselect sure预装柱。
15.较佳地,所述的冲洗缓冲液进一步含有mgcl2和/或tris-hcl。
16.其中,所述mgcl2的浓度可为本领域常规,例如为0.2-1.0m,优选0.2-0.8m,更优选为0.4-0.8m。
17.其中,所述tris-hcl的浓度可为本领域常规,例如为10-50mm,优选20mm。
18.在某一较佳实施例中,所述的冲洗缓冲液由tris-hcl和cacl2组成。其中,所述tris-hcl的浓度优选为10-50mm,例如20mm;所述cacl2的浓度优选为0.4-2m,例如0.5或1m。
19.在某一较佳实施例中,所述的冲洗缓冲液由tris-hcl、cacl2和mgcl2组成。其中,所述tris-hcl的浓度优选为10-50mm,例如20mm;所述cacl2和mgcl2的浓度各自独立地优选为0.2-1.0m,更优选0.4-0.8m。
20.在某一较佳实施例中,所述的冲洗缓冲液由20mm tris-hcl和0.5m cacl2组成,其ph为6.0-8.0,优选为7.0。
21.在某一较佳实施例中,所述的冲洗缓冲液由20mm tris-hcl和1m cacl2组成,其ph为6.0-8.0,优选为6.8。
22.在某一较佳实施例中,所述的冲洗缓冲液由20mm tris-hcl和2m cacl2组成,其ph为6.0-8.0,优选为6.4。
23.在某一较佳实施例中,所述的冲洗缓冲液由20mm tris-hcl、0.1m cacl2和0.1mmgcl2组成,其ph为6.0-8.0,优选为7.2。
24.在某一较佳实施例中,所述的冲洗缓冲液由20mm tris-hcl、0.4m cacl2和0.4mmgcl2组成,其ph为6.0-8.0,优选为6.9。
25.在某一较佳实施例中,所述的冲洗缓冲液由20mm tris-hcl、0.6m cacl2和0.6mmgcl2组成,其ph为6.0-8.0,优选为6.7。
26.在某一较佳实施例中,所述的冲洗缓冲液由20mm tris-hcl、0.8m cacl2和0.8mmgcl2组成,其ph为6.0-8.0,优选为6.5。
27.本发明中所述的双特异性抗体为pct/cn2020/073964中公开的同时结合pd-l1和lag-3的双特异性抗体。为了本发明的目的,该pct申请的全部内容特此并入本文作为参考。所述双特异性抗体可以为如图1所示结构的抗lag-3/pd-l1双特异性抗体,其中抗原a为lag-3,抗原b为pd-l1。由式(i)的vh和式(ii)的vl形成的结合位点对lag-3是特异性的,由
式(i)的vhh形成的结合位点对pd-l1是特异性的。
28.较佳地,所述的双特异性抗体中,所述的vhh包含互补决定区域(cdr)vhh cdr1、vhh cdr2和vhh cdr3,其中vhh cdr1包含seq id no:10的氨基酸序列,或由如seq id no:10所示的氨基酸序列组成;vhh cdr2包含seq id no:11的氨基酸序列,或由如seq id no:11所示的氨基酸序列组成;vhh cdr3包含seq id no:12的氨基酸序列或由如seq id no:12所示的氨基酸序列组成。更佳地,所述的vhh包含seq id no:6所示的氨基酸序列或由如seq id no:6所示的氨基酸序列组成;或与seq id no:6的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列或由其组成。
29.较佳地,所述的双特异性抗体中,所述的vh包含互补决定区域(cdr)hcdr1、hcdr2和hcdr3,其中hcdr1包含seq id no:13的氨基酸序列,或由如seq id no:13所示的氨基酸序列组成;hcdr2包含seq id no:14的氨基酸序列,或由如seq id no:14所示的氨基酸序列组成;hcdr3包含seq id no:15的氨基酸序列,或由如seq id no:15所示的氨基酸序列组成。更佳地,所述的vh包含seq id no:2所示的氨基酸序列或由如seq id no:2所示的氨基酸序列组成;或与seq id no:2的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列或由其组成。
30.较佳地,所述的双特异性抗体中,所述的vl包含互补决定区域(cdr)lcdr1、lcdr2和lcdr3,其中lcdr1包含seq id no:16的氨基酸序列,或由如seq id no:16所示的氨基酸序列组成;lcdr2包含seq id no:17的氨基酸序列,或由如seq id no:17所示的氨基酸序列组成;lcdr3包含seq id no:18的氨基酸序列,或由如seq id no:108所示的氨基酸序列组成。更佳地,所述的vl包含seq id no:8所示的氨基酸序列或由如seq id no:8所示的氨基酸序列组成;或与seq id no:8的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列或由其组成。
31.较佳地,所述的双特异性抗体包含1条或2条式(i)的多肽链和1条或2条式(ii)的多肽链,或由所述多肽链组成。在某一较佳实施例中,所述的双特异性抗体包含至少一条式(i)的多肽链和一条式(ii)的多肽链。在某一较佳实施例中,所述的双特异性抗体包含两条(例如相同的)式(i)的多肽链和两条(例如相同的)式(ii)的多肽链。
32.较佳地,所述接头是柔性接头,例如具有单独或组合的甘氨酸和/或丝氨酸残基的接头。在某一较佳实施例中,所述接头包含氨基酸序列(gly4ser)n,其中n是等于或大于1的正整数,例如,n是1-7中的正整数,例如,n是2,3,4,5,6。在一个实施方案中,n是1、2、3或4。在某一较佳实施例中,所述接头可以包含seq id no:5的氨基酸序列或由如seq id no:5所示的氨基酸序列组成。
33.较佳地,所述的双特异性抗体为人抗体或人源化抗体,或嵌合抗体。
34.较佳地,所述式(i)的ch1-fc为选自igg的ch1-fc,例如选自igg1、igg2或igg4的ch1-fc。应当理解的是,可以对恒定结构域中的fc进行突变,以实现稳定抗体的作用,或增强效应子功能的作用。例如在一个具体实施方案中,所述效应子功能是抗体依赖的细胞介导的细胞毒性(adcc)。在一个实施方案中,所述氨基酸突变存在于ch2结构域,例如,所述抗体分子包含在第234和235位置(eu编号,根据kabat等,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md(1991)的eu索引进行编号)处的氨基酸置换。在一个具体实施方案中,
所述氨基酸置换是l234a和l235a。
35.较佳地,所述ch1和所述fc之间存在铰链区。在某一较佳实施例中,在ch1和cl之间存在二硫键。在某一较佳实施例中,如果包含两条式(i)多肽链,则在两个式(i)多肽链的ch1和ch2之间的铰链区之间存在二硫键,二硫键的数量依据抗体恒定结构域所来源igg形式不同而可变化,在一些实施方案中,铰链区之间存在2个或4个二硫键。
36.较佳地,所述式(ii)的cl来自κ或λ;其序列包含seq id no:9的氨基酸序列或由如seq id no:19所示的氨基酸序列组成。
37.较佳地,所述的式(i)中的vh-ch1-fc:
38.(i)包含与seq id no:19的氨基酸序列具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列或由其组成;或者
39.(ii)包含seq id no:19的氨基酸序列或由如seq id no:19所示的氨基酸序列组成。
40.较佳地,所述的式(ii)中的vl-cl:
41.(i)包含与seq id no:7的氨基酸序列具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列或由其组成;或者
42.(ii)包含seq id no:7的氨基酸序列或由如seq id no:7所示的氨基酸序列组成。
43.较佳地,所述的式(i)的多肽链包含seq id no:1所示的序列或由如seq id no:1所示的氨基酸序列组成,或包含与其具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列或由其组成。
44.较佳地,所述的式(ii)的多肽链包含seq id no:7所示的序列或由如seq id no:7所示的氨基酸序列组成,或包含与其具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列或由其组成。
45.本发明中,所述双特异性抗体的等电点通常可以为8.1,其分子量通常可以为174kda。
46.本发明中,所述双特异性抗体是在293细胞或cho细胞中重组表达的抗lag-3/pd-l1双特异性抗体。
47.本发明中,所述的抗体分子中式(i)的单结构域抗原结合蛋白(vhh)是能够以较高亲和力特异性结合靶抗原表位的单个重链可变结构域,例如,衍生自骆驼科重链抗体的重链可变结构域、骆驼化的人vh结构域和/或人源化的骆驼科抗体重链可变结构域。现有技术中已经对从骆驼科物种(例如骆驼、羊驼、单峰驼、驼羊和原驼)获得的抗体蛋白的大小、结构和针对人类受试者的抗原性进行了表征。在自然界中来自骆驼科哺乳动物家族的某些igg抗体缺少轻链,并且因此在结构上区别于来自其他动物的具有两条重链和两条轻链的常见四链抗体结构。参见pct/ep 93/02214(1994年3月3日公布的wo94/04678)。
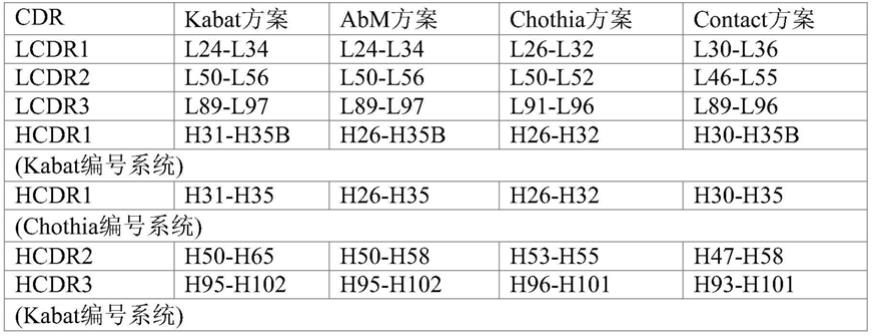
48.本发明中,“互补决定区”或“cdr区”或“cdr”是抗体可变结构域中在序列上高变并且形成在结构上确定的环(“超变环”)和/或含有抗原接触残基(“抗原接触点”)的区域。cdr主要负责与抗原表位结合。重链和轻链的cdr通常被称作cdr1、cdr2和cdr3,从n-端开始顺序编号。位于抗体重链可变结构域内的cdr被称作hcdr1、hcdr2和hcdr3,而位于抗体轻链可变结构域内的cdr被称作lcdr1、lcdr2和lcdr3。在一个给定的轻链可变区或重链可变区氨基酸序列中,各cdr的精确氨基酸序列边界可以使用许多公知的抗体cdr指派系统的任一种
或其组合确定,所述指派系统包括例如:基于抗体的三维结构和cdr环的拓扑学的chothia(chothia等人.(1989)nature 342:877-883,al-lazikani等人,“standard conformations for the canonical structures of immunoglobulins”,journal of molecular biology,273,927-948(1997)),基于抗体序列可变性的kabat(kabat等人,sequences of proteins of immunological interest,第4版,u.s.department of health and human services,national institutes of health(1987)),abm(university of bath),contact(university college london),国际immunogenetics database(imgt)(在万维网上imgt.cines.fr/上),以及基于利用大量晶体结构的近邻传播聚类(affinity propagation clustering)的north cdr定义。
49.例如,根据不同的cdr确定方案,每一个cdr的残基如下所述。
[0050][0051]
cdr也可以基于与参考cdr序列(例如本发明示例性cdr之任一)具有相同的kabat编号位置而确定。
[0052]
除非另有说明,否则在本发明中,术语“cdr”或“cdr序列”涵盖以上述任一种方式确定的cdr序列。
[0053]
除非另有说明,否则在本发明中,当提及抗体可变区中的残基位置(包括重链可变区残基和轻链可变区残基)时,是指根据kabat编号系统(kabat等人,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.(1991))的编号位置。
[0054]
在一个实施方案中,本发明抗体的cdr通过kabat规则确定边界,通过imgt确定规则,或通过abm确定规则,或通过其任何组合确定规则。
[0055]
在一个实施方案中,本发明抗体分子式(i)中的vh的hcdr1是通过结合kabat、abm、chothia及经验性等综合因素确定边界,在kabat编号系统中位置为h27-h35b,vh的hcdr2是通过kabat规则确定,vh的hcdr3是通过imgt规则确定,式(ii)中的vl的lcdr是通过kabat规则确定。在本发明的一个实施方案中,本发明抗体分子式(i)中的vhh的hcdr1是通过abm规则确定,hcdr2和hcdr3是通过kabat规则确定。
[0056]
具有不同特异性(即,针对不同抗原的不同结合位点)的抗体具有不同的cdr。然而,尽管cdr在抗体与抗体之间是不同的,但是cdr内只有有限数量的氨基酸位置直接参与抗原结合。使用kabat,chothia,abm和contact方法中的至少两种,可以确定最小重叠区域,从而提供用于抗原结合的“最小结合单位”。最小结合单位可以是cdr的一个子部分。正如本领域技术人员所了解的,通过抗体的结构和蛋白折叠,可以确定cdr序列其余部分的残基。
因此,本发明也考虑本文所给出的任何cdr的变体。例如,在一个cdr的变体中,最小结合单位的氨基酸残基可以保持不变,而根据kabat或chothia定义的其余cdr残基可以被保守氨基酸残基替代(保守性置换)。所述的保守性置换可为本领域常规,或者如pct申请号pct/cn2020/073964中所提及的那些。
[0057]
本发明中,所述纯化方法中的亲和层析通常还可以包括预平衡、上样、平衡、再平衡和/或洗脱的步骤。
[0058]
较佳地,用于所述预平衡的平衡缓冲液包括20
±
10mm tris-hcl和150
±
10mm nacl,其ph优选为6-8如7.2,其体积优选为5
±
1cv(柱体积)。
[0059]
较佳地,所述上样的载量为40-48g/l,例如为47g/l。
[0060]
较佳地,所述上样的保留时间为6
±
2min。
[0061]
较佳地,用于所述平衡、再平衡的平衡缓冲液包括20
±
10mm tris-hcl,其ph优选为6-8如7.2,其体积优选为3
±
1cv。
[0062]
较佳地,用于所述冲洗的冲洗缓冲液的体积为3
±
1cv。
[0063]
较佳地,用于所述洗脱的洗脱缓冲液包括100mm hac-naac,其ph优选为3.5
±
0.1,其体积优选为7
±
1cv。
[0064]
本发明中,所述亲和层析通常在所述洗脱后还可以进一步包括再生、又平衡和/或清洗的步骤。
[0065]
较佳地,所述再生的再生缓冲液为3%冰醋酸,其体积优选为3
±
1cv。
[0066]
较佳地,所述又平衡的平衡缓冲液包括20
±
10mm tris-hcl和150mm nacl,其ph优选为6-8如7.2,其体积优选为2
±
1cv。
[0067]
较佳地,所述清洗的清洗缓冲液包括200-500mm naoh。
[0068]
较佳地,所述清洗的时间为15
±
2min。
[0069]
在某一较佳实施例中,所述纯化方法包括以下步骤:
[0070]
采用ge公司mabselect sure lx填料装填merck millipore公司的llaboratory column vl 11
×
250层析柱,柱高7.5cm,柱体积8ml;层析柱经过平衡缓冲液(20mm tris-hcl,150mm nacl,ph 7.2)平衡5柱体积(cv)后,采用akta pure m纯化系统(紫外检测器光程为2mm)上样,上样载量40g/l填料,上样时样品保留时间为6min,即1.33ml/min;上样完毕后用亲和再平衡液(20mm tris-hcl,ph 7.2)平衡3cv,再用亲和冲洗液冲洗3cv(冲洗液14-18见表4),亲和再平衡液冲洗3cv;然后开始洗脱,洗脱液为100mm hac-naac ph 3.5
±
0.1,收集紫外280nm处主峰。
[0071]
在某一较佳实施例中,所述纯化方法包括以下步骤:
[0072]
采用ge公司mabselect sure预装柱(hitrap),柱高5cm,柱体积4.7ml;层析柱经过平衡缓冲液(20mm tris-hcl,150mm nacl,ph 7.2)平衡5柱体积(cv)后,采用akta pure m纯化系统(紫外检测器光程为2mm)上样,上样载量48g/l填料,上样时样品保留时间为6min,即0.78ml/min;上样完毕后用亲和再平衡液(20mm tris-hcl,ph 7.2)平衡3cv,再用亲和冲洗液冲洗3cv,亲和再平衡液冲洗3cv;然后开始洗脱,洗脱液为100mm hac-naac,ph 3.5
±
0.1,收集紫外280nm处主峰。
[0073]
在某一较佳实施例中,所述的纯化方法的步骤如下表所示。
[0074][0075]
为了解决上述技术问题,本发明还提供了一种双特异性抗体的制备方法,所述方法包括培养生产上述双特异性抗体的宿主细胞,并且从所述宿主细胞回收并且纯化所述双特异性抗体,所述纯化为利用上述的纯化方法进行。
[0076]
为了解决上述技术问题,本发明还提供了上述的冲洗缓冲液在纯化上述的双特异性抗体中的应用。
[0077]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0078]
本发明所用试剂和原料均市售可得。
[0079]
本发明的积极进步效果在于:
[0080]
使用本发明所述的纯化方法纯化所述的双特异性抗体时,可以将hcp控制在工艺可接受范围内,收集液残留hcp的含量低于7000ppm。
附图说明
[0081]
图1显示了lag-3/pd-l1双特异性抗体的结构图。
具体实施方式
[0082]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0083]
实施例1lag-3/pd-l1双特异性抗体的构建
[0084]
根据pct申请号pct/cn2020/073964所述方法,构建了如图1所示结构的lag-3/pd-l1双特异性抗体,其中抗原a为lag-3,抗原b为pd-l1。抗体在cho细胞中重组表达。
[0085]
双特异性抗体的具体序列如下表所示:
[0086]
本发明双特异性抗体蛋白序列编号
[0087][0088][0089]
本发明双特异性抗体蛋白序列
[0090][0091]
[0092]
实施例2
[0093]
(1)亲和层析上样样品制备
[0094]
如实施例1所述的表达lag-3/pd-l1双特异性抗体的cho细胞培养液采用merck milipore公司millistak d0hc和x0hc深层吸附膜包过滤。澄清收获液测得样品蛋白含量为3.9g/l。
[0095]
(2)protein-a亲和层析
[0096]
采用ge公司mabselect sure预装柱(hitrap),柱高5cm,柱体积4.8ml。层析柱经过平衡缓冲液(20mm tris-hcl,150mm nacl,ph 7.2)平衡5柱体积(cv)后,采用akta pure m纯化系统(紫外检测器光程为2mm)上样上述样品蛋白,上样载量47g/l填料,上样时样品保留时间为6min,即流速为0.83ml/min。上样完毕后用亲和再平衡液(20mm tris-hcl,ph 7.2)平衡3cv,再分别用不同亲和冲洗液冲洗3cv(冲洗液1-3见表1),亲和再平衡液冲洗3cv。然后开始洗脱,洗脱液为100mm hac-naac,ph 3.5
±
0.1,收集紫外280nm处主峰(紫外吸收值上升至100mau/mm时开始收集,紫外吸收值下降至100mau/mm时停止收集),命名为亲和收集液。洗脱结束后用3%hac(冰醋酸)缓冲液再生3cv,平衡缓冲液(20mm tris-hcl,150mm nacl,ph 7.2)平衡2cv后,用0.5m naoh溶液清洗15min,再用2%苯甲醇保存,后续实施例中再生、清洗和保存方法均与本实施例相同,后文不再赘述。
[0097]
(3)检测和分析
[0098]
检测亲和收集液的蛋白含量和hcp含量,蛋白含量检测采nanodrop2000检测,hcp含量采用商业化渠道购买的elisa试剂盒测定,检测结果见表1。
[0099]
由表1中可以看出,使用表1中常规的亲和冲洗缓冲液wash buffer纯化蛋白时,收集液残留hcp的含量较高;并且hcp残留检测结果表明不同冲洗缓冲液对hcp的去除效果有很大的影响。
[0100]
表1冲洗液1-3名称及收集液hcp残留
[0101][0102]
实施例3
[0103]
(1)亲和层析上样样品制备
[0104]
制备过程同实施例2,澄清收获液测得样品蛋白含量为4.3g/l。
[0105]
(2)protein-a亲和层析
[0106]
采用ge公司mabselect sure lx填料装填merck millipore公司的
llaboratory column vl 11
×
250层析柱,柱高7.5cm,柱体积8ml。层析柱经过平衡缓冲液(20mm tris-hcl,150mm nacl,ph 7.2)平衡5柱体积(cv)后,采用akta pure m纯化系统(紫外检测器光程为2mm)上样,上样载量40g/l填料,上样时样品保留时间为6min,即1.33ml/min。上样完毕后用亲和再平衡液(20mm tris-hcl,150mm nacl,ph 7.2)平衡3cv,再分别用不同亲和冲洗液冲洗3cv(冲洗液4-8见表2),亲和再平衡液冲洗3cv。然后开始洗脱,洗脱液为100mm hac-naac,ph 3.5
±
0.1,收集紫外280nm处主峰(紫外吸收值上升至100mau/mm时开始收集,紫外吸收值下降至100mau/mm时停止收集),命名为亲和收集液。
[0107]
(3)检测和分析
[0108]
检测亲和收集液的蛋白含量及hcp含量,检测结果见表2。
[0109]
由表2中可以看出,使用表2中各种不同组合的亲和冲洗缓冲液wash buffer纯化蛋白时,收集液残留hcp的含量较高;并且hcp残留检测结果表明不同冲洗缓冲液对hcp的去除效果有很大的影响。
[0110]
表2冲洗液4-8名称及收集液hcp残留
[0111][0112]
实施例4
[0113]
(1)亲和层析上样样品制备
[0114]
制备过程同实施例2,澄清收获液测得样品蛋白含量为3.9g/l。
[0115]
(2)protein-a亲和层析
[0116]
采用ge公司mabselect sure lx填料装填merck millipore公司的llaboratory column vl 11
×
250层析柱,柱高7.5cm,柱体积8ml。层析柱经过平衡缓冲液(20mm tris-hcl,150mm nacl,ph 7.2)平衡5柱体积(cv)后,采用akta pure m纯化系统(紫外检测器光程为2mm)上样,上样载量40g/l填料,上样时样品保留时间为6min,即1.33ml/min。上样完毕后用亲和再平衡液(20mm tris-hcl,ph 7.2)平衡3cv,再分别用亲和冲洗液冲洗3cv(冲洗液9-13,见表3),亲和再平衡液冲洗3cv。然后开始洗脱,洗脱液为100mm hac-naac,ph 3.5
±
0.1,收集紫外280nm处主峰(紫外吸收值上升至100mau/mm时开始收集,紫外吸收值下降至100mau/mm时停止收集),命名为亲和收集液。
[0117]
(3)检测和分析
[0118]
检测亲和收集液的蛋白含量和hcp含量,检测结果见表3。
[0119]
由表3中可以看出,使用表3中的亲和冲洗缓冲液tris-hcl或其与尿素的组合纯化
蛋白时,收集液残留hcp的含量较高;当使用tris-hcl与尿素以及丙二醇的组合缓冲液时,hcp残留量降低;当使用tris-hcl与盐酸胍的组合缓冲液时,hcp残留量降低,但尿素、盐酸胍存在破坏氢键而使蛋白变性的风险,影响产品稳定性,因此避免使用。
[0120]
表3冲洗液9-13名称及收集液hcp残留
[0121][0122]
实施例5
[0123]
(1)亲和层析上样样品制备
[0124]
制备过程同实施例2,澄清收获液测得样品蛋白含量为4.52g/l。
[0125]
(2)protein-a亲和层析的步骤同实施例4,其中亲和冲洗液采用表4中的冲洗液14-15。
[0126]
(3)检测和分析
[0127]
检测亲和收集液的hcp含量,检测结果见表4。
[0128]
由表4中可以看出,当冲洗步骤使用包含cacl2的缓冲液的时候,可以将hcp控制在工艺可接受范围内,收集液残留中hcp的残留量可以降低到大概1000-7000ppm。
[0129]
表4冲洗液14-15名称及收集液hcp残留
[0130]
编号冲洗缓冲液收集液残留hcp(ppm)1420mm tris-hcl,1m cacl2,ph 6.8;32801520mm tris-hcl,0.4m cacl2,0.4m mgcl
2 ph6.94098
[0131]
实施例6
[0132]
(1)亲和层析上样样品制备
[0133]
制备过程同实施例2,澄清收获液测得样品蛋白含量为4.09g/l。
[0134]
(2)protein-a亲和层析
[0135]
采用ge公司mabselect sure预装柱(hitrap),柱高5cm,柱体积4.7ml。层析柱经过平衡缓冲液(20mm tris-hcl,150mm nacl,ph 7.2)平衡5柱体积(cv)后,采用akta pure m纯化系统(紫外检测器光程为2mm)上样,上样载量48g/l填料,上样时样品保留时间为6min,即0.78ml/min。上样完毕后用亲和再平衡液(20mm tris-hcl,ph 7.2)平衡3cv,再用亲和冲洗液冲洗3cv,亲和再平衡液冲洗3cv。然后开始洗脱,洗脱液为100mm hac-naac,ph 3.5
±
0.1,收集紫外280nm处主峰(紫外吸收值上升至100mau/mm时开始收集,紫外吸收值下降至
100mau/mm时停止收集),命名为亲和收集液。
[0136]
(3)检测和分析
[0137]
检测亲和收集液的蛋白含量和hcp含量,检测结果见表5。
[0138]
由表5中可以看出,当亲和冲洗液为tris-hcl和cacl2时,tris-hcl的浓度为20mm、cacl2的浓度约为0.5-2m时,可以将hcp控制在工艺可接受范围内,收集液残留hcp的含量低于7000ppm;当亲和冲洗液为tris-hcl、cacl2和mgcl2时,tris-hcl的浓度为20mm,cacl2和mgcl2的浓度为0.4-0.8m时,可以将hcp控制在工艺可接受范围内,收集液残留hcp的含量低于7000ppm。
[0139]
表5
[0140]
冲洗缓冲液hcp20mm tris-hcl,0.5m cacl2.ph7.0661820mm tris-hcl,1m cacl2.ph6.8313220mm tris-hcl,2m cacl2.ph6.4551220mm tris-hcl,0.1m cacl2,0.1m mgcl2,ph7.21658220mm tris-hcl,0.4m cacl2,0.4m mgcl2,ph6.9357720mm tris-hcl,0.6m cacl2,0.6m mgcl2,ph6.7568020mm tris-hcl,0.8m cacl2,0.8m mgcl2,ph6.56161
[0141]
实施例7
[0142]
根据pct申请号pct/cn2020/073964所公开的,实施例1中所述的lag-3/pd-l1双特异性抗体可以:
[0143]
(1)同时和pd-l1及lag-3蛋白结合,且维持了亲本抗体的亲和力常数;
[0144]
(2)能够和表达在细胞表面的pd-l1结合,结合ec50为1.033nm,与亲本抗pd-l1抗体的结合能力相似(ec50为1.199nm);
[0145]
(3)能够和细胞表面的lag-3结合,结合ec50为0.4345nm,与亲本抗lag-3抗体adi-31853的结合能力相似(ec50为0.5039nm);
[0146]
(4)能够诱导chos-pd-l1细胞及293-lag-3细胞的交联,从而能够同时结合来自不同细胞表面的靶抗原;
[0147]
(5)双特异性抗体的tm》63℃,具有较好的热稳定性;
[0148]
(6)可以在体外激活t细胞,其激活效果比抗pd-l1或抗lag-3抗体单独使用更强,和抗pd-l1和抗lag-3抗体联合使用相似。
[0149]
(7)与各自的单抗人源化nb-fc抗体和抗lag-3抗体adi-31853甚至联合(人源化nb-fc抗体 抗lag-3抗体adi-31853)相比,更能促进tcr:pmhc结合,并激活下游信号通路。
[0150]
(8)单独使用时与igg对照(equitech-bio)或抗lag-3或抗pd-l1抗体单独或组合使用相比,能显著抑制肿瘤的生长。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
