1.本发明涉及生物医学分子影像技术领域,具体涉及一种高亲和力结合早期胃癌的近红外探针及其制备方法。
背景技术:
2.在中国所有恶性肿瘤中,胃癌的发病率及其导致的死亡率排名第二;通过内镜粘膜下剥离术或内镜粘膜切除术的方法对早期胃癌患者进行手术治疗后,其5年生存率高达90%以上;因此,如果能够早期检出并精确切除胃癌病变,可进一步延长患者的生存期及提高其生活质量;普通白光内镜是检出早期胃癌的常规方法,在白光内镜下,包括颜色的改变(比如更红或苍白)、血管消失、局部隆起或凹陷等特征通常被用来描述早期胃癌,但是依据这些特征对可疑的病变活检胃癌检出率并不高,多个前瞻性平行临床试验发现白光内镜下早期胃癌的阳性检出率仅为40%-72%;
3.近红外内镜(nir内镜)是近红外成像技术与内窥镜相结合的新产物,可提供普通白光内镜无法获取的肿瘤病变信息,帮助内镜医生更为实时、快速、准确地定位肿瘤,特别有助于发现一些微小癌病变;nir内镜由白光和近红外成像系统组成,使用时可通过一键切换方式转换白光和nir成像模式;该成像方式具有较大视野范围,容许对空腔脏器表面进行大范围筛查;如今,nir内镜联合静脉注射icg已经被成功用于对喉头癌、食管癌和胃癌的近红外成像;但是正常白光内镜下早期胃癌病变显示不清楚,边界仍无法确定,当切换至近红外成像后,含有icg的肿瘤组织显示为蓝色;然而如今nir内镜依旧仅依靠无靶向性的icg判断病变的类型,限制了近红外内镜在消化道肿瘤精准诊断中的应用;
4.因此设计一种针对肿瘤特异性的icg靶向探针,是解决nir内镜肿瘤诊断特异性差的关键。
技术实现要素:
5.针对上述存在的问题,本发明旨在提供一种高亲和力结合早期胃癌的近红外探针及其制备方法,通过多肽-受体的三维结构预测,使用“丙氨酸扫描突变法”预测与受体蛋白关键的氨基酸残基后,通过替换非“热点”氨基酸,可优化多肽与蛋白质的结合能力;得到后最优多肽后,通过与近红外染料cy5.5反应结合,形成可以特异性靶向早期胃癌的荧光探针,本近红外探针具有良好的稳定性、免疫原性低、生产成本低和给药后可迅速成像等良好的特点。
6.为了实现上述目的,本发明所采用的技术方案如下:
7.一种高亲和力结合早期胃癌的近红外探针,所述近红外探针的序列为ynfqppr-gggsk-cy5.5。
8.优选的,所述的红外探针的化学式为:
[0009][0010]
一种高亲和力结合早期胃癌的近红外探针的制备方法,包括步骤
[0011]
s1.首先构建多肽snf及其三维结构,获得多肽snf的结合受体epcam细胞外的三维结构,并对三维模拟snf与epcam结合位点并进行snf改构,筛选获得候选优化短肽;
[0012]
s2.对优化多肽与epcam高表达的胃癌细胞系sgc7901细胞进行荧光染色及亲和力比较;
[0013]
s3.制备探针:将步骤s2筛选出的最优短肽通过gggsk与cy5.5链接合成近红外探针。
[0014]
优选的,步骤s1所述的候选优化短肽的获得过程包括:
[0015]
s101.首先使用软件swiss-pdbviewer4.1构建多肽snf及三维结构;
[0016]
s102.使用pdb蛋白质结构数据库获得多肽snf的结合受体epcam细胞外的三维结构;
[0017]
s103.使用pep-sitefinder通过丙氨酸扫描和计算机3d模拟预测多肽与受体蛋白的关键结合氨基酸残基;
[0018]
s104.对非关键氨基酸进行替换得到新多肽序列,再次通过计算机模拟预测和计算新多肽序列与受体蛋白结合亲和力;
[0019]
s105.通过亲和力得分排序,筛选出5个改构多肽序列qnfwcpy、qnfwcpe、mnfpqpl、ynfqppr、mnfpqpk;其中上述多肽的亲和力预测p值分别为0.01342、0.01289、0.005481、0.005809、0.005809。
[0020]
优选的,步骤s2所述的对优化多肽与epcam高表达的胃癌细胞系sgc7901细胞进行荧光染色及亲和力比较的过程包括:
[0021]
s201.使用荧光染料fitc分别标记步骤s1筛选得到的候选多肽及对照多肽snf,分别选择胃癌细胞系sgc7901作为研究对象,常规培养细胞,待细胞处于生长对数期进行实验;
[0022]
s202.培养后弃去培养基,用pbs清洗细胞后,使用2%bsa与细胞孵育;
[0023]
s203.将fitc标记的qnfwcpy、qnfwcpe、mnfpqpl、ynfqppr、mnfpqpk探针以1umol/l的浓度加入,在常温下孵育10分钟;
[0024]
s204.用pbs清洗三次后,用冰的4%多聚甲醛固定细胞10分钟,激光共聚焦显微镜观察结合效果,并通过荧光值定量分析以上探针对相关细胞系结合的强弱;
[0025]
s205.然后进行结合亲和力鉴定:首先稀释以上探针,使最终浓度为0、10、25、50、100和200nmol/l,然后将计数105的细胞与上述溶液在4℃孵育1h,在使用pbs清洗后,通过流式细胞仪检测细胞荧光染色情况,计算解离指数kd;用非线性方程i=(i0 imax ka[x])/(i0 ka[x])的最小二乘拟合计算平衡离解常数kd=1/ka;
[0026]
其中:i0和imax是初始细胞荧光强度和最大荧光强度,[x]代表结合肽浓度,得到与sgc7901细胞亲和力最强的探针序列ynf。
[0027]
优选的,步骤s3所述的红外探针的制备过程包括:
[0028]
s301.取100mg mbha氨基树脂放入反应瓶,在反应瓶中加入二甲基甲酰胺,分别取0.1mmol的0.1mmol的boc-l-tyrosine(boc-l-酪氨酸)、fmoc-l-asparagine(fmoc-l-天冬氨酸)、fmoc-l-phenyalaniene(fmoc-l-phenylalanine)、fmoc-l-glutamine(fmoc-l-谷氨酰胺)、fmoc-l-proline(fmoc-l-脯氨酸)、fmoc-l-proline(fmoc-l-脯氨酸)、fmoc-l-arginine(fmoc-l精氨酸)、fmoc-l-glycine(fmoc-l甘氨酸)、fmoc-l-glycine(fmoc-l甘氨酸)、fmoc-l-glycine(fmoc-l甘氨酸)、fmoc-l-serine(fmoc-l丝氨酸)、fmoc-d-lys(ivdde)-oh(fmoc-l-ivdde-赖氨酸)加入独立反应小瓶中,另外在反应小瓶中分别加入0.1mmol的1-羟基苯并三唑和o-苯并三氮唑-四甲基脲六氟磷酸盐,启动多肽合成仪合成化合物1(ynfqppr-gggsk-resin);
[0029]
s302.然后脱ivdde保护:向化合物1中加入含5%水合肼的dmf溶液,在室温下剧烈旋转摇动3次,每次15分钟,以除去化合物1中的第二个赖氨酸的长链上ivdde基团,得到化合物2(ynfqppr-gggsk-resin);
[0030]
s303.然后标记cy5.5:把化合物2溶于2ml的无水dmf中,加入5mg的cy5.5-nhs,剧烈摇动10分钟后,向溶液中加入150ul的n,n-二异丙基乙胺,然后在室温避光条件下剧烈反应24h,反应后分别用dmf及二氯甲烷(dcm)冲洗3次,真空干燥5分钟,得到化合物3(ynfqppr-gggsk-cy5.5-resin);
[0031]
s304.脱resin保护:用三氟乙酸、1,2-乙二硫醇、去离子水和三异丙基硅烷按92.5/2.5/2.5/2.5比例配置成混合溶液,取以上混合溶液3ml加入化合物5中,常温剧烈反应4h;
[0032]
s305.过滤收集反应溶液,用氮气吹干溶液,可见有铜绿色结晶沉淀;用-20℃冰冻乙醚重悬后以3000转离心5分钟,用氮气吹干后,即可得到ynfqppr-gggsk-cy5.5(ynf-cy5.5);
[0033]
s306.提纯及鉴定:用c18 column凝胶柱通过高压液相色谱法提纯上述产物,在hplc中出现铜绿色峰时,收集该峰,进行质谱检测。
[0034]
优选的,所述制备过程还包括:
[0035]
s4.体外验证探针与胃癌结合特异性:将步骤s3制备的探针与sgc7901及对照细胞ges共培养,进行免疫荧光实验及流式细胞术;
[0036]
s5.体外验证探针与胃癌结合特异性:体内验证探针结合特异性:将步骤s3制备的
探针通过尾静脉注入sgc7901荷瘤模型小鼠体内,在不同的时间点对探针进行成像。
[0037]
优选的,步骤s4所述的体外验证探针与胃癌结合特异性的具体过程包括:
[0038]
s401.选取sgc7901、及ges作为研究对象,常规培养细胞,待细胞处于生长对数期时进行实验;
[0039]
s402.弃去培养基,用pbs清洗细胞后,使用2%bsa与细胞孵育1h;
[0040]
s403.将探针ynf-cy5.5以1umol/l浓度加入细胞,在常温下孵育10分钟;
[0041]
s404.用pbs清洗3次后,再用4%的pfa固定10分钟,dapi染核后,分别使用dapi、cy5.5滤光片,在共聚焦荧光显微镜下描述探针与不同细胞系结合的荧光强度。
[0042]
优选的,步骤s404所述的在共聚焦荧光显微镜下描述探针与不同细胞系结合的荧光强度的过程为竞争实验过程,所述竞争实验过程的具体操作方法为:
[0043]
(1)在添加探针前,向培养液中分别加入足量的ynfqpprgggsk,37℃孵育30分钟后弃去孵育液;
[0044]
(2)pbs清洗3次后分别加入浓度为5umol/l的ynfqpprgggsk-cy5.5,孵育10分钟后,记录并观察竞争效果。
[0045]
优选的,步骤s5所述的体内验证探针结合特异性的过程包括:
[0046]
s501.取一组胃癌荷瘤裸鼠,尾静脉分别注射浓度为100umol/l的ynfqpprgggsk-cy5.5和block组,在注射探针后,分别在10mins、2h、6h、18h和24h通过ivis系统采集裸鼠体内探针荧光信号,通过圈选肿瘤部位的roi,计算肿瘤部位荧光信号值。
[0047]
本发明的有益效果是:本发明公开了一种高亲和力结合早期胃癌的近红外探针及其制备方法,与现有技术相比,本发明的改进之处在于:
[0048]
(1)本发明设计了一种高亲和力结合早期胃癌的近红外探针,该近红外探针的应用可拓展到整个消化道疾病,包括消化道肿瘤的研究和治疗中;近红外探针及近红外内镜技术为疾病诊疗打开了新的一道大门,近红外具有较好的组织穿透力,在当今微创医学的发展趋势下,本研究的成果甚至对其他各种腹部,盆腔疾病诊断和治疗产生影响,如利用近红外腹腔镜诊断治疗卵巢癌、宫颈癌、肝癌等;
[0049]
(2)在制备近红外探针的过程中,采用基于短肽snfympl,通过化学预测模型探索优化与epcam结合能力更强的短肽,提高了探针对胃癌的亲和力,有更高的临床运用价值;同时利用红外成像原理使得近红外内镜在观察病变时,来自组织的非特异干扰信号少,因而病变更容易发现;此外,该内镜上白光和近红外模式可以简便切换红外成像,检查时间短,痛苦少。
附图说明
[0050]
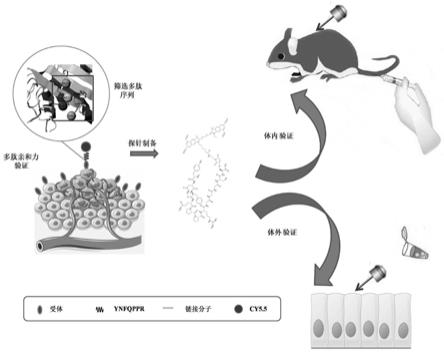
图1为本发明高亲和力结合早期胃癌的近红外探针的制备流程图。
[0051]
图2为本发明筛选优化多肽免疫荧光实验及亲和力检测图。
[0052]
图3为本发明ynfqpprgggsk-cy5.5合成的高压液相检测图。
[0053]
图4为本发明ynfqpprgggsk-cy5.5合成质谱图。
[0054]
图5为本发明高亲和力结合早期胃癌的近红外探针的化学结构图。
[0055]
图6为本发明胃癌细胞特异性结合免疫荧光验证图。
[0056]
图7为本发明胃癌细胞特异性结合流式验证图。
[0057]
图8为本发明体内胃癌特异性结合验证图。
[0058]
其中:在图2中,图a代表snfympl细胞免疫荧光结合图,图b代表mnfpqpl细胞免疫荧光结合图,图c代表ynfqppr细胞免疫荧光结合图,图d代表qnfwcpy细胞免疫荧光结合图,图e代表qnfwcpe细胞免疫荧光结合,图f代表mnfpqpk细胞免疫荧光结合图,图h显示荧光定量分析显示:ynfqppr的荧光强度明显强于其他多肽,**,p《0.01;***,p《0.001;图i代表三个荧光强度较强的多肽snfympl、mnfpqpr和ynfqppr,对它们进行了亲和力验证实验,通过计算,结果显示它们对应的kd值分别为153nm、427nm及68nm;
[0059]
在图6中:图a代表探针ynfqppr-cy5.5与胃癌肿瘤细胞sgc7901结合免疫荧光图,图b代表ynfqppr-cy5.5与胃永生上皮细胞ges结合免疫荧光图,图c代表ynfqppr-cy5.5 ynfqpprgggsk后与胃癌肿瘤细胞sgc7901结合免疫荧光图,图d代表ynfqppr-cy5.5 ynfqpprgggsk后与胃永生上皮细胞ges结合免疫荧光图;
[0060]
在图7中:图a代表ynfqppr-cy5.5与sgc7901结合流式细胞检测图,图b代表ynfqppr-cy5.5 ynfqpprgggsk与sgc7901结合流式细胞检测图。
[0061]
具体实施方式
[0062]
为了使本领域的普通技术人员能更好的理解本发明的技术方案,下面结合附图和实施例对本发明的技术方案做进一步的描述。
[0063]
参照附图1-8所示的一种高亲和力结合早期胃癌的近红外探针的制备方法,包括如图1所示的步骤,包括步骤:
[0064]
s1.构建多肽snf及其三维结构,获得多肽snf的结合受体epcam细胞外的三维结构,并对三维模拟snf与epcam结合位点并进行snf改构,筛选获得候选优化短肽,其具体过程包括:
[0065]
s101.首先使用软件swiss-pdbviewer4.1(expasy)构建多肽snf及三维结构;
[0066]
s102.使用pdb蛋白质结构数据库获得多肽snf的结合受体epcam细胞外的三维结构;
[0067]
s103.申请pep-sitefinder的使用权限,通过丙氨酸扫描和计算机3d模拟预测多肽与受体蛋白的关键结合氨基酸残基;
[0068]
s104.对非关键氨基酸进行替换得到新多肽序列,再次通过计算机模拟预测和计算新多肽序列与受体蛋白结合亲和力,得到1000个多肽序列;
[0069]
s105.通过亲和力得分排序,筛选出5个改构多肽序列qnfwcpy、qnfwcpe、mnfpqpl、ynfqppr、mnfpqpk;其中上述多肽的亲和力预测p值分别为0.01342、0.01289、0.005481、0.005809、0.005809;
[0070]
s2.对优化多肽与epcam高表达的胃癌细胞系sgc7901细胞进行荧光染色及亲和力比较,其具体过程包括:
[0071]
s201.使用荧光染料fitc分别标记步骤s1筛选得到的5个候选多肽及对照多肽snf,分别选择胃癌细胞系sgc7901作为研究对象,常规培养细胞,待细胞处于生长对数期进行实验;
[0072]
s202.培养后弃去培养基,用pbs清洗细胞后,使用2%bsa与细胞孵育,以防止非特异性结合;
[0073]
s203.将fitc标记的qnfwcpy、qnfwcpe、mnfpqpl、ynfqppr、mnfpqpk探针以1umol/l
的浓度加入,在常温下孵育10分钟;
[0074]
s204.用pbs清洗三次后,用冰的4%多聚甲醛(pfa)固定细胞10分钟,激光共聚焦显微镜观察结合效果,并通过荧光值定量分析以上探针对相关细胞系结合的强弱,荧光结合效果可见图2;
[0075]
s205.然后进行结合亲和力鉴定:首先稀释以上探针,使最终浓度为0、10、25、50、100和200nmol/l,然后将计数大约105的细胞与上述溶液在4℃孵育1h,在使用pbs清洗后,通过流式细胞仪检测细胞荧光染色情况,计算解离指数kd;用非线性方程i=(i0 imax ka[x])/(i0 ka[x])的最小二乘拟合计算平衡离解常数kd=1/ka;
[0076]
其中:i0和imax是初始细胞荧光强度和最大荧光强度,[x]代表结合肽浓度,通过上述实验获得与sgc7901细胞亲和力最强的探针序列ynf,得到亲和力检测图如图2所示;
[0077]
s3.制备探针:将步骤s2筛选出的最优短肽通过gggsk与cy5.5链接合成近红外探针,其具体过程包括:
[0078]
s301.取100mg mbha氨基树脂(resin)放入反应瓶,在反应瓶中加入二甲基甲酰胺(dmf)以湿润膨胀树脂,分别取0.1mmol的boc-l-tyrosine(boc-l-酪氨酸)、fmoc-l-asparagine(fmoc-l-天冬氨酸)、fmoc-l-phenyalaniene(fmoc-l-phenylalanine)、fmoc-l-glutamine(fmoc-l-谷氨酰胺)、fmoc-l-proline(fmoc-l-脯氨酸)、fmoc-l-proline(fmoc-l-脯氨酸)、fmoc-l-arginine(fmoc-l精氨酸)、fmoc-l-glycine(fmoc-l甘氨酸)、fmoc-l-glycine(fmoc-l甘氨酸)、fmoc-l-glycine(fmoc-l甘氨酸)、fmoc-l-serine(fmoc-l丝氨酸)、fmoc-d-lys(ivdde)-oh(fmoc-l-ivdde-赖氨酸)加入独立反应小瓶中,另外在反应小瓶中分别加入0.1mmol的1-羟基苯并三唑(hobt)和o-苯并三氮唑-四甲基脲六氟磷酸盐(hbtu),启动多肽合成仪合成化合物1(ynfqppr-gggsk-resin);
[0079]
s302.然后脱ivdde保护:向化合物1中加入含5%水合肼的dmf溶液,在室温下剧烈旋转摇动3次,每次15分钟,以除去化合物1中的第二个赖氨酸的长链上ivdde基团,得到化合物2(ynfqppr-gggsk-resin);
[0080]
s303.然后标记cy5.5:把化合物2溶于2ml的无水dmf中,加入5mg的cy5.5-nhs,剧烈摇动10分钟后,向溶液中加入150ul的n,n-二异丙基乙胺,然后在室温避光条件下剧烈反应24h,反应后分别用dmf及dcm冲洗3次,真空干燥5分钟,得到化合物3(ynfqppr-gggsk-cy5.5-resin);
[0081]
s304.脱resin保护:用三氟乙酸、1,2-乙二硫醇、去离子水和三异丙基硅烷按92.5/2.5/2.5/2.5比例配置成混合溶液,取以上混合溶液3ml加入化合物4中,常温剧烈反应4h;
[0082]
s305.过滤收集反应溶液,用氮气吹干溶液,可见有铜绿色结晶沉淀;用-20℃冰冻乙醚重悬后以3000转离心5分钟,用氮气吹干后,即可得到ynfqppr-gggsk-cy5.5;
[0083]
s306.提纯及鉴定:用c18 column凝胶柱(waters inc)通过高压液相色谱法(hplc)提纯上述产物,在hplc中出现铜绿色峰时,收集该峰,hplc图谱可见图3,进行质谱检测,可见图4,得到近红外探针的序列如图5所示。
[0084]
s401.选取sgc7901、及ges(正常胃上皮永生化细胞)作为研究对象,常规培养细胞,待细胞处于生长对数期时进行实验;
[0085]
s402.弃去培养基,用pbs清洗细胞后,,使用2%bsa与细胞孵育1h,以防止非特异
性结合;
[0086]
s403.将探针ynf-cy5.5以1umol/l浓度加入细胞,在常温下孵育10分钟;
[0087]
s404.用pbs清洗3次后,再用4%的pfa固定10分钟,dapi染核后,分别使用dapi、cy5.5滤光片,在共聚焦荧光显微镜下描述探针与不同细胞系结合的荧光强度,其中,所使用方法为竞争实验:在添加探针前,向培养液中分别加入足量的ynfqpprgggsk,37℃孵育30分钟后弃去孵育液;pbs清洗3次后分别加入浓度为5umol/l的ynfqpprgggsk-cy5.5,孵育10分钟后,记录并观察竞争效果,胃癌细胞特异性结合免疫荧光验证图如图6所示。
[0088]
s5.体外验证探针与胃癌结合特异性:体内验证探针结合特异性:将步骤s3制备的探针通过尾静脉注入sgc7901荷瘤模型小鼠体内,在不同的时间点对探针进行成像,其具体过程包括:
[0089]
s501.取一组胃癌荷瘤裸鼠,尾静脉分别注射浓度为100umol/l的ynfqpprgggsk-cy5.5和block组,在注射探针后,分别在10mins、2h、6h、18h和24h通过ivis系统采集裸鼠体内探针荧光信号,通过圈选肿瘤部位的roi,计算肿瘤部位荧光信号值,得出以上探针中最佳成像探针及最佳成像时间如图7和图8所示;
[0090]
一种高亲和力结合早期胃癌的近红外探针的应用,所述的近红外探针能够应用于早期胃癌的检测。
[0091]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
