抗csf1r抗体、il10融合蛋白及其用途
1.相关申请的交叉引用
2.本技术依据35 u.s.c.
§
119(e)要求2019年5月24日提交的美国临时专利申请序列号62/852,418的权益,其整体在此并入本文以作为参考。
技术领域
3.本公开涉及结合csf1r受体的抗体和融合蛋白,以及使用此类抗体和融合蛋白的方法。
4.序列表的引用
5.序列表的正式副本与说明书同时以ascii格式文档经由efs
‑
web提交,其文件名为“09793
‑
003wo1_seqlist_st25.txt”,创建日期为2020年5月21日,且大小为136,762字节。经由efs
‑
web提交的序列表是说明书的部分,且于此通过引用全部并入。
背景技术:
6.集落刺激因子1受体(colony stimulating factor 1 receptor)或“csf1r”(在本领域中也称作cd115、c
‑
fms、csf
‑
1r、csfr、fim2、fms、hdls、m
‑
csfr、m
‑
csf
‑
r或banddos)为细胞表面蛋白,其在人体内由csf1r基因(也称作“c
‑
fms”)编码。csf1r为972个氨基酸的单跨(single pass)i型膜蛋白,其用作集落刺激因子1(“csf1”)的受体,集落刺激因子1为控制巨噬细胞的产生、分化和功能的细胞因子。据信,csf1r介导大多数(即使并非全部)csf1细胞因子的生物学作用。csf1r为酪氨酸
‑
蛋白激酶,且csf1的结合将其活化以经历寡聚化和转磷酸作用。
7.已发现csf1r在许多癌症中及肿瘤相关巨噬细胞(tams)上过表达。发现csf1与csf1r的结合调节tams的存活,其可促进免疫抑制性肿瘤微环境。因此,已研究csf1r抑制剂作为癌症或炎性疾病的可能治疗。有许多csf1r的小分子和抗体抑制剂进入临床试验,包括:培西达替尼(pexidartinib)、plx7486、arry
‑
382、jnj
‑
40346527、blz945、依米妥珠单抗(emactuzumab)、卡比拉单抗(cabiralizumab)、amg820、imc
‑
cs4。
8.白介素10或“il10”(也称作人细胞因子合成抑制因子、csif、il
‑
10、il10a、gvhds或tgif)为抗炎性细胞因子。人il10蛋白为两个178氨基酸亚单元的同型二聚体。il10通过由两个il10受体
‑
1与两个il10受体
‑
2蛋白组成的受体复合物发出信号。因此,功能性受体由四个il10受体分子组成。il10结合诱导经由jak1和tyk2对il10受体1 il10受体2的胞质尾的磷酸化诱导stat3信号传导。il10主要由单核细胞产生,且在较小程度上由淋巴细胞产生,即ii型t辅助细胞(t
h
2)、肥大细胞、cd4
cd25
foxp3
调节性t细胞,及活化t细胞和b细胞的特定亚群中。il10可在pd
‑
1触发时由单核细胞产生。
9.已知il10在免疫调节及炎症中具有多重作用。已知il10下调th1细胞因子、ii类mhc抗原和巨噬细胞上共刺激分子的表达。还已知il10增强b细胞存活、增殖和抗体产生。il10可阻断nf
‑
κb活性,并参与jak
‑
stat信号传导途径的调节。il10能抑制细胞(如巨噬细胞和th1 t细胞)产生的促炎性细胞因子(如ifn
‑
γ、il
‑
2、il
‑
3、tnfα和gm
‑
csf)的合成。其
也表现出抑制抗原呈递细胞的抗原呈递能力的强大能力;然而,其也对特定t细胞(th2)和肥大细胞为刺激性的,并刺激b细胞成熟和抗体产生。
10.il10被公认为肿瘤转移的潜在抑制剂,及可用于免疫肿瘤治疗的免疫刺激剂。在转基因小鼠中,il10的表达或以il10给药观察到控制原发性肿瘤生长并且减少肿瘤转移负荷。重组鼠il10蛋白的聚乙二醇化形式显示在小鼠模型中诱导ifnγ和cd8 t细胞依赖性抗肿瘤免疫。聚乙二醇化重组人il10显示增强cd8 t细胞的细胞毒性分子颗粒酶b和穿孔素分泌,并增强t细胞受体依赖性ifnγ的分泌。在临床试验中,已发现聚乙二醇化重组人il10(peg
‑
rhuil
‑
10,am0010)显示出实质的抗肿瘤功效,从而引发免疫刺激性细胞因子ifnγ、il
‑
18、il
‑
7、gm
‑
csf和il
‑
4的剂量可滴定的诱导。治疗的患者还表现出表达激活标志物(如pd1、淋巴细胞活化基因3(lag3) 和增加的fas配体(fasl))的外周血cd8 t细胞的增加,及血清tgfβ的减少。这些发现表明,il10治疗在人类中产生主要免疫刺激性的作用。
技术实现要素:
11.本公开提供一种抗csf1r抗体,其以高亲和力特异性结合人csf1r。该抗体能够降低、抑制和/或完全阻断csf1r介导的免疫调节作用,包括csf1的结合。本公开还提供抗csf1r抗体与一个或两个il10多肽的融合体。本公开的这些抗csf1r/il10融合蛋白能提供阻断由csf1r介导的免疫调节作用和产生由il10介导的免疫刺激作用的合并治疗效果。
12.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其包含(i)第一轻链互补决定区(cdr
‑
l1)、第二轻链互补决定区(cdr
‑
l2)和第三轻链互补决定区(cdr
‑
l3),和/或(ii)第一重链互补决定区(cdr
‑
h1)、第二重链互补决定区(cdr
‑
h2)和第三重链互补决定区(cdr
‑
h3),其中:
13.(a)cdr
‑
h1包含选自seq id no:3、4、28或29的氨基酸序列;
14.(b)cdr
‑
h2包含选自seq id no:6、7、31或32的氨基酸序列;
15.(c)cdr
‑
h3包含选自seq id no:8、9、33或34的氨基酸序列;
16.(d)cdr
‑
l1包含选自seq id no:13、14、37或38的氨基酸序列;
17.(e)cdr
‑
l2包含选自kas、vas或seq id no:15或39的氨基酸序列;
18.(f)cdr
‑
l3包含选自seq id no:16、17、40或41的氨基酸序列。
19.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其中:
20.(a)cdr
‑
h1包含seq id no:3或4的氨基酸序列,cdr
‑
h2包含seq id no:6或7的氨基酸序列,且cdr
‑
h3包含seq id no:8或9的氨基酸序列;或
21.(b)cdr
‑
h1包含seq id no:28或29的氨基酸序列,cdr
‑
h2包含seq id no:31或32的氨基酸序列,且cdr
‑
h3包含seq id no:33或34的氨基酸序列。
22.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其中:
23.(a)cdr
‑
l1包含seq id no:13或14的氨基酸序列,cdr
‑
l2包含kas或seq id no:15的氨基酸序列,且cdr
‑
l3包含seq id no:16或17的氨基酸序列;或
24.(b)cdr
‑
l1包含seq id no:37或38的氨基酸序列,cdr
‑
l2包含vas或seq id no:39的氨基酸序列,且cdr
‑
l3包含seq id no:40或41的氨基酸序列。
25.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其中:
26.(a)cdr
‑
h1包含seq id no:3的氨基酸序列,cdr
‑
h2包含seq id no:6的氨基酸序
列,cdr
‑
h3包含seq id no:8的氨基酸序列,cdr
‑
l1包含seq id no:13的氨基酸序列,cdr
‑
l2包含kas的氨基酸序列,且cdr
‑
l3包含seq id no:16的氨基酸序列;
27.(b)cdr
‑
h1包含seq id no:28的氨基酸序列,cdr
‑
h2包含seq id no:31的氨基酸序列,cdr
‑
h3包含seq id no:33的氨基酸序列,cdr
‑
l1包含seq id no:37的氨基酸序列,cdr
‑
l2包含vas的氨基酸序列,且cdr
‑
l3包含seq id no:40的氨基酸序列;
28.(c)cdr
‑
h1包含seq id no:4的氨基酸序列,cdr
‑
h2包含seq id no:7的氨基酸序列,cdr
‑
h3包含seq id no:9的氨基酸序列,cdr
‑
l1包含seq id no:14的氨基酸序列,cdr
‑
l2包含seq id no:15的氨基酸序列,且cdr
‑
l3包含seq id no:17的氨基酸序列;
29.(d)cdr
‑
h1包含seq id no:29的氨基酸序列,cdr
‑
h2包含seq id no:32的氨基酸序列,cdr
‑
h3包含seq id no:34的氨基酸序列,cdr
‑
l1包含seq id no:38的氨基酸序列,cdr
‑
l2包含vas或seq id no:39的氨基酸序列,且cdr
‑
l3包含seq id no:41的氨基酸序列。
30.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其中该抗体包含与选自seq id no:2、19、23、27、43或47的序列具有至少90%同一性的重链可变域(v
h
)氨基酸序列;和/或与选自seq id no:12、21、25、36、45或49的序列具有至少90%同一性的轻链可变域(v
l
)氨基酸序列;任选地其中:
31.(a)该抗体包含与seq id no:2具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:12具有至少90%同一性的轻链可变域(v
l
)氨基酸序列;
32.(b)该抗体包含与seq id no:19具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:21具有至少90%同一性的v
l
氨基酸序列;
33.(c)该抗体包含与seq id no:23具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:25具有至少90%同一性的v
l
氨基酸序列;
34.(d)该抗体包含与seq id no:27具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:36具有至少90%同一性的v
l
氨基酸序列;
35.(e)该抗体包含与seq id no:43具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:45具有至少90%同一性的v
l
氨基酸序列;或
36.(f)该抗体包含与seq id no:47具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:49具有至少90%同一性的v
l
氨基酸序列。
37.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其中该抗体包含与选自seq id no:58、60、62、64、66或68的序列具有至少90%同一性的重链(hc)氨基酸序列,和/或与选自seq id no:59、61、63、65、67或69的序列具有至少90%同一性的轻链(lc)氨基酸序列;任选地其中该抗体包含:
38.(a)seq id no:58的hc氨基酸序列,以及seq id no:59的lc氨基酸序列;
39.(b)seq id no:60的hc氨基酸序列,以及seq id no:61的lc氨基酸序列;
40.(c)seq id no:62的hc氨基酸序列,以及seq id no:63的lc氨基酸序列;
41.(d)seq id no:64的hc氨基酸序列,以及seq id no:65的lc氨基酸序列;
42.(e)seq id no:66的hc氨基酸序列,以及seq id no:67的lc氨基酸序列;或
43.(f)seq id no:68的hc氨基酸序列,以及seq id no:69的lc氨基酸序列。
44.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其中该抗体包含经由接头与il10多肽融合的重链;任选地其中:
45.(a)接头包含seq id no:78的氨基酸序列;
46.(b)il10多肽包含一个、二个或四个il10多肽;和/或
47.(c)il10多肽包含seq id no:75的氨基酸序列;
48.(d)hc包含与选自seq id no:50、51、52、53、54、55、56或57的序列具有至少90%同一性的氨基酸序列。
49.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其中该抗体包含与选自seq id no:50、51、52、53、54、55、56或57的序列具有至少90%同一性的重链(hc)氨基酸序列,以及与选自seq id no:59、61、63、65、67或69的序列具有至少90%同一性的轻链(lc)氨基酸序列;任选地其中该抗体包含:
50.(a)seq id no:50的hc氨基酸序列,以及seq id no:59的lc氨基酸序列;
51.(b)seq id no:51的hc氨基酸序列,以及seq id no:59的lc氨基酸序列;
52.(c)seq id no:52的hc氨基酸序列,以及seq id no:61的lc氨基酸序列;
53.(d)seq id no:53的hc氨基酸序列,以及seq id no:63的lc氨基酸序列;
54.(e)seq id no:54的hc氨基酸序列,以及seq id no:65的lc氨基酸序列;
55.(f)seq id no:55的hc氨基酸序列,以及seq id no:65的lc氨基酸序列;
56.(g)seq id no:56的hc氨基酸序列,以及seq id no:67的lc氨基酸序列;或
57.(h)seq id no:57的hc氨基酸序列,以及seq id no:69的lc氨基酸序列。
58.在至少一个实施方案中,本公开提供一种抗csf1r抗体,其中:
59.(a)该抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下的结合亲和力结合人csf1r;任选地,其中结合亲和力通过与seq id no:70的hucsf1r多肽的平衡解离常数(k
d
)测量;
60.(b)该抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下的结合亲和力结合食蟹猴csf1r;任选地,其中结合亲和力通过与seq id no:71的cynocsf1r多肽的平衡解离常数(k
d
)测量;
61.(c)该抗体减少csf1诱导和il34诱导的hucsf1r或akt的磷酸化;
62.(d)该抗体抑制csf1依赖性的和il34诱导的细胞增殖至少65%、至少75%、至少85%、至少95%或至少100%;任选地其中在csf1浓度为20ng/ml或il34浓度为33ng/ml时,抗体的ic
50
为5nm或以下、1nm或以下、0.5nm或以下或者0.1nm或以下;
63.(e)该抗体抑制人cd14 单核细胞或单核细胞衍生的巨噬细胞的csf1依赖性存活至少65%、至少75%、至少85%、至少95%或至少100%;任选地其中在csf1浓度为100ng/ml时,抗体的ic
50
为5nm或以下、1nm或以下、0.5nm或以下或者0.1nm或以下;
64.(f)该抗体增加针对表达csf1r的293f细胞的nk细胞介导的adcc至少10%、至少20%或至少25%;
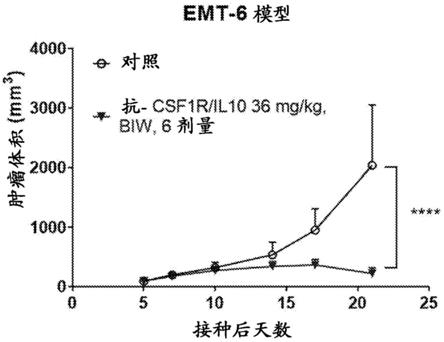
65.(g)该抗体在21天测量的同基因小鼠肿瘤模型中减小肿瘤体积至少25%、至少50%、至少75%或以上,其中小鼠肿瘤模型选自:ct26 crc、emt6 tnbc、mc38 crc、renca rcc、ll/2肺癌、pan02 pdac、h22 hcc、q1 hnscc;
66.(h)该抗体在ct26结肠肿瘤同基因小鼠模型中增加csf1和il34的血液水平至少50倍、至少100倍、至少200倍或至少500倍;
67.(i)该抗体在ct26结肠肿瘤同基因小鼠模型中减少tam群体至少20%、至少30%、
至少40%、至少50%、至少60%或以上;任选地其中mdsc群体减少小于10%、小于5%或以下;
68.(j)该抗体增加mc/9细胞增殖至少25%、至少50%、至少100%、至少150%、至少200%或以上;
69.(k)该抗体增加活化的cd8 t细胞的ifnγ和颗粒酶b产生至少25%、至少50%、至少100%或以上;和/或
70.(l)该抗体在ct26结肠肿瘤同基因小鼠模型中增加cd8 lag3 pd1 t细胞血液水平至少2倍、至少4倍、至少6倍、至少8倍、至少10倍或以上。
71.本公开还提供了本文中公开的抗csfr1抗体的实施方案,包括以下的实施方案:(i)该抗体为人抗体、人源化抗体或嵌合抗体;(ii)该抗体包含与重组蛋白的融合体;任选地与il10多肽的融合体;(iii)该抗体为igg类别的全长抗体,任选地其中igg类别的抗体具有选自igg1、igg2、igg3和igg4的同种型;(iv)该抗体包含fc区变体,任选地改变效应子功能的fc区变体和/或改变抗体半衰期的变体;(v)该抗体为抗体片段,任选地选自由f(ab’)2、fab'、fab、fv、单结构域抗体(vhh)和scfv组成的组;(vi)该抗体包含免疫缀合物,任选地其中该免疫缀合物包含用于治疗csf1r介导的疾病或病症的治疗剂;或(vii)该抗体为多特异性抗体,任选地双特异性抗体。
72.在至少一个实施方案中,本公开提供一种分离的多核苷酸或载体,其编码本公开的抗csf1r抗体。在至少一个实施方案中,本公开提供一种分离的宿主细胞,其包含编码本公开的抗csf1r抗体的多核苷酸或载体。在至少一个实施方案中,本公开还提供一种产生本公开的抗csfr1抗体的方法,包括培养包含编码抗csf1r抗体的多核苷酸或载体的宿主细胞,使得产生抗体。
73.在至少一个实施方案中,本公开提供一种药物组合物,其包含本公开的抗csf1r抗体和药学上可接受的载体;任选地其中该组合物还包含il10多肽、化疗剂和/或含对于免疫检查点分子的特异性的抗体。
74.在至少一个实施方案中,本公开提供一种治疗受试者的csf1r介导疾病的方法,该方法包括向受试者施用治疗有效量的本公开的抗csf1r抗体,或向受试者施用治疗有效量的本公开的药物组合物;任选地其中该疾病为癌症;任选地其中该癌症选自结肠癌、胰腺癌、卵巢癌、hcc、肾癌、乳腺癌、肺癌、胃癌、头颈癌和口腔癌。
75.在至少一个实施方案中,本公开提供一种治疗受试者的癌症的方法,包括向受试者施用csf1r拮抗剂与il
‑
10激动剂;任选地其中csf1r拮抗剂包括抗csf1r抗体、shrna、sirna、mirna、csf1r的小分子抑制剂或其组合;任选地其中il
‑
10激动剂为il
‑
10、il
‑
10受体结合蛋白或其组合;任选地其中csf1r拮抗剂为本公开的抗csf1r抗体;任选地其中csf1r拮抗剂和il10激动剂包含具有经由接头与il10多肽融合的hc的抗csf1r抗体;任选地其中该方法进一步包括向受试者施用t细胞疗法。
76.附图简要说明
77.图1a和图1b描绘fortebio表位分箱(epitope binning)分析的结果,其显示从杂交瘤上清液纯化的两个抗csf1r抗体“hy6d4”和“hy6m6”结合csf1r的不同表位。传感器经过多个测定步骤(以数字表示,并以虚线分开),包括步骤1.基线;步骤2.生物素
‑
csf1r抗原捕获;步骤3.以1
st mab饱和;以及步骤4。图1a显示与1
st mab hy6m6和2
nd mab hy6d4竞争的结
果。图1b显示与1
st mab hy6m6和2
nd mab hy6m6竞争的结果。
78.图2a、图2b和图2c描绘柱状图(histogram),其显示如实例2所述进行的代表性流式细胞术实验中,嵌合抗csf1r抗体“6d4”和“6m6”对人和食蟹猴csf1r蛋白的跨物种结合。图2a:6d4、6m6或对照人igg(higg)与aml
‑
5人急性髓性白血病细胞的结合;图2b:6d4、6m6和higg与过表达人csf1r的293f细胞的结合;以及图2c:6d4、6m6和higg与过表达食蟹猴csf1r的293f细胞的结合。
79.图3a和图3b描绘蛋白质印迹凝胶图像,其显示抗csf1r抗体存在下aml5细胞中配体诱导的csf1r和akt磷酸化的减弱。如实施例2所述,将aml5细胞用对照higg、市售抗csf1r抗体“csf1r ab
‑
r”和“csf1r ab
‑
l”、嵌合抗csf1r抗体6d4或6m6预处理5分钟,随后用csf1(图3a)或il
‑
34(图3b)刺激5分钟。以蛋白质印迹法探测细胞裂解物中的总(t)csf1r和akt及磷酸(p)csf1r和akt。
80.图4a、图4b、图4c和图4d描绘了显示在嵌合抗csf1r抗体6d4和6m6存在下csf1或il
‑
34配体依赖性细胞增殖的抑制的图。如实施例2所述,aml5细胞与csf1(图4a)或il
‑
34(图4b)及不同浓度的对照higg、嵌合抗csf1r抗体6d4和6m6孵育3天;或者aml5细胞与csf1和人源化抗csf1r抗体“6d4.hu22”、“6d4.hu41”(图4c)或“6m6.hu12”和“6m6.hu41”(图4d)孵育3天。通过celltiter
‑
glo试验测量细胞增殖。
81.图5a、图5b、图5c和图5d描绘了显示在抗csf1r抗体存在下csf1依赖性细胞存活的抑制的图。人cd14 血液单核细胞(图5a)或单核细胞衍生的巨噬细胞(图5b)与csf1及不同浓度的对照higg、嵌合抗csf1r抗体6d4和6m6一起孵育;或人cd14 血液单核细胞与不同浓度的嵌合抗csf1r抗体6d4和人源化抗体6d4.hu22和6d4.hu41(图5c)或者嵌合抗csf1r抗体6m6和人源化抗体6m6.hu12和6m6.hu41(图5d)一起孵育。通过celltiter
‑
glo试验测量细胞存活。
82.图6显示在抗csf1r抗体存在下自然杀伤(nk)细胞介导的抗体依赖性细胞毒性(adcc)的增强。在抗csf1r抗体存在下以e:t比率20:1混合新鲜分离的nk效应细胞和293f/csf1r靶细胞,并在37℃下孵育5小时。通过cytotox
‑
glo细胞毒性试验(promega)测定细胞毒性。
83.图7a和图7b描绘了显示抗csf1r抗体阻断与il10激动剂的组合免疫治疗发挥作用以控制肿瘤负荷的图。在植入后7天肿瘤达到50至100mm3时,将ct26肿瘤随机分组,接着用同种型对照(bioxcell,30mg/kg)、抗csf1r(bioxcell,30mg/kg)、il10
‑
fc(20mg/kg)或组合每周两次治疗,共3周。图7a:ct26植入的balb/c小鼠在第28天终点时的肿瘤体积。图7b:第0天时ct26植入的balb/c小鼠随时间的个体肿瘤体积。每组n=8只小鼠。
84.图8a、图8b、图8c和图8d描绘了显示在同基因ct26结肠癌模型中,与csf1r抑制和il10功能相关的细胞因子水平的图。用抗csf1r或il10
‑
fc融合蛋白处理1周的小鼠中的csf1(图8a)、il
‑
34(图8b)、cxcl9(图8c)血浆水平。用抗csf1r或il10
‑
fc处理3周的小鼠中的il
‑
18血浆水平(图8d)。
85.图9a、图9b、图9c、图9d和图9e描绘了显示在ct26同基因肿瘤模型中,肿瘤浸润免疫细胞分析中的处理效果的图。用同种型对照抗体、抗csf1r或il10
‑
fc处理同基因ct26肿瘤。在7天处理后,收获肿瘤并以流式细胞术进行分析。肿瘤微环境中tams(cd11b f4/80 )(图9a)、单核细胞mdscs(cd11b ly6c )(图9b)、颗粒细胞mdscs(cd11b ly6g )(图9c)、活化
的cd4 t细胞(cd4 ifnγ )(图9d)、活化的cd8 t细胞(cd8 ifnγ )(图9e)的百分比以cd45 白细胞进行门控。每组n=8只小鼠。显示了平均值
±
sd。*p<0.05、**p<0.01、***p<0.001。
86.图10a、图10b和图10c描绘了显示实施例5所述制备的igg/il10融合蛋白的成功表达和纯化的凝胶图像。图10a显示il10
‑
fc和(il10)2‑
fc的sds
‑
page图像;图10b显示6d4/il10、6d4/(il10)2、6m6/il10和6m6/(il10)2融合蛋白制备物的sds
‑
page图像;图10c显示替代抗小鼠csf1r抗体“ab98”和ab98/il10融合蛋白的sds
‑
page图像。凝胶泳道底部的标记:n:非还原,r:还原。
87.图11a和图11b描绘了如实施例5所述测定的数据的图,其显示嵌合抗csf1r/il10融合蛋白(“6d4/il10”和“6m6/il10”)及人源化抗csf1r/il10融合蛋白(“6d4.hu22/il10”、“6d4.hu41/il10”、“6m6.hu12/il10”和“6m6.hu41/il10”)与过表达人csf1r(“hucsf1r”)(图11a)或食蟹猴csf1r(“cynocsf1r”)(图11b)的293f细胞的跨物种结合。
88.图12描绘了如实施例5中所述获得的凝胶图像,其显示在对照higg、抗csf1r 6m6、抗csf1r 6m6加il10
‑
fc、抗csf1r加(il10)2‑
fc或抗csf1r/il10融合蛋白6m6/il10或6m6/(il10)2存在下,aml5细胞中csf1诱导的csf1r磷酸化的减弱。
89.图13a、图13b、图13c和图13d描绘如实施例5所述获得的数据的图,其显示在抗csf1r/il10融合蛋白存在下csf1依赖性细胞增殖的抑制。图13a:在具有人源化抗csf1r/il10融合蛋白的情况下与csf1孵育3天的aml5细胞。图13b:在具有不同浓度的对照higg、抗csf1r或抗csf1r/il10融合蛋白的情况下与csf1孵育6天的人cd14 血液单核细胞。图13c:在具有不同浓度的人源化抗csf1r/il10融合蛋白的情况下与csf1孵育3天的人单核细胞衍生的巨噬细胞。图13d:在具有替代抗csf1r/il10融合蛋白的情况下与csf1孵育3天的m
‑
nfs
‑
60细胞。通过celltiter
‑
glo试验测量细胞存活和增殖。
90.图14a和图14b描绘如实施例5所述获得的数据的图,其显示抗csf1r/il10融合蛋白诱导的mc/9细胞增殖。mc/9细胞与il10
‑
fc和嵌合抗csf1r/il10融合蛋白(图14a)或人源化抗csf1r/il10融合蛋白(图14b)共培养3天。通过celltiter
‑
glo试验测量细胞增殖。
91.图15a、图15b、图15c和图15d描绘如实施例5所述获得的数据的图,其显示抗csf1r/il10融合蛋白增强用抗cd3和抗cd28活化3天的cd8 t细胞的ifnγ和颗粒酶b产生。活化的cd8 t细胞用il10
‑
fc(图15a、图15b)或抗csf1r/il10融合蛋白(图15c、图15d)处理3天,并用抗cd3触发4小时。通过elisa测量ifnγ(图15a、图15c)和细胞毒性蛋白颗粒酶b(图15b、图15d)的水平。
92.图16描绘了显示在同基因ct26结肠癌模型中与csf1r抑制和il
‑
10功能相关的细胞因子水平的图。用抗csf1r il10
‑
fc或抗csf1r/il10处理1周的小鼠的血浆csf1水平。每组n=6只小鼠。显示了平均值
±
sd。*p<0.05。
93.图17a、图17b和图17c描绘了显示在ct26同基因肿瘤模型中肿瘤浸润免疫细胞分析的结果的图。同基因ct26肿瘤用同种型对照、il10
‑
fc、替代抗csf1r或抗csf1r/il10处理。在7天处理后,收获肿瘤并用流式细胞术分析。肿瘤微环境中的cd11b (图17a)、tams(cd11b f4/80 )(图17b)、颗粒细胞mdscs(cd11b ly6g )(图17c)的百分比以cd45 白细胞进行门控。每组n=6只小鼠。显示了平均值
±
sd。*p<0.05、**p<0.01、***p<0.001。
94.图18a和图18b描绘了显示在ct26同基因肿瘤模型中血液t细胞分析的结果的图。同基因ct26肿瘤用同种型对照、il10
‑
fc、替代抗csf1r或抗csf1r/il10处理。在7天处理后,
收集血液并通过流式细胞术分析。总cd8 t细胞(图18a)或cd8 lag3 pd1 (图18b)的百分比以cd3 白细胞进行门控。每组n=6只小鼠。显示了平均值
±
sd。*p<0.05、**p<0.01、***p<0.001。
95.图19a、图19b、图19c、图19d、图19e、图19f、图19g和图19h描绘了显示抗csf1r/il10融合蛋白可控制肿瘤生长的图。一旦肿瘤达到50至100mm3,将emt6肿瘤(图19a)、ct26肿瘤(图19b)、mc38肿瘤(图19c)、renca肿瘤(图19d)、ll/2肿瘤(图19e)、pan02肿瘤(图19f)、h22肿瘤(图19g)和q1肿瘤(图19h)随机分组,接着用pbs对照或替代抗csf1r/il10(36mg/kg)每周两次治疗,共3周。第0天植入肿瘤细胞的小鼠随时间的肿瘤体积。每组n=10只小鼠。显示了平均值
±
sd。*p<0.05、**p<0.01、***p<0.001。
具体实施方式
96.本公开提供抗体,包括人源化抗体,其以高亲和力特异性地结合csf1r,从而抑制、减少和/或完全阻断作为细胞表面受体的csf1r参与免疫调节的功能,特别是csf1r在调节肿瘤相关巨噬细胞(tams)的存活和维持中的功能。tams为肿瘤微环境(tme)的主要细胞成分,且对肿瘤生长与进展有重要贡献。据信,抑制csf1r信号传导可耗尽tams,从而增强抗肿瘤的t细胞反应。在临床试验中,当csf1r抑制剂作为唯一药剂施用时,在患者中显示有限的抗肿瘤作用,表明需要组合使用这些抑制剂与其他抗肿瘤治疗途径。il10为具有抗炎性和cd8 t细胞活化特性的细胞因子。强的il
‑
10信号可以促进肿瘤特异性cd8 t细胞增殖,使耗竭的t细胞恢复活力,从而增加t细胞的细胞毒性。本公开考虑抗csf1r抗体与il10激动剂组合的使用,包括作为与il10多肽的抗csf1r抗体融合体。如本文所公开的,组合csf1r抑制以减少免疫抑制性tams和集中的il10剂量以增强tme中的cd8 t细胞的细胞毒性可提供改进的癌症治疗途径。
97.因此,预期包含本公开的抗csf1r抗体(包括与il10多肽融合的抗csf1r抗体)的任何组合物或制剂可用作治疗由csf1r或其标抗原csf1的功能介导的疾病(如癌症)的治疗剂。此外,预期本公开的抗csf1r抗体可用作与其他治疗剂(如活化cd8 t细胞的抗体,和/或靶标免疫检查点分子,包括但不限于,pd1、pd
‑
l1、lag3、ctla
‑
4、a2ar、tim
‑
3、btla、cd276、cd328、vtcn1、ido、kir、nox2、vista、ox40、cd27、cd28、cd40、cd122、cd137、gitr、icos)组合的治疗剂。
98.术语及技术的概述
99.对于本文的说明书及所附的权利要求,单数形式“一”及“一个”包括复数指示物,除非上下文另有明确说明。因此,例如,提及“一蛋白质”包括一个以上的蛋白质,提及“一化合物”指一个以上的化合物。还应注意的是,权利要求可撰写成排除任何任选要素。因此,该陈述旨在作为与权利要求要素的陈述结合使用排他性术语如“唯一”、“仅”等,或使用“负”限制的先行基础。“包含(复数动词)”、“包含(单数动词)”、“包含(动名词)”、“包括(复数动词)”、“包括(单数动词)”以及“包括(动名词)”的使用是可互换的,且不意图进行限制。应进一步理解的是,在各种实施方案的描述使用术语“包含”的情况下,本领域技术人员将理解,在某些特定情况下,实施方案可以使用“基本上由
……
组成”或“由
……
组成”的语言来替代地描述。
100.在提供值的范围的情况下,除非上下文另有明确规定,应理解的是该范围的上限
与下限之间的该值的每个中间整数以及该值的每个中间整数的每十分之一(除非上下文另有明确规定),以及该规定范围内的任何其他规定或中间值,都包含于本发明内。这些较小范围的上限与下限可以独立地包括在较小范围内,并且也包含于本发明内,但受该规定范围内的任何特别排除的限制。在该规定范围包括这些限值中的一个或两个的情况下,排除这些包括的限值中的(i)任一或(ii)两者的范围也包括在本发明中。例如,“1至50”包括“2至25”、“5至20”、“25至50”、“1至10”等。
101.通常,本文使用的命名法及本文描述的技术和程序包括本领域技术人员充分理解和通常使用的这些,例如sambrook等人,分子克隆
‑
实验室指南(molecular cloning
‑
a laboratory manual)(第2版),第1~3卷,冷泉港(cold spring harbor)实验室,冷泉港,纽约,1989年(以下称“sambrook”);分子生物学现行规范(current protocols in molecular biology),f.m.ausubel等人编辑,current protocols,greene publishing associates,inc.和john wiley&sons,inc.联合企业(补充至2011年)(以下称“ausubel”);抗体工程(antibody engineering),第1和2卷,r.kontermann和s.dubel编辑,springer
‑
verlag,柏林与海德堡(2010年);单克隆抗体:方法与规范(monoclonal antibodies:methods and protocols),v.ossipow和n.fischer编辑,第2版,humana出版社(2014年);治疗性抗体:从实验室至临床(therapeutic antibodies:from bench to clinic),z.an编辑,j.wiley&sons,hoboken,n.j.(2009年);以及噬菌体展示技术(phage display),tim clackson和henry b.lowman编辑,牛津大学出版社,英国(2004年)中描述的常用技术及方法。
102.本发明中引用的所有出版物、专利、专利申请以及其他文献出于所有目的通过引用整体并入本文,其程度如同每个单独的出版物、专利、专利申请或其他文献被单独指出出于所有目的通过引用在此并入。
103.除非另外定义,否则本文使用的所有技术及科学术语具有与本发明所属领域具有通常知识者通常理解的含义相同的含义。应当理解的是,本文使用的术语仅用于描述特定实施方案,而非意图是限制性的。出于解释本公开的目的,以下对术语的描述将适用,并且在适当的情况下,以单数形式使用的术语还将包括复数形式,反之亦然。
104.如本文所用,“csf1r”指集落刺激因子1受体蛋白,且如本文所用,包括人类、食蟹猴、小鼠的csf1r蛋白及这些蛋白的任何异形体。各种示例性csf1r蛋白的氨基酸序列是本领域中已知的,并提供于下表1及在附件序列表中。
105.如本文所用,“csf1r介导的病症”或“csf1r介导的疾病”包括与csf1和细胞表面受体csf1r的特异性结合相关的任何医学病症。例如,csf1与csf1r的特异性结合发挥调节肿瘤微环境中tams的存活的作用。因此,csf1r介导的疾病可包括但不限于,由csf1r和/或csf1介导的和/或对csf1r和/或csf1的拮抗剂或抑制剂有反应的任何疾病或病症,包括但不限于癌症。
106.如本文所用,“il10”或“il
‑
10”指抗炎性细胞因子白介素10,其也称作细胞因子合成抑制性因子(csif)。各种示例性il10多肽及重组il10融合构建体的氨基酸序列是本领域中已知的,并提供于下表2及附件序列表中。
107.如本文所用,“抗体”指包含一个或多个多肽链的分子,其特异性结合特定抗原或与特定抗原具有免疫反应性。本公开的示例性抗体包括单克隆抗体、多克隆抗体、嵌合抗体、人源化抗体、人抗体、抗体融合体(如,融合蛋白)、多特异性抗体(如,双特异性抗体)、单
价抗体(如,单臂抗体)、多价抗体、抗原结合片段(如,fab'、f(ab’)2、fab、fv、rigg和scfv片段)和合成抗体(或抗体模拟物)。
[0108]“抗csf1r抗体”或“结合csf1r的抗体”指以足够的亲和力结合csf1r的抗体,使得该抗体可用作靶向csf1r的治疗和/或诊断剂。在一些实施方案中,抗csf1r特异性抗体与不相关的非csf1r抗原的结合程度小于该抗体与csf1r的结合的约20%、小于约15%、小于约10%或小于约5%,如通过例如放射免疫测量法(ria)或表面等离子体共振法(spr)测量的。在一些实施方案中,本公开的抗csf1r抗体具有<1μμ、<100nm、<10nm、<1nm、<0.1nm、<0.01nm或<1pm(如,10
‑8m或以下,如,10
‑8m至10
‑
13
m,例如,10
‑9m至10
‑
13
m)的解离常数(k
d
)。
[0109]“全长抗体”、“完整抗体”或“全抗体”在本文中可互换使用,指具有与天然抗体结构基本上相似的结构或具有含如本文所定义的fc区的重链的抗体。
[0110]“抗体融合体”指与多肽或蛋白共价缀合(或融合)(通常经由抗体轻链(lc)或重链(hc)末端的接头)的抗体。本公开的示例性抗体融合体包括经由14氨基酸的接头与重组il10多肽融合的抗csf1r抗体,其是从抗体重链c端至il10多肽的n端。抗体融合体在本文中以“抗体/多肽”命名法标记以表示融合组分,如“ab/il10”或“抗csfr1/il10”或“6d4/il10”。
[0111]“抗体片段”指全长抗体的一部分,其能够与全长抗体结合相同的抗原。抗体片段的实例包括但不限于,fv、fab、fab'、fab'
‑
sh、f(ab’)2、双体抗体、线性抗体、单价或单臂抗体、单链抗体分子(如,scfv)和由抗体片段形成的多特异性抗体。
[0112]
抗体的“类别”指其重链具有的恒定域或恒定区的类型。有五种主要的抗体类别:iga、igd、ige、igg和igm,其中一些进一步分为亚类(同种型),例如,igg1、igg2、igg3、igg4、iga1和iga2。对应于不同免疫球蛋白类别的重链恒定域分别称作α、δ、ε、γ和μ。
[0113]“可变区”或“可变域”指抗体重链或轻链的结构域,其参与抗体与抗原的结合。天然抗体的重链及轻链的可变域(分别v
h
及v
l
)通常具有相似的结构,每个结构域包含四个保守的框架区(frs)及三个高变区(hvrs)(参阅,如kindt等人,kuby immunology,第6版,w.h.freeman and co.,第91页)。单个v
h
或v
l
结构域可能足以赋予抗原结合特异性。此外,可使用来自结合特定抗原的抗体的v
h
或v
l
结构域分离结合该抗原的抗体,以分别筛选互补v
l
或v
h
结构域的文库(参阅,如portolano等人,j.immunol.150:880
‑
887(1993年);clarkson等人,nature 352:624
‑
628(1991年))。
[0114]
如本文所用,“高变区”或“hvr”指抗体可变域的各区域,其在序列中是高变的和/或形成结构上限定的环(“高变环”)。通常,天然抗体包含具有六个hvrs的四条链;在重链可变域中三个,v
h
(hvr
‑
h1、hvr
‑
h2、hvr
‑
h3),和在轻链可变域中三个,v
l
(hvr
‑
l1、hvr
‑
l2、hvr
‑
l3)。hvrs通常包含来自高变环和/或来自“互补决定区”(cdrs)的氨基酸残基。多种高变区划界正在使用中,并涵盖在本文中。kabat互补决定区(cdrs)是基于序列变异性,且是最常使用的(kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md.(1991年))。chothia相反指结构环的位置(chothia和lesk,j.mol.biol.196:901
‑
917(1987年))。abm高变区代表kabat cdrs与chothia结构环之间的折衷,并由oxford molecular's abm抗体建模软件使用。“接触”高变区是基于对可得的复合晶体结构的分析。下表列出在这些系统下定义的高变区残基范围。
[0115][0116]
除了上述系统之外,可使用国际immunogenetics信息系统识别hvrs和cdrs,该系统称作imgt/v
‑
quest,描述于brochet,x.等人,nucl.acids res.36,w503
‑
508(2008年).pmid:18503082;且在www.imgt.org/imgt_vquest/input上可供在线使用。imgt/v
‑
quest使用imgt独特编号分析与最接近种系v基因可变区核苷酸序列的比对,以识别hvrs和cdrs。
[0117]
如本文所用,高变区(hvrs)可包括如下的延伸或可选高变区:v
h
结构域中的27
‑
32、27
‑
36、24
‑
34或24
‑
38(hvr
‑
l1);50
‑
52、54
‑
56、50
‑
56或54
‑
60(hvr
‑
l2);89
‑
97或93
‑
101(hvr
‑
l3);26
‑
33、26
‑
35或31
‑
35(hvr
‑
h1);51
‑
58、50
‑
61或50
‑
66(h2);以及97
‑
110、97
‑
112、99
‑
110或99
‑
112(h3)。针对这些定义的每一者,可变域残基依据kabat等人(同上)编号。
[0118]
如本文所用,“互补决定区”或“cdr”指可变域的hvr内具有最高序列变异性和/或参与抗原识别的区域。通常,天然抗体包含具有6个cdr的四条链;在重链可变域中三个,v
h
(cdr
‑
h1、cdr
‑
h2、cdr
‑
h3),和在轻链可变域中三个,v
l
(cdr
‑
l1、cdr
‑
l2、cdr
‑
l3)。示例性cdrs存在于以下可变域氨基酸残基位置处:24
‑
34、27
‑
32、27
‑
36、24
‑
38(cdr
‑
l1);50
‑
56、50
‑
52、54
‑
56或54
‑
60(cdr
‑
l2);89
‑
97或93
‑
101(cdr
‑
l3);31
‑
35或26
‑
33(cdr
‑
h1);50
‑
66或51
‑
58(cdr
‑
h2);以及99
‑
112、99
‑
110、97
‑
112或97
‑
110(cdr
‑
h3)。
[0119]“框架区”或“fr”指hvr残基之外的可变域残基。可变域的frs通常由四个结构域组成:fr1、fr2、fr3和fr4。因此,hvr和fr序列通常以下列顺序出现在v
h
(或v
l
)中:fr1
‑
h1(l1)
‑
fr2
‑
h2(l2)
‑
fr3
‑
h3(l3)
‑
fr4。
[0120]
除非另有说明,在hvrs、cdrs、frs和可变域中的其他残基的残基位置在本文中依据kabat等人(同上)编号。
[0121]“天然抗体”指天然存在的免疫球蛋白分子。例如,天然igg抗体为约150,000道尔顿的异四聚体糖蛋白,由二硫键键合的两条相同的轻链和两条相同的重链所组成。从n端至c端,每条重链具有可变区(v
h
),也称作可变重链结构域或重链可变域,接着是三个恒定结构域(ch1、ch2和ch3)。类似地,从n端至c端,每条轻链具有可变区(v
l
),也称作可变轻链结构域或轻链可变域,接着是恒定轻链(cl)结构域。基于其恒定域的氨基酸序列,抗体的轻链可分配为两种类型中的一种,称作kappa(κ)和lambda(λ)。
[0122]
如本文所用,“单克隆抗体”指从基本上同质的抗体群体获得的抗体,即,构成该群体的单个抗体是相同的和/或结合相同的表位,除了可能的变体抗体外(例如,变体抗体含有天然发生的突变或在单克隆抗体的产生过程中产生的突变,并且通常以少量存在)。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制备物相反,单克隆抗体制备物的
每个单克隆抗体针对抗原上的单一决定簇。因此,术语“单克隆”表示抗体如从基本上同质的抗体群体获得的特征,并且不解释为需要通过任何特定方法来产生抗体。例如,待使用的单克隆抗体可通过多种技术制备,包括但不限于,杂交瘤法、重组dna法、噬菌体展示法以及利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,本文描述了制备单克隆抗体的此类方法以及其他示例性方法。
[0123]“嵌合抗体”指其中一部分重链和/或轻链源自特定来源或物种,而该重链和/或轻链的其余部分源自不同的来源或物种的抗体。
[0124]“人源化抗体”指包含来自非人类hvrs的氨基酸序列和来自人类frs的氨基酸序列的嵌合抗体。在特定实施方案中,人源化抗体包含至少一个,且通常两个可变域的基本上全部,其中全部或基本上全部hvrs对应于非人抗体的那些hvrs,且全部或基本上全部frs对应于人抗体的那些frs。人源化抗体任选地可包含源自人抗体的抗体恒定区的至少一部分。抗体(如非人抗体)的“人源化形式”指已经历人源化的抗体。
[0125]“人抗体”指具有对应于由人或人细胞产生的,或源自使用人抗体库或其他人抗体编码序列的非人类来源的抗体的氨基酸序列的抗体。人抗体的这一定义特别地排除包含非人抗原结合残基的人源化抗体。
[0126]“人共有框架”是代表在人免疫球蛋白v
l
或v
h
框架序列的选择中最常见的氨基酸残基的框架。通常,人免疫球蛋白v
l
或v
h
序列是选自可变域序列的亚组。通常,该序列亚组是如kabat等人,sequences of proteins of immunological interest,第5版,nih publication 91
‑
3242,bethesda md(1991),第1
‑
3卷中的亚组。在一个实施方案中,针对v
l
,该亚组为如kabat等人(同上)中的亚组κi。在一个实施方案中,针对v
h
,该亚组为如kabat等人(同上)中的亚组iii。
[0127]
如本文所用,“受体人框架”为包含源自人免疫球蛋白框架或人共有框架的轻链可变域(v
l
)框架或重链可变域(v
h
)框架的氨基酸序列的框架。“源自”人免疫球蛋白框架或人共有框架的受体人框架可包含其相同的氨基酸序列,或可包含氨基酸序列变化。在一些实施方案中,氨基酸变化的数量为10或以下、9或以下、8或以下、7或以下、6或以下、5或以下、4或以下、3或以下或者2或以下。在一些实施方案中,v
l
受体人框架在序列上与v
l
人免疫球蛋白框架序列或人共有框架序列相同。
[0128]“fc区”指包含免疫球蛋白重链的c端多肽序列的二聚体复合物,其中c端多肽序列为可通过木瓜蛋白酶消化完整抗体而获得的序列。fc区可包含天然或变体fc序列。尽管免疫球蛋白重链的fc序列的边界可以变化,但人igg重链fc序列通常定义为从大约cys226位的氨基酸残基或从大约pro230位延伸至fc序列的羧基末端。然而,fc序列的c端赖氨酸(lys447)可存在或不存在。免疫球蛋白的fc序列通常包含两个恒定结构域,即ch2结构域和ch3结构域,且任选地包含ch4结构域。
[0129]“fc受体”或“fcr”指结合抗体fc区的受体。在一些实施方案中,fcr为天然人类fcr。在一些实施方案中,fcr为结合igg抗体(γ受体)的fcr,且包括fcγri、fcγrii和fcγriii子类,包括这些受体的等位基因变体和可变剪接形式。fcγrii受体包括fcγriia(“活化受体”)和fcγriib(“抑制受体”),其具有类似的氨基酸序列,主要差别在于其胞质结构域。活化受体fcγriia在其胞质结构域中含有免疫受体酪氨酸活化基序(itam)。抑制受体fcγriib在其胞质结构域中含有免疫受体酪氨酸抑制基序(itim)(参阅,如daeron,
annu.rev.immunol.15:203
‑
234(1997年))。如本文所用,fcr也包括新生受体fcrn,其负责将母体iggs转移至胎儿(guyer等人,j.immunol.1 17:587(1976年)及kim等人,j.immunol.24:249(1994年))和调控免疫球蛋白的内稳态。fcrs综述于诸如,ravetch和kinet,annu.rev.immunol 9:457
‑
92(1991年);capel等人,immunomethods 4:25
‑
34(1994年);以及de haas等人,j.lab.clin.med.126:330
‑
41(1995年)中。
[0130]“多特异性抗体”为具有至少两个不同结合位点的抗体,每个位点具有不同结合特异性。多特异性抗体可为全长抗体或抗体片段,且不同结合位点可各自结合不同抗原,或不同结合位点可结合同一抗原的两个不同表位。
[0131]“fv片段”指含有完整抗原识别和结合位点的抗体片段。这一区域由紧密结合的一个重链和一个轻链可变域的二聚体组成,该紧密结合在性质上可为共价的,例如在scfv中。在此构形中,每一可变域的三个hvrs相互作用以在v
h
‑
v
l
二聚体的表面上限定抗原结合位点。六个hvrs或其子集共同赋予该抗体抗原结合特异性。然而,即使单一可变域(或包含仅三个对抗原具有特异性的hvrs的fv的一半)具有识别与结合抗原的能力,虽然通常其亲和力低于整个结合位点。
[0132]“fab片段”指含有轻链的可变和恒定结构域及重链的可变域和第一恒定结构域(ch1)的抗体片段。“f(ab’)2片段”包含一对fab片段,其通常通过它们之间的铰链半胱氨酸在羧基端附近共价连接。抗体片段的其他化学偶联在本领域中也是已知的。
[0133]
如本文所用,“抗原结合臂”指具有特异性结合感兴趣的靶分子的能力的抗体组分。通常,抗原结合臂为免疫球蛋白多肽序列(如,免疫球蛋白轻链和重链的hvr和/或可变域序列)的复合物。
[0134]“单链fv”或“scfv”指包含抗体的v
h
和v
l
结构域的抗体片段,其中这些结构域存在于单一多肽链中。通常,fv多肽进一步包含在v
h
和v
l
结构域之间的多肽接头,其使得scfv能够形成所需的抗原结合结构。
[0135]“亲和力”指分子(如,抗体)的单个结合位点与其结合伴体(如,抗原)之间的非共价相互作用的总和的强度。“结合亲和力”指固有结合亲和力,其反映结合对的成员(如,抗体和抗原)之间的1:1相互作用。分子x对其伴体y的亲和力通常可以由平衡解离常数(k
d
)表示。亲和力可通过本领域已知的常用方法测量,包括本文所述的那些方法。用于测量结合亲和力的具体说明性及示例性实施方案以下描述。
[0136]“特异性地结合”或“特异性结合”指抗体与抗原以不超过约1
×
10
‑7m的亲和力值的结合。在一些实施方案中,抗体对其特异性结合的抗原以外的抗原可具有二级亲和力,其中“二级亲和力”通常指如本文另外所述的抗体与二级抗原以大于约10nm的亲和力值结合。在抗体可对二级抗原具有二级亲和力的情况下,这种抗体仍与一级抗原特异性结合。
[0137]“分离的抗体”指与其自然环境的组分分离的抗体。在一些实施方案中,抗体纯化至纯度大于95%或99%,如通过例如电泳法(如,sds
‑
page、等电聚焦(ief)、毛细管电泳)或层析法(如,离子交换或反相hplc)测定的。有关用于抗体纯度评估的方法的综述,参阅,如flatman等人,j.chromatogr.b 848:79
‑
87。
[0138]“效应子功能”是指归因于抗体fc区的生物学活性,其随抗体同种型而变化。抗体效应子功能的实例包括:clq结合和补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞表面受体(如,b细胞受体)的下调;以及b细胞活
化。
[0139]“免疫缀合物”指与一个或多个异源分子(包括但不限于细胞毒性剂)缀合的抗体。
[0140]“治疗(名词)”、“治疗(动词)”或“治疗(动名词)”指试图改变所治疗个体的病症的自然进程的临床干预,并可进行用于预防或在临床病理学过程中进行。期望的治疗结果可包括,但不限于,预防病症的发生或复发、减轻症状、减少病症的任何直接或间接的病理后果、预防转移、降低进展速度、改善或缓解疾病状态以及缓解或改善预后。例如,治疗可包括对受试者施用治疗有效量的包含抗csf1r抗体的药物制剂,以延迟通过csf1r和/或其与csf1或其他配体的结合介导的疾病或病症或者其中csf1r可在病理发生和/或进展中发挥作用的疾病或病症的发生或减慢其进展。
[0141]“药物制剂”指允许活性成分的生物学活性有效的形式的制备物,且其不含对施用该制剂的受试者具有毒性的另外的组分。药物制剂可包括一种或多种活性剂。例如,药物制剂可包括抗csf1r抗体作为制剂的唯一活性剂,或可包括抗csf1r抗体及一种或多种另外的活性剂、免疫激活剂(如il10)或免疫检查点分子的抑制剂。
[0142]
如本文所用的,“唯一活性剂”指药物制剂中的活性剂,其为提供或预期提供相关药理作用以治疗受试者的所治疗病症的该药物制剂中存在的仅有活性剂。包含唯一活性剂的药物制剂不排除在该制剂中存在一种或多种非活性剂,例如,药学上可接受的载体。“非活性剂”为预期不提供或以另外的方式明显有助于旨在治疗受试者病症的相关药理学作用的药剂。
[0143]“药学上可接受的载体”指药物制剂中活性成分以外的成分,其对所施用的受试者无毒。药学上可接受的载体包括但不限于,缓冲剂、赋形剂、稳定剂或防腐剂。
[0144]
如本文所用,“免疫检查点分子”指功能在于调节免疫系统途径并由此防止其不必要地攻击细胞的分子。许多免疫检查点分子(抑制性和共刺激性)是用于治疗癌症和病毒感染的免疫疗法(如,以阻断抗体阻断免疫抑制或以激动剂促进免疫刺激)的靶标。癌症免疫疗法所靶向的示例性免疫检查点分子包括但不限于,pd1、pd
‑
l1、lag3、ctla
‑
4、a2ar、tim
‑
3、btla、cd276、cd328、vtcn1、ido、kir、nox2、vista、ox40、cd27、cd28、cd40、cd122、cd137、gitr、icos。
[0145]“治疗上有效量”指实现期望的治疗或预防结果(例如,治疗或预防受试者的疾病、障碍或病症)的活性成分或活性剂(如,药物制剂)的量。在csf1r介导的疾病或病症的情况中,治疗剂的治疗有效量是在一定程度上减轻、预防、抑制和/或缓解与疾病、障碍或病症相关的一种或多种症状的量。对于癌症治疗,体内功效可以,例如,通过评估原发性肿瘤的生长、继发性肿瘤的发生和/或生长、转移的发生和/或数量、症状的持续时间、严重程度和/或复发、反应率(rr)、反应持续时间和/或生活质量来测量。
[0146]
如本文所用,“同时”指施用两种或更多种治疗剂,其中至少一部分施用在时间上重叠。因此,同时施用包括在停止施用一种或多种其他药剂后继续施用一种或多种药剂的给药方案。
[0147]“个体”或“受试者”指哺乳动物,包括但不限于,驯养的动物(如,牛、绵羊、猫、狗和马)、灵长类动物(如,人类和非人类灵长动物,如猴子)、兔和啮齿动物(如,小鼠和大鼠)。
[0148]
各种实施方案的详述
[0149]
i.csf1r和csf1
[0150]
人csf1r(在本文中也称作“hucsf1r”)的序列和注释可在uniprot登录号p07333中找到,且全长972个氨基酸的序列如本文中的seq id no:70所示。食蟹猴csf1r(在本文中也称作“cynocsf1r”)的序列和注释可在uniprot登录号a0a2k5wg90中找到,且全长976个氨基酸的序列如本文中的seq id no:71所示。人csf1(其为csf1r的同源配体)的序列和注释可在nm_172212.2中找到。在本文其他处所描述的实施例中,使用包含人csf1的glu33
‑
ser190与n端his9
‑
(sggg)2
‑
iegr标签的较短重组csf1片段(“m
‑
csf1”)。
[0151]
下表1提供本公开使用的csf1r蛋白和重组m
‑
csf1多肽构建体的序列,及其序列标识符号的概述。序列也包含在随附的序列表中。
[0152]
表1:csf1r和csf1序列
[0153][0154]
[0155]
ii.il10
[0156]
下表2提供本公开实施例中使用的人il10多肽和两个重组il10
‑
fc融合体构建体的序列,及其序列标识符号的概述。序列也包含在随附的序列表中。
[0157]
表2:重组il10多肽(包括il10
‑
fc融合体)序列
[0158][0159][0160]
iii.抗csf1r抗体
[0161]
在一些实施方案中,本公开提供了抗csf1r抗体关于各种公知免疫球蛋白特征(如,cdrs、frs、v
h
、v
l
结构域,及全长重链和轻链)的氨基酸和编码核苷酸序列的结构。下表3提供本公开抗csf1r抗体序列(包括抗体融合体)及其序列标识符号的概述。序列包括在随附的序列表中。
[0162]
表3:抗csf1r抗体(包括抗体融合体)序列
[0163]
[0164]
[0165]
[0166]
[0167]
[0168]
[0169]
[0170][0171]
1.抗csf1r抗体结合亲和力和功能特征
[0172]
在一些实施方案中,本文提供的抗csf1r抗体以<100nm、<10nm、<1nm、<0.1nm、<0.01nm或<0.001nm(如,10
‑8m或以下,10
‑8m至10
‑
13
m,如,10
‑9m至10
‑
13
m)的平衡解离常数(k
d
)结合csf1r。
[0173]
考虑到如本文公开产生的各种抗csf1r抗体包括能够以高亲和力结合hu
‑
csf1r、cy
‑
csf1r及hu
‑
csf1r和cy
‑
csf1r两者的抗体。更特别地,在一些实施方案中,本公开的抗csf1r抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下或者1x10
‑
11
m或以下的结合亲和力结合hu
‑
csf1r。在一些实施方案中,结合亲和力测量为结合seq id no:70的hucsf1r多肽的平衡解离常数(k
d
)。在一些实施方案中,本公开的抗csf1r抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下或者1x10
‑
11
m或以下的结合亲和力结合cy
‑
csf1r。在一些实施方
案中,结合亲和力测量为结合seq id no:71的cynocsf1r多肽的平衡解离常数(k
d
)。在一些实施方案中,本公开的抗csf1r抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下或者1x10
‑
11
m或以下的结合亲和力结合hucsf1r和cynocsf1r两者。在一些实施方案中,结合亲和力测量为结合seq id no:70的hucsf1r多肽和seq id no:75的cynocsf1r多肽的平衡解离常数(k
d
)。
[0174]
通常,可使用多种测定方法中的任一者测定配体与其受体的结合亲和力,并以多种定量值表示。本文实施例中公开了可用于确定抗体亲和力的特定csf1r结合试验。此外,抗原结合试验为本领域已知,且可用于本发明中,包括但不限于,使用诸如蛋白质印迹法、放射免疫测定法、酶联免疫吸附测定法(elisa)、“夹心”免疫测定法、基于表面等离子体共振的试验(如wo2005/012359所述的biacore测定法)、免疫沉淀测定法、荧光免疫测定法、蛋白a免疫测定法、流式细胞术和荧光激活细胞分选(facs)测定法等的技术的任何直接或竞争性结合试验。
[0175]
因此,在一些实施方案中,结合亲和力以k
d
值表示,且反映出固有结合亲和力(如,以最小化的亲合力效应)。本公开的抗csf1r抗体对seq id no:70的hucsf1r多肽呈现强的结合亲和力,例如,呈现出k
d
值介于10nm与1pm之间。因此,本公开的抗csf1r抗体可与对csf1r的相同或重叠表位具有较低亲和力的抗体竞争。
[0176]
在一些实施方案中,本文提供的抗csf1r抗体减少、抑制和/或完全阻断csf1与csf1r的结合,以及由csf1与csf1r的结合所介导的免疫调节和/或免疫信号传导,包括在肿瘤微环境中tams的维持。利用已知的基于细胞的分析,包括本公开实施例中所描述的那些试验,可在体外测定抗体抑制这些由csf1与csf1r的结合所介导的免疫调节和免疫信号传导途径的能力。
[0177]
此外,本文提供的抗csf1r抗体包含与il10的抗体融合体,且因此可提供由il10激动剂活性介导的作用,包括活化肿瘤微环境中的cd8 t细胞。与il10的抗csf1r抗体融合体提供il10激动剂作用的能力可利用已知的基于细胞的分析在体外进行测定,包括本公开实施例所描述的那些基于细胞的分析。
[0178]
因此,在一些实施方案中,本公开的抗csf1r抗体特征在于一项或多项下列基于减少、抑制和/或完全阻断由csf1r所介导的细胞内信号传导的能力的功能特性。
[0179]
在至少一个实施方案中,抗csf1r抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下的结合亲和力结合人csf1r;任选地其中结合亲和力通过对seq id no:70的hucsf1r多肽的平衡解离常数(k
d
)测量。
[0180]
在至少一个实施方案中,抗csf1r抗体,该抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下的结合亲和力结合食蟹猴csf1r;任选地其中结合亲和力通过对seq id no:71的cynocsf1r多肽的平衡解离常数(k
d
)测量。
[0181]
在至少一个实施方案中,抗csf1r抗体,该抗体减少csf1诱导和il34诱导的hucsf1r或akt的磷酸化。
[0182]
在至少一个实施方案中,抗csf1r抗体,该抗体抑制csf1依赖性的和il34诱导的细胞增殖至少65%、至少75%、至少85%、至少95%或至少100%;任选地其中在csf1浓度为20ng/ml或il34浓度为33ng/ml时,抗体的ic
50
为5nm或以下、1nm或以下、0.5nm或以下或者0.1nm或以下。
[0183]
在至少一个实施方案中,抗csf1r抗体,该抗体抑制人cd14 单核细胞或单核细胞衍生的巨噬细胞的csf1依赖性存活至少65%、至少75%、至少85%、至少95%或至少100%;任选地其中在csf1浓度为100ng/ml时,抗体的ic
50
为5nm或以下、1nm或以下、0.5nm或以下或者0.1nm或以下。
[0184]
在至少一个实施方案中,抗csf1r抗体,该抗体增加对表达csf1r的293f细胞的nk细胞介导的adcc至少10%、至少20%或至少25%。
[0185]
在至少一个实施方案中,抗csf1r抗体,该抗体在21天测量的同基因小鼠肿瘤模型中减小肿瘤体积至少25%、至少50%、至少75%或以上,其中小鼠肿瘤模型选自:ct26 crc、emt6 tnbc、mc38 crc、renca rcc、ll/2肺癌、pan02 pdac、h22 hcc、q1 hnscc。
[0186]
在至少一个实施方案中,抗csf1r抗体,该抗体在ct26结肠肿瘤同基因小鼠模型中增加csf1和il34的血液水平至少50倍、至少100倍、至少200倍或至少500倍。
[0187]
在至少一个实施方案中,抗csf1r抗体,该抗体在ct26结肠肿瘤同基因小鼠模型中减少tam群体至少20%、至少30%、至少40%、至少50%、至少60%或以上;任选地其中mdsc群体减少小于10%、小于5%或更低。
[0188]
在至少一个实施方案中,抗csf1r抗体,该抗体增加mc/9细胞增殖至少25%、至少50%、至少100%、至少150%、至少200%或以上。
[0189]
在至少一个实施方案中,抗csf1r抗体,该抗体增加活化的cd8 t细胞的ifnγ和颗粒酶b产生至少25%、至少50%、至少100%或以上。
[0190]
在至少一个实施方案中,抗csf1r抗体,该抗体在ct26结肠肿瘤同基因小鼠模型中增加cd8 lag3 pd1 t细胞血液水平至少2倍、至少4倍、至少6倍、至少8倍、至少10倍或以上。
[0191]
2.抗csf1r抗体片段
[0192]
在一些实施方案中,本公开的抗csf1r抗体可为抗体片段。本公开的可用于结合决定簇的抗体片段包括但不限于,fab、fab'、fab'
‑
sh、f(ab’)2、fv、scfv片段、单价、单结构域抗体、一臂或单臂抗体及本文所述的和本领域已知的其他片段。因此,在本公开的抗csf1r抗体的一些实施方案中,抗体为选自由f(ab’)2、fab'、fab、fv、单结构域抗体(vhh)、单臂抗体和scfv的抗体片段。
[0193]
对于各种抗体片段的综述,参阅,如hudson等人,nat.med.9:129
‑
134(2003年)。对于scfv片段的综述,参阅,如pluckthun,the pharmacology of monoclonal antibodies,vol.113,rosenburg和moore eds.(springer
‑
verlag,new york),pp.269
‑
315(1994年);也参阅,wo93/16185;以及美国专利号5,571,894和5,587,458。针对包含挽救受体结合表位残基且具有增加的体内半衰期的fab和f(ab’)2片段的说明,参阅美国专利号5,869,046。其他单价抗体形式说明于,例如wo2007/048037、wo2008/145137、wo2008/145138和wo2007/059782中。单价、单臂抗体说明于,例如wo2005/063816中。双体抗体为具有两个抗原结合位点的抗体片段,其可为双价或双特异性的(参阅,如ep0404097;wo93/01161;hudson等人,nat.med.9:129
‑
134(2003年);以及hollinger等人,proc.natl.acad.sci.usa 90:6444
‑
6448(1993年))。
[0194]
在一些实施方案中,抗体片段为单结构域抗体,其包含抗体的重链可变域的全部或一部分或者轻链可变域的全部或一部分。在一些实施方案中,单结构域抗体为人单结构
域抗体(domantis,inc.,waltham,ma;参阅,如美国专利号6,248,516)。
[0195]
抗体片段可利用各种技术制造,包括但不限于,完整抗体的蛋白水解消化以及通过重组宿主细胞(如,大肠杆菌或噬菌体)产生,如本文所述。
[0196]
3.嵌合、人源化和人抗csf1r抗体
[0197]
在一些实施方案中,本公开的抗csf1r抗体可为嵌合抗体(参阅,如美国专利号4,816,567所描述的嵌合抗体;以及morrison等人,proc.natl.acad.sci.usa,81:6851
‑
6855(1984年))。在一个实施方案中,嵌合抗体包含非人可变区(如,源自小鼠、大鼠、仓鼠、兔或非人类灵长动物如猴子的可变区)及人恒定区。在一些实施方案中,嵌合抗体为“类别转换”的抗体,其中类别或亚类从亲本抗体的类别或亚类发生改变。预期嵌合抗体可包括其抗原结合片段。
[0198]
在一些实施方案中,本公开的抗csf1r抗体为人源化抗体。通常,非人抗体进行人源化以降低对人类的免疫原性,同时保留亲本非人抗体的特异性和亲和力。通常,人源化抗体包含一个或多个可变域,其中hvrs、cdrs(或其部分)是源自非人抗体,且frs(或其部分)是源自人抗体序列。人源化抗体任选地也包含至少一部分的人恒定区。在一些实施方案中,人源化抗体中的一些fr残基用来自非人抗体(如,cdr残基来源的抗体)的相应残基置换,以恢复或改善抗体特异性或亲和力。
[0199]
人源化抗体及其制备方法综述于,如,almagro和fransson,front.biosci.13:1619
‑
1633(2008年),且进一步说明于,如riechmann等人,nature 332:323
‑
329(1988年);queen等人,proc.nat
′
i acad.sci.usa 86:10029
‑
10033(1989年);美国专利号5,821,337、7,527,791、6,982,321和7,087,409;kashmiri等人,methods 36:25
‑
34(2005年)(描述sdr(a
‑
hvr)移植);padlan,mol.immunol.28:489
‑
498(1991年)(描述“表面重塑”);dall'acqua等人,methods 36:43
‑
60(2005年)(描述“fr改组”);以及osbourn等人,methods 36:61
‑
68(2005年)和klimka等人,br.j.cancer,83:252
‑
260(2000年)(描述fr改组的“指导选择”途径)。
[0200]
可用于人源化的人框架区包括但不限于,使用“最适化(best
‑
fit)”方法选择的框架区(参阅,如sims等人j.immunol.151:2296(1993年));源自特定亚组的轻链或重链可变区的人抗体共有序列的框架区(参阅,如carter等人,proc.natl.acad.sci.usa,89:4285(1992年);以及presta等人,j.immunol,151:2623(1993年));人成熟(体细胞突变)框架区或人种系框架区(参阅,如almagro和fransson,front.biosci.13:1619
‑
1633(2008年));以及源自筛选fr文库的框架区(参阅,如baca等人,j.biol.chem.272:10678
‑
10684(1997年)及rosok等人,j.biol.chem.271:22611
‑
22618(1996年))。
[0201]
在一些实施方案中,本公开的抗csf1r抗体可为人抗体。人抗体可利用本领域中已知的各种技术产生。人抗体通常描述于van dijk和van de winkel,curr.opin.pharmacol.5:368
‑
74(2001年)及lonberg,curr.opin.immunol.20:450
‑
459(2008年)中。可通过对转基因动物施用免疫原制备人抗体,该转基因动物经修饰以响应于抗原性攻击产生完整人抗体或具有人可变区的完整抗体。此类动物通常含有人免疫球蛋白基因座的全部或一部分,其取代内源性免疫球蛋白基因座,或其存在于染色体外或随机整合至动物染色体中。在这种转基因小鼠中,内源性免疫球蛋白基因座通常被灭活。对于从转基因动物获得人抗体的方法的综述,参阅lonberg,nat.biotech.23:1117
‑
1125(2005年)。
也参阅,如美国专利号6,075,181和6,150,584中的xenomouse
tm
技术;美国专利号5,770,429中的技术;美国专利号7,041,870中的k
‑
m技术;以及美国专利申请公开号2007/0061900中的技术。来自由此类动物产生的完整抗体的人可变区可进一步修饰,如通过与不同的人恒定区组合。
[0202]
人抗体也可通过基于杂交瘤的方法产生。用于产生人单克隆抗体的人骨髓瘤和小鼠
‑
人异种骨髓瘤细胞系已有描述。参阅,如kozbor j.immunol,133:3001(1984年);brodeur等人,monoclonal antibody productiontechniques and applications,pp.51
‑
63(marcel dekker,inc.,new york,1987年);以及boerner等人,j.immunol.,147:86(1991年)。通过人b细胞杂交瘤技术产生的人抗体还描述于li等人,proc.natl.acad.sci.usa,103:3557
‑
3562(2006年)中。另外的方法包括描述于,例如美国专利号7,189,826(描述由杂交瘤细胞系产生单克隆人igm抗体)中的那些。人杂交瘤技术(三源杂交瘤(trioma)技术)还描述于vollmers和brandlein,histology and histopathology,20(3):927
‑
937(2005年)及vollmers和brandlein,methods and findings in experimental and clinical pharmacology,27(3):185
‑
91(2005年)中。
[0203]
还可通过分离fv克隆可变域序列(其选自人来源的噬菌体展示文库)产生人抗体。此类可变域序列可随后与所需的人恒定域组合。从抗体文库选择人抗体的技术描述如下。
[0204]
4.文库来源的抗csf1r抗体变体
[0205]
在至少一个实施方案中,通过筛选组合文库中具有所需改善的功能特性(如,结合亲和力或交叉反应性)的抗体,可分离改善的抗csf1r抗体的变体。例如,本领域已知用于产生噬菌体展示文库和筛选此类文库中具有改善的结合特性的变体抗体的多种方法。其他用于产生此类文库来源的抗体的方法可于,如hoogenboom等人,methods in molecular biology 178:1
‑
37(o'brien等人,ed.,humana press,totowa,nj,2001年);mccafferty等人,nature 348:552
‑
554;clackson等人,nature 352:624
‑
628(1991年);marks等人,j.mol.biol.222:581
‑
597(1992年);marks和bradbury,m methods in molecular biology 248:161
‑
175(lo,ed.,humana press,totowa,nj,2003年);sidhu等人,j.mol.biol.338(2):299
‑
310(2004年);lee等人,j.mol.biol.340(5):1073
‑
1093(2004年);fellouse,proc.natl.acad.sci.usa 101(34):12467
‑
12472(2004年);以及lee等人,j.immunol.methods 284(1
‑
2):119
‑
132(2004年)中发现。
[0206]
5.多特异性抗体
[0207]
在至少一个实施方案中,考虑到本公开的抗csf1r抗体可为多特异性抗体,如,双特异性抗体。在一些实施方案中,多特异性抗体具有至少两个不同的结合位点,每一个具有对不同抗原的结合特异性,其中至少一个特异性地结合csf1r。在至少一个实施方案中,考虑到多特异性抗体为包含对csf1r的特异性和对另一介导免疫调节、免疫信号传导和/或在癌症或肿瘤细胞上表达的抗原的特异性的双特异性抗体。例如,另一特异性可针对免疫检查点分子,如pd1、lag3、ctla
‑
4、a2ar、tim
‑
3、btla、cd276、cd328、vtcn1、ido、kir、nox2、vista、ox40、cd27、cd28、cd40、cd122、cd137、gitr或icos。
[0208]
制备多特异性抗体的技术包括但不限于,具有不同特异性的两个免疫球蛋白重链
‑
轻链对的重组共表达(参阅,如milstein和cuello,nature 305:537(1983年)、wo 93/
08829和traunecker等人,emboj.10:3655(1991年))。“杵
‑
臼(knob
‑
in
‑
hole)”工程还可用于产生可用于本公开的抗csf1r抗体的双特异性抗体。杵
‑
臼工程的技术为本领域中已知,且描述于,如美国专利号5,731,168中。
[0209]
多特异性抗体还可通过对有利于形成fc杂二聚体抗体分子而非同型二聚体的“静电转向(electrostatic steering)”效应工程化(wo2009/089004a1);交联两个或更多个抗体或片段(参阅,如美国专利号4,676,980和brennan等人,science,229:81(1985年));利用亮氨酸拉链以产生双特异性抗体(参阅,如kostelny等人,j.immunol,148(5):1547
‑
1553(1992年));利用“双体抗体”技术制备双特异性抗体片段(参阅,如hollinger等人,proc.natl.acad.sci.usa,90:6444
‑
6448(1993年));利用单链fv(scfv)二聚体(参阅,如gruber等人,j.immunol,152:5368(1994年));或三特异性抗体(参阅,如tutt等人,j.immunol.147:60(1991年)来制备。
[0210]
6.抗csf1r抗体的变体
[0211]
在一些实施方案中,预期本公开的抗csf1r抗体的变体具有改善的特性,如抗体的结合亲和力和/或其他生物学性质。可通过将适当的修饰引入编码抗体的核苷酸序列中,或通过肽合成来制备变体。此类修饰包括,例如,在抗体的氨基酸序列内残基的删除和/或插入和/或置换。可进行删除、插入和置换的任意组合以得到最终的构建体,只要该最终的构建体具有所需的csf1r抗原结合的特性。
[0212]
a.置换、插入和删除变体
[0213]
在一些实施方案中,除了本文所述的那些,提供具有一个或多个氨基酸置换的抗csf1r抗体变体。用于诱变的位点可包括hvrs和frs。典型的“保守”氨基酸置换和/或基于共同的侧链类别或性质的置换为本领域中公知的,且可在本公开的实施方案中使用。本公开还考虑基于非保守氨基酸置换的变体,其中氨基酸侧链类别之一的成员交换为另一类别的氨基酸。氨基酸侧链通常依据下列类别或共同特性进行分组:(1)疏水性:met、ala、val、leu、ile、正亮氨酸;(2)中性亲水性:cys、ser、thr、asn、gln;(3)酸性:asp、glu;(4)碱性:his、lys、arg;(5)链取向影响:gly、pro;以及(6)芳香族:trp、tyr、phe。本领域公知用于将氨基酸置换到抗体中和随后筛选所需功能的技术,例如,保持/改善的抗原结合、降低的免疫原性或者改善的adcc或cdc。
[0214]
氨基酸置换变体也可包括具有在亲本抗体的高变区中一个或多个置换的变体。通常,相对于亲本抗体,选择用于进一步研究的所得变体具有特定生物学特性的改变(如,亲和力增加、免疫原性降低),和/或保留亲本抗体的特定生物学特性。示例性的置换变体为亲和力成熟的抗体,其可利用基于噬菌体展示的亲和力成熟技术方便地产生。简言之,一个或多个hvr残基发生突变,且变体抗体在噬菌体上展示并针对特定生物学活性(如,结合亲和力)进行筛选。
[0215]
用于鉴定可靶向用于诱变的抗体残基或区域的一种有用的方法为“丙氨酸扫描诱变”(参阅,如cunningham和wells(1989)science,244:1081
‑
1085)。在此方法中,鉴定残基或靶残基的组(如,带电的残基,如arg、asp、his、lys和glu)并用中性或带负电的氨基酸(如,ala或聚丙氨酸)替代以确定抗体与抗原的相互作用是否受到影响。可在表明对初始置换的功能敏感性的氨基酸位置处引入进一步的置换。可选地或另外地,可确定抗原
‑
抗体复合物的晶体结构以鉴定抗体与抗原之间的接触点。此类接触残基和邻近残基可被靶向或消
除以作为置换的候选。可筛选变体以确定其是否包含所需的特性。
[0216]
可制备的氨基酸序列插入包括氨基和/或羧基末端融合体,其长度范围为一个残基至含有一百个或以上残基的多肽,以及单一或多个氨基酸残基的序列内插入。末端插入的实例包括具有n端甲硫基残基的抗体。抗体分子的其他插入性变体可包括抗体的n端或c端与酶或多肽(其增加抗体血清半衰期)的融合体。
[0217]
可在hvrs中进行其他残基置换以改善抗体亲和力。此类改变可在“热点”中进行,即由在体细胞成熟过程中经历高频突变的密码子编码的残基(参阅,如chowdhury,methods mol.biol.207:179
‑
196(2008年)),其中测试所得变体v
h
或v
l
的结合亲和力。在一个实施方案中,可以通过构建并从二级文库中再筛选进行亲和力成熟(参阅,如hoogenboom等人,methods in molecular biology 178:1
‑
37(o'brien等人,ed.,human press,totowa,nj(2001年))。引入多样性的另一种方法涉及hvr定向途径,其中将数个hvr残基(如,一次4
‑
6个残基)随机化。利用诸如丙氨酸扫描诱变或建模,可特别地鉴定出参与抗原结合的hvr残基。特别地,经常靶向hvr
‑
h3和hvr
‑
l3。通常,可在一个或多个hvrs内进行置换、插入或删除,只要此类改变不实质上降低抗体结合抗原的能力。例如,可在hvrs中进行不实质上降低结合亲和力的保守性改变(如,本文提供的保守性置换)。此类改变可在hvr“热点”之外。
[0218]
在一些实施方案中,考虑到本文所述的抗csf1r抗体可在特定非hvr位置以半胱氨酸残基置换,从而产生反应性巯基。此类工程化的“thiomabs”可用于将抗体与,如,药物部分或接头
‑
药物部分缀合,从而产生免疫缀合物,如本文他处所述。半胱氨酸工程抗体的产生可如在例如美国专利号7,521,541中所述。在一些实施方案中,下列抗体残基中的任一个或多个可以用半胱氨酸置换:轻链的v205(kabat编号);重链的a118(eu编号);以及重链fc区的s400(eu编号)。
[0219]
b.糖基化变体
[0220]
在一些实施方案中,本公开的抗csf1r抗体经改变以增加或减少该抗体糖基化的程度。通过改变氨基酸序列可进行抗体糖基化位点的添加或删除,从而产生或移除一个或多个糖基化位点。在其中抗体包含fc区的实施方案中,可改变连接至fc区的糖。通常,由哺乳动物细胞产生的天然抗体包含分支的双触角寡糖,该寡糖通过n
‑
连接附接于fc区ch2结构域的约297位的天冬酰胺(“n297”)(参阅,如wright等人,tibtech 15:26
‑
32(1997年))。寡糖可包括各种碳水化合物,如甘露糖、n
‑
乙酰基葡萄糖胺(glcnac)、半乳糖和唾液酸,以及在双触角寡糖结构的“茎”中连接至glcnac的岩藻糖。在一些实施方案中,抗体fc区寡糖的修饰可产生具有某些改善的特性的变体。
[0221]
在一些实施方案中,本公开的抗csf1r抗体可为包含缺乏连接(直接或间接)至fc区的岩藻糖的糖结构的变体。例如,岩藻糖在这种抗体中的量可为约1%至约80%、约1%至约65%、约5%至约65%或约20%至约40%。岩藻糖的量可通过计算相对于n297处连接的所有糖
‑
结构(如复杂、杂合和高级甘露糖结构)的总和,连接至残基n297的糖链中岩藻糖的平均量而确定,如通过maldi
‑
tof质谱测量的(参阅,如wo 2008/077546)。
[0222]
在一些实施方案中,岩藻糖基化变体可提供变体抗体的改善的adcc功能。参阅,如美国专利公开号us 2003/0157108或us 2004/0093621。“去岩藻糖基化”或“岩藻糖缺失”抗体的实例及制备其的相关方法公开于,如us2003/0157108;us2003/0115614;us2002/0164328;us2004/0093621;us2004/0132140;us2004/0110704;us2004/0110282;us2004/
acad.sci.usa 83:7059
‑
7063(1986年))及hellstrom等人,proc.nat'l acad.sci.usa 82:1499
‑
1502(1985年);5,821,337(参阅,bruggemann,m.等人,j.exp.med.166:1351
‑
1361(1987年))中。或者,可使用非放射性测定法,参阅,如用于流式细胞术的acti
tm
非放射性细胞毒性测定法(celltechnology,inc.,mountain view,ca);以及非放射性细胞毒性测定法(promega,madison,wi)。此类测定的有用效应细胞包括外周血单核细胞(pbmc)和自然杀伤(nk)细胞。可选地或另外地,可体内评估感兴趣分子的adcc活性,如,在动物模型中,如clynes等人,proc.nat'l acad.sci.usa 95:652
‑
656(1998年)中公开的。也可进行clq结合试验以确认抗体无法结合clq,从而缺乏cdc活性。参阅,如wo2006/029879和wo2005/100402中的clq和c3c结合elisa。为评估补体激活,可进行cdc测定(参阅,如gazzano
‑
santoro等人,j.immunol.methods 202:163(1996年);cragg,m.s.等人,blood 101:1045
‑
1052(2003年);以及cragg,m.s.和m.j.glennie,sw 103:2738
‑
2743(2004年))。fcrn结合和体内清除率/半衰期的测定可利用本领域中已知的方法进行(参阅,如petkova等人,intl.immunol.18(12):1759
‑
1769(2006年))。
[0229]
d.非蛋白质抗体衍生物
–
免疫缀合物
[0230]
在一些实施方案中,本公开的抗csf1r抗体可进一步用非蛋白质部分修饰(即衍生化)。适合于抗体衍生化的非蛋白质部分包括但不限于,水溶性聚合物,例如:聚乙二醇(peg)、乙二醇和丙二醇共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚
‑
1,3
‑
二氧戊环、聚
‑
1,3,6
‑
三氧杂环己烷、乙烯/马来酸酐共聚物、聚氨基酸均聚物或无规共聚物及葡聚糖或聚(n
‑
乙烯基吡咯烷酮)聚乙二醇、丙二醇(propropylene glycol)均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙基化多元醇(如,甘油)、聚乙烯醇,及其混合物。在一些实施方案中,可利用甲氧基
‑
聚乙二醇丙醛进行抗体的修饰。聚合物可为任何分子量的,且可为分支或非分支的。连接于抗体的聚合物的数量可变化,且如果连接超过一个聚合物,其可为相同或不同的分子。通常,用于衍生化的聚合物的数量和/或类型可基于包括但不限于以下的考虑因素确定:抗体的特定性质或功能,例如,抗体衍生物是否在规定的条件下用于治疗。
[0231]
在一些实施方案中,本公开的抗csf1r抗体也可为免疫缀合物,其中该免疫缀合物包含与一个或多个细胞毒性剂缀合的抗csf1r抗体。本公开考虑的合适细胞毒性剂包括化疗剂、药物、生长抑制剂、毒素(如,蛋白毒素,细菌、真菌、植物或动物源的酶活性毒素,或其片段)或放射性同位素。在一些实施方案中,免疫缀合物为抗体
‑
药物缀合物(adc),其中本文所述的抗csf1r抗体与一个或多个药物缀合。在一些实施方案中,本公开的免疫缀合物包含缀合至用于治疗csf1r介导的疾病或病症的药物或治疗剂的本文所述的抗csf1r抗体。
[0232]
在一些实施方案中,本文所述的抗csf1r抗体可缀合至酶活性毒素或其片段,包括但不限于白喉a链、白喉毒素的非结合活性片段、外毒素a链(来自绿脓杆菌(pseudomonas aeruginosa))、蓖麻毒素a链、相思豆素素a链、蒴莲根毒素a链、α
‑
帚曲霉素(alpha
‑
sarcin)、油桐(aleurites fordii)蛋白、石竹素蛋白、美洲商陆(phytolaca americana)蛋白、苦瓜(momordica charantia)抑制剂、泻果素、巴豆毒素、肥皂草(sapaonaria officinalis)抑制剂、白树毒素、丝林霉素(mitogellin)、局限曲菌素、酚霉素(phenomycin)、依诺霉素和单端孢霉烯类(tricothecenes)。
[0233]
在一些实施方案中,本公开的免疫缀合物包含缀合至放射性同位素的本文所述的
抗csf1r抗体(即放射缀合物)。许多放射性同位素可用于产生此类放射缀合物。实例包括
211
at、
131
i、
125
i、
90
y、
186
re、
188
re、
153
sm、
212
bi、
32
p、
212
pb和lu的放射性同位素。在一些实施方案中,免疫缀合物可包含用于闪烁显影检测的放射性同位素,或用于nmr检测或mri的自旋标记。适合的放射性同位素或自旋标记可包括例如
123
i,
131
i,
111
in,
13
c,
19
f,
15
n,
17
o,gd、mn和fe的各种同位素。
[0234]
抗csf1r抗体与细胞毒性剂的免疫缀合物可使用适合于与蛋白质缀合的多种公知双功能试剂和化学作用制造。此类试剂包括但不限于:n
‑
琥珀酰亚胺基
‑3‑
(2
‑
吡啶基二硫代)丙酸酯(spdp)、琥珀酰亚胺基
‑4‑
(n
‑
马来酰亚胺基甲基)环己烷
‑1‑
羧酸酯(smcc)、亚胺基硫烷(it)、亚氨基酯的双功能衍生物(如,二甲基己二亚酰胺化物hq)、活性酯类(如,辛二酸二琥珀酰亚胺基酯)、醛类(如,戊二醛)、双叠氮基化合物(如,双
‑
(对叠氮基苯甲酰基)
‑
己二胺)、双重氮衍生物(如,双
‑
(对重氮基苯甲酰)
‑
乙二胺)、二异氰酸酯类(如,甲苯
‑
2,6
‑
二异氰酸酯)和双活性氟化合物(如,1,5
‑
二氟
‑
2,4
‑
二硝基苯)。用于制备本公开免疫缀合物的试剂也可包括市售“交联”试剂,例如:bmps、emcs、gmbs、hbvs、lc
‑
smcc、mbs、mpbh、sbap、sia、siab、smcc、smpb、smph、磺基
‑
emcs、磺基
‑
gmbs、磺基
‑
kmus、磺基
‑
mbs、磺基
‑
siab、磺基
‑
smcc和磺基
‑
smpb及svsb(琥珀酰亚胺基
‑
(4
‑
乙烯基砜)苯甲酸酯)(参阅,如pierce biotechnology,inc.,rockford,il.,u.s.a)。
[0235]
iv.重组方法和组合物
[0236]
本公开的抗csf1r抗体可使用抗体生产领域中公知的重组方法和材料产生。在一些实施方案中,本公开提供编码抗csf1r抗体的分离的核酸。该核酸可编码包含抗体的v
l
的氨基酸序列和/或包含抗体的v
h
的氨基酸序列(如,抗体的轻链和/或重链)。在一些实施方案中,提供一个或多个包含编码本公开的抗csf1r抗体的核酸序列的载体(如,表达载体)。在一些实施方案中,提供包含编码本公开的抗csf1r抗体的核酸序列的宿主细胞。在一个实施方案中,宿主细胞用包含编码含有抗体的v
l
的氨基酸序列和含有抗体的v
h
的氨基酸序列的核酸序列的载体转化。在另一实施方案中,宿主细胞用包含编码含有抗体的v
l
的氨基酸序列的核酸的第一载体和包含编码含有抗体的v
h
的氨基酸序列的核酸的第二载体转化。
[0237]
在重组方法的一些实施方案中,所使用的宿主细胞为真核细胞,如中国仓鼠卵巢(cho)细胞或淋巴样细胞(如,y0、ns0、sp20)。在一个实施方案中,提供制备抗csf1r抗体的方法,其中该方法包括在适于抗体表达的条件下培养如前面所提供的含有编码抗体的核酸的宿主细胞,且任选地从宿主细胞(或宿主细胞培养基)回收抗体。
[0238]
简言之,通过分离编码抗体的核酸(如,本文所述的)并将此核酸插入一个或多个载体中用于进一步克隆和/或在宿主细胞中表达来进行抗csf1r抗体的重组产生。此类核酸易于使用本领域公知的常规程序分离和测序(如,通过利用能够特异性地结合编码所需抗体的重链和轻链的基因的寡核苷酸探针)。用于克隆或表达抗体编码载体的合适宿主细胞和培养方法为本领域中公知的,且包括原核或真核细胞。通常,在表达之后,抗体可在可溶部分中从细胞浆分离,并进一步纯化。除了原核生物以外,真核微生物(如丝状真菌或酵母)为用于抗体编码载体的合适克隆或表达宿主,包括其糖基化途径经“人源化”的真菌与酵母菌株,从而导致产生具有部分或完全人糖基化模式的抗体(参阅,如gerngross,nat.biotech.22:1409
‑
1414(2004年),及li等人,nat.biotech.24:210
‑
215(2006年))。
[0239]
适合于表达本公开的糖基化抗csf1r抗体的宿主细胞也可源自多细胞生物体(无
international,inc.)。
[0245]
也考虑本文公开的制剂可含有除了抗csf1r以外的活性成分,如对于施用该制剂的受试者中所治疗的特定适应症必要的。优选地,任何附加的活性成分具有与抗csf1r抗体活性互补的活性,且所述活性不会不利地彼此影响。
[0246]
如本文其他处(包括实施例)所公开的,已证明本公开的抗csf1r抗体可结合il10多肽使用以在癌症治疗中提供改善的治疗效果。因此,在一些实施方案中,本公开提供一种可用于治疗癌症的药物组合物或制剂,其包含csf1r拮抗剂(如,抗csf1r)和il10激动剂(如,il10)。此外,将本公开抗csf1r抗体用作此类药物制剂或组合物中的csf1r拮抗剂,还考虑可以使用其他拮抗剂,包括但不限于shrna、sirna、mirna、csf1r的小分子抑制剂或其组合。可用于此类药物组合物或制剂中的csf1r的小分子抑制剂可包括临床开发中的已知化合物,包括但不限于,培西达替尼、arry
‑
382、prv
‑
6527、blz
‑
945、dcc
‑
3014和plx
‑
7486。除了本公开的抗csf1r抗体外,可用于与il10的这种组合药物组合物或制剂中的其他已知抗csf1r抗体可包括结合csf1r的任何已知抗体,包括癌症治疗的临床开发中的那些,如依米妥珠单抗(emactuzumab)、卡比拉单抗(cabiralizumab)、amg820和ly3022855。
[0247]
如本文其他处所述的,在一些实施方案中,本公开提供用于组合治疗的药物组合物或制剂,其包含csf1r拮抗剂和il10激动剂。在一些实施方案中,此组合可作为单一药物组合物或制剂提供,其包含具有通过多肽接头(如,seq id no:78的14个氨基酸的接头)与il10共价融合的抗csf1r抗体的抗csf1r抗体融合体。本文另外提供了证明此类抗csf1r抗体融合体(如,6d4/il10、6d4/(il10)2、6d4.hu22/il10等)及其在药物组合物中减少多种同基因小鼠癌症模型的肿瘤体积的用途的实例。
[0248]
在一些实施方案中,药物组合物包含抗csf1r抗体和用于癌症治疗的另外的活性剂,如免疫检查点抑制剂。可用于此类实施方案的免疫检查点抑制剂包括但不限于,包含对作为免疫检查点分子的抗原的特异性的第二抗体。在一些实施方案中,第二抗体包含对免疫检查点分子的特异性,该免疫检查点分子选自pd1、pd
‑
l1、lag3、ctla
‑
4、a2ar、tim
‑
3、btla、cd276、cd328、vtcn1、ido、kir、nox2、vista、ox40、cd27、cd28、cd40、cd122、cd137、gitr、icos。在至少一个实施方案中,药物组合物包含抗csf1r抗体和另外的活性剂,其中另外的活性剂为包含对免疫检查点分子pd1的特异性的抗体。可用于本文公开的药物组合物实施方案中的包含对pd1的特异性的示例性抗体包括但不限于,多塔利单抗(dostarlimab)、派姆单抗、纳武单抗和匹地利珠单抗(pidilizumab)。
[0249]
在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米颗粒和纳米胶囊)或在粗乳液中,活性成分可分别包埋在,例如,通过凝聚技术或通过界面聚合制备的微胶囊中,例如,羟甲基纤维素或明胶
‑
微胶囊和聚(甲基丙烯酸甲酯)微胶囊。此类技术公开于remington's pharmaceutical sciences 16th edition,osol,a.ed.(1980年)中。
[0250]
在一些实施方案中,制剂可为抗体和/或其他活性成分的持续释放制剂。持续释放制剂的合适实例包括含有该抗体的固体疏水性聚合物的半透性基质,该基质为成型物品的形式,例如,薄膜或微胶囊。
[0251]
通常,待向受试者施用的本公开的制剂是无菌的。无菌制剂可易于使用公知的技术制备,例如,通过无菌滤膜过滤。
[0252]
vi.治疗的用途和方法
[0253]
预期含有本公开的抗csf1r抗体的任何组合物或制剂可用于任何方法或用途,例如,利用其特异性结合csf1r的能力且从而抑制、降低和/或完全阻断csf1r作为参与免疫调节或信号传导的受体的功能(特别是csf1r调控肿瘤相关巨噬细胞(tams)的存活和维持的功能)的治疗方法。tams为肿瘤微环境(tme)中的主要细胞组分,且显著促进肿瘤生长和进展。抑制csf1r信号传导可耗尽tams,从而诱导抗肿瘤t细胞反应增加。
[0254]
存在可以通过抑制、降低和/或完全阻断csf1r的免疫调节和/或免疫信号传导活性(特别是csf1r对tams的作用)潜在治疗的多种疾病、失调和病症。疾病、失调和病症包括但不限于,癌症,其包括但不限于,结肠癌、胰腺癌、卵巢癌、hcc、肾癌、乳腺癌、肺癌、胃癌、头颈癌或口腔癌。预期含有本公开抗csf1r抗体(包括与il10多肽的抗csf1r抗体融合体)的任何组合物或制剂可用于治疗任一上述癌症的方法或用途。在一些实施方案中,癌症选自结肠癌、胰腺癌、卵巢癌、hcc、肾癌、乳腺癌、肺癌、胃癌、头颈癌或口腔癌。在一些实施方案中,本公开提供一种治疗受试者癌症的方法,该方法包括向有需要的受试者施用治疗有效量的本公开抗csf1r抗体或向受试者施用治疗有效量的包含本公开抗csf1r抗体和药学上可接受载体的药物组合物。
[0255]
如本文所公开的,包括在以下实施例中,本公开的抗csf1r抗体具有减少、抑制和/或阻断csf1结合csf1r的能力,从而改变csf1与csf1r介导的免疫信号传导途径的相互作用。因此,在一些实施方案中,本公开提供治疗受试者的csf1r介导的疾病或病症的方法,该方法包括向受试者施用治疗有效量的本公开抗csf1r抗体或向有需要的受试者施用治疗有效量的含有本公开抗csf1r抗体和药学上可接受载体的药物组合物。类似地,在一些实施方案中,本公开提供治疗受试者的通过结合细胞上表达的csf1r所介导的疾病的方法,该方法包括向受试者施用治疗有效量的本公开抗csf1r抗体或向有需要的受试者施用治疗有效量的包含本公开抗csf1r抗体和药学上可接受载体的药物组合物。
[0256]
依据治疗方法施用抗csf1r抗体、组合物或药物制剂提供抗体诱导的治疗效果,其保护受试者免于csf1r介导的疾病进展和/或治疗受试者的csf1r介导的疾病进展。在一些实施方案中,治疗方法可进一步包括施用本领域技术人员已知的一种或多种另外的治疗剂或治疗以预防和/或治疗csf1r介导的疾病或病症。包括施用一种或多种另外的药剂的此类方法可包括组合施用(其中两种或更多种治疗剂包括在相同或分开的制剂中)及单独施用,在该情况中,抗体组合物或制剂的施用可在施用另外的治疗剂之前、同时和/或之后进行。
[0257]
细胞因子il10表现出抗炎及cd8 t细胞活化特性。强的il
‑
10信号可促进肿瘤特异性cd8 t细胞增殖,使耗竭的t细胞恢复活力,从而增加t细胞的细胞毒性。因此,在至少一个实施方案中,本公开考虑使用csf1r拮抗剂(如,抗csf1r抗体)与il10激动剂组合的治疗方法。在至少一个实施方案中,这种组合治疗可以使用与il10多肽的抗csf1r抗体融合体进行。如本文所公开的,csf1r抑制以减少免疫抑制性tams以及tme中附近的集中il10信号以增强cd8 t细胞的细胞毒性的组合可提供改善的癌症治疗。因此,在使用本公开抗csfr1抗体治疗csf1r介导的疾病(如,癌症)的方法的任一实施方案中,考虑抗csf1r抗体可为如本文其他处所公开的与il10多肽的抗体融合体(或融合蛋白)。
[0258]
也考虑其他csf1拮抗剂可用于与il10的这一组合治疗,包括但不限于,shrna、sirna、mirna或csf1r的小分子抑制剂,或其组合。可用于这种方法的csf1r的小分子抑制剂可包括临床开发中的已知csf1r抑制剂化合物,如培西达替尼、arry
‑
382、prv
‑
6527、blz
‑
945、dcc
‑
3014和plx
‑
7486。此外,其他已知的csf1r拮抗剂抗体可用于与il10的这一组合治疗中,包括已知的阻断csf1r的抗体,包括用于癌症治疗的临床开发中的那些,如依米妥珠单抗、卡比拉单抗、amg820和ly3022855。
[0259]
在本公开治疗方法的一些实施方案中,抗csf1r抗体或包含抗csf1r抗体的药物制剂通过系统性地递送药剂的任何施用方式向受试者施用,或施用至所需的靶组织。系统性施用通常指在除了直接施用至所需的靶位点、组织或器官中以外的位点处将抗体施用到受试者中的任一施用方式,以使得抗体或其制剂进入受试者的循环系统,且因此经历代谢及其他类似过程。
[0260]
因此,可用于本公开治疗方法的施用方式可包括但不限于,注射、输注、滴注和吸入。注射施用可包括静脉内、肌肉内、动脉内、鞘内、脑室内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、包膜下、蛛网膜下、椎管内、脑脊髓内和胸骨内注射和输注。
[0261]
在一些实施方案中,抗csf1r抗体的药物制剂经配制,使得保护抗体免于在肠道中失活。因此,治疗方法可包括口服施用制剂。
[0262]
在一些实施方案中,还提供包含本公开的抗csf1r抗体的组合物或制剂作为药物的用途。此外,在一些实施方案中,本公开还提供包含抗csf1r抗体的组合物或制剂在制造或制备药物,特别是用于治疗、预防或抑制csf1r介导的疾病的药物中的用途。在进一步的实施方案中,药物用于治疗、预防或抑制csf1r介导的疾病的方法中,包括向具有csf1r介导的疾病的个体施用有效量的药物。在特定实施方案中,药物进一步包含有效量的至少一种另外的治疗剂或治疗。在至少一个实施方案中,另外的治疗剂或治疗为il10激动剂,如il10多肽,其结合抗csf1r抗体(而非作为抗体融合体)施用。
[0263]
如本文其他处所公开的,还考虑,可在具有本公开抗csf1r抗体的这种药物中使用的另外治疗剂或治疗可包括但不限于,包含对免疫检查点分子的特异性的治疗性抗体,该免疫检查点分子如pd1、pd
‑
l1、lag3、ctla
‑
4、a2ar、tim
‑
3、btla、cd276、cd328、vtcn1、ido、kir、nox2、vista、ox40、cd27、cd28、cd40、cd122、cd137、gitr、icos。包含对免疫检查点分子的特异性的示例性抗体包括但不限于抗pd1抗体,其选自多塔利单抗、派姆单抗、纳武单抗和匹地利珠单抗。
[0264]
在进一步的实施方案中,药物用于治疗、抑制或预防受试者的csf1r介导的疾病,如癌症,包括向受试者施用有效量的药物以治疗、抑制或预防csf1r介导的疾病。
[0265]
本公开的组合物和制剂中包含的抗csf1r抗体的适宜剂量(当单独或结合一种或多种另外的治疗剂使用时)取决于所治疗的特定疾病或病症、疾病的严重程度与病程、是出于预防还是治疗目的而施用抗体、先前施用于患者的治疗、患者的临床病史和对抗体的反应,及主治医师的判断。包括于本文所述的组合物和制剂中的抗csf1r抗体可一次或通过一系列治疗适当地施用于患者。本文考虑各种给药时间表,包括但不限于,在各个时间点上的单次或多次施用、推注施用和脉冲输注。
[0266]
取决于疾病的类型和严重程度,本公开制剂中约1μg/kg至15mg/kg的抗csf1r抗体为用于施用于人类受试者的初始候选剂量,无论是例如通过一次或多次单独施用,或通过连续输注。通常,抗体的施用剂量范围为约0.05mg/kg至约10mg/kg。在一些实施方案中,可对患者施用一个或多个约0.5mg/kg、2.0mg/kg、4.0mg/kg或10mg/kg(或其任意组合)的剂量。
[0267]
剂量施用可维持数天或更久,其取决于受试者的状况,例如,施用可持续直到csf1r介导的疾病得到充分治疗,如通过本领域已知方法确定的。在一些实施方案中,可施用初始的较高负荷剂量,接着施用一个或多个较低剂量。然而,其他剂量方案可能是有用的。可通过常规技术和测定法监测剂量施用的治疗效果的进展。
[0268]
因此,在本公开的方法的一些实施方案中,抗csf1r抗体的施用包括约1mg/kg至约100mg/kg的每日剂量。在一些实施方案中,抗csf1r抗体的剂量包括至少约1mg/kg、至少约5mg/kg、至少约10mg/kg、至少约20mg/kg或至少约30mg/kg的每日剂量。
[0269]
实施例
[0270]
本公开的各种特征及实施方案在以下列代表性实施例中说明,其旨在说明而非限制。本领域技术人员将易于理解,特定实施例仅为如随附的权利要求中更充分描述的本发明的说明。本技术中所描述的每一实施方案和特征应理解为可与本技术内包含的每一实施方案互换和组合。
[0271]
实施例1:抗csf1r抗体的产生
[0272]
本实施例说明使用杂交瘤技术产生本公开的两种示例性抗csf1r单克隆抗体hy6d4和hy6m6。
[0273]
a.产生抗csf1r抗体的杂交瘤细胞系的生成
[0274]
材料和方法:13只小鼠用重组人csf1r细胞外结构域(ecd)
‑
fc融合蛋白(r&d systems)进行免疫。将来自免疫的小鼠的脾细胞分离,并使用基于peg的标准方案与小鼠骨髓瘤细胞系融合以产生杂交瘤。将杂交瘤接种于96孔平底微量滴定板中,接着在选择培养基中孵育2至4周。随后,在体外培养稳定的亚克隆以在组织培养基中产生抗体用于表征。如下所述,杂交瘤的培养上清液筛选与人csf1r(seq id no:70)的结合以及抑制配体诱导的aml5增殖的能力。从选择的杂交瘤上清液纯化的抗体进一步分析csf1r表位结合特性、阻断配体结合人csf1r的能力、结合食蟹猴csf1r的能力以及抑制配体诱导的csf1r磷酸化的能力。
[0275]
b.csf1r特异性elisa
[0276]
材料与方法:将重组人csf1r
‑
his(biolegend)或csf1r
‑
fc融合蛋白在涂覆溶液(seracare)中以1μg/ml的浓度在4℃下固定于96孔微量滴定板上过夜。孔用洗涤溶液(咪唑缓冲盐水中的0.05%tween20)清洗,并用1%bsa封闭。杂交瘤培养上清液或连续稀释的抗体加入孔中。在37℃下孵育1小时后,孔用洗涤溶液清洗。过氧化物酶偶联的山羊抗人κ轻链抗体(bethyl)在37℃下施用到各孔用于1小时孵育。在清洗后,孔在室温下用tmb底物显影5至10分钟,接着用1n hcl终止。随后,在450nm和650nm下测量吸光度。ec
50
值通过graphpad prism7计算。
[0277]
结果:如表4所示,标记为“hy6d4”和“hy6m6”的杂交瘤克隆的抗体表现出与重组人csf1r(以单体和融合二聚体形式)的强亚纳摩尔的结合。
[0278]
表4:抗体与人csf1r的结合活性
[0279][0280]
c.使用竞争elisa测定的与csf1r的配体结合的抑制
[0281]
材料和方法:将重组人csf1r
‑
fc融合蛋白在涂覆溶液(seracare)中以1μg/ml的浓度在4℃下固定于96孔微量滴定板上过夜。在室温下,孔用洗涤溶液清洗,并用1%bsa封闭。将连续稀释的抗体加入孔中。随后,加入2.5ug/ml生物素化csf1
‑
his(biolegend),并在37℃下孵育1小时。在清洗后,将链霉亲和素
‑
hrp(jackson immunoresearch)在室温下施用到孔中用于孵育1小时。在清洗后,孔在室温下以tmb底物显影5至10分钟,并用1n hcl终止。随后,在450nm和650nm下测量吸光度。ic
50
值通过graphpad prism7计算。
[0282]
结果:如表5所示,抗csf1r抗体hy6d4和hy6m6呈现对配体csf1与其同源受体csf1r的结合的强(纳摩尔水平)阻断活性。
[0283]
表5:抗体对csf1r与csf1的相互作用的阻断活性
[0284]
mabic
50
(m)hy6d41.76
×
10
‑9hy6m61.04
×
10
‑9[0285]
d.表位分箱研究
[0286]
材料与方法:表位分箱研究通过bio
‑
layer interferometry(bli,fortebio octet red96)进行。链霉亲和素涂覆的octet生物传感器尖端(fort
é
bio)用于对一组抗csf1r抗体(6d4和6m6)进行表位分箱。开始时,10μg/ml的生物素化重组人csf1r
‑
his(biolegend)加载至链霉亲和素传感器尖端上以获取2nm位移。在100s和120s基线步骤后,在600s的结合步骤中将自杂交瘤上清液纯化的5μg/ml第一饱和抗csf1r抗体(hy6m6)单独加载至尖端上。此外,5μg/ml的第二竞争抗csf1r抗体(hy6m6或hy6d4)也与生物传感器尖端孵育用于600s结合。若信号显示尖端的质量积聚(mass accumulation),则考虑其与不同的表位结合。
[0287]
结果:如图1a和图1b描绘的图所示,传感器经过多个测定步骤(以数字表示,并以虚线分开),包括:步骤1
‑
基线;步骤2
‑
生物素
‑
csf1r抗原捕获;步骤3
–
用第一mab(hy6m6)饱和;以及步骤4
‑
以第二mab hy6d4(图1a)或hy6m6(图1b)竞争。图1a的图中步骤4处的位移不存在于图1b的步骤4中,其清楚地表明来自纯化的上清液的两种抗csf1r抗体hy6d4和hy6m6结合csf1r多肽上的不同表位。
[0288]
实施例2:嵌合抗csf1r抗体6d4和6m6的制备
[0289]
本实施例说明使用重组基因技术从两种抗体hy6d4和hy6m6制备本公开的两种示例性嵌合抗csf1r单克隆抗体6d4和6m6。
[0290]
a.嵌合抗体的构建、表达和纯化
[0291]
材料与方法:
[0292]
利用rneasy mini kit(qiagen)从杂交瘤克隆hy6d4和hy6m6提取总rna。igh和igl/igk基因的可变区编码序列通过5’race方法(takara bio)获得。用于igg1 vh扩增的引
物为:gattacgccaagcttatagacagatgggggtgtcgttttggc(seq id no:76)。用于κvl扩增的引物为:gattacgccaagcttggatacagttggtgcagcatc(seq id no:77)。框架和互补决定区(cdrs)使用imgt/v
‑
quest程序(www.imgt.org/imgt_vquest/vquest)确定。将抗体可变区构建体克隆至cdna表达载体中,其重格式化为包含人igg1重链恒定区和人κ轻链恒定区的嵌合抗体。
[0293]
嵌合抗体在expicho
‑
s细胞(thermo scientific)中瞬时表达。在指数生长期中,通过expifectamine cho transfection kit(thermo scientific)用20μg编码嵌合抗体的载体瞬时转染6x106个expicho
‑
s细胞。在转染后18至22小时,将expifectamine cho enhancer和expicho feed加入烧瓶中。将细胞培养8天。将各培养物的上清液离心,随后通过0.45μm过滤器过滤。
[0294]
嵌合抗体,本文称为“6d4”和“6m6”,用protein a sepharose fast flow珠(ge healthcare)从转染细胞上清液纯化。抗体加载的柱用20倍柱体积的pbs清洗,接着用3倍珠体积的0.1m甘氨酸(ph 2.5)直接洗脱至1/10体积的1m tris缓冲液(ph 9.0)中。将含有抗体的级分合并并针对pbs进行透析。在存在和不存在还原剂的情况下,通过sds
‑
page检查纯化抗体的质量。表3及随附的序列表提供嵌合抗体6d4和6m6的氨基酸序列。
[0295]
b.使用流式细胞术进行细胞结合和物种交叉反应性研究
[0296]
材料与方法:编码seq id no:70的全长人csf1r氨基酸序列或seq id no:71的食蟹猴csf1r氨基酸序列的基因片段使用thermo基因合成服务获得,并克隆至哺乳动物表达载体pcdna3.4中。freestyle 293
‑
f细胞(thermo scientific)通过聚乙烯亚胺(pei)方法用csf1r表达载体转染,并用遗传霉素(geneticin)(thermo scientific)进行选择以建立csf1r稳定细胞系。在4℃下,aml5人急性髓样白血病细胞(acc 247,dsmz)或csf1r过表达的293f细胞与对照人igg1(bioxcell)或抗csf1r mab(1μg/106个细胞)孵育1小时。在用facs缓冲液(pbs中2%fbs)清洗后,细胞用抗人igg
–
alexa fluor 647染色,并通过attune nxt flow cytometer(thermo scientific)分析。
[0297]
结果:如图2a、2b和2c所示,嵌合抗csf1r抗体6d4和6m6呈现特异性结合aml5细胞(图2a)和293f细胞(其表达人csf1r)(图2b)。6d4和6m6也呈现特异性结合表达食蟹猴csf1r的293f细胞(图2c)。
[0298]
c.通过嵌合抗csf1r抗体6d4和6m6抑制配体诱导的csf1r磷酸化
[0299]
材料与方法:aml5细胞根据dsmz方案培养,并维持在对数期。在室温下,将aml5细胞(2
×
106个)在1ml分析培养基(含glutamax的memα)中与对照higg1或抗csf1r mab(1μg/ml)孵育5至10分钟。随后,细胞在37℃下用50ng/ml csf1(r&d systems)或50ng/ml il
‑
34(r&d systems)刺激5分钟。在孵育后,细胞随后裂解,并提取总蛋白质。50μg蛋白质通过用抗总csf1r(cell signaling)、磷酸
‑
csf1r(tyr723)(cell signaling)、总akt(cell signaling)、磷酸
‑
akt(tyr723)(cell signaling)或β
‑
肌动蛋白(cell signaling)的抗体探测蛋白质印迹来进行分析。
[0300]
结果:如图3a和3b所示,嵌合抗csf1r抗体6d4和6m6抑制在aml5细胞上表达的csf1r的配体诱导磷酸化,其中所使用的配体为csf1(图3a)或il
‑
34(图3b)。
[0301]
d.抗csf1r抗体6d4和6m6抑制配体依赖性aml5细胞增殖
[0302]
材料与方法:在增殖试验中,aml
‑
5细胞(每孔1.5
×
104个细胞)在96孔板的分析培
养基(含glutamax的memα)中与连续稀释的对照higg1或抗csf1r抗体一起孵育。随后,向接种的细胞添加csf1(20ng/ml)或il
‑
34(33ng/ml)以刺激72小时。利用celltiter
‑
glo分析(promega)测量aml
‑
5细胞增殖。
[0303]
结果:如图4a和4b所示,嵌合抗csf1r抗体6d4和6m6抑制由配体csf1(图4a)或il
‑
34(图4b)诱导的aml5细胞的配体依赖性增殖。表6显示图4a和图4b的图中所测定的6d4和6m6的ic
50
值。
[0304]
表6:csf1和il
‑
34配体依赖性抑制
[0305][0306]
e.抗csf1r抗体6d4和6m6抑制单核细胞和巨噬细胞的csf1依赖性细胞存活
[0307]
从健康供体取得人外周血,立即使用ficoll
‑
paque plus(ge healthcare)通过密度梯度离心分离外周血单核细胞(pbmc)。cd14 单核细胞通过使用抗人cd14偶联的磁珠(miltenyi biotec)分离。在细胞存活试验中,将cd14 单核细胞(每孔1
×
104个细胞)在96孔板的培养基(含有10%fbs的rpmi1640)中与连续稀释的对照higg1或抗csf1r抗体孵育。随后,将csf1(100ng/ml)添加到细胞。在刺激后6天,利用celltiter
‑
glo试验(promega)测量细胞存活。
[0308]
为产生单核细胞衍生的巨噬细胞,将人cd14 单核细胞以2
×
106个细胞/ml培养于补充有10%fbs和100ng/ml csf1的rpmi1640中6天。在增殖试验中,分化的巨噬细胞(每孔2
×
104个细胞)在96孔板的培养基(含有10%fbs的rpmi1640)中与连续稀释的对照higg1或抗csf1r抗体一起孵育。随后,将csf1(10ng/ml)添加到细胞。在刺激后72小时,利用celltiter
‑
glo试验(promega)测量细胞存活。
[0309]
结果:如图5a和图5b所示,嵌合抗csf1r抗体6d4和6m6抑制人cd14 单核细胞和由单核细胞衍生的巨噬细胞的csf1依赖性存活。图5a和图5b的图中所确定的6d4和6m6的ic
50
值显示于表7。
[0310]
表7:单核细胞和巨噬细胞的csf1依赖性存活的抑制
[0311][0312]
f.抗csf1r抗体的csf1r结合亲和力的测定
[0313]
利用bio
‑
layer interferometry(bli)(fortebio octet red96)测定6d4和6m6结合csf1r的动力学速率常数ka和kd。利用ahc(抗higg fc capture)生物传感器(fortebio)进行bli试验来捕获各种抗csf1r抗体(2μg/ml),以取得0.5nm的位移,随后将生物传感器浸入含有pbs
‑
tween 20(0.1%)、bsa(0.1%)的运行缓冲液中的不同浓度(即0、0.549、1.65、4.94、14.8、44.4、133.3和400nm)的重组csf1r
‑
his蛋白中。通过5分钟结合和15分钟解离相互作用时间的结合反应的曲线拟合分析(1:1langmuir模型)计算速率常数。
[0314]
结果:所测定的嵌合抗csf1r抗体6d4和6m6结合hu
‑
csf1r的结合常数k
d
及速率常数ka和kd显示于表8。
[0315]
表8:抗体与人csf1r的结合动力学
[0316]
mabk
a
(1/ms)k
d
(1/s)k
d
(m)6d42.77
×
1059.46
×
10
‑43.42
×
10
‑96m66.88
×
1052.23
×
10
‑43.25
×
10
‑
10
[0317]
g.抗体依赖性细胞介导的细胞毒性(adcc)试验
[0318]
利用nk cell isolation kit(miltenyi biotec)从pbmc分离人nk细胞。在96孔板中,将293f/hucsf1r靶细胞(5
×
103个细胞/孔)与3μg/ml的抗csf1r抗体预孵育30分钟。随后,nk效应细胞(1
×
105个细胞/孔)以20:1的效应:靶(e:t)比率加入培养中,并在37℃下孵育5小时。使用cytotox
‑
glo cytotoxixity assay(promega)测定细胞毒性。
[0319]
结果:如图6所示,抗csf1r抗体6d4和6m6两者诱导增强的自然杀伤(nk)细胞介导的抗体依赖性细胞毒性(adcc)。
[0320]
实施例3:人源化抗csf1r抗体的制备和功能分析
[0321]
本实施例说明其中制备和功能表征本公开的示例性人源化抗csf1r抗体的研究。
[0322]
a.6d4和6m6的人源化
[0323]
通过改变重链与轻链可变区(v
h
和v
l
)的框架区(fr)中的特定氨基酸残基且同时维持cdrs,将抗csf1r抗体6d4和6m6人源化。对于6d4或6m6设计总共四个人源化v
h
区和三个人源化v
l
区。所得的12个人源化抗体针对与csf1r的结合、热稳定性、与杆状病毒的非特异性结合、聚集电位和毛细管电泳进行功能性分析。选择两个人源化形式的6d4,“6d4.hu22”和“6d4.hu41”,及两个人源化形式的6m6,“6m6.hu12”和“6m6.hu41”,用于进一步的功能表征。表3及所附的序列表提供四个人源化抗体的氨基酸序列。
[0324]
b.csf1r特异性elisa
[0325]
材料与方法:将重组人csf1r
‑
his(biolegend)或csf1r
‑
fc融合蛋白在涂覆溶液(seracare)中以1μg/ml的浓度在4℃固定于96孔微量滴定板上过夜。孔用洗涤溶液(含有0.05%tween 20的咪唑缓冲盐水)清洗,并以1%bsa封闭。将连续稀释的抗体加入孔中。在37℃下孵育1小时后,以洗涤溶液清洗孔。在37℃下将过氧化物酶偶联的山羊抗人κ轻链抗体(bethyl)施加到各孔中用于1小时孵育。在清洗后,孔在室温下以tmb底物显影5至10分钟,接着以1n hcl终止。随后,在450nm和650nm下测量吸光度。ec
50
值通过graphpad prism7计算。
[0326]
结果:如表9所示,人源化抗体6d4.hu22和6d4.hu41以及6m6.hu12和6m6.hu41与单体和融合二聚体形式的重组人csf1r表现出亚纳摩尔的结合,其与嵌合亲本抗体6d4和6m6相当或更佳。
[0327]
表9:抗体与人csf1r的结合活性
[0328][0329]
c.人源化抗csf1r抗体6d4.hu22、6d4.hu41、6m6.hu12和6m6.hu41抑制csf1依赖性aml5细胞增殖
[0330]
材料与方法:在96孔板的分析培养基(含有glutamax的memα)中,aml
‑
5细胞(每孔1.5
×
104个细胞)与连续稀释的对照higg1或抗csf1r抗体一起孵育。随后,将csf1(20ng/ml)加入接种的细胞用于刺激72小时。利用celltiter
‑
glo试验(promega)测量aml
‑
5细胞增殖。
[0331]
结果:如图4c和4d所示,人源化抗csf1r抗体6d4.hu22、6d4.hu41、6m6.hu12和6m6.hu41抑制配体csf1诱导的aml5细胞的配体依赖性增殖。如表10所示,从图4c和图4d图中确定的6d4.hu22、6d4.hu41、6m6.hu12和6m6.hu41的ic
50
值与亲本嵌合抗体的值相当。
[0332]
表10:csf1配体依赖性抑制
[0333][0334]
d.人源化抗csf1r抗体6d4.hu22、6d4.hu41、6m6.hu12和6m6.hu41抑制单核细胞的csf1依赖性细胞存活
[0335]
利用ficoll
‑
paque plus(ge healthcare)通过密度梯度离心法分离人pbmc。cd14 单核细胞通过使用抗人cd14偶联磁珠(miltenyi biotec)分离。在细胞存活试验中,将cd14 单核细胞(每孔1
×
104个细胞)在96孔板的培养基(含有10%fbs的rpmi1640)中与连续稀释的对照higg1或抗csf1r抗体一起孵育。随后,将csf1(100ng/ml)添加到细胞。6天刺激后,利用celltiter
‑
glo试验(promega)测量细胞存活。
[0336]
结果:如图5c和图5d所示,人源化抗csf1r抗体6d4.hu22、6d4.hu41、6m6.hu12和6m6.hu41抑制人cd14 单核细胞的csf1依赖性存活。由图5c和图5d的图确定6d4和6m6的ic
50
值。
[0337]
实施例4:与il10激动剂的抗csf1r组合免疫治疗
[0338]
此实施例说明其中示例性抗csf1r抗体用于与il10激动剂组合以治疗肿瘤的研究。
[0339]
a.il10激动剂的制备
[0340]
材料与方法:重组il10
‑
fc(seq id no:73)和(il10)2‑
fc(seq id no:74)融合蛋白通过遗传融合人il
‑
10与人igg1
‑
fc的n端(其以14个氨基酸的接头ggggsggggsgggg(seq id no:78)分开)来设计。所需的编码融合蛋白的基因之前有il
‑
2分泌序列用于生产重组蛋白。该基因利用基因合成服务(thermo scientific)获得。该基因片段克隆至哺乳动物表达载体中,且重组il10
‑
fc和(il10)2‑
fc蛋白在转染的expicho细胞中表达。通过sds
‑
page确认il10
‑
fc和(il10)2‑
fc融合蛋白的成功制备。
[0341]
b.抗csf1r和il
‑
10在同基因ct26结肠癌模型中的抗肿瘤活性
[0342]
材料与方法:将balb/c小鼠(6至8周大,雌性)皮下植入5
×
105个ct26.wt细胞(atcc crl
‑
2638)。在7天后,当肿瘤体积达到50至100mm3时,将小鼠随机分配至处理组。随后,小鼠每周两次腹膜内注射30mg/kg大鼠igg同种型对照(bioxcell)、30mg/kg抗csf1r(克隆afs98,bioxcell)、20mg/kg人fc对照(bioxcell)或20mg/kg il10
‑
fc融合蛋白(seq id no:73)。通过卡尺每周两次测量肿瘤体积直到研究结束。每周收集血液样品。通过elisa试剂盒(biolegend)测量血浆中小鼠csf1、il
‑
34、il
‑
18和cxcl9的浓度。
[0343]
结果:如图7a和图7b所示,抗csf1r抗体阻断与il10激动剂的组合发挥控制肿瘤负荷的作用。此外,如图8a和图8b中的图所示,抗csf1r抗体阻断与il10激动剂的组合发挥维持同基因ct26结肠癌模型中与csf1r抑制和il10激动剂功能相关的细胞因子水平的作用。
[0344]
c.肿瘤浸润免疫细胞分析
[0345]
对于免疫表型分析,在第14天切除肿瘤并解离成单细胞悬液。随后,用荧光染料偶联的抗cd45(克隆30
‑
f11,bd biosciences)、抗cd3(克隆500a2,bd biosciences)、抗cd4(克隆rm4
‑
5,bd biosciences)、抗cd8(克隆53
‑
6.7,bd biosciences)、抗f4/80(克隆t45
‑
2342,bd biosciences)、抗cd11b(克隆m1/70,bd biosciences)、抗ly6c(克隆al
‑
21,bd biosciences)、抗ly6g(克隆1a8,bd biosciences)和pi(sigma)染色肿瘤浸润的细胞。在冰上染色30分钟后,细胞用facs缓冲液洗涤,并通过2%多聚甲醛固定。在室温下,固定的细胞进一步用荧光染料偶联的抗ifnγ(克隆xmg1.2,bd biosciences)进行细胞内染色1小时。在洗涤后,细胞在lsrfortessa(bd biosciences)上分析。
[0346]
结果:如图9a
‑
9c的图所示,在ct26同基因肿瘤模型中,抗csf1r抗体与il10
‑
fc融合激动剂的组合减少tam群体而非mdsc。如图9d
‑
9e的图所示,该组合增加活化的肿瘤浸润t细胞群体。
[0347]
实施例5:抗csf1r/il10融合蛋白的制备和功能分析
[0348]
本实施例说明其中产生和功能表征本公开示例性抗csf1r/il10抗体融合体(或“融合蛋白”)的研究。
[0349]
a.双功能抗csf1r/il10融合蛋白的产生
[0350]
材料与方法:重组il10
‑
fc(seq id no:73)和(il10)2‑
fc(seq id no:74)融合蛋白的制备如实施例4所述,其是通过遗传融合il
‑
10至人igg1
‑
fc的n端(其以14个氨基酸的接头ggggsggggsgggg(seq id no:78)分开),并在转染的expicho细胞中表达。重组抗csf1r/il10融合体(或“融合蛋白”)6d4/il10、6m6/il10、6d4.hu22/il10、6d4.hu41/il10、6m6.hu12/il10和6m6.hu41/il10类似地通过遗传融合人il10至嵌合或人源化抗csf1r抗体v
h
结构域(如实施例2和3所述的制备)的c端来设计和制备,其以14个氨基酸的接头
ggggsggggsgggg(seq id no:78)分开。此外,替代抗小鼠抗csf1r抗体(“ab98”)用于产生替代小鼠抗csf1r/il10融合蛋白(“ab98/il10”)。抗csf1r/il10融合蛋白的整体氨基酸序列设计总结于表3。所需的基因片段(其之前有分泌重组蛋白所需的il
‑
2分泌序列)通过商业基因合成服务(thermo scientific)制备,并克隆至哺乳动物表达载体中。抗csf1r/il10融合蛋白构建体在转染的expicho细胞中表达。
[0351]
b.抗csf1r/il10融合蛋白的表达和纯化
[0352]
材料与方法:抗csf1r/il10融合蛋白在expicho
‑
s细胞(thermo scientific)中瞬时表达。在指数生长期中,6x106个expicho
‑
s细胞通过expifectamine cho transfection kit(thermo scientific)用20μg编码ab/il10融合蛋白的载体瞬时转染。在转染后18至22小时,将expifectamine cho enhancer和expicho feed加入烧瓶中。将细胞培养8天。将各培养物的上清液离心,随后通过0.45μm过滤器过滤。
[0353]
利用protein a sepharose fast flow珠(ge healthcare),纯化来自转染细胞上清液的融合蛋白。加载的柱以20倍柱体积的pbs洗涤,接着以3倍珠体积的0.1m甘氨酸(ph 2.5)直接洗脱至1/10体积的1m tris缓冲液(ph 9.0)中。含融合蛋白的级分合并并针对pbs透析。纯化的抗csf1r/il10融合蛋白的质量在存在和不存在还原剂的情况下通过sds
‑
page检查,并以考马斯亮蓝染色。
[0354]
结果:确认il10融合蛋白il10
‑
fc和(il10)2‑
fc及抗csf1r/il10融合蛋白6d4/il10、6d4/(il10)2、6m6/il10和6m6/(il10)2的纯度的示例性sds
‑
page图像分别如图10a和图10b所示。图10c显示替代抗小鼠csf1r(“ab98”)和相应的“ab98/il10”融合蛋白的sds
‑
page。
[0355]
c.csf1r特异性elisa
[0356]
材料与方法:重组人csf1r
‑
fc或小鼠csf1r
‑
fc(sino biological)在涂覆溶液(seracare)中以浓度1μg/ml在4℃下固定在96孔微量滴定板上过夜。孔用洗涤溶液(咪唑缓冲盐水中的0.05%tween 20)清洗,并以1%bsa封闭。连续稀释的抗csf1r/il
‑
10融合蛋白加入孔中。在37℃下孵育1小时后,用洗涤溶液清洗孔。为检测嵌合ab/il10融合体,过氧化物酶偶联的山羊抗人κ轻链抗体(bethyl)在37℃下施加到各孔中用于1小时孵育。为检测ab98或ab98/il10融合体,将过氧化物酶偶联的山羊抗小鼠igg fab抗体(jacksonimmunoresearch)在37℃下施加到各孔中进行1小时孵育。在清洗后,孔在室温下以tmb底物显影5至10分钟,接着以1n hcl终止。随后,在450nm和650nm下测量吸光度。
[0357]
结果:通过graphpad prism7计算的ec
50
值如表11(下方)所示。
[0358]
表11:抗csf1r/il10融合蛋白与csf1r的结合活性
[0359][0360]
d.通过流式细胞术测定的细胞结合和物种交叉反应性
[0361]
材料与方法:编码全长人csf1r或食蟹猴csf1r的基因片段利用thermo基因合成服务获得,并克隆至哺乳动物表达载体pcdna3.4中。通过聚乙烯亚胺(pei)方法用csf1r表达载体转染freestyle 293
‑
f细胞(thermo scientific),并以遗传霉素(thermo scientific)进行选择以建立csf1r稳定细胞系。在4℃下,csf1r过表达的293f细胞与连续稀释的抗csf1r/il10融合蛋白孵育1小时。在以facs缓冲液(pbs中2%fbs)洗涤后,细胞用抗人igg
‑
alexa fluor 647染色,并利用attune nxt flow cytometer(thermo scientific)分析。
[0362]
结果:如图11a和图11b的图所示,抗csf1r/il10融合蛋白是交叉反应性的,其识别在293f细胞上表达的hucsf1r和cynocsf1r两者。
[0363]
e.通过抗csf1r/il10融合蛋白抑制配体诱导的csf1r磷酸化材料与方法:在室温下,aml5细胞(2
×
106)在1ml分析培养基(含glutamax的memα)中与1μg/ml的对照higg1、抗csf1r、il10
‑
fc或抗csf1r/il10融合蛋白孵育5至10分钟。随后,细胞在37℃下与50ng/ml人csf1(r&d systems)孵育5分钟。孵育后将细胞裂解,并提取总蛋白质。50μg的蛋白质通过用针对总csf1r(cell signaling)、磷酸csf1r(tyr723)(cell signaling)或β
‑
肌动蛋白(cell signaling)的抗体探测蛋白质印迹进行分析。
[0364]
结果:如图12描绘的蛋白质印迹图像所示,抗csf1r/il10融合蛋白、6m6/il10和6m6/(il10)2减弱csf1介导的csf1r磷酸化。
[0365]
f.通过竞争elisa测定与csf1r的配体结合的抑制
[0366]
材料与方法:重组人csf1r
‑
fc或小鼠csf1r
‑
fc(sino biological)融合蛋白在涂覆溶液(seracare)中以1μg/ml的浓度在4℃下固定于96孔微量滴定板上过夜。在室温下,孔用洗涤溶液清洗,并以1%bsa封闭。连续稀释的ab/il
‑
10融合蛋白施加到孔中。随后,加入2.5ug/ml生物素化人csf1
‑
his(biolegend)或小鼠csf1
‑
his(sino biological),并在37℃下孵育1小时。在清洗后,在室温下将链霉亲和素
‑
hrp(jackson immunoresearch)施加到孔中用于1小时孵育。在清洗后,孔在室温下以tmb底物显影5至10分钟,并以1n hcl终止。随后,在450nm和650nm下测量吸光度。ic
50
值通过graphpad prism7计算。
[0367]
结果:如表2所示,抗csf1r/il10融合体呈现对配体csf1与其同源受体csf1r的结合的阻断活性。
[0368]
表12:抗csf1r/il10融合蛋白对csf1r与csf1相互作用的阻断活性
[0369][0370]
g.il10ra特异性elisa
[0371]
材料与方法:重组人il
‑
10ra融合蛋白(r&d systems)在涂覆溶液(seracare)中以1μg/ml的浓度在4℃下固定于96孔微量滴定板上过夜。孔用洗涤溶液(咪唑缓冲盐水中的0.05%tween 20)清洗,并以1%bsa封闭。连续稀释的ab/il
‑
10融合蛋白添加到孔中。在37℃下孵育1小时后,以洗涤溶液清洗孔。过氧化物酶偶联的山羊抗人κ轻链抗体(bethyl)在37℃下施加到各孔中用于1小时孵育。在清洗后,孔在室温下以tmb底物显影5至10分钟,接着以1n hcl终止。随后,在450nm和650nm下测量吸光度。ec
50
值通过graphpad prism7计算。
[0372]
结果:通过graphpad prism7计算的ec
50
值如表13(下方)所示。
[0373]
表13:抗csf1r/il10融合蛋白与il10r的结合活性
[0374] ec
50
(m)il10
‑
fc3.847
×
10
‑9(il10)2‑
fc7.236
×
10
‑96d4/il102.764
×
10
‑96d4/(il10)26.076
×
10
‑96m6/il102.752
×
10
‑96m6/(il10)29.355
×
10
‑9ab98/il102.472
×
10
‑8[0375]
h.抗csf1r/il10融合蛋白抑制配体依赖性aml5细胞增殖
[0376]
材料与方法:aml
‑
5细胞(每孔1.5
×
104个细胞)在96孔板中的分析培养基(含有glutamax而无fbs的memα)中与连续稀释的ab/il10融合蛋白一起孵育。随后,将人csf
‑
1(20ng/ml)添加到接种的细胞进行72小时刺激。利用celltiter
‑
glo试验(promega)测量aml
‑
5细胞增殖。
[0377]
结果:如图13a的图所示,抗csf1r/il10抗体融合体6d4/il10、6d4.hu22/il10、6d4.hu41/il10、6m6/il10、6m6.hu12/il10和6m6.hu41/il10全部能够抑制csf1依赖性细胞增殖。图中确定的ic
50
值如下表14所示。
[0378]
表14
[0379][0380]
i.抗csf1r/il10融合蛋白抑制cd14 单核细胞和巨噬细胞的csf1依赖性细胞存活
[0381]
材料与方法:利用ficoll
‑
paque plus(ge healthcare)通过密度梯度离心立即分离人pbmc。cd14 单核细胞通过使用抗人cd14偶联磁珠(miltenyi biotec)分离。在细胞存活试验中,cd14 单核细胞(每孔1
×
104个细胞)在96孔板的培养基(含10%fbs的rpmi1640)中与连续稀释的抗csf1r或ab/il10融合蛋白一起孵育。随后,将csf1(100ng/ml)添加到细胞。在刺激后6天,利用celltiter
‑
glo试验(promega)测量细胞存活。
[0382]
为产生单核细胞衍生的巨噬细胞,将人cd14 单核细胞以2
×
106个细胞/ml培养于rpmi1640(其补充10%fbs和100ng/mlcsf1)中6天。在增殖试验中,分化的巨噬细胞(每孔2
×
104个细胞)在96孔板的培养基(含10%fbs的rpmi1640)中与连续稀释的抗csf1r或ab/il10融合蛋白一起孵育。随后,将csf1(10ng/ml)添加到细胞。在刺激后72小时,利用celltiter
‑
glo试验测量细胞存活。
[0383]
结果:如图13b和图13c的图所示,抗csf1r/il10抗体融合体6m6/il10、6m6/(il10)2、6m6.hu12/il10和6m6.hu41/il10都能够抑制csf1依赖性cd14 单核细胞和巨噬细胞存活。由图中确定的ic
50
值如下表15所示。
[0384]
表15
[0385][0386]
j.替代小鼠抗csf1r抗体ab98抑制配体依赖性m
‑
nfs
‑
60细胞增殖
[0387]
材料与方法:在96孔板中,将m
‑
nfs
‑
60鼠髓性白血病细胞(atcc crl
‑
1838)(每孔2
×
103个细胞)在分析培养基(含10%fbs和0.05mmβ
‑
me的rpmi1640)中与连续稀释的抗小鼠csf1r(ab98)或抗小鼠csf1r/il10融合蛋白(ab98/il10)一起孵育。随后将人csf
‑
1(20ng/ml)添加到接种的细胞以刺激72小时。利用celltiter
‑
glo试验(promega)测量m
‑
nfs
‑
60细胞增殖。
[0388]
结果:如图13d的图所示,替代小鼠抗csf1r ab98、抗csf1r/il10融合蛋白ab98/
il10也能抑制csf1依赖性m
‑
nfs
‑
60细胞增殖。由图中确定的ic
50
值如下表16所示。
[0389]
表16
[0390][0391]
k.il10刺激mc/9细胞增殖
[0392]
材料与方法:利用增殖试验测定il10的生物学活性。mc/9(atcc,crl
‑
8306)鼠肥大细胞培养于补充2mm l
‑
谷氨酰胺、0.05mm 2
‑
巯基乙醇、10%大鼠t
‑
stim(becton dickenson)和10%fbs的dmem(gibco)中。在增殖试验中,mc/9细胞在96孔板中在il10
‑
fc或ab/il10融合蛋白存在下以每孔1
×
104个细胞接种于200μl分析培养基(含有10%fbs的dmem)中。刺激72小时后,利用celltiter
‑
glo试验测量mc/9细胞增殖。
[0393]
结果:如图14a和图14b中的图所示,抗csf1r抗体融合体6m6/il10、6m6/(il10)2、6d4.hu22/il10、6d4.hu41/il10、6m6.hu12/il10和6m6.hu41/il10能够诱导mc/9细胞增殖。由图中确定的ec
50
值如下表17所示。
[0394]
表17
[0395][0396]
l.通过il10的cd8 t细胞活化
[0397]
材料与方法:利用cd8磁珠(miltenyi biotec)从pbmcs分离人cd8 t细胞。将分离的cd8 t细胞(1
×
107个细胞/3ml/6孔板的孔)培养于aim
‑
v培养基(thermo scientific)中,并以t cell transact(miltenyi biotec)活化3天。在活化后,cd8 t细胞接着洗涤并接种(每孔4
×
105个细胞)于96孔板中,且以ab/il
‑
10融合蛋白处理3天。ab/il
‑
10融合蛋白处理后,细胞用1μg/ml可溶性抗cd3(biolegend)再刺激4小时。根据制造商的说明,通过elisa(biolegend)测量细胞培养基中ifn
‑
γ和颗粒酶b的浓度。
[0398]
结果:如图15a、图15b、图15c和图15d的图所示,与il10的抗csf1r抗体融合体能增强活化cd8 t细胞的ifnγ和颗粒酶b的产生。由图15c和图15d的图中确定的ec
50
值如下表18所示。
[0399]
表18
[0400][0401]
m.ct26肿瘤模型中的肿瘤浸润免疫细胞分析
[0402]
材料与方法:将balb/c小鼠(6至8周大,雌性)皮下植入5
×
105个ct26.wt细胞(atcc crl
‑
2638)。在第7天,当肿瘤体积达到50至100mm3时,将小鼠随机分配至处理组。随后,小鼠每周两次腹膜内注射20mg/kg人igg1 fc对照(bioxcell)、20mg/kg il10
‑
fc、30mg/kg抗csf1r ab98、12或36mg/kg抗csf1r/il10融合蛋白(ab98/il10)。在两次处理后,在第14天时收集全血和肿瘤用于免疫表型分析。将肿瘤解离成单细胞悬液。随后,在冰上,以荧光染料偶联的抗cd45(克隆30
‑
f11,bd biosciences)、抗cd3(克隆500a2,bd biosciences)、抗cd4(克隆rm4
‑
5,bd biosciences)、抗cd8(克隆53
‑
6.7,bd biosciences)、抗f4/80(克隆t45
‑
2342,bd biosciences)、抗cd11b(克隆m1/70,bd biosciences)、抗ly6c(克隆al
‑
21,bd biosciences)、抗ly6g(克隆1a8,bd biosciences)、抗lag3(克隆c9b7w,bd biosciences)、抗pd1(克隆rmp1
‑
30,bd biosciences)和pi(sigma)将血液细胞和肿瘤浸润细胞染色30分钟。在洗涤后,细胞在lsrfortessa(bd biosciences)上分析。
[0403]
每周收集血液样品。利用elisa试剂盒(biolegend)测量小鼠csf1的浓度。
[0404]
结果:如图17a
‑
17c的图所示,在肿瘤模型中,通过抗csf1r抗体阻断csf1r减少tams(cd11b f4/80 )群体。如图17d
‑
17e的图所示,在肿瘤模型中,抗csf1r/il10融合体中il
‑
10的存在增加cd8 lag3 pd1 t细胞群体。
[0405]
n.抗csf1r/il10融合体在同基因肿瘤模型中的抗肿瘤活性
[0406]
材料与方法:将balb/c小鼠(6至8周大,雌性)皮下植入5
×
105个ct26.wt细胞(atcc crl
‑
2638)、5
×
105个emt6细胞(atcc crl
‑
2755)、1
×
106个h22细胞(rrid:cvcl_h613)或1
×
106个renca细胞(atcc crl
‑
2947)。c57bl/6小鼠(6至8周大,雌性)皮下植入3
×
105个ll/2细胞(atcc crl
‑
1642)、1
×
106个mc38细胞(rrid:cvcl_b288)、3
×
106个pan02细胞(rrid:cvcl_d627)或5
×
105个q1
‑
2细胞。当肿瘤体积达到50至100mm3时,将小鼠随机分配至处理组。随后,小鼠每周两次腹膜内注射溶媒对照或36mg/kg抗csf1r/il10融合蛋白(ab98/il10)。利用卡尺每周两次测量肿瘤体积直到研究结束。
[0407]
结果:如图19a
‑
19g的图所示,替代抗小鼠csf1r/il10抗体融合体ab98/il10的处理在所有肿瘤模型中在第3周时导致肿瘤体积明显减小(~30
‑
70%)。
[0408]
尽管有所附权利要求,但本文中的公开内容也可由下列条款限定,这些条款可在单独或与一个或多个其他条款或实施方案结合时是有益的。非限制前述说明,提供如以下编号的本公开的特定非限制性条款,其中可使用各单独编号的条款或与之前或之后的条款中的任一者一起组合。因此,这旨在提供对所有的此类组合的支持,而非必然限于以下明确提供的特定组合:
[0409]
1.一种分离的抗体或其抗原结合部分,其包含:cdr
‑
h1,其包含选自seq id no:3
或seq id no:28的氨基酸序列;cdr
‑
h2,其包含选自seq id no:6或seq id no:31的氨基酸序列;cdr
‑
h3,其包含选自seq id no:8或seq id no:33的氨基酸序列;cdr
‑
l1,其包含选自seq id no:13或seq id no:37的氨基酸序列;cdr
‑
l2,其包含选自kas或vas的氨基酸序列;以及cdr
‑
l3,其包含选自seq id no:16或seq id no:40的氨基酸序列。
[0410]
2.如条款1的分离的抗体或其抗原结合部分,其中:该cdr
‑
h1、cdr
‑
h2和cdr
‑
h3分别为seq id no:3、seq id no:6和seq id no:8;和/或该cdr
‑
l1、cdr
‑
l2和cdr
‑
l3分别为seq id no:13、kas和seq id no:16。
[0411]
3.如条款1的分离的抗体或其抗原结合部分,其中该cdr
‑
h1、cdr
‑
h2和cdr
‑
h3分别为seq id no:28、seq id no:31和seq id no:33;和/或该cdr
‑
l1、cdr
‑
l2和cdr
‑
l3分别为seq id no:37、vas和seq id no:40。
[0412]
4.如条款1至3中任一项的分离的抗体或其抗原结合部分,其中:
[0413]
(a)v
h
包含与seq id no:2具有至少90%同一性的序列;且v
l
包含与seq id no:12具有至少90%同一性的序列;
[0414]
(b)v
h
包含与seq id no:19具有至少90%同一性的序列;且v
l
包含与seq id no:21具有至少90%同一性的序列;
[0415]
(c)v
h
包含与seq id no:23具有至少90%同一性的序列;且v
l
包含与seq id no:25具有至少90%同一性的序列;
[0416]
(d)v
h
包含与seq id no:27具有至少90%同一性的序列;且v
l
包含与seq id no:36具有至少90%同一性的序列;
[0417]
(e)v
h
包含与seq id no:43具有至少90%同一性的序列;且v
l
包含与seq id no:45具有至少90%同一性的序列;或
[0418]
(f)其中v
h
包含与seq id no:47具有至少90%同一性的序列;且v
l
包含与seq id no:49具有至少90%同一性的序列。
[0419]
5.一种重组蛋白,其包含与il
‑
10多肽融合的如条款1至4中任一项的分离的抗体或其抗原结合部分。
[0420]
6.如条款5的重组蛋白,其中il
‑
10多肽包含seq id no:75的氨基酸序列。
[0421]
7.如条款5至6中任一项的重组蛋白,其中分离的抗体或其抗原结合部分经由接头与il
‑
10多肽融合;任选地,其中该接头包含seq id no:78的氨基酸序列。
[0422]
8.如条款5至7中任一项的重组蛋白,其包含一、二或四个il
‑
10多肽。
[0423]
9.如条款5至8中任一项的重组蛋白,其包含与seq id no:50、51、52、53、54、55、56或57具有至少90%同一性的序列。
[0424]
10.一种药物组合物,其包含如条款1至4中任一项的分离的抗体或其抗原结合部分及药学上可接受的载体。
[0425]
11.如条款10的药物组合物,其进一步包含il
‑
10。
[0426]
12.如条款11的药物组合物,其中该分离的抗体或其抗原结合部分与il
‑
10融合,从而形成重组蛋白。
[0427]
13.如条款12的药物组合物,其中该重组蛋白为如条款5至9中任一项的重组蛋白。
[0428]
14.一种治疗癌症的方法,包括向需要的受试者施用有效量的如条款1至4中任一项的分离的抗体或其抗原结合部分或如条款5至9中任一项的重组蛋白。
[0429]
15.如条款14的方法,其中该癌症为结肠癌、胰腺癌、卵巢癌、hcc、肾癌、乳腺癌、肺癌、胃癌、头颈癌或口腔癌。
[0430]
16.一种用于治疗癌症的试剂盒,其包含:csf1r拮抗剂和il10激动剂。
[0431]
17.如条款16的试剂盒,其中csf1r拮抗剂为抗体或其抗原结合片段、shrna、sirna、mirna、csf1r的小分子抑制剂或其组合。
[0432]
18.如条款16至17中任一项的试剂盒,其中csf1r拮抗剂为条款1至4中任一项的分离的抗体或其抗原结合部分。
[0433]
19.如条款16至18中任一项的试剂盒,其中il10激动剂为il10、il10受体结合蛋白、il10受体激动剂或其组合。
[0434]
20.一种治疗癌症的方法,其包括向需要的受试者施用csf1r拮抗剂和il
‑
10激动剂。
[0435]
21.如条款20的方法,其中csf1r拮抗剂为抗体或其抗原结合片段、shrna、sirna、mirna、csf1r的小分子抑制剂或其组合。
[0436]
22.如条款20至21中任一项的方法,其中csf1r拮抗剂为如条款1至4中任一项的分离的抗体或其抗原结合部分。
[0437]
23.如条款20至22中任一项的方法,其中il10激动剂为il10、il10受体结合蛋白或其组合。
[0438]
24.如条款20至23中任一项的方法,其进一步包括向受试者施用t细胞疗法。
[0439]
25.一种t细胞活化的方法,其包括将t细胞群体与csf1r拮抗剂和il10激动剂接触。
[0440]
26.如条款25的方法,其中csf1r拮抗剂为抗体或其抗原结合片段、shrna、sirna、mirna、csf1r的小分子抑制剂或其组合。
[0441]
27.如条款25至26中任一项的方法,其中csf1r拮抗剂为如条款1至4中任一项的分离的抗体或其抗原结合部分。
[0442]
28.如条款25至27中任一项的方法,其中il10激动剂为il10、il10受体结合蛋白或其组合。
[0443]
29.如条款23的方法,其中il
‑
10激动剂为il
‑
10。
[0444]
30.如条款27至29中任一项的方法,其中分离的抗体或其抗原结合部分与il10融合,从而形成重组蛋白。
[0445]
31.如条款30的方法,其中该重组蛋白为如条款5至9中任一项的重组蛋白。
[0446]
32.如条款31的方法,其中t细胞为cd8
t细胞、cd4
t细胞或其组合。
[0447]
33.一种抗csf1r抗体,其包含(i)第一轻链互补决定区(cdr
‑
l1)、第二轻链互补决定区(cdr
‑
l2)和第三轻链互补决定区(cdr
‑
l3),和/或(ii)第一重链互补决定区(cdr
‑
h1)、第二重链互补决定区(cdr
‑
h2)和第三重链互补决定区(cdr
‑
h3),其中:
[0448]
(a)cdr
‑
h1包含选自seq id no:3、4、28或29的氨基酸序列;
[0449]
(b)cdr
‑
h2包含选自seq id no:6、7、31或32的氨基酸序列;
[0450]
(c)cdr
‑
h3包含选自seq id no:8、9、33或34的氨基酸序列;
[0451]
(d)cdr
‑
l1包含选自seq id no:13、14、37或38的氨基酸序列;
[0452]
(e)cdr
‑
l2包含选自kas、vas或seq id no:15或39的氨基酸序列;
[0453]
(f)cdr
‑
l3包含选自seq id no:16、17、40或41的氨基酸序列。
[0454]
34.如条款33的抗体,其中:
[0455]
(a)cdr
‑
h1包含seq id no:3或4的氨基酸序列,cdr
‑
h2包含seq id no:6或7的氨基酸序列,且cdr
‑
h3包含seq id no:8或9的氨基酸序列;或
[0456]
(b)cdr
‑
h1包含seq id no:28或29的氨基酸序列,cdr
‑
h2包含seq id no:31或32的氨基酸序列,且cdr
‑
h3包含seq id no:33或34的氨基酸序列。
[0457]
35.如条款33至34中任一项的抗体,其中:
[0458]
(a)cdr
‑
l1包含seq id no:13或14的氨基酸序列,cdr
‑
l2包含kas或seq id no:15的氨基酸序列,且cdr
‑
l3包含seq id no:16或17的氨基酸序列;或
[0459]
(b)cdr
‑
l1包含seq id no:37或38的氨基酸序列,cdr
‑
l2包含vas或seq id no:39的氨基酸序列,且cdr
‑
l3包含seq id no:40或41的氨基酸序列。
[0460]
36.如条款33至35中任一项的抗体,其中:
[0461]
(a)cdr
‑
h1包含seq id no:3的氨基酸序列,cdr
‑
h2包含seq id no:6的氨基酸序列,cdr
‑
h3包含seq id no:8的氨基酸序列,cdr
‑
l1包含seq id no:13的氨基酸序列,cdr
‑
l2包含kas的氨基酸序列,且cdr
‑
l3包含seq id no:16的氨基酸序列;
[0462]
(b)cdr
‑
h1包含seq id no:28的氨基酸序列,cdr
‑
h2包含seq id no:31的氨基酸序列,cdr
‑
h3包含seq id no:33的氨基酸序列,cdr
‑
l1包含seq id no:37的氨基酸序列,cdr
‑
l2包含vas的氨基酸序列,且cdr
‑
l3包含seq id no:40的氨基酸序列;
[0463]
(c)cdr
‑
h1包含seq id no:4的氨基酸序列,cdr
‑
h2包含seq id no:7的氨基酸序列,cdr
‑
h3包含seq id no:9的氨基酸序列,cdr
‑
l1包含seq id no:14的氨基酸序列,cdr
‑
l2包含seq id no:15的氨基酸序列,且cdr
‑
l3包含seq id no:17的氨基酸序列;
[0464]
(d)cdr
‑
h1包含seq id no:29的氨基酸序列,cdr
‑
h2包含seq id no:32的氨基酸序列,cdr
‑
h3包含seq id no:34的氨基酸序列,cdr
‑
l1包含seq id no:38的氨基酸序列,cdr
‑
l2包含vas或seq id no:39的氨基酸序列,且cdr
‑
l3包含seq id no:41的氨基酸序列。
[0465]
37.如条款33至36中任一项的抗体,其中该抗体包含(i)第一轻链高变区(hvr
‑
l1)、第二轻链高变区(hvr
‑
l2)和第三轻链高变区(hvr
‑
l3),和/或(ii)第一重链高变区(hvr
‑
h1)、第二重链高变区(hvr
‑
h2)和第三重链高变区(hvr
‑
h3),其中:
[0466]
(a)hvr
‑
h1包含选自seq id no:5或30的氨基酸序列;
[0467]
(b)hvr
‑
h2包含选自seq id no:7或32的氨基酸序列;
[0468]
(c)hvr
‑
h3包含选自seq id no:10或33的氨基酸序列;
[0469]
(d)hvr
‑
l1包含选自seq id no:14或38的氨基酸序列;
[0470]
(e)hvr
‑
l2包含选自seq id no:15或39的氨基酸序列;
[0471]
(f)hvr
‑
l3包含选自seq id no:17或41的氨基酸序列。
[0472]
38.如条款37的抗体,其中:
[0473]
(a)hvr
‑
h1包含seq id no:5的氨基酸序列;hvr
‑
h2包含seq id no:7的氨基酸序列;hvr
‑
h3包含seq id no:10的氨基酸序列;hvr
‑
l1包含seq id no:14的氨基酸序列;hvr
‑
l2包含seq id no:15的氨基酸序列;且hvr
‑
l3包含seq id no:41的氨基酸序列;或
[0474]
(b)hvr
‑
h1包含seq id no:30的氨基酸序列;hvr
‑
h2包含seq id no:32的氨基酸序列;hvr
‑
h3包含seq id no:33的氨基酸序列;hvr
‑
l1包含seq id no:38的氨基酸序列;
hvr
‑
l2包含seq id no:39的氨基酸序列;且hvr
‑
l3包含seq id no:41的氨基酸序列。
[0475]
39.如条款33至38中任一项的抗体,其中该抗体包含与选自seq id no:2、19、23、27、43或47的序列具有至少90%同一性的重链可变域(v
h
)氨基酸序列;和/或与选自seq id no:12、21、25、36、45或49的序列具有至少90%同一性的轻链可变域(v
l
)氨基酸序列;任选地,其中:
[0476]
(a)该抗体包含与seq id no:2具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:12具有至少90%同一性的轻链可变域(v
l
)氨基酸序列;
[0477]
(b)该抗体包含与seq id no:19具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:21具有至少90%同一性的v
l
氨基酸序列;
[0478]
(c)该抗体包含与seq id no:23具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:25具有至少90%同一性的v
l
氨基酸序列;
[0479]
(d)该抗体包含与seq id no:27具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:36具有至少90%同一性的v
l
氨基酸序列;
[0480]
(e)该抗体包含与seq id no:43具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:45具有至少90%同一性的v
l
氨基酸序列;或
[0481]
(f)该抗体包含与seq id no:47具有至少90%同一性的v
h
氨基酸序列;和/或与seq id no:49具有至少90%同一性的v
l
氨基酸序列。
[0482]
40.如条款33至39中任一项的抗体,其中该抗体包含与选自seq id no:58、60、62、64、66或68的序列具有至少90%同一性的重链(hc)氨基酸序列,和/或与选自seq id no:59、61、63、65、67或69的序列具有至少90%同一性的轻链(lc)氨基酸序列;任选地,其中该抗体包含:
[0483]
(a)seq id no:58的hc氨基酸序列,以及seq id no:59的lc氨基酸序列;
[0484]
(b)seq id no:60的hc氨基酸序列,以及seq id no:61的lc氨基酸序列;
[0485]
(c)seq id no:62的hc氨基酸序列,以及seq id no:63的lc氨基酸序列;
[0486]
(d)seq id no:64的hc氨基酸序列,以及seq id no:65的lc氨基酸序列;
[0487]
(e)seq id no:66的hc氨基酸序列,以及seq id no:67的lc氨基酸序列;或
[0488]
(f)seq id no:68的hc氨基酸序列,以及seq id no:69的lc氨基酸序列。
[0489]
41.如条款33至40中任一项的抗体,其中该抗体包含经由接头与il10多肽融合的hc;任选地,其中:
[0490]
(a)接头包含seq id no:78的氨基酸序列;
[0491]
(b)il10多肽包含一、二或四个il10多肽;和/或
[0492]
(c)il10多肽包含seq id no:75的氨基酸序列;
[0493]
(d)hc包含与选自seq id no:50、51、52、53、54、55、56或57的序列具有至少90%同一性的氨基酸序列。
[0494]
42.如条款41的抗体,其中该抗体包含与选自seq id no:50、51、52、53、54、55、56或57的序列具有至少90%同一性的重链(hc)氨基酸序列,以及与选自seq id no:59、61、63、65、67或69的序列具有至少90%同一性的轻链(lc)氨基酸序列;任选地,其中该抗体包含:
[0495]
(a)seq id no:50的hc氨基酸序列,以及seq id no:59的lc氨基酸序列;
[0496]
(b)seq id no:51的hc氨基酸序列,以及seq id no:59的lc氨基酸序列;
[0497]
(c)seq id no:52的hc氨基酸序列,以及seq id no:61的lc氨基酸序列;
[0498]
(d)seq id no:53的hc氨基酸序列,以及seq id no:63的lc氨基酸序列;
[0499]
(e)seq id no:54的hc氨基酸序列,以及seq id no:65的lc氨基酸序列;
[0500]
(f)seq id no:55的hc氨基酸序列,以及seq id no:65的lc氨基酸序列;
[0501]
(g)seq id no:56的hc氨基酸序列,以及seq id no:67的lc氨基酸序列;或
[0502]
(h)seq id no:57的hc氨基酸序列,以及seq id no:69的lc氨基酸序列。
[0503]
43.如条款33至42中任一项的抗体,其中:
[0504]
(a)该抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下的结合亲和力结合人csf1r;任选地其中结合亲和力通过与seq id no:70的hucsf1r多肽的平衡解离常数(k
d
)测量;
[0505]
(b)该抗体以1x10
‑8m或以下、1x10
‑9m或以下、1x10
‑
10
m或以下的结合亲和力结合食蟹猴csf1r;任选地其中结合亲和力通过与seq id no:71的cynocsf1r多肽的平衡解离常数(k
d
)测量;
[0506]
(c)该抗体减少csf1诱导和il34诱导的hucsf1r或akt的磷酸化;
[0507]
(d)该抗体抑制csf1依赖性的和il34诱导的细胞增殖至少65%、至少75%、至少85%、至少95%或至少100%;任选地其中在csf1浓度为20ng/ml或il34浓度为33ng/ml时,抗体的ic
50
为5nm或以下、1nm或以下、0.5nm或以下或者0.1nm或以下;
[0508]
(e)该抗体抑制人cd14 单核细胞或单核细胞衍生的巨噬细胞的csf1依赖性存活至少65%、至少75%、至少85%、至少95%或至少100%;任选地其中在csf1浓度为100ng/ml时,抗体的ic
50
为5nm或以下、1nm或以下、0.5nm或以下或者0.1nm或以下;
[0509]
(f)该抗体增加针对表达csf1r的293f细胞的nk细胞介导的adcc至少10%、至少20%或至少25%;
[0510]
(g)该抗体在21天测量的同基因小鼠肿瘤模型中减小肿瘤体积至少25%、至少50%、至少75%或以上,其中小鼠肿瘤模型选自:ct26crc、emt6 tnbc、mc38 crc、renca rcc、ll/2肺、pan02 pdac、h22 hcc、q1 hnscc;
[0511]
(h)该抗体在ct26结肠肿瘤同基因小鼠模型中增加csf1和il34的血液水平至少50倍、至少100倍、200倍或至少500倍;
[0512]
(i)该抗体在ct26结肠肿瘤同基因小鼠模型中减少tam群体至少20%、至少30%、至少40%、至少50%、至少60%或以上;任选地其中mdsc群体减少小于10%、小于5%或以下;
[0513]
(j)该抗体增加mc/9细胞增殖至少25%、至少50%、至少100%、至少150%、至少200%或以上;
[0514]
(k)该抗体增加活化的cd8 t细胞的ifnγ和颗粒酶b产生至少25%、至少50%、至少100%或以上;和/或
[0515]
(l)该抗体在ct26结肠肿瘤同基因小鼠模型中增加cd8 lag3 pd1 t细胞血液水平至少2倍、至少4倍、至少6倍、至少8倍、至少10倍或以上。
[0516]
44.一种编码条款33至43中任一项的抗体的分离的多核苷酸或载体;或包含该寡核苷酸或载体的分离的宿主细胞;任选地其中该宿主细胞选自中国仓鼠卵巢(cho)细胞、骨
髓瘤细胞(如,y0、ns0、sp2/0)、猴肾细胞(cos
‑
7)、人胚肾细胞系(293)、幼仓鼠肾细胞(bhk)、小鼠塞尔托利细胞(如,tm4)、非洲绿猴肾细胞(vero
‑
76)、人宫颈癌细胞(hela)、犬肾细胞、人肺细胞(w138)、人肝细胞(hep g2)、小鼠乳腺肿瘤细胞、tr1细胞、医学研究委员会5(mrc 5)细胞和fs4细胞。
[0517]
45.一种产生抗体的方法,包括培养如条款44的宿主细胞以使得产生抗体。
[0518]
46.一种药物组合物,包含如条款33至43中任一项的抗体及药学上可接受的载体;任选地其中该组合物进一步包含il10、化疗剂和/或包含对免疫检查点分子的特异性的抗体。
[0519]
47.一种治疗受试者的csf1r介导的疾病的方法,该方法包括向受试者施用治疗有效量的如条款33至43中任一项的抗体,或向受试者施用治疗有效量的如条款46的药物组合物;任选地其中该疾病为癌症;任选地其中该癌症为结肠癌、胰腺癌、卵巢癌、hcc、肾癌、乳腺癌、肺癌、胃癌、头颈癌或口腔癌。
[0520]
48.一种治疗受试者的癌症的方法,包拓向该受试者施用csf1r拮抗剂和il
‑
10激动剂;任选地其中该csf1r拮抗剂包含抗csf1r抗体、shrna、sirna、mirna、csf1r的小分子抑制剂或其组合;任选地其中il
‑
10激动剂为il
‑
10、il
‑
10受体结合蛋白或其组合;任选地其中csf1r拮抗剂为如条款33至43中任一项的抗csf1r抗体;任选地其中csf1r拮抗剂和il10激动剂包括具有经由接头与il10多肽融合的hc的抗csf1r抗体。
[0521]
49.如条款48的方法,其中该癌症为结肠癌、胰腺癌、卵巢癌、hcc、肾癌、乳腺癌、肺癌、胃癌、头颈癌或口腔癌。
[0522]
50.如条款48至49中任一项的方法,其中该方法进一步包括向该受试者施用t细胞疗法。
[0523]
51.包含如条款33至43中任一项的抗csf1r抗体的组合物或制剂在治疗或在用于治疗的药物中的用途;任选地其中该治疗是用于csf1r介导的疾病;任选地其中csf1r介导的疾病为癌症。
[0524]
52.包含如条款33至43中任一项的抗csf1r抗体的组合物或制剂在制造或制备药物中的用途;任选地,其中该药物用于治疗csf1r介导的疾病;任选地其中csf1r介导的疾病为癌症。
[0525]
尽管出于清楚及理解的目的通过示例及说明的方式详细描述了本发明的前述公开内容,但是包括本文描述的实施例、描述和实施方案的本公开是出于说明性目的,旨在为示例性的,并且不应该被解释为限制本公开。本领域技术人员将清楚,可以对本文描述的实施例、描述和实施方案进行各种修改或改变,并且将包括于本公开以及所附权利要求的精神及范围内。此外,本领域技术人员将认识到许多与本文描述的那些等同的方法及程序。所有这些等同物应被理解为于本发明的范围内并且由所附权利要求覆盖。
[0526]
在以下权利要求中阐述了本发明的另外的实施方案。
[0527]
出于所有目的,此处引用的所有出版物、专利申请、专利或其他文件的公开内容皆明确地通过引用而全文并入本文中,其程度与单独地指明每一此类单独的出版物、专利、专利申请或其他文件基于所有目的通过引用全文并入本文相同,并在此全文提出。在发生冲突的情况下,以本说明书(包括指定的术语)为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。