1.本发明生物医药领域,涉及糖皮质激素与糖酵解调节剂在制备急性移植物抗宿主病的药物中的应用,具体来说涉及糖皮质激素与糖酵解调节剂协同治疗急性移植物抗宿主病。
背景技术:
2.急性移植物抗宿主病(agvhd)是异基因造血干细胞移植的重要合并症。agvhd通常被认为是一种免疫介导的疾病,具体地说,agvhd以“细胞因子风暴”刺激,增强对受者抗原的免疫反应,以受者皮肤、肝及肠道为主要的靶目标发动细胞毒攻击为特征,导致相关死亡率增高及患者医疗费用增高。
3.糖皮质激素是目前agvhd的一线治疗方案,但是仍有40
‑
60%患者出现激素耐药,且现有二线治疗效果欠佳。因此,agvhd发病机制的深入阐明及其新型治疗策略的建立是亟待解决的重要临床科学问题。
技术实现要素:
4.本发明的目的是提供糖皮质激素与糖酵解调节剂在制备急性移植物抗宿主病的药物中的应用,具体来说涉及糖皮质激素与糖酵解调节剂协同治疗急性移植物抗宿主病。
5.本发明保护糖皮质激素和糖酵解调节剂在制备药物中的应用;所述药物为针对急性移植物抗宿主病的药物。应用所述药物时,糖皮质激素和糖酵解调节剂通过协同作用发挥针对急性移植物抗宿主病的疗效。
6.具体的,所述糖酵解调节剂为3po。
7.具体的,所述糖酵解调节剂为mtx。
8.具体的,所述糖皮质激素为mp。
9.具体的,mp和3po的摩尔配比可为1:2.5
‑
20。
10.具体的,mp和3po的摩尔配比为1:10。
11.具体的,mp和3po的质量配比为2:25。
12.具体的,mp和mtx的摩尔配比为1:0.25
‑
2。
13.具体的,mp和mtx的摩尔配比为1:0.25。
14.具体的,mp和mtx的质量配比为2:1。
15.本发明还保护一种药物,其活性成分为糖皮质激素和糖酵解调节剂;所述药物为针对急性移植物抗宿主病的药物。应用所述药物时,糖皮质激素和糖酵解调节剂通过协同作用发挥针对急性移植物抗宿主病的疗效。
16.具体的,所述糖酵解调节剂为3po。
17.具体的,所述糖酵解调节剂为mtx。
18.具体的,所述糖皮质激素为mp。
19.具体的,mp和3po的摩尔配比可为1:2.5
‑
20。
20.具体的,mp和3po的摩尔配比为1:10。
21.具体的,mp和3po的质量配比为2:25。
22.具体的,mp和mtx的摩尔配比为1:0.25
‑
2。
23.具体的,mp和mtx的摩尔配比为1:0.25。
24.具体的,mp和mtx的质量配比为2:1。
25.本发明还保护糖酵解调节剂在制备药物中的应用;所述药物的功能为治疗和/或预防急性移植物抗宿主病患者的糖皮质激素耐药。糖酵解调节剂可用于治疗和/或预防急性移植物抗宿主病患者的糖皮质激素耐药,从而糖皮质激素和糖酵解调节剂通过协同作用发挥针对急性移植物抗宿主病的疗效。
26.具体的,所述糖酵解调节剂为3po。
27.具体的,所述糖酵解调节剂为mtx。
28.具体的,所述糖皮质激素为mp。
29.本发明还保护一种药物,其活性成分为糖酵解调节剂;所述药物的功能为治疗和/或预防急性移植物抗宿主病患者的糖皮质激素耐药。糖酵解调节剂可用于治疗和/或预防急性移植物抗宿主病患者的糖皮质激素耐药,从而糖皮质激素和糖酵解调节剂通过协同作用发挥针对急性移植物抗宿主病的疗效。
30.具体的,所述糖酵解调节剂为3po。
31.具体的,所述糖酵解调节剂为mtx。
32.具体的,所述糖皮质激素为mp。
33.所述急性移植物抗宿主病患者可为造血干细胞移植后的急性移植物抗宿主病患者。
34.t细胞内的代谢反应控制着细胞的增殖、分化、激活以及凋亡,细胞代谢失衡与免疫紊乱互为因果。因此,深入理解t细胞代谢及其动态调控将为免疫相关疾病的防治提供有效的分子靶点和潜在临床治疗的新方法。通过动物模型发现在移植物抗宿主病的发展过程中,糖酵解成为效应t细胞的主要能量来源。在主要组织相容性复合体不合的移植小鼠模型中,发现供者同种异体反应性t细胞通过增加糖酵解和氧化磷酸化以获得活化和增殖所需的物质,同时细胞代谢关键酶6
‑
磷酸果糖
‑2‑
激酶/果糖
‑
2,6
‑
双磷酸酶3(6
‑
phosphofructo
‑2‑
kinase/fructose
‑
2,6
‑
biphosphatase 3,pfkfb3)水平显著升高。通过药物阻断pfkfb3,抑制糖酵解,可减少同种异体反应性t细胞的产生,从而减轻急性移植物抗宿主病严重程度。
35.目前,移植后agvhd患者的t细胞代谢状态是否存在异常,尚待深入研究。本发明发现,通过调控t细胞糖代谢水平可以改善t细胞功能,从而将糖皮质激素和糖酵解调节剂协同治疗移植后agvhd患者,对临床靶向治疗具有十分重要的意义。
附图说明
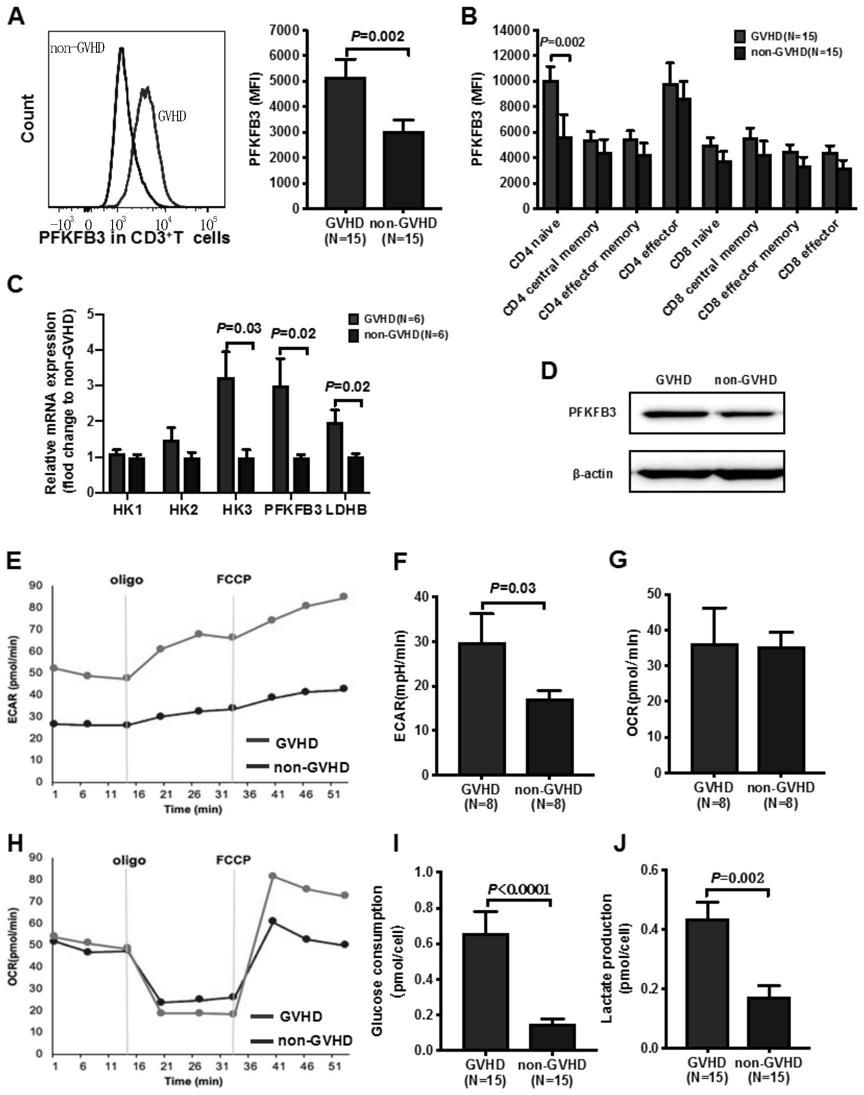
36.图1为实施例1的结果图。
37.图2为实施例2的结果图。
38.图3为实施例3的结果图。
39.图4为实施例4中的存活率结果。
40.图5为实施例4中的评分结果。
41.图6为实施例4中流式细胞术检测pfkfb3和glut1的结果。
42.图7为实施例4中流式细胞术检测cd4
和cd8
细胞比例的结果。
43.图8为实施例4中he染色的结果。
44.图9为实施例4中体内生物发光成像的结果。
具体实施方式
45.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
46.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。如无特殊说明,以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
47.甲泼尼龙(mp),白色结晶性粉末,cas登录号为82
‑
43
‑
2。甲氨蝶呤(mtx),黄色结晶性粉末,cas登录号为59
‑
05
‑
2。3po,全称为3
‑
(3
‑
pyridinyl)
‑1‑
(4
‑
pyridinyl)
‑2‑
propen
‑1‑
one:sigma,st.louis,mo,usa,货号为sml1343,化学结构式为c
13
h
10
n2o。mp属于糖皮质激素。mtx属于糖酵解调节剂。3po属于糖酵解调节剂。
48.cd3磁珠:美天旎(miltenyibiotec,bergischgladbach,germany),货号为130
‑
050
‑
101。带有ms分选柱的minimacs
tm
分离器:美天旎(miltenyibiotec,bergischgladbach,germany),货号为130
‑
090
‑
312。
49.th1细胞表型为cd3
且cd8
‑
且ifn
‑
γ
。th2细胞表型为cd3
且cd8
‑
且il
‑4
。th17细胞表型为cd3
且cd8
‑
且il
‑
17a
。treg细胞表型为cd3
且cd8
‑
且cd25
且foxp3
。tc1细胞表型为cd3
且cd8
且ifn
‑
γ
。tc2细胞表型为cd3
且cd8
且il
‑4
。流式细胞检测中的抗体如下:cd8抗体(bd,货号:560347),ifn
‑
γ抗体(biolegend,货号:502536),il
‑
4抗体(bd,货号:559333),il
‑
17a抗体(biolegend,货号:512304),cd25抗体(bd货号:335807),foxp3抗体(bd,货号:560045)。dmem高糖培养基:gibco,货号:11965092。cd3/cd28抗体偶联磁珠(cd3/cd28 monoclonal antibody beads):gibco,货号:11131d。
50.实施例1、前瞻性临床队列研究发现agvhd患者外周t细胞糖酵解水平异常升高
51.研究对象:同种异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo
‑
hsct)后的agvhd患者(用gvhd表示)以及非agvhd患者(用non
‑
gvhd表示)。agvhd患者与非agvhd患者的基本特征(如性别、年龄、移植前基础疾病、化疗次数、危险度评估、预处理方案、移植干细胞来源、总有核细胞剂量、移植后检测时间、巨细胞病毒感染史)等类似。
52.通过前瞻性临床队列研究发现agvhd患者外周t细胞糖酵解水平异常升高。
53.发明人检测agvhd患者外周t细胞各亚群分布情况发现,与非agvhd患者相比,agvhd患者t细胞向th1、tc1分化,agvhd患者th17细胞升高,th17与treg细胞比例失衡,呈现向促炎表型方向的t细胞分化失衡状态。
54.发明人进一步评估agvhd患者与非agvhd患者外周t细胞是否存在糖酵解水平差异。利用流式细胞术检测受试者的外周血cd3
t细胞中的pfkfb3丰度,与非agvhd患者相比,agvhd患者的pfkfb3丰度增高(图1的a)。利用wseternblot检测受试者的外周血总蛋白中的pfkfb3丰度,与非agvhd患者相比,agvhd患者的pfkfb3丰度增高(图1的d)。利用seahorse细胞能量代谢分析、乳酸测定试剂盒、葡萄糖测定试剂盒检测agvhd患者t细胞糖代谢水平;与非agvhd患者相比,agvhd患者t细胞表现出较高的ecar值(图1的e和f)、较高的葡萄糖消耗速率(图1的i)和较高的乳酸生成速率(图1的j)。然而,与非agvhd患者相比,agvhd患者t细胞的ocr无显著性变化(图1的g和h)。通过流式细胞术检测发现,与非agvhd患者相比,agvhd患者的t细胞,尤其是cd4
幼稚t细胞的pfkfb3蛋白水平显著升高(图1的b)。进一步通过实时荧光定量pcr发现,与非agvhd患者相比,agvhd患者糖酵解途径的代谢酶的mrna水平升高,其中包括己糖激酶3(hk3)、pfkfb3和乳酸脱氢酶b(ldhb)的mrna水平显著升高(图1的c)。
55.综上所述,这些结果表明agvhd患者t细胞存在pfkfb3介导的糖酵解增加。
56.实施例2、pfkfb3调节剂通过抑制糖酵解抑制agvhd患者外周t细胞增殖和活化
57.同种异基因造血干细胞移植(allo
‑
hsct)后的agvhd患者,为北京大学人民医院的确诊病人,对相关试验已知情同意。取agvhd患者的外周血,分离外周血单个核细胞,然后从外周血单个核细胞中分离cd3
细胞,即为外周cd3
t细胞。
58.取外周cd3
t细胞,分为两组,一组进行3po处理(该组别用gvhd 3po表示),一组作为对照组(该组别用gvhd表示)。
59.利用流式细胞术检测细胞中的pfkfb3丰度,结果见图2的a。利用葡萄糖测定试剂盒检测细胞的葡萄糖消耗量,结果见图2的b。利用乳酸测定试剂盒检测细胞的乳酸生成量,结果见图2的c。通过流式细胞术检测t细胞中促炎细胞因子的表达,获得th1细胞比例、tc1细胞比例、th17细胞比例,结果见图2的d、e和f。利用流式细胞术检测细胞中的t细胞炎性转录因子(t
‑
bet和rorγt)丰度,结果见图2的g和h。利用流式细胞术检测细胞中的gata3和foxp3丰度,结果见图2的i和j。利用流式细胞术检测细胞中的t细胞的增殖能力和t细胞凋亡情况,结果见图2的k和l。
60.结果表明:应用3po可显著降低agvhd患者t细胞中pfkfb3的表达,促使葡萄糖消耗速率降低,促使乳酸生成速率显著降低;3po降低agvhd患者t细胞中促炎细胞因子的表达,th1细胞、tc1细胞和th17细胞的比例降低;3po降低agvhd患者t细胞炎性转录因子的表达,t
‑
bet和rorγt降低;3po对于转录因子gata3、foxp3的表达无明显影响;3po降低了agvhd患者t细胞的增殖能力,而不影响t细胞的凋亡。
61.综上所述,3po通过抑制糖酵解抑制agvhd患者外周t细胞活化和增殖。
62.实施例3、糖皮质激素与糖酵解调节剂协同治疗agvhd
63.一、获得agvhd患者的cd3
t细胞
64.同种异基因造血干细胞移植(allo
‑
hsct)后的agvhd患者,均为北京大学人民医院的确诊病人,对相关试验已知情同意。
65.1、取患者的外周血,分离单个核细胞。
66.2、使用cd3磁珠和带有ms分选柱的minimacs
tm
分离器从步骤1获得的单个核细胞中分离cd3
细胞,即为cd3
t细胞。
signaling technology,danvers,ma,usa)或胞内流式抗体glut1(cell signaling technology,danvers,ma,usa)。
92.(5)加入2ml pbs缓冲液并混匀,1500rpm离心5分钟;然后,弃上清,加入100μl fix&perm
tm
细胞透化试剂盒中的透化培养基b混匀,加入兔抗鼠二抗(cell signaling technology,danvers,ma,usa),室温避光孵育15min。
93.(6)加入2ml pbs缓冲液并混匀,1500rpm离心5分钟;然后,弃上清,加入200μl pbs缓冲液重悬细胞,4h内上机检测。流式图像分析采用diva 7.0软件(美国bd公司)。
94.结果见图3的f和g。
95.3、检测葡萄糖消耗
96.(1)取96孔板,每孔接种2
×
105个步骤1处理后的细胞,采用100
‑
200μl含cd3/cd28抗体偶联磁珠和10%fbs的dmem高糖培养基培养24小时。cd3/cd28抗体偶联磁珠数量与细胞数量的配比为1:1。
97.(2)完成步骤(1)后,1500rpm离心5分钟,收集上清液。
98.(3)取步骤(2)得到的上清液,采用葡萄糖测定试剂盒(南京建成生物工程研究所,货号:361510)检测葡萄糖含量,计算葡萄糖消耗率。
99.结果见图3的d。
100.4、检测乳酸生成
101.(1)取96孔板,每孔接种2
×
105个步骤1处理后的细胞,采用100
‑
200μl含cd3/cd28抗体偶联磁珠和10%fbs的dmem高糖培养基培养24小时。cd3/cd28抗体偶联磁珠数量与细胞数量的配比为1:1。
102.(2)完成步骤(1)后,1500rpm离心5分钟,收集上清液。
103.(3)取步骤(2)得到的上清液,采用乳酸测定试剂盒(南京建成生物工程研究所,货号:a019
‑2‑
1)检测乳酸含量,计算乳酸生成率。
104.结果见图3的e。
105.5、检测t细胞中促炎细胞因子的表达
106.(1)取96孔板,每孔接种取2
×
105个步骤1处理后的细胞,加入1ng/μl pma水溶液100μl、1μg/μl离子霉素水溶液2μl、golgistop水溶液0.7μl,震荡混匀,37℃孵箱孵育4
‑
6小时。
107.(2)1500rpm离心5min,弃上清后弹起细胞,加入表面流式抗体(cd3抗体、cd8抗体和cd25抗体),室温孵育15min。
108.(3)加入2ml pbs缓冲液,1500rpm离心5min,弃上清后弹起细胞。
109.(4)加入1ml由ebioscience
tm
foxp3/转录因子固定浓缩液和diluent buffer按照1:3配制的固定液,涡旋混匀,4℃冰箱孵育30min。
110.(5)加入2ml由wash buffer和去离子水按1:9比例配制的破核膜工作液(invitrogen,ebioscience
tm
foxp3/转录因子染色缓冲液套件,货号:00
‑
5523
‑
00),2000rpm离心5min,弃上清。
111.(6)加入胞内抗体(ifn
‑
γ、il
‑
4、il
‑
17和foxp3),涡旋混匀,4℃冰箱孵育30min。
112.(7)加2ml破核膜工作液,2000rpm
×
5min,弃上清,加200μl破核膜工作液,弹起细胞。
113.(8)24h内上机检测。流式图像分析采用diva 7.0软件。
114.结果见图3的a和b。
115.6、cck
‑
8检测t细胞增殖能力
116.(1)取96孔板,每孔接种取100μl1
×
105/ml步骤一处理后的细胞,培养24h。
117.(2)向每孔加入10μl cck
‑
8溶液,在培养箱内孵育2h。
118.(3)用酶标仪测定在450nm的吸光度。
119.结果见图3的c。
120.7、nf
‑
κb p65的检测
121.(1)取步骤1处理后的细胞至流式检测管。
122.(2)在流式检测管中加入5μl cd3
细胞表面流式抗体cd3,室温避光孵育15min。
123.(3)加入2ml pbs缓冲液并混匀,1500rpm离心5分钟;然后,弃上清,加入100μl fix&perm
tm
细胞透化试剂盒中的固定培养基a(invitrogen,货号:gas004)混匀,室温避光孵育15min。
124.(4)加入2ml pbs缓冲液并混匀,1500rpm离心5分钟;然后,弃上清,加入100μl fix&perm
tm
细胞透化试剂盒中的透化培养基b(invitrogen,货号:gas004)混匀,加入1μl胞内流式抗体nf
‑
κb p65(cell signaling technology,danvers,ma,usa),室温避光孵育15min。
125.(5)加入2ml pbs缓冲液并混匀,1500rpm离心5分钟;然后,弃上清,加入100μl fix&perm
tm
细胞透化试剂盒中的透化培养基b混匀,加入兔抗鼠二抗(cell signaling technology,danvers,ma,usa),室温避光孵育15min。
126.(6)加入2ml pbs缓冲液并混匀,1500rpm离心5分钟;然后,弃上清,加入200μl pbs缓冲液重悬细胞,4h内上机检测。流式图像分析采用diva 7.0软件(美国bd公司)。
127.结果见图3的h。
128.四、ci值的计算
129.供试细胞:步骤一制备的cd3
t细胞。
130.设置两种药物组合:mp和3po组合,mp和mtx组合。
131.每种药物组合设置多种配比浓度。
132.参照步骤二的分组处理方法进行处理。
133.通过com
‑
pusyn软件计算计算对cd3
t细胞合成ifnγ的抑制率为25%、50%、75%、90%、95%时对应的ci值。通过com
‑
pusyn软件计算对cd3
t细胞增殖的抑制率为25%、50%、75%、90%、95%时对应的ci值。
134.结果见图3的j。mp和3po对于t细胞ifnγ合成的平均ci值为0.364;mp和mtx对于t细胞ifnγ合成的平均ci值为0.554。mp和3po对于t细胞增殖的平均ci值为0.475;mp和mtx对于t细胞增殖的平均ci值为0.406。
135.对agvhd患者外周t细胞体外联合应用糖皮质激素(mp)和糖酵解调节剂(3po或mtx),发现联合应用糖皮质激素和糖酵解调节剂可协同抑制糖酵解,进而协同抑制agvhd患者外周t细胞活化和增殖。
136.通过剂量
‑
反应效应,发现mp(1μm)和mtx(0.5μm)作用48h对agvhd患者t细胞的抑制效果最好,但对t细胞存活无明显影响。体外应用mp和mtx显著降低了葡萄糖消耗速率和
乳酸生成速率。mp通过下调glut1和pfkfb3的表达来降低t细胞的糖酵解活性。mtx通过下调glut1的表达来降低t细胞的糖酵解活性。此外,mp和mtx降低了agvhd患者t细胞中促炎性细胞,包括th1、tc1细胞的比例较低。并且mp和mtx降低了agvhd患者t细胞的增殖,但不显著影响t细胞凋亡。这些结果表明mp通过抑制glut1和pfkfb3刺激的糖酵解来抑制t细胞活化和增殖,mtx通过抑制glut1刺激的糖酵解来抑制t细胞活化和增殖。
137.糖皮质激素和糖酵解调节剂联合使用,对agvhd患者t细胞活性的改善具有协同作用,其机制可能是通过降低糖酵解活性来实现的。与单药处理的细胞相比,糖皮质激素和糖酵解调节剂联合使用对t细胞向促炎性th1、tc1分化及t细胞增殖有协同抑制作用。此外,糖皮质激素和糖酵解调节剂联合使用在体外对糖酵解活性的下调作用优于糖皮质激素单独作用。
138.值得注意的是,联合方案对t细胞有很强的协同作用,mp和3po对于t细胞ifnγ合成的平均ci值为0.364。此外,mp和mtx对于t细胞ifnγ合成的平均ci值为0.554。mp和3po对于t细胞增殖的平均ci值为0.475。此外,mp和mtx对于t细胞增殖的平均ci值为0.406。
139.实施例4、糖皮质激素与糖酵解调节剂协同治疗agvhd
140.采用agvhd小鼠模型验证糖皮质激素与糖酵解调节剂的协同治疗作用。
141.npg小鼠(nod.cg
‑
prkdcscid il2rgtm1vst/vst小鼠):北京维通利华实验动物技术有限公司。
142.荧光素酶luciferase
thp
‑
1白血病细胞(thp
‑1‑
luc cells),记载于如下文献:azacytidine prevents experimental xenogeneic graft
‑
versus
‑
host diseasewithout abrogating graft
‑
versus
‑
leukemia effects,oncoimmunology,2017,vol.6,no.5,e1314425。
143.1、用1
×
溶血素悬浮人外周血干细胞,混悬震荡5秒,然后冰上避光静置15分钟,然后1500rpm离心5分钟,弃上清;然后用pbs缓冲液悬浮,然后1500rpm离心5分钟,弃上清;然后用pbs缓冲液悬浮,得到细胞悬液。1体积份10
×
溶血素(bd biosciences)和9体积份灭菌注射用水混匀,得到1
×
溶血素。
144.2、npg小鼠注射细胞前一周开始饮用抗生素水,预防感染,置入空气层流柜行无菌饲养。
145.3、注射细胞前一天用
60
coγ射线以1.5gy(半致死剂量)对npg小鼠行全身照射。
146.4、每只小鼠经尾静脉注射步骤1制备的细胞悬液(5
×
106个细胞/只)和荧光素酶luciferase
thp
‑
1白血病细胞(1
×
106个细胞/只)。完成注射后开始计天数。
147.5、完成步骤4的小鼠,随机分为六组(pbs组、mp组、3po组、mtx组、mp联合3po组、mp联合mtx组),每组11只。pbs组小鼠每天腹腔注射1次pbs缓冲液,注射体积为200μl/只。mp组小鼠每天腹腔注射1次mp溶液,注射体积为200μl/只,mp的剂量为2毫克/千克体重/次。3po组小鼠每天腹腔注射1次3po溶液,注射体积为200μl/只,3po的剂量为25毫克/千克体重/次。mtx组小鼠每天腹腔注射1次mtx溶液,注射体积为200μl/只,mtx的剂量为1毫克/千克体重/次。mp联合3po组小鼠每天腹腔注射1次mp
‑
3po溶液,注射体积为200μl/只,mp的剂量为2毫克/千克体重/次,3po的剂量为25毫克/千克体重/次。mp联合mtx组小鼠每天腹腔注射1次mp
‑
mtx溶液,注射体积为200μl/只,mp的剂量为2毫克/千克体重/次,mtx的剂量为1毫克/千克体重/次。连续给药30天。pbs组又称为ctl组。
148.mp溶液是将mp溶于无菌水得到的。3po溶液是将3po溶于无菌水得到的。mtx溶液是将mtx溶于无菌水得到的。mp
‑
3po溶液是将mp和3po溶于无菌水得到的。mp
‑
mtx溶液是将mp和mtx溶于无菌水得到的。
149.持续统计存活率,结果见图4。
150.第28天,进行急性gvhd评分。急性gvhd临床评分系统基于六个参数:体重减轻、姿势、活动、皮毛质地、皮肤完整性和腹泻。结果见图5。
151.第30天,处死小鼠,取肝脏、脾脏,收集单个核细胞,流式细胞术检测cd4
细胞比例、cd8
细胞比例、th1细胞比例、tc1细胞比例以及t细胞增殖能力。结果见图6。
152.第28天,取小鼠外周血,收集单个核细胞,流式细胞术检测cd4
细胞比例和cd8
细胞比例。结果见图7。
153.第28天,处死小鼠,取急性gvhd靶器官(肝、脾、皮肤、肠道、肺)组织,用4%多聚甲醛固定,然后制备石蜡切片并进行he染色。按照评分系统进行小鼠急性gvhd病理评分。结果见图8。
154.第21天,通过体内生物发光成像评估npg小鼠移植后白血病细胞的清除情况。结果见图9。寻找有效治疗gvhd的同时又能保持gvl效应的途径对提高造血干细胞移植的疗效,减少移植相关并发症至关重要。为了进一步探究mp与3po或mtx联用治疗是否影响gvl效应,回输荧光素酶luciferase
thp
‑
1白血病细胞,通过体内生物发光成像评估npg小鼠移植后白血病细胞的清除情况。与单用mp相比,mp与3po或mtx联用治疗对gvl的影响不明显。这些结果表明在人源化小鼠模型中,mp与3po或mtx联用可通过下调糖酵解活性,协同降低t细胞的同种异体反应性,改善agvhd,而不丧失gvl效应。
155.与单药治疗相比,联合应用糖皮质激素(mp)和糖酵解调节剂(3po或mtx)可降低小鼠agvhd临床评分和致死率。病理学证据表明,mp与3po或mtx联用的小鼠gvhd靶器官病理学评分显著降低。结果表明,联合应用mp和3po或者联合应用mp和mtx可协同治疗agvhd。
156.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。