本发明涉及一种治疗高血压和高脂血症的单一剂型药物组合物。
背景技术:
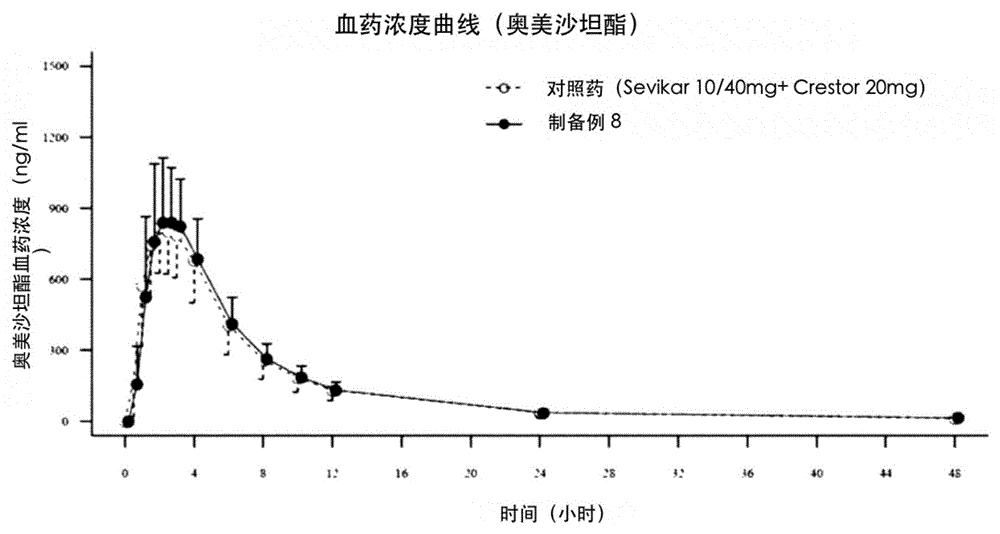
由于高血压和高脂血症患者众多,许多患者被同时开出治疗高血压和高脂血症的药物。由于给患者开单一剂型是有利的,例如,卡杜埃坦(CaduetTM)是阿托伐他汀(atorvastatin)和氨氯地平(amlodipine)的一种复合药物,正在作为治疗高血压和高脂血症的复合药物给患者开处方。奥美沙坦酯是一种优秀的血管紧张素Ⅱ受体阻滞剂(AngiotensinIIreceptorblockerARB),已知可用作治疗或预防高血压、心脏病等的药物。奥美沙坦酯目前以商品名OlmetecTM出售。氨氯地平是钙通道阻滞剂(CalciumChannelBlockerCCB),已知可用作治疗或预防高血压、心脏病等的药物。氨氯地平目前以NorvascTM的商品名出售。同时,瑞舒伐他汀是一种HMG-CoA还原酶抑制剂(HMG-CoAreductaseinhibitor),用于治疗高胆固醇血症、高脂蛋白血症和动脉粥样硬化,目前以CrestroTM的商品名出售。奥美沙坦酯作为血管紧张素Ⅱ受体阻滞剂对肾素依赖性高血压特别有用,而氨氯地平对肾素非依赖性高血压非常有用,因为氨氯地平除了具有钙通道扩张作用外,还具有钠利尿剂作用。因此,奥美沙坦酯和氨氯地平的复合药物被开发出来用于治疗高血压,无论病因如何,目前以SevikarTM的商品名出售。同时,本申请人通过韩国专利申请号10-2013-0030734公开了一种含有奥美沙坦酯和瑞舒伐他汀的复合药物,目前,含有奥美沙坦酯和瑞舒伐他汀的复合药物以商品名OlostarTM销售。如上所述,分别开发有含有奥美沙坦酯和氨氯地平的复合药物和含有奥美沙坦酯和瑞舒伐他汀的复合药物,但是迄今为止尚未开发含有奥美沙坦酯、氨氯地平和瑞舒伐他汀的复合药物。相关技术文件专利文件(专利文件1)韩国专利申请号10-2013-0030734技术实现要素:技术问题虽然本申请人的在先发明(申请号10-2013-0030734)中,开发了含有奥美沙坦酯和瑞舒伐他汀的单一剂型的复合药物,但是奥美沙坦酯和瑞舒伐他汀表现出相互干扰或相互作用,而且已经证实即使为了防止干扰或相互作用而制备了单独分隔的复合药物,但是只有当使用特定的崩解剂时,每个单独制剂的生物等效性才得到保证。同时,当两种药物奥美沙坦酯和氨氯地平组合使用时,由于药物相互作用,奥美沙坦酯的溶出度降低。因此,本发明的目的是开发一种作为包含奥美沙坦酯、氨氯地平和瑞舒伐他汀的单一剂型的药物组合物的复合药物,其中每种药物均满足与药物溶出度和生物等效性相关的所有要求。技术方案作为通过设计各种制剂来进行试验以开发包含奥美沙坦酯、氨氯地平和瑞舒伐他汀的单一剂型的复合药物的结果,本发明人完成了本发明。本发明提供一种单一剂型的药物组合物,其包含:包含奥美沙坦酯和氨氯地平或其盐的隔室;以及包含瑞舒伐他汀或其盐的隔室,其中所述隔室以彼此分离的形式制成。本发明证实由于通过将药物组合物分为包含奥美沙坦酯和氨氯地平或其盐的隔室;以及包含瑞舒伐他汀或其盐的隔室来制成包含奥美沙坦酯、氨氯地平或其盐、和瑞舒伐他汀或其盐的药物组合物,防止了奥美沙坦酯和瑞舒伐他汀之间的药物相互作用以及奥美沙坦酯和氨氯地平之间的药物相互作用,从而所述药物组合物表现出与对照药物相似的溶出模式。此外,本发明人证实,在特定溶出溶液条件下,试验管内(体外)比较溶出试验中,与含有奥美沙坦酯和氨氯地平的单一制剂相比,只有当奥美沙坦酯的溶出度在药物等效性方面设计为与非等效水平一样高的水平时,才能获得生物等效于含有奥美沙坦酯和氨氯地平的单一制剂的制剂。即,根据本发明的复合药物组合物具有比包含奥美沙坦酯和氨氯地平的单一剂型的常规复合药物更高的奥美沙坦酯初始溶出度。本发明的药物组合物可具有单独的隔室剂型,例如,双层片、包芯片、含有小片和/或含有微丸的胶囊。在本发明的示例性实施例中,本发明的药物组合物具有双层片的剂型,该双层片包括含有奥美沙坦酯和氨氯地平或其盐的层和含有瑞舒伐他汀或其盐的层。在另一示例性实施例中,本发明的药物组合物具有包芯片的剂型,该片剂包括含有瑞舒伐他汀或其盐的内核和含有奥美沙坦酯和氨氯地平或其盐的外壳。或者,本发明的药物组合物具有包芯片的剂型,包括含有奥美沙坦酯和氨氯地平或其盐的内核和含有瑞舒伐他汀或其盐的外壳。在又一示例性实施例中,本发明的药物组合物可具有胶囊的剂型,该胶囊包含含有瑞舒伐他汀或其盐的小片和含有奥美沙坦酯和氨氯地平或其盐的小片。在又一示例性实施例中,本发明的药物组合物可具有胶囊的剂型,所述胶囊包含含有瑞舒伐他汀或其盐的小片和含有奥美沙坦酯和氨氯地平或其盐的微丸或粉末。或者,本发明的药物组合物可以具有胶囊的剂型,该胶囊包含含有奥美沙坦酯和氨氯地平或其盐的小片和含有瑞舒伐他汀或其盐的微丸或粉末。在又一示例性实施例中,本发明的药物组合物可具有胶囊的剂型,所述胶囊包含含有奥美沙坦酯和氨氯地平或其盐的微丸和含有瑞舒伐他汀或其盐的微丸。作为特殊点,优选含有奥美沙坦酯和氨氯地平或其盐的隔室含有磷酸氢钙二水合物。如可在以下实施例中证实的,当在含有奥美沙坦酯和氨氯地平或其盐的隔室中含有磷酸氢钙二水合物时,可在比较溶出试验和生物等效性试验中获得优异结果。相反,当磷酸氢钙二水合物仅包含在瑞舒伐他汀隔室中时,即使磷酸氢钙二水合物的含量增加,在比较溶出试验和生物等效性试验中也不能获得令人满意的结果。此外,与磷酸氢钙二水合物用于比较溶出试验中的情况相比,在含有奥美沙坦酯和氨氯地平或其盐的隔室中含有无水磷酸氢钙而不是磷酸氢钙二水合物的制剂具有比对照药物更小的相对于奥美沙坦酯的偏差,并且具有比对照药物更大的相对于氨氯地平和瑞舒伐他汀的偏差。然而,在生物等效性试验中,该制剂与对照药物不等效。因此,本发明的优选示例性实施例在含有奥美沙坦酯和氨氯地平或其盐的隔室中含有磷酸氢钙二水合物。基于含有奥美沙坦酯和氨氯地平或其盐的隔室的总100重量份,可含有磷酸氢钙二水合物在1重量份到30重量份、优选1重量份到20重量份、例如10重量份到20重量份的范围内。在本发明的示例性实施例中,含有奥美沙坦酯和氨氯地平或其盐的隔室可优选地含有选自预胶化淀粉、交联羧甲基纤维素钠、交联聚维酮、羧甲基纤维素钙、羧甲基淀粉钠、共聚维酮和复合硅酸盐中两种以上的崩解剂。基于含有奥美沙坦酯和氨氯地平或其盐的隔室的总100重量份,可含有的崩解剂在5重量份到60重量份,但该量不限于此。具体而言,基于含有奥美沙坦酯和氨氯地平或其盐的隔室总的100重量份,分别含有4重量份至40重量份预胶化淀粉、1重量份至10重量份交联羧甲基纤维素钠及1重量份至20重量份交联聚维酮。同样地,基于含有奥美沙坦酯和氨氯地平或其盐的隔室的总100重量份,可含有的羧甲基纤维素钙、羧甲基淀粉钠、共聚维酮和复合硅酸盐中的每一种为1至40重量份。含有奥美沙坦酯和氨氯地平或其盐的隔室除了含有磷酸氢钙二水合物和崩解剂外,还可含有合适的赋形剂和添加剂。赋形剂的实例包括乳糖(包括其水合物)、糊精、甘露醇、山梨醇、淀粉、微晶纤维素[例如CelphereTM]、硅化微晶纤维素[例如ProsolvTM]、碳酸钙、糖或其混合物。其它添加剂的实例包括粘合剂、助溶剂、着色剂等。粘合剂包括聚乙烯吡咯烷酮、共聚维酮、明胶、淀粉、蔗糖、甲基纤维素、乙基纤维素、羟丙基纤维素、羟丙基烷基纤维素(例如羟丙基甲基纤维素)及其混合物。所述助溶剂包括硬脂酸、硬脂酸盐(例如硬脂酸镁)、滑石、玉米淀粉、巴西棕榈蜡、硬无水硅酸、硅酸镁、合成硅酸铝、硬化油、白铅、氧化钛、微晶纤维素、聚乙二醇4000和6000、肉豆蔻酸异丙酯、磷酸氢钙,以及它们的混合物。同时,在本发明的示例性实施例中,含有瑞舒伐他汀或其盐的隔室优选含有两种以上崩解剂,所述崩解剂选自交联聚维酮、低取代羟丙基纤维素、交联羧甲基纤维素钠和羧甲基纤维素钙。基于含有瑞舒伐他汀或其盐的隔室的总100重量份,含有2重量份至20重量份崩解剂,但该范围不限于此。具体地,基于含有瑞舒伐他汀或其盐的隔室的总100重量份,可含有1至20重量份、优选含有1至10重量份的交联聚维酮、低取代羟丙基纤维素、交联羧甲基纤维素钠和羧甲基纤维素钙中的任意一种。在本发明的示例性实施例中,基于含有瑞舒伐他汀或其盐的隔室的总100重量份,含有瑞舒伐他汀或其盐的隔室含有2重量份到20重量份的作为崩解剂的交联聚维酮和交联羧甲基纤维素钠。在这种情况下,可基于含有瑞舒伐他汀或其盐的隔室的总100重量份,可以包含1至20重量份(例如,1至10重量份)交联聚维酮和交联羧甲基纤维素钠中的任意一种。除崩解剂外,含有瑞舒伐他汀或其盐的隔室可含有合适的赋形剂和添加剂。赋形剂的实例包括乳糖(包括其水合物)、糊精、甘露醇、山梨醇、淀粉、微晶纤维素[例如CelphereTM]、硅化微晶纤维素[例如ProsolvTM]、磷酸二氢钙(包括其水合物)、无水磷酸二氢钙、碳酸钙、糖或其混合物。其它添加剂的实例包括粘合剂、助溶剂、着色剂等。粘合剂包括聚乙烯吡咯烷酮、共聚维酮、明胶、淀粉、蔗糖、甲基纤维素、乙基纤维素、羟丙基纤维素、羟丙基烷基纤维素(例如羟丙基甲基纤维素)及其混合物。所述助溶剂包括硬脂酸、硬脂酸盐(例如硬脂酸镁)、滑石、玉米淀粉、巴西棕榈蜡、硬无水硅酸、硅酸镁、合成硅酸铝、硬化油、白铅、氧化钛、微晶纤维素、聚乙二醇4000和6000、肉豆蔻酸异丙酯、磷酸氢钙,以及它们的混合物。在示例性实施例中,呈双层片形式的本发明药物组合物可通过传统方法制备奥美沙坦酯/苯磺酸氨氯地平部分混合物及瑞舒伐他汀-钙部分混合物中的每一者,然后使用双层片机压缩该混合物来制备。在另一示例性实施例中,呈双层片形式的本发明药物组合物可通过制备奥美沙坦酯/苯磺酸氨氯地平颗粒及瑞舒伐他汀颗粒中任意一个,然后使用双层片机压缩所述颗粒来制备。奥美沙坦酯/苯磺酸氨氯地平颗粒和瑞舒伐他汀颗粒可通过使用传统方法的干法造粒或湿法造粒工艺制备。如有必要,可在获得的双层片上形成诸如OpadryTM的膜包衣层。在另一个示例性实施例中,双层片形式的本发明药物组合物可通过形成含有瑞舒伐他汀的内核片,然后形成如上所述的薄膜包衣层(如有必要)来制备,然后使用单压片机(EKO、Korsch)等将内核片与奥美沙坦酯颗粒一起压缩。这里,含有瑞舒伐他汀的内核片可以例如通过将瑞舒伐他汀钙部分制备为干颗粒或湿颗粒,然后用连续压片机(PiccolaD-8,RIVA)等压缩瑞舒伐他汀钙部分来制备。如有必要,还可在所获得的包芯片上形成诸如OpadryTM的膜包衣层。在又一示例性实施例中,以包含小片的剂型形式存在的本发明药物组合物可通过制备包含奥美沙坦酯/氨氯地平或其盐的小片和/或包含瑞舒伐他汀或其盐的小片来制备,然后将所述小片与含有瑞舒伐他汀或其盐的小片、微丸或粉末,或含有奥美沙坦酯/氨氯地平或其盐的小片、微丸或粉末一起填充到胶囊中。在又一个示例性实施例中,可通过制备奥美沙坦酯/苯磺酸氨氯地平微丸和瑞舒伐他汀微丸中的每一种,然后用所述微丸填充胶囊来制备含有微丸的胶囊形式的本发明药物组合物。这里,瑞舒伐他汀微丸可通过例如将non-pareil珠状物放入流化床涂布机中并使用通过将瑞舒伐他汀钙、赋形剂(稀释剂)、粘合剂和崩解剂溶解于适当溶剂中制备的涂布溶液来制备,例如,水和甲醇的混合溶剂。涂布溶液的粘度最好在5mPas到100mPas的范围内。此外,还可通过将non-pareil珠状物放入流化床涂布机中并用通过将奥美沙坦酯、赋形剂(稀释剂)和粘合剂溶解于适当溶剂(例如,水和甲醇的混合溶剂)中制备的涂布溶液涂布所述珠状物来类似地制备奥美沙坦酯微丸。当本发明的药物组合物是片剂时,药物组合物可被包衣剂涂覆。在示例性实施例中,本发明的药物组合物可以是涂覆有包衣剂的双层片或包芯片。包衣剂,例如,膜包衣剂可包含典型聚合物,例如OpadryTM。作为膜包衣剂,可具体使用聚乙烯醇(PVA)、聚乙烯醇共聚物、羟丙基甲基纤维素(HPMC)等。聚乙烯醇共聚物的实例可为PVA/聚乙二醇接枝聚合物,但不限于此。在示例性实施例中,本发明的药物组合物可为涂覆有聚乙烯醇或聚乙烯醇共聚物的双层片或包芯片。所使用的膜包衣剂的量优选为能够提供最佳制剂尺寸的最小量,且不受特别限制。同时,在本发明中,氨氯地平的盐包含典型的药学上可接受的盐,并且例如,可以使用苯磺酸盐、盐酸盐、氢溴酸盐、富马酸盐、柠檬酸盐、酒石酸盐、马来酸盐、甘氨酸盐、乳酸盐、甲磺酸盐、甘氨酸盐、葡萄糖酸盐等。优选地,可以使用苯磺酸氨氯地平。同时,瑞舒伐他汀的盐包括典型的医药上可接受的盐,并且例如,可以使用钙盐、盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、醋酸盐、苹果酸盐、富马酸盐、乳酸盐、酒石酸盐、柠檬酸盐、葡萄糖酸盐、苯磺酸盐、甘草酸盐等。优选地,可使用瑞舒伐他汀钙。尽管不限于此,奥美沙坦酯、氨氯地平或其盐、瑞舒伐他汀或其盐的粒径可适当调整。当需要药物粒度的微粉化时,可使用典型的磨机,例如Z型磨机、锤式磨机、球磨机和流体能磨机,粉碎颗粒。此外,可使用使用筛子进行的筛分方法或诸如气流分类的粒度分类方法来细分药物的粒度。调整所需粒径的方法在本领域是众所周知的。例如,参考以下文件:[药物剂型:第2卷,第2版,编辑:H.A.Lieberman,L.Lachman,J.B.Schwartz(第3章:尺寸减小)]。本说明书中药物的粒径基于粒径分布来表示,例如d(X)=Y(其中X和Y是正数)。d(X)=Y是指当通过测量制剂中任何药物的粒径获得的药物的粒径分布由累积曲线表示时,以粒径升序累积的X%(%基于数量、体积或重量计算)处的粒径为Y。例如,d(10)表示在药物的粒径以升序累积并且变为10%的点处的粒子的直径,d(50)表示在药物的粒径以升序累积并且变为50%的点处的粒子的直径,并且d(90)表示在药物的粒径以升序累积并变为90%的点处的粒子的直径。粒度分布d(X)是否代表基于数量、体积或重量的总累积颗粒的百分比取决于用于测量粒度分布的方法。本领域已知测量粒度分布的方法和相关的%类型。例如,当通过众所周知的激光衍射方法测量粒度分布时,d(X)中的X值表示由体积平均值计算的百分比。本领域技术人员清楚地知道,基于典型实验的经验,通过特定方法获得的测量粒度分布的结果可以与从其他技术获得的结果相关联。例如,激光衍射方法响应于粒子的体积提供体积平均粒径,其对应于密度恒定时的重量平均粒径。在本发明中,可以使用基于激光衍射的商用设备来测量药物颗粒的粒度分布·基于Mie理论的散射方法。例如,药物颗粒的粒径分布是使用市售设备测量的,例如MalvernInstrumentsLtd.制造的Mastersizer激光衍射仪。在该设备中,当用氦氖激光束和蓝光发光二极管照射颗粒时,会发生散射,从而在探测器上出现光散射图样,并根据Mie理论对光散射图样进行分析,得到粒子的粒径分布。测量方法可以是干法或湿法。在奥美沙坦酯的情况下,D(90)可以是5到45μm、最好10到30μm。在氨氯地平或其盐的情况下,D(90)可为5至100μm、最好是10到60μm、最好是15到45μm。在瑞舒伐他汀或其盐的情况下,D(90)可为5至50μm、最好15到40μm、最好是20到35μm。当奥美沙坦酯、氨氯地平或其盐、瑞舒伐他汀或其盐在上述范围内时,可适当指示药物的溶出度,其水平相当于对照药物,以及血药浓度-时间曲线下的面积(AUC)和生物等效于对照药物水平的最大血药浓度(Cmax)。本发明的药物组合物可用于需要同时施用奥美沙坦酯和瑞舒伐他汀的患者。目前,奥美沙坦酯和氨氯地平的联合用药用于治疗原发性高血压,其中氨氯地平或奥美沙坦酯单药治疗不能适当调节血压。此外,瑞舒伐他汀用于治疗高胆固醇血症、高脂蛋白血症和/或动脉粥样硬化。关于每种药物的信息已经众所周知了。本发明提供一种药物组合物,其中氨氯地平或其盐的溶出度等同于SevikarTM片剂的氨氯地平或其盐的溶出度。在此,溶出度是否达到等效水平,可按《药品等效性试验管理规定》进行判定。本发明还提供一种药物组合物,其中瑞舒伐他汀或其盐的溶出度相当于甲硝唑片剂的瑞舒伐他汀的溶出度。在本发明的药物组合物中,奥美沙坦酯和氨氯地平或其盐的特征在于显示血药浓度-时间曲线下的面积(AUC)和最大血药浓度(Cmax),其生物等效于具有相同活性成分剂量的SevikarTM片剂。此外,本发明药物组合物中的瑞舒伐他汀钙盐的特征在于显示血药浓度-时间曲线下的面积(AUC)和生物等效于具有相同活性成分剂量的克瑞司妥坦片剂的水平的最大血药浓度(Cmax)。因此,本发明的药物组合物对于需要氨氯地平和奥美沙坦酯的联合治疗并且同时需要施用瑞舒伐他汀的患者特别有用。在本发明的药物组合物中,活性成分奥美沙坦酯、氨氯地平或其盐、瑞舒伐他汀或其盐可按治疗有效量使用。治疗有效量可根据患者的症状、年龄和体重、疾病的严重程度等而变化。奥美沙坦酯可基于例如单位制剂(即单位给药形式)以约5mg至约80mg、优选约10mg至约40mg的含量使用,但其含量不限于此。此外,氨氯地平或其盐可基于单位制剂(即单位给药形式)以约2.5mg至10mg的含量使用。此外,瑞舒伐他汀或其盐可基于单位制剂(即单位给药形式)以约2.5mg至约40mg、优选约5mg至约20mg的含量使用。在示例性实施例中,本发明的药物组合物可包含40mg奥美沙坦酯、10mg氨氯地平或其盐和20mg瑞舒伐他汀或其盐。在另一示例性实施例中,本发明的药物组合物可包含40mg奥美沙坦酯、10mg氨氯地平或其盐和10mg瑞舒伐他汀或其盐。在又一示例性实施例中,本发明的药物组合物可包含40mg奥美沙坦酯、5mg氨氯地平或其盐和10mg瑞舒伐他汀或其盐。在又一示例性实施例中,本发明的药物组合物可包含40mg奥美沙坦酯、5mg氨氯地平或其盐和5mg瑞舒伐他汀或其盐。在又一示例性实施例中,本发明的药物组合物可包含20mg奥美沙坦酯、5mg氨氯地平或其盐、10mg瑞舒伐他汀或其盐。在又一示例性实施例中,本发明的药物组合物可包含20mg奥美沙坦酯、5mg氨氯地平或其盐、5mg瑞舒伐他汀或其盐。在示例性实施例中,本发明的药物组合物可包含40mg奥美沙坦酯、2.5mg氨氯地平或其盐和20mg瑞舒伐他汀或其盐。在又一示例性实施例中,本发明的药物组合物可包含40mg奥美沙坦酯、2.5mg氨氯地平或其盐和10mg瑞舒伐他汀或其盐。在又一示例性实施例中,本发明的药物组合物可包含20mg奥美沙坦酯、2.5mg氨氯地平或其盐、10mg瑞舒伐他汀或其盐。在又一示例性实施例中,本发明的药物组合物可包含20mg奥美沙坦酯、2.5mg氨氯地平或其盐、5mg瑞舒伐他汀或其盐。根据本发明的药物组合物可每天施用一次,但不限于此。发明效果根据本发明,含有药物的隔室以单独形式配制以解决由于药物相互作用而引起的与药物的溶出和吸收有关的问题,并且与常规单一制剂相比,可以获得生物等效制剂。附图说明图1示出了制备例7至9的制剂相对于奥美沙坦酯的对照药物的溶出度试验结果。图2示出了制备例7至9的制剂相对于苯磺酸氨氯地平的对照药物的溶出度试验结果。图3示出了制备例7至9的制剂相对于瑞舒伐他汀钙盐与对照药物的溶出度试验结果。图4至6分别说明了当施用制备例8的双层片(试验药物)和对照药物(Sevikar和Crestor)时,奥美沙坦酯血药浓度曲线、苯磺酸氨氯地平血药浓度曲线和瑞舒伐他汀随时间的血药浓度曲线。图7至9分别说明了当施用制备例15的双层片(试验药物)和对照药物(Sevikar和Crestor)时,奥美沙坦酯血药浓度曲线、苯磺酸氨氯地平血药浓度曲线和瑞舒伐他汀随时间的血药浓度曲线。具体实施方式实施例在下文中,将在以下示例中更详细地描述本发明。然而,以下实施例仅例示了本发明的内容,并不限制本发明的权利范围。根据本发明的详细说明和示例,应当理解,本发明所属领域的技术人员能够容易地推断出的内容属于本发明的权利范围。制备例奥美沙坦/氨氯地平双层片和瑞舒伐他汀双层片的制备根据下表的组成和典型方法制备奥美沙坦酯/苯磺酸氨氯地平隔室(混合物)和瑞舒伐他汀钙隔室(混合物)。使用双层片机制备了一种复合双层片,包括奥美沙坦酯/氨氯地平隔室(第一层)和瑞舒伐他汀钙隔室(第二层)。实验例实验例1:溶出试验在以下溶出试验条件下对根据本发明制备实例制备的制剂进行比较溶出试验。作为比较溶出度试验中使用的对照药物,使用了SevikarTM10/40mg片剂(苯磺酸氨氯地平/奥美沙坦酯)和Crestrotm20mg片剂(瑞舒伐他汀钙)。SevikarTM片剂和Crestrotm片剂为薄膜包衣单片形式。SevikarTM片剂包括硅化微晶纤维素、预胶化淀粉、交联羧甲基纤维素钠和硬脂酸镁作为赋形剂,并且包括聚乙烯醇、聚乙二醇3350、二氧化钛、滑石粉和氧化铁作为薄膜包衣剂。同时,甲硝唑片剂包括微晶纤维素、水合乳糖、磷酸三钙、交联聚维酮和硬脂酸镁作为赋形剂,并且包括羟丙甲纤维素、三醋酸甘油酯、二氧化钛和氧化铁作为薄膜包衣剂。[溶出试验条件]溶出液:韩国药典溶出度试验方法第一液体、第二液体或水奥美沙坦酯:水苯磺酸氨氯地平:第一种液体,pH1.2瑞舒伐他汀钙:第二种液体,pH6.8温度:37±0.5℃试验方法:韩国药典溶出度试验方法2(桨法)桨叶转速:50rpm分析方法:UPLC法*UPLC操作条件□柱:ACQUITYUPLCBEHC18(2.1×50毫米1.7μm)□检测器:紫外吸收光度计(239nm)□流速:0.1ml/min□分析时间:30分钟□流动相:磷酸盐缓冲液/乙腈=80/20制备例1至6:包括奥美沙坦/氨氯地平层和瑞舒伐他汀层的双层片的制备[表1]制剂溶出度试验结果见下表。[表2]奥美沙坦酯片的溶出度[表3]苯磺酸氨氯地平片的溶出度溶出时间0分钟5分钟10分钟15分钟30分钟45分钟60分钟制备例1083.2885.4786.4888.4188.3890.20制备例2087.2087.4286.1988.0289.8689.82制备例3087.8589.7390.2191.8493.6595.07制备例4095.3995.1196.8892.4196.4295.60制备例5095.1594.2993.8292.7295.1091.76制备例6086.3091.4591.7792.2192.4894.08Sevikar Crestor088.7890.5592.4992.2393.3893.64[表4]瑞舒伐他汀钙溶出度制备例1至6的制剂与对照药物相比,在所有时间段中奥美沙坦的溶出度都较高,并且氨氯地平的溶出度总体上没有大的偏差。同时,制剂实施例3至6的制剂的瑞舒伐他汀的初溶出度略高于对照药物,但总体上与对照药物的偏差不大。已证实奥美沙坦/氨氯地平的组成可能对瑞舒伐他汀层的初始溶出度有一定影响,但对瑞舒伐他汀层的整体溶出曲线没有显著影响。制备例7至9:包括奥美沙坦/氨氯地平层和瑞舒伐他汀层的双层片的组合物通过改变上述制备实例中崩解剂和赋形剂的种类和含量,制备以下制剂。[表5]包括奥美沙坦/氨氯地平层和瑞舒伐他汀层的双层片的组成制剂的溶出度试验结果见下表6至8和图1到3。[表6]奥美沙坦酯溶出度溶出时间0分钟5分钟10分钟15分钟30分钟45分钟60分钟制备例7030.2348.9959.9676.7084.3888.78制备例8050.5674.0584.4594.8397.2798.75制备例9031.0847.9557.7672.6580.1584.36Sevikar Crestor026.3234.0537.9644.7848.4951.23[表7]苯磺酸氨氯地平溶出度[表8]瑞舒伐他汀钙溶出度溶出时间0分钟5分钟10分钟15分钟30分钟45分钟60分钟制备例7091.4393.7394.0595.0896.1596.04制备例8089.9992.5593.4094.6995.4195.89制备例9083.8690.5592.8095.0796.2696.78Sevikar Crestor076.5585.3985.3090.5093.7995.02制备例7至9的制剂与对照药物相比仍然具有高的奥美沙坦溶出度。与制剂实施例7和9相比,制剂实施例8中氨氯地平的溶出度与对照药物的偏差最小。制剂实施例7至9的制剂的瑞舒伐他汀的初始溶出度略高于对照药物,但总体上与对照药物的偏差不大。制剂实施例8的制剂与对照药物相比,氨氯地平和瑞舒伐他汀的溶出度没有大的偏差,因此在制剂中显示出与对照药物最相似的溶出度。考虑到制剂实施例8的制剂的溶出速率良好,确定磷酸氢钙二水合物对制剂的溶出速率起重要作用。同时,制剂实施例9的制剂具有与制剂实施例7的制剂相似的奥美沙坦溶出度,并且显示出与对照药物的偏差处于15%的水平。制剂实施例9的制剂与对照药物的偏差小于制剂实施例8的制剂与对照药物的偏差为30%或以上。此外,就氨氯地平和瑞舒伐他汀的溶出度而言,制剂实施例9的制剂与对照药物的偏差小于制剂实施例7的制剂。因此,对制剂实施例8和9的制剂进行生物等效性实验。一般情况下,比较溶出度试验的相似性判定参照食品药品安全部公告第2017-28号第3章第21条。在奥美沙坦的情况下,对照药物在规定的试验时间内的平均溶出度小于50%,因此确定溶出度偏差在50%以内时,溶出度是等效的±8%或相似系数(f2)值大于等于55。可以看出,在制备例1至9的制剂中,奥美沙坦的洗脱率与对照药物的洗脱率不相等,并且与对照药物的洗脱率存在30%或更大的偏差。在氨氯地平和瑞舒伐他汀的情况下,对照药物的平均溶出度在15分钟内为85%或以上,因此溶出度在15分钟内出现偏差±15%可以判断为相等。制备例8A和8B:包衣片的制备制备例8A和8B的包衣片通过用以下组合物的包衣材料包衣根据制备例8制备的裸片来制备。[表9]包括奥美沙坦/氨氯地平层和瑞舒伐他汀层的双层包衣片的组成制剂实施例8A和8B的制剂的溶出度试验结果与制剂实施例8的制剂的溶出度试验结果相似。实验例2:生物等效性试验通过对制剂实施例8的制剂进行药代动力学试验(PK试验)来评估与对照药物的生物等效性。即将64名健康男性志愿者分为两组,每组32人,第一组口服制剂实施例8的片剂,第二组联合口服Sevikar10/40mg片剂(苯磺酸氨氯地平/奥美沙坦酯)和Crestor20mg片剂。在给药后0、0、5、1、5、2、2、5、3、4、5、6、8、10、12、16、24、48和72小时采集血液,并使用UPLC-MS/MS(WatersACQUITYUPLCTM系统)对奥美沙坦、氨氯地平和瑞舒伐他汀的血药浓度进行定量。量化后,通过统计处理对照药物(联合用药)和试验药物给药时奥美沙坦、氨氯地平和瑞舒伐他汀的AUC和Cmax,评估制剂之间的生物等效性。生物等效性评价按照食品药品安全部生物等效性标准指南进行。也就是说,对奥美沙坦、氨氯地平和瑞舒伐他汀的AUC和Cmax值进行对数变换后,获得几何平均值,并计算几何平均比的预计90%置信区间。当90%置信区间为0.8到1.25时,两种制剂在生物学上是等效的。通过PK试验获得的血液浓度曲线如图所示。4至6.图。4至6分别说明了当施用制备例8的双层片(试验药物)和对照药物(塞维卡片剂和克瑞斯特片剂)时,奥美沙坦酯血药浓度曲线、苯磺酸氨氯地平血药浓度曲线和瑞舒伐他汀随时间的血药浓度曲线。按上述方法进行的生物等效性评价结果见下表10。在表10中,T/R比是用供试制剂评价项目的几何平均值除以对照制剂评价项目的几何平均值得出的[即,T/R比值=评价项目的几何平均数(试验制剂)/评价项目的几何平均数(对照制剂)]。T/R比大于1表示受试药物平均吸收量大于对照药物,且受试药物的最大血药浓度平均高于对照药物,T/R比小于1表示受试药物平均吸收量小于对照药物,或者试验药物的血药浓度平均低于对照药物。也就是说,T/R比离1越远,就越有可能被确定为生物学上不等价的。[表10]制备例8的双层片的PK此外,通过在比格犬体内对制剂实施例9的制剂进行药代动力学试验(PK试验),评估与对照药物的生物等效性。也就是说,将32只比格犬分为两组,每组16只,第一组口服制备例9的片剂,第二组口服Sevikar片剂10/40mg(苯磺酸氨氯地平/奥美沙坦酯)和Crestor片剂20mg。给药后,以与上述PK试验方法相同的方式对各血液浓度进行量化,然后通过统计处理对照药物(联合给药)和试验药物给药时的AUC和Cmax来评估制剂之间的生物等效性。按上述方法进行的生物等效性评价结果见下表11。[表11]制备例9的双层片的PK实验例3:最终片剂大小的比较作为对照药物的Sevikar片剂10/40mg和Crestor片剂20mg的总重量分别为208mg和309mg。根据本发明的制备例8的双层片的总重量为470mg,其总重量和尺寸小于Sevikar片剂和Crestor片剂的组合,从而增强了患者的给药便利性。制备例10至14:低剂量双层片的制备基于制备例8的包衣片的组合物,制备具有以下组合物的制备例10至14的双层片。[表12]包括奥美沙坦/氨氯地平层和瑞舒伐他汀层的双层片的组成制备例10至14的制剂的溶出试验结果示于下表13至15中。[表13]奥美沙坦酯(pH6.8)溶出时间0分钟5分钟10分钟15分钟30分钟45分钟60分钟制备例8046.7866.9677.3090.0995.8799.60制备例10048.8069.4678.6389.8694.7297.37制备例11046.4168.2777.8389.0693.7196.32制备例12050.7070.4884.0394.0498.24100.35制备例13050.5670.5684.4495.3698.58102.95制备例14051.2271.8085.5195.6098.81102.62表14苯磺酸氨氯地平(pH1.2)溶出时间0分钟5分钟10分钟15分钟30分钟45分钟60分钟制备例8083.7389.5491.5293.90制备例10084.1087.3689.1190.62制备例11085.8389.5289.1091.34制备例12084.5586.6688.2392.84制备例13085.2787.9089.8390.76制备例14083.4289.1390.6693.71表15瑞舒伐他汀钙(pH6.8)制备例10至14的制剂是其中改变了制备例8的制剂的原料药及其量的制剂。可以看出,尽管原料药及其用量发生变化,奥美沙坦、氨氯地平和瑞舒伐他汀成分在每种成分的特定洗脱液中的溶出度是相同的。制备例15和16:低剂量双层片的制备基于制备例8的包衣片的组合物,制备具有以下组合物的制备例15和16的双层片。[表16]包括奥美沙坦/氨氯地平层和瑞舒伐他汀层的双层片的组成实验例4:溶出试验使用制备例15和ServikarTM片剂5/40mg(苯磺酸氨氯地平/奥美沙坦酯)和Crestor片剂10mg(瑞舒伐他汀钙)作为对照药物,通过实验实施例1的方法进行比较溶出度试验。溶出度对比试验结果见下表17至19。[表17]奥美沙坦酯溶出度(水)溶出时间0分钟5分钟10分钟15分钟30分钟45分钟60分钟制备例15058.4777.5585.8094.7097.2398.56Sevikar Crestor016.8621.6424.5329.3531.3432.55[表18]苯磺酸氨氯地平溶出度(pH1.2)溶出时间0分钟5分钟10分钟15分钟30分钟45分钟60分钟制备例15089.8992.7892.7393.3793.1592.63Sevikar Crestor091.0292.7892.7393.3793.1592.63[表19]瑞舒伐他汀钙溶出度(pH6.8)溶出时间0分钟5分钟10分钟15分钟30分钟45分钟60分钟制备例15092.1795.5396.5697.6198.4698.85Sevikar Crestor083.5587.9388.9391.0192.9393.94制剂实施例15的制剂与对照药物相比,奥美沙坦的溶出度仍然较高,氨氯地平和瑞舒伐他汀的溶出度与对照药物的溶出度没有大的偏差,显示出与对照药物相似的溶出度。实验例5:生物等效性试验通过对制剂实施例15的制剂进行药代动力学试验(PK试验)来评估与对照药物的生物等效性。即,将64名健康男性志愿者分为两组,每组32人,第一组口服制剂实施例15的片剂,第二组联合口服Sevikar片剂5/40mg(苯磺酸氨氯地平/奥美沙坦酯)和Crestor片剂20mg。在给药后0、0、5、1、5、2、2、5、3、4、5、6、8、10、12、16、24、48和72小时采集血液,并使用UPLC-MS/MS(WatersACQUITYUPLCTM系统)对奥美沙坦、氨氯地平和瑞舒伐他汀的血药浓度进行量化。量化后,通过统计处理对照药物(联合用药)和试验药物给药时奥美沙坦、氨氯地平和瑞舒伐他汀的AUC和Cmax,评估制剂之间的生物等效性。生物等效性评价按照食品药品安全部生物等效性标准指南进行。也就是说,对奥美沙坦、氨氯地平和瑞舒伐他汀的AUC和Cmax值进行对数变换后,获得几何平均值,并计算几何平均比的预计90%置信区间。当90%置信区间为0.8到1.25时,两种制剂在生物学上是等效的。通过PK试验获得的血液浓度曲线如图所示。图7至9分别说明了当施用制备例15的双层片(试验药物)和对照药物(塞维卡片剂和克瑞斯特片剂)时,奥美沙坦酯血药浓度曲线、苯磺酸氨氯地平血药浓度曲线和瑞舒伐他汀随时间的血药浓度曲线。按上述方法进行的生物等效性评价结果见下表20。在表20中,T/R比是用供试制剂评价项目的几何平均值除以对照制剂评价项目的几何平均值得出的[即,T/R比值=评价项目的几何平均数(试验制剂)/评价项目的几何平均数(对照制剂)]。T/R比大于1表示受试药物平均吸收量大于对照药物,且受试药物的最大血药浓度平均高于对照药物,T/R比小于1表示受试药物平均吸收量小于对照药物,或者试验药物的血药浓度平均低于对照药物。也就是说,T/R比离1越远,就越有可能被确定为生物学上不等价的。[表20]制备例15的双层片的PK当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。