1.本技术依据35 u.s.c.
§
119,主张于2019年2月25日提出的美国暂时专利申请号62/809,919的权益,其揭示内容在此并入本技术以作为参考数据。
2.本发明涉及提供一种抑制病毒感染的方法及组合物。
背景技术:
3.病毒由一蛋白质包覆内的遗传物质所制成,会侵入正常的活细胞,并利用这些细胞繁殖并产生其他与自己一样的病毒,这些病毒可能会引起常见的传染病,例如流感以及疣,或是可能导致严重的疾病,例如天花以及后天免疫缺乏症候群(acquired immune deficiencysyndrome,aids)。
4.例如,有5种不同类型的肝炎病毒,即a、b、c、d以及e,以及x与g型。a型与e型肝炎病毒由食用受病毒污染的水及食物所引起的。然而,b型、c型以及d型肝炎病毒则是由肠胃外感染伴随被感染的体液所引起。此外,c型与d型肝炎病毒感染也在增加,需要有效的治疗方法。
5.b型肝炎病毒(hepatitis b virus,hbv)会导致人类急性与慢性病毒性肝炎。b型肝炎病毒(hbv)感染通常与严重的肝脏疾病有关,包括肝硬化及肝细胞癌(hepatocellular carcinoma,hcc)[1]。全世界 b型肝炎病毒感染盛行率很高。尽管有效疫苗可供使用已超过25年,但仍有约3.5亿的人口受到慢性感染。相较于非带原者,hbv带原者罹患hcc的相对风险大约增加了100倍[2]。
[0006]
由于不良反应及抗药性的出现,越来越多的感染hbv的患者无法使用目前核准的抗hbv药物,包括抑制病毒反转录酶的干扰素α或核苷(酸)同质物[3]。
[0007]
因此,需要寻求有效、安全且负担得起的抗hbv药物,以干扰病毒生命周期的其他步骤为标的,以改善治疗效果。
[0008]
hbv为一种小的dna病毒,由保护3.2kb病毒基因组的核鞘所组成[4]。hbv核鞘被一套膜蛋白包围,该套膜蛋白由b型肝炎病毒表面抗原(hepatitis b surface antigens,hbsags)所组成。hbsags于一带有三个同相起始密码子的开放阅读框中编码。mhbsag具有55 个胺基酸(amino acid,aa),其从s结构域延伸出去,称为pre
‑
s2结构域。lhbsag具有一额外的108个胺基酸的区域,其从该pre
‑
s2结构域延伸出去以组成pre
‑
s1结构域。最近,牛磺胆酸钠共转运多胜肽 (sodium taurocholate cotransporting polypeptide,ntcp)被鉴定为一 hbv的受体[5,6]。长期以来,一直有人建议将hbv进入未感染的肝细胞作为抗病毒干预的潜在目标[7]。另一方面,hepg2.2.15细胞包含 hbv整个基因组,已被广泛用于研究hbv复制、组装,以及分泌。
[0009]
长期以来,hbv在感染期间对肝细胞的附着一直被认为是抗病毒干预的潜在目标。人们认为与hbv颗粒特异性结合的分子可能会干扰病毒的附着,进而减少或阻断随后的感染[8]。
[0010]
由于缺乏支持完整复制周期的细胞培养系统,因此对hbv早期感染事件的了解有
限。迄今为止,已经显示出两种易受hbv感染的细胞类型。一种为人类肝癌细胞株heparg,在二甲基亚碸(dimethylsulfoxide,dmso)诱导分化后变为可被感染[7,9],而另一种细胞类型,即正常人类初代肝细胞,很容易被hbv感染[10,11],但是体外细胞寿命有限以及缺乏稳定来源的情况严重限制其进一步的应用。
[0011]
此外,单纯疱疹病毒(herpes simplex virus,hsv)也由包裹在蛋白质包覆中的dna基因组所组成。第1型与第2型单纯疱疹病毒 (hsv
‑
1与hsv
‑
2)为人类疾病的病原体,包括龈口炎、咽炎、唇疱疹、脑炎、眼睛及生殖器感染[12]。疱疹病毒感染通常涉及轻度或无症状的初期阶段,然后以非复制潜伏状态或临床上无法检测到的复制程度持续存在[13]。hsv
‑
1的原发感染最常涉及口腔及/或喉咙,导致龈口炎与咽炎。从原发性口咽感染中恢复后,该个体的三叉神经节终生保留hsv的dna,并可能遭受唇疱疹的反覆发作。研究还显示,疱疹病毒家族的某些成员与牙周疾病之间可能存在关联[14]。人类疱疹病毒可能发生在牙周病的病变中,且盛行率较高[15]。就牙周附连丧失而言,hsv与牙周疾病的严重程度有关[16]。病毒性牙龈感染可能会削弱宿主的防御机制,进而造成病原性口腔细菌的过度生长[15,17]。
[0012]
单纯疱疹病毒(hsv)通常攻击黏膜、皮肤、眼睛以及神经系统,并能够感染多种细胞[18]。人类牙龈黏膜器官培养物可感染hsv
‑
1与 hsv
‑
2[19]。此外,体外生长的人类牙龈角质形成细胞以及牙龈纤维母细胞支持hsv的繁殖[20,21]。hsv
‑
1编码病毒胸苷激酶,该激酶将阿昔洛韦(acyclovir)间接代谢为无环鸟苷三磷酸,后者为hsv dna 聚合酶的连锁反应终止剂受质,并阻止病毒的dna复制[22]。然而,已有5
‑
30%的病例被报导hsv对阿昔洛韦具抗药性[23]。抗阿昔洛韦的hsv
‑
1株常在免疫功能低下的患者中发生,可能导致严重的并发症 [24]。由于缺乏疫苗,局部杀菌剂可能是预防hsv传播的重要策略。
[0013]
仍然需要开发一种新的抗病毒疗法或药物。
技术实现要素:
[0014]
于本发明中意外地发现樟芝(antrodia camphorata)的制剂与樟芝的活性成分可有效抑制病毒感染,特别是一b型肝炎病毒(hbv)感染及/或一单纯疱疹病毒(hsv)感染。
[0015]
于实施例中确定樟芝制剂能够抑制病毒复制、病毒颗粒的组装或释放;以及病毒的进入。
[0016]
本发明的一目的为提供一种预防及/或治疗病毒感染的方法,该方法包含对一有需要的个体施用一樟芝制剂及/或樟芝的活性成分。
[0017]
于一实施例中,本发明中待预防及/或治疗的病毒感染选自由下列所组成的群组:肝炎病毒感染、流感病毒感染、单纯疱疹病毒感染、肠病毒感染、轮状病毒感染、登革热病毒感染、痘病毒感染、人类免疫不全病毒感染、腺病毒感染、冠状病毒感染、沙状病毒感染、麻疹病毒感染、反转录病毒感染,以及诺罗病毒感染。
[0018]
于一实施例中,本发明提供一种预防及/或治疗hbv感染的方法,包含对一有需要的个体施用一樟芝制剂。
[0019]
于另一实施例中,本发明提供一种预防及/或治疗单纯疱疹病毒 hsv感染的方法,包含对一有需要的个体施用一樟芝制剂。
[0020]
实际上,从发现中可衍生,通过抑制病毒的复制、病毒颗粒的组装、释放,以及病毒
的进入而抑制肝炎病毒的感染以开发广泛型抗病毒制剂,因为这些制剂抑制了病毒的发展。
[0021]
于另一目的中,本发明提供一种用于预防及/或治疗病毒感染的医药组合物,其包含一治疗有效量的樟芝制剂及/或樟芝的活性成分,以及一医药上可接受的载体。
[0022]
于本发明的一具体实施例中,该樟芝制剂包括但不限于一樟芝萃取物、一皿培式樟芝萃取物、一樟芝子实体萃取物,以及分离自上述萃取物的活性物质。
[0023]
于本发明的一实施例中,该活性化合物可为一或多种选自由下列所组成的群组:
[0024]
[0025][0026]
其中r1为o、α
‑
oh,或β
‑
h;r2为h或oh;r3为o、α
‑
h, β
‑
oac或h2;r4为h或oh;r5为h或oh;r6为cooh或 coo(ch2)n
‑
ch3;n为一0至3的整数;r7为h、oh或oac;r8 为ch3或cooh;r21为ch3、cooh,或coo(ch2)n
‑
ch3;n为一 0至3的整数;r22、r23、r24各为och3,或r22与r23一起形成一o
‑
ch2
‑
o;或r23与r24一起形成一o
‑
ch2
‑
o;虚线表示一单键或一双键。
[0027]
于本发明的一特定实施例中,该化合物为去氢齿孔酸(dehydroeburicoic acid):
[0028][0029]
于本发明的另一实施例中,该化合物为变孔孔菌酸d (versisponic acid d):
[0030][0031]
于本发明的另一实施例中,该化合物为去氢硫色多孔菌酸 (dehydrosulphurenic acid;dehydrosulfurenic acid):
[0032][0033]
于本发明的一特定实施例中,式(ii)的化合物为4,7
‑
二甲氧基
‑5‑ꢀ
甲基
‑
1,3
‑
苯并二恶唑(4,7
‑
dimethoxy
‑5‑
methyl
‑
1,3
‑
benzodioxole):
[0034][0035]
于本发明的一实施例中,该化合物为樟芝酸a:
[0036][0037]
于本发明的一实施例中,该化合物为樟芝酸b:
[0038]
的百分比,并显示为三个独立实验的平均值
±
标准差。*,p<0.05;**, p<0.01;***,p<0.001。
[0052]
图2b所示为樟芝子实体萃取物对hbv组装的影响。以不同浓度的樟芝子实体萃取物培养hepg2.2.15细胞48小时,然后收集培养基通过elisa法测量b型肝炎病毒核心抗原(hepatitis b core antigen, hbeag)。以不含hbv的hepg2作为阴性对照(nc)。结果表示为未经药物处理的阳性对照(nt)的百分比,并显示为三个独立实验的平均值
±
标准差。*,p<0.05;**,p<0.01;***,p<0.001。
[0053]
图2c所示为樟芝子实体萃取物对hbv释放的影响。以不同浓度的樟芝子实体萃取物培养hepg2.2.15细胞48小时,然后收集培养基以通过即时pcr测量hbv的dna。含有1.3倍hbv基因组(ayw亚型(galibert等人,1979年))的质体p1.3hbcl作为平行pcr反应的标准品,而以不含hbv的hepg2作为阴性对照(nc)。结果表示为未经药物处理的阳性对照(nt)的百分比,并显示为三个独立实验的平均值
±
标准差。*,p<0.05;**,p<0.01;***,p<0.001。
[0054]
图3a所示为樟芝子实体萃取物对b型肝炎病毒(hbv)进入的影响。在指定浓度的樟芝子实体萃取物存在下,将dmso分化的 hus
‑
e/2细胞暴露于感染复数(multiplicity of infection,moi)为10 的hbv 20小时,然后去除hbv以及药物并培养细胞2天,通过elisa 测量分泌到培养基中的hbsags,并表示为非药物处理对照的值的百分比。结果为三个独立实验的平均值
±
标准差。*,p<0.05;**,p<0.01; ***,p<0.001。
[0055]
图3b所示为樟芝子实体萃取物对hbv进入的影响。在指定浓度的樟芝子实体萃取物存在下,将dmso分化的hus
‑
e/2细胞暴露于 moi为10的hbv 20小时,然后去除hbv以及药物,并培养细胞2 天,通过elisa测量分泌到培养基中的hbeag,并表示为非药物处理对照的值的百分比。结果为三个独立实验的平均值
±
标准差。*, p<0.05;**,p<0.01;***,p<0.001。
[0056]
图3c所示为樟芝子实体萃取物对hbv进入的影响。在指定浓度的樟芝子实体萃取物存在下,将dmso分化的hus
‑
e/2细胞暴露于感染复数moi为10的hbv 20小时,然后去除hbv以及药物,并培养细胞2天。然后从细胞中萃取rna并进行rt
‑
pcr以测量hbv的 mrna含量。结果表示为非药物处理细胞的值的百分比。以内源 gapdh mrna作为加载对照进行对照pcr。结果为三个独立实验的平均值。*,p<0.05;**,p<0.01;***,p<0.001。
[0057]
图4提供实验条件,用于评估樟芝子实体萃取物在hsv
‑
1感染期间对口腔上皮细胞的作用。进行了三个实验条件,包括不处理、预处理,以及后处理。仅以培养基或含有每种樟芝萃取物的培养基预处理口腔上皮细胞(oc3)2小时,然后接种hsv
‑
1。以感染复数(moi) 为5的hsv
‑
1病毒感染细胞,或在37℃模拟使病毒进入以感染细胞1 小时。病毒接种1小时后未添加樟芝萃取物,以避免其直接对病毒体产生影响。在不存在或存在药物的情况下,将受模拟或hsv
‑
1感染的细胞进一步培养19小时。
[0058]
图5所示为hsv
‑
1感染后,a4(樟芝酸k)对口腔上皮细胞中细胞活性与病毒繁殖的影响。在如图1所示的实验条件下将口腔上皮细胞(oc3)与各种浓度的a4培养。感染后19小时,使用mtt测定法测试细胞活性的粒线体去氢酶活性。显示相对于对照细胞活性的百分比。模拟感染的培养基对照的存活率被认为是100%。此外,使用噬菌斑测定法检查上清液中的病毒产量。来自培养基处理的对照组的病毒产率被认为是100%。显示的结果为至少三个独立实验的平均值
±
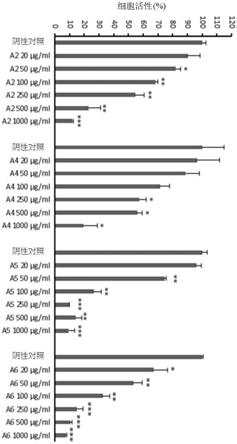
该平均值的标准差(sem)。统计差异由不同的小写字母表示(变异数
分析,tukey,α=0.05)。若使用完全不同的小写字母表示,则两个样本在统计上不相同。
[0059]
图6所示为hsv
‑
1感染后,a3(去氢硫色多孔菌酸)对口腔上皮细胞中细胞活性与病毒繁殖的影响。oc3细胞在如图4所示的实验条件下与各种浓度的a3培养。感染后19小时,使用mtt测定法测试细胞活性。显示相对于对照细胞活性的百分比。模拟感染的培养基对照的存活率被认为是100%。此外,使用噬菌斑测定法检查上清液中的病毒产量。来自培养基处理的对照组的病毒产率被认为是100%。显示的结果为至少三个独立实验的平均值
±
sem。统计差异由不同的小写字母表示(变异数分析,tukey,α=0.05)。若使用完全不同的小写字母表示,则两个样本在统计上不相同。
[0060]
图7所示为hsv
‑
1感染后,a5(变孔孔菌酸)对口腔上皮细胞中细胞活性与病毒繁殖的影响。oc3细胞在如图4所示的实验条件下与各种浓度的a5培养。感染后19小时,使用mtt测定法测试细胞活性。显示相对于对照细胞活性的百分比。模拟感染的培养基对照的存活率被认为是100%。此外,使用噬菌斑测定法检查上清液中的病毒产量。来自培养基处理的对照组的病毒产率被认为是100%。显示的结果为至少三个独立实验的平均值
±
sem。统计差异由不同的小写字母表示(变异数分析,tukey,α=0.05)。若使用完全不同的小写字母表示,则两个样本在统计上不相同。
[0061]
图8所示为hsv
‑
1感染后,a6(去氢齿孔酸)对口腔上皮细胞中细胞活性与病毒繁殖的影响。在如图1所示的实验条件下,将oc3 细胞与各种浓度的a6培养。感染后19小时,使用mtt测定法测试细胞活性。显示相对于对照细胞活性的百分比。模拟感染的培养基对照的存活率被认为是100%。此外,使用噬菌斑测定法检查上清液中的病毒产量。来自培养基处理的对照组的病毒产率被认为是100%。显示的结果为至少三个独立实验的平均值
±
sem。统计差异由不同的小写字母表示(变异数分析,tukey,α=0.05)。若使用完全不同的小写字母表示,则两个样本在统计上不相同。
[0062]
图9所示为hsv
‑
1感染后,a2(樟芝萃取物)对口腔上皮细胞中细胞活性与病毒繁殖的影响。oc3细胞在如图4所示的实验条件下与各种浓度的a2培养。感染后19小时,使用mtt测定法测试细胞活性。显示了相对于对照细胞活性的百分比。模拟感染的培养基对照的存活率被认为是100%。此外,使用噬菌斑测定法检查上清液中的病毒产量。来自培养基处理的对照组的病毒产率被认为是100%。显示的结果为至少三个独立实验的平均值
±
sem。统计差异由不同的小写字母表示(变异数分析,tukey,α=0.05)。若使用完全不同的小写字母表示,则两个样本在统计上不相同。
[0063]
图10所示为樟芝萃取物对hsv
‑
1病毒体的作用。将纯化的hsv
‑
1 与含有各种浓度的樟芝萃取物的培养基直接在37℃下培养1小时。然后使用噬菌斑测定法在口腔上皮细胞(oc3)中检查病毒滴度。显示的结果为至少三个独立实验的平均值
±
sem。统计差异由不同的小写字母表示(变异数分析,tukey,α=0.05)。若使用完全不同的小写字母表示,则两个样本在统计上不相同。
具体实施方式
[0064]
将参考以下示例的具体实施例进一步描述本发明的以上概述。然而,不应理解为本发明的内容仅限于以下具体实施方式,而是基于本发明的上述内容的所有发明都属于本发明的范围。
[0065]
除非另有定义,否则本文使用的所有技术及科学术语具有与本发明所属领域的技术人员通常理解的相同含义。
[0066]
如本文所用,单数形式的「一(a)」、「一种(an)」以及「该(the)」包括复数指示物,除非上下文另外明确指出。因此,例如,提及「一样品」包括本领域技术人员已知的多个这样的样品及其等同物。
[0067]
本发明提供一种预防及/或治疗病毒感染的方法,该方法包含对一有需要的个体施用一樟芝制剂及/或樟芝的活性成分。
[0068]
本发明还提供一种用于预防及/或治疗病毒感染,尤其是b型肝炎病毒(hbv)感染及/或单纯疱疹病毒(hsv)感染的组合物/医药组合物,包含一治疗有效量的樟芝制剂及/或樟芝的活性成分,以及一医药上可接受的载体。
[0069]
根据本发明,该樟芝制剂包括但不限于一樟芝萃取物、一皿培式樟芝萃取物、一樟芝子实体萃取物,以及分离自上述萃取物的活性化合物,及其衍生物。
[0070]
更具体而言,该分离自樟芝的活性化合物为一或多种选自由下列所组成的群组:
[0071]
(1)
[0072]
[0073][0074]
其中r1为o、α
‑
oh或β
‑
h;r2为h或oh;r3为o、α
‑
h、β
‑
oac或h2;r4为h或oh;r5为h或oh;r6为cooh或 coo(ch2)n
‑
ch3;r7为h、oh,或oac;r8为ch3或cooh;虚线表示一单键或一双键;n为一0至3的整数;或
[0075]
(2)
[0076][0077]
其中r21为ch3或cooh,或coo(ch2)n
‑
ch3;n为一0至3 的整数;r22、r23、r24各为och3,或r22与r23一起形成一 o
‑
ch2
‑
o;或r23与r24一起形成一o
‑
ch2
‑
o。
[0078]
于本发明的实施例中,该化合物可为:
[0079][0080] r1r2r3r4δ樟芝酸aohh2h 樟芝酸bohoh 樟芝酸cohβ
‑
ohh 樟芝酸dohooh 樟芝酸eohh
2 14樟芝酸fohβ
‑
oh 14樟芝酸kα
‑
ohohβ
‑
ohh [0081]
于本发明的另一实施例中,该化合物可为:
[0082][0083]
r7=h;r8=ch3[0084][0085]
于本发明的又一个实施例中,该化合物可为:
[0086][0087][0088]
于本发明的又一个实施例中,该化合物可为:
[0089][0090][0091]
于本发明的一特定实施例中,该化合物可为羊毛甾烷(lanostane):
[0092][0093]
此外,式(ii)的化合物可为
[0094][0095][0096]
据此,该化合物选自由下列所组成的群组:
[0097]
(去氢松二酸,dehydrotumolosaeure),
[0098]
(去氢土莫酸,dehydrotumulosic acid),
[0099]
(3
‑
表
‑
去氢土莫酸, 3
‑
epi
‑
dehydrotumulosic acid),
[0100]
(去氢硫色多孔菌酸, dehydrosulphurenic acid),
[0101][0102]
(去氢松二酸
‑
甲酯,dehydrotumolosaeure
‑
methylester),
[0103][0104]
((20ξ)
‑
3β,15α,16α
‑
三羟基
‑
24
‑
甲基羊毛脂
‑
7,9(11),24(241)
‑
三烯
‑
21
‑
油酸;15α
‑
羟基去氢土莫酸,(20ξ)
‑
3β,15α,16α
ꢀ‑
trihydroxy
‑
24
‑
methyllanosta
‑
7,9(11),24(241)
‑
trien
‑
21
‑
oic acid;15α
ꢀ‑
hydroxydehydrotumulosic acid),
[0105][0106]
(甲基25
‑
羟基
‑3‑
表去氢土莫盐(甲基),methyl 25
‑
hydroxy
‑3‑
epidehydrotumulosate(methyl)),
[0107][0108]
(去氢茯苓酸,dehydropachymic acid),
[0109][0110]
(15α
‑
乙酰去氢磺尿酸,15α
‑
acetyldehydrosulfurenic acid),
[0111][0112]
(15α
‑
乙酰去氢硫色多孔菌酸,15α
‑
acetyldehydrosulphurenic acid),
[0113][0114]
(变孔孔菌酸d,versisponic acid d),
[0115][0116]
(去氢硫色多孔菌酸,dehydrosulphurenic acid),
[0117][0118]
(29
‑
羟基去氢茯苓酸;(3β,16α)
‑3‑
(乙酰氧基)
‑
16,29
‑
二羟基
‑
24
‑ꢀ
甲基亚胺基
‑
7,9(11)
‑
二烯
‑
21
‑
油酸,29
‑
hydroxydehydropachymic acid;(3 β,16 α)
‑3‑
(acetyloxy)
‑
16,29
‑
dihydroxy
‑
24
‑
methylidenelanosta
‑
7,9(11)
‑
dien
‑
21
ꢀ‑
oic acid),以及
[0119][0120]
(去氢齿孔酸,dehydroeburicoic acid)。
[0121]
根据本发明,该化合物选自由下列所组成的群组:
[0122]
(樟芝酸a,antcin a),
[0123]
(樟芝酸b,antcin b),
[0124]
(樟芝酸c,antcin c),
[0125]
(樟芝酸h,antcin h),以及
[0126]
(樟芝酸k,antcink)。
[0127]
于本发明的一特定实施例中,式(ii)的化合物为
[0128][0129]
(4,7
‑
二甲氧基
‑5‑
甲基
‑
1,3
‑
苯并二恶唑, 4,7
‑
dimethoxy
‑5‑
methyl
‑
1,3
‑
benzodioxole)。
[0130]
如本文所用,「病毒」一词指任何病毒,其为仅在生物体的活细胞内复制的小型感染原,其可感染从动物、植物到微生物,包括细菌与古细菌,的所有类型的生命形式。例示性病毒包括但不限于肝炎病毒、流感病毒、单纯疱疹病毒、肠病毒、轮状病毒、登革热病毒、痘病毒、人类免疫不全病毒、腺病毒、麻疹病毒、反转录病毒,以及诺罗病毒。
[0131]
如本文所用,「治疗」一词指将包含一或多种活性剂的组合物应用于或施用于患有一疾病、该疾病的症状或病状,或该疾病的进展的一个体,其目的为治疗、治愈、减轻、缓解、改变、补救、改善,增进或影响该疾病,该疾病的症状或病状,由该疾病引起的残疾,或该疾
病的进展。
[0132]
如本文所用,「个体」一词包括人类或非人类动物,例如伴侣动物 (例如,狗、猫等)、农场动物(例如,牛、羊、猪、马等),或实验动物(例如,大鼠、小鼠、天竺鼠等)。
[0133]
如本文所用,「治疗有效量」一词指,相较于没有接受该量的相应个体,在治疗、治愈、预防或改善一疾病、障碍,或副作用,或降低一疾病或障碍的进展速度方面有作用的一药剂的量。该术语在其范围内还包括有效增强正常生理功能的量。
[0134]
为了用于治疗,将该治疗有效量的该化合物配制为用于给药的一医药组合物。因此,本发明进一步提供一医药组合物,其包含一治疗有效量的樟芝制剂或从樟芝中分离的活性化合物,以及一或多种医药上可接受的载体。
[0135]
为了递送及吸收,可将一治疗有效量的根据本发明的活性成分与一医药上可接受的载体一起以一合适的形式配制成为一医药组合物。基于给药途径,本发明的医药组合物较佳占活性成分总重量的0.1重量%至100重量%。
[0136]
本文所用的「医药上可接受的载体」一词指与制剂的其他成分相容且对要与医药组合物一起给药的个体无害的可接受的载体、稀释剂或赋形剂。根据医药制剂的要求,本领域中通常已知或使用的任何载体、稀释剂或赋形剂均可用于本发明。根据本发明,该医药组合物可适于通过任何适当的途径施用,包括但不限于口服、直肠、鼻部、局部、阴道,或肠胃外途径。于本发明的一特定实施例中,将医药组合物配制为用于口服给药。这样的制剂可通过医药领域中已知的任何方法来制备。
[0137]
如本文所用,「医药上可接受的」指载体与组合物中的活性成分相容,且较佳地可使该活性成分稳定且对于接受治疗的个体是安全的。该载体可为活性成分的稀释剂、载剂、赋形剂,或基质。合适的赋形剂的一些实例包括乳糖、右旋糖、蔗糖、山梨糖、甘露糖、淀粉、阿拉伯胶、磷酸钙、藻酸盐、黄芪胶、明胶、矽酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、无菌水、糖浆,以及甲基纤维素。该组合物可另外包含润滑剂,例如滑石粉、硬脂酸镁,以及矿物油;润湿剂;乳化剂以及助悬剂;防腐剂,例如,羟基苯甲酸甲酯以及羟基苯甲酸丙酯;甜味剂;以及调味剂。在对患者给药后,本发明的组合物可提供活性成分的快速、持续或延迟释放的效果。
[0138]
根据本发明,该组合物的形式可为片剂、丸剂、粉剂、口含锭、小包、片剂、酏剂、悬浮剂、洗剂、溶液、糖浆、软及硬明胶胶囊、栓剂、无菌注射液,以及包装的粉末。
[0139]
本发明的组合物可通过任何生理上可接受的途径递送,例如口服、肠胃外(例如,肌内、静脉内、皮下,以及腹膜内)、透皮、栓剂,以及鼻内方法。关于肠胃外给药,其较佳以无菌水溶液形式使用,其可包含足以使溶液与血液等渗的其他物质,例如盐或葡萄糖。可根据需要适当地缓冲水溶液(较佳ph值为3至9)。在无菌条件下合适的肠胃外组合物的制备可通过本领域技术人员已知的标准药理技术来完成。
[0140]
于本发明中,该方法与组合物/医药组合物可有效治疗一病毒感染。有效的示例性病毒包括但不限于肝炎病毒、流感病毒、单纯疱疹病毒、肠病毒、轮状病毒、登革热病毒、痘病毒、人类免疫不全病毒、腺病毒、冠状病毒、沙状病毒、麻疹病毒,以及诺罗病毒。较佳地,该病毒感染为一肝炎病毒感染。更佳地,该病毒感染为b型肝炎病毒感染、c型肝炎病毒感染,或d型肝炎病毒感染。最佳地,该病毒感染为b型肝炎病毒感染。
[0141]
于另一方面,该病毒感染较佳为单纯疱疹病毒感染。
[0142]
通过以下实施例进一步说明本发明,提供这些实施例是为说明而非限制。
[0143]
实施例
[0144]
材料与方法
[0145]
实施例1
[0146]
实施例1樟芝萃取物及其有效成分的制备
[0147]
将100克樟芝子实体与甲醇以热再循环6小时,收集萃取物并减压干燥,以获得15克樟芝甲醇萃取物。
[0148]
取15克如上获得的樟芝甲醇萃取物,填充二氧化矽,并在管柱分离(3
×
12cm)中以冲提剂「己烷/乙酸乙酯/甲醇」进行梯度冲提以获得活性级分,包括a2(樟芝萃取物)、a3(去氢硫色多孔菌酸)、a4(樟芝酸k)、a5(变孔孔菌酸),以及a6(去氢齿孔酸)。
[0149]
实施例2
[0150]
樟芝萃取物对b型肝炎病毒(hbv)感染的影响
[0151]
2.1材料与方法
[0152]
2.1.1hepg2.2.15细胞
[0153]
可在以adw2亚型的hbv基因组稳定转染的hepg2.2.15细胞 (rrid:cvcl_l855)中进行连续b型肝炎病毒(hbv)增殖。使用 hepg2.2.15细胞是因为其供应无限且品质稳定,并保存在dulbecco改良的eagle培养基(dulbecco’s modified eagle medium,dmem; invitrogen公司)中,该培养基中添加了10%热灭活的胎牛血清(fetalbovine serum,fbs;thermo公司)以及100单位的青霉素与每毫升100 μg的链霉素(均来自invitrogen公司)。
[0154]
2.1.2hus
‑
e/2细胞
[0155]
即使在长时间培养后仍保留原代肝细胞特征的hus
‑
e/2细胞可用于hbv感染。针对hbv感染,hus
‑
e/2细胞以2%dmso分化7天,然后如本案发明人先前的研究所述[25],收集病毒颗粒以感染并在 hus
‑
e/2细胞中复制。这些细胞可用于检测hbv株的感染性以及筛选抗hbv的药物。
[0156]
2.1.3hbv颗粒的收集
[0157]
将经过药物处理的hepg2.2.15细胞的培养基通过在4℃下以 1,000xg离心10分钟进行澄清,然后将上清液铺在20%蔗糖垫层上 (20%蔗糖,20mm hepes,ph 7.4,0.1%牛血清白蛋白[bovine serumalbumin,bsa]),然后以197,000xg于4℃下离心3小时以沉淀hbv 颗粒,然后将其浓缩100倍以检测hbv的dna。
[0158]
2.1.4dna与rna分离、反转录,以及即时pcr
[0159]
以基因组dna分离试剂盒(nexttec biotechnologie公司,德国) 萃取总dna。使用试剂(invitrogen公司)从培养的细胞中分离总rna。以rna模板、amv反转录酶(roche公司)以及oligo
‑
dt 引子进行反转录。使用特定基因的引子组以及sybr green pcr mastermix(bio
‑
rad公司)对产品进行即时pcr。用于hbv核心、hbsags、 cccdna,以及gapdh的引子对如前述[25]。使用icycler iq即时pcr 检测系统(bio
‑
rad公司)分析结果。质体p1.3hbcl以10倍稀释 (2*104
–
2*109个复制数/ml)制备,以在平行pcr反应中建立标准曲线。
[0160]
2.1.5酵素连结免疫吸附测定(enzyme
‑
linked immunosorbent assay,elisa)
[0161]
使用hbsags与hbeag elisa试剂盒(general biologicals公司) 以按照建议的方案检测b型肝炎病毒表面抗原(hbsag)与b型肝炎病毒核心抗原(hbeag)。
[0162]
2.1.6统计分析
[0163]
所有值均表示为平均值
±
se。每个值为每个药物体外实验中至少三个实验的平均值。学生氏t检验用于统计比较。*表示该值与对照显著不同(*,p<0.05;**,p<0.01;***,p<0.001)。
[0164]
2.2樟芝子实体萃取物的细胞活性
[0165]
所使用的樟芝子实体萃取物为a2(樟芝萃取物)、a4(樟芝酸k)、 a5(变孔孔菌酸),以及a6(去氢齿孔酸)。在测试它们对hbv感染的潜在抗病毒作用之前,我们首先检查了它们浓度为20至1000 μg/ml对hepg2.2.15细胞以及hus
‑
e/2永生化人类初代肝细胞的毒性。如图1所示,在hepg2.2.15细胞中,50μg/ml a2、50μg/ml a4,以及20μg/ml a5几乎没有毒性作用。观察到a6的毒性为20μg/ml。在hus
‑
e/2细胞中,a2的毒性为20μg/ml。而50μg/ml的a4、20μ g/ml的a5,以及20μg/ml的a6没有毒性作用。因此,以表1与表2 中所示的浓度用于后续研究。
[0166]
表1
[0167][0168][0169]
表2
[0170]
hus
‑
e/2細胞剂量1(μg/ml)剂量2(μg/ml)a2510a42050a51020a61020
[0171]
2.3樟芝子实体萃取物对hepg2.2.15细胞中hbv感染的抑制作用
[0172]
为了测试樟芝子实体萃取物是否对hbv基因组复制、组装或分泌有任何影响,将稳定转染hbv基因组的hepg2.2.15细胞与四种樟芝子实体萃取物一起培养48小时,然后以elisa以及即时pcr检测从培养基中收集的hbsag、hbeag,以及hbv的dna。有趣的是,elisa 结果显示,在培养液上清液中hbsag(图2a)以及hbeag(图2b) 的含量,其反映了hbv分泌颗粒的数量,在a4药物浓度为20μg/ml 以及50μg/ml的情况下显著降低至约50
‑
60%。此外,如图2c所示,在以浓度为50μg/ml的a4药物处理时,hbv的dna也被抑制至 55%。
[0173]
2.4樟芝子实体萃取物对hus
‑
e/2细胞中hbv进入的抑制作用
[0174]
为了评估樟芝子实体萃取物对hbv感染及复制的影响,将 hus
‑
e/2细胞感染衍生自hepg2.2.15细胞的ayw亚型hbv。在感染 hbv的过程中,将不同樟芝子实体萃取物添加到培养基中18小时,然后洗涤感染的细胞,并在新鲜培养基中培养48小时,此时通过elisa 检
测培养基中的hbsag与hbeag,且以即时pcr检测到的hbv的 mrna作为hbv感染效率指标。有趣的是,在以20μg/ml的a5与 a6药物处理的细胞中,观察到hbsag与hbeag的含量降低了80%以上,而其他化合物的作用较小或无作用(图3a与b)。感染期间a5 与a6药物的存在导致hbv mrna含量降低(图3c)。
[0175]
在这项研究中,使用稳定表现hbv基因组的hepg2.2.15细胞来检测樟芝子实体萃取物对hbv形态发生的影响。这些结果显示,a4 药物可显著抑制hbv复制、病毒颗粒的组装或释放。以a4处理(图 2c)可看到颗粒中hbsag蛋白与核心蛋白含量(图2a与2b)以及 hbv dna的明显的剂量依赖性降低。
[0176]
另一方面,为了测试樟芝子实体萃取物是否对hbv进入造成影响,使用hus
‑
e/2细胞检测樟芝子实体萃取物对hbv感染的影响。当 hus
‑
e/2细胞暴露于hbv时,a5与a6通过降低hbv的hbsag、 hbeag,以及hbv mrna表现量来更有效地抑制hbv进入hus
‑
e/2 细胞(图3a、3b,以及3c)。综上,这些结果显示,在hbv感染期间的不同步骤中,通过a4、a5,以及a6处理可以大幅减少hbv感染。
[0177]
实施例3
[0178]
樟芝萃取物对hsv感染的影响
[0179]
我们评估了arh003对具有神经胶质簇的斑块数量的影响。为了确定app/ps1转基因小鼠大脑中具有神经胶质簇的斑块,分别通过 amylo
‑
glo染色以及iba
‑1‑
与gfap免疫染色检查aβ斑块、小神经胶质细胞,以及星状神经胶细胞。我们发现在以arh003处理后,具有神经胶质簇的斑块数量减少了(图3a
‑
3e)。
[0180]
3.1材料与方法
[0181]
3.1.1.实验设计
[0182]
使用口腔上皮细胞株(oc3)确定樟芝萃取物在hsv
‑
1感染过程中对口腔上皮细胞的可能作用。如图4所示处理细胞单层(亦请参阅「材料与方法」部分中的详细资讯)。进行三个实验条件,包括不处理、预处理,以及后处理。检查樟芝萃取物在病毒感染之前或之后是否具有作用。研究樟芝萃取物对感染的口腔上皮细胞中病毒繁殖(病毒产量)的影响。在感染后19
‑
20小时,使用噬菌斑测定法测定上清液中的病毒产量。处理过的细胞的活性亦以mtt测定法测定粒线体去氢酶活性来分析。此外,纯化的hsv
‑
1病毒颗粒直接以樟芝萃取物处理,以检查樟芝萃取物在进入病毒之前是否直接对病毒颗粒发挥抗hsv
‑
1活性。
[0183]
3.1.2口腔细胞培养
[0184]
从咀嚼槟榔/不吸烟患者中建立的口腔癌细胞3(oral carcinoma 3,oc3)细胞[26]以1:2的比例在含有10%热灭活胎牛血清(fbs)以及 ksfm的dulbecco改良eagle培养基(dmem)组成的培养基中培养。 ksfm为补充有重组表皮生长因子(0.1
‑
0.2ng/ml)以及牛脑下垂体萃取物(20
‑
30μg/ml)的上皮无血清培养基(gibco brl laboratories 公司)。非洲绿猴肾(vero)细胞于添加5%胎牛血清(fbs)的dmem 培养基中增殖。所有生长培养基均补充有抗生素
‑
抗霉菌溶液,100单位/ml青霉素g钠、100μg/ml硫酸链霉素,以及0.25μg/ml两性霉素b(gibco brl laboratories公司,格兰德岛,纽约)。
[0185]
3.1.3hsv病毒的制备
[0186]
使用蔗糖梯度从感染的vero细胞的细胞外液中纯化hsv
‑
1病毒(kos株)。纯化的病毒以小等份冷冻保存。使用噬菌斑测定法滴定纯化的病毒。
[0187]
3.1.4感染条件
[0188]
以感染复数(moi)为5的hsv
‑
1感染口腔上皮细胞(oc3细胞) 或在37℃模拟感染1小时以使病毒进入。去除未附着的病毒。然后将感染的细胞以适当的培养基覆盖并于37℃下培养。所使用的樟芝子实体萃取物为a2(樟芝萃取物)、a3(去氢硫色多孔菌酸)、a4(樟芝酸k)、a5(变孔孔菌酸),以及a6(去氢齿孔酸)。为了获得樟芝子实体萃取物的效果,在三种不同的实验条件下对口腔细胞进行了处理(图1):(1)不处理;(2)感染前以樟芝子实体的每种萃取物进行预处理;(3))感染后以樟芝各子实体萃取物进行后处理。纯化的 hsv
‑
1病毒颗粒也可直接与仅含培养基或含有樟芝子实体萃取物的培养基直接培养。然后使用噬菌斑测定法检查处理过的病毒颗粒的病毒感染性。
[0189]
3.1.5mtt检测粒线体去氢酶活性
[0190]
使用含有1mg/ml的3
‑
[4,5
‑
二甲基噻唑
‑2‑
基]
‑
2,5二苯基四唑溴化物(3
‑
[4,5
‑
dimethylthiazol
‑2‑
yl]
‑
2,5diphenyltetrazolium bromide,mtt) 的无胎牛血清(fbs)培养基评估处理后细胞的粒线体去氢酶活性。于 37℃下培养4小时后,移除培养基,将mtt与活细胞中的粒线体去氢酶反应而形成的甲蓝溶解在dmso中。于570nm下测量光密度 (optical density,od)。从每个样品获得的吸光度中减去不存在细胞时培养盘固有的背景信号。
[0191]
3.1.6以噬菌斑测定分析病毒滴度
[0192]
使用噬菌斑测定法测定感染后上清液中的病毒滴度。细胞生长至汇合并以十倍系列稀释的样品感染。然后将细胞以含有3%羧甲基纤维素的培养基覆盖,以防止次级斑块的形成。培养细胞直至形成明确的透明噬菌斑。以3.7%的甲醛固定细胞,并以结晶紫染色。观察噬菌斑并在倒置显微镜下计数。以培养基预处理的hsv
‑
1感染对照的病毒产率被认为是100%。
[0193]
3.1.7统计分析
[0194]
每个实验至少重复三次,以确保可重复性。计算数据的平均值以及平均值的标准差(sem)。单向标准差分析用于确定统计学上的显著差异。p<0.05的程度被认为有显著差异。
[0195]
3.2樟芝子实体萃取物对hsv
‑
1感染后口腔上皮细胞的细胞活性以及病毒繁殖的影响
[0196]
评估樟芝子实体萃取物[(a2(樟芝萃取物)、a3(去氢硫色多孔菌酸)、a4(樟芝酸k)、a5(变孔孔菌酸),以及a6(去氢齿孔酸)]对细胞活性以及病毒繁殖的影响。模拟感染的细胞或感染hsv
‑
1 的细胞的活性不受a4的明显影响(图5)。以a4预处理oc3细胞对病毒产量影响很小。但是,以a4对oc3细胞进行后处理会以剂量依赖性方式显著降低上清液中的病毒产量。当以100μg/ml a4后处理感染的细胞时,平均病毒产量降低至19%。
[0197]
模拟感染的细胞或感染hsv
‑
1的细胞的活性不受a3的明显影响 (图6)。在hsv
‑
1感染之前,以10μg/ml a3预处理细胞2小时,病毒产率降低到57%(图6)。此外,当在hsv
‑
1感染后以2.5μg/ml a3 对细胞进行后处理时,病毒产率降低至65%(图6)。但是,减少没有达到统计学差异。
[0198]
模拟感染的细胞或感染hsv
‑
1的细胞的活性并未受到a5的明显影响(图7)。以a5对oc3细胞进行预处理及后处理以剂量依赖性方式显著降低了上清液中的病毒产量(图7)。在
hsv
‑
1感染之前,以25μg/mla5细胞预处理2小时后,病毒产率降低至48%(图7)。当以12.5μg/mla5对感染的细胞进行后处理时,病毒产率降低至57%(图7)。
[0199]
当将细胞以10μg/mla6后处理19小时后,模拟感染细胞的生存能力显著降低(图8)。结果显示,10μg/ml的a6可能会部分降低细胞活性。以a6对oc3细胞进行预处理及后处理以剂量依赖性方式显著降低了上清液中的病毒产量(图8)。在hsv
‑
1感染之前,以10μg/mla6预处理细胞2小时,病毒产率降低到37%(图8)。当以2.5μg/mla6对感染的细胞进行后处理时,病毒产率降低至63%(图8)。
[0200]
当细胞以25μg/mla2后处理19小时后,模拟感染细胞的生存能力降低(图9)。以a2预处理oc3细胞会以剂量依赖性方式显著降低上清液中的病毒产量。但是,以a2对oc3细胞进行后处理对病毒产量影响很小。
[0201]
3.3樟芝子实体萃取物对hsv
‑
1病毒颗粒感染性的直接影响
[0202]
将纯化的hsv
‑
1病毒颗粒直接与仅含培养基或含有各种浓度的樟芝子实体萃取物的培养基直接培养。然后使用噬菌斑测定法检查处理过的病毒颗粒的病毒感染性。结果显示,a4、a5、a6以剂量依赖的方式在统计学上显著抑制了病毒的感染性(图10),表示这些药物在进入病毒之前直接对病毒颗粒发挥抗hsv
‑
1活性。表4总结了hsv
‑
1病毒体的最有效浓度。当使用25μg/ml的a2时,病毒感染性也分别降低到30%或41%(图10)。
[0203]
综上,樟芝子实体萃取物对hsv
‑
1感染的作用是不同的。以樟芝子实体萃取物对oc3细胞进行预处理或后处理可能会降低上清液中的病毒产量。a4、a5,以及a6以剂量依赖的方式在统计学上显著抑制了病毒感染性。
[0204]
上面的描述仅涉及本发明中的较佳具体实施例,应当指出,对于本领域的普通技术人员来说,在不背离本发明原理的前提下,还可以做出一些改进及修改,且这些改进及修改也应视为于本发明的保护范围之内。
[0205]
引用文件
[0206]
1.ganem,d.anda.m.prince,hepatitisbvirusinfection
‑‑
naturalhistoryandclinicalconsequences.nengljmed,2004.350(11):p.1118
‑
29.
[0207]
2.beasley,r.p.,hepatitisbvirus.themajoretiologyofhepatocellularcarcinoma.cancer,1988.61(10):p.1942
‑
56.
[0208]
3.zoulim,f.ands.locarnini,hepatitisbvirusresistancetonucleos(t)ideanalogues.gastroenterology,2009.137(5):p.1593
‑
608e1
‑
2.
[0209]
4.chen,w.n.andc.j.oon,humanhepatitisbvirusmutants:significanceofmolecularchanges.febslett,1999.453(3):p.237
‑
42.
[0210]
5.yan,h.,etal.,sodiumtaurocholatecotransportingpolypeptideisafunctionalreceptorforhumanhepatitisbanddvirus.elife.1:p.e00049.
[0211]
6.watashi,k.,etal.,ntcpandbeyond:openingthedoortounveilhepatitisbvirusentry.intjmolsci.15(2):p.2892
‑
905.
[0212]
7.gripon,p.,etal.,infectionofahumanhepatomacelllinebyhepatitisbvirus.procnatlacadsciusa,2002.99(24):p.15655
‑
60.
[0213]
8.urban,s.andp.gripon,inhibitionofduckhepatitisbvirusinfectionbyamyristoylatedpre
‑
speptideofthelargeviralsurfaceprotein.jvirol,
2002.76(4):p.1986
‑
90.
[0214]
9.abou
‑
jaoude,g.,etal.,myristoylationsignaltransferfromthelargetothemiddleorthesmallhbvenvelopeproteinleadstoalossofhdvparticlesinfectivity.virology,2007.365(1):p.204
‑
9.
[0215]
10.chai,n.,etal.,assemblyofhepatitisbvirusenvelopeproteinsontoalentiviruspseudotypethatinfectsprimaryhumanhepatocytes.jvirol,2007.81(20):p.10897
‑
904.
[0216]
11.gudima,s.,etal.,primaryhumanhepatocytesaresusceptibletoinfectionbyhepatitisdeltavirusassembledwithenvelopeproteinsofwoodchuckhepatitisvirus.jvirol,2008.82(15):p.7276
‑
83.
[0217]
12.coreyl,spearpg.infectionswithherpessimplexviruses.newengljmed1986;314:686
‑
691.
[0218]
13.ahmedr,morrisonla,knipedm.persistenceofviruses,in:fieldsbn,knipedm,howleypm,eds.field'svirology.philadelphia:lippincott
‑
ravenpublishers,1996:219
‑
250.
[0219]
14.contrerasa,slotsj.herpesvirusesinhumanperiodontaldisease.jperiodontalres2000;35:3
‑
16.
[0220]
15.parrab,slotsj.detectionofhumanvirusesinperiodontalpocketsusingpolymerasechainreaction.oralmicrobiolimmunol1996;11:289
‑
293.
[0221]
16.lingl
‑
j,hoc
‑
c,wuc
‑
y,cheny
‑
t,hungs
‑
l.associationbetweenhumanherpesvirusesandtheseverityofperiodontitis.jperiodontol2004;75:1479
‑
1485.
[0222]
17.contrerasa,slotsj.mammalianvirusesinhumanperiodontitis.oralmicrobiolimmunol1996;11:381
‑
386.
[0223]
18.parknh.virology,in:nisengardrj,newmanmg,eds.oralmicrobiologyandimmunology.philadelphia:w.b.saunderscompany,1994:248
‑
285.
[0224]
19.yuray,igah,kondoy,etal.herpessimplexvirustype1andtype2infectioninhumanoralmucosainculture.joralpatholmed1991;20:68
‑
73.
[0225]
20.ronesy,hochmann,ehrlichj,zakay
‑
ronesz.sensitivityoforaltissuestoherpessimplexvirus
‑‑
invitro.jperiodontol1983;54:91
‑
95.
[0226]
21.hungs
‑
l,wangy
‑
h,chenh
‑
w,leep
‑
l,cheny
‑
t.analysisofherpessimplexvirusenteringintocellsoforalorigin.virusres2002;86:59
‑
69.
[0227]
22.furmanpa,stclairmh,spectort.acyclovirtriphosphateisasuicideinactivatoroftheherpessimplexvirusdnapolymerase.jbiolchem1984;259:9575
‑
9579.
[0228]
23.morfinf,thouvenotd.herpessimplexvirusresistancetoantiviraldrugs.jclinvirol2003;26:29
‑
37.
[0229]
24.fieldhj.herpessimplexvirusantiviraldrugresistance
‑‑
currenttrendsandfutureprospects.jclinvirol2001;21:261
‑
269.
[0230]
25.huang,h.c.,etal.,entryofhepatitisbvirusintoimmortalizedhumanprimaryhepatocytesbyclathrin
‑
dependentendocytosis.jvirol.86(17):p.9443
‑
53.
[0231]
26.linsc,liucj,chiucp,changsm,lusy,chenyj.establishmentofoc3oralcarcinomacelllineandidentificationofnf
‑
kappabactivationresponsestoarecanutextract.joralpatholmed2004;33:79
‑
86.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。