1.本发明属于抗肿瘤药物领域,具体涉及同源靶向单宁酸铜白蛋白复合纳米颗粒及其制备方法和肿瘤治疗方面的应用。
背景技术:
2.恶性肿瘤的发病率逐年升高,严重威胁了人类的生命健康,是导致70岁之前死亡的第一原因。传统的肿瘤的治疗方法主要以手术切除为主,化疗和放疗为辅。但是恶性肿瘤常呈浸润性生长,手术只能切除边界清晰地实体瘤,对于浸润式生长的瘤体难以全部精确切除干净,而化疗药物的肿瘤通常靶向性不佳,而放疗是基于全身的治疗手段,这种缺乏特异性的治疗方式在抑制肿瘤组织生长的同时对正常组织也造成了不可逆转的损伤,但依然无法阻止恶性肿瘤生长、复发并转移。因此,开发新型特异性和高效低毒的癌症治疗方式去减少化疗药物的毒副作用,增强治疗效果,是近年来肿瘤治疗的研究热点。
3.近年来,芬顿样反应在抗肿瘤治疗研究中显示出强大的抗肿瘤治疗效果。它是利用金属作为催化剂,使肿瘤内的二氧化氢转化为高活性的羟基自由基,诱导肿瘤细胞发生严重的氧化损伤从而抑制肿瘤组织的发展。单宁酸(ta)是一种高分子量的多酚,它含有五个双烯丙基酯基团共价连接在中心葡萄糖核上,它的邻苯二酚和没食子酚为金属螯合提供了结合位点,它可以作为金属离子配位的多齿配体,因此含有没食子酰基的ta可以和铜离子形成高度稳定的金属配合物,为后续的芬顿样反应提供充足的金属离子。
4.近年来,声动力肿瘤治疗方式由于其非侵入和时空可控的优势而被广泛研究。声动力治疗(sdt)是依赖超声波和声敏剂使氧气变为具有细胞毒性的活性氧(ros),导致肿瘤细胞的死亡,消融肿瘤病灶。超声波具有强的组织穿透性,可以穿透10cm的组织,其深的穿透特性使其成为肿瘤治疗领域的研究热点。因此,声动力治疗在深层的恶性瘤中具有重大意义。
5.针对肿瘤部位短时间产生充足的ros从而达到有效地杀灭肿瘤的目标,目前研究中面临着肿瘤部位ros产量不足以及对正常组织损伤较大的问题,因此,严重限制了其在抗肿瘤研究领域的应用。研究证明,肿瘤组织具有特殊的酸性、缺氧和氧化还原微环境,主要表现为:ph较低(ph 5.5
‑
6.5)和较高的过氧化氢含量。如何利用肿瘤细胞的特性实现靶向治疗是亟需解决的问题。
技术实现要素:
6.本发明公开了同源靶向多功能纳米颗粒的制备方法,旨在提供一种制备简单、尺寸可控、性质稳定的肿瘤靶向多功能纳米颗粒,解决纳米颗粒肿瘤靶向性和肿瘤微环境过氧化氢含量不足的问题。同时,本发明还提供了一种单宁酸铜配合物在抗肿瘤中的应用。在超声激发下,同源靶向单宁酸铜人血清白蛋白复合纳米颗粒具有杀伤肿瘤细胞的作用,可作为声敏剂应用于声动力抗肿瘤。
7.本发明一个方面提供了一种靶向单宁酸铜白蛋白复合纳米颗粒,其包括纳米颗粒内核、纳米颗粒内核外部包裹的单宁酸和铜的配合物以及具有靶向能力的癌细胞膜,所述纳米颗粒内核由白蛋白以及吸附于白蛋白上的葡萄糖氧化酶构成。
8.在本发明的技术方案中,所述的同源靶向单宁酸铜白蛋白复合纳米颗粒通过以下方法制成,
9.1)将白蛋白与葡萄糖氧化酶在水溶液中混合,加入有机溶剂后分散均匀,然后去除有机溶剂获得纳米颗粒内核;
10.2)将步骤1)获得的纳米颗粒内核分散在碱性水溶液中清洗后,加入单宁酸和铜盐,并混合均匀,得到包裹单宁酸和铜的配合物的纳米颗粒;
11.3)在步骤2)所得纳米颗粒与癌细胞的细胞膜进行混合,并通过机械力挤压获得外层包含癌细胞的细胞膜的纳米颗粒。
12.在本发明的技术方案中,所述的白蛋白为人血清白蛋白、牛血清白蛋白。
13.在本发明的技术方案中,所述靶向单宁酸铜白蛋白复合纳米颗粒的粒径为43
‑
340nm。
14.在本发明的技术方案中,所述的癌细胞膜为与治疗肿瘤相对应的癌细胞的细胞膜或该细胞膜的表面标志物。例如,以下癌细胞的细胞膜:乳腺癌、肝癌、肺癌、胰腺癌、肠癌、胃癌、黑色素肿瘤、头颈癌、胆管癌、宫颈癌、卵巢癌、前列腺癌。
15.在本发明的技术方案中,所述的癌细胞膜通过以下方法获得:收集癌细胞后,通过加入含蛋白酶抑制剂的中性裂解液破碎细胞,收集细胞悬液低速离心取上清后进一步高速离心取上清液,得细胞膜悬液;所述的低速离心为4000g以下的速度离心,所述的高速离心为15000g以上的速度离心。
16.本发明另一个方面提供了上述同源靶向单宁酸铜白蛋白复合纳米颗粒的制备方法,其包括以下步骤:
17.1)将白蛋白与葡萄糖氧化酶在水溶液中混合,加入有机溶剂后分散均匀,然后去除有机溶剂获得纳米颗粒内核;
18.2)将步骤1)获得的纳米颗粒内核分散在碱性水溶液中清洗后,加入单宁酸和铜盐,并混合均匀,得到包裹单宁酸和铜的配合物的纳米颗粒;
19.3)在步骤2)所得纳米颗粒与癌细胞的细胞膜进行混合,并通过机械力挤压获得外层包含癌细胞的细胞膜的纳米颗粒。
20.在本发明的技术方案中,步骤1)中白蛋白与葡萄糖氧化酶的质量比为3
‑
10:1,优选为1
‑
5:1。
21.在本发明的技术方案中,步骤1)中有机溶剂选自氯仿、乙醇、丙酮、乙酸乙酯、二氯甲烷。
22.在本发明的技术方案中,步骤1)中有机溶剂的体积为水溶液体积之比为1:10
‑
100,优选为1:15
‑
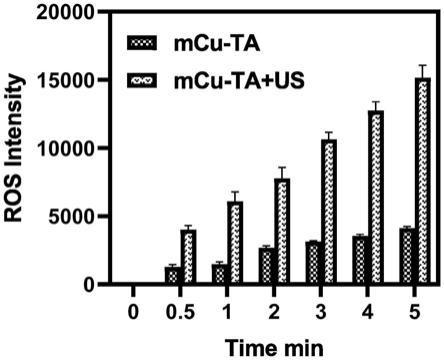
25。
23.在本发明的技术方案中,步骤2)中碱性水溶液选自0.1m碳酸钠水溶液。
24.在本发明的技术方案中,步骤2)中铜盐选自氯化铜、硫酸铜。
25.在本发明的技术方案中,步骤2)中单宁酸与铜盐的质量比为1:2
‑
5,优选为1:3
‑
4。
26.在本发明的技术方案中,步骤3)中机械力挤压的方式为将步骤2)所得纳米颗粒与
癌细胞的细胞膜的混合物采用薄膜挤压法通过220nm的滤器,获得同源靶向单宁酸铜人血清白蛋白复合纳米颗粒。
27.在本发明的技术方案中,步骤3)中机械力挤压后还包括采用超滤法除去融合纳米颗粒中的有机溶剂和游离小分子的步骤。
28.本发明又一个方面提供了上述同源靶向单宁酸铜白蛋白复合纳米颗粒在制备抗肿瘤药物中的用途。
29.本发明又一个方面提供了上述同源靶向单宁酸铜白蛋白复合纳米颗粒在制备声动力学治疗中的声敏剂中的用途。
30.本发明再一个方面提供了一种抗肿瘤制剂,所述抗肿瘤制剂中包含上述同源靶向单宁酸铜白蛋白复合纳米颗粒。
31.本发明一个具体实施方案公开了采用以下具体方案来制备同源靶向单宁酸铜白蛋白复合纳米颗粒:
32.1)癌细胞膜的提取:
①
收集10cm培养皿的细胞悬液,1000rpm离心,4min,弃上层培养液,得沉淀细胞。
②
往沉淀细胞加入中性裂解液(含蛋白酶抑制剂),冰浴20min。超声进一步破碎30s,功率20%超2s停2s。
③
裂解完成的细胞悬液于3200g离心5min,取上清液。
④
上述上清液在4℃,20000g高速离心条件下进一步离心20min,取上清液,得细胞膜悬液。
33.2)葡萄糖氧化酶人血清白蛋白纳米颗粒制备:
①
称取人血清白蛋白20
‑
40mg,葡萄糖氧化酶5
‑
10mg葡萄糖氧化酶溶解在去离子水中,混合均匀。其中人血清白蛋白浓度范围为10
‑
20mg/ml,葡萄糖氧化酶浓度范围为5
‑
10mg/ml;
②
取适量的氯仿100
‑
200μl加入混合物中;
③
冰浴保护,间歇式超声5分钟,去除有机溶剂,同时得到纳米复合体系;
④
加入0.1m的碳酸钠水溶液100
‑
200微升,超声清洗波中超声5
‑
10分钟,得到透明澄清纳米颗粒水溶液
⑤
超滤/透析去除纳米体系中游离小分子;
⑥
在2ml上述纳米颗粒溶液中加入10μl单宁酸(40mg ml
‑
1),再加入200μl cucl2.2h2o(6.3mg ml
‑1),继续搅拌30min。
⑦
取制备好的细胞膜溶液采用薄膜挤压法10次通过220nm的滤器。
⑧
通过超滤法(100kd)除去融合纳米颗粒中的有机溶剂和游离小分子,即得到同源靶向单宁酸铜白蛋白复合纳米颗粒。用粒度仪和透射电镜检测纳米颗粒的形状和尺寸大小后,避光保存备用。
34.3)在不同浓度过氧化氢中,mcu
‑
ta的纳米颗粒在水溶液中产生ros的检测:将一定浓度的mcu
‑
ta的纳米颗粒置于细胞培养板中,在暗光条件下,加入2,7
‑
二氯荧光素(dcfh
‑
da)活性氧探针,稀释一定倍数后,用多功能酶标仪检测活性氧的荧光强度。
35.4)在超声的刺激下,mcu
‑
ta的纳米颗粒在水溶液中产生ros的检测:将一定浓度的mcu
‑
ta的纳米颗粒置于细胞培养板中,在暗光条件下,加入2,7
‑
二氯荧光素(dcfh
‑
da)活性氧探针,并超声刺激(2mhz,2w)0
‑
5分钟,将超声处理后的溶液稀释一定倍数后,用多功能酶标仪检测活性氧的荧光强度。
36.有益效果
37.本发明同源靶向单宁酸铜白蛋白复合纳米颗粒具有良好的生物相容性和肿瘤靶向性,并且可以创造性地作为声敏剂协同应用,增加抗肿瘤作用。同源靶向单宁酸铜在过氧化氢的过度表达的肿瘤部位可以特异性反应和杀伤肿瘤细胞并且经过超声激发进一步增强抗肿瘤作用,纳米颗粒中的葡萄糖氧化酶可以增加实体肿瘤过氧化氢水平,促进肿瘤中的芬顿样反应。
38.本发明利用了肿瘤细胞自身环境特点,即肿瘤细胞附近具有较高的过氧化氢含量,特异性地在肿瘤部位产生大量的ros,从而提高肿瘤治疗的效果,减少正常组织的损伤,实现精准的肿瘤治疗效果。此外,发明通过癌细胞膜实现同源靶向,进一步提高了纳米颗粒对于肿瘤的靶向性。
39.同时,本发明纳米颗粒的粒径在43
‑
340nm,可通过实体瘤血管的高通透和淋巴回流的滞留性(epr效应)被动靶向到肿瘤组织;重要的是,纳米颗粒包载的药物在体内长循环中,降低了跟血液接触的机会,导致药物在血液循环中的半衰期显著提高。
附图说明
40.图1为mcu
‑
ta的纳米颗粒的合成及结构示意图。
41.图2为cu
‑
ta和mcu
‑
ta的纳米颗粒的粒径图。
42.图3为在不同浓度过氧化氢中,mcu
‑
ta的纳米颗粒在在水溶液中产生ros强度曲线。
43.图4为mcu
‑
ta的纳米颗粒在超声的激发下中产生ros强度曲线。
44.图5为mcu
‑
ta的纳米颗粒在超声激发下的细胞杀伤性。
具体实施方式
45.为了使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明,但不能理解为对本发明的可实施范围的限定。
46.实施例1癌细胞膜的提取
47.收集10cm培养皿的mda
‑
mb
‑
231乳腺癌细胞,1000rpm离心,4min,收集沉淀细胞,然后往沉淀细胞加入1ml中性裂解液(含蛋白酶抑制剂),1~1.5ml/管,冰浴放置20min。然后在冰浴保护中进一步超声破碎30s(功率20%超2s停2s)。超声后的细胞悬液用3200g离心5min,取上清液。最后,将上述上清液在4℃,20000g高速离心条件下进一步离心20min,取上清液,得细胞膜悬液。
48.实施例2同源靶向单宁酸铜人血清白蛋白复合纳米颗粒制备
49.称取人血清白蛋白20mg,葡萄糖氧化酶5mg溶解在2ml去离子水中,与人血清白蛋白混合均匀。加入100μl氯仿,在冰浴保护下,间歇式超声5分钟,去除有机溶剂,同时得到纳米复合体系;加入0.1m的碳酸钠水溶液200μl,超声清洗波中超声5分钟,得到透明澄清纳米颗粒水溶液。在2ml上述纳米颗粒溶液中加入10μl单宁酸(40mg/ml),再加入200μl cucl2.2h2o(6.3mg/ml),继续搅拌30min,得到cu
‑
ta纳米颗粒。最后,加入制备好的细胞膜溶液采用薄膜挤压法10次通过220nm的滤器,即得到同源靶向单宁酸铜人血清白蛋白复合纳米颗粒mcu
‑
ta纳米颗粒。通过超滤法(100kd)除去融合纳米颗粒中的有机溶剂和游离小分子。用粒度仪和透射电镜检测纳米颗粒的形状和尺寸大小后,结果如图2所示。避光保存备用。从粒度仪结果可知,本发明中mcu
‑
ta纳米颗粒的粒径分布在43
‑
340nm,粒径分布较窄,相比于cu
‑
ta,包裹细胞膜后的mcu
‑
ta纳米颗粒粒径更大一些。
50.实施例3在不同浓度过氧化氢中,复合纳米颗粒在水溶液中产生ros的检测
51.在暗光条件下,在2ml含不同过氧化氢浓度(0mm、10mm、50mm、100mm)的实施例2得到的复合纳米颗粒中加入4μl 10μm 2
′
,7
′‑
二氯荧光素二乙酸盐(dcfh
‑
da)荧光探针,稀释
一定倍数后,用多功能酶标仪检测活性氧的荧光强度,得到反应后的活性氧浓度,结果如图3所示,纳米颗粒产生的活性氧簇与过氧化氢浓度呈正相关,活性氧簇随过氧化氢的增加而增加,从而可实现高效的芬顿样反应效果。
52.实施例4复合纳米颗粒在超声(us)的激发下中产生活性氧簇(ros)的检测
53.在暗光条件下,在2ml实施例2得到的纳复合米颗粒中加入4μl 10μm 2
′
,7
′‑
二氯荧光素二乙酸盐(dcfh
‑
da)荧光探针,再加以超声(2mhz,2w)处理,检测超声不同时间产生活性氧簇。超声后如图4所示,超声后活性氧簇强度显著增加,且纳米颗粒产生的活性氧簇随超声时间增加而增加,从而实现高效的声动力效果,可用于肿瘤治疗的声动力学治疗中的声敏剂。
54.实施例5在超声的激发下,复合纳米颗粒对乳腺癌细胞mda
‑
mb
‑
231细胞的杀伤活性评价
55.将处于对数生长期的乳腺癌mda
‑
mb
‑
231细胞,以5
×
104个/孔接种于96孔板中,每孔加入1ml细胞悬液,于37℃培养箱中(含5%co2)孵育24小时后,将实施例2获得的复合纳米颗粒用培养基稀释到一定浓度后加入到细胞中,同时设置对照组(培养细胞不加药或无超声),继续孵育3小时后,将96孔板中需要超声处理的孔置于平面超声探头下,超声激发(2mhz,2w)2min,继续放置于培养箱中培养24小时后,加入mtt,4小时后去掉旧培养基,加入150
‑
200μl dmso然后放置于摇床震荡混匀15
‑
20min,最后用多功能酶标仪检测od(490)值,进而肿瘤细胞的杀伤活性评价。结果如图5所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。