1.本发明涉及一种培养应用于免疫疗法的自然杀伤细胞(nk细胞)的方法。更具体地,本发明涉及一种通过培养源自健康供体(而不是要施用免疫细胞治疗剂的患者)的血液的淋巴细胞来培养同种异体免疫细胞的方法,所述免疫细胞高效地扩增和活化对治疗恶性肿瘤有效的nk细胞,还涉及使用该方法获得的免疫细胞培养物和包含其的免疫细胞治疗剂。
背景技术:
2.nk细胞是一种淋巴细胞,更具体地说是大颗粒淋巴细胞。nk细胞能够有效杀死病毒感染的细胞和肿瘤细胞,但不杀死大多数正常细胞。其抗肿瘤作用是通过坏死和/或凋亡的作用机制来实现的。nk细胞对诸如il
‑
2、il
‑
12和干扰素等细胞因子产生响应,从而增加细胞毒性、分泌和增殖功能。在人类中nk细胞的表型是cd16(fcγriii)或cd56,由于细胞表面没有t细胞受体复合物(trc),所以cd16和cd56被用作nk细胞的标志物。
3.已知此类nk细胞在人体的初始生物防御机制和肿瘤免疫中起重要作用。也就是说,nk细胞可以杀死特定的自体细胞、同质细胞甚至异质癌细胞,而无需根据主要组织相容性复合体(mhc)的表达来获得免疫性的过程。特别是,nk细胞能够更好地杀死几乎不表达或不表达i类mhc的靶细胞。因此,nk细胞可以有效杀死多数不表达mhc的癌细胞,也可以杀死一些病毒感染的细胞和细菌,例如伤寒沙门氏菌(almonella typhi)。然而,具有如此优异杀伤癌细胞作用的nk细胞,即使在正常人中也仅占外周血淋巴细胞的5%~15%。特别而言,由于在癌症患者中其比率或细胞毒性大幅降低,因此在不进行单独扩增过程的情况下通过免疫疗法有效攻击癌细胞是受限的。
4.这种免疫疗法是包括以下步骤的方法:从患者血液中提取对于治疗癌症而言最重要的免疫细胞,例如自然杀伤细胞(nk细胞)、树突细胞(dc)、b细胞和t细胞,使用几种类型的刺激物使其生长为对癌症有强烈作用的免疫细胞,然后将所产生的免疫细胞注射回患者体内。由于使用的是患者自己的血液,与典型的化疗相比,其副作用少,施用方法简单,因此近年来正在积极研究这种方法。
5.对于抗癌免疫细胞治疗剂来说,自身免疫细胞治疗剂是重要的药剂,其用于通过从自身血液中分离和培养免疫细胞来进行治疗。但是,对于重度晚期癌症患者,由于细胞数量少且活性极低,因此有时难以培养细胞,存在例如必须等待培养期等许多困难。因此,如果能通过培养其他健康人的免疫细胞来进行治疗,就可以有效地用于不易进行细胞培养的重度晚期癌症患者。
6.即,当开发出这种同种异体免疫细胞治疗剂时,可以预先培养大量的健康人免疫细胞并冷冻保存,然后在患者需要时在短时间内直接施用于患者,从而增加其效果。为了使用其他人的免疫细胞,必须使用纯nk细胞,因为其他人的tc细胞会攻击患者的身体。在制造纯nk细胞的典型方法中,培养过程非常复杂且昂贵,因为使用饲养细胞(例如经历肿瘤发生
的细胞系)或需要进行伽马射线治疗。
7.因此,需要一种消除这些缺点的开发同种异体免疫细胞治疗剂的技术。
技术实现要素:
8.技术问题
9.本发明人进行了研究和努力来解决上述问题,结果,本发明人开发了一种培养免疫细胞的方法,在将要施用健康供体t细胞的患者中引起免疫耐受,从而导致转变为没有攻击性的细胞,由此完成了本发明。
10.因此,本发明的一个目的是提供一种培养同种异体免疫细胞的方法,其中,健康人的t细胞在要施用免疫细胞的患者中出现免疫耐受,从而将该t细胞变为没有攻击性的细胞、提高细胞增殖并延长细胞寿命,还提供使用该方法获得的免疫细胞培养物以及包含其的免疫细胞治疗剂。
11.本发明的另一个目的是提供一种培养同种异体免疫细胞的方法,其中,当培养来自从健康供体血液中分离出的淋巴细胞外周血单个核细胞(pbmc)的免疫细胞时,即使不使用抗cd3抗体,也能刺激免疫细胞,从而有利于进行培养并诱导免疫耐受,由此使与t细胞混合的他人的免疫细胞可用于免疫治疗,还提供用该方法获得的免疫细胞培养物以及包含其的免疫细胞治疗剂。
12.本发明的目的不仅限于上述目的,即使没有明确提及,其中也自然可以包括本领域普通技术人员从下文对本发明的详细描述中能够认识到的本发明的目的。
13.技术方案
14.为了实现本发明的上述目的,本发明提供了一种培养同种异体免疫细胞的方法。该方法包括:将分离自健康供体血液的外周血单个核细胞(pbmc)培养9至12天,从而获得第一供体细胞培养物;从将要施用免疫细胞治疗剂的患者的血液制备患者源pbmc;将患者源pbmc加入第一供体细胞培养物中,由此得到第一混合培养物;和培养第一混合培养物的混合培养步骤。
15.此外,本发明提供了一种培养同种异体免疫细胞的方法。该方法包括:将分离自健康供体血液的外周血单个核细胞(pbmc)培养1至2天,从而获得第二供体细胞培养物;从将要施用免疫细胞治疗剂的患者的血液制备患者源pbmc;将患者源pbmc加入第二供体细胞培养物中,由此得到第二混合培养物;和培养第二混合培养物的混合培养步骤。
16.在一个优选实施方式中,患者源pbmc是从患者血液中分离出且未经培养的pbmc、将从患者血液中分离出的pbmc培养1至2天而获得的患者细胞培养物、以及将从患者血液中分离出的pbmc培养7至14天而获得的患者细胞培养物中的任一种。
17.在一个优选实施方式中,包括第一混合培养物或第二混合培养物,使得在第一供体细胞培养物或第二供体细胞培养物中包含的每100个免疫细胞中,患者源pbmc中的免疫细胞数为30至200个。
18.在一个优选实施方式中,混合培养步骤进行30天以上,同时进行更换和收获多种培养基组合物的步骤。
19.在一个优选实施方式中,在以3至4天的间隔改变细胞因子浓度的同时进行更换和收获多种培养基组合物的步骤。
20.此外,本发明提供了一种同种异体免疫细胞培养物质,其包含:通过使用上述任一种培养方法进行培养而获得的培养基组合物,和增殖的免疫细胞。
21.此外,本发明提供了一种培养基组合物,其中从同种异体免疫细胞培养物质中去除了增殖的免疫细胞。
22.此外,本发明提供了一种免疫细胞治疗剂,其包含从同种异体免疫细胞培养物质中去除了培养基组合物后获得的免疫细胞作为活性成分。
23.在一个优选实施方式中,免疫细胞包括nk细胞和t细胞,所述t细胞对要施用免疫细胞治疗剂的特定患者具有免疫耐受性。
24.在一个优选实施方式中,具有免疫耐受性的t细胞包括nkt细胞、辅助t细胞(th)、细胞毒性t细胞(tc)和γδt细胞。
25.在一个优选实施方式中,通过培养从健康供体血液中分离出的外周血单个核细胞(pbmc)并且还培养源自特定患者的pbmc预定的时间来获得免疫耐受性。
26.此外,本发明提供了在使用培养同种异体免疫细胞的方法培养的多种培养基组合物的更换和收获步骤中获得的培养基组合物。
27.此外,本发明提供了一种化妆品组合物,其包含所述培养基组合物作为活性成分。
28.此外,本发明提供了一种用于治疗损伤或皮肤病(包括烧伤和创伤)的药物组合物,该药物组合物包含所述培养基组合物作为活性成分。
29.有益效果
30.根据本发明的培养同种异体免疫细胞的方法、使用该方法获得的免疫细胞培养物和包含其的免疫细胞治疗剂,健康人的t细胞对于要施用免疫细胞的患者出现免疫耐受,从而将该t细胞变为没有攻击性的细胞、提高细胞增殖并延长细胞寿命。
31.此外,对于本发明的培养同种异体免疫细胞的方法、使用该方法获得的免疫细胞培养物以及包含该培养物的免疫细胞治疗剂,当培养来自从健康供体血液分离出的淋巴细胞外周血单个核细胞(pbmc)的免疫细胞时,即使不使用抗cd3抗体也能刺激免疫细胞,从而有利地进行培养并诱导免疫耐受,从而使与t细胞混合的他人的免疫细胞可用于免疫治疗。
32.本发明的这些技术效果不仅限于上述范围,并且即使没有明确提及,其中也自然可以包括本领域普通技术人员从下文对实施本发明的具体内容的描述中能够认识到的本发明的效果。
附图说明
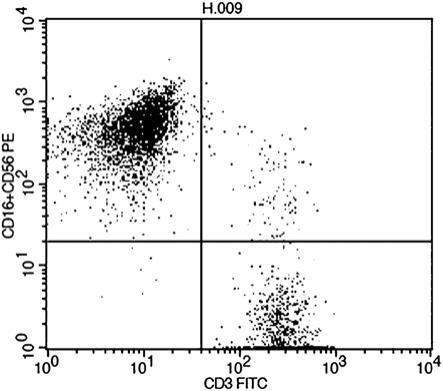
33.图1是示出了实验中使用的效应细胞的facs数据的图,其用于确认在诱导t细胞免疫耐受后细胞杀伤能力降低;
34.图2是示出了使用典型方法进行的免疫细胞的细胞毒性测试结果的图,其用于确认在诱导t细胞的免疫耐受后细胞杀伤能力降低;
35.图3是示出了本发明实施方式的培养同种异体免疫细胞的方法中细胞数量随时间的变化的图。
36.图4a至4c是示出了在本发明的另一实施方式的培养同种异体免疫细胞的方法中在第20、31和54天测量的facs数据的图;
37.图5是示出了在本发明的另一个实施方式的培养同种异体免疫细胞的方法中细胞
数量随时间的变化的图;和
38.图6是示出了在图5中的培养后14天测量的facs数据的图。
具体实施方式
39.本发明中所使用的术语仅用于描述具体实施方式,并非意在限制本发明。除非上下文另有明确规定,否则单数表达包括复数表达。在本技术中,应当理解,诸如“包括”或“具有”等术语旨在表示存在说明书中描述的特征、数量、步骤、操作、组件、部件或其组合,但是这不排除存在或添加一个或多个其他特征、数量、步骤、操作、组件、部件或其组合的可能性。
40.诸如第一和第二等术语可用于描述各种组件,但这些组件不应受这些术语的限制。上述术语仅用于将一个组件与另一组件区分开。例如,在不脱离本发明的范围的情况下,第一组件可以被称为第二组件,类似地,第二组件也可以被称为第一组件。
41.除非另有定义,本文使用的所有术语,包括技术或科学术语,具有与本发明所属领域的普通技术人员通常理解的相同的含义。诸如在常用词典中定义的术语应被解释为具有与相关技术上下文中的含义一致的含义,而不应被解释为理想的或过于正式的含义,除非在本发明中明确定义。
42.在本发明中,“免疫细胞”在包括仅nk细胞和t细胞的意义上使用。此外,“nk细胞”在包括nk细胞和nkt细胞的意义上使用,但在某些情况下可被解释为表示仅nk细胞。
43.在时间关系的描述中,例如,在时间前后关系用“之后”、“后”、“在
……
之后”或“之前”来解释的情况下,其包括不连续的情况,除非使用“立即”或“直接”。
44.下面将结合附图和优选实施方式来详细描述本发明的技术构成。
45.然而,本发明不限于在此描述的实施方式并且可以以其他形式实施。在整个说明书中,用于描述本发明的相同附图标记指代类似的组件。
46.本发明的技术特征是:一种培养同种异体免疫细胞的方法,其中,即使将两种不同来源的免疫细胞(即源自健康供体血液的免疫细胞和源自患者血液的免疫细胞)彼此混合来进行培养,对于所培养的t细胞会产生免疫耐受,从而将t细胞转变为无攻击性的细胞、促进细胞增殖、延长细胞寿命;使用该方法获得的免疫细胞培养物;以及包含其的免疫细胞治疗剂。
47.因此,根据混合两种不同来源的免疫细胞的时机以及是否使用抗cd3抗体,本发明的同种异体免疫细胞的培养方法可以分为以下两种类型。
48.首先,本发明的培养同种异体免疫细胞的第一种方法可以包括:将分离自健康供体血液的外周血单个核细胞(pbmc)培养9至12天,从而获得第一供体细胞培养物;从将要施用免疫细胞治疗剂的患者的血液制备患者源pbmc;将患者源pbmc加入第一供体细胞培养物中,由此得到第一混合培养物;和培养第一混合培养物的混合培养步骤。因此,本发明的培养同种异体免疫细胞的第一种方法的优点在于,在两种不同来源的免疫细胞中,由于健康供体的免疫细胞使用抗cd3抗体培养至少7天、然后与患者源pbmc混合,因此应用了双重刺激来提高免疫细胞的增殖率及其寿命。此外,对于因晚期癌症阶段而具有非常低数量的nk细胞的患者、由于患者特异性而具有较差的nk细胞培养和增殖的患者、或者供体中有大量患者的情况,培养同种异体免疫细胞的第一种方法是有效的方法。在这些患者的情况下,nk
细胞培养不良,但t细胞的培养相对较好,因此可以大大增加细胞数。这是因为当不同来源的细胞混合时,提供刺激所需的细胞可能仅由t细胞组成。
49.接下来,培养本发明的同种异体免疫细胞的第二种方法可以包括:将分离自健康供体血液的外周血单个核细胞(pbmc)培养1至2天,从而获得第二供体细胞培养物;从将要施用免疫细胞治疗剂的患者的血液制备患者源pbmc;将患者源pbmc加入第二供体细胞培养物中,由此得到第二混合培养物;和培养第二混合培养物的混合培养步骤。因此,在本发明的培养同种异体免疫细胞的第二种方法中,在培养开始之前至少3天从健康供体血液中分离的外周血单个核细胞(pbmc)的培养开始时混合患者源pbmc,由此即使不使用抗cd3抗体也能刺激供体的免疫细胞。因此,培养步骤变得更简单,并且有利于进行免疫细胞的培养。此外,供体的免疫细胞数量少,因为培养处于早期状态,因此诱导免疫耐受所需的患者免疫细胞的数量可以较少。
50.包括第一混合培养物和第二混合培养物,使得在供体细胞培养物中包含的每100个免疫细胞中,患者源pbmc中的免疫细胞数为30至200个。上述混合比是通过实验确定的,并且将混合比设置为上述范围的原因是患者源免疫细胞的数量与供体免疫细胞的数量相比应至少为30%或更多,以诱导免疫学耐受并有效刺激免疫细胞以利于培养。同时,随着患者源免疫细胞的数量相对于供体免疫细胞的数量增加,容易诱导完美的免疫耐受。但是,混合比超过1:2的情况可能会给危重病人带来负担,因此将最大混合比设置为1:2。
51.此外,制备患者源pbmc的步骤可以通过制备从患者血液中分离出且未经培养的pbmc、将分离的pbmc培养1至2天而获得的患者细胞培养物、以及将分离的pbmc培养7至14天而获得的患者细胞培养物中的任一种来进行。特别而言,在患者病情危重的情况下,当使用通过培养患者源pbmc 7至14天而获得的患者细胞培养物时,进行增殖,使得即使收集了少量血液细胞数量也较多。因此,患者细胞培养物能够多次使用,这是更有利的。同时,除了处于分离自血液且处于未培养状态下的免疫细胞之外,患者源pbmc还可以包括其他单核细胞,例如b细胞。然而,由于在随后的培养过程中仅免疫细胞存活,患者细胞培养物可以基本上仅包含免疫细胞。
52.同时,在本发明的培养同种异体免疫细胞的第一种和第二种方法中,由于两种不同来源的免疫细胞混合培养,因此延长了免疫细胞的寿命。因此,混合培养步骤可以进行30天或更长时间,同时进行更换和收获多种培养基组合物的步骤。可以在以3至4天的间隔改变细胞因子浓度的同时进行更换和收获多种培养基组合物的步骤。同时,当以这种方式延长细胞寿命时,可以确保大量的培养物,即,从中去除了免疫细胞的含有大量有用成分(例如细胞因子)的培养基组合物。众所周知,这种含有大量有用成分的培养基组合物可以是化妆品或药物的原料。因此,根据本发明的培养同种异体免疫细胞的方法,可以非常经济地获得含有大量有用成分但不含血清的培养基组合物。特别地,当为了获得作为化妆品或药物原料的培养基组合物而执行本发明的同种异体免疫细胞的培养方法时,使用源自两个健康供体的血液的pbmc而不是使用源自健康供体和患者的pbmc作为两种不同来源的免疫细胞来进行培养可能更有助于获得大量的培养基组合物。
53.由此获得的培养基组合物可用作化妆品组合物和药物组合物中的活性成分。特别地,本发明的培养基组合物对于韩国专利申请第10
‑
2018
‑
0057359号(本发明人的在先专利)中所述的皮肤美白、去除色素沉着和消除皱纹中的一种或多种有效。该培养基组合物可
有效克服炎症,例如过敏性鼻炎、过敏性皮炎、特应性皮炎、痤疮和昆虫叮咬引起的炎症。特别是,该培养基组合物在快速去除瘙痒方面是有效的。此外,确认了该培养基组合物通过治疗烧伤和创伤而具有皮肤再生作用,并且在去除沉积的色素和皮肤美白方面非常有效。
54.接下来,本发明的同种异体免疫细胞培养物质包括:通过执行培养同种异体免疫细胞的第一种和第二种方法而获得的培养基组合物;和增殖的免疫细胞。培养基组合物和增殖的免疫细胞可以从同种异体免疫细胞培养物质中分离出,以将去除了增殖的免疫细胞的培养基组合物用作化妆品组合物或药物组合物中的活性成分,并将分离的免疫细胞用作免疫细胞治疗剂中的活性成分。
55.因此,本发明的免疫细胞治疗剂包括从同种异体免疫细胞培养物质中分离出的免疫细胞作为活性成分。免疫细胞包括nk细胞和对要施用免疫细胞治疗剂的特定患者具有免疫耐受性的t细胞。具有免疫耐受性的t细胞包括nkt细胞、辅助t细胞(th)、细胞毒性t细胞(tc)和γδt细胞。如上所述,免疫耐受是通过培养从健康供体血液中分离出的外周血单个核细胞(pbmc)并且培养源自特定患者的pbmc预定时间来获得的。通过将免疫细胞包含在诸如生理盐水等载体中,本发明的免疫细胞治疗剂通常可以以林格氏型施用到患者体内,并且不影响免疫细胞。然而,当然,免疫细胞治疗剂还可以包含有效治疗患者的已知成分。
56.上述本发明的培养同种异体免疫细胞的第一种和第二种方法中使用的培养免疫细胞的培养基添加试剂盒(nktm)是单独包装的,以便在淋巴细胞培养的每个阶段添加到培养基中,其包括不同组成成分的内容物,即b单元、c1
‑
1单元、c1
‑
2单元、c2单元、a1单元、a2单元和d单元。每个单元的详细描述以及使用该单元培养免疫细胞的培养过程(nktm培养过程)的具体条件的详细描述在韩国专利申请第10
‑
2018
‑
0057359号中公开(在先的专利,以下简称“在先专利”),因此以下实施例中仅主要描述与在先专利所述不同的部分。
57.实施方式
58.实施例1
59.如下进行培养同种异体免疫细胞的第一种方法。
60.1.获得第一供体细胞培养物的步骤
61.首先,利用人淋巴细胞或单核细胞等单个核细胞的比重低于1.077的特性,将健康供体的血液叠置在比重为1.077的ficoll
‑
paque plus溶液上,从而利用恒定的离心力进行离心沉淀。由此,根据比重差进行分离,使得比重大于1.077的红细胞和粒细胞层位于底部,并且比重为1.077以下的单个核细胞层和血小板位于顶部,从而获得包含淋巴细胞的pbmc。如有必要,可以仅提取和使用pbmc中的淋巴细胞。然而,即使在未经任何修改的情况下培养pbmc,也可以获得相同的结果,因为在随后的培养条件下会去除除免疫细胞(nk细胞和t细胞)之外的其余细胞。因此,pbmc和淋巴细胞可以以相同的方式进行分析和使用。
62.此后,从第0天至第10天,按照在先专利的实施例中描述的方法(即nktm培养法)培养从健康供体血液中分离出的pbmc,从而获得第一供体细胞培养物。
63.2.制备患者源pbmc的步骤
64.通过执行上述方法从待施用免疫细胞治疗剂的患者的血液中分离出pbmc,并根据nktm培养法从第0天至第10天培养该pbmc,因此获得患者细胞培养物。
65.3.获得第一混合培养物的步骤
66.与在先专利(其中,通过离心(400xg)从包含细胞的原代培养物中分离出免疫细胞
和无血清原代培养物,从而在第11天收集无血清原代培养物)不同,在本发明中,以1:1的体积比混合所制备的第一供体细胞培养物和患者细胞培养物,得到第一混合培养物。
67.4.混合培养步骤
68.根据nktm培养法从第12天至第18天培养第一混合培养物,以获得包含培养基组合物和增殖的免疫细胞的同种异体免疫细胞培养物质1。
69.实施例2
70.在以与实施例1中相同的方式获得第一混合培养物后,在以与下表1中相同的方式进行更换和收获培养基组合物的同时进行培养60天,不同之处在于改变供体的血液和患者的血液,从而获得了大量的培养基组合物。
71.在第11天,将两袋中的细胞相互混合,然后分成两袋,然后进行培养。此外,在以3~4天的间隔改变培养基中的细胞因子浓度的同时改变刺激物,并在更换培养基的同时进行培养。细胞因子浓度的改变可以通过重复nktm培养法的第8至第14天的过程来实施。即,在高浓度c1溶液下进行培养后,使用不含细胞因子的培养袋进行培养,并且可通过逐渐小幅度松开培养袋来改变细胞因子的浓度。以这种方式进行培养时,可以使用少量的免疫细胞获得大量的富含细胞因子的免疫细胞培养物。
72.[表1]
[0073][0074]
实施例3
[0075]
培养同种异体免疫细胞的第二种方法如下进行。
[0076]
1.获得第二供体细胞培养物的步骤
[0077]
将按照与实施例1相同的方式从另一供体的血液中分离出的pbmc按照nktm培养法从第0天至第1天进行培养,从而获得第二供体细胞培养物。免疫细胞数为1.2
×
107。
[0078]
2.制备患者源pbmc的步骤
[0079]
将从待施用免疫细胞治疗剂的患者的血液中分离出的pbmc按照nktm培养法从第0天至第14天进行培养,从而获得患者细胞培养物。
[0080]
3.获得第二混合培养物的步骤
[0081]
按照nktm培养法在第2天加入患者细胞培养物代替d单位加入第二供体细胞培养物中,使免疫细胞数为0.8
×
107,从而获得第二混合培养物。
[0082]
4.混合培养步骤
[0083]
按照nktm培养方法将第二混合培养物从第2天至第14天进行培养,从而获得包含培养基组合物和增殖的免疫细胞的同种异体免疫细胞培养物质2。
[0084]
实验例1
[0085]
如下进行了实验以确认在使用基底干细胞诱导t细胞的免疫耐受之后降低的细胞杀伤能力。即,使用特定人的干细胞诱导t细胞的免疫耐受,并比较t细胞对这些干细胞的杀伤能力,从而确认免疫耐受。与其他细胞相比,已知干细胞在细胞表面表达较少的mhc i类分子。作为实验中使用的干细胞,使用获自脐带的第8代干细胞。使用在细胞培养第14天收获的免疫细胞(nk细胞纯度:69%),将干细胞与这些免疫细胞混合,使干细胞的量约为30%,然后培养一天,随后进行免疫细胞的细胞毒性测试。换言之,将免疫细胞用作效应细胞、将人类干细胞(例如在前一天培养的干细胞)用作靶细胞来进行测试。使用以下典型方法进行免疫细胞的细胞毒性测试。
[0086]
[细胞毒性测试]
[0087]
在体外对靶细胞进行荧光染色,使其与效应细胞反应,然后测量被效应细胞攻击并因此破坏的靶细胞所发出的荧光强度,由此评价效应细胞的杀伤能力。细胞毒活性越高,荧光强度的测量值越高。
[0088]
作为荧光试剂的钙黄绿素am是脂溶性二酯产荧光酯酶底物并且可以穿过细胞膜。在活细胞中,使用完整细胞膜的细胞内酯酶进行水解,以将钙黄绿素am(非荧光)转化为钙黄绿素(荧光),从而确保发出荧光。由于活细胞的膜完整,酯酶活性得以维持,从而确保荧光。但是,在死细胞的细胞膜受损的情况下,酯酶活性丧失并发出荧光,因此荧光得不到保证(在死细胞的情况下,荧光无法维持)。
[0089]
当靶细胞被钙黄绿素am荧光染色从而与效应细胞反应时,被效应细胞攻击的靶细胞被破坏并发出荧光,只有活的靶细胞才有荧光。随着效应细胞造成的损伤增加,从被破坏的靶细胞发出的荧光强度增加。可以使用能够测量荧光强度的装置测量从靶细胞发出的荧光的强度。
[0090]
该实验按以下顺序进行。
[0091]
1)将靶细胞收集在15ml管中并以1500rpm离心5分钟。去除上清液,用1ml培养基(rpmi1640 10%fbs)溶解沉淀块,然后进行细胞计数。
[0092]
2)在1.5ml试管中将细胞数设置为1
×
106/ml后,加入10μl钙黄绿素am染色溶液(1mg/dmso 1ml),然后与5%co2在37℃下温育30分钟。
[0093]
3)温育后,去除上清液,用1ml培养基(rpmi1640 10%fbs)洗涤细胞(重复两次)。
[0094]
4)将效应细胞以1500rpm离心5分钟,然后用培养基(rpmi1640 10%fbs)洗涤一次。图1显示了实验中使用的效应细胞的facs数据。
[0095]
5)去除上清液后,加入1ml培养基。然后,用血细胞计数器进行细胞计数以制备细胞,使得细胞浓度为靶细胞浓度的10倍和5倍。
[0096]
6)在96孔板中制造对照和靶细胞/效应细胞,然后分配在孔中。
[0097]
7)天然玻璃孔(阴性对照):100μl培养基(rpmi1640 10%fbs) 50μl靶细胞
[0098]
8)max玻璃孔(阳性对照):70μl培养基(rpmi1640 10%fbs) 50μl靶细胞 30μl1%tritonx
‑
100
[0099]
9)培养基孔:150μl培养基(rpmi1640 10%fbs)
[0100]
10)样品孔:50μl靶细胞 100μl效应细胞
[0101]
11)将培养基和样品混合以实现良好反应。
[0102]
12)在37℃下与5%co2温育4小时。
[0103]
13)反应后,在1500rpm下进行离心5分钟。
[0104]
14)离心后,将120μl所得材料移至黑板以使用fluoroskan上升板读数器测量荧光值。
[0105]
15)用以下计算公式计算细胞毒性。
[0106]
效应细胞的细胞毒性(%)=(样品的荧光值
‑
天然玻璃荧光值)/(最大玻璃荧光值
‑
天然玻璃荧光值)
×
100
[0107]
比较从上述实验得到的共培养免疫细胞(效应物:靶细胞)的细胞毒性,结果见表2和图2。
[0108]
[表2]
[0109] 对照(未共培养)1天共培养对照(未共培养)1天共培养效应物/靶细胞(10:1)(10:1)(5:1)(5:1)细胞毒性49.7%33.8%35.5%24.3%
[0110]
从表2和图2的结果看,可以确认出现了免疫耐受。即,已知在干细胞的情况下,在其表面上不表达大量mhc i类分子。在这种情况下,其容易被nk细胞攻击,而表达了大量mhc i类分子的干细胞由于其差异而被他人的tc(cd8 t细胞)攻击并随后死亡。这是因为,如表2和图2所示,通过混合培养干细胞而诱导了免疫耐受的免疫细胞的活性被证实远低于未诱导免疫耐受的免疫细胞的活性。然而,认为由于nk细胞,活性仍在一定程度上得以保持,并证实通过将同质细胞一起培养,诱导了对靶细胞的免疫耐受。由此可知,可以更容易地制造同质免疫细胞治疗剂而无需去除t细胞。
[0111]
实验例2
[0112]
在实施例1中,从第0天至第18天进行培养,并根据培养天数观察免疫细胞的数量。结果示于表3和图3。
[0113]
[表3]
[0114][0115]
在表3和图3的结果中,当两人的细胞相互混合时,tc细胞最初相互攻击,因此细胞数量略有减少。但是,免疫耐受出现后,两人的细胞并不会互相攻击。此外,由于差异,免疫细胞在刺激下变得更加活化,因此增殖超过预期。此外,可以看出细胞寿命延长,因此可以在第14天和第21天之间收获细胞。
[0116]
实验例3
[0117]
在实施例2中,从第0天至第60天进行培养,并根据培养天数观察免疫细胞的数量。
结果示于表4和图4a至4c。
[0118]
[表4]
[0119][0120][0121]
从表4和图4a至4c可以看出,当两人的细胞以与实验例2相同的方式相互混合时,tc细胞最初相互攻击,因此细胞数量略有减少。然而,在出现免疫耐受后,tc细胞不会相互攻击。此外,由于差异,免疫细胞在刺激下变得更加活化,因此增殖超过预期。nk细胞对k562细胞系也显示出非常大的细胞毒性,因此无论免疫耐受如何,都发现nk免疫细胞的活性得以维持。此外,可以确认细胞寿命非常长。在典型的培养方法中,细胞数在约17至20天后迅速减少。然而,当混合他人的细胞的同时进行培养时,以3至4天的间隔改变培养基中的细胞因子浓度、改变刺激并更换培养基,确认了大量免疫细胞存活,即使其寿命为60天或更长。
[0122]
实验例4
[0123]
在实施例3中,从第0天至第14天进行培养,并根据培养天数观察免疫细胞的数量。结果示于表5和图5和6中。
[0124]
[表5]
[0125]
培养天数04681114细胞数(x107)1.21.03.613.1115325
[0126]
在表5和图5和6中,当将两人的细胞相互混合时,tc细胞最初相互攻击,因此细胞数量略有减少。然而,在出现免疫耐受后,tc细胞不会相互攻击。即使根据本发明的培养同种异体免疫细胞的第二种方法在培养初始阶段不使用抗cd3抗体进行刺激,也可以看出,由于患者的免疫细胞来源不同,即由于差异,免疫细胞在刺激下也变得更加活化,因而增殖超
过预期。
[0127]
已经参考如上所述的优选实施方式说明和描述了本发明。然而,本发明不限于上述实施方式,本发明所属领域的技术人员可以在不脱离本发明的精神的范围内做出各种改变和修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。