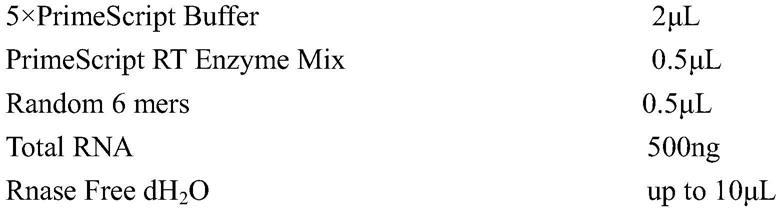1.本发明涉及生物医学技术领域,具体地说,是一种抗乙型脑炎病毒(jev)感染的新靶点:古蛋白1(archain 1,arcn1),及其在制备预防或治疗乙型脑炎病毒感染药物中的应用。
背景技术:
2.乙型脑炎病毒又称日本脑炎病毒(japanese encephalitis virus,jev),属于黄病毒科(flaviviridae)黄病毒属(flavivirus),为有包膜的单正链rna病毒[gubler,d.,g.kuno,and l.markoff.flaviviruses,p.2007.1153
‑
1252.in d.m.knipe and p.m.howley(ed.),fields virology,5th ed.,vol.1.lippincott
‑
williams&wilkins,philadelphia,pa.]。jev为流行性乙型脑炎的病原体,主要以蚊虫为媒介进行传播,感染后能够引发脑炎或脑膜炎等严重的急性神经系统症状,对人类健康威胁巨大。乙型脑炎主要流行于东亚、东南亚以及大洋洲的部分地区,目前主要的控制手段为疫苗预防以及蚊虫的消除,然而在过去十年周期中,由世界卫生组织统计的全球乙型脑炎病例平均为69,000例/年,死亡人数超过10,000例[turtle l,solomon t.japanese encephalitis—the prospects for new treatments.nature reviews neurology,2018,14(5):298
‑
313.],由于诊断和报告机制不完善,实际的感染和死亡病例要超过这些数字,其范围可预估5万
‑
17.5万例/年,且jev引发的神经系统疾病导致了大量的感染人员终身残疾。可见乙型脑炎仍然是危害公众健康的重大问题,因而研究jev致病机理和预防手段,寻找新的抗病毒策略,已成为亟待解决的前沿课题。
[0003]
尽管jev可以感染不同组织类型的细胞,而其最主要的威胁还在于侵入中枢神经系统,引发脑炎。jev感染具有嗜神经性,易造成严重的中枢神经系统(cns)疾病及其并发症,这也是导致乙型脑炎患者发展为重症甚至死亡的主要原因。jev在体内扩增后,经血液循环,能够突破血脑屏障感染中枢神经系统。研究表明,jev感染可直接或间接引发神经细胞的凋亡。jev入侵神经细胞后可引起炎性反应,激活一系列细胞炎症相关信号通路,并引发宿主细胞产生大量的炎症因子,从而促进了疾病进程[denizot m,neal jw,gasque p.encephalitis due to emerging viruses:cns innate immunity and potential therapeutic targets.j infect.2012.65(1):1
‑
16.]。目前,针对jev感染神经系统的机制研究相对较少。前期,我们发现jev侵入神经母细胞瘤细胞是通过小窝介导的内吞途径,与病毒侵入非神经类细胞的机制不同[zhu yz,xu qq,wu dg,et al.japanese encephalitis virus enters rat neuroblastoma cells via a ph
‑
dependent,dynamin and caveola
‑
mediated endocytosis pathway.j virol.2012,86(24):13407
‑
22.]。kalia等人研究也发现jev入侵小鼠神经母细胞瘤细胞(neuro2a)的途径与侵入其他种类宿主细胞的途径存在差异,并非依赖于网格蛋白途径[kalia m,khasa r,sharma m,nain m,vrati s.japanese encephalitis virus infects neuronal cells through a clathrin
‑
independent endocytic mechanism.j virol,2013,87(1):148
‑
62.]。这些研究表明jev入侵神经细胞的
机制并不同于其入侵其他种类宿主细胞,jev侵入神经细胞的特殊性可能与jev的嗜神经性和致病性相关。
[0004]
目前,虽有一些针对乙型脑炎病毒复制周期抗病毒药物、疫苗开发、rna等方面的报道,但迄今为止,还没有特异的药物或有效的方法来治疗乙型脑炎。目前研究的抗jev药物主要包括以下几种:核酸靶向治疗剂、核酸类似物、细胞因子类和黄酮类化合物等。国内外研究人员在抗乙脑药物研究方面可以归结为几个主要方向:一是利用现有的抗病毒药物治疗乙型脑炎;二是依据jev的分子生物学特点设计并合成现有抗病毒药物的衍生物;三是寻找新的靶点,进而筛选新的抗jev药物。双氢青蒿素(dihydroartemisinin,dha)是临床安全、有效的抗疟疾药物。此外,研究表明dha还具有抗病毒和抗炎等功能。青蒿素类化合物对疱疹病毒如巨细胞病毒、乙型肝炎病毒、丙型肝炎病毒、寨卡病毒等多种病毒均具有抑制作用。dha可通过调节炎症信号通路以及氧化应激通路来调控病毒感染及病毒复制。我们前期对dha作用于人神经母细胞瘤sh
‑
sy5y前后对jev感染的影响进行了分析,结果发现dha作用可显著抑制jev的感染。进一步采用基因组测序方法比较了dha作用前后,对jev感染的sh
‑
sy5y细胞中基因转录水平的改变,从中筛选出一组参与jev感染神经细胞的关键宿主细胞分子,这些分子中在jev感染中的作用还未有报道。
[0005]
古蛋白1(archain 1,arcn1)是蛋白转运机制中的一个重要分子,参与细胞内囊泡结构的形成以及多种途径的囊泡介导的蛋白转运过程。arcn1是衣被蛋白的组分,分布于高尔基体膜上,介导了生物合成蛋白从内质网通过高尔基体到达反式高尔基体网络的运输过程,也是高尔基膜出芽所必需的分子[izumi k,brett m,nishi e,et al.arcn1 mutations cause a recognizable craniofacial syndrome due to copi
‑
mediated transport defects.the american journal of human genetics,2016,99(2):451
‑
459.]。arcn1也被证实参与了病原体的感染过程。arcn1参与了甲型流感病毒在宿主细胞内的复制过程,下调arcn1的表达可显著降低甲型流感病毒的感染。arcn1也被证实可以同h5n1流感病毒的pb1 n40蛋白相互作用,从而影响了h5n1流感病毒的感染性。可见arcn1在参与病毒感染与致病过程中发挥着重要作用[wang q,liu r,li q,et al.host cell interactome of pb1 n40 protein of h5n1 influenza a virus in chicken cells[j].journal of proteomics,2019,197:34
‑
41.]。
[0006]
目前还没有任何关于古蛋白1(arcn1)在jev感染中作用的报道,对于该分子进行深入研究不仅能够提升对jev感染与致病机制的认识,也可以为预防与治疗jev感染提供新的思路与靶点。
技术实现要素:
[0007]
本发明的目的在于提供一种抗乙型脑炎病毒(jev)感染的新靶点,即古蛋白1(archain 1,arcn1)。
[0008]
本发明的另一目的在于提供古蛋白1(arcn1)的新用途,特别是在制备预防或治疗乙型脑炎病毒感染药物中的应用。
[0009]
本发明的第三目的在于提供干扰古蛋白1(arcn1)表达的sirna及其应用。
[0010]
为了实现上述目的,本发明的主要技术方案是:
[0011]
本发明,以人神经母细胞瘤sh
‑
sy5y细胞作为靶细胞来感染jev,同时比较双氢青
蒿素(20μm)作用前后靶细胞转录水平的变化,从而来寻找可有效抑制jev感染人神经细胞的宿主因子,从而保护神经系统的功能。本实验通过基因表达量变化筛选出一组在双氢青蒿素作用后显著下调且jev感染显著下降的宿主分子。本发明发现古蛋白1(arcn1)在jev感染sh
‑
sy5y中发挥着重要的作用,下调arcn1的表达,能明显抑制jev的感染。
[0012]
本发明的第一方面,提供一种抗乙型脑炎病毒(jev)感染的新靶点,即古蛋白1(arcn1)。
[0013]
本发明的第二方面,提供古蛋白1(arcn1)在制备预防或治疗乙型脑炎病毒感染药物中的应用。
[0014]
进一步地,本发明还提供古蛋白1(arcn1)在制备预防或治疗乙型脑炎药物中的应用。
[0015]
进一步的,所述的应用是指古蛋白1(arcn1)作为预防或治疗乙型脑炎病毒感染的干预靶点。
[0016]
进一步的,所述的药物是通过抑制或下调古蛋白1(arcn1)表达量抑制乙型脑炎病毒感染的药物。
[0017]
本发明的第三方面,提供抑制或下调古蛋白1(arcn1)表达量的试剂在制备预防或治疗乙型脑炎病毒感染药物中的应用。
[0018]
本发明还提供抑制或下调古蛋白1(arcn1)表达量的试剂在制备预防或治疗乙型脑炎药物中的应用。
[0019]
进一步的,所述的抑制或下调古蛋白1(arcn1)表达量的试剂指特异性干扰古蛋白1(arcn1)基因表达、加工的sirna、shrna,或包含sirna、shrna的重组载体(如质粒)等。
[0020]
在本发明的一个实施方式中,所述的抑制或下调古蛋白1(arcn1)表达量的试剂是古蛋白1(arcn1)的干扰rna(sirna),所述的干扰rna的序列选自以下任一:
[0021]
uaccauauacaguuucuccau(seq id no:1)、
[0022]
acagaauuucauacuuaucca(seq id no:2)、
[0023]
uguacauaucgaaacaaucag(seq id no:3)。
[0024]
其中,以如seq id no:3所示的sirna下调arcn1的表达量效果最佳,且降低乙型脑炎病毒对sh
‑
sy5y细胞的感染最为明显。
[0025]
本发明的第四方面,提供一种预防或治疗乙型脑炎病毒感染的药物,所述的药物中包含抑制或下调古蛋白1(arcn1)表达量的试剂。
[0026]
本发明优点在于:
[0027]
1、本发明以人神经母细胞瘤sh
‑
sy5y作为靶细胞,采用转录组测序技术分析双氢青蒿素作用后对jev感染靶细胞基因表达的影响,从而来寻找可有效抑制jev感染人神经细胞的宿主因子,从而保护神经系统的功能,预防病毒感染中枢神经系统造成的脑炎。本发明通过实验发现古蛋白1(arcn1)在jev感染人神经母细胞瘤shsy5y中发挥着重要的作用,下调arcn1的表达,能明显抑制jev的感染。
[0028]
2、本发明筛选到能够抑制乙型脑炎病毒感染sh
‑
sy5y细胞的一个新的宿主细胞分子arcn1。arcn1基因下调以后,不影响细胞正常的生理功能,但明显抑制了乙型脑炎病毒对sh
‑
sy5y细胞的感染。
[0029]
3、本发明为临床预防和治疗因乙型脑炎病毒感染所导致的神经系统的失能提供
了新的靶点和治疗方案。
附图说明
[0030]
图1为双氢青蒿素作用于jev感染的sh
‑
sy5y细胞前后,靶细胞分子转录水平下降最为显著的20个分子的变化情况(排序根据差异倍数由高到低排序)。图中纵坐标轴表示双氢青蒿素作用后宿主细胞分子表达下降倍数,横坐标表示分子名称。
[0031]
图2为转染arcn1分子的不同干扰序列后的干扰效率及对细胞活力的影响图,其中a为arcn1基因的mrna水平检测图(**,p<0.01,与ctrl相比统计学差异显著),b为western blot检测arcn1蛋白的表达图,c为arcn1基因下调对细胞活力影响图;
[0032]
ctrl:不转染任何sirna的sh
‑
sy5y细胞组(空细胞组);
[0033]
nt
‑
ctrl:转染non
‑
targeting sirna的sh
‑
sy5y细胞组(阴性对照组);
[0034]
arcn1
‑
1:转染针对arcn1基因的sirna(seq id no:1)的sh
‑
sy5y细胞组;
[0035]
arcn1
‑
2:转染针对arcn1基因的sirna(seq id no:2)的sh
‑
sy5y细胞组;
[0036]
arcn1
‑
3:转染针对arcn1基因的sirna(seq id no:3)的sh
‑
sy5y细胞组。
[0037]
图3为arcn1下调后对jev感染的影响,采用荧光定量pcr法检测jev病毒量图(**,p<0.01,与ctrl相比统计学差异显著);
[0038]
ctrl:不转染任何sirna的sh
‑
sy5y细胞组(空细胞组);
[0039]
nt
‑
ctrl:转染non
‑
targeting sirna的sh
‑
sy5y细胞组(阴性对照组);
[0040]
arcn1
‑
1:转染针对arcn1基因的sirna(seq id no:1)的sh
‑
sy5y细胞组;
[0041]
arcn1
‑
2:转染针对arcn1基因的sirna(seq id no:2)的sh
‑
sy5y细胞组;
[0042]
arcn1
‑
3:转染针对arcn1基因的sirna(seq id no:3)的sh
‑
sy5y细胞组。
[0043]
图4为免疫荧光法检测arcn1下调后对jev感染的影响,其中a为下调arcn1分子后对病毒感染性影响的免疫荧光检测图,荧光所示为jev包膜蛋白阳性的细胞,b为下调各分子后对病毒感染的抑制率统计图(**和***分别代表p<0.01和p<0.001,与ctrl相比统计学差异显著);
[0044]
ctrl:不转染任何sirna的sh
‑
sy5y细胞组(空细胞组);
[0045]
nt
‑
ctrl:转染non
‑
targeting sirna的sh
‑
sy5y细胞组(阴性对照组);
[0046]
arcn1
‑
1:转染针对arcn1基因的sirna(seq id no:1)的sh
‑
sy5y细胞组;
[0047]
arcn1
‑
2:转染针对arcn1基因的sirna(seq id no:2)的sh
‑
sy5y细胞组;
[0048]
arcn1
‑
3:转染针对arcn1基因的sirna(seq id no:3)的sh
‑
sy5y细胞组。
具体实施方式
[0049]
下面结合实施例和附图对本发明提供的具体实施方式作详细说明。
[0050]
本发明所用试剂和原料均市售可得或可按文献方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人《分子克隆:实验室指南》(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0051]
实施例1:
[0052]
一、实验方法
[0053]
1.转录组测序分析双氢青蒿素治疗前后sh
‑
sy5y细胞基因表达水平的改变。
[0054]
1.1提前12
‑
16小时将sh
‑
sy5y细胞(购自atcc,保藏号:htb
‑
11)铺在24孔细胞培养板上培养,使得转染时细胞密度为80%
‑
90%。在96孔板或24孔板中接种sk
‑
n
‑
sh细胞,37℃、5%co2条件下培养12
‑
16h,使得细胞密度为80%
‑
90%。实验设置药物处理组以及一般感染组,每一组各设置3个复孔,实验独立重复3次。每孔中加入双氢青蒿素(20μm)药物后先于37℃孵育1h,一般感染组加入等量全培液。随后,将含有药物的jev病毒(感染剂量moi=1)液加入到细胞中去,置于37℃孵箱中感染2h后弃去病毒液,并用预温pbs润洗3次,加入含有双氢青蒿素药物的新鲜培养基继续培养,一般感染组加入等量溶剂。培养48h后,收集各组细胞,采用核酸抽提试剂盒分别提取对照组、jev感染组、双氢青蒿素干预组(每组3个独立样本)的核酸成分。
[0055]
1.2提取样品总rna并使用dnase消化dna后,用带有oligo(dt)的磁珠富集mrna;加入打断试剂将mrna打断成短片段,以打断后的mrna为模板,用六碱基随机引物合成一链cdna,然后配制二链合成反应体系合成二链cdna,并使用试剂盒纯化双链cdna;纯化的双链cdna再进行末端修复、加a尾并连接测序接头,然后进行片段大小选择,最后进行pcr扩增;构建好的文库用agilent 2100 bioanalyzer质检合格后,使用illumina hiseqtm 2500测序仪进行测序分析。基于测序结果进行大规模数据分析,分别比较对照组与jev感染组,jev感染组与双氢青蒿素治疗组的基因表达谱差异,通过统计学聚类分析筛选差异显著基因。
[0056]
2.sirna干扰效果鉴定
[0057]
2.1 rna转染
[0058]
转染步骤参照lipofectamine 3000说明书
[0059]
1)提前12
‑
16小时将sh
‑
sy5y细胞(购自atcc,保藏号:htb
‑
11)铺在24孔细胞培养板上培养,使得转染时细胞密度为80%
‑
90%。
[0060]
2)取1μl lipofectamine 3000加入50μl opti
‑
mem中并轻柔混匀,室温孵育5分钟;另取5μl浓度为5μm的不同干扰rna和50μl opti
‑
mem混合。孵育结束后,将稀释的lipofectamine 3000转染试剂加入稀释的rna中,并轻柔吹吸混匀。室温孵育20min后,加入sh
‑
sy5y细胞中,补加400μl opti
‑
mem,使得rna终浓度为50nm。
[0061]
3)转染后6
‑
8小时更换含有双抗的新鲜培养基。
[0062]
2.2实时荧光定量pcr(rt
‑
pcr)检测arcn
‑
1分子的mrna水平
[0063]
1)trizol提取对照组与干扰组细胞的总rna,具体步骤如下:
[0064]
转染48小时后,去培养上清,在细胞中加入1ml trizol,充分混合室温裂解细胞3
‑
5分钟。加入1/5体积的氯仿,手动剧烈混合15秒。于4℃、12,000转离心15分钟。取上层水相并转移到新的ep管中,加入等体积异丙醇,充分混合,室温沉淀10分钟。于4℃、12,000转离心10分钟。弃上清,加入1ml预冷的75%乙醇。于4℃、12,000离心5分钟。充分弃上清,室温晾干rna沉淀,加入depc处理水溶解沉淀,得到总rna。
[0065]
2)利用takara反转录试剂盒获取对照组与干扰组细胞的cdna,具体步骤如下:
[0066]
在pcr管中加入如下反应体系,
[0067][0068]
轻柔混合混匀,置于37℃反应15分钟,然后置于85℃加热5秒钟灭活逆转录酶。
[0069]
3)荧光定量rt
‑
pcr检测
[0070]
利用takara的sybr premix ex taq试剂盒进行反应,反应体系如下,
[0071][0072]
利用rotor gene 3000a仪器进行两步法扩增,95℃预变性2min,进行40个pcr循环,95℃5秒,60℃30秒。
[0073]
3.细胞毒性实验
[0074]
采用cck
‑
8方法检测转染sirna后对细胞增殖的影响,具体步骤如下:
[0075]
收集对数生长期细胞,以每孔3000个的密度接种于96孔板。待细胞过夜贴壁后,转染各sirna,培养48小时后检测细胞增殖情况。弃去原有培养基,每孔加入含10μl cck
‑
8的新鲜培养基110μl,培养3h后用多功能酶标仪在450nm波长检测各孔吸光度值。实验独立重复3次,计算平均值。
[0076]
4.jev病毒感染sh
‑
sy5y细胞
[0077]
4.1 sh
‑
sy5y细胞的jev病毒感染实验
[0078]
sh
‑
sy5y细胞转染rna后72小时,进行jev病毒感染实验。将培养上清吸出,用预温pbs润洗2次,以moi=1的病毒量接种jev,37℃孵育2h后弃去病毒液,并用预温pbs润洗3次,加入新鲜培养基继续培养。
[0079]
4.2免疫荧光染色检测jev抗原表达
[0080]
sh
‑
sy5y细胞感染病毒后继续培养48h,采用免疫荧光法检测病毒抗原的表达,具体步骤如下:
[0081]
1)细胞固定:将96孔板中的培养液移去,加入pbs清洗细胞2次,每孔加入100μl预冷甲醇,于
‑
20℃条件下固定20min,用预冷的pbs清洗细胞3次。
[0082]
2)透膜:固定后的细胞每孔加入100μl 0.1%tritonx
‑
100,室温孵育15min,用预冷pbs洗涤3次。
[0083]
3)封闭:每孔加入100μl 3%bsa,于室温下孵育1h。
[0084]
4)一抗孵育:每孔加入jev特异性鼠源单抗(1:500稀释)100μl,室温孵育1h,用预冷的pbs洗涤3次。
[0085]
5)二抗孵育:每孔加入af 488荧光标记抗鼠igg(1:1000稀释)100μl,室温避光孵育1h,用预冷的pbs避光洗涤2次。
[0086]
6)标记细胞核:每孔加入细胞核荧光染料dapi(1:5000,pbs稀释),室温避光孵育15min,用预冷的pbs避光洗涤3次。
[0087]
7)荧光显微镜下检测并计算绿色荧光阳性细胞克隆数。
[0088]
4.3蛋白免疫印迹。
[0089]
(1)用蛋白裂解液分别提取对照组与arcn1干扰组sh
‑
sy5y细胞的总蛋白。
[0090]
(2)蛋白质定量后分别将30μg蛋白加到12.5%浓度的聚丙烯酰胺凝胶中电泳,并截取相应条带用电转仪转到pvdf膜上。
[0091]
(3)蛋白的非特异性位点用5%的脱脂牛奶封闭,然后用arcn1抗体封闭,4℃过夜,用tbst缓冲液洗三遍,洗去一抗。
[0092]
(4)然后用hrp标记的二抗室温孵育2小时,继而用tbst缓冲液洗三遍。
[0093]
(5)最后利用显色液显色并拍照分析。
[0094]
4.4 rt
‑
pcr检测细胞中jev病毒量
[0095]
sh
‑
sy5y细胞感染病毒后继续培养48h,采用trizol提取对照组与干扰组细胞的总rna,并逆转录获得cdna,通过rt
‑
pcr检测jev病毒量。具体步骤同2.2所示。
[0096]
二、实验结果:
[0097]
1.jev感染sh
‑
sy5y细胞关键宿主分子筛选
[0098]
采用sh
‑
sy5y细胞作为感染模型,通过双氢青蒿素作用后利用二代测序平台对各组样本的转录组进行深度测序,基于测序结果进行大规模数据分析,比较jev感染组与双氢青蒿素干预组的基因表达谱差异。结果如图1所示,双氢青蒿素作用后与单纯jev感染组相比,引发了多个宿主细胞分子的表达变化,图1列出了双氢青蒿素作用后下调最为显著的20个宿主分子。其中古蛋白1(arcn1)下调最为明显,差异倍数为5.72倍(图1),提示arcn1可能为参与jev感染sh
‑
sy5y细胞的关键分子。
[0099]
2.arcn1 sirna设计、干扰效率及细胞毒性检测
[0100]
针对arcn1目的基因序列,我们设计了多个rna干扰靶点序列,并利用设计软件进行预评估测定,选择3个最佳的动力学参数靶点进入后续实验流程,共合成3条干扰序列,如表1所示。
[0101]
表1.arcn1 sirna靶点序列设计
[0102][0103]
采用体外转染的方法,将arcn1基因的干扰rna转染到sh
‑
sy5y细胞中去,48h后通过rt
‑
pcr法检测各干扰rna的干扰效率,最终筛选到干扰效果最佳的sirna序列进行后续实验,同时采用cck8检测转染后对sh
‑
sy5y细胞毒性的影响。
[0104]
结果如图2.a所示,转染有效sirna组与ctrl组相比,转染各sirna后能够明显抑制相应基因的表达水平(p<0.01)。转染arcn1 sirna(seq idno:3)的抑制效率可达到71%,其对应序列为抑制相应基因表达的最佳sirna序列。
[0105]
免疫印迹法检测arcn1下调后对蛋白的影响,结果与基因表达量检测结果相一致,其中转染nsf sirna(seq id no:3)对arcn1蛋白的表达下调最为明显(图2.b)。
[0106]
细胞毒性实验表明,各sirna转染后并没有产生明显的细胞毒性(p>0.05),对细胞正常的生理功能未产生影响(图2.c),可用于后续实验。
[0107]
3.arcn1下调后对jev病毒感染的影响
[0108]
分别转染三条arcn1分子的sirna观察对病毒感染性的影响。结果表明,三条nsf分子的sirna对病毒感染的抑制率均可达到55%以上(图3)。arcn1sirna(seq id no:1)与arcn1 sirna(seq id no:2)对arcn1基因表达的抑制率分别为55%与45%,对jev感染的抑制率分别为51%与61%;随着arcn1 sirna(seq id no:3)对arcn1基因表达抑制率增高至70%(图2a),对jev感染的抑制率也增高至78%(图3),这些结果提示随着对arcn1分子的下调效率的增高,对jev感染的抑制率也在升高,表明arcn1分子在jev感染sh
‑
sy5y中发挥着重要作用。
[0109]
进一步,转染arcn1的有效sirna来下调宿主细胞相关分子的表达并感染相同剂量的jev病毒,感染48h后采用免疫荧光法检测宿主分子下调后对jev感染的影响,发现与对照组相比,转染arcn1 sirna(seq id no:3)使arcn1基因下调后,jev包膜蛋白抗原阳性的细胞数明显减少,进一步证实arcn1基因的下调能够降低jev对sh
‑
sy5y细胞的感染(图4.a)。通过计算病毒量发现,与对照组相比arcn1基因下调后(seq id no:3)对病毒的抑制率达到75%,明显抑制jev对sh
‑
sy5y细胞的感染(图4.b)。
[0110]
通过以上实验结果证明:本发明筛选到能够抑制jev感染sh
‑
sy5y细胞的一个新的宿主细胞分子arcn1。arcn1基因下调以后,不影响细胞正常的生理功能,但明显抑制了jev对sh
‑
sy5y细胞的感染。因此本发明为临床预防和治疗因jev感染所导致的神经系统损伤提供了新的靶点和治疗方案。
[0111]
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本技术权利要求所限定的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。