retinal sheet transplants”,prog retin eye res.2012nov;31(6):661
‑
687
技术实现要素:
15.发明所要解决的课题
16.根据本技术的发明人的研究,发现了如下课题,即,在制造包含以水凝胶包埋的神经视网膜和视网膜色素上皮细胞片的复合体时,由于神经视网膜和视网膜色素上皮细胞片相分离,因此在到移植为止的操作过程中复合体易于崩坏,不能制造适于移植的复合体。此外,根据本技术的发明人的研究判明,在制造包含以水凝胶包埋的神经视网膜和视网膜色素上皮细胞片的复合体时,使分别制造的神经视网膜与视网膜色素上皮细胞片直接地长时间接触后,物理性接触对细胞造成了伤害。
17.另一方面,从水凝胶难以分解时,移植的神经视网膜与同时移植的rpe细胞或宿主的rpe细胞的相互作用或者物质在上述细胞间的移动难以发生的观点来看,水凝胶优选在移植后迅速地溶解,得到分解和吸收。
18.因此,鉴于上述情况,本发明的目的是提供适于移植的神经视网膜与视网膜色素上皮细胞片的复合体及其制造方法。
19.用于解决课题的手段
20.本技术的发明人经过深入研究,结果发现,通过将例如熔点在体温附近的水凝胶于低温条件下以高浓度进行固化,能够提供神经视网膜与视网膜色素上皮细胞片的复合体的操作变得容易、适于移植的视网膜组织。特别是发现,通过使水凝胶介于神经视网膜与视网膜色素上皮细胞片之间及它们的周围,能够防止细胞伤害,且能够提供神经视网膜与视网膜色素上皮细胞片的复合体的操作变得容易、适于移植的视网膜组织,从而完成了本发明。
21.即,本发明涉及以下各发明。
22.1.23.复合体,其是包含神经视网膜、视网膜色素上皮细胞片和水凝胶的复合体,其中,
24.上述神经视网膜和上述视网膜色素上皮细胞片分别来源于人多能干细胞,
25.上述神经视网膜中形成有至少包含视细胞层的神经视网膜层,上述视细胞层至少包含选自由视细胞、视细胞前体细胞及视网膜前体细胞组成的组中的1种以上的细胞,
26.上述水凝胶的熔点为20℃~40℃,
27.上述神经视网膜和上述视网膜色素上皮细胞片的整体包埋于上述水凝胶中,上述神经视网膜和上述视网膜色素上皮细胞片各自的表面的切线方向大致平行,上述神经视网膜的顶端面与上述视网膜色素上皮细胞片的顶端面相对,二者被上述水凝胶隔离而不接触。
28.2.29.上述[1]所述的复合体,其中,上述水凝胶的凝胶强度为1000g~2000g。
[0030]
[3]
[0031]
上述[1]或[2]所述的复合体,其中,上述水凝胶的浓度为10重量%~50重量%。
[0032]
[4]
[0033]
上述[1]~[3]中任一者所述的复合体,其中,上述水凝胶的ph为6.5~7.5。
[0034]
[5]
[0035]
上述[1]~[4]中任一者所述的复合体,其中,上述水凝胶具有生物分解性。
[0036]
[6]
[0037]
上述[1]~[5]中任一者所述的复合体,其中,上述水凝胶是明胶的水凝胶。
[0038]
[7]
[0039]
上述[6]所述的复合体,其中,上述明胶为经碱处理及/或加热处理的明胶。
[0040]
[8]
[0041]
上述[1]~[7]中任一者所述的复合体,其中,上述神经视网膜是从对人多能干细胞进行分化诱导而得的细胞聚集体获得的神经视网膜,
[0042]
上述细胞聚集体至少包含第一上皮组织和第二上皮组织、上述第一上皮组织包含人神经视网膜,第二上皮组织具有与上述第一上皮组织的表面中的切线斜率的连续性不同的表面的切线斜率的连续性,且包含视网膜谱系细胞以外的细胞及/或视网膜色素上皮细胞,
[0043]
上述神经视网膜包含上述细胞聚集体中的距离第二上皮组织最远的第一上皮组织上的区域。
[0044]
[9]
[0045]
包含神经视网膜、视网膜色素上皮细胞片和水凝胶的复合体的制造方法,其中,
[0046]
上述神经视网膜和上述视网膜色素上皮细胞片分别来源于人多能干细胞,
[0047]
上述神经视网膜中形成有至少包含视细胞层的神经视网膜层,上述视细胞层至少包含选自由视细胞、视细胞前体细胞及视网膜前体细胞组成的组中的1种以上的细胞,
[0048]
上述水凝胶的熔点为20℃~40℃,
[0049]
上述方法包括以下步骤:
[0050]
(1)第一步骤,将上述视网膜色素上皮细胞片和上述神经视网膜中的任一者设置于容器中,
[0051]
(2)第二步骤,将流动状态的水凝胶添加至设置有上述一者的上述容器中,
[0052]
(3)第三步骤,冷却,以包埋上述一者的整体的方式使上述水凝胶凝固,形成具备上述一者和上述水凝胶的第一水凝胶层,
[0053]
(4)第四步骤,以使上述第一水凝胶层中的上述一者与上述视网膜色素上皮细胞片和上述神经视网膜中的另一者各自的表面的切线方向成为大致平行、且上述神经视网膜的顶端面与上述视网膜色素上皮细胞的顶端面相对的方式,在上述第一水凝胶层上进一步设置上述另一者,
[0054]
(5)第五步骤,将流动状态的水凝胶添加至进一步设置了上述另一者的上述容器中,和
[0055]
(6)第六步骤,冷却,以包埋上述第一水凝胶层及上述另一者的整体的方式使上述水凝胶凝固,形成具备上述第一水凝胶层、上述另一者和上述水凝胶的第二水凝胶层。
[0056]
[10]
[0057]
上述[9]所述的制造方法,其中,上述第三步骤中,冷却至2℃~8℃。
[0058]
[11]
[0059]
上述[9]或[10]所述的制造方法,其中,上述第六步骤中,冷却至2℃~8℃。
[0060]
[12]
[0061]
上述[9]~[11]中任一者所述的制造方法,其中,在第六步骤之后还包括(7)将上述复合体以10℃~20℃进行保存的第七步骤。
[0062]
[13]
[0063]
上述[9]~[12]所述的制造方法,其中,上述水凝胶的凝胶强度为1000g~2000g。
[0064]
[14]
[0065]
上述[9]~[13]所述的制造方法,其中,上述水凝胶的浓度为10重量%~50重量%。
[0066]
[15]
[0067]
上述[9]~[14]中任一者所述的制造方法,其中,上述水凝胶的ph为6.5~7.5。
[0068]
[16]
[0069]
上述[9]~[15]中任一者所述的制造方法,其中,上述水凝胶具有生物分解性。
[0070]
[17]
[0071]
上述[9]~[16]中任一者所述的制造方法,其中,上述水凝胶是明胶的水凝胶。
[0072]
[18]
[0073]
上述[17]所述的制造方法,其中,上述明胶为经碱处理及/或加热处理的明胶。
[0074]
[19]
[0075]
上述[9]~[18]中任一者所述的制造方法,其中,上述神经视网膜是从对人多能干细胞进行分化诱导而得的细胞聚集体获得的神经视网膜,
[0076]
上述细胞聚集体至少包含第一上皮组织和第二上皮组织,上述第一上皮组织包含人神经视网膜,第二上皮组织具有与上述第一上皮组织的表面中的切线斜率的连续性不同的表面的切线斜率的连续性,且包含视网膜谱系细胞以外的细胞及/或视网膜色素上皮细胞,
[0077]
上述神经视网膜包含上述细胞聚集体中的距离第二上皮组织最远的第一上皮组织上的区域。
[0078]
[20]
[0079]
药物组合物,其含有上述[1]~[8]中任一者所述的复合体作为有效成分。
[0080]
[21]
[0081]
基于视网膜组织的障碍或视网膜组织的损伤的疾病的治疗药,其含有上述[1]~[8]中任一者所述的复合体。
[0082]
[22]
[0083]
移植用组合物,其含有上述[1]~[8]中任一者所述的复合体。
[0084]
[23]
[0085]
[22]所述的移植用组合物,其用于移植至患者的眼底或视网膜下(subretinal space)。
[0086]
[24]
[0087]
[23]所述的移植用组合物,其用于以如下方式进行移植,在进行了移植的患者中,以被移植的复合体的神经视网膜朝向该患者的神经视网膜层、被移植的复合体的视网膜色素上皮细胞片朝向该患者的视网膜色素上皮层的状态植入。
[0088]
[25]
[0089]
基于视网膜组织的障碍或视网膜组织的损伤的疾病的治疗方法,所述方法包括以下步骤:
[0090]
步骤(1),将[1]~[8]中任一者所述的复合体移植至患者的眼底或视网膜下(subretinal space),
[0091]
步骤(2),在患者的生物体内,以被移植的复合体的神经视网膜朝向该患者的神经视网膜层、被移植的复合体的视网膜色素上皮细胞片朝向该患者的视网膜色素上皮层的状态植入。
[0092]
发明效果
[0093]
根据本发明,可以提供适于移植的神经视网膜与视网膜色素上皮细胞片的复合体及其制造方法。
附图说明
[0094]
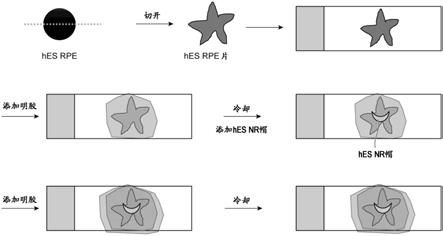
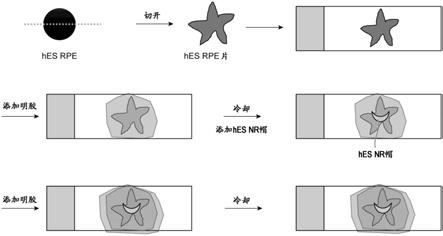
图1:为示出通过显微镜观察实施例1中的、来源于hes细胞的神经视网膜(a)、来源于hes细胞的悬浮rpe(b)和来源于hes细胞的rpe细胞片(c)而得的结果的图像。
[0095]
图2:为示出通过显微镜观察实施例5中的、用ph5的明胶包埋3天、进行恢复培养后的来源于hes细胞的神经视网膜的形态而得的结果的图像。
[0096]
图3:为示出通过显微镜观察实施例5中的、用ph7的明胶包埋3天、进行恢复培养后的来源于hes细胞的神经视网膜的形态而得的结果的图像。
[0097]
图4:为示出针对实施例5中的、来源于hes细胞的神经视网膜用dapi、rcvrn和hla i类实施免疫染色的结果、以及crx::venus的荧光(ph5)的荧光显微镜图像。
[0098]
图5:为示出针对实施例5中的、来源于hes细胞的神经视网膜用dapi、rcvrn和hla i类实施免疫染色的结果、以及crx::venus的荧光(ph7)的荧光显微镜图像。
[0099]
图6:为示出针对实施例5中的、来源于hes细胞的神经视网膜用dapi、埃兹蛋白(ezrin)和coliv实施免疫染色的结果、以及crx::venus的荧光的荧光显微镜图像。
[0100]
图7:为示出针对实施例5中的、来源于hes细胞的神经视网膜用dapi、chx10和pax6实施免疫染色的结果、以及crx::venus的荧光的荧光显微镜图像。
[0101]
图8:为示出针对实施例5中的、来源于hes细胞的神经视网膜用dapi、caspase3、chx10和ki67实施免疫染色的结果的荧光显微镜图像。
[0102]
图9:为示出实施例7的实验步骤的示意图。
[0103]
图10:为示出实施例7中的、神经视网膜(nr)载于视网膜色素上皮(rpe)片上的试样(1)和试样(2)的照片。
[0104]
图11:为示出实施例7中的、nr载于rpe片上的试样(1)和试样(2)的crx::venus的荧光的荧光显微镜图像。
[0105]
图12:为示出实施例7中的、明胶的切出操作的步骤的照片。
[0106]
图13:为示出针对实施例7中的、被包埋的来源于人es细胞的rpe与神经视网膜复合体的切片的crx::venus的荧光的荧光显微镜图像。
[0107]
图14:为示出针对实施例7中的、明胶刚刚粘附后的被包埋的来源于人es细胞的rpe与神经视网膜复合体的切片用dapi实施染色的结果、以及crx::venus的荧光的荧光显
微镜图像。
[0108]
图15:为示出针对实施例8中的、组织切片中的人细胞和rpe细胞用dapi、stem121和rpe65实施免疫染色的结果、以及crx::venus的荧光的荧光显微镜图像。
[0109]
图16:为示出针对实施例8中的、组织切片中的人细胞和rpe细胞用dapi、stem121和rpe65实施免疫染色的结果、以及crx::venus的荧光的荧光显微镜图像。
[0110]
图17:为示出针对实施例8中的、组织切片中的人细胞和rpe细胞用dapi、hunu和mitf实施免疫染色的结果的荧光显微镜图像。
[0111]
图18:为示出针对实施例8中的、组织切片中的人细胞和rpe细胞用dapi、hunu、mitf和bf实施免疫染色的结果的荧光显微镜图像。
[0112]
图19:为示出针对实施例8中的、组织切片中的人细胞和rpe细胞用dapi、hunu、mitf和iba
‑
1实施免疫染色的结果的荧光显微镜图像。
[0113]
图20:为示出针对实施例8中的、组织切片中的人细胞和rpe细胞用dapi、hunu、mitf和iba
‑
1实施免疫染色的结果的荧光显微镜图像。
[0114]
图21:为示出实施例9中的、nr载于rpe细胞片上的情况的显微镜图像(a)和示出crx::venus的荧光的荧光显微镜图像(b)。
具体实施方式
[0115]
〔定义〕
[0116]“干细胞”意指具有分化能力和增殖能力(特别是自我复制能力)的未分化的细胞。干细胞根据分化能力而包括多能干细胞(pluripotent stem cell)、专能干细胞(multipotent stem cell)、单能干细胞(unipotent stem cell)等亚群。多能干细胞是指可以在体外进行培养、且具有能分化为属于三胚层(外胚层、中胚层、内胚层)及/或胚外组织的所有细胞谱系的能力(分化多能性(pluripotency))的干细胞。专能性干细胞意指具有能分化为多种而非全部种类的组织、细胞的能力的干细胞。单能性干细胞意指具有能分化为特定的组织、细胞的能力的干细胞。
[0117]“多能干细胞”可以从受精卵、克隆胚胎、生殖干细胞、组织内干细胞、体细胞等诱导。作为多能干细胞,可举出胚胎干细胞(es细胞:embryonic stem cell)、eg细胞(胚胎生殖细胞,embryonic germ cell)、人工多能干细胞(ips细胞:induced pluripotent stem cell)等。从间充质干细胞(mesenchymal stem cell;msc)得到的muse细胞(multi
‑
lineage differentiating stress enduring cell,多系分化持续应激细胞)、从生殖细胞(例如精巢)制得的gs细胞也包含于多能干细胞中。
[0118]
人胚胎干细胞建立于1998年,也被逐渐用于再生医学。胚胎干细胞可以通过将内部细胞聚集体在饲养细胞上或含有bfgf的培养基中进行培养来制造。胚胎干细胞的制造方法被记载于例如wo96/22362、wo02/101057、us5,843,780、us6,200,806、us6,280,718等中。胚胎干细胞可以自规定的机构获得,还可购买市售品。例如,作为人胚胎干细胞的khes
‑
1、khes
‑
2和khes
‑
3可以自京都大学再生医科学研究所获得,作为人胚胎干细胞的crx::venus株(来源于khes
‑
1)可以自日本国立研究开发法人理化学研究所获得。
[0119]“人工多能干细胞”是通过将体细胞利用已知的方法等进行重编程(reprogramming)而诱导出多能性的细胞。
[0120]
人工多能干细胞是由山中等于2006年用小鼠细胞建立的(cell,2006,126(4),pp.663
‑
676)。对于人工多能干细胞而言,在2007年还在人成纤维细胞中得以建立,与胚胎干细胞同样具有多能性和自我复制能力(cell,2007,131(5),pp.861
‑
872;science,2007,318(5858),pp.1917
‑
1920;nat.biotechnol.,2008,26(1),pp.101
‑
106)。
[0121]
具体而言,人工多能干细胞可举出通过使成纤维细胞、外周血单核细胞等已分化的体细胞表达选自包括oct3/4、sox2、klf4、myc(c
‑
myc、n
‑
myc、l
‑
myc)、glis1、nanog、sall4、lin28、esrrb等的重编程基因群中的多个基因的组合中的任一者来进行重编程、从而诱导出多分化能力的细胞。作为优选的重编程因子的组合,可举出(1)oct3/4、sox2、klf4、和myc(c
‑
myc或l
‑
myc)、(2)oct3/4、sox2、klf4、lin28和l
‑
myc(stem cells、2013;31:458
‑
466)。
[0122]
作为人工多能干细胞,除了通过利用基因表达直接重编程进行制造的方法以外,还可以通过化合物的添加等来从体细胞诱导人工多能干细胞(science,2013,341,pp.651
‑
654)。
[0123]
此外,也可以获得已株系化的人工多能干细胞,例如,可以自京都大学和ips academia japan株式会社获得由京都大学建立的201b7细胞、201b7
‑
ff细胞、253g1细胞、253g4细胞、1201c1细胞、1205d1细胞、1210b2细胞、1231a3细胞等人的人工多能性细胞株。作为已株系化的人工多能干细胞,例如,可以自京都大学获得由京都大学建立的ff
‑
i01细胞和ff
‑
i14细胞。
[0124]
在本说明书中,多能干细胞优选为胚胎干细胞或人工多能干细胞,更优选为人工多能干细胞。
[0125]
在本说明书中,多能干细胞为人的多能干细胞,优选为人的人工多能干细胞(ips细胞)或人胚胎干细胞(es细胞)。
[0126]
人ips细胞等多能干细胞可以用本领域技术人员已知的方法进行维持培养和扩大培养。
[0127]“视网膜组织(retinal tissue)”意指生物体视网膜中构成各视网膜层的一种或多种视网膜谱系细胞按照一定的秩序存在的组织,“神经视网膜(neural retina)”为视网膜组织,意指包含内侧的神经视网膜层(不包含后述的视网膜层之中的视网膜色素上皮层)的组织。
[0128]“视网膜谱系细胞”意指生物体视网膜中构成各视网膜层的细胞或其前体细胞。视网膜谱系细胞包括视细胞(视杆细胞、视锥细胞)、水平细胞、无长突细胞、中间神经细胞、视网膜神经节细胞(神经节细胞)、双极细胞(杆状双极细胞、锥状双极细胞)、缪勒氏神经胶质细胞(muller glia cell)、视网膜色素上皮(rpe)细胞、睫状体边缘带细胞、上述细胞的前体细胞(例如:视细胞前体细胞、双极细胞前体细胞等)、视网膜前体细胞等细胞,但不限于这些。视网膜谱系细胞中,作为构成神经视网膜层的细胞,具体而言,可举出视细胞(视杆细胞、视锥细胞)、水平细胞、无长突细胞、中间神经细胞、视网膜神经节细胞(神经节细胞)、双极细胞(杆状双极细胞、锥状双极细胞)、缪勒氏神经胶质细胞、和上述细胞的前体细胞(例如:视细胞前体细胞、双极细胞前体细胞等)等细胞。
[0129]“成熟的视网膜谱系细胞”意指可能包含于成人的视网膜组织中的细胞,具体而言,意指视细胞(视杆细胞、视锥细胞)、水平细胞、无长突细胞、中间神经细胞、视网膜神经
节细胞(神经节细胞)、双极细胞(杆状双极细胞、锥状双极细胞)、缪勒氏神经胶质细胞、视网膜色素上皮(rpe)细胞、睫状体边缘带细胞等已分化的细胞。“未成熟的视网膜谱系细胞”意指确定会向成熟的视网膜谱系细胞分化的前体细胞(例如:视细胞前体细胞、双极细胞前体细胞、视网膜前体细胞等)。
[0130]
视细胞前体细胞、水平细胞前体细胞、双极细胞前体细胞、无长突细胞前体细胞、视网膜神经节细胞前体细胞、缪勒氏神经胶质前体细胞、视网膜色素上皮前体细胞分别指确定会向视细胞、水平细胞、双极细胞、无长突细胞、视网膜神经节细胞、缪勒氏神经胶质细胞、视网膜色素上皮细胞分化的前体细胞。
[0131]“视网膜前体细胞”指能分化为视细胞前体细胞、水平细胞前体细胞、双极细胞前体细胞、无长突细胞前体细胞、视网膜神经节细胞前体细胞、缪勒氏神经胶质细胞、视网膜色素上皮前体细胞等中的任何未成熟的视网膜谱系细胞的前体细胞,且是最终能分化为视细胞、视杆细胞、视锥细胞、水平细胞、双极细胞、无长突细胞、视网膜神经节细胞、视网膜色素上皮细胞等中的任何成熟的视网膜谱系细胞的前体细胞。
[0132]
所谓“视细胞(photoreceptor cell)”,存在于视网膜的视细胞层中,具有吸收光刺激并转换为电信号的作用。视细胞有于亮处发挥功能的锥体(cone)和于暗处发挥功能的杆状体(或杆体、rod)这两种。视细胞是从视细胞前体细胞分化并成熟的。本领域技术人员可以通过例如后述的细胞标志物(在视细胞前体细胞中表达的crx和blimp1、在视细胞中表达的恢复蛋白(recoverin)、在成熟视细胞中表达的视紫红质(rhodopsin)、s
‑
视蛋白和m/l
‑
视蛋白等)的表达、外节结构的形成等来容易地确认细胞是否为视细胞或者视细胞前体细胞。在一个方式中,视细胞前体细胞为crx阳性细胞,视细胞为视紫红质、s
‑
视蛋白和m/l
‑
视蛋白阳性细胞。
[0133]
可以通过视网膜谱系细胞的标志物(以下有时称为“视网膜谱系细胞标志物”)有无表达来确认视网膜谱系细胞的存在。本领域技术人员可以容易地确认视网膜谱系细胞标志物有无表达,或者细胞群或组织中的视网膜谱系细胞标志物阳性细胞的比例。例如,可以通过使用市售抗体的流式细胞术、免疫染色等手段,将特定的视网膜谱系细胞标志物阳性细胞的数量除以总细胞数来确认。
[0134]
作为视网膜谱系细胞标志物,可举出在视网膜前体细胞中表达的rx(也称为rax)和pax6、在神经视网膜前体细胞中表达的rx、pax6和chx10、在视细胞前体细胞中表达的crx和blimp1等。此外,在双极细胞中高表达的chx10、在双极细胞中表达的pkcα、goα、vsx1和l7、在视网膜神经节细胞中表达的tuj1和brn3、在无长突细胞中表达的钙视网膜蛋白(calretinin)和hpc
‑
1、在水平细胞中表达的钙结合蛋白(calbindin)、在视细胞和视细胞前体细胞中表达的恢复蛋白、在杆体细胞中表达的视紫红质、在视杆细胞和视杆细胞前体细胞中表达的nrl、在视锥细胞中表达的s
‑
视蛋白和lm
‑
视蛋白、在锥体细胞、视锥细胞前体细胞和神经节细胞中表达的rxr
‑
γ、在视锥细胞之中的于分化初期出现的视锥细胞或其前体细胞中表达的trβ2、otx2和oc2、在水平细胞、无长突细胞和神经节细胞中共通地表达的pax6、在视网膜色素上皮细胞中表达的rpe65和mitf、在穆勒细胞中表达的cralbp等。
[0135]“阳性细胞”意指细胞表面上或细胞内表达特定标志物的细胞。例如,“chx10阳性细胞”意指表达chx10蛋白质的细胞。
[0136]“视网膜色素上皮细胞”意指生物体视网膜中存在于神经视网膜的外侧的上皮细
胞。本领域技术人员可以通过例如后述的细胞标志物(rpe65、mitf、cralbp、mertk、best1等)的表达、黑色素颗粒的存在(黑褐色)、细胞间的紧密连接、多边形
·
鹅卵石状的特征性细胞形态等来容易地确认细胞是否为视网膜色素上皮细胞。可以通过vegf和pedf等细胞因子的分泌能力等来容易地确认细胞是否具有视网膜色素上皮细胞的功能。在一个方式中,视网膜色素上皮细胞为rpe65阳性细胞、mitf阳性细胞、或者rpe65阳性且mitf阳性细胞。
[0137]“视网膜色素上皮细胞片”意指视网膜色素上皮细胞至少沿二维方向通过生物学的结合而彼此粘附,由单个或多个细胞构成的单层或复层的片状结构体。
[0138]“视网膜层”意指构成视网膜的各层,具体而言,可举出视网膜色素上皮层、视细胞层、外界膜、外颗粒层、外网层、内颗粒层、内网层、神经节细胞层、神经纤维层和内界膜。
[0139]“神经视网膜层”意指构成神经视网膜的各层,具体而言,可举出视细胞层、外界膜、外颗粒层、外网层、内颗粒层、内网层、神经节细胞层、神经纤维层和内界膜。所谓“视细胞层”,是视网膜层(神经视网膜层)中的1种,意指形成于神经视网膜的最外侧并包含大量选自由视细胞(视杆细胞、视锥细胞)、视细胞前体细胞和视网膜前体细胞组成的组中的1种以上的细胞的视网膜层。可以通过已知的方法,例如细胞标志物的表达的有无或表达的程度等来确认各细胞是否是构成任一视网膜层的细胞。
[0140]
所谓“细胞聚集体”(cell aggregate),只要多个细胞彼此粘附而形成立体结构即可,没有特殊限定,例如,指分散于培养基等介质中的细胞聚集而形成的团块,或指经过细胞分裂而形成的细胞的团块等。细胞聚集体也包括形成特定组织的情况。
[0141]“球(sphere)状细胞聚集体”意味着具有近似球状的立体形状的细胞聚集体。所谓近似球状的立体形状,是具有三维结构的形状,可举出投影至二维平面时例如呈现圆形或椭圆形的球状形状、和多个球状形状融合而形成的形状(例如,进行二维投影时,显示出形成了2~4个圆形或椭圆形重叠而形成的形状)。在一个方式中,聚集体的核心部具有下述特征:具有囊泡性层状结构,在明视野显微镜下,观察到中央部分较暗,外缘部分较亮。
[0142]
所谓“睫状体边缘带样结构体”,是与睫状体边缘带类似的结构体。作为“睫状体边缘带(ciliary marginal zone;cmz)”,例如,可举出生物体视网膜中存在于神经视网膜与视网膜色素上皮的边界区域的组织、且包含视网膜的组织干细胞(视网膜干细胞)的区域。睫状体边缘带也被称为睫状缘(ciliarymargin)或视网膜缘(retinal margin),睫状体边缘带、睫状缘和视网膜缘是同等的组织。已知睫状体边缘带发挥了向视网膜组织供给视网膜前体细胞、分化细胞、维持视网膜组织结构等重要作用。作为睫状体边缘带的标志物基因,例如,可举出rdh10基因(阳性)、otx1基因(阳性)和zic1(阳性)。
[0143]“顶端面(apical)”是指上皮组织中,富含粘多糖(pas染色阳性)、形成于下述位置的表面(表层面):含有大量层粘连蛋白和iv型胶原蛋白的、50
‑
100nm的上皮细胞所产生的基底(basal)侧的层(基底膜)存在的基底膜侧的相反一侧。“基底膜”是指含有大量层粘连蛋白和iv型胶原蛋白的、50
‑
100nm的存在于上皮细胞所产生的基底(basal)侧的层(基底膜)的基底膜。在一个方式中,指在发育阶段进行至可观察到视细胞或视细胞前体细胞的程度的视网膜组织中,与形成了外界膜且存在视细胞、视细胞前体细胞的视细胞层(外颗粒层)相接的面。此外,这样的顶端面可以使用针对顶端面的标志物(例如:atypical
‑
pkc(以下简称为“apkc”)、e
‑
cadherin、n
‑
cadherin)的抗体,用本领域技术人员已知的免疫染色法等进行鉴定。
[0144]“连续上皮组织”指具有连续上皮结构的组织。连续上皮结构指上皮组织连续的状态。所谓上皮组织连续,例如,是沿相对于上皮组织的切线方向排列10个细胞~107个细胞,优选沿切线方向排列30个细胞~107个细胞,更优选排列102个细胞~107个细胞的状态。
[0145]
例如,对视网膜组织中形成的连续上皮结构而言,视网膜组织具有上皮组织特有的顶端面,顶端面与形成神经视网膜层的各层之中的至少视细胞层(外颗粒层)等大致平行地、且连续地形成于视网膜组织的表面。例如,从多能干细胞制作的包含视网膜组织的细胞聚集体的情况下,顶端面形成于聚集体的表面,视细胞或视细胞前体细胞相对于表面沿切线方向有规律地连续排列10个细胞以上、优选30个细胞以上、更优选100个细胞以上、进一步优选400个细胞以上。
[0146]
所谓“水凝胶”,是将水等液体摄入至交联成三维网状结构的高分子的内部而成的。作为形成水凝胶的高分子,例如,可举出明胶、胶原蛋白、果胶、透明质酸、海藻酸等。后文描述了本说明书中的“水凝胶”的具体物性等。
[0147]
〔复合体〕
[0148]
本发明的一个方式为包含神经视网膜、视网膜色素上皮细胞片和水凝胶的复合体。
[0149]
本发明所涉及的复合体中,神经视网膜和视网膜色素上皮细胞片来源于人多能干细胞。本发明所涉及的复合体中,神经视网膜和视网膜色素上皮细胞片分别来源于人多能干细胞。神经视网膜中形成有至少包含视细胞层的神经视网膜层,视细胞层至少包含选自由视细胞、视细胞前体细胞和视网膜前体细胞组成的组中的1种以上的细胞。视网膜色素上皮细胞片具有视网膜色素上皮细胞以多边形或鹅卵石状的细胞形态形成的片状结构。神经视网膜和视网膜色素上皮细胞片的整体均包埋于水凝胶中,神经视网膜和视网膜色素上皮细胞片各自的表面的切线方向大致平行,神经视网膜的顶端面与视网膜色素上皮细胞的顶端面相对,二者被水凝胶隔离而不接触。
[0150]
<神经视网膜的制造>
[0151]
神经视网膜来源于多能干细胞,具体而言可通过分化诱导多能干细胞获得。分化诱导可举出wo2011/055855、wo2013/077425、wo2015/025967、wo2016/063985、wo2016/063986、wo2017/183732、plos one.2010jan 20;5(1):e8763.,stem cells.2011 aug;29(8):1206
‑
18.,proc natl acad sci usa.2014 jun 10;111(23):8518
‑
23,nat commun.2014 jun 10;5:4047中公开的方法,没有特殊限制。
[0152]
神经视网膜可作为神经视网膜的细胞聚集体的形式进行制造。作为一个具体的方式,可以通过包括下述步骤(a)、(b)和(c)的方法来制备神经视网膜的细胞聚集体。
[0153]
步骤(a),将多能干细胞在不存在饲养细胞的条件下,在含有1)tgfβ家族信号转导通路抑制物质及/或音猬因子(sonic hedgehog)信号转导通路作用物质、以及2)未分化维持因子的培养基中进行培养;
[0154]
步骤(b),通过在无血清培养基中悬浮培养来使细胞聚集体形成;
[0155]
步骤(c),在含有bmp信号转导通路作用物质的培养基中,进一步悬浮培养步骤(b)中得到的细胞聚集体。
[0156]
本方法也公开于例如wo2016/063985、wo2017/183732中,更详细而言,可参见wo2016/063985、wo2017/183732。
[0157]
所谓tgfβ家族信号转导通路抑制物质,表示抑制tgfβ家族信号转导通路,即经由smad家族进行传递的信号转导通路的物质,具体可举出tgfβ信号转导通路抑制物质(例如:sb431542、ly
‑
364947、sb
‑
505124、a
‑
83
‑
01等)、nodal/活化素(activin)信号转导通路抑制物质(例如:sb431542、a
‑
83
‑
01等)和bmp信号转导通路抑制物质(例如:ldn193189、dorsomorphin等)。上述物质均有市售,是可以获得的。
[0158]
音猬因子(以下有时记作“shh”)信号转导通路作用物质指能够增强经由shh介导的信号转导的物质。作为shh信号转导通路作用物质,例如,可举出pma(purmorphamine)、sag(smoothened激动剂)等。
[0159]
tgfβ家族信号转导通路抑制物质和音猬因子信号转导通路作用物质的浓度只要是能诱导向视网膜谱系细胞的分化的浓度即可。例如,sb431542通常以0.1~200μm、优选2~50μm的浓度使用。a
‑
83
‑
01通常以0.05~50μm、优选0.5~5μm的浓度使用。ldn193189通常以1~2000nm、优选10~300nm的浓度使用。sag通常以1~2000nm、优选10~700nm的浓度使用。pma通常以0.002~20μm、优选0.02~2μm的浓度使用。
[0160]
在步骤(a)中的无饲养层条件下的多能干细胞的培养中,作为培养基可使用含有未分化维持因子的上述无饲养层培养基。
[0161]
在步骤(a)中的无饲养层条件下的多能干细胞培养中,为了向多能干细胞提供替代饲养细胞的支架,可使用合适的基质作为支架。作为能够用作支架的基质,可举出层粘连蛋白(nat biotechnol 28,611
‑
615,(2010))、层粘连蛋白片段(nat commun 3,1236,(2012))、基底膜标准品(nat biotechnol 19,971
‑
974,(2001))、明胶、胶原蛋白、硫酸乙酰肝素、蛋白聚糖、巢蛋白(entactin)、波连蛋白(vitronectin)等。
[0162]
对于步骤(a)中的多能干细胞的培养时间而言,在可以达成使步骤(b)中形成的细胞聚集体的品质提高的效果的范围内没有特殊限制,但通常为0.5~144小时。在一个方式中,优选为2~96小时、更优选为6~48小时、进一步优选为12~48小时、更进一步优选为18~28小时(例如,24小时)。
[0163]
对于无血清培养基的准备和细胞聚集体的形成而言,可以与上述同样地实施。
[0164]
在一个方式中,步骤(b)中使用的培养基含有音猬因子信号转导通路作用物质。作为音猬因子信号转导通路作用物质,可以以上述的浓度使用上述物质。音猬因子信号转导通路作用物质优选从开始悬浮培养时包含于培养基中。培养基中可添加rock抑制剂(例如y
‑
27632)。培养时间为例如12小时~6天。
[0165]
所谓bmp信号转导通路作用物质,是能够增强经由bmp介导的信号转导通路的物质。作为bmp信号转导通路作用物质,可举出例如bmp2、bmp4或bmp7等bmp蛋白、gdf7等gdf蛋白、抗bmp受体抗体、或者、bmp部分肽等。bmp2蛋白、bmp4蛋白和bmp7蛋白可自例如r&d systems公司获得,gdf7蛋白可自例如和光纯药获得。
[0166]
对于所使用的培养基而言,例如,可举出添加有bmp信号转导通路作用物质的无血清培养基或血清培养基(优选为无血清培养基)。无血清培养基、血清培养基可如上所述地准备。
[0167]
bmp信号转导通路作用物质的浓度只要是能诱导向视网膜谱系细胞的分化的浓度即可。例如在人bmp4蛋白的情况下,以成为约0.01nm~约1μm、优选约0.1nm~约100nm、更优选约1nm~约10nm、进一步优选约1.5nm(55ng/ml)的浓度的方式添加至培养基中。
[0168]
bmp信号转导通路作用物质可于步骤(a)的悬浮培养开始约24小时以后进行添加,也可于悬浮培养开始后数天以内(例如,15天以内)添加至培养基中。优选地,bmp信号转导通路作用物质于悬浮培养开始后第1天~第15天之间,更优选第1天~第9天之间,最优选于第3天添加至培养基中。
[0169]
作为具体的方式,例如,可以在步骤(b)的悬浮培养开始后第1~9天、优选第1~3天,将培养基的一部分或全部更换为含有bmp4的培养基,将bmp4的最终浓度制备为约1~10nm,在bmp4的存在下培养例如1~12天、优选2~9天、进一步优选2~5天。此处,为了将bmp4的浓度维持在相同浓度,可以将培养基的一部分或全部更换为含有bmp4的培养基1次或2次左右。或者可以阶段性减少bmp4的浓度。
[0170]
可以适当设定上述步骤(a)~步骤(c)中的培养温度、co2浓度等培养条件。培养温度为例如约30℃~约40℃,优选为约37℃。此外co2浓度为例如约1%~约10%,优选为约5%。
[0171]
通过改变上述步骤(c)中的培养时间,可以制造各种分化阶段的视网膜谱系细胞作为包含于神经视网膜的细胞聚集体中的视网膜谱系细胞。即,可以制造以各种比例包含未成熟的视网膜谱系细胞(例如:视网膜前体细胞、视细胞前体细胞)和成熟的视网膜谱系细胞(例如:视细胞)的、神经视网膜的细胞聚集体中的视网膜谱系细胞。通过延长步骤(c)的培养时间,可以增加成熟的视网膜谱系细胞的比例。
[0172]
上述步骤(b)及/或步骤(c)可使用wo2017/183732中公开的方法。即,在步骤(b)及/或步骤(c)中,可以在进一步含有wnt信号转导通路抑制物质的培养基中进行悬浮培养,形成神经视网膜的细胞聚集体。
[0173]
作为步骤(b)及/或步骤(c)中使用的wnt信号转导通路抑制物质,只要是能够抑制经由wnt介导的信号转导的物质即可,没有特殊限定,可以是蛋白质、核酸、小分子化合物等中的任何。经由wnt介导的信号是介由以frizzled(fz)和lrp5/6(low
‑
density lipoprotein receptor
‑
related protein 5/6,低密度脂蛋白受体相关蛋白5/6)的异源二聚体的形式存在的wnt受体转导的。作为wnt信号转导通路抑制物质,例如,可举出直接作用于wnt或wnt受体的物质(抗wnt中和抗体、抗wnt受体中和抗体等)、抑制编码wnt或wnt受体的基因的表达的物质(例如反义寡核苷酸、sirna等)、抑制wnt受体与wnt的结合的物质(可溶性wnt受体、显性负性wnt受体等、wnt拮抗剂、dkk1、cerberus蛋白等)、对起因于利用wnt受体的信号转导的生理活性进行抑制的物质{cki
‑
7(n
‑
(2
‑
氨基乙基)
‑5‑
氯异喹啉
‑8‑
磺酰胺)、d4476(4
‑
[4
‑
(2,3
‑
二氢
‑
1,4
‑
苯并二氧杂环己
‑6‑
基)
‑5‑
(2
‑
吡啶基)
‑
1h
‑
咪唑
‑2‑
基]苯甲酰胺)、iwr
‑1‑
endo(iwr1e)(4
‑
[(3ar,4s,7r,7as)
‑
1,3,3a,4,7,7a
‑
六氢
‑
1,3
‑
二氧代
‑
4,7
‑
甲桥
‑
2h
‑
异吲哚
‑2‑
基]
‑
n
‑8‑
喹啉基
‑
苯甲酰胺)、以及iwp
‑
2(n
‑
(6
‑
甲基
‑2‑
苯并噻唑基)
‑2‑
[(3,4,6,7
‑
四氢
‑4‑
氧代
‑3‑
苯基噻吩并[3,2
‑
d]嘧啶
‑2‑
基)硫代]乙酰胺)等小分子化合物等}等,但不限于这些。作为wnt信号转导通路抑制物质,可含有上述物质中的一种或两种以上。cki
‑
7、d4476、iwr
‑1‑
endo(iwr1e)、iwp
‑
2等是已知的wnt信号转导通路抑制物质,可适当获得市售品等。作为wnt信号转导通路抑制物质,优选使用iwr1e。
[0174]
步骤(b)中的wnt信号转导通路抑制物质的浓度只要是能诱导形成良好的细胞聚集体的浓度即可。例如iwr
‑1‑
endo的情况下,以成为约0.1μm至约100μm、优选约0.3μm至约30μm、更优选约1μm至约10μm、进一步优选约3μm的浓度的方式添加至培养基中。使用iwr
‑1‑
endo以外的wnt信号转导通路抑制物质的情况下,期望以显示与上述iwr
‑1‑
endo的浓度同等的wnt信号转导通路抑制活性的浓度使用。
[0175]
步骤(b)中,向培养基中添加wnt信号转导通路抑制物质的时机优选为较早。对于wnt信号转导通路抑制物质而言,可从步骤(b)中的悬浮培养开始起通常6天以内、优选3天以内、更优选1天以内、更优选12小时以内、进一步优选于步骤(b)中的悬浮培养开始时添加至培养基中。具体而言,例如,可以实施添加有wnt信号转导通路抑制物质的基础培养基的添加、更换该基础培养基的一部分或全部培养基。步骤(b)中使wnt信号转导通路抑制物质作用于步骤(a)中得到的细胞的时间没有特殊限制,但优选是使其在步骤(b)中的悬浮培养开始时向培养基添加后,作用至步骤(b)结束时(即将添加bmp信号转导通路作用物质之前)。进一步优选的是,如后文所述,在步骤(b)结束后(即步骤(c)期间)也继续暴露于wnt信号转导通路抑制物质中。作为一个方式,如后文所述,可以在步骤(b)结束后(即步骤(c)期间)也继续使wnt信号转导通路抑制物质发挥作用,使其作用至视网膜组织形成为止。
[0176]
步骤(c)中,作为wnt信号转导通路抑制物质,可以使用上述wnt信号转导通路抑制物质中的任一者,优选在步骤(c)中使用与步骤(b)中使用的wnt信号转导通路抑制物质相同种类的物质。
[0177]
步骤(c)中的wnt信号转导通路抑制物质的浓度只要是能诱导视网膜前体细胞和视网膜组织的浓度即可。例如iwr
‑1‑
endo的情况下,以成为约0.1μm至约100μm、优选约0.3μm至约30μm、更优选约1μm至约10μm、进一步优选约3μm的浓度的方式添加至培养基中。使用iwr
‑1‑
endo以外的wnt信号转导通路抑制物质的情况下,期望以显示与上述iwr
‑1‑
endo的浓度同等的wnt信号转导通路抑制活性的浓度使用。以步骤(b)的培养基中的wnt信号转导通路抑制物质的浓度为100时,步骤(c)的培养基中的wnt信号转导通路抑制物质的浓度优选为50~150,更优选为80~120、进一步优选为90~110,与第二步骤的培养基中的wnt信号转导通路抑制物质的浓度同等的情况是更优选的。
[0178]
对于wnt信号转导通路抑制物质向培养基添加的时间而言,在能够达成包含视网膜谱系细胞或视网膜组织的聚集体形成的范围内没有特殊限制,但越早越好。优选的是,在步骤(c)开始时向培养基中添加wnt信号转导通路抑制物质。更优选的是,步骤(b)中添加wnt信号转导通路抑制物质之后,步骤(c)中仍继续(即,从步骤(b)开始时起)包含于培养基中。进一步优选的是,在步骤(b)的悬浮培养开始时添加wnt信号转导通路抑制物质之后,步骤(c)中仍继续包含于培养基中。例如,可以将bmp信号转导作用物质(例如,bmp4)添加至步骤(b)中得到的培养物(含有wnt信号转导通路抑制物质的培养基中的聚集体的悬浮液)中。
[0179]
使wnt信号转导通路抑制物质作用的时间没有特殊限制,优选的是,在步骤(b)中的悬浮培养开始时添加wnt信号转导通路抑制物质的情况下,将步骤(b)中的悬浮培养开始时作为起算点,为2天至30天,更优选为6天至20天、8天至18天、10天至18天、或10天至17天(例如,10天)。在其他方式中,对于使wnt信号转导通路抑制物质作用的时间而言,在步骤(b)中的悬浮培养开始时添加wnt信号转导通路抑制物质的情况下,将步骤(b)中的悬浮培养开始时作为起算点,优选为3天至15天(例如,5天、6天、7天),更优选为6天至10天(例如,6天)。
[0180]
通过将上述方法中得到的神经视网膜的细胞聚集体在含有wnt信号转导通路作用物质、及/或、fgf信号转导通路抑制物质的无血清培养基或血清培养基中培养3天至6天左
右的时间(步骤(d)),然后在不含wnt信号转导通路作用物质和fgf信号转导通路抑制物质的无血清培养基或血清培养基中培养30天~60天左右(步骤(e)),也可以制造包含睫状边缘带样结构体的神经视网膜。
[0181]
作为一个方式,可以从下述神经视网膜的细胞聚集体通过上述步骤(d)和步骤(e)来制造包含睫状边缘带样结构体的神经视网膜,所述神经视网膜的细胞聚集体为从步骤(a)~(c)中得到的、步骤(b)的悬浮培养开始后第6~30天、第10~20天(第10天、第11天、第12天、第13天、第14天、第15天、第16天、第17天、第18天、第19天或第20天)的神经视网膜的细胞聚集体。
[0182]
作为wnt信号转导通路作用物质,只要是能够增强经由wnt介导的信号转导的物质即可,没有特殊限制。作为具体的wnt信号转导通路作用物质,例如,可举出gsk3β抑制剂(例如,6
‑
bromoindirubin
‑3’‑
oxime(bio)、chir99021、kenpaullone)。例如chir99021的情况下,可举出约0.1μm~约100μm、优选约1μm~约30μm的范围。
[0183]
作为fgf信号转导通路抑制物质,只要是能够抑制经由fgf介导的信号转导的物质即可,没有特殊限制。作为fgf信号转导通路抑制物质,例如,可举出su
‑
5402、azd4547、bgj398等。例如su
‑
5402的情况下,以约0.1μm~约100μm、优选约1μm~约30μm、更优选约5μm的浓度添加。
[0184]
上述步骤(e)中的一部分或全部步骤可使用wo2019/017492中公开的连续上皮组织维持用培养基进行培养。即,通过使用连续上皮组织维持用培养基进行培养,可以维持神经视网膜的连续上皮结构。作为一个实例,可举出neurobasal培养基(例如:thermo fisher scientific公司制、21103049)中配合有b27补充剂(例如:thermo fisher scientific、12587010)的培养基作为连续上皮组织维持用培养基。
[0185]
上述步骤(e)中的一部分或全部的步骤中,在使用细胞增殖用基础培养基、连续上皮组织维持用培养基或它们的混合培养基中的任何培养基的情况下,均可进一步含有甲状腺激素信号转导通路作用物质。通过在含有甲状腺激素信号转导通路作用物质的培养基中进行培养,从而能够制造包含神经视网膜中所含的双极细胞、无长突细胞、神经节细胞或水平细胞等的比例低、且视细胞前体细胞的比例增大的神经视网膜的细胞聚集体。
[0186]
在本说明书中,所谓甲状腺激素信号转导通路作用物质,是能够增强经由甲状腺激素介导的信号转导的物质,只要是能够增强甲状腺激素信号转导通路的物质即可,没有特殊限定。作为甲状腺激素信号转导通路作用物质,例如,可举出三碘甲状腺原氨酸(以下有时简称t3)、甲状腺素(以下有时简称t4)、甲状腺激素受体(优选为trβ受体)激动剂等。
[0187]
使用t3作为甲状腺激素信号转导通路作用物质的情况下,例如,可以成为0.1~1000nm的范围的方式添加至培养基中。可举出具有与优选1~500nm;更优选10~100nm;进一步优选30~90nm;更优选60nm左右的浓度的t3相当的甲状腺激素信号转导亢进活性的浓度。使用t4作为甲状腺激素信号转导通路作用物质的情况下,例如,可以成为1nm~500μm的范围的方式添加至培养基中。优选为50nm~50μm;更优选为500nm~5μm的范围。使用其他甲状腺激素受体激动剂的情况下,只要是显示出与上述浓度的t3或t4所示出的激动剂活性相同程度的活性的浓度即可。
[0188]
步骤(e)中使用的培养基可适当含有l
‑
谷氨酰胺、牛磺酸、血清等。在一个实例中,步骤(e)中使用的培养基为未添加选自由bmp信号转导通路作用物质、fgf信号转导通路抑
制物质、wnt信号转导通路作用物质、wnt信号转导通路抑制物质、shh信号转导通路作用物质、tgfβ家族信号转导通路抑制物质和tgfβ家族信号转导通路作用物质组成的组中的1种以上(优选全部)的培养基。
[0189]
通过上述方法,可以制造神经视网膜的细胞聚集体,但不限于这些。
[0190]
本发明所涉及的神经视网膜包含神经视网膜层,所述神经视网膜层包含视细胞层和内层,视细胞层中包含选自由视细胞前体细胞及视细胞组成的组中的1种以上的细胞,且具有上皮组织的结构,具有顶端面和基底。上皮组织的结构为连续上皮结构是优选的。
[0191]
在一个方式中,本发明所涉及的神经视网膜可以通过使用镊子、刀、剪刀等从神经视网膜的细胞聚集体中切出来获得。可以通过从球状的神经视网膜的细胞聚集体中切出来获得神经视网膜片。神经视网膜片意指维持了上述神经视网膜层的层结构的复层片状结构体。
[0192]
在一个方式中,本发明所涉及的神经视网膜可以是从分化诱导人多能干细胞而得的细胞聚集体得到的神经视网膜。上述细胞聚集体至少包含第一上皮组织和第二上皮组织,第一上皮组织包含人神经视网膜,第二上皮组织具有与第一上皮组织的表面中的切线斜率的连续性不同的表面的切线斜率的连续性,且可以包含视网膜谱系细胞以外的细胞及/或视网膜色素上皮细胞。第二上皮组织中包含的视网膜谱系细胞以外的细胞可举出眼球相关组织及脑脊髓组织的细胞,作为眼球相关组织,可举出视网膜色素上皮细胞及睫状体边缘带结构体。本发明所涉及的神经视网膜可以通过目视,以不含第二上皮组织的方式从该聚集体切出神经视网膜而获得。本发明所涉及的神经视网膜可以包含上述细胞聚集体中的、距离第二上皮组织最远的第一上皮组织上的区域,特别是第一上皮组织的中心附近的区域。在一个方式中,本发明所涉及的神经视网膜可包含连续上皮组织的中心附近的区域。
[0193]
在一个方式中,本发明所涉及的神经视网膜的特征如下:
[0194]
(1)来源于多能干细胞,
[0195]
(2)具有三维结构,
[0196]
(3)包含神经视网膜层,所述神经视网膜层具有包含视细胞层和内层的多层结构,
[0197]
(4)视细胞层包含选自由视细胞前体细胞及视细胞组成的组中的1种以上的细胞,
[0198]
(5)内层包含选自由视网膜前体细胞、神经节细胞、无长突细胞及双极细胞组成的组中的1种以上的细胞,
[0199]
(6)神经视网膜层的表面具有顶端面,
[0200]
(7)内层存在于沿着顶端面存在的视细胞层的内侧,
[0201]
(8)相对于神经视网膜的表面的总面积而言,神经视网膜层的面积为50%以上,
[0202]
(9)相对于神经视网膜层的顶端面的总面积而言,连续上皮结构的面积为80%以上。
[0203]
对于该神经视网膜而言,(3)包含神经视网膜层,所述神经视网膜层具有包含视细胞层和内层的多层结构。如(6)和(7)所记载的,视细胞层存在于该神经视网膜的外侧(表面),在内层也可存在异位性视细胞层。
[0204]
对于该神经视网膜而言,(5)内层包含选自由视网膜前体细胞、神经节细胞、无长突细胞及双极细胞组成的组中的1种以上的细胞,也可包含选自由异位性的视细胞前体细
胞及视细胞组成的组中的1种以上的细胞。在一个方式中,还提供:神经节细胞、无长突细胞、水平细胞的含有率为总细胞数的30%以下的神经视网膜,神经节细胞、无长突细胞、水平细胞及双极细胞的含有率为总细胞数的30%以下的神经视网膜,及/或双极性细胞的含有率为总细胞数的10%以下的神经视网膜。
[0205]
对于该神经视网膜而言,(8)相对于神经视网膜的表面的总面积而言,神经视网膜层的面积为40%以上,优选为50%以上,更优选为60%以上。对于该神经视网膜而言,(9)相对于神经视网膜层的顶端面的总面积而言,连续上皮结构的面积为60%以上,优选为70%以上,更优选为80%以上。
[0206]
在一个方式中,本发明所涉及的神经视网膜的长径可为例如300μm~3300μm,优选为600μm~2500μm,更优选为1100μm~1700μm。
[0207]
在一个方式中,本发明所涉及的神经视网膜的短径可为例如100μm~2000μm,优选为200μm~1500μm,更优选为400μm~1100μm。
[0208]
在一个方式中,本发明所涉及的神经视网膜的高度可为例如50μm~1500μm,优选为100μm~1000μm,更优选为200μm~700μm。
[0209]
在一个方式中,本发明所涉及的神经视网膜的体积可为例如0.001mm3~4.0mm3,优选为0.01mm3~1.5mm3,更优选为0.07mm3~0.57mm3。
[0210]
测定神经视网膜的长径、短径和高度的方法没有特殊限定,例如,根据显微镜下拍摄的图像进行测定即可。例如,对于从细胞聚集体中切出的神经视网膜,可以用实体显微镜拍摄在将切割面朝向物镜侧的状态下拍摄的正面图像、和切割面以从物镜观察成为垂直的倾斜状态下拍摄的侧面图像,根据拍摄的图像进行测定。此处,长径意指正面图像中,连接该片截面上的2个端点的线段之中最长的线段及其长度。短径意指正面图像中,作为连接该片截面上的2个端点的线段、且与长径正交的线段之中最长的线段及其长度。高度意指作为与该片截面正交的线段、且以与该片截面的交点和视网膜片的顶点为端点的线段之中最长的线段及其长度。该片的体积意指将神经视网膜估为以截面穿过长径的方式对半切割的椭圆体后、根据以下算式计算出的体积。
[0211]
体积=2/3
×
圆周率(π)
×
(长径/2)
×
(短径/2)
×
高度
[0212]
<视网膜色素上皮细胞片的制造>
[0213]
视网膜色素上皮(rpe)细胞来源于多能干细胞,具体而言可通过分化诱导多能干细胞来获得。制造视网膜色素上皮细胞的方法可举出wo2005/070011、wo2006/080952、wo2011/063005、wo2012/173207号、wo2015/053375号、wo2015/053376号、wo2015/068505号、wo2017/043605、stem cell reports,2(2),205
‑
218(2014)和cell stem cell,10(6),771
‑
785(2012)中公开的方法,没有特殊限制。此外,可以通过改良上述wo2016/063985中记载的方法来制备视网膜色素上皮(rpe)细胞片。视网膜色素上皮细胞可以作为细胞片或球状细胞聚集体的形式来制造。作为球状细胞聚集体来制造时,例如,可以通过使用镊子、刀、剪刀等切开细胞聚集体来制备rpe细胞片。
[0214]
作为wo2016/063985中记载的方法的改良方法,上述方法中,将多能干细胞在不存在饲养细胞的条件下,1)在分化诱导一天前用tgfβ家族信号转导通路抑制物质和音猬因子信号转导通路作用物质进行处理,2)在分化诱导开始时以不进行音猬因子信号转导通路作用物质处理的条件来培养。之后,实施上述步骤(b)和(c)。另外,优选将上述步骤(d)的开始
时期提前。具体而言,在步骤(b)的悬浮培养开始9天前后(例如:7天、8天、9天、10天、11天后),开始步骤(d)。之后,实施上述步骤(e)即可。通过本方法,可获得球状的rpe细胞的细胞聚集体。可以使该细胞聚集体分散而成为细胞悬浮液,也可以通过使用镊子、刀、剪刀等切开细胞聚集体来制备rpe细胞片。通过将分散而得的细胞悬浮液以贴壁培养的方式进行培养,也可以制备rpe细胞片。
[0215]
对于视网膜色素上皮细胞片而言,在与神经视网膜的细胞聚集体接触前,可以进一步培养直至具有多边形或鹅卵石状的细胞形态。此时的培养基没有特殊限制,也可以更换为视网膜色素上皮细胞的维持培养基(以下有时也记载为rpe维持培养基),进一步培养。基于此,还可以清楚地观察黑色素沉积细胞群、粘附于基底膜上的具有多边扁平状形态的细胞群。对于基于rpe维持培养基的培养而言,只要形成视网膜色素上皮细胞的集落即可,没有限定,例如在以3天1次以上的频率实施总量培养基更换的同时,培养5~20天左右。本领域技术人员可以一边确认该形态,一边容易地设定培养时间。视网膜色素上皮细胞的维持培养基可以使用例如iovs,march2004,vol.45,no.3,masatoshiharuta等,iovs,november 2011,vol.52,no.12,okamoto等,cell science122(17)、fumitaka osakadar等,ebruary 2008,vol.49,no.2,gamm等中记载的培养基。
[0216]
在一个方式中,视网膜色素上皮细胞片的长径可为例如3mm~50mm、5mm~30mm、10mm~20mm等范围。
[0217]
在一个方式中,视网膜色素上皮细胞片的短径可为例如2mm~40mm、5mm~30mm、10mm~20mm等范围。
[0218]
视网膜色素上皮细胞片的黑色素沉积的程度没有特殊限制。视网膜色素上皮细胞片中所含的视网膜色素上皮细胞中的黑色素沉积的程度优选在细胞之间为相同程度。作为一个方式,视网膜色素上皮细胞片的平均黑色素含量可以是小于20pg/个细胞、小于15pg/个细胞、小于10pg/个细胞、小于8pg/个细胞、小于7pg/个细胞、小于6pg/个细胞、小于5pg/个细胞、小于4pg/个细胞、小于3pg/个细胞、小于2pg/个细胞、小于1pg/个细胞。此外,视网膜色素上皮细胞片的平均黑色素含量也可以是0.1pg/个细胞以上、0.5pg/个细胞以上、1pg/个细胞以上、2pg/个细胞以上、5pg/个细胞以上。
[0219]
对于视网膜色素上皮细胞片中的黑色素含量而言,例如,可以在使视网膜色素上皮细胞片分散后,使用用naoh等提取的细胞提取物,使用分光光度计等进行测定。平均黑色素含量可以通过将黑色素含量除以视网膜色素上皮细胞片中包含的总细胞数来求出。
[0220]
<水凝胶>
[0221]
本发明中的水凝胶只要能够将细胞以存活的状态进行包埋即可,例如,可以是明胶的水凝胶、胶原蛋白的水凝胶、果胶的水凝胶、透明质酸的水凝胶、海藻酸的水凝胶,优选为明胶的水凝胶。上述水凝胶由于具有生物分解性和期望的熔点,因此易于操作且可以期待高植入率。生物分解性意指被生物体内的酶等分解从而得到吸收或排泄。本发明中的水凝胶为熔点在20℃~40℃的范围的水凝胶。即,具有在移植时于体温融化的特征。下面以“明胶”为例,详细地记载其物性。对于明胶以外的水凝胶,与后述的明胶具有同样的物性的水凝胶是优选的。
[0222]
所谓“明胶”,是将水不溶性胶原蛋白通过例如酸或碱进行前处理,并通过热水解等进行可溶化而得的。在本说明书中,如果没有特殊记载,则意指水凝胶的状态的明胶,但
有时也明确记载为“明胶的水凝胶”。通过加热使得胶原蛋白的3链螺旋的分子结构破坏而分成随机的3条分子,由此进行可溶化。作为明胶的原材料,主要使用牛骨和牛皮、猪皮、猪骨、鱼鳞等。为了从上述胶原蛋白原材料中提取明胶,使用盐酸、硫酸等无机酸或石灰,实施原料的前处理。根据原料的前处理条件,有时也将前者称为酸处理明胶(或a型明胶),将后者称为碱处理(石灰处理)明胶(b型明胶)。对酸处理明胶与碱处理明胶而言,明胶的性质不同。此外,通过加热处理进行水解,明胶的分子量减小,溶解度提高,在相同条件下凝胶强度降低。例如,也可以通过温水(50℃~80℃)进行加热处理,可以重复进行多次。也可以获得市售的明胶,例如,可举出明胶ls
‑
h(新田明胶(株)、猪皮碱处理明胶、非加热处理明胶、高凝胶强度)明胶ls
‑
w(新田明胶(株)、猪皮碱处理明胶、加热处理明胶、低凝胶强度)。碱处理(石灰处理)明胶(b型明胶)是优选的,加热处理明胶是优选的。
[0223]
胶原蛋白是由具有约10万分子量的3条多肽链(α链)构成的。胶原蛋白分子经加热处理变性后,分成3条α链(α成分)。此外还可能生成α链的2聚体(β成分:约20万的分子量)和3聚体(γ成分:约30万的分子量)。此外,由于胶原蛋白、明胶的分子间键或分子内键合的一部分也被明胶的处理步骤随机切断,因此明胶是具有各种分子量的分子的集合体。虽然根据有无加热处理而不同,但市售明胶通常具有数万~数百万的分子量分布。作为一个方式,对于明胶而言,50%以上(优选为60%以上、70%以上、80%以上、90%以上)包含于约10万~约30万的范围内的分子量分布是优选的。此外,明胶的优选的平均分子量为约5万~约100万、约10万~约80万、约10万~约60万、约20万~约50万、约30万~约50万的范围。
[0224]
需要说明的是,分子量分布和平均分子量可以通过本领域技术人员普遍已知的方法进行测定。例如,可以使用高效液相色谱,通过凝胶过滤法求出明胶水溶液的色谱图来推定分子量分布,进而通过普鲁兰多糖(pullulan)换算等来推定平均分子量。
[0225]“等离子点”意指蛋白质、或两性电解质的水溶液在不与其他离子共存的状态(不包括水电离生成的氢离子、氢氧化物离子、成为对象的两性电解质本身的离子)下示出的ph。等离子点可以通过本领域技术人员普遍已知的方法进行测定。作为具体例,可以利用ph计测定经离子更换树脂脱盐而得的试验液(明胶水溶液)的氢离子浓度。例如,在明胶的制造步骤中实施碱处理后,由于大部分被脱酰胺化,因此等离子点低至约ph5。与之相对,对于酸处理明胶而言,脱酰胺率低,示出与胶原蛋白接近的ph7~9的等离子点。明胶水溶液在低于等离子点的ph侧带 电(正电),在高ph侧带
‑
电(负电)。对于本说明书中的水凝胶(明胶等)而言,优选示出约ph4~约ph7、约ph5~约ph7、约ph6~约ph7的等离子点。
[0226]
对于含有明胶的水凝胶而言,由于加热或冷却使得溶液从凝胶相变为溶胶,从溶胶相变为凝胶。明胶等水凝胶通过冷却而丧失流动性来进行凝胶(胶质)化,通过加热获得流动性而进行溶胶(水溶液)化。以明胶为例,明胶发生胶质化是因为冷却使得明胶分子的一部分成为与胶原蛋白同样的螺旋结构从而在分子间形成网络。此处,“熔点”意指在一定压力下发生溶胶化的温度。“凝固点”意指在一定压力下发生凝胶化的温度。如上所述,继续冷却将形成更坚固的凝胶。对于本说明书中的水凝胶而言,熔点为20℃~40℃(例如:20℃~35℃、25℃~35℃、30℃~40℃、35℃~40℃)。一般而言,凝胶的熔点是网络强度的衡量标准,随着水凝胶的浓度和分子量的升高,水凝胶(例如:明胶)的熔点升高。此外,例如,利用糖类增加固体成分时,则熔点和凝固点呈升高的倾向。如此可以使熔点和凝固点在一定范围内发生变化。
[0227]
水凝胶的熔点的测定方法没有特殊限定,例如,可以通过jis k6503规定的方法进行测定。具体而言,可将下述温度作为熔点:用试验液(例如:10w/w%浓度的明胶溶液)在直径10mm的玻璃管中制成自末端5mm的位置起45mm高度的凝胶,以末端5mm朝下的方式放入水槽中并升温时,凝胶融化使得末端的气泡的上端升高了10mm的温度。
[0228]
水凝胶的凝固点的测定方法没有特殊限定,例如,可以通过jis k6503规定的方法进行测定。具体而言,可将下述温度作为凝固点:将35℃的试验液(例如:10w/w%浓度的明胶溶液)在装有35℃缓冲浴的15℃水槽中一边搅拌一边使其缓慢冷却,可以将观察到返回现象(日文:戻
り
現象)(搅拌溶液时产生的气泡等在停止搅拌时,没有因惯性向搅拌方向移动,而是被拉回相反方向的现象)时的温度。为了使返回现象易于确认,可以向试验液中放入滤纸片等。
[0229]
水凝胶的“凝胶强度”意指形成了凝胶的物体的机械强度。通常以使一定形状的凝胶发生变形所需的力或使凝胶断裂所需的力(单位:g、dyne(s)/cm2或g/cm2)来表现,主要是凝胶的硬度的衡量标准。需要说明的是,1达因(dyne(s))被定义为作用于质量为1克(g)的物体时,在其方向上给予1厘米每平方秒(cm/s2)的加速度的力。例如含有明胶的水凝胶的凝胶强度根据其浓度、温度、ph和共存物质等而变动,在同一条件下依赖于分子量等固有性质而变化。明胶的“凝胶强度”例如以日本药典药食发(日文:薬食発)0531第3号、jis k6503规定的方法进行试验。具体而言,将下述参数作为凝胶强度:对将明胶溶液在10℃冷却17小时制备而得的胶质的表面用2分之1英寸(12.7mm)直径的柱塞压下4mm所必需的负荷。通常,伴随明胶浓度增加,凝胶强度也增加。此外,通常,酸性ph(例如:ph4以下)和碱性ph(例如:ph8以上)下,明胶的凝胶强度大幅降低。此外,在一定范围(例如:分子量3万~7万)内,分子量越高,则凝胶强度越高,但达到一定程度以上(例如:分子量10万以上)后,凝胶强度变得恒定。此外,通常,对于凝胶化而言,需要于20℃以下冷却,在例如4℃~20℃左右的冷却温度的范围中,冷却温度越低,则凝胶强度越高。由于分子的取向、网络形成的反应是以较慢的速度进行的,因此在其内部,凝胶形成后分子间网络仍在形成,因而冷却开始后凝胶强度经1~5小时左右而升高。此外,急速冷却的情况下,凝胶凝胶强度进一步升高。这是因为分子进行取向的时间不充裕,分子间细密地形成网络。
[0230]
在本说明书中,只要是例如在10℃~20℃不会影响所包埋的细胞、组织的范围、且在复合体的通常的移植操作等中水凝胶不崩解的程度的凝胶强度即可。对于凝胶强度而言,5重量%~30重量%左右的水凝胶(明胶)中,例如,水凝胶(明胶)的凝胶强度可以是在jis k6503规定的方法中为50g以上、100g以上、200g以上、500g以上、1000g以上、1200g以上、1300g以上、1400g以上或1500g以上。此外,水凝胶(明胶)的凝胶强度可以是3000g以下、2500g以下或2000g以下。
[0231]
所谓“粘度”,是表示流体的粘性的强度的指标。本领域技术人员可以通过普遍已知的方法测定粘度。例如,可以通过jis k6503规定的方法进行测定。即,可以将一定量的明胶溶液(60℃、6.67%)流下移液管(粘度计)型粘度计的时间换算为粘度值(单位:mpa
·
s)。
[0232]
含有明胶的水凝胶的溶胶状态时的粘度受明胶等的浓度、体系的温度、ph、共存盐类等影响。一般而言,伴随明胶等的浓度的升高、温度的降低,粘度升高。例如,对于b型明胶而言,粘度是ph依赖性的,粘度在等离子点的ph附近成为最小。另一方面,在a型明胶中,未观察到粘度与ph有显著的关系。
[0233]
含有明胶的水凝胶的粘度只要是能够形成后述的复合体的程度的粘度即可,没有特别限定。为了包埋活的细胞,考虑到对细胞的伤害,需要使用约40℃(约30℃~约50℃左右)的水凝胶来包埋细胞。因此,可举出在约40℃(30℃~50℃左右)显示出包埋细胞所需程度的粘度、例如2~50mpa
·
s(5~30mpa
·
s)左右的粘度。
[0234]“起泡率”意指包含气泡在内的总体积(v1)相对于检体的初始体积(v0)的比例(v1/v0)。起泡率低是优选的。具体而言,为1.2以下(优选1.15以下、1.1以下、1.05以下)。起泡率可以通过例如作为照片用明胶试验法的pagi法第10版(2006年版)来测定。具体而言,将放入量筒中的50℃试验液50ml以振幅300mm、振动数145次/分钟振动1分钟后,读取振动停止起3分钟后包含气泡在内的总体积即可。
[0235]
对于本说明书中记载的水凝胶而言,由于是通过移植施予至生物体内,因此优选符合日本药典规定的纯度试验的基准。例如,日本药典中规定了明胶和纯化明胶的品质规格与试验方法,具体而言满足下述基准。
[0236]
(1)异臭和不溶物向本品1.0g中加入水40ml,加热溶解时,液体没有难闻气味。此外,该液体为澄清,或即使有浑浊也较少,其颜色不浓于比较液a。
[0237]
(2)亚硫酸盐60ppm以下
[0238]
(3)重金属50ppm以下(20ppm以下)
[0239]
(4)砷1ppm以下
[0240]
(5)汞0.1ppm以下
[0241]
(6)干燥减量15.0%以下
[0242]
(7)燃余残留(ignition residue)2.0%以下
[0243]
从防止由各种操作造成的崩解、操作中的溶解等的观点来看,水凝胶的浓度高是优选的。水凝胶的浓度是相对于使水凝胶溶解的介质(溶剂)的水凝胶的比例。对于水凝胶的浓度而言,例如,在使用明胶的情况下,可以是10重量%~50重量%,优选为25重量%~50重量%、30重量%~50重量%、或20重量%~40重量%。
[0244]
对于以水凝胶的浓度成为上述范围的方式计量的水凝胶,利用合适的介质使其溶解即可。介质只要是不影响细胞的介质即可,例如,可举出hbss等缓冲盐溶液等。
[0245]
对于水凝胶的ph而言,基于减轻对包埋的组织、移植后的生物体的伤害的目的,中性附近是优选的。例如可以是6~8或6.5~7.5,优选为7~7.5。水凝胶的ph可以作为溶液或溶胶状态时的ph进行测定。如上所述,如果在该ph范围,凝胶强度不会大幅降低。水凝胶的ph的测定方法没有特殊限定,例如,可以通过市售的ph计、ph试纸来测定。
[0246]
在一个方式中,水凝胶优选是具有生物分解性水凝胶。优选的是,将复合体向人移植后,通过生物分解性水凝胶的生物分解,被移植的神经视网膜与视网膜色素上皮细胞片逐渐接触,成熟后与生物体视网膜同样,视细胞的外节与视网膜色素上皮细胞片接触。此外,即使不接触,移植的视网膜色素上皮细胞片只要具有如下的功能即可:抑制新生血管渗出、及/或能够进行类视黄醇循环、外节的吞噬、营养等的供给。通过处理作为主要的生物体构成成分的胶原蛋白而得到的明胶是具有生物分解性的水凝胶。
[0247]
在一个方式中,本说明书中的水凝胶优选具有20℃~40℃的范围的熔点、且满足下述物性中的1个以上的水凝胶。
[0248]
(1)制备方法:碱处理及/或加热处理
[0249]
(2)平均分子量:约10万~约50万
[0250]
(3)浓度:10重量%~50重量%(优选25重量%~50重量%、30重量%~50重量%、或20重量%~40重量%)
[0251]
(4)凝胶强度:50g以上、100g以上、200g以上、500g以上、1000g以上、1200g以上、1300g以上、1400g以上或1500g以上(3000g以下、2500g以下或2000g以下)
[0252]
(5)ph:6~8(优选6.5~7.5、7~7.5)
[0253]
(6)等离子点:酸性范围(约ph4~约ph7、约ph5~约ph7、约ph6~约ph7)
[0254]
(7)起泡率:1.2以下(优选1.15以下、1.1以下、1.05以下)
[0255]
(8)粘度:约40℃(30℃~50℃左右)中,约5~30mpa
·
s。
[0256]
<复合体的结构>
[0257]
在一个方式中,本发明所涉及的复合体中,水凝胶包埋神经视网膜和视网膜色素上皮细胞片的整体。“包埋”意指细胞等以埋入水凝胶的状态被覆盖。所谓包埋神经视网膜和视网膜色素上皮细胞片,例如,可以是水凝胶存在于神经视网膜与视网膜色素上皮细胞片之间及它们的周围的状态。需要说明的是,在本技术中,特别是由于预定使用分别制造或分离的神经视网膜和视网膜色素上皮细胞片,因此视网膜色素上皮细胞与神经视网膜层并未一起构成连续的上皮结构。
[0258]
复合体中,水凝胶可具有单层结构,也可具有二层以上的结构。在一个方式中,复合体可具备仅包埋视网膜色素上皮细胞片的第一水凝胶层、和包埋第一水凝胶层及神经视网膜的第二水凝胶层。在其他方式中,复合体可具备仅包埋神经视网膜的第一水凝胶层、和包埋第一水凝胶层及视网膜色素上皮细胞片的第二水凝胶层。
[0259]
本发明所涉及的复合体中,神经视网膜和视网膜色素上皮细胞片各自的切线方向大致平行。“切线方向大致平行”意指神经视网膜与视网膜色素上皮细胞片的相对面的切线方向平行。此外,本发明所涉及的复合体中,神经视网膜的顶端面与视网膜色素上皮细胞的顶端面是相对的。即,神经视网膜的顶端面与视网膜色素上皮细胞的顶端面以接近的状态存在。
[0260]
在一个方式中,复合体中的神经视网膜和视网膜色素上皮细胞片被水凝胶隔离而不接触。因而可以减小由于神经视网膜与视网膜色素上皮细胞片机械性接触造成的细胞伤害。需要说明的是,“神经视网膜与视网膜色素上皮细胞片不接触”意指神经视网膜与视网膜色素上皮细胞片不以物理方式相接。可以通过例如目视(例如:显微镜下)来确认通过水凝胶使神经视网膜与视网膜色素上皮细胞片不接触。
[0261]
本发明所涉及的复合体中,作为包埋于水凝胶中的神经视网膜,可以是单一的连续神经视网膜,也可以是多个连续的神经视网膜。由于可以通过1个复合体治疗更大范围的视网膜组织的障碍状态或视网膜组织的损伤状态,因此包埋多个神经视网膜是优选的。在此情况下,多个神经视网膜各自的顶端面朝向相同方向排列成一列是优选的。此外,包埋于水凝胶中的视网膜色素上皮细胞片可以是单一的连续的片状视网膜色素上皮组织,也可以是多个连续的片状视网膜色素上皮组织。多个视网膜色素上皮组织包埋于水凝胶的情况下,各自视网膜色素上皮组织的顶端面朝向相同方向排列成一列是优选的。
[0262]
〔复合体的制造方法〕
[0263]
本发明的一个方式为含有神经视网膜、视网膜色素上皮细胞片和水凝胶的复合体
的制造方法。本发明所涉及的制造方法中,所制造的复合体,以及复合体中所含的神经视网膜、视网膜色素上皮细胞片和水凝胶可以适用与上述复合体中的说明同样的形式。
[0264]
本发明所涉及的制造方法中,神经视网膜和视网膜色素上皮细胞片来源于人多能干细胞。水凝胶的熔点为20℃~40℃,可以使用例如上述的水凝胶。优选地,水凝胶为明胶的水凝胶。
[0265]
将神经视网膜和视网膜色素上皮细胞片于细胞外基质(例如:胶原蛋白)上进行培养、制造时,神经视网膜和视网膜色素上皮细胞片的回收中有时会利用分解细胞外基质的酶(例如:胶原酶)进行剥离。此时,为了防止混入该酶,利用培养基等洗涤数次是优选的。
[0266]
作为复合体的制造方法,可举出同时包埋神经视网膜和视网膜色素上皮细胞片的方法(也称为一阶段包埋法),或者,预先包埋神经视网膜和视网膜色素上皮细胞片中的任一者形成水凝胶层,之后包埋该水凝胶层及神经视网膜和视网膜色素上皮细胞片中的另一者的方法(也称为二阶段包埋法)。为了避免神经视网膜与视网膜色素上皮细胞片的物理性接触,分二个阶段进行包埋的方法是优选的。
[0267]
本发明所涉及的制造方法在一个方式中为二阶段包埋法,其包括以下步骤:
[0268]
(1)第一步骤,将上述视网膜色素上皮细胞片和上述神经视网膜中的任一者设置于容器中,
[0269]
(2)第二步骤,将流动状态的水凝胶添加至设置有上述一者的容器中,
[0270]
(3)第三步骤,冷却,以包埋上述一者的整体的方式使水凝胶凝固,形成具备上述一者和水凝胶的第一水凝胶层,
[0271]
(4)第四步骤,以使上述第一水凝胶层中的上述一者与上述视网膜色素上皮细胞片和上述神经视网膜的另一者各自的表面的切线方向成为大致平行、且神经视网膜的顶端面与视网膜色素上皮细胞的顶端面相对的方式,将第一水凝胶层上设置上述另一者,
[0272]
(5)第五步骤,将流动状态的水凝胶添加至进一步设置了上述另一者的容器中,和
[0273]
(6)第六步骤,冷却,以包埋第一水凝胶层和神经视网膜的整体的方式使水凝胶凝固,形成具备第一水凝胶层、上述另一者和上述水凝胶的第二水凝胶层。
[0274]
(1)第一步骤中,将视网膜色素上皮细胞片和神经视网膜中的任一者设置于容器中的方法没有特殊限定,例如,可以利用镊子、容易拣起片的平坦器具等进行设置。对于容器而言,没有特殊限定,可以根据视网膜色素上皮细胞片或神经视网膜的大小合适地选择,例如可举出培养皿、载玻片、硅片、塑料容器等。
[0275]
(2)第二步骤中,将水凝胶添加至容器的方法没有特殊限定,例如,可以通过用移液器、滴管添加的方法来实施。第一步骤中设置了视网膜色素上皮细胞片的情况下,优选以使视网膜色素上皮细胞片能维持片状的方式安静且缓慢地进行添加。考虑对细胞的伤害,流动状态的水凝胶的温度可以是例如约25℃~约50℃,优选30℃~40℃。
[0276]
(3)第三步骤中,针对容器,冷却至例如2℃~8℃,优选4℃~5℃,以包埋第一步骤中设置的视网膜色素上皮细胞片和神经视网膜中的任一者的方式使水凝胶凝固,形成第一层水凝胶。第三步骤中的冷却温度只要是低于熔点15℃~25℃的温度(优选20℃~25℃)即可。冷却时间只要能够使水凝胶凝固即可,根据水凝胶的种类而不同,但考虑到低温对细胞造成的恶劣影响,尽可能快是优选的。例如可以是10分钟~1小时,可以是5分钟~3小时或5小时以上。冷却手段没有特别限定,例如可举出冰上、4℃冰箱、冰袋上等。
[0277]
(4)第四步骤中,在第一层水凝胶上设置视网膜色素上皮细胞片和神经视网膜中的另一者的方法没有特殊限定,例如,可以通过使用镊子、药匙等的方法进行设置。此时,以视网膜色素上皮细胞片与神经视网膜各自的表面的切线方向成为大致平行、且神经视网膜的顶端面与视网膜色素上皮细胞的顶端面相对的方式进行设置。通过以该状态进行设置,可以以与生物体的视网膜同样的取向进行移植。
[0278]
(5)第五步骤中,考虑对细胞的伤害,流动状态的水凝胶的温度可以是例如约25℃~约50℃,优选30℃~40℃。第五步骤的流动状态的水凝胶的温度可以与第二步骤的温度相同,也可以不同。
[0279]
第五步骤中,通过与第二步骤同样的手段,可以将水凝胶添加至容器中。此时,优选的是,为了包入第一层水凝胶(其包埋第一步骤中设置的视网膜色素上皮细胞片和神经视网膜中的任一者)、及视网膜色素上皮细胞片和神经视网膜中的另一者,以不破坏二者的位置关系的方式,安静、缓慢且以尽可能不产生气泡的方式进行添加。
[0280]
(6)第六步骤中,可以与第三步骤同样地进行冷却。
[0281]
在一个方式中,本发明的复合体的制造方法在第六步骤之后还可以包括(7)将该复合体以10℃~20℃进行保存的第七步骤。低温状态是对细胞的胁迫,另一方面,升高温度后由于水凝胶溶解及/或凝胶强度降低使操作变得困难。因此,(7)第七步骤中,保存该复合体的温度是例如8℃~25℃,优选为10℃~20℃。第七步骤中,可以在固定后进一步冷却。冷却温度可以是较之熔点低5℃~15℃的温度(优选低10℃~15℃的温度)。
[0282]
在上述二阶段包埋法中,先用水凝胶包埋视网膜色素上皮细胞片的方法是优选的。
[0283]
本发明所涉及的制造方法在一个方式中为一阶段包埋法,其包括以下步骤:
[0284]
(1)第一步骤,将视网膜色素上皮细胞片和神经视网膜设置于容器中,
[0285]
(2)第二步骤,将流动状态的水凝胶添加至设置有视网膜色素上皮细胞片和神经视网膜的容器中,
[0286]
(3)第三步骤,冷却,以包埋视网膜色素上皮细胞片和神经视网膜的整体的方式使水凝胶凝固,形成具备视网膜色素上皮细胞片、神经视网膜和水凝胶的水凝胶层。
[0287]
第一步骤中,以视网膜色素上皮细胞片与神经视网膜各自的表面的切线方向成为大致平行、且神经视网膜的顶端面与视网膜色素上皮细胞的顶端面相对的方式,一边用镊子调整位置一边进行设置。通过以该状态进行设置,可以以与生物体的视网膜同样的取向进行移植。
[0288]
第二步骤和第三步骤如二阶段包埋法中所记载地实施即可。此外,也可以还包括二阶段包埋法中的第七步骤。
[0289]
〔药物组合物、治疗药和治疗方法〕
[0290]
作为本发明的一个方式,可举出含有本发明中得到的复合体作为有效成分的药物组合物。药物组合物除本发明的复合体外,优选还包含允许作为药物的担载体。
[0291]
药物组合物能用于基于视网膜组织的障碍或视网膜组织的损伤的疾病的治疗。作为基于视网膜组织的障碍的疾病,例如,可举出视网膜变性疾病、黄斑变性症、老年性黄斑变性、视网膜色素变性、青光眼、角膜疾病、视网膜脱落、中心性浆液性脉络膜视网膜症、锥体营养不良、锥体杆体营养不良等眼科疾病。作为视网膜组织的损伤状态,例如,可举出视
细胞、视网膜色素上皮细胞等变性死亡的状态等。
[0292]
作为允许作为药物的担载体,可使用生理性水性溶剂(生理盐水、缓冲液、无血清培养基等)。根据需要,药物组合物中也可配合在移植医疗中通常用于包含移植的组织或细胞的药物的防腐剂、稳定剂、还原剂、等渗剂等。
[0293]
作为本发明的一个方式,可举出含有通过本发明获得的复合体的、基于视网膜组织的障碍或视网膜组织的损伤的疾病的治疗药。
[0294]
对于本发明的治疗药而言,通过向具有基于视网膜组织的障碍或视网膜组织的损伤的疾病的患者移植通过本发明获得的复合体,可以治疗视网膜组织的障碍状态或视网膜组织的损伤状态。作为基于视网膜组织的障碍或视网膜组织的损伤的疾病,可举出上述疾病。
[0295]
作为本发明的一个方式,可举出含有通过本发明获得的复合体的移植用组合物。为了移植到患者的眼底或视网膜下(subretinal space),可以使用本发明的复合体。此外,本发明的复合体可用于以如下方式进行移植,在进行了移植的患者中,以被移植的复合体的神经视网膜朝向该患者的神经视网膜层、被移植的复合体的视网膜色素上皮细胞片朝向该患者的视网膜色素上皮层的状态植入。对于移植用组合物而言,除本发明的复合体以外,优选还含有允许作为药物的担载体,允许作为药物的担载体如上所述。
[0296]
作为本发明的一个方式,可举出基于视网膜组织的障碍或视网膜组织的损伤的疾病的治疗方法,所述方法包括以下步骤。
[0297]
步骤(1),将通过本发明获得的复合体移植至患者的眼底或视网膜下(subretinal space),
[0298]
步骤(2),在患者的生物体内,以被移植的复合体的神经视网膜朝向该患者的神经视网膜层、被移植的复合体的视网膜色素上皮细胞片朝向该患者的视网膜色素上皮层的状态植入。
[0299]
作为本发明的一个方式,可举出治疗基于视网膜组织的障碍或视网膜组织的损伤的疾病的方法,所述方法包括将通过本发明获得的复合体移植至需要移植的对象(例如,发生了眼科疾病的眼的视网膜下)。作为基于视网膜组织的障碍的疾病的治疗药,或者,为了在该视网膜组织的损伤状态下补充对应的损伤部位,可以使用本发明的复合体。通过将本发明的复合体移植至需要移植的、具有基于视网膜组织的障碍的疾病的患者、或者视网膜组织的损伤状态的患者,补充遭受该障碍的视网膜组织,可以治疗基于视网膜组织的障碍的疾病、或视网膜组织的损伤状态。作为移植方法,例如,可举出通过眼球的切开等来将本发明的移植用复合体移植到损伤部位的视网膜下的方法。作为移植方法,例如可举出使用细管进行注入的方法、用镊子夹持而进行移植的方法,作为细管可举出注射针等。
[0300]
实施例
[0301]
以下,给出实施例来详细说明本发明,但本发明不限于这些实施例。
[0302]
<实施例1从人es细胞基于sfebq法制作视网膜色素上皮细胞片(rpe细胞片)和神经视网膜>
[0303]
将以具有crx::venus报告基因的方式进行了基因改造的人es细胞(khes
‑
1株、(非专利文献3))根据“scientific reports,4,3594(2014)”中记载的方法在无饲养层条件下培养。作为无饲养层培养基,使用stemfit培养基(商品名:ak03n、味之素公司制),作为代替
饲养细胞的支架,使用laminin511
‑
e8(商品名,nippi公司制)。
[0304]
具体的人es细胞的维持培养操作如下实施。首先,将已成为亚汇合(培养面积的6成左右被细胞覆盖)的人es细胞用pbs洗涤后,使用tryple select(商品名,life technologies公司制)分散为单一细胞。之后,将分散为单一细胞的人es细胞接种于用laminin511
‑
e8包被的塑料培养皿,在y27632(rock抑制物质,10μm)的存在下,用stemfit培养基在无饲养层条件下培养。使用6孔板(iwaki公司制,细胞培养用,培养面积9.4cm2)作为上述塑料培养皿的情况下,上述分散为单一细胞的人es细胞的接种细胞数设为每1个孔为0.4~1.2
×
104个细胞。接种1天后,更换为不含y27632的stemfit培养基。之后,每1天~2天用不含y27632的stemfit培养基更换一次培养基。之后,在不存在饲养细胞的条件下(无饲养层条件下)培养至亚汇合1天前。将该亚汇合1天前的人es细胞在sb431542(tgfβ信号转导通路抑制物质,5μm)和sag(shh信号转导通路作用物质,300nm)的存在下(预处理(precondition)),进行1天无饲养层条件下的培养。
[0305]
将人es细胞用pbs洗涤后,使用tryple select进行细胞分散液处理,进而通过吹吸操作分散为单一细胞,然后,将分散为单一细胞的人es细胞以成为非细胞粘附性96孔培养板(商品名:primesurface 96孔v底板,住友bakelite公司制)的每1个孔为1.2
×
104个细胞的方式悬浮于100μl的无血清培养基中,37℃、5%co2悬浮培养。此时的无血清培养基(gfcdm ksr)使用向f
‑
12培养基与imdm培养基的1:1混合液中添加有10%ksr、450μm 1
‑
硫代甘油、1
×
化学成分明确的脂质浓缩液(chemically defined lipid concentrate)的无血清培养基。
[0306]
悬浮培养开始时(悬浮培养开始后第0天),向上述无血清培养基中添加y27632(rock抑制物质,最终浓度10μm)和sag(shh信号转导通路作用物质,300nm或30nm、0nm)。悬浮培养开始后第3天,用不含y27632和sag、而含有人重组bmp4(商品名:recombinant human bmp
‑
4,r&d公司制)的培养基,添加50μl含有最终浓度1.5nm的外源性人重组bmp4的培养基。悬浮培养开始后第6天以后,每3天一次,用不含y27632、sag和人重组bmp4的培养基进行半量更换。神经视网膜和rpe细胞片也均以与上述制造方法相同的方法实施。
[0307]
(神经视网膜的制造方法)
[0308]
将该悬浮培养开始后第15天至第18天的聚集体移入90mm低粘附培养皿(住友bakelite公司制),用含有wnt信号转导通路作用物质(chir99021、3μm)和fgf信号转导通路抑制物质(su5402、5μm)的无血清培养基(向dmem/f12培养基添加1%n2 supplement而得的培养基)在37℃、5%co2培养3~4天。之后,用90mm低粘附培养皿(住友bakelite公司制),使用不含wnt信号转导通路作用物质和fgf信号转导通路抑制物质、而含有血清的dmem/f12培养基(以下有时也称为nuct0培养基)中长期培养。悬浮培养开始后(分化诱导)第40天以后,使用不含wnt信号转导通路作用物质和fgf信号转导通路抑制物质的血清培养基(nuct0培养基与nuct2培养基的混合培养基,以下有时也称为nuct1培养基)长期培养。悬浮培养开始后(分化诱导)第60天以后,使用含有甲状腺激素信号转导通路作用物质t3的neurobasal培养基(以下有时也称为nuct2培养基)长期培养(悬浮培养开始后第80天至第150天左右),获得球状的神经视网膜和pre细胞。挑出神经视网膜和rpe细胞。将球状的来源于人es细胞的rpe用眼科用剪展开并切开,使其成为一层的片状,获得rpe细胞片。
[0309]
使用显微镜观察,结果可知,人es细胞株中分化出具有层结构的神经视网膜(nr)
和rpe细胞(图1的a和b)。
[0310]
此外,使该球状的rpe细胞附着于用imatrix511包被的培养皿,向含有b27和200mm l
‑
谷氨酰胺的dmem、f12培养基(称为sfrm培养基)添加sb431542(wako公司)和bfgf(wako公司)并进行培养,扩大培养后,挑出良好的rpe部位进行传代。扩大培养后,用stem
‑
cellbanker(注册商标;日本全药工业株式会社)冷冻保存。将冷冻保存的rpe再次在用imatrix511包被的培养皿上扩大培养后,使用bematrix低内毒素化胶原蛋白液(新田明胶公司collagenat),在胶原蛋白凝胶化的基础上,使用向f10(sigma公司)添加10%fbs而得的培养基培养1个月,然后,向sfrm培养基添加sb431543和bfgf进行培养,发现可以制作具有六边形结构的rpe细胞片(图1的c)。由此制作的rpe细胞片可以使用胶原酶(roche公司)消化胶原蛋白凝胶,进行回收。以下实施例中,通过与实施例1同样的方法制造视网膜色素上皮细胞片(rpe细胞片)和神经视网膜。
[0311]
<实施例2实验条件的研究——明胶的浓度与易溶性>
[0312]
将明胶视移植至网膜下时,优选以尽可能低的浓度进行移植、迅速地进行溶解和吸收
·
分解。另一方面,如果移植时明胶立即融化,则操作会变得困难,因此对最适浓度进行了研究。
[0313]
使用hbss(gibco公司制)于37℃使明胶ls
‑
w(新田明胶公司制)以成为10重量%、15重量%、20重量%、25重量%、30重量%的浓度的方式溶解,分别在载玻片上滴加数滴。滴加后,在4℃冰箱中孵育30分钟。孵育后,将载玻片以垂直竖立的状态室温(25℃)放置5分钟左右,以出现下垂作为指标研究易融性。
[0314]
其结果可知,10重量%、15重量%、20重量%的浓度的情况下,室温下能够迅速融化。另一方面可知,25重量%以上的浓度的情况下,在室温下保持凝固。因此,实施例3之后,明胶的浓度以30重量%来实施。
[0315]
<实施例3实验条件的研究——明胶融化的温度>
[0316]
针对明胶ls
‑
w(新田明胶公司制)的溶解温度进行研究。于37℃用hbss使明胶ls
‑
w以成为30重量%的方式溶解,在4℃、16℃、26℃、37℃孵育1天。需要说明的是,4℃的保存使用冰箱,16℃、26℃和37℃的保存在设定为各温度的co2温箱内实施。
[0317]
一天后进行观察,4℃和16℃的情况下明胶保持凝固,与之相对,26℃和37℃的情况下明胶完全溶解。由此可知,30重量%明胶l
‑
sw的溶解温度为16℃至26℃之间。
[0318]
<实施例4实验条件的研究——ph调整和易溶性>
[0319]
溶解于hbss(gibco公司制)中的30重量%明胶ls
‑
w(新田明胶公司制)为ph5.0~6.0附近的酸性,认为对于细胞存在凋亡等不利影响。于是,通过对100ul的30重量%明胶l
‑
sw添加1ul、2ul、3ul或4ul的1.2n naoh,调整至ph6附近、ph7附近、ph8附近。
[0320]
为了研究以各ph进行调整后的明胶的性质(易溶性)是否改变,以包埋5~10个来源于人es细胞的神经视网膜的状态,在设定为16℃的5%co2温箱内孵育1天和3天。其结果是,调整至中性附近的明胶在16℃下保持凝固1~3天。因此可知,即使通过ph调整成为中性,明胶的特性也不会改变。因此可知,明胶ls
‑
w(新田明胶公司制)即使在中性范围其溶解温度也未发生较大变化。实施例5之后,ph使用7附近。
[0321]
<实施例5明胶包埋的来源于hes细胞的神经视网膜的毒性试验>
[0322]
针对具有高浓度(30重量%)以及酸性范围或中性范围的ph的明胶l
‑
sw(新田明胶
公司制)对细胞的存活和分化产生的影响进行研究。用30重量%的明胶(ph5或ph7)包埋来源于hes细胞的神经视网膜3天,保存于16℃。之后,通过在约37℃孵育使明胶融化后,在增殖培养基中恢复培养3天、9天、14天。之后,在显微镜下,通过免疫染色确认组织的形态和各种标志物的表达等。
[0323]
在显微镜下确认组织的形态,结果发现,用30重量%的明胶包埋3天并在16℃保存的、来源于人es细胞的神经视网膜在培养3天后观察到少量细胞死亡、层结构紊乱(图2和图3,箭头),但培养9天以上时则恢复正常(图2和图3)。此外,确认到由于ph5的明胶的即时伤害强,因此中性附近的明胶是优选的(图2)。
[0324]
已知神经视网膜中,hla i类在通常条件下不表达,但在炎症条件下表达升高。因此,针对来源于hes细胞的神经视网膜的形态和hla i类的表达,使用ph5和ph7的明胶包埋、保存之后,恢复培养14天,进行了比较。其结果是,在用ph5的明胶包埋和保存的情况下,来源于hes细胞的神经视网膜的层结构和连续上皮结构得到良好的维持,并确认到恢复蛋白阳性的视细胞,但确认到一部分连续上皮结构崩坏并形成玫瑰花结(rosette)(图4)。在形成玫瑰花结的部位,hla i类的表达升高,可认为有由明胶的酸性造成伤害的可能性。另一方面,在用ph7的明胶包埋和保存的情况下,来源于hes细胞的神经视网膜的层结构得到良好的维持,并确认到大量恢复蛋白阳性的视细胞(图5)。此外,并未确认到hla i类的表达(图5)。
[0325]
其次,由于明胶是使作为基底膜成分的胶原蛋白分解而得的物质,因此针对明胶引起来源于hes细胞的神经视网膜的顶端(apical)和基底(basal)的极性、层结构(连续上皮结构)的崩坏、分化诱导的促进、或凋亡等的可能性进行了研究。具体而言,通过针对各标志物进行免疫染色,确认恢复培养14天后的来源于人es细胞的神经视网膜的apical和basal的极性变化、有无分化诱导的促进(确认前体细胞的存在)和有无凋亡诱导。结果示于图6~8中。
[0326]
其结果是apical和basal的极性保持不变,显示明胶没有影响(埃兹蛋白:apical标志物,r&d systems公司制;col iv:collagen iv
·
basal标志物,abcam公司制)(图6)。此外,对于视网膜标志物,crx(takara公司制)、chx10(exalpha公司制)和pax6(bd公司制)各自为阳性的细胞的区域性存在得到正确的维持,显示明胶没有影响(crx:视细胞前体细胞;chx10&pax6:视网膜前体细胞;pax6:无长突细胞)(图7)。视网膜前体细胞仍然存在。此外,针对凋亡,几乎没有确认到活性型caspase3(bd公司制)阳性的引起凋亡的细胞,显示明胶没有影响(图8)。针对上述影响,也未观察到由ph的区别造成的差异。
[0327]
基于以上结果可知,用明胶包埋3天并保存于16℃的、来源于人es细胞的神经视网膜虽然在刚刚使明胶融化后观察到少许伤害,但恢复了正常。此外,确认到由于ph5的明胶的即时伤害强,因此中性附近的明胶是优选的。
[0328]
<实施例6来源于人es细胞的神经视网膜在30重量%明胶ls
‑
w中的并列包埋>
[0329]
将通过与实施例1相同方法制造的、悬浮培养开始后80天至150天的来源于人es细胞的神经视网膜用眼科用剪切出,准备成可以移植的大小,置于60cm培养皿(住友bakelite公司)上,除去培养基。从上方滴加于37℃加热的30重量%明胶ls
‑
w(新田明胶公司制)20~30ul,将切出的神经视网膜横向并列配置,4℃冷却30分钟。基于其结果,可以横向连续地准备多个连续移植片。通过添加明胶后横向并列配置,可以在移植时同时准备多个移植片。
[0330]
<实施例7来源于人es细胞的rpe与来源于人es细胞的神经视网膜在30重量%明胶ls
‑
w中的二阶段包埋>
[0331]
准备通过与实施例1相同方法制造的、悬浮培养开始后80天至150天的来源于人es细胞的神经视网膜和rpe细胞片。作为用于以明胶进行凝固的容器,将重叠2片200μm厚的硅片而得的400um硅片置于载玻片(松浪玻璃公司)上的两端作为间隔物。将rpe细胞片静置于载玻片上。从上方滴加于52℃加热的30重量%明胶ls
‑
w(新田明胶公司制)50ul,从上方叠加载玻片,4℃冷却20分钟。冷却后,剥下已埋入了rpe的凝胶,翻转,使rpe的顶端(apical)面成为上侧。将从通过实施例1制作的神经视网膜组织中切出的神经视网膜以顶端面向下(rpe侧)的方式置于rpe细胞片上,从上方滴加52℃的明胶ls
‑
w,加盖盖玻片。4℃冷却20分钟。实施例7的步骤示于图9中。
[0332]
冷却后,可以以rpe细胞片和神经视网膜固化的状态进行回收。使用显微镜观察,确认到神经视网膜载于rpe细胞片上(图10和11)。此外,使用手术刀、镊子除去周围不需要的明胶后,剥下粘附于载玻片上的明胶,用镊子回收(图12)。将该来源于人es细胞的rpe细胞片与神经视网膜的复合体用pbs洗涤,使用4%pfa,于4℃进一步固定15分钟。用pbs洗涤后,浸泡在30%蔗糖溶液中。之后,使用oct冰冻切片包埋剂(o.c.t.compound)包埋在包埋模具(cryomold)中。用低温恒温器(cryostat)制作12μm的切片。用共焦显微镜(leica公司制sp
‑
8)对该切片进行观察。其结果可知,来源于人es细胞的神经视网膜和rpe细胞片被明胶隔离而不接触但接近(图13和14)。基于该结果可知,通过使用明胶以二阶段进行包埋,能够使从人es细胞分别各自分化诱导而得的rpe细胞片和神经视网膜以被明胶隔离而不接触但接近的状态获得。
[0333]
<实施例8nr
‑
rpe细胞片的移植和植入确认>
[0334]
使用手术刀和剪刀将通过实施例7的方法制作的、用明胶固化的来源于人es细胞的rpe细胞片与神经视网膜的复合体以能够用移植针吸取的方式细长地切出。使用玻璃毛细管抽吸切出的复合片,移植至裸大鼠的视网膜下。就移植而言,将眼球的一部分切开,使玻璃毛细管从切开部位侵入玻璃体,移植至视网膜下。移植1周后,从大鼠摘出眼,多聚甲醛固定并进行蔗糖置换。用低温恒温器制作12μm的组织切片。针对切出的切片,通过免疫染色,用人细胞质标志物特异性小鼠单克隆抗体(商品名:stem121,takara公司制)、抗rpe65抗体(商品名:rpe65 antibody,millipore公司制)、抗hunu抗体(millipore公司制)、抗mitf抗体(exalpha公司制)、抗iba1抗体(wako公司制),分别染色组织切片中的人细胞和rpe细胞,评价移植后的移植物。通过对人细胞进行染色,判断是否是移植的人源细胞。
[0335]
用共焦显微镜(商品名:tcs sp8、莱卡公司制)对染色的组织进行荧光观察。结果示于图15~20中。观察用stem121和rpe65染色的切片,观察到来源于移植片(移植物,graft)的rpe及紧靠其上方的crx::venus阳性的视细胞玫瑰花结(rosette)。该结果显示,nr
‑
rpe细胞片的同时移植中,nr与rpe细胞能够保持方向性来进行同时移植和植入。
[0336]
<实施例9来源于人es细胞的rpe片与来源于人es细胞的神经视网膜在30重量%明胶l
‑
sw中的一阶段包埋>
[0337]
准备通过与实施例1相同方法制造的、悬浮培养开始后80天至150天的来源于人es细胞的神经视网膜和rpe细胞片。将制造的来源于人es细胞的rpe细胞片使用胶原酶从胶原蛋白凝胶中回收,充分洗涤后,置于60mm培养皿(住友bakelite公司)上。此外,用眼科用剪
切出10个来源于人es细胞的神经视网膜,置于rpe细胞片之上。从上方滴加于37℃加热的30重量%明胶ls
‑
w(新田明胶公司制)20~30ul,用镊子调整神经视网膜与rpe的位置关系,4℃冷却30分钟。
[0338]
冷却后,用手术刀切除周围的多余部位,实现了将rpe细胞片和神经视网膜以固化的状态回收。使用显微镜观察,确认到nr载于rpe细胞片上(图21)。图21的a示出了显微镜图像,图21的b示出了显示crx::venus的荧光的荧光显微镜图像。由该结果可知,可以使用明胶以一阶段包埋从人es细胞各自分别分化诱导而得的rpe细胞片和神经视网膜。此外,即使在以一阶段进行包埋时,神经视网膜和rpe细胞片也能够以被明胶隔离而不接触但接近的状态获得。
[0339]
产业上的可利用性
[0340]
根据本发明,可提供适于移植的神经视网膜与视网膜色素上皮细胞的复合体及其制造方法。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。