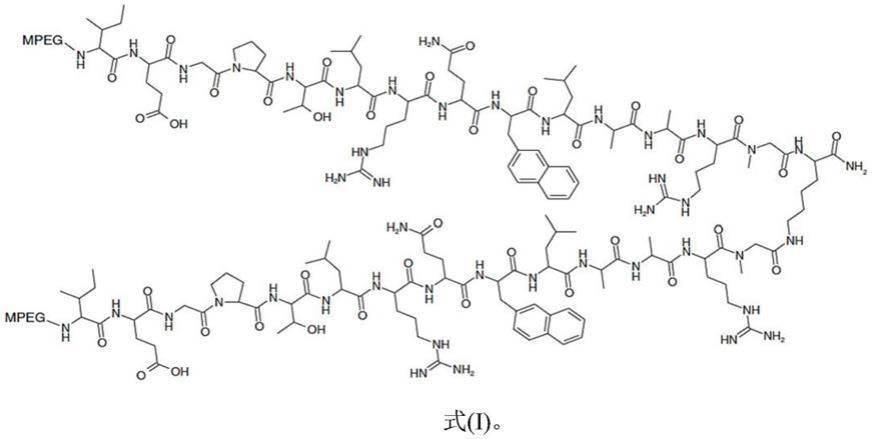
与放射和/或放射模拟物治疗结合的减轻肝损伤和促进肝肥大、再生和细胞植入的方法
1.相关申请的交叉引用
2.本技术要求2019年1月25日提交的美国专利申请号62/796,806的权利,其公开整体援引加入本文。
3.电子提交的序列表的引用
4.本技术包含序列表,其通过efs
‑
web以ascii格式的序列表电子提交,文件名“688097.0956/456wo的序列表”,创建日期2020年1月23日,大小为约3.6kb。通过efs
‑
web提交的序列表是本说明书的一部分,并且其整体援引加入本文。
技术领域
5.本发明涉及在有此需要的受试者中减轻肝损伤以及促进肝再生、肥大(hypertrophy)和肝细胞植入的方法和试剂盒。特别地,本发明涉及包括向受试者单独给药有效量的血小板生成素(tpo)模拟物或者与细胞移植联合,与放射或放射模拟物结合,以促进有益效果的方法,以及包含药物组合物的试剂盒,所述药物组合物包含有效量的tpo模拟物和药学可接受的载剂。
背景技术:
6.肝病是全世界发病率和死亡率的重要原因(yang,j.,int.j.environ.res.public health 2018,15,170)。肝脏疾病可以由各种因素引起,包括病毒感染、酒精和基因突变。
7.肝肿瘤在患有肝病的患者中发生的频率高得多,目前在美国呈上升趋势,是全球最常见的恶性肿瘤之一,每年发病率为约100万例(howlader et al.,seer cancer statistics review 1975
‑
2014,2017:2012
–
2014)。在肝肿瘤中,肝细胞癌(hcc)是全球癌症相关死亡的第二大原因,每年占约745,000例(siegel et al.,ca cancer j.clin.,2015,65:5
–
29)。如果没有明确治疗,肝癌通常会发展并导致癌症患者的显著发病率和死亡率;局部肝癌患者的5年生存率为27.7%(howlader n,noone am,krapcho m,et al(eds).seer cancer statistics review,1975
‑
2009[vintage 2009populations],national cancer institute.bethesda,md)。仅15
‑
20%的hcc患者存在可切除的肿瘤,5年总生存率(os)为40
‑
70%,5年无发展生存率(pfs)为23
‑
50%(bismuth h et.al.semin liver dis.1999,19(3):311
‑
22)。
[0008]
目前hcc患者的治疗选择包括肝移植、肿瘤切除、肝切除术、索拉非尼化疗、射频消融、经动脉化疗/放射栓塞或放射疗法(bruix,j.gastroenterology,2016,150:835
‑
853;keane,f.liver cancer,2016,5:198
–
209)。相当多无法进行肝移植的hcc患者也不适合这些其他治疗选择;这是由于他们因肝功能差而死于手术本身的风险要高得多。门静脉栓塞/结扎是近年来开发和应用的一种外科手术,通过肥大诱导肝再生并增强患者的健康肝功能(capacity),从而使他们能够进行这些干预(cieslak,k.surgery,2017,162:37
‑
47)。
[0009]
临床上非常需要细胞移植疗法,其可以使受伤或患病的肝脏恢复健康并重建其生
物学功能。例如,关于肝病,仅在美国每年就有超过40,000名患者死于晚期肝病,并且估计约20,000,000人患有肝病(hagmann,m.,science,287:1185,1187(2000))。对于那些患有遗传学代谢性肝病或晚期肝功能衰竭的患者,正交异性肝移植(olt)是唯一的治疗选择,但是由于供体严重短缺,大多数人在没有olt的情况下死亡。理论上,许多患有原发性或转移性肝癌的患者也可以通过olt全肝切除术治愈,或者显著改善他们的生存和/或生活质量。但是,在实践中,由于等待捐赠肝脏的名单很长,癌症患者很少考虑olt。
[0010]
虽然放射疗法(rt)用于所有非肝癌患者的三分之一,但是传统上rt在肝脏恶性肿瘤中的作用受到肝脏低放射耐受性的限制。早期研究证明超过30
‑
35gy的全肝放射与放射诱发的肝病(rild)的高风险有关(lawrence et al.,int.j.radiat.oncol.biol.phys.,1995,31:1237
–
48;reed et al.,am.j.pathol.,1966,48:597
–
611)。肝脏照射疗法的应用有限的潜在原因是目前没有可用于预防或治疗rild的广泛接受的疗法或放射缓解剂(radiomitigator)。此外,rild的可能性随着基线肝功能障碍而增加(pan et al.,int.j.radiat.oncol.biol.phys.,2010,76:s94
‑
100)。最近的一项回顾性研究报告称,11.2%的接受肝脏立体定向放射疗法(sbrt)的患者发生了rild(lo et al.,plos one,2017,12(5):e0177793)。接受骨髓移植的预备性照射也发生rild的患者经历显著的死亡率(84%)(fulgenzi et al.,hepatic med.evid.res.,2016,8:105
–
113)。此外,肝脏是胃肠道癌症的rt治疗期间经常碰巧受到照射的器官之一,因为其接近胃肠道且体积较大(pan et al.,int.j.radiat.oncol.biol.phys.,2010,76:s94
‑
100)。
[0011]
肝脏是对放射最敏感的器官之一(emami et al.,int.j.radiat.oncol.biol.phys.,1991,21:109
–
22),因为它的血管丰富并且其血管内衬的内皮细胞对放射及其敏感(baker et al.,cancer invest.,1989,7:287
–
94)。由于生理器官大小固定,未受照射的肝脏会肥大以补偿受照射叶的萎缩(guha et al.,seminars in oncology,2011,21(4):256
‑
263)。肝脏照射还可能对肝窦内皮细胞(lsec)造成损伤,这可以导致肝窦充血,中央和小叶下静脉的内皮下空间水肿性增宽,甚至窦阻塞(pan et al.,int.j.radiat.oncol.biol.phys.,2010,76:s94
‑
100)。因此,需要仔细的治疗计划以尽量减少受照射的组织,以保护患者并防止rild(kalman et al.,int.j.radiat.oncol.,2017,98:662
–
682;guha et al.,seminars in oncology,2011,21(4):256
‑
263)。通过先进的治疗计划,如果放射体积足够小(肝脏总体积的约1/3),则可以给予非常高的剂量(高达90
‑
100gy)(dawson et al.,int.j.radiat.oncol.biol.physics.,2002,53:810
–
821)。立体定向身体放射疗法(sbrt)和多次放射(分割)的施加是其他用来减少放射的总体毒性并使其能够用于患者的方法。
[0012]
血小板生成素(tpo)是一种由肝脏合成和分泌的生长因子。除了作为体液生长因子通过血小板生成素受体(tpo
‑
r或c
‑
mpl)刺激巨核细胞的增殖和分化,已显示重组人tpo(rhtpo)在体外促进血小板活化以及肝内皮细胞生长和迁移(cardier et al.,blood,1998,91:923
–
929)。
[0013]
去纤苷酸是唯一获得临床批准的用于缓解与放射诱发的肝病(rild)相关的窦阻塞综合征的药物。去纤苷酸是纯化自猪肠粘膜dna的核苷酸混合物(fulgenzi et al.,hepatic med.evid.res.,2016,8:105
–
113;guha et al.,seminars in oncology,2011,21(4):256
‑
263),它通过调节lsec的活性来减少肝窦损伤,这降低肝窦渗透性和lsec开裂。
[0014]
还没有临床批准的用于促进肝细胞植入的药物,如肝中的肝窦内皮细胞、干细胞、肝实质细胞祖细胞或肝实质细胞。此外,还没有批准用于增强肝肥大的药物。
技术实现要素:
[0015]
现在发现血小板生成素(tpo)模拟物可以减轻肝损伤,促进肝再生,增加肝体积,并且促进有此需要的受试者中的肝细胞植入。例如,据发现tpo模拟物对靶向放射疗法诱发的肝病(rild)具有显著的缓解作用,可以增强未受照射的肝叶的肥大,并且促进内源性骨髓来源或外源性肝细胞的植入,如肝窦内皮细胞(lsec),在有此需要的受试者中,当单独使用或者与肝细胞如lsec,和/或蛋白因子的施用一起使用时。还发现与放射之后的tpo模拟物治疗相比,在放射之前用tpo模拟物治疗可以对肝脏的保护和修复具有增强的作用。虽然在照射后给予tpo模拟物时需要lsec移植来防止rild,但是在照射之前预防性给予tpo模拟物时不需要lsec移植来防止rild。
[0016]
因此,在一个一般方面,本技术涉及一种减轻有此需要的受试者中的rild的方法,所述方法包括:向所述受试者给药有效量的血小板生成素(tpo)模拟物,优选地,所述tpo模拟物包含seq id no:1的氨基酸序列,更优选地,所述tpo模拟物是rwj
‑
800088或罗米司亭(romiplostim)。rild的实例包括但不限于肝肿大、腹水、肝酶升高、血小板减少症、肝窦阻塞综合征(sos)、肝中心静脉闭塞病(vod)和肝纤维化。
[0017]
在另一个一般方面,本技术涉及一种在用靶向放射疗法治疗的受试者中增强未受照射的肝叶的肥大的方法,所述方法包括向所述受试者给药有效量的血小板生成素(tpo)模拟物,优选地,所述tpo模拟物包含seq id no:1的氨基酸序列,更优选地,所述tpo模拟物是rwj
‑
800088或罗米司亭。优选地,未受照射的肝叶的肥大补偿受照射的肝叶的肝萎缩。
[0018]
在另一个一般方面,本技术涉及一种促进有此需要的受试者中内源性或外源性肝细胞、它们的祖细胞或者干细胞植入的方法,所述方法包括:(a)向所述受试者施用靶向放射或放射模拟治疗;(b)向所述受试者给药肝细胞;以及(c)向所述受试者给药有效量的血小板生成素(tpo)模拟物,从而促进所述肝细胞在所述受试者肝脏中的植入。优选地,所述tpo模拟物包含seq id no:1的氨基酸序列,更优选地,所述tpo模拟物是rwj
‑
800088或罗米司亭。最优选地,受试者中肝细胞的植入恢复肝功能。例如,植入的肝细胞增加血浆和肝脏中因子viii(fviii)的表达。
[0019]
在另一个一般方面,本技术涉及一种减少用放射、放射模拟物质或两者治疗的受试者中的窦阻塞的方法,所述方法包括:向所述受试者单独给药有效量的血小板生成素(tpo)模拟物或与肝细胞和/或骨髓干细胞动员剂(例如cxcr4拮抗剂)组合。优选地,所述tpo模拟物包含seq id no:1的氨基酸序列,更优选地,所述tpo模拟物是rwj
‑
800088或罗米司亭。优选地,所述方法防止由暴露于放射模拟物质或放射疗法导致的肝窦阻塞综合征(sos)的表现。
[0020]
在某些实施方案中,将tpo模拟物与另一活性剂联合给药至受试者。例如,tpo模拟物可以与肝细胞移植联合给药,如lsec、肝实质细胞、祖细胞、多能干细胞、肝干细胞或者表达一种或多种转基因的重组肝细胞。tpo模拟物还可以与蛋白因子联合给药,例如骨髓干细胞动员因子如cxcr4拮抗剂;生长因子,如gm
‑
csf、gcsf或flt3配体;或者任选地进一步联合肝实质细胞生长因子。tpo模拟物可以进一步与肝细胞(如lsec)移植和生长因子的给药联
合给药。可以在其他活性剂如肝细胞(例如,lsec、肝实质细胞)或蛋白因子之前、之后或同时向受试者给药tpo模拟物。
[0021]
在某些实施方案中,需要本技术的治疗的受试者是用放射疗法治疗的受试者,优选靶向放射疗法,其可能导致rild,如肝病的靶向放射疗法、骨髓移植的预备性照射或胃肠道癌的靶向放射疗法。在另一实施方案中,为了肝细胞的植入,用预备性肝脏照射(hir)治疗受试者。可以在放射疗法之前、之后或同时向受试者给药tpo模拟物。在某些实施方案中,在向受试者施用放射剂量之前至少约24小时至之后至少约24小时向受试者给药tpo模拟物。在一些实施方案中,在放射剂量之前或之后24至2小时给药tpo模拟物。在其他实施方案中,在放射剂量之前或之后1分钟至2小时给药tpo模拟物。在一些实施方案中,例如,在放射剂量之后2
‑
24小时与肝细胞的给药一起给药tpom。
[0022]
在某些实施方案中,用靶向放射治疗受试者,优选肝脏,剂量为10
‑
70戈瑞(gy),分1
‑
10个部分。
[0023]
在某些实施方案中,tpo模拟物的有效量为约1至约5μg/kg受试者体重。在优选的实施方案中,tpo模拟物的有效量为约1μg/kg受试者体重。在某些优选的实施方案中,当皮下或静脉内给药时,tpo模拟物的有效量为约3μg/kg受试者体重。
[0024]
在某些实施方案中,通过静脉内、肌肉内或皮下注射向受试者给药有效量的tpo模拟物。在优选的实施方案中,通过皮下注射给药tpo模拟物。
[0025]
在另一个一般方面,本技术涉及一种用于在有此需要的受试者中减轻rild的试剂盒。所述试剂盒包含药物组合物,所述药物组合物包含有效量的tpo模拟物和药学可接受的载剂用于减轻rild。任选地,所述试剂盒进一步包括与至少一种额外的治疗剂一起给药。任选地,所述试剂盒进一步包含用于向受试者给药tpo模拟物的装置或工具。优选地,所述试剂盒包含tpo模拟物,所述tpo模拟物具有seq id no:1的氨基酸序列,更优选rwj
‑
800088或罗米司亭的tpo模拟物。在某些实施方案中,所述试剂盒进一步包含肝细胞,优选lsec,任选地还有肝实质细胞,用于向受试者给药。在其他实施方案中,所述试剂盒进一步包含生长因子或骨髓干细胞刺激剂。
附图说明
[0026]
当结合附图阅读时,会更好地理解前述概述以及本发明的优选实施方案的以下详细描述。但是,应当理解本技术不限于图中示出的明确的实施方案。
[0027]
专利或申请文件包含至少一张彩色绘图。当请求和支付必要费用后会由专利局提供本专利或专利申请公开的带有彩图的副本。
[0028]
图1示出有或没有tpom(rwj
‑
800088)给药,进行部分肝脏照射(hir)之后未治疗的尾状叶的平均体积。
[0029]
图2a说明实验2中靶向肝脏照射(hir) tpom(rwj
‑
800088) lsec移植研究的时间线。图2b是用dppiv( / )lsec细胞移植的小鼠dppiv(
‑
/
‑
)模型的图示,用于检测肝窦中移植细胞的再群体化。
[0030]
图3a
‑
3f示出免疫组织化学染色以检测移植之后的dppiv( / )lsec细胞,其再群体化接受tpom(rwj
‑
800088)的动物受照射的肝脏:图3a示出移植之前的dppiv(
‑
/
‑
)移植受体肝脏,显示无ddpiv染色(阴性对照);图3b示出dppiv( / )的lesc供体c57bl6小鼠中的阳
性dppiv染色(阳性对照);图3c示出没有dppiv( / )细胞再群体化的hir lsec;图3d示出lsec adhgf治疗和dppiv( / )细胞再群体化肝脏;图3e示出在肝脏照射之后给予tpom时看到大量lsec再群体化;图3f示出低倍下再群体化的肝叶。
[0031]
图4a
‑
4b证实用tpom(rwj
‑
800088)治疗减少受照射组织中的肝损伤:图4a示出受照射叶的相对变化,图4b示出未受照射叶的相对变化。
[0032]
图5a
‑
5e示出spect
‑
ct定量移植后2个月肝脏中的残余灌注缺陷:图5a示出spect原理的基本示意图;图5b示出对应于用于放射给药的5mm准直器的受照射肝组织中的灌注缺陷;图5c示出用lsec移植后注射tpom(rwj
‑
800088)治疗的动物中的灌注恢复;图5d示出在肝硬化小鼠肝脏中tpom lsec组中,放射后2个月的残余缺陷显著减少;图5e示出与在肝脏照射(hir)之前2小时和24小时以及没有lsec移植的hir后10分钟给药tpom之后的未受照射的组织相比,与hir后24小时进行lsec移植之后以及hir后24小时和10分钟给药tpom相比,受照射的肝组织的缺陷体积的相对百分比。数据显示当在照射后将tpom与lsec移植一起给药时,缺陷形成显著减轻,而在没有lsec移植的情况下给药时,单独用tpom时,缺陷体积显著减少。
[0033]
图6示出在hir后4
‑
5天lsec移植之后10分钟给药tpom或罗米司亭时lsec的植入。
[0034]
图7示出在研究中未受照射的右叶重量比受照射的左叶重量的比例,以评价tpom 肝窦内皮细胞(lsec)移植、照射后给药的tpom 普乐沙福(plerixafor)以及照射前和照射后给药的tpom 普乐沙福对放射诱发的肝病的影响。
[0035]
图8示出在研究中通过spect
‑
ct定量的肝硬化小鼠中的缺陷体积/肝体积,以评价tpom 肝窦内皮细胞(lsec)移植、照射后给药的tpom 普乐沙福以及照射前和照射后给药的tpom 普乐沙福对放射诱发的肝病的影响。
[0036]
图9示出kaplan
‑
meyer曲线,显示实验6中第120天drabkin’s出血测试后的存活率。经过的天数是第120天出血测试后的天数。
[0037]
图10a和10b证明对于血浆(10a)或肝脏(10b),与未处理的a型血友病小鼠相比,处理的hir lsec jnj
‑
26366821或adhgf组中fviii生成的elisa分析。n=5且***p<0.005。wt;野生型,hir;肝脏照射;lsec;肝窦内皮细胞。
[0038]
图11示出免疫荧光评价对因子viii(红色)、lyve
‑
1(绿色)
–
肝窦内皮细胞的选择性抗体、dapi(蓝色)
–
显示细胞的dna染色以及fvii lyve
‑
1的合并区域(黄色)染色的肝切片。(a)wt=c57/bl6,(b)lsec供体小鼠=b6129sf2/j,(c)a型血友病小鼠f8(
‑
/
‑
),(d)a型血友病小鼠f8(
‑
/
‑
) hir,(e)f8(
‑
/
‑
) hir lsec jnj
‑
26366821(tpom),(f)f8(
‑
/
‑
) hir lsec ad hgf以及(g)二抗阴性对照免疫荧光。完整图像=10x,缩放图像=64x放大率,白条为20μm(微米)。
具体实施方式
[0039]
本公开至少部分是基于鉴定血小板生成素(tpo)模拟物作为治疗剂用于减轻有此需要的受试者的放射诱发的肝病。可以配制tpo模拟物并将其给药至正在或将要接受放射疗法的受试者以减轻放射诱发的肝病。
[0040]
在背景和整个说明书中引用或描述了各种出版物、文章和专利;这些参考文献每个整体援引加入本文。本说明书中已包括的文件、条例、材料、装置、文章等的讨论仅为了提
供本发明的上下文的目的。这样的讨论不是承认任何或全部这些材料形成关于公开或要求保护的任何发明的现有技术的部分。
[0041]
除非另有定义,本文使用的所有技术和科学术语均具有与本发明所属领域的技术人员通常理解的相同的含义。否则,本文使用的某些术语具有如说明书中示出的含义。
[0042]
必须注意,当用于本文和所附权利要求时,除非上下文另有明确规定,单数形式“一个(a)”、“一个(an)”和“这个(the)”包括复数指代。
[0043]
除非另有说明,任何数值,如本文描述的浓度或浓度范围,应当理解为在所有情况下均被术语“约”修饰。因此,数值通常包括所述值的
±
10%。例如,1mg/ml的浓度包括0.9mg/ml至1.1mg/ml。同样地,1%至10%(w/v)的浓度范围包括0.9%(w/v)至11%(w/v)。如本文所用,除非上下文另有明确指示,数值范围的使用明确包括所有可能的子范围,该范围内的所有单个数值,包括这类范围内的整数和值的分数。
[0044]
除非另有说明,一系列元素之前的术语“至少”应当理解为指该系列中的每个元素。本领域技术人员会认识到或者能够利用不超过常规实验确定本文所述的发明的具体实施方案的许多等同物。本发明意图涵盖这类等同物。
[0045]
如本文所用,术语“包含(comprises)”、“包含(comprising)”、“包括(includes)”、“包括(including)”、“具有(has)”、“具有(having)”、“含有(contains)”或“含有(containing)”,或者它们的任何其他变化,将理解为表示包括所述整数或整数的组但不排除任何其他整数或整数的组,并且意图是非排他的或开放的。例如,包含元素列表的组合物、混合物、过程、方法、物品或装置不必仅限于那些元素,而是可以包括未明确列出或者不是这种组合物、混合物、过程、方法、物品或装置固有的其他元素。此外,除非有相反的明确说明,“或”是指包含性的或而不是排除性的或。例如,条件a或b满足以下任一条件:a为真(或存在)且b为假(或不存在),a为假(或不存在)且b为真(或存在),以及a和b均为真(或存在)。
[0046]
如本文所用,多个引用元素之间的连接术语“和/或”理解为涵盖单独和组合选项。例如,当两个元素通过“和/或”连接时,第一选项是指没有第二元素的第一元素的适用性。第二选项是指没有第一元素的第二元素的适用性。第三选项是指第一和第二元素一起的适用性。这些选项中的任一种均理解为落在含义内,因此满足如本文所用的术语“和/或”的要求。一个以上选项的并发适用性也理解为落在含义内,因此满足术语“和/或”的要求。
[0047]
如本文所用,在整个说明书和权利要求书中使用时,术语“由
…
组成(consists of)”或者变化如“由
…
组成(consist of)”或“由
…
组成(consisting of)”表示包括任何列举的整数或整数组,但是没有额外的整数或整数组可以添加至指定的方法、结构或组合物。
[0048]
如本文所用,在整个说明书和权利要求书中使用时,术语“基本上由
…
组成(consists essentially of)”或者变化如“基本上由
…
组成(consist essentially of)”或“基本上由
…
组成(consisting essentially of)”表示包括任何列举的整数或整数组,并且任选地包括不实质性改变指定方法、结构或组合物的基本或新特性的任何列举的整数或整数组。参见m.p.e.p.
§
2111.03.
[0049]
如本文所用,“受试者”表示任何动物,优选哺乳动物,最优选人,其将会或已经通过本发明的实施方案的方法治疗。如本文所用的术语“哺乳动物”涵盖任何哺乳动物。哺乳动物的实例包括但不限于牛、马、绵羊、猪、猫、狗、小鼠、大鼠、兔、豚鼠、猴、人等,更优选人。
[0050]
词语“右”、“左”、“下”和“上”表示所参考的图中的方向。
[0051]
还应当理解当提到优选发明的组件的尺寸或特征时,本文使用的术语“约”、“大约”、“一般”、“基本上”和类似术语表示所描述的尺寸/特征不是严格的边界或参数,并且不排除功能上相同或相似的微小变化,如本领域普通技术人员会理解的。至少,包括数值参数的这类参考会包括使用本领域中接受的数学和工业原理(例如,四舍五入、测量或其他系统误差、制造公差等)不会改变最低有效数字的变化。
[0052]
如本文所用,在向受试者给予两种或更多种疗法的上下文中,术语“组合”是指使用一种以上疗法。术语“组合”的使用不限制向受试者给予疗法的顺序。例如,可以在向受试者给予第二疗法之前(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周之前)、同时或之后(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周之后)给予第一疗法(例如,本文描述的组合物)。
[0053]
如本文所用,术语“rild”或“放射诱发的肝病”是指在放射疗法(rt)的最初几周期间或之内的急性反应,或者作为rt之后数月的迟发反应。放射诱发的肝病(rild)的实例包括但不限于肝肿大、肝坏死、细胞凋亡、腹水、肝酶升高、血小板减少症、肝窦阻塞综合征(sos)、肝中心静脉闭塞病(vod)和肝纤维化。
[0054]
rild是rt的并发症之一。虽然rild通常在rt结束之后4
–
8周发生,但是已报道最早在rt之后2周或晚至7个月出现(guha et al.,seminars in oncology,2011,21(4):256
‑
263;khozouz et al.,j.clin.oncol.,2008,26(29):4844
‑
4845)。有两种类型的rild:经典rild和非经典rild。患有经典rild的患者通常在肝rt之后1
–
3个月出现疲劳、腹痛、腹围增加、肝肿大和无黄疸腹水的症状(lawrence et al.,int.j.radiat.oncol.biol.phys.,1995,31:1237
‑
48)。此外,碱性磷酸酶(alp)的水平比正常水平增加两倍以上,而转氨酶和胆红素的水平保持正常(liang et al.,radiother.oncol.,2011,98(2):265
‑
9)。经典rild的病理标志是肝静脉闭塞病(vod),其特征在于中心静脉腔被困在网硬蛋白和胶原纤维网络中的红细胞完全闭塞(reed et al.,am.j.pathol.,1966,48:597
–
611;ogata et al.,tokushima j.exp.med.,1963,10:240
–
251)。被困的红细胞产生血管充血,导致向中心区域输送的氧减少。这种缺氧环境导致小叶中心肝实质细胞的死亡和肝内板的萎缩,导致肝功能障碍。此外,有助于肝纤维化的肝星状细胞激活是患有经典rild的患者中的共同特征(sempoux et al.,hepatology,1997,26(1):128
‑
34)。发展非经典rild的患者有潜在的慢性肝病,如肝硬化和病毒性肝炎,并且表现出更多的肝功能失调,伴有黄疸和/或显著升高的血清转氨酶(与正常水平相比增加5倍以上)而不是alp(pan et al.,int.j.radiat.oncol.biol.phys.,2010,76:s94
‑
100;cheng et al.,int.j.radiat.oncol.biol.phys.,2004,60(5):1502
‑
9)。例如,在非经典rild中已检测到肝细胞丢失、肝功能障碍、肝窦内皮死亡和hsc激活。
[0055]
如本文所用,“sos”或“肝窦阻塞综合征”是指肝脏的静脉闭塞病(vod)。sos是一种独特且可能致死的肝损伤形式,其主要发生在暴露于放射模拟物质、放射或移植之后。sos可以以急性、亚急性或慢性形式出现,通常伴有腹痛和肿胀,伴有门脉高血压和不同程度的血清酶升高和黄疸。肝组织学证实具有肝实质细胞坏死和出血的中心区域的窦阻塞。
[0056]
放射疗法
[0057]
如本文所用,术语“trt”或“靶向放射疗法”是指使用电离辐射或放射模拟物质的疗法,其优先靶向或定位至特定器官或身体部位。其一般用作癌症治疗的一部分。trt如靶向电离放射疗法有时也称作放射治疗、放疗、放射或x
‑
射线疗法。靶向电离放射疗法主要分为三个部分:外部放射疗法(ebrt或xrt)、内部放射疗法和全身放射性同位素疗法。有时,放射可以分几次治疗进行,以递送相同或略高的剂量,这称作分次放射疗法。如本文所用,术语“放射模拟物质”或“放射模拟化学物质”是指当向受试者给药时产生与电离辐射相似的效果的化学物质。这种效果的实例包括dna损伤。放射模拟化学物质的实例包括但不限于依托泊苷、多柔比星、卡铂和博来霉素。可以将放射模拟化学物质如本文描述的那些局部给药至受试者,以便允许以治疗方式靶向应用所述试剂。
[0058]
外部放射疗法(ebrt)使用机器,所述机器将来自体外的高能射线引导至肿瘤中。当前的放射技术允许外部放射疗法的精确递送,如靶向放射疗法,其使用计算机产生肿瘤的3d图片,以便尽可能准确地靶向肿瘤并提供尽可能高剂量的放射,同时尽可能保留正常组织。ebrt的实例包括但不限于立体定向放射疗法、图像引导放射疗法(igrt)、调强放射疗法(imrt)、螺旋断层放射疗法、质子束放射疗法和术中放射疗法(iort)。其中,立体定向放射是一种专门类型的外部放射疗法。其使用聚焦放射束,利用非常详细的成像扫描靶向明确定义的肿瘤。有两种类型的立体定向放射:立体定向放射外科(srs)用于脑或脊柱的立体定向放射治疗,而立体定向身体放射疗法(sbrt)是指对体内器官如肺和肝的更精确的靶向放射治疗。
[0059]
内部放射也称作近距离放射疗法,其中将放射性植入物放入体内或靠近肿瘤。与外部放射治疗相比,其允许在更小的区域内接受更高剂量的放射。其使用通常密封在称作植入物的小容器中的放射源。不同类型的植入物可以称作颗粒、种子、带、线、针、胶囊、气球或管。内部放射的几个这类实例有y
‑
90sir
‑
sphere和/或thera
‑
sphere。
[0060]
经动脉化疗栓塞(tace)包括使用放射模拟化学疗法以治疗肝癌。
[0061]
靶向全身放射性同位素疗法(srt)也称作非密封源放射疗法。在srt中使用靶向放射性药物以全身性治疗某些类型的癌症,如胸腺、骨和前列腺。通常连接至靶向实体如单克隆抗体或细胞特异性配体的这些药物可以通过口服或静脉给药;然后它们通过身体直至到达期望的靶标,在那里药物会以相对较高的浓度积累。
[0062]
trt可能导致各种程度的肝功能代偿不全和rild的表现。rild可以临床表现为无黄疸腹水的发展。trt导致的rild是不期望的,并且需要缓解。
[0063]
但是,靶向照射可以用来使靶器官的内源细胞如患病肝脏的癌细胞生长不利,并且增强植入的健康细胞的生长。例如,预备性肝脏照射(hir)可以用于损伤宿主肝实质细胞并防止它们在有丝分裂刺激下增殖和与供体肝实质细胞竞争。预备性照射常用于骨髓移植(thomas,e.et al.,n.engl.j.med.,292:832
‑
843(1975))。预备性hir还用来促进啮齿动物模型中的肝实质细胞移植(参见,例如,guha,c.et al.,int.j.radiat.oncol.biol.phys.,49:451
‑
457(2001);takahashi,m.et al.,gene.ther.,10:304
‑
313(2003))。在人中,放射诱发的肝损伤是平均肝放射剂量和受照射的肝体积的函数(lawrence,t.et al.,int.j.radiat.oncol.biol.phys.,19:1041
‑
1047(1990);dawson,l.et al.,int.j.radiat.oncol.biol.phys.,53:810
‑
821(2002))。较低剂量的hir或部分肝脏照射对
于hir的临床应用是期望的。可以利用立体定向放射外科(srs)或3
‑
d适形trt(3
‑
d crt)技术在临床中安全地给予hir。因此,预备性hir可以用作应用方法的预备方案。
[0064]
部分肝脏照射在癌症患者中具有良好的耐受性,并且采用现代imrt技术。在临床中可以向患者安全地提供50gy以上的肝脏部分剂量。例如,据报道施用于肝脏前叶的hir可以诱导供体细胞的选择性叶再群体化(deb,n.et al.,hepatology,34(4):153a.,34:153a(2001))。因此预期部分肝脏照射可以用作应用方法的预备方案。
[0065]
如本文所用,“用靶向放射疗法治疗的受试者”是指正在接受靶向放射治疗的受试者,并且所述治疗可以在给药tpo模拟物之前、之后或同时进行。
[0066]
tpo模拟物
[0067]
如本文所用,“tpom”、“tpo模拟物”或“血小板生成素模拟物”是指包含能够结合并激活血小板生成素受体或c
‑
mpl的肽的化合物。优选地,在可用于本发明的tpo模拟物中,能够结合并激活血小板生成素受体的肽与血小板生成素(tpo)没有显著的同源性。与tpo缺少同源性降低产生针对内源性tpo的抗体的可能性。可用于tpo模拟物的这种肽的实例包括但不限于美国公开号2003/0158116;2005/0137133;2006/0040866;2006/0210542;2007/0148091;2008/0119384;美国专利号5,869,451;7,091,311;7,615,533;8,227,422;国际专利公开wo2007/021572;wo2007/094781和wo2009/148954中描述的那些,其全部内容援引加入本文。更优选地,在可用于本发明的tpo模拟物中,将能够结合并激活血小板生成素受体的肽共价连接至改善所述肽的一种或多种性质的部分。通过非限制性实例的方式,所述部分可以是亲水性聚合物,包括但不限于聚乙二醇(peg)、聚丙二醇、聚乳酸和聚乙醇酸。所述部分还可以是多肽,如fc区或白蛋白。
[0068]
在一优选实施方案中,可用于本发明的tpo模拟物包含具有以下氨基酸序列的肽:iegptlrqxaalaaryaa(seq id no:1),其中xaa是色氨酸(w)或β
‑
(2
‑
萘基)丙氨酸(在本文中称作“2
‑
nal”),并且yaa是丙氨酸(a)或肌氨酸(在本文中称作“sar”)。优选地,将seq id no:1的肽共价连接至peg或融合至fc结构域。
[0069]
在一些实施方案中,可用于本发明的tpo模拟物包含共价连接至peg的seq id no:1的肽,优选平均分子量为约5,000至约30,000道尔顿的peg。优选地,所述peg选自单甲氧基聚乙二醇(mepeg
‑
oh)、单甲氧基聚乙二醇
‑
琥珀酸酯(mepeg
‑
s)、单甲氧基聚乙二醇
‑
琥珀酰亚胺基琥珀酸酯(mepeg
‑
s
‑
nhs)、单甲氧基聚乙二醇
‑
胺(mepeg
‑
nh2)、单甲氧基聚乙二醇
‑
三氟乙磺酸酯(mepeg
‑
tres)和单甲氧基聚乙二醇
‑
咪唑基
‑
羰基(mepeg
‑
im)。肽的聚乙二醇化导致化合物的清除率降低而不损失效力。参见,例如,美国专利号7,576,056,其全部内容援引加入本文。
[0070]
在一优选实施方案中,可用于本发明的tpo模拟物是rwj
‑
800088或其衍生物。如本文所用,“rwj
‑
800088”是指如下的29元肽,其具有通过赖氨酰胺残基连接的两条相同的14
‑
元链(seq id no:2):
[0071]
[0072]
并且具有共价连接至每个n
‑
末端异亮氨酸的甲氧基聚(乙二醇)(mpeg),或者其药学可接受的盐或酯。因此rwj
‑
800088包含通过赖氨酰胺残基连接的两条seq id no:1的14个氨基酸肽链,其中xaa是2
‑
nal,yaa是sar,并且每个n
‑
末端异亮氨酸连接至甲氧基聚乙二醇(mpeg)链。因此,rwj
‑
800088的分子结构缩写为(mpeg
‑
ile
‑
glu
‑
gly
‑
pro
‑
thr
‑
leu
‑
arg
‑
gln
‑
(2
‑
nal)
‑
leu
‑
ala
‑
ala
‑
arg
‑
(sar))2‑
lys
‑
nh2;其中(2
‑
nal)是β
‑
(2
‑
萘基)丙氨酸,(sar)是肌氨酸,并且mpeg是甲氧基聚(乙二醇),或者其药学可接受的盐或酯。优选地,mpeg具有约20,000道尔顿的分子量或代表甲氧基聚乙二醇20000。
[0073]
在一实施方案中,rwj
‑
800088具有式(i)的分子结构,或者其药学可接受的盐或酯:
[0074][0075]
在一优选实施方案中,rwj
‑
800088中的mpeg是甲氧基聚乙二醇20000,并且rwj
‑
800088的化学全名是:甲氧基聚乙二醇20000
‑
丙酰基
‑
l
‑
异亮氨酰基
‑
l
‑
谷氨酰基
‑
甘氨酰基
‑
l
‑
脯氨酰基
‑
l
‑
苏氨酰基
‑
l
‑
亮氨酰基
‑
l
‑
精氨酰基
‑
l
‑
谷氨酰胺酰基
‑
l
‑2‑
萘基丙氨酰基
‑
l
‑
亮氨酰基
‑
l
‑
丙氨酰基
‑
l
‑
丙氨酰基
‑
l
‑
精氨酰基
‑
肌氨酰基
‑
ne
‑
(甲氧基聚乙二醇20000
‑
丙酰基
‑
l
‑
异亮氨酰基
‑
l
‑
谷氨酰基
‑
甘氨酰基
‑
l
‑
脯氨酰基
‑
l
‑
苏氨酰基
‑
l
‑
亮氨酰基
‑
l
‑
精氨酰基
‑
l
‑
谷氨酰胺酰基
‑
l
‑2‑
萘基丙氨酰基
‑
l
‑
亮氨酰基
‑
l
‑
丙氨酰基
‑
l
‑
丙氨酰基
‑
l
‑
精氨酰基
‑
肌氨酰基
‑
)
‑
赖氨酰胺,或者其药学可接受的盐或酯。不含peg的肽的分子量为3,295道尔顿,具有两条20,000道尔顿mpeg链的肽的分子量约为43,295道尔顿。
[0076]
在一些实施方案中,可用于本发明的tpo模拟物包含融合至fc结构域的seq id no:1的肽。将所述肽融合至fc结构域可以在体内稳定所述肽。参见,例如,美国专利号6,660,843,其全部内容援引加入本文。
[0077]
在另一优选实施方案中,可用于本发明的tpo模拟物是罗米司亭。如本文所用,“罗米司亭”是指具有连接至seq id no:1的肽的n
‑
末端异亮氨酸的fc结构域的融合蛋白,其中xaa是w且yaa是a。特别地,罗米司亭具有以下氨基酸序列:
[0078]
mdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkgggggiegptlrqwlaaraggggggggiegptlrqwlaara(seq id no:4),其具有
iegptlrqwlaara(seq id no:3)的血小板生成素受体结合结构域氨基酸序列。
[0079]
剂量和给药
[0080]
在本发明中,发明人发现tpo模拟物对rild具有显著的缓解作用,可以增强未受照射的肝叶的肥大并促进肝细胞的植入,如肝窦内皮细胞(lsec)。因此,本发明的方法包括向有此需要的受试者给药有效量的tpo模拟物,从而实现一种或多种有益结果,如在有此需要的受试者中,如用放射疗法治疗的受试者,或需要肝细胞移植的受试者,减轻一种或多种rild,促进肝细胞植入并增强未受照射的肝叶的肥大。
[0081]
例如,tpo模拟物可以作为药物组合物的活性成分与药物载剂或稀释剂一起给药。tpo模拟物可以通过口服、肺部、肠胃外(肌肉内(im)、腹腔内(ip)、静脉内(iv)或皮下(sc)注射)、吸入(通过细粉制剂)、透皮、鼻部、阴道、直肠或舌下给药途径给药,可以配制为适合每种给药途径的剂型。优选地,通过皮下注射给药tpo模拟物。例如,国际公开号wo1993/25221(bernstein et al.)公开了包含促红细胞生成素(epo)的可生物降解的聚合物微球,其可以通过肠胃外给药或肠给药,优选口服给药,进行体表、局部或全身给药。wo1994/17784(pitt et al.)公开了epo可以通过肺部途径全身给药,并且与其他epo给药方法相比,这种递送产生可比水平的治疗益处。相似的组合物和方法可以用于给药本发明的tpo模拟物。
[0082]
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这类固体剂型中,将活性肽化合物与至少一种药学可接受的载剂如蔗糖、乳糖或淀粉混合。按照常规做法,这类剂型还可以包含惰性稀释剂以外的其他物质,例如,润滑剂如硬脂酸镁。在胶囊剂、片剂和丸剂的情况下,所述剂型还可以包含缓冲剂。片剂和丸剂还可以用肠溶衣制备。
[0083]
用于口服给药的液体剂型包括药学可接受的乳剂、溶液剂、悬浮剂、糖浆剂和酏剂,包含本领域常用的惰性稀释剂,如水。除了这类惰性稀释剂外,组合物还可以包含佐剂,如润湿剂、乳化剂和助悬剂以及甜味剂、增香剂和芳香剂。
[0084]
用于肠胃外给药的制品包括无菌水性或非水性溶液、悬浮液或乳液。非水性溶剂或媒介物的实例有丙二醇、聚乙二醇、植物油如橄榄油和玉米油、明胶以及可注射的有机酯如油酸乙酯。这类剂型还可以包含佐剂如防腐剂、湿润剂、乳化剂和分散剂。它们可以通过例如通过细菌截留过滤器过滤、通过将灭菌剂掺入组合物、通过照射组合物或通过加热组合物来灭菌。它们还可以在使用前立即使用无菌水或一些其他无菌可注射介质制造。
[0085]
tpo模拟物的给药通常是肌肉内、皮下或静脉内。但是也可以设想其他给药模式如皮肤、皮内或鼻部给药。tpo模拟物的肌肉内给药可以通过使用针头注射tpo模拟物组合物的悬浮液来实现。一种替代方法是使用无针注射装置来给药组合物(使用例如biojector
tm
)或tpo模拟物组合物的冻干粉末。
[0086]
对于静脉内、皮肤或皮下注射,tpo模拟物组合物可以是无热原并且具有合适的ph、等渗性和稳定性的肠胃外可接受的水溶液形式。本领域技术人员能够很好地利用例如等渗媒介物如氯化钠注射液、林格氏注射液、乳酸林格氏注射液制备合适的溶液。根据需要,可以包括防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其他添加剂。还可以采用缓释制剂。
[0087]
用于直肠或阴道给药的组合物优选是栓剂,除了活性tpo模拟物,其可以包含赋形剂如可可脂或栓剂蜡。用于鼻部或舌下给药的组合物也用本领域公知的标准赋形剂制备。
[0088]
通常,给药会具有治疗和/或预防目的,以在放射疗法之前、期间或之后减轻受试
者中放射诱发的肝病。在治疗应用中,在暴露于放射疗法期间或之后向受试者给药tpo模拟物组合物,并且以足以治愈或至少部分缓解放射诱发的肝病、增加肝脏体积或者增强肥大和/或引起受试者肝中肝窦内皮细胞植入的量给药tpo模拟物组合物。在预防性应用中,在暴露于放射疗法之前向易患rild或有发展rild风险的受试者给药tpo模拟物组合物,并且在有此需要的受试者中在放射疗法后增强肝功能。在这些情况中的每种情况下,tpo模拟物组合物的量取决于暴露的状态和性质(例如,放射疗法的类型,暴露的剂量和时间长度)、受试者的身体特征(例如,身高、体重、疾病状态等)以及治疗的设计(例如,单独使用tpom或与另一治疗剂联合使用等)。
[0089]
向受试者给药包含tpo模拟物的药学可接受的组合物,导致减轻放射诱发的肝病,增加肝脏体积和/或在受试者的肝脏中植入肝窦内皮细胞。足以减轻疾病的组合物的量定义为组合物的“有效剂量”或“有效量”。
[0090]
实际给药量以及给药的速率和时间过程取决于所治疗的性质和严重程度。治疗处方,例如,剂量决定等,由全科医生和其他医生负责,或者在兽医方面由兽医负责,通常考虑放射疗法的类别和剂量、个体患者的状况、递送部位、给药方法和从业者已知的其他因素。上文提到的技术和方案的实例可以在remington's pharmaceutical sciences,16th edition,osol,a.ed.,1980中找到。
[0091]
在某些实施方案中,将tpo模拟物与肝细胞、它们的祖细胞或干细胞和/或一种或多种蛋白因子如vegf
‑
a、vegf
‑
e、fgf
‑
2、egf、mmp14、cxcr4拮抗剂、sdf1、gm
‑
csf、gcsf、flt3、r
‑
spondin1和双调蛋白联合给药至受试者。
[0092]
在某些实施方案中,给药tpom以促进肝细胞在有此需要的受试者中的植入。
[0093]
如本文所用,“植入(engraft)”或“植入(engraftment)”表示成为宿主器官的活体部分或附件。移植物可以与宿主器官原位或异位。
[0094]
如本文所用,“自体的”是指源自受试者或宿主的组织或细胞的生物物质或细胞。待植入受试者的离体肝细胞可以是自体的。
[0095]
如本文所用,“异源的”是指源自与受试者或宿主不同的物种或同一物种的不同个体的组织或细胞的生物物质或细胞(例如,同种异体的或异种的)。待植入受试者的离体肝细胞可以是异源的。
[0096]
在某些实施方案中,将tpom与肝细胞联合给药,所述肝细胞可以是肝脏中天然存在的任何细胞,包括肝窦内皮细胞(lsec)和肝实质细胞。
[0097]
在某些实施方案中,将tpom与肝窦内皮细胞(lsec)联合给药。在某些实施方案中,将tpom与肝实质细胞联合给药。在某些实施方案中,将tpom与lsec和肝实质细胞联合给药。lsec组成结构和功能独特的毛细血管网络,使特定器官如肝血管化。肝循环主要由lsec排列(lee,hepatology 45:817
‑
825(2007);klein,hepatology47:1018
‑
1031(2008)),每个肝实质细胞的位置都紧密细胞接近于(in close cellular proximity to)lsec。
[0098]
鉴于本公开,可用于本发明的细胞可以通过本领域已知的方法获得。例如,可以用改良的胶原酶灌注方法从哺乳动物器官或组织分离肝实质细胞,如berry和friend所述(takahashi,m.et al.,gene.ther.,10:304
‑
313(2003))。解离之后,可以通过尺寸对应于所关注的细胞的dacron网过滤,然后以50
×
g洗涤两次,每次1min。可以通过台盼蓝染料排除法确定细胞活力。通常,具有>90%活力的细胞可以用于移植,但是根据部位特异性方案
或疾病状态而有所不同。离体细胞可以是成人体细胞、成人祖细胞、成人干细胞、胚胎祖细胞或胚胎干细胞。这类细胞的来源是本领域技术人员公知的。
[0099]
可用于本发明的细胞还可以获得自商业来源。例如,lsec如sk
‑
hep
‑
1细胞可以获得自公认的保藏机构,如美国典型培养物保藏中心(atcc,manassas,va.,usa)以及其他来源。lsec还可以通过利用本领域已知的方法分化获得自多能细胞,例如但不限于人胚胎干细胞、诱导的多能干细胞等。
[0100]
用于离体生长细胞的合适的生长培养基是本领域公知的,并且公开于例如“culture of animal cells:a manual of basic technique and specialized applications”r.i.freshney,2010,wiley
‑
blackwell。每种细胞类型的最佳培养基可以获得自细胞的专业供应商(例如:atcc
‑
lgc,mi,italy;cdc,atlanta,ga.,usa)。例如,sk
‑
hep
‑
1细胞获得自atcc并在完全emem培养基中,在包含5%co2的加湿细胞培养箱中,在37℃下利用明胶包被的组织培养瓶培养。按照atcc提供的说明书,每2
‑
3天通过胰蛋白酶介导的分离对细胞进行传代培养。lsec的密度可以为约5
×
104个细胞/ml至约5
×
105个细胞/ml、约2.5
×
104个细胞/ml至约2.5
×
105个细胞/ml或约5
×
104个细胞/ml至约2
×
105个细胞/ml。为了获得最佳治疗,在某些实施方案中,可以考虑治疗的性质来优化细胞密度。
[0101]
在某些实施方案中,lsec细胞和/或肝实质细胞可以收获自患者并进行遗传修饰,然后移植回患者体内以治疗由于lsec和/或肝实质细胞遗传多态性导致的遗传疾病,如血友病、α1
‑
抗胰蛋白酶缺乏症、crigler
–
najjar综合征i型、家族性高胆固醇血症、因子vii缺乏症、糖原贮积病、婴儿呕吐病、原发性草酸中毒和苯丙酮尿症。
[0102]
将离体细胞引入受试者,数量取决于待植入的器官的细胞类型和条件以及对这种疗法的需要程度。例如,可以如前所述将离体细胞直接注射至受试者的靶器官中(guha,c.et al.,artificial organs,25:522
‑
528(2001))或者腹腔内或另一植入位点给药。它们还可以静脉内或门静脉内(在肝脏的情况下)给药。例如,当向大鼠给予肝实质细胞时,在乙醚麻醉下,可以暴露脾脏,并且可以将悬浮于0.5ml的rpmi 1640中的5
×
106个肝实质细胞注射入脾髓。一般来说,肝实质细胞可以在合适的培养基中施用,每次治疗提供1
×
105‑5×
109个细胞的单剂量或分剂量。单独或作为分剂量给药的总剂量可以为1
×
105至5
×
10
10
个离体细胞/kg体重;在一些实施方案中,单独或作为分剂量给药的总剂量可以为1
×
106至1
×
109个离体细胞/kg体重;在一些实施方案中,单独或作为分剂量给药的总剂量可以为1
×
107至5
×
108个离体细胞/kg体重。
[0103]
在一些实施方案中,鉴于本公开,lsec和/或肝实质细胞可以使用本领域已知的方法通过肝内给药来给药。lsec诱导肝实质细胞增殖并形成新组织。lsec本身也可以增殖为再生组织提供血管支持。优选地,lsec是vegfr2 ve
‑
钙粘着蛋白
vegfr
3
cd34
‑
因子viii
lsec。任选地,lsec可以与肝实质细胞和/或蛋白因子一起给药,如cxcr4拮抗剂、sdf1、vegf
‑
a、vegf
‑
e、fgf
‑
2、egf和mmp14中的一种或多种。
[0104]
根据本发明的实施方案可以与tpom联合使用的其他肝细胞包括例如肝实质细胞、肝干细胞、多能干细胞和表达外源多核苷酸序列的产物的重组肝细胞。鉴于本发明,可以使用本领域已知的方法获得这些细胞并将其给药至受试者。
[0105]
优选地,本技术的方法将离体细胞植入有此需要的受试者的肝脏,并且植入的细胞生长以提供或替代受损器官细胞的至少1%、5%、10%、20%、30%、40%、50%、60%、
70%、80%、90%或95%(或其间代表的任何范围)。被替代的细胞可以是与植入细胞相同的细胞类型。更优选地,植入的细胞生长至群体,所述群体的数量和活性足以改善与肝脏损伤相关的疾病状况或改进最初因肝脏损伤而受损的体内稳态(例如,葡萄糖、氨、血脂等的代谢)。通过离体细胞的再群体化通常可以提供器官特异性实质细胞。离体细胞对于器官可以是自体的或同种异体的。
[0106]
本领域已知的方法如组织学分析可以用来确定植入。例如,通过本领域普通技术人员已知的方法,通过使用抗原标记、鉴定植入和内源细胞之间的染色体或基因组核酸序列差异、荧光标记如gfp或者酶促标记如dppiv,或者根据离体细胞中存在且在宿主内源细胞中缺乏的功能性酶,可以区分植入的离体细胞和内源细胞。可以将器官的切片包埋在oct中,在液氮中冷冻,并且储存在
‑
70℃下,或者固定在福尔马林中用于石蜡包埋和标准h&e染色。对于肝脏,可以在标准组织病理学实验室中进行网硬蛋白和三色染色。
[0107]
各种模型系统可以用来检测供体肝细胞的植入和再群体化(repopulation)。例如,可以使用小鼠模型,其中将转基因的表达β
‑
半乳糖苷酶(b
‑
gal)(rosa)的c57b1/6肝实质细胞移植至野生型c57b1/6小鼠中。或者,可以将dppiv ve f344肝实质细胞移植至同属的dppiv
‑
ve f344宿主肝脏中。因为dppiv在肝实质细胞的胆管结构域中高表达,所以通过酶组织化学可以容易地检测到移植的细胞。此外,在表征非侵入性的、稳健的、预备性的肝实质细胞再群体化方案之后,可以进一步检测其在改善代谢肝病的啮齿动物模型中的有效性,如gunn大鼠,这是crigler
‑
najjar综合征的模型。可以在一种以上的物种中同时进行实验。
[0108]
在临床环境中,可以通过活组织检查用如上所述的分析评价植入。此外,临床测试可以用来评价植入器官为体内稳态支持的程度。与靶标或植入器官的功能相关的一个或多个临床参数的改进可以用来间接评价植入的效力。合适的临床测试会随器官而变化。
[0109]
在某些实施方案中,在lsec移植之前、之后或同时向受试者给药tpo模拟物。在某些实施方案中,在肝实质细胞移植之前、之后或同时向受试者给药tpo模拟物。
[0110]
在某些实施方案中,在lsec和肝实质细胞移植之前、之后或同时向受试者给药tpo模拟物。
[0111]
tpo模拟物还可以与一种或多种蛋白因子的给药联合给药,有或没有肝细胞移植。而且,如本领域技术人员已知的,某些物质可以刺激细胞生长或分裂。这类物质的实例包括但不限于肽因子。优选的刺激是组织特异性的和/或至少刺激待植入的离体细胞类型。适用于本发明的刺激包括蛋白因子如哺乳动物生长因子(例如hgf、egf、fgf、vegf、ngf)、il
‑
6、tnf
‑
α、循环肿瘤坏死因子(ctnf)、r
‑
spondin 1、noggin和tweak、生长受体配体和c
‑
met激活抗体。优选地,可用于本发明的蛋白因子包括刺激lsec生长的因子。这类蛋白因子的实例包括但不限于cxcr4拮抗剂、sdf1、vegf
‑
a、vegf
‑
e、fgf
‑
2、egf、mmp14、gm
‑
csf、gcsf、flt3、r
‑
spondin1和双调蛋白。其他优选的蛋白因子包括例如甲状腺激素(parashar,b.et al.,hepatology,32:206a(2000))或肝实质细胞生长因子(hgf)。生长因子可以是野生型(例如,人、灵长类、小鼠、大鼠等)或与野生型因子基本上相同。其可以由哺乳动物细胞内源性产生或重组制备。生长因子可以局部或全身给药。例如,tpo模拟物可以与cxcr4拮抗剂如普乐沙福一起给药。
[0112]
tpo模拟物可以与靶向放射疗法联合给药。
[0113]
在某些实施方案中,在靶向放射疗法之前24小时至之后24小时或与靶向放射疗法同时向受试者给药tpo模拟物。例如,在靶向放射疗法之前24、20、16、12、8、4、2、1、0.5或0.1小时(或其间代表的任何范围),或者在靶向放射疗法之后24、20、16、12、8、4、2、1、0.5或0.1小时(或其间代表的任何范围)向受试者给药tpo模拟物。优选地,在对受试者施用靶向放射疗法之前约24至约1小时(或其间代表的任何范围)向受试者给药tpo模拟物。
[0114]
鉴于本技术中的公开和本领域中的知识,在本技术的方法中可以使用任何合适剂量的放射。例如,可以进行hir的剂量反应研究(例如,10、20、30和50gy),以便确定允许有效供体细胞再群体化的最低hir剂量。为了研究对宿主肝实质细胞的放射损伤的性质,还可以用接受hir和tpom的小鼠进行实验,有或没有肝细胞移植和/或蛋白因子。可以在不同时间点(1d、2d、3d、1wk、3wk、6wk和12wk)将来自不同组群的动物处死,并且可以将肝脏切片用h&e染色用于组织病理学分析。可以进行brdu和tunel染色分别用于检测肝实质细胞增殖和凋亡。
[0115]
在某些实施方案中,靶向放射疗法是对肝脏的靶向放射,优选剂量为5
‑
70戈瑞(gy),如5、10、20、30、40、50、60或70gy(或其间代表的任何范围),以1至10个部分(fraction),如1、2、3、4、5、6、7、8、9或10个部分。在其他实施方案中,靶向放射疗法时预备性hir,优选较低剂量的hir,更优选使用立体定位放射外科(srs)或3
‑
d适形trt(3
‑
d crt)技术在临床中施用。在其他实施方案中,靶向放射疗法是使用imrt现代技术对部分肝脏施用的部分肝脏照射。
[0116]
在某些实施方案中,将tpo模拟物与靶向放射疗法联合给药。优选地,未受照射的肝叶的肥大补偿受照射的肝叶的退化(hypotrophy)。在其他实施方案中,在放射模拟物质或放射疗法之前或之后给药。
[0117]
任何合适的有效量的tpom均可以用于本技术的方法。鉴于本公开,可以使用本领域已知的方法确定这种有效量。在某些实施方案中,tpo模拟物的有效量为约1至约5μg/kg受试者体重,如1、2、3、4或5μg/kg受试者体重(或其间代表的任何范围)。在优选的实施方案中,tpo模拟物的有效量为约1至约3μg/kg受试者体重。
[0118]
在某些实施方案中,通过静脉内、肌肉内、皮内或皮下注射中的任一种向受试者给药有效量的tpo模拟物。在一优选实施方案中,通过皮下注射给药tpo模拟物。
[0119]
在生产tpo模拟物和任选地将tpo模拟物配制为组合物之后,可以向个体给药组合物,特别是人或另一灵长类。可以向人或另一哺乳动物给药,例如,小鼠、大鼠、仓鼠、豚鼠、兔、绵羊、山羊、马、牛、驴、猴、狗或猫。递送至非人哺乳动物不必为了治疗目的,但是可以用于实验环境,例如用于研究由于给药tpo模拟物而保护血管完整性的机制。
[0120]
本发明的tpo模拟物组合物可以单独给药或者与其他治疗或额外的治疗剂联合给药,根据待治疗的疾病状况同时或顺序给药。
[0121]
如本文所用,术语“额外的治疗剂”是指在本技术的方法中与tpo模拟物一起给药时已知或表现出有利特性的任何化合物或治疗剂。这类物质的实例包括但不限于镇痛剂、防腐剂、其他tpo模拟物、其他细胞因子、可溶性mpl受体、造血因子、白介素、蛋白因子或抗体以及化疗剂。其他细胞因子可以是干细胞因子(scf)、白介素3(il
‑
3)、cxcr4拮抗剂或flt
‑
3配体。参见例如,ku et al.,blood,87:4544
‑
4551(1996);sitnicka et al.,blood,87:4998
‑
5005(1996)。还可以给药其他物质如高剂量的皮质类固醇,尝试减少trt期间的肝
内炎症。
[0122]
如果期望,tpo模拟物组合物可以存在于试剂盒、包装或分配器中,其可以包含一个或多个单位剂型,所述单位剂型包含活性成分。例如,试剂盒可以包含金属或塑料薄膜,如透明包装。试剂盒、包装或分配器可以附有给药说明。试剂盒可以进一步包含至少一种额外的治疗剂或装置用于减轻毒性作用。试剂盒可以进一步包括额外的治疗剂,如本文描述的那些。试剂盒中包括的装置可以是例如容器、递送媒介物或给药装置。
[0123]
肝功能测试
[0124]
如本文所用,短语“肝功能”是指肝脏的功能,包括但不限于蛋白合成如血清蛋白,例如,白蛋白、凝血因子、碱性磷酸酶、氨基转移酶(例如,丙氨酸转氨酶、天冬氨酸转氨酶)、5
′‑
核苷酶、γ
‑
谷氨酰基转肽酶等,胆红素合成,胆固醇合成和胆汁酸合成;肝脏代谢功能,包括但不限于碳水化合物代谢、氨基酸和氨代谢、激素代谢以及脂质代谢;外源性药物的解毒;胆固醇、胆汁酸、磷脂和胆红素排泄功能;以及血流动力学功能,包括内脏和门静脉血流动力学。
[0125]
鉴于本公开,可以使用本领域已知的方法确定肝功能。可以使用监测任何丙氨酸氨基转移酶;天冬氨酸氨基转移酶;碱性磷酸酶;γ
‑
谷氨酰基转移酶、胆红素或氨的血液水平的标准肝功能测试。
[0126]
还可以测试再群体化的植入肝细胞如肝实质细胞和肝窦内皮细胞(lsec)的生理功能。可以根据已发表的方案在新鲜冷冻切片中检测移植细胞执行独特的肝实质细胞生化功能、白蛋白合成(白蛋白免疫染色)、葡萄糖代谢(葡萄糖
‑6‑
磷酸酶染色)和糖异生(糖原染色)的能力(laconi,e.et al.,am.j.pathol.,153:319
‑
329(1998))。在gunn大鼠中,高胆红素血症的改善可以用来指示移植肝实质细胞的再群体化程度和生理功能。在不同的时间点(1、2、3和6个月),将动物处死,并且可以通过测量肝活检样本中的ugt1a1活性,进行ugt1a1的免疫印迹分析和免疫组织化学以检测供体ugt1a1 ve肝实质细胞以及通过确定胆汁中胆红素葡糖苷酸的排泄来评价植入的正常肝实质细胞的功能。此外,可以测量血液中的血清透明质酸、白蛋白、转铁蛋白、ast、alt、ggt、gst
‑
pi或甲胎蛋白(afp)以检查肝脏的正常生理功能,并且确定放射损伤和肿瘤发生的任何潜在表现。可以进行肝脏活检的h&e染色以检查肝脏放射损伤和肿瘤发生的组织病理学证据。
[0127]
例如,肝窦内皮细胞(lsec)可以产生因子viii(fviii),其缺乏是a型血友病的特征。可以通过蛋白印迹以及血液和肝脏来源样品的mrna谱检测体循环和肝脏中的fviii来证实产生fviii的正常lsec的植入。在相关的临床环境中,可以用如上文所述的分析评价血友病小鼠模型(f8
tm1kaz
)中的lsec植入和因子viii的产生。此外,为了评价lsec的植入和恢复的生物学功能,可以对凝血因子进行尾静脉出血测试,并且还可以对肝脏进行免疫组织化学以染色lsec中fviii的存在。
[0128]
实施方案
[0129]
本发明还提供以下非限制性实施方案。
[0130]
实施方案1是一种减轻有此需要的受试者中放射诱发的肝病(rild)的方法,所述方法包括向所述受试者给药有效量的血小板生成素(tpo)模拟物,其中向所述受试者给药有效量的tpo模拟物减轻所述受试者中放射诱发的肝病。
[0131]
实施方案1(a)是实施方案1的方法,其中所述tpo模拟物包含具有seq id no:1的
氨基酸序列的肽。
[0132]
实施方案1(b)是实施方案1(a)的方法,其中所述肽具有seq id no:2的氨基酸序列。
[0133]
实施方案1(c)是实施方案1(a)或1(b)的方法,其中所述tpo模拟物进一步包含共价连接至所述肽的亲水聚合物。
[0134]
实施方案1(d)是实施方案1(c)的方法,其中所述亲水聚合物是以下任一种:i)聚乙二醇(peg),ii)聚丙二醇,iii)聚乳酸,或iv)聚乙醇酸。
[0135]
实施方案1(e)是实施方案1(d)的方法,其中所述亲水聚合物是peg。
[0136]
实施方案1(f)是实施方案1(e)的方法,其中所述peg是单甲氧基聚乙二醇(mepeg
‑
oh)、单甲氧基聚乙二醇
‑
琥珀酸酯(mepeg
‑
s)、单甲氧基聚乙二醇
‑
琥珀酰亚胺基琥珀酸酯(mepeg
‑
s
‑
nhs)、单甲氧基聚乙二醇
‑
胺(mepeg
‑
nh2)、单甲氧基聚乙二醇
‑
三氟乙磺酸酯(mepeg
‑
tres)或单甲氧基聚乙二醇
‑
咪唑基
‑
羰基(mepeg
‑
im)中的任一种。
[0137]
实施方案1(g)是实施方案1(e)的方法,其中所述peg是甲氧基聚(乙二醇)(mpeg)。
[0138]
实施方案1(h)是实施方案1(g)的方法,其中所述tpo模拟物是具有式(i)的分子结构的rwj
‑
800088,或者其药学可接受的盐或酯。
[0139]
实施方案1(i)是实施方案1(h)的方法,其中所述rwj
‑
800088中的mpeg是甲氧基聚乙二醇20000。
[0140]
实施方案1(j)是实施方案1(a)的方法,其中所述肽具有seq id no:3的氨基酸序列。
[0141]
实施方案1(k)是实施方案1(j)的方法,其中将所述肽融合至多肽。
[0142]
实施方案1(l)是实施方案1(k)的方法,其中所述多肽是fc结构域。
[0143]
实施方案1(m)是实施方案1(l)的方法,其中所述tpo模拟物是罗米司亭。
[0144]
实施方案1(m)(1)是实施方案1(m)的方法,其中罗米司亭包含seq id no:4的氨基酸序列。
[0145]
实施方案2是实施方案1
‑
1(m)(1)中任一项的方法,其中所述放射诱发的肝病是以下疾病中的任一种或多种:肝肿大、肝坏死、细胞凋亡、腹水、肝酶升高、血小板减少症、肝窦阻塞综合征(sos)和肝中心静脉闭塞病(vod)。
[0146]
实施方案2(a)是实施方案2的方法,其中所述放射诱发的肝病是肝肿大。
[0147]
实施方案2(b)是实施方案2的方法,其中所述放射诱发的肝病是腹水。
[0148]
实施方案2(c)是实施方案2的方法,其中所述放射诱发的肝病是肝酶升高。
[0149]
实施方案2(d)是实施方案2的方法,其中所述放射诱发的肝病是血小板减少症。
[0150]
实施方案2(e)是实施方案2的方法,其中所述放射诱发的肝病是肝窦阻塞综合征(sos)。
[0151]
实施方案2(f)是实施方案2的方法,其中所述放射诱发的肝病是肝中心静脉闭塞病(vod)。
[0152]
实施方案2(g)是实施方案2的方法,其中所述放射诱发的肝病是肝坏死。
[0153]
实施方案2(h)是实施方案2的方法,其中所述放射诱发的肝病是细胞凋亡。
[0154]
实施方案3是一种增强用靶向放射疗法治疗的受试者中未受照射的肝叶的肥大的方法,所述方法包括向所述受试者给药有效量的血小板生成素(tpo)模拟物,其中向所述受
试者给药有效量的tpo模拟物增强所述受试者中未受照射的肝叶的肥大。
[0155]
实施方案3(a)是实施方案3的方法,其中所述tpo模拟物包含具有seq id no:1的氨基酸序列的肽。
[0156]
实施方案3(b)是实施方案3(a)的方法,其中所述肽具有seq id no:2的氨基酸序列。
[0157]
实施方案3(c)是实施方案3(a)或1(b)的方法,其中所述tpo模拟物进一步包含共价连接至所述肽的亲水聚合物。
[0158]
实施方案3(d)是实施方案3(c)的方法,其中所述亲水聚合物是以下任一种:i)聚乙二醇(peg),ii)聚丙二醇,iii)聚乳酸,或iv)聚乙醇酸。
[0159]
实施方案3(e)是实施方案3(d)的方法,其中所述亲水聚合物是peg。
[0160]
实施方案3(f)是实施方案3(e)的方法,其中所述peg是单甲氧基聚乙二醇(mepeg
‑
oh)、单甲氧基聚乙二醇
‑
琥珀酸酯(mepeg
‑
s)、单甲氧基聚乙二醇
‑
琥珀酰亚胺基琥珀酸酯(mepeg
‑
s
‑
nhs)、单甲氧基聚乙二醇
‑
胺(mepeg
‑
nh2)、单甲氧基聚乙二醇
‑
三氟乙磺酸酯(mepeg
‑
tres)或单甲氧基聚乙二醇
‑
咪唑基
‑
羰基(mepeg
‑
im)中的任一种。
[0161]
实施方案3(g)是实施方案3(e)的方法,其中所述peg是甲氧基聚(乙二醇)(mpeg)。
[0162]
实施方案3(h)是实施方案3(g)的方法,其中所述tpo模拟物是具有式(i)的分子结构的rwj
‑
800088,或者其药学可接受的盐或酯。
[0163]
实施方案3(i)是实施方案3(h)的方法,其中所述rwj
‑
800088中的mpeg是甲氧基聚乙二醇20000。
[0164]
实施方案3(j)是实施方案3(a)的方法,其中所述肽具有seq id no:3的氨基酸序列。
[0165]
实施方案3(k)是实施方案3(j)的方法,其中将所述肽融合至多肽。
[0166]
实施方案3(l)是实施方案3(k)的方法,其中所述多肽是fc结构域。
[0167]
实施方案3(m)是实施方案3(l)的方法,其中所述tpo模拟物是罗米司亭。
[0168]
实施方案3(m)(1)是实施方案3(m)的方法,其中罗米司亭包含seq id no:4的氨基酸序列。
[0169]
实施方案3(n)是实施方案3
‑
3(m)(1)中任一项的方法,其中未受照射的肝叶的增强的肥大补偿所述受试者中受照射的肝叶的退化。
[0170]
实施方案4是实施方案1
‑
3(n)中任一项的方法,其中用靶向放射疗法治疗所述受试者的肝病。
[0171]
实施方案4(a)是实施方案4的方法,其中所述肝病是肝肿瘤。
[0172]
实施方案4(b)是实施方案4的方法,其中所述肝病是肝转移。
[0173]
实施方案4(c)是实施方案4的方法,其中所述肝病是肝癌。
[0174]
实施方案4(d)是实施方案4的方法,其中所述肝病是肝细胞癌(hcc)。
[0175]
实施方案4(e)是实施方案4的方法,其中所述肝病是遗传性病症。
[0176]
实施方案4(f)是实施方案4(e)的方法,其中所述遗传性病症导致蛋白缺乏。
[0177]
实施方案5是实施方案1
‑
3(n)中任一项的方法,其中用靶向放射疗法治疗所述受试者的胃肠癌。
[0178]
实施方案6是实施方案1
‑
3(n)中任一项的方法,其中用预备性照射治疗所述受试
者以进行骨髓移植。
[0179]
实施方案7是实施方案1
‑
3(n)中任一项的方法,其中用预备性肝脏照射(hir)治疗所述受试者以植入肝细胞。
[0180]
实施方案8是实施方案1
‑
7中任一项的方法,其中将tpo模拟物与肝窦内皮细胞(lsec)、肝实质细胞、肝干细胞、多能干细胞和表达外源多核苷酸序列的产物的重组肝细胞中的至少一种联合给药至所述受试者。
[0181]
实施方案8(a)是实施方案8的方法,其中将所述tpo模拟物与lsec联合给药至所述受试者。
[0182]
实施方案8(a)(1)是实施方案8(a)的方法,其中移植所述lsec。
[0183]
实施方案8(b)是实施方案8(a)(1)的方法,其中移植的lsec是自体的。
[0184]
实施方案8(c)是实施方案8(a)(1)的方法,其中移植的lsec是同种异体的。
[0185]
实施方案8(d)是实施方案8(a)(1)或8(c)的方法,其中移植的lsec是同基因的。
[0186]
实施方案8(e)是实施方案8
‑
8(d)中任一项的方法,其中将所述tpo模拟物与肝实质细胞联合给药至所述受试者。
[0187]
实施方案8(f)是实施方案8(e)的方法,其中移植所述肝实质细胞。
[0188]
实施方案8(f)(1)是实施方案8(f)的方法,其中移植的肝实质细胞是自体的。
[0189]
实施方案8(f)(2)是实施方案8(f)的方法,其中移植的肝实质细胞是同种异体的。
[0190]
实施方案8(f)(3)是实施方案8(f)或8(f)(2)的方法,其中移植的肝实质细胞是同基因的。
[0191]
实施方案8(g)是实施方案8
‑
8(f)(3)中任一项的方法,其中将所述tpo模拟物与肝干细胞联合给药至所述受试者。
[0192]
实施方案8(g)(1)是实施方案8(g)的方法,其中移植所述肝干细胞。
[0193]
实施方案8(g)(2)是实施方案8(g)(1)的方法,其中移植的肝干细胞是自体的。
[0194]
实施方案8(g)(3)是实施方案8(g)(1)的方法,其中移植的肝干细胞是同种异体的。
[0195]
实施方案8(g)(4)是实施方案8(g)(1)或8(g)(3)的方法,其中移植的肝干细胞是同基因的。
[0196]
实施方案8(h)是实施方案8
‑
8(g)(4)中任一项的方法,其中将所述tpo模拟物与多能干细胞联合给药至所述受试者。
[0197]
实施方案8(h)(1)是实施方案8(h)的方法,其中移植所述多能干细胞。
[0198]
实施方案8(h)(2)是实施方案8(h)(1)的方法,其中移植的多能干细胞是自体的。
[0199]
实施方案8(h)(3)是实施方案8(h)(1)的方法,其中移植的多能干细胞是同种异体的。
[0200]
实施方案8(h)(4)是实施方案8(h)(1)或8(h)(3)的方法,其中移植的多能干细胞是同基因的。
[0201]
实施方案8(i)是实施方案8
‑
8(h)(4)中任一项的方法,其中将所述tpo模拟物与表达外源多核苷酸序列的产物的重组肝细胞联合给药至所述受试者。
[0202]
实施方案8(i)(1)是实施方案8(i)的方法,其中移植所述重组肝细胞。
[0203]
实施方案8(i)(2)是实施方案8(i)(1)的方法,其中移植的重组肝细胞是自体的。
[0204]
实施方案8(i)(3)是实施方案8(i)(1)的方法,其中移植的重组肝细胞是同种异体的。
[0205]
实施方案8(i)(4)是实施方案8(i)(1)或8(i)(3)的方法,其中移植的重组肝细胞是同基因的。
[0206]
实施方案8(j)是实施方案8
‑
8(i)(4)中任一项的方法,其中还向所述受试者给药蛋白因子。
[0207]
实施方案8(k)是实施方案8(j)的方法,其中给药的蛋白因子是以下任一种:
[0208]
i.vegf
‑
a,
[0209]
ii.vegf
‑
e,
[0210]
iii.fgf
‑
2,
[0211]
iv.egf,
[0212]
v.mmp14,
[0213]
vi.cxcr4拮抗剂,
[0214]
vii.sdf1,
[0215]
viii.gm
‑
csf,
[0216]
ix.gcsf,
[0217]
x.flt3,
[0218]
xi.r
‑
spondin1,以及
[0219]
xii.双调蛋白。
[0220]
实施方案8(l)是实施方案8
‑
8(i)(4)中任一项的方法,其中还向受试者给药两种或更多种蛋白因子。
[0221]
实施方案8(m)是实施方案8(l)的方法,其中给药的蛋白因子是以下任两种:
[0222]
i.vegf
‑
a,
[0223]
ii.vegf
‑
e,
[0224]
iii.fgf
‑
2,
[0225]
iv.egf,
[0226]
v.mmp14,
[0227]
vi.cxcr4拮抗剂,
[0228]
vii.sdf1,
[0229]
viii.gm
‑
csf,
[0230]
ix.gcsf,
[0231]
x.flt3,
[0232]
xi.r
‑
spondin1,以及
[0233]
xii.双调蛋白。
[0234]
实施方案8(n)是实施方案8(l)的方法,其中给药的蛋白因子是以下任三种:
[0235]
i.vegf
‑
a,
[0236]
ii.vegf
‑
e,
[0237]
iii.fgf
‑
2,
[0238]
iv.egf,或者
[0239]
v.mmp14,
[0240]
vi.cxcr4拮抗剂,
[0241]
vii.sdf1,
[0242]
viii.gm
‑
csf,
[0243]
ix.gcsf,
[0244]
x.flt3,以及
[0245]
xi.r
‑
spondin1.
[0246]
xii.双调蛋白。
[0247]
实施方案8(o)是实施方案8(l)的方法,其中给药的蛋白因子是以下任四种:
[0248]
i.vegf
‑
a,
[0249]
ii.vegf
‑
e,
[0250]
iii.fgf
‑
2,
[0251]
iv.egf,
[0252]
v.mmp14,
[0253]
vi.cxcr4拮抗剂,
[0254]
vii.sdf1,
[0255]
viii.gm
‑
csf,
[0256]
ix.gcsf,
[0257]
x.flt3,
[0258]
xi.r
‑
spondin1,以及
[0259]
xii.双调蛋白。
[0260]
实施方案8(p)是实施方案8(l)的方法,其中给药的蛋白因子是以下任五种:
[0261]
i.vegf
‑
a,
[0262]
ii.vegf
‑
e,
[0263]
iii.fgf
‑
2,
[0264]
iv.egf,
[0265]
v.mmp14,
[0266]
vi.cxcr4拮抗剂,
[0267]
vii.sdf1,
[0268]
viii.gm
‑
csf,
[0269]
ix.gcsf,
[0270]
x.flt3,
[0271]
xi.r
‑
spondin1,以及
[0272]
xii.双调蛋白。
[0273]
实施方案8(q)是实施方案8(l)的方法,其中给药的蛋白因子是以下任六种:
[0274]
i.vegf
‑
a,
[0275]
ii.vegf
‑
e,
[0276]
iii.fgf
‑
2,
[0277]
iv.egf,
[0278]
v.mmp14,
[0279]
vi.cxcr4拮抗剂,
[0280]
vii.sdf1,
[0281]
viii.gm
‑
csf,
[0282]
ix.gcsf,
[0283]
x.flt3,
[0284]
xi.r
‑
spondin1,以及
[0285]
xii.双调蛋白。
[0286]
实施方案8(r)是实施方案8(l)的方法,其中给药的蛋白因子是以下任七种或更多种:
[0287]
i.vegf
‑
a,
[0288]
ii.vegf
‑
e,
[0289]
iii.fgf
‑
2,
[0290]
iv.egf,
[0291]
v.mmp14,
[0292]
vi.cxcr4拮抗剂,
[0293]
vii.sdf1,
[0294]
viii.gm
‑
csf,
[0295]
ix.gcsf,
[0296]
x.flt3,
[0297]
xi.r
‑
spondin1,以及
[0298]
xii.双调蛋白。
[0299]
实施方案9是实施方案8
‑
8(r)中任一项的方法,其中在给药所述tpo模拟物之前、之后或同时将所述lsec移植至所述受试者。
[0300]
实施方案9(a)是实施方案9的方法,其中在给药所述tpo模拟物之前将所述lsec所述移植至所述受试者。
[0301]
实施方案9(b)是实施方案9的方法,其中在给药所述tpo模拟物之后将所述lsec移植至所述受试者。
[0302]
实施方案9(c)是实施方案9的方法,其中在给药所述tpo模拟物的同时将所述lsec移植至所述受试者。
[0303]
实施方案10是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用靶向放射剂量之前至少约24小时至之后至少约24小时向所述受试者给药所述tpo模拟物。
[0304]
实施方案10(a)是实施方案10的方法,其中在向所述受试者施用放射剂量之前24小时至2小时向所述受试者给药所述tpo模拟物。
[0305]
实施方案10(a)(1)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前24小时向所述受试者给药所述tpo模拟物。
[0306]
实施方案10(a)(2)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前23小时向所述受试者给药所述tpo模拟物。
[0307]
实施方案10(a)(3)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用
放射剂量之前22小时向所述受试者给药所述tpo模拟物。
[0308]
实施方案10(a)(4)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前21小时向所述受试者给药所述tpo模拟物。
[0309]
实施方案10(a)(5)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前20小时向所述受试者给药所述tpo模拟物。
[0310]
实施方案10(a)(6)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前19小时向所述受试者给药所述tpo模拟物。
[0311]
实施方案10(a)(7)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前18小时向所述受试者给药所述tpo模拟物。
[0312]
实施方案10(a)(8)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前17小时向所述受试者给药所述tpo模拟物。
[0313]
实施方案10(a)(9)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前16小时向所述受试者给药所述tpo模拟物。
[0314]
实施方案10(a)(10)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前15小时向所述受试者给药所述tpo模拟物。
[0315]
实施方案10(a)(11)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前14小时向所述受试者给药所述tpo模拟物。
[0316]
实施方案10(a)(12)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前13小时向所述受试者给药所述tpo模拟物。
[0317]
实施方案10(a)(13)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前12小时向所述受试者给药所述tpo模拟物。
[0318]
实施方案10(a)(14)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前11小时向所述受试者给药所述tpo模拟物。
[0319]
实施方案10(a)(15)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前10小时向所述受试者给药所述tpo模拟物。
[0320]
实施方案10(a)(16)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前9小时向所述受试者给药所述tpo模拟物。
[0321]
实施方案10(a)(17)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前8小时向所述受试者给药所述tpo模拟物。
[0322]
实施方案10(a)(18)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前7小时向所述受试者给药所述tpo模拟物。
[0323]
实施方案10(a)(19)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前6小时向所述受试者给药所述tpo模拟物。
[0324]
实施方案10(a)(20)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前5小时向所述受试者给药所述tpo模拟物。
[0325]
实施方案10(a)(21)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前4小时向所述受试者给药所述tpo模拟物。
[0326]
实施方案10(a)(22)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前3小时向所述受试者给药所述tpo模拟物。
[0327]
实施方案10(a)(23)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前2小时向所述受试者给药所述tpo模拟物。
[0328]
实施方案10(a)(24)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前1小时向所述受试者给药所述tpo模拟物。
[0329]
实施方案10(a)(25)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前30分钟向所述受试者给药所述tpo模拟物。
[0330]
实施方案10(a)(26)是实施方案4
‑
9(c)中任一项的方法,其中在向所述受试者施用放射剂量之前15分钟向所述受试者给药所述tpo模拟物。
[0331]
实施方案10(b)是实施方案10的方法,其中在向所述受试者施用放射剂量之后0.1
‑
2小时向所述受试者给药所述tpo模拟物。
[0332]
实施方案10(c)是实施方案10
‑
10(b)中任一项的方法,其中用靶向放射疗法治疗所述受试者。
[0333]
实施方案10(d)是实施方案10
‑
10(b)中任一项的方法,其中用立体定向放射疗法治疗所述受试者。
[0334]
实施方案10(e)是实施方案10
‑
10(b)中任一项的方法,其中用经动脉化疗栓塞(tace)治疗所述受试者。
[0335]
实施方案11是实施方案10
‑
10(e)中任一项的方法,其中所述放射剂量是10
‑
70戈瑞(gy)。
[0336]
实施方案11(a)是实施方案11的方法,其中所述放射剂量是10戈瑞(gy)。
[0337]
实施方案11(b)是实施方案11的方法,其中所述放射剂量是20戈瑞(gy)。
[0338]
实施方案11(c)是实施方案11的方法,其中所述放射剂量是30戈瑞(gy)。
[0339]
实施方案11(d)是实施方案11的方法,其中所述放射剂量是40戈瑞(gy)。
[0340]
实施方案11(e)是实施方案11的方法,其中所述放射剂量是50戈瑞(gy)。
[0341]
实施方案11(f)是实施方案11的方法,其中所述放射剂量是60戈瑞(gy)。
[0342]
实施方案11(g)是实施方案11的方法,其中所述放射剂量是70戈瑞(gy)。
[0343]
实施方案11(h)是实施方案11
‑
11(g)中任一项的方法,其中将所述放射剂量以1
‑
10个部分施用至所述受试者。
[0344]
实施方案12是实施方案1
‑
11(h)中任一项的方法,其中所述tpo模拟物的有效量为约1至约5μg/kg受试者体重。
[0345]
实施方案12(a)是实施方案12的方法,其中所述tpo模拟物的有效量为约1μg/kg受试者体重。
[0346]
实施方案12(b)是实施方案12的方法,其中所述tpo模拟物的有效量为约2μg/kg受试者体重。
[0347]
实施方案12(c)是实施方案12的方法,其中所述tpo模拟物的有效量为约3μg/kg受试者体重。
[0348]
实施方案12(d)是实施方案12的方法,其中所述tpo模拟物的有效量为约4μg/kg受试者体重。
[0349]
实施方案12(e)是实施方案12的方法,其中所述tpo模拟物的有效量为约5μg/kg受试者体重。
[0350]
实施方案13是实施方案1
‑
12(e)中任一项的方法,其中将有效量的tpo模拟物通过静脉内、肌肉内、皮内或皮下注射中的任一种给药至所述受试者。
[0351]
实施方案13(a)是实施方案13的方法,其中将有效量的tpo模拟物通过皮下注射给药至所述受试者。
[0352]
实施方案13(b)是实施方案13的方法,其中将有效量的tpo模拟物通过静脉内注射给药至所述受试者。
[0353]
实施方案13(c)是实施方案13的方法,其中将有效量的tpo模拟物通过肌肉内注射给药至所述受试者。
[0354]
实施方案13(d)是实施方案13的方法,其中将有效量的tpo模拟物通过皮内注射给药至所述受试者。
[0355]
实施方案14是一种促进有此需要的受试者中的肝细胞植入的方法,所述方法包括:
[0356]
a)向所述受试者施用靶向放射;
[0357]
b)向所述受试者给药肝细胞;以及
[0358]
c)向所述受试者给药有效量的血小板生成素(tpo)模拟物。
[0359]
从而促进所述肝细胞在所述受试者肝脏中的植入。
[0360]
实施方案14(a)是实施方案14的方法,其中所述tpo模拟物包含具有seq id no:1的氨基酸序列的肽。
[0361]
实施方案14(b)是实施方案14(a)的方法,其中所述肽具有seq id no:2的氨基酸序列。
[0362]
实施方案14(c)是实施方案14(a)或14(b)的方法,其中所述tpo模拟物进一步包含共价连接至所述肽的亲水聚合物。
[0363]
实施方案14(d)是实施方案14(c)的方法,其中所述亲水聚合物是聚乙二醇(peg)、聚丙二醇、聚乳酸和聚乙醇酸中的任一种。
[0364]
实施方案14(e)是实施方案14(d)的方法,其中所述亲水聚合物是peg。
[0365]
实施方案14(f)是实施方案14(e)的方法,其中所述peg是单甲氧基聚乙二醇(mepeg
‑
oh)、单甲氧基聚乙二醇
‑
琥珀酸酯(mepeg
‑
s)、单甲氧基聚乙二醇
‑
琥珀酰亚胺基琥珀酸酯(mepeg
‑
s
‑
nhs)、单甲氧基聚乙二醇
‑
胺(mepeg
‑
nh2)、单甲氧基聚乙二醇
‑
三氟乙磺酸酯(mepeg
‑
tres)或单甲氧基聚乙二醇
‑
咪唑基
‑
羰基(mepeg
‑
im)中的任一种。
[0366]
实施方案14(g)是实施方案14(e)的方法,其中所述peg是甲氧基聚(乙二醇)(mpeg)。
[0367]
实施方案14(h)是实施方案14(g)的方法,其中所述tpo模拟物是具有式(i)的分子结构的rwj
‑
800088,或者其药学可接受的盐或酯。
[0368]
实施方案14(i)是实施方案14(h)的方法,其中所述rwj
‑
800088中的mpeg是甲氧基聚乙二醇20000。
[0369]
实施方案14(j)是实施方案14(a)的方法,其中所述肽具有seq id no:3的氨基酸序列。
[0370]
实施方案14(k)是实施方案14(j)的方法,其中将所述肽融合至多肽。
[0371]
实施方案14(l)是实施方案14(k)的方法,其中所述多肽是fc结构域。
[0372]
实施方案14(m)是实施方案14(l)的方法,其中所述tpo模拟物是罗米司亭。
[0373]
实施方案14(m)(1)是实施方案14(m)的方法,其中罗米司亭包含seq id no:4的氨基酸序列。
[0374]
实施方案14(n)是实施方案14
‑
14(m)(1)中任一项的方法,其中植入所述肝细胞并使其生长以提供或代替至少5%、10%、20%、30%、40%、50%、60%、70%、80%,90%或95%(或其间代表的任何范围)受损肝脏的细胞。
[0375]
实施方案14(n)(1)是实施方案14
‑
14(m)(1)中任一项的方法,其中植入所述肝细胞并使其生长以重新建立至少5%、10%、20%、30%、40%、50%、60%、70%、80%,90%或95%(或其间代表的任何范围)受损肝脏的功能。
[0376]
实施方案14(n)(2)是实施方案14
‑
14(m)(1)中任一项的方法,其中植入所述肝细胞并使其再生回至少5%、10%、20%、30%、40%、50%、60%、70%、80%,90%或95%(或其间代表的任何范围)受损肝脏的大小。
[0377]
实施方案14(o)是实施方案14
‑
14(n)(2)中任一项的方法,其中植入所述肝细胞并改善与向肝脏施用靶向放射相关的疾病状况。
[0378]
实施方案14(o)(1)是实施方案14(o)的方法,其中与向肝脏施用靶向放射相关的疾病状况改变葡萄糖代谢。
[0379]
实施方案14(o)(2)是实施方案14(o)的方法,其中与向肝脏施用靶向放射相关的疾病状况改变所述受试者血液中氨的正常水平。
[0380]
实施方案14(o)(3)是实施方案14(o)的方法,其中与向肝脏施用靶向放射相关的疾病状况改变所述受试者血液中脂质的正常水平。
[0381]
实施方案14(p)是实施方案14
‑
14(n)(2)中任一项的方法,其中植入所述肝细胞并在所述受试者中产生因子viii。
[0382]
实施方案14(p)(1)是实施方案14(p)的方法,其中所述肝细胞是lsec,优选功能性lsec。
[0383]
实施方案14(p)(2)是实施方案14(p)
‑
14(p)(1)中任一项的方法,其中所述方法促进lsec的植入。
[0384]
实施方案14(p)(3)是实施方案14(p)
‑
14(p)(2)中任一项的方法,其中所述方法促进因子viii的产生。
[0385]
实施方案14(q)是实施方案14
‑
14(p)(3)中任一项的方法,其中在给药所述肝细胞之前将所述tpo模拟物给药至所述受试者。
[0386]
实施方案14(r)是实施方案14
‑
14(p)(3)中任一项的方法,其中在给药所述肝细胞之后将所述tpo模拟物给药至所述受试者。
[0387]
实施方案14(r)是实施方案14
‑
14(o)(3)中任一项的方法,其中在给药所述肝细胞的同时将所述tpo模拟物给药至所述受试者。
[0388]
实施方案15是一种减少用靶向放射治疗的受试者中的窦阻塞的方法,所述方法包括:
[0389]
a)向所述受试者给药肝细胞和蛋白因子中的至少一种;以及
[0390]
b)向所述受试者给药有效量的血小板生成素(tpo)模拟物,
[0391]
从而减少窦阻塞。
[0392]
实施方案15(a)是实施方案15的方法,其中所述tpo模拟物包含具有seq id no:1的氨基酸序列的肽。
[0393]
实施方案15(b)是实施方案15(a)的方法,其中所述肽具有seq id no:2的氨基酸序列。
[0394]
实施方案15(c)是实施方案15(a)或15(b)的方法,其中所述tpo模拟物进一步包含共价连接至所述肽的亲水聚合物。
[0395]
实施方案15(d)是实施方案15(c)的方法,其中所述亲水聚合物是聚乙二醇(peg)、聚丙二醇、聚乳酸和聚乙醇酸中的任一种。
[0396]
实施方案15(e)是实施方案15(d)的方法,其中所述亲水聚合物是peg。
[0397]
实施方案15(f)是实施方案15(e)的方法,其中所述peg是单甲氧基聚乙二醇(mepeg
‑
oh)、单甲氧基聚乙二醇
‑
琥珀酸酯(mepeg
‑
s)、单甲氧基聚乙二醇
‑
琥珀酰亚胺基琥珀酸酯(mepeg
‑
s
‑
nhs)、单甲氧基聚乙二醇
‑
胺(mepeg
‑
nh2)、单甲氧基聚乙二醇
‑
三氟乙磺酸酯(mepeg
‑
tres)或单甲氧基聚乙二醇
‑
咪唑基
‑
羰基(mepeg
‑
im)中的任一种。
[0398]
实施方案15(g)是实施方案15(e)的方法,其中所述peg是甲氧基聚(乙二醇)(mpeg)。
[0399]
实施方案15(h)是实施方案15(g)的方法,其中所述tpo模拟物是具有式(i)的分子结构的rwj
‑
800088,或者其药学可接受的盐或酯。
[0400]
实施方案15(i)是实施方案15(h)的方法,其中所述rwj
‑
800088中的mpeg是甲氧基聚乙二醇20000。
[0401]
实施方案15(j)是实施方案15(a)的方法,其中所述肽具有seq id no:3的氨基酸序列。
[0402]
实施方案15(k)是实施方案15(j)的方法,其中将所述肽融合至多肽。
[0403]
实施方案15(l)是实施方案15(k)的方法,其中所述多肽是fc结构域。
[0404]
实施方案15(m)是实施方案15(l)的方法,其中所述tpo模拟物是罗米司亭。
[0405]
实施方案15(m)(1)是实施方案15(m)的方法,其中罗米司亭包含seq id no:4的氨基酸序列。
[0406]
实施方案15(n)是实施方案15
‑
15(m)(1)中任一项的方法,所述方法包括:(a)向所述受试者给药至少一种蛋白因子;以及(b)向所述受试者给药有效量的tpo模拟物。
[0407]
实施方案15(o)是实施方案15
‑
15(m)(1)中任一项的方法,所述方法包括:(a)向所述受试者给药肝细胞;以及(b)向所述受试者给药有效量的tpo模拟物。
[0408]
实施方案15(p)是实施方案15
‑
15(m)(1)中任一项的方法,所述方法包括:(a)向所述受试者给药肝细胞和至少一种蛋白因子;以及(b)向所述受试者给药有效量的tpo模拟物。
[0409]
实施方案15(q)是实施方案15(o)或15(p)的方法,其中在给药所述肝细胞之前将所述tpo模拟物给药至所述受试者。
[0410]
实施方案15(r)是实施方案15(o)或15(p)的方法,其中在给药所述肝细胞之后将所述tpo模拟物给药至所述受试者。
[0411]
实施方案15(s)是实施方案15(o)或15(p)的方法,其中在给药所述肝细胞的同时将所述tpo模拟物给药至所述受试者。
[0412]
实施方案16是实施方案14
‑
15(s)中任一项的方法,其中所述肝细胞是肝窦内皮细胞(lsec)、肝实质细胞、肝干细胞、多能干细胞和表达外源多核苷酸序列的产物的重组肝细胞中的至少一种。
[0413]
实施方案16(a)是实施方案16的方法,其中将所述tpo模拟物与lsec联合给药至所述受试者。
[0414]
实施方案16(a)(1)是实施方案16(a)的方法,其中移植所述lsec。
[0415]
实施方案16(b)是实施方案16(a)(1)的方法,其中移植的lsec是自体的。
[0416]
实施方案16(c)是实施方案16(a)(1)的方法,其中移植的lsec是同种异体的。
[0417]
实施方案16(d)是实施方案16(a)(1)或16(c)的方法,其中移植的lsec是同基因的。
[0418]
实施方案16(e)是实施方案16
‑
16(d)中任一项的方法,其中将所述tpo模拟物与肝实质细胞联合给药至所述受试者。
[0419]
实施方案16(f)是实施方案16(e)的方法,其中移植所述肝实质细胞。
[0420]
实施方案16(f)(1)是实施方案16(f)的方法,其中移植的肝实质细胞是自体的。
[0421]
实施方案16(f)(2)是实施方案16(f)的方法,其中移植的肝实质细胞是同种异体的。
[0422]
实施方案16(f)(3)是实施方案16(f)或16(f)(2)的方法,其中移植的肝实质细胞是同基因的。
[0423]
实施方案16(g)是实施方案16
‑
16(f)(3)中任一项的方法,其中将所述tpo模拟物与肝干细胞联合给药至所述受试者。
[0424]
实施方案16(g)(1)是实施方案16(g)的方法,其中移植所述肝干细胞。
[0425]
实施方案16(g)(2)是实施方案16(g)(1)的方法,其中移植的肝干细胞是自体的。
[0426]
实施方案16(g)(3)是实施方案16(g)(1)的方法,其中移植的肝干细胞是同种异体的。
[0427]
实施方案16(g)(4)是实施方案16(g)(1)或16(g)(3)的方法,其中移植的肝干细胞是同基因的。
[0428]
实施方案16(h)是实施方案16
‑
16(g)(4)中任一项的方法,其中将所述tpo模拟物与多能干细胞联合给药至所述受试者。
[0429]
实施方案16(h)(1)是实施方案16(h)的方法,其中移植所述多能干细胞。
[0430]
实施方案16(h)(2)是实施方案16(h)(1)的方法,其中移植的多能干细胞是自体的。
[0431]
实施方案16(h)(3)是实施方案16(h)(1)的方法,其中移植的多能干细胞是同种异体的。
[0432]
实施方案16(h)(4)是实施方案16(h)(1)或16(h)(3)的方法,其中移植的多能干细胞是同基因的。
[0433]
实施方案16(i)是实施方案16
‑
16(h)(4)中任一项的方法,其中将所述tpo模拟物与表达外源多核苷酸序列的产物的重组肝细胞联合给药至所述受试者。
[0434]
实施方案16(i)(1)是实施方案16(i)的方法,其中移植所述重组肝细胞。
[0435]
实施方案16(i)(2)是实施方案16(i)(1)的方法,其中移植的重组肝细胞是自体
的。
[0436]
实施方案16(i)(3)是实施方案16(i)(1)的方法,其中移植的重组肝细胞是同种异体的。
[0437]
实施方案16(i)(4)是实施方案16(i)(1)或16(i)(3)的方法,其中移植的重组肝细胞是同基因的。
[0438]
实施方案16(j)是实施方案16
‑
16(i)(4)中任一项的方法,其中还向所述受试者给药蛋白因子。
[0439]
实施方案16(k)是实施方案16(j)的方法,其中给药的蛋白因子是以下任一种:
[0440]
i.vegf
‑
a,
[0441]
ii.vegf
‑
e,
[0442]
iii.fgf
‑
2,
[0443]
iv.egf,
[0444]
v.mmp14,
[0445]
vi.cxcr4拮抗剂,
[0446]
vii.sdf1,
[0447]
viii.gm
‑
csf,
[0448]
ix.gcsf,
[0449]
x.flt3,
[0450]
xi.r
‑
spondin1,以及
[0451]
xii.双调蛋白。
[0452]
实施方案16(l)是实施方案16
‑
16(i)(4)中任一项的方法,其中还向所述受试者给药两种或更多种蛋白因子。
[0453]
实施方案16(m)是实施方案16(l)的方法,其中给药的蛋白因子是以下任两种:
[0454]
i.vegf
‑
a,
[0455]
ii.vegf
‑
e,
[0456]
iii.fgf
‑
2,
[0457]
iv.egf,
[0458]
v.mmp14,
[0459]
vi.cxcr4拮抗剂,
[0460]
vii.sdf1,
[0461]
viii.gm
‑
csf,
[0462]
ix.gcsf,
[0463]
x.flt3,
[0464]
xi.r
‑
spondin1,以及
[0465]
xii.双调蛋白。
[0466]
实施方案16(n)是实施方案16(l)的方法,其中给药的蛋白因子是以下任三种:
[0467]
i.vegf
‑
a,
[0468]
ii.vegf
‑
e,
[0469]
iii.fgf
‑
2,
[0470]
iv.egf,或者
[0471]
v.mmp14,
[0472]
vi.cxcr4拮抗剂,
[0473]
vii.sdf1,
[0474]
viii.gm
‑
csf,
[0475]
ix.gcsf,
[0476]
x.flt3,
[0477]
xi.r
‑
spondin1,以及
[0478]
xii.双调蛋白。
[0479]
实施方案16(o)是实施方案16(l)的方法,其中给药的蛋白因子是以下任四种:
[0480]
i.vegf
‑
a,
[0481]
ii.vegf
‑
e,
[0482]
iii.fgf
‑
2,
[0483]
iv.egf,
[0484]
v.mmp14,
[0485]
vi.cxcr4拮抗剂,
[0486]
vii.sdf1,
[0487]
viii.gm
‑
csf,
[0488]
ix.gcsf,
[0489]
x.flt3,
[0490]
xi.r
‑
spondin1,以及
[0491]
xii.双调蛋白。
[0492]
实施方案16(p)是实施方案16(l)的方法,其中给药的蛋白因子是以下任五种:
[0493]
i.vegf
‑
a,
[0494]
ii.vegf
‑
e,
[0495]
iii.fgf
‑
2,
[0496]
iv.egf,
[0497]
v.mmp14,
[0498]
vi.cxcr4拮抗剂,
[0499]
vii.sdf1,
[0500]
viii.gm
‑
csf,
[0501]
ix.gcsf,
[0502]
x.flt3,
[0503]
xi.r
‑
spondin1,以及
[0504]
xii.双调蛋白。
[0505]
实施方案16(q)是实施方案16(l)的方法,其中给药的蛋白因子是以下任六种:
[0506]
i.vegf
‑
a,
[0507]
ii.vegf
‑
e,
[0508]
iii.fgf
‑
2,
[0509]
iv.egf,
[0510]
v.mmp14,
[0511]
vi.cxcr4拮抗剂,
[0512]
vii.sdf1,
[0513]
viii.gm
‑
csf,
[0514]
ix.gcsf,
[0515]
x.flt3,
[0516]
xi.r
‑
spondin1,以及
[0517]
xii.双调蛋白
[0518]
实施方案16(r)是实施方案16(l)的方法,其中给药的蛋白因子是以下任七种或更多种:
[0519]
i.vegf
‑
a,
[0520]
ii.vegf
‑
e,
[0521]
iii.fgf
‑
2,
[0522]
iv.egf,
[0523]
v.mmp14,
[0524]
vi.cxcr4拮抗剂,
[0525]
vii.sdf1,
[0526]
viii.gm
‑
csf,
[0527]
ix.gcsf,
[0528]
x.flt3,
[0529]
xi.r
‑
spondin1,以及
[0530]
xii.双调蛋白。
[0531]
实施方案16(s)是实施方案16
‑
16(i)(4)中任一项的方法,其中向所述受试者给药适合将造血干细胞动员至血流中的物质。
[0532]
实施方案16(t)是实施方案16(s)的方法,其中在放射疗法之后将所述物质给药至所述受试者。
[0533]
实施方案16(u)是实施方案16(s)或16(t)的方法,其中所述物质是cxcr4拮抗剂。
[0534]
实施方案16(v)是16(s)
‑
16(u)中任一项的实施方案的方法,其中所述物质是普乐沙福。
[0535]
实施方案17是实施方案14
‑
16(v)中任一项的方法,其中用靶向放射疗法治疗所述受试者的肝病。
[0536]
实施方案17(a)是实施方案17的方法,其中所述肝病是肝肿瘤。
[0537]
实施方案17(b)是实施方案17的方法,其中所述肝病是肝转移。
[0538]
实施方案17(c)是实施方案17的方法,其中所述肝病是肝癌。
[0539]
实施方案17(d)是实施方案17的方法,其中所述肝病是肝细胞癌(hcc)。
[0540]
实施方案17(e)是实施方案17的方法,其中所述肝病是遗传性病症。
[0541]
实施方案17(f)是实施方案17(e)的方法,其中所述遗传性病症导致蛋白缺乏。
[0542]
实施方案17(g)是实施方案14
‑
16(r)中任一项的方法,其中用靶向放射疗法治疗
所述受试者的a型血友病。
[0543]
实施方案18是实施方案14
‑
16(r)中任一项的方法,其中用靶向放射疗法治疗所述受试者的胃肠癌。
[0544]
实施方案19是实施方案14
‑
16(r)中任一项的方法,其中用预备性照射治疗所述受试者以进行骨髓移植。
[0545]
实施方案20是实施方案14
‑
16(r)中任一项的方法,其中用预备性肝脏照射(hir)治疗所述受试者以植入肝细胞。
[0546]
实施方案21是实施方案16
‑
20中任一项的方法,其中在移植lsec之前、之后或同时将所述tpo模拟物给药至所述受试者。
[0547]
实施方案21(a)是实施方案21的方法,其中在移植lsec之前将所述tpo模拟物给药至所述受试者。
[0548]
实施方案21(b)是实施方案21的方法,其中在移植lsec之后将所述tpo模拟物给药至所述受试者。
[0549]
实施方案21(c)是实施方案21的方法,其中在移植lsec的同时将所述tpo模拟物给药至所述受试者。
[0550]
实施方案22是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前至少约24小时至之后至少约24小时向所述受试者给药所述tpo模拟物。
[0551]
实施方案22(a)是实施方案22的方法,其中在向所述受试者施用放射剂量之前24小时至2小时向所述受试者给药所述tpo模拟物。
[0552]
实施方案22(a)(1)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前24小时向所述受试者给药所述tpo模拟物。
[0553]
实施方案22(a)(2)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前23小时向所述受试者给药所述tpo模拟物。
[0554]
实施方案22(a)(3)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前22小时向所述受试者给药所述tpo模拟物。
[0555]
实施方案22(a)(4)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前21小时向所述受试者给药所述tpo模拟物。
[0556]
实施方案22(a)(5)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前20小时向所述受试者给药所述tpo模拟物。
[0557]
实施方案22(a)(6)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前19小时向所述受试者给药所述tpo模拟物。
[0558]
实施方案22(a)(7)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前18小时向所述受试者给药所述tpo模拟物。
[0559]
实施方案22(a)(8)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前17小时向所述受试者给药所述tpo模拟物。
[0560]
实施方案22(a)(9)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前16小时向所述受试者给药所述tpo模拟物。
[0561]
实施方案22(a)(10)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前15小时向所述受试者给药所述tpo模拟物。
[0562]
实施方案22(a)(11)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前14小时向所述受试者给药所述tpo模拟物。
[0563]
实施方案22(a)(12)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前13小时向所述受试者给药所述tpo模拟物。
[0564]
实施方案22(a)(13)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前12小时向所述受试者给药所述tpo模拟物。
[0565]
实施方案22(a)(14)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前11小时向所述受试者给药所述tpo模拟物。
[0566]
实施方案22(a)(15)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前10小时向所述受试者给药所述tpo模拟物。
[0567]
实施方案22(a)(16)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前9小时向所述受试者给药所述tpo模拟物。
[0568]
实施方案22(a)(17)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前8小时向所述受试者给药所述tpo模拟物。
[0569]
实施方案22(a)(18)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前7小时向所述受试者给药所述tpo模拟物。
[0570]
实施方案22(a)(19)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前6小时向所述受试者给药所述tpo模拟物。
[0571]
实施方案22(a)(20)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前5小时向所述受试者给药所述tpo模拟物。
[0572]
实施方案22(a)(21)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前4小时向所述受试者给药所述tpo模拟物。
[0573]
实施方案22(a)(22)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前3小时向所述受试者给药所述tpo模拟物。
[0574]
实施方案22(a)(23)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前2小时向所述受试者给药所述tpo模拟物。
[0575]
实施方案22(a)(24)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前1小时向所述受试者给药所述tpo模拟物。
[0576]
实施方案22(a)(25)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前30分钟向所述受试者给药所述tpo模拟物。
[0577]
实施方案22(a)(26)是实施方案17
‑
21(c)中任一项的方法,其中在向所述受试者施用放射剂量之前15分钟向所述受试者给药所述tpo模拟物。
[0578]
实施方案22(b)是实施方案22的方法,其中在向所述受试者施用放射剂量之后0.1
‑
2小时向所述受试者给药所述tpo模拟物。
[0579]
实施方案22(c)是实施方案22
‑
22(b)中任一项的方法,其中用靶向放射疗法治疗所述受试者。
[0580]
实施方案22(d)是实施方案22
‑
22(b)中任一项的方法,其中用立体定向放射疗法治疗所述受试者。
[0581]
实施方案23是实施方案22
‑
22(d)中任一项的方法,其中所述放射剂量是10
‑
70戈
瑞(gy)。
[0582]
实施方案23(a)是实施方案23的方法,其中所述放射剂量是10戈瑞(gy)。
[0583]
实施方案23(b)是实施方案23的方法,其中所述放射剂量是20戈瑞(gy)。
[0584]
实施方案23(c)是实施方案23的方法,其中所述放射剂量是30戈瑞(gy)。
[0585]
实施方案23(d)是实施方案23的方法,其中所述放射剂量是40戈瑞(gy)。
[0586]
实施方案23(e)是实施方案23的方法,其中所述放射剂量是50戈瑞(gy)。
[0587]
实施方案23(f)是实施方案23的方法,其中所述放射剂量是60戈瑞(gy)。
[0588]
实施方案23(g)是实施方案23的方法,其中所述放射剂量是70戈瑞(gy)。
[0589]
实施方案23(h)是实施方案23
‑
23(g)中任一项的方法,其中将所述放射剂量以1
‑
10个部分施用至受试者。
[0590]
实施方案24是实施方案14
‑
23(h)中任一项的方法,其中所述tpo模拟物的有效量是约1至约5μg/kg受试者体重。
[0591]
实施方案24(a)是实施方案24的方法,其中所述tpo模拟物的有效量为约1μg/kg受试者体重。
[0592]
实施方案24(b)是实施方案24的方法,其中所述tpo模拟物的有效量为约2μg/kg受试者体重。
[0593]
实施方案24(c)是实施方案24的方法,其中所述tpo模拟物的有效量为约3μg/kg受试者体重。
[0594]
实施方案24(d)是实施方案24的方法,其中所述tpo模拟物的有效量为约4μg/kg受试者体重。
[0595]
实施方案24(e)是实施方案24的方法,其中所述tpo模拟物的有效量为约5μg/kg受试者体重。
[0596]
实施方案25是实施方案14
‑
24(e)中任一项的方法,其中将有效量的tpo模拟物通过静脉内、肌肉内、皮内或皮下注射中的任一种给药至受试者。
[0597]
实施方案25(a)是实施方案25的方法,其中将有效量的tpo模拟物通过皮下注射给药至受试者。
[0598]
实施方案25(b)是实施方案25的方法,其中将有效量的tpo模拟物通过静脉内注射给药至受试者。
[0599]
实施方案25(c)是实施方案25的方法,其中将有效量的tpo模拟物通过肌肉内注射给药至受试者。
[0600]
实施方案25(d)是实施方案25的方法,其中将有效量的tpo模拟物通过皮内注射给药至受试者。
[0601]
实施方案26是实施方案1
‑
25(a)中任一项的方法,其中给药有效量的所述tpo模拟物导致未受照射的肝叶的肝功能的增加、受照射的组织的退化的增加以及受试者中循环肝损伤标志物如血液中的透明质酸或肝转氨酶的浓度升高的减少中的至少一种。
[0602]
实施方案26(a)是实施方案26的方法,其中给药有效量的所述tpo模拟物导致未受照射的肝叶的肝功能的增加、受照射的组织的退化的增加以及受试者中肝损伤标志物如血液中的透明质酸或肝转氨酶的浓度升高的减少中的至少两种。
[0603]
实施方案26(b)是实施方案26的方法,其中给药有效量的所述tpo模拟物导致未受
照射的肝叶的肝功能的增加、受照射的组织的退化的增加以及受试者中肝损伤标志物如血液中的透明质酸或肝转氨酶的浓度升高的增加。
[0604]
实施方案27是一种减轻有此需要的受试者中放射诱发的肝病的试剂盒,其包含药物组合物,所述药物组合物包含有效量的tpo模拟物和药学可接受的载剂。
[0605]
实施方案27(a)是实施方案27的试剂盒,其中所述tpo模拟物包含具有seq id no:1的氨基酸序列的肽。
[0606]
实施方案27(b)是实施方案27的试剂盒,其中所述肽具有seq id no:2的氨基酸序列。
[0607]
实施方案27(c)是实施方案27(a)或27(b)的试剂盒,其中所述tpo模拟物进一步包含共价连接至肽的亲水聚合物。
[0608]
实施方案27(d)是实施方案27的试剂盒,其中所述亲水聚合物是聚乙二醇(peg)、聚丙二醇、聚乳酸和聚乙醇酸中的任一种。
[0609]
实施方案27(e)是实施方案27(d)的试剂盒,其中所述亲水聚合物是peg。
[0610]
实施方案27(f)是实施方案27(e)的试剂盒,其中所述peg是单甲氧基聚乙二醇(mepeg
‑
oh)、单甲氧基聚乙二醇
‑
琥珀酸酯(mepeg
‑
s)、单甲氧基聚乙二醇
‑
琥珀酰亚胺基琥珀酸酯(mepeg
‑
s
‑
nhs)、单甲氧基聚乙二醇
‑
胺(mepeg
‑
nh2)、单甲氧基聚乙二醇
‑
三氟乙磺酸酯(mepeg
‑
tres)或单甲氧基聚乙二醇
‑
咪唑基
‑
羰基(mepeg
‑
im)中的任一种。
[0611]
实施方案27(g)是实施方案27(e)的试剂盒,其中所述peg是甲氧基聚(乙二醇)(mpeg)。
[0612]
实施方案27(h)是实施方案27(g)的试剂盒,其中所述tpo模拟物是具有式(i)的分子结构的rwj
‑
800088,或者其药学可接受的盐或酯。
[0613]
实施方案27(i)是实施方案27(h)的试剂盒,其中所述rwj
‑
800088中的mpeg是甲氧基聚乙二醇20000。
[0614]
实施方案27(j)是实施方案27(a)的试剂盒,其中所述肽具有seq id no:3的氨基酸序列。
[0615]
实施方案27(k)是实施方案27(j)的试剂盒,其中将所述肽融合至多肽。
[0616]
实施方案27(l)是实施方案27(k)的试剂盒,其中所述多肽是fc结构域。
[0617]
实施方案27(m)是实施方案27(l)的试剂盒,其中所述tpo模拟物是罗米司亭。
[0618]
实施方案27(m)(1)是实施方案27(m)的试剂盒,其中罗米司亭包含seq id no:4的氨基酸序列。
[0619]
实施方案28是实施方案27
‑
27(m)(1)中任一项的试剂盒,其进一步包含至少一种额外的治疗剂或装置用于减轻放射诱发的肝病。
[0620]
实施方案29是实施方案28的试剂盒,其中所述额外的治疗剂选自镇痛剂、防腐剂、其他tpo模拟物、其他细胞因子、可溶性mpl受体、造血因子、白介素、蛋白因子或抗体以及化疗剂。
[0621]
实施方案30是实施方案27
‑
29中任一项的试剂盒,其中所述试剂盒进一步包含肝窦内皮细胞(lsec)、肝实质细胞、肝干细胞、多能干细胞和表达外源多核苷酸序列的产物的重组肝细胞中的至少一种。
[0622]
实施方案30(a)是实施方案30的试剂盒,其中所述试剂盒进一步包含lsec。
[0623]
实施方案30(a)(1)是实施方案30(a)的试剂盒,其中所述lsec用于移植。
[0624]
实施方案30(b)是实施方案30(a)(1)的试剂盒,其中所述lsec用于自体移植。
[0625]
实施方案30(c)是实施方案30(a)(1)的试剂盒,其中所述lsec用于同种异体移植。
[0626]
实施方案30(d)是实施方案30(a)(1)或30(c)的试剂盒,其中所述lsec用于同基因移植。
[0627]
实施方案30(e)是实施方案30
‑
30(d)中任一项的试剂盒,其中所述试剂盒进一步包含肝实质细胞。
[0628]
实施方案30(f)是实施方案30(e)的试剂盒,其中所述肝实质细胞用于移植。
[0629]
实施方案30(f)(1)是实施方案30(f)的试剂盒,其中所述肝实质细胞用于自体移植。
[0630]
实施方案30(f)(2)是实施方案30(f)的试剂盒,其中所述肝实质细胞用于同种异体移植。
[0631]
实施方案30(f)(3)是实施方案30(f)或30(f)(2)的试剂盒,其中所述肝实质细胞用于同基因移植。
[0632]
实施方案30(g)是实施方案30
‑
30(f)(3)中任一项的试剂盒,其中所述试剂盒进一步包含肝干细胞。
[0633]
实施方案30(g)(1)是实施方案30(g)的试剂盒,其中所述肝干细胞用于移植。
[0634]
实施方案30(g)(2)是实施方案30(g)(1)的试剂盒,其中所述肝干细胞用于自体移植。
[0635]
实施方案30(g)(3)是实施方案30(g)(1)的试剂盒,其中所述肝干细胞用于同种异体移植。
[0636]
实施方案30(g)(4)是实施方案30(g)(1)或30(g)(3)的试剂盒,其中所述肝干细胞用于同基因移植。
[0637]
实施方案30(h)是实施方案30
‑
30(g)(4)中任一项的试剂盒,其中所述试剂盒进一步包含多能干细胞。
[0638]
实施方案30(h)(1)是实施方案30(h)的试剂盒,其中所述多能干细胞用于移植。
[0639]
实施方案30(h)(2)是实施方案30(h)(1)的试剂盒,其中所述多能干细胞用于自体移植。
[0640]
实施方案30(h)(3)是实施方案30(h)(1)的试剂盒,其中所述多能干细胞用于同种异体移植。
[0641]
实施方案30(h)(4)是实施方案30(h)(1)或30(h)(3)的试剂盒,其中所述多能干细胞用于同基因移植。
[0642]
实施方案30(i)是实施方案30
‑
30(h)(4)中任一项的试剂盒,其中所述试剂盒进一步包含表达外源多核苷酸序列的产物的重组肝细胞。
[0643]
实施方案30(i)(1)是实施方案30(i)的试剂盒,其中所述重组肝细胞用于移植。
[0644]
实施方案30(i)(2)是实施方案30(i)(1)的试剂盒,其中所述重组肝细胞用于自体移植。
[0645]
实施方案30(i)(3)是实施方案30(i)(1)的试剂盒,其中所述重组肝细胞用于同种异体移植。
[0646]
实施方案30(i)(4)是实施方案30(i)(1)或30(i)(3)的试剂盒,其中所述肝干细胞用于同基因移植。
[0647]
实施方案30(j)是实施方案30
‑
30(i)(4)中任一项的试剂盒,其进一步包含蛋白因子。
[0648]
实施方案30(k)是实施方案30(j)的试剂盒,其中所述蛋白因子是以下任一种:
[0649]
i.vegf
‑
a,
[0650]
ii.vegf
‑
e,
[0651]
iii.fgf
‑
2,
[0652]
iv.egf,
[0653]
v.mmp14,
[0654]
vi.cxcr4拮抗剂,
[0655]
vii.sdf1,
[0656]
viii.gm
‑
csf,
[0657]
ix.gcsf,
[0658]
x.flt3,
[0659]
xi.r
‑
spondin1,以及
[0660]
xii.双调蛋白。
[0661]
实施方案30(l)是实施方案30(j)的试剂盒,其中所述试剂盒进一步包含两种或更多种蛋白因子。
[0662]
实施方案30(m)是实施方案30(l)的试剂盒,其中所述蛋白因子是以下任两种:
[0663]
i.vegf
‑
a,
[0664]
ii.vegf
‑
e,
[0665]
iii.fgf
‑
2,
[0666]
iv.egf,
[0667]
v.mmp14,
[0668]
vi.cxcr4拮抗剂,
[0669]
vii.sdf1,
[0670]
viii.gm
‑
csf,
[0671]
ix.gcsf,
[0672]
x.flt3,
[0673]
xi.r
‑
spondin1,以及
[0674]
xii.双调蛋白。
[0675]
实施方案30(n)是实施方案30(j)的试剂盒,其中所述试剂盒进一步包含以下任三种:
[0676]
i.vegf
‑
a,
[0677]
ii.vegf
‑
e,
[0678]
iii.fgf
‑
2,
[0679]
iv.egf,或
[0680]
v.mmp14,
[0681]
vi.cxcr4拮抗剂,
[0682]
vii.sdf1,
[0683]
viii.gm
‑
csf,
[0684]
ix.gcsf,
[0685]
x.flt3,
[0686]
xi.r
‑
spondin1,以及
[0687]
xii.双调蛋白。
[0688]
实施方案30(o)是实施方案30(j)的试剂盒,其中所述试剂盒进一步包含以下任四种:
[0689]
i.vegf
‑
a,
[0690]
ii.vegf
‑
e,
[0691]
iii.fgf
‑
2,
[0692]
iv.egf,
[0693]
v.mmp14,
[0694]
vi.cxcr4拮抗剂,
[0695]
vii.sdf1,
[0696]
viii.gm
‑
csf,
[0697]
ix.gcsf,
[0698]
x.flt3,
[0699]
xi.r
‑
spondin1,以及
[0700]
xii.双调蛋白。
[0701]
实施方案30(p)是实施方案30(j)的试剂盒,其中所述试剂盒进一步包含以下任五种:
[0702]
i.vegf
‑
a,
[0703]
ii.vegf
‑
e,
[0704]
iii.fgf
‑
2,
[0705]
iv.egf,
[0706]
v.mmp14,
[0707]
vi.cxcr4拮抗剂,
[0708]
vii.sdf1,
[0709]
viii.gm
‑
csf,
[0710]
ix.gcsf,
[0711]
x.flt3,
[0712]
xi.r
‑
spondin1,以及
[0713]
xii.双调蛋白。
[0714]
实施方案30(q)是实施方案30(j)的试剂盒,其中所述试剂盒进一步包含以下任六种:
[0715]
i.vegf
‑
a,
[0716]
ii.vegf
‑
e,
[0717]
iii.fgf
‑
2,
[0718]
iv.egf,
[0719]
v.mmp14,
[0720]
vi.cxcr4拮抗剂,
[0721]
vii.sdf1,
[0722]
viii.gm
‑
csf,
[0723]
ix.gcsf,
[0724]
x.flt3,
[0725]
xi.r
‑
spondin1,以及
[0726]
xii.双调蛋白。
[0727]
实施方案30(r)是实施方案30(j)的试剂盒,其中所述试剂盒进一步包含以下任七种或更多种:
[0728]
i.vegf
‑
a,
[0729]
ii.vegf
‑
e,
[0730]
iii.fgf
‑
2,
[0731]
iv.egf,
[0732]
v.mmp14,
[0733]
vi.cxcr4拮抗剂,
[0734]
vii.sdf1,
[0735]
viii.gm
‑
csf,
[0736]
ix.gcsf,
[0737]
x.flt3,
[0738]
xi.r
‑
spondin1,以及
[0739]
xii.双调蛋白。
[0740]
实施例
[0741]
实施例1:tpom对未照射的叶的影响
[0742]
材料和方法
[0743]
动物:将8
‑
12周龄的c57bl6雄性小鼠安置在阿尔伯特爱因斯坦医学院的动物研究所并喂食普通食物。在实验开始时和组织收集之前将动物称重。所有实验均根据阿尔伯特爱因斯坦医学院的动物护理和使用机构委员会批准的方案进行。
[0744]
肝脏照射:利用小动物放射研究平台(sarrp,xstrahl inc.,suwanee,ga)进行图像引导的外部光束照射。通过管饲法给予小鼠泛影葡胺造影剂以改善胃肠(gi)道的可视化。大约2分钟之后,将小鼠放置在管状诊察台上,并且用2l/min纯氧中的~2%异氟烷(isothesia,usp)麻醉。获得锥形束计算机断层扫描(cbct),并且利用muriplan软件产生照射中叶和右叶的治疗计划。为了最小化毒性,使用2个平行的相对场进行照射。
[0745]
在目标叶内,选择等中心的位置以最小化gi道、脊柱和心脏的照射(对这些器官的最大剂量保持在10gy以下)。使用用于束硬化的1mm铜过滤器,用220kvp能量和13ma管电流的50gy x
‑
射线(2.4
‑
2.5gy/min的剂量率)照射靶标(brodin et al.,the radiation safety journal,2015,109supp 3,s190)。
[0746]
tpom制剂制备和剂量给药:将tpom在无菌pbs中稀释至10mg/ml原液。将原液储存在
‑
20℃下,并且在给药之前使其达到室温。将tpom在照射之后10分钟通过皮下注射以单剂量(300μg/kg)给药。
[0747]
靶向肝脏照射 /
‑
tpom的评价:对c57bl6雄性小鼠的肝脏中叶给予50gy,并且在照射后10分钟通过皮下注射给药盐水或300μg/kg的tpom。部分肝脏照射后一个月,在每只小鼠中鉴定所关注的区域(n=4/组)。
[0748]
未治疗的尾状叶的体积测量:由于生理器官大小固定,未受照射的肝脏会肥大以补偿受照射的萎缩叶。在这个实验中,测量尾状叶的体积作为未受照射的叶。
[0749]
结果
[0750]
tpom导致未受照射的叶肥大
[0751]
示出每个治疗组的平均值和标准差(图1)。当比较hir 盐水与hir tpom的未受照射的尾状叶大小时,在tpom治疗组中有显著增加(p
‑
值<0.00932)。这些数据证实tpom促进未受照射的叶的肝功能增加。这些作用可以通过窦肝实质细胞再生或血管内皮细胞保护/再生来介导。
[0752]
实施例2:tpom /
‑
移植的肝窦内皮细胞(lsec)对正常和肝硬化肝脏中照射诱发的肝损伤的影响
[0753]
材料和方法
[0754]
动物:在这个研究中使用8
‑
12周龄雄性和雌性二肽基肽酶iv(dppiv)
‑
/
‑
敲除小鼠以及8
‑
12周龄雄性和雌性c57bl6小鼠。在实验开始时和组织收集之前将动物称重。将所有动物安置在阿尔伯特爱因斯坦医学院的动物研究所并喂食普通啮齿动物食物。所有实验均根据阿尔伯特爱因斯坦医学院的动物护理和使用机构委员会批准的方案进行。利用ccl4给药(每周两次腹腔内[ip]注射,持续至少11周)使动物肝硬化。
[0755]
肝脏照射:利用小动物放射研究平台(sarrp,xstrahl inc.,suwanee,ga)进行图像引导的外部光束照射。通过管饲法给予小鼠泛影葡胺造影剂以改善胃肠(gi)道的可视化。大约2分钟之后,将小鼠放置在管状诊察台上,并且用2l/min纯氧中的~2%异氟烷(isothesia,usp)麻醉。获得锥形束计算机断层扫描(cbct),并且利用muriplan软件产生照射中叶和右叶的治疗计划。为了最小化毒性,与使用两个平行相对场的实施例1相比,每个具有相等剂量给药重量的肝脏靶标使用2弧进行照射(与实施例1相比,可能导致更多附加的较低剂量放射暴露)。在目标叶内,选择等中心的位置以最小化gi道、脊柱和心脏的照射(对这些器官的最大剂量保持在10gy以下)。使用用于束硬化的1mm铜过滤器,以220kvp能量和13ma管电流的50gy x
‑
射线照射靶标(2.4
‑
2.5gy/min的剂量率)。(brodin et al.,the radiation safety journal,2015,109supp 3,s190)。
[0756]
tpom制剂制备和剂量给药:将tpom在无菌pbs中稀释至10mg/ml原液。将原液储存在
‑
20℃下,并且在给药之前使其达到室温。将tpom在移植手术之后10分钟通过皮下注射以单剂量(300μg/kg)给药。
[0757]
靶向肝脏照射 /
‑
tpom /
‑
lsec移植的评价
[0758]
dppiv染色和成像:选择dppiv作为dppiv(
‑
/
‑
)动物中外源性lsec植入的标记。根据dabeva等人公布的方案将5μm冷冻肝切片固定并对dppiv染色(proc.natl.acad.sci.usa,1997,94:7356
–
7361)。使用perkin elmer p250高容量玻片扫
描仪进行玻片成像。
[0759]
肝窦内皮细胞(lsec)分离:使用温和的macs肝分离试剂盒(miltenyi biotec gmbh#130
‑
105
‑
807)将新鲜外植的肝脏分离为单细胞悬浮液。使用cd146微珠(miltenyi biotec gmbh#130
‑
092
‑
007)从单细胞悬浮液分离lsec。
[0760]
细胞移植:lsec移植是一种新技术,其需要对有效肝脏再群体化的强大生长刺激(guha et al.,hepatology,2002,36:354
–
62;laconi et al.,am.j.pathol.,1998,153:319
–
29)。在分离lsec之后,在hir后24hr通过脾内注射将500 x 105个lsec移植至用异氟烷(isothesia,usp)麻醉的健康成年小鼠中。术后给予丁丙诺啡作为镇痛剂。
[0761]
单光子发射计算机断层(spect)扫描:在这个工作中已开发并利用spect与放射性示踪剂来评价体内rild的发展。在前一天晚上将动物带到实验室并使其适应设备的环境噪音。使动物在异氟烷麻醉下休息至少10分钟。从装在铅后的2
‑
ml注射器中的10mci剂量抽取
99m
tc硫胶体的剂量。活性高达0.500
–
0.600mci,最大体积为0.2ml,并且通过眶后窦注射。以每0.1ml体积约3秒的速度对针头施加正压。然后立即将动物放入spect/ct扫描仪的隧道中。在对动物的放射暴露非常少的情况下拍摄ct探查性图像。这是为了在视野(fov)中对齐动物。将ct设置为中等分辨率,通过剂量计测量并由第三方公司读取,每次ct扫描/动物的暴露量为5mrem/hr。然后通过龙门架将动物移至spect fov中,然后启动。然后以spect模式收集计数。这又持续20分钟,因为两个spect探测器头在隧道内围绕动物旋转180度。在研究结束时观察动物的恢复情况,然后将其置于专门的放射衰减室中。锝99m(
99
mtc)的半衰期为6小时,这意味着在释放动物之前需要保留60小时。ct采集这样进行,总旋转360度,180个旋转步骤,暴露时间200ms/1帧,电压设置为80kv,电流设置为0.5ma,横轴fov:59.45mm,轴向fov:68.26mm,系统放大率设置为中等分辨率,有效像素尺寸69微米。使用标准houndsfield重建方案进行ct重建,接受所有默认值。
[0762]
spect采集:准直器:5
‑
孔鼠全身(5
‑
mwb
‑
1.0)在30mm旋转半径横轴(transaxial)fov 38mm,最高分辨率1.3mm,采集模式设置为:spect scan photo peak设置为:140kev,同位素:锝99m(99mtc),转数:0.5,投影之间的角度:3.7,总投影:40,第一步采集时间:20秒,预计扫描时间:19分钟。spect直方图:采集模式:sect scan,下鉴别器(lower level discriminator),设置为126kev,上鉴别器(upper discriminator)设置为154kev,数据格式:intel/vax 4位整数spect重构:启用的检测器:1和2,重建类型:有序子集期望最大化三维(osem3d),迭代:8,子集:4。
[0763]
图像和数据分析:为了进一步研究暴露于放射损伤的组织的特征以及放射治疗之后2个月血管损伤和恢复的情况,使用内部开发的半自动量化软件显示灌注减少的组织体积,使用matlab(the mathworks inc.,natick,ma)进行测量。该软件使用简单的阈值算法,将减少的灌注体积指定为与未受照射的叶相比15
–
80%的示踪剂吸收。利用来自具有已知体积的受照射的肝组织或未接受肝照射的动物的spect/ct扫描来验证软件性能。
[0764]
统计分析:利用prism 7(graphpad)统计分析软件进行统计分析。数据表示为平均值
±
标准差。使用普通的单向方差分析进行比较。报告所有p值。
[0765]
结果
[0766]
tpom导致受照射的肝脏中移植的lsec的增殖和植入
[0767]
为了测试tpom作为可以引起lsec植入的物质的效力,使用外束ct引导的x
‑
射线照
射,dppiv
‑
/
‑
敲除小鼠接受对肝脏中叶和右叶的50gy肝脏照射(hir)以及表达dppiv的lsec(图2a)。螺旋状dppiv染色表明肝窦中肝实质细胞之间lsec的再群体化(图2b和图3a
–
3f)。
[0768]
lsec在没有生长刺激的情况下不会再群体化受照射的肝脏(图3c),但是当给予强烈生长刺激时,移植的细胞再群体化肝窦(图3d)。当tpom用作生长刺激时,观察到受照射组织的大量再群体化(图3e和3f)。在接受lsec tpom hir的6/7动物中,看到一定水平的肝脏再群体化(图3f)。
[0769]
基于tpom的治疗减少肝脏照射之后受照射组织中的肝损伤
[0770]
放射产生自由基并破坏基因组dna,这导致细胞凋亡和细胞衰老。受照射的肝组织缩小,并且肝稳态(hepatostat)通过增加健康肝组织的体积来补偿。为了研究基于tpom的治疗如何影响放射诱发的肝损伤,仔细解剖并称重单个肝叶。图4a和4b显示相对于肝脏总大小和动物体重标准化的肝叶大小的相对变化。在接受hir然后在hir后24
‑
小时接受lsec /
‑
rwj
‑
800088的动物中,在hir后2个月未受照射的左叶体积有增加的趋势(图b)。此外,在仅用rwj
‑
800088和hir治疗的组中,受照射的叶(中间和右侧)的大小有减小的趋势(图4a)。仅用rwj
‑
800088 hir的受照射叶的大小减小的趋势可能是由于dna照射损伤细胞增殖增加导致细胞死亡增加的结果。
[0771]
在单独用rwj
‑
800088和与lsec移植联合治疗的动物中,肝脏中的肝血管损伤和相应的窦阻塞减少。spect可以用于通过测量硫
‑
胶体连接的tc
99
(sc
‑
tc99)的信号来可视化和量化肝脏中的灌注变化,其在注射至循环中的15分钟内被肝kupffer细胞选择性地吸收。接受50gy hir至中叶的动物在hir后2个月在受照射的区域中具有71.4%的平均残留缺陷体积(图5b和5e)。在照射前2或24小时用rwj
‑
80008治疗的具有正常肝脏的动物中,平均残留缺陷体积与未受照射的动物相似(图5e)。在照射之后接受rwj
‑
800088和lsec移植的具有正常肝脏的动物中,在hir后2个月时受照射区域中的残留缺陷体积是18.2%,(p=0.03)(图5c和5e)。在照射后24
‑
小时接受rwj
‑
800088和lsec移植的具有硬化肝的动物中观察到类似的保护作用(图5d)。
[0772]
实施例3:照射之后tpom或罗米司亭 /
‑
移植的肝窦内皮细胞(lsec)的影响
[0773]
材料和方法
[0774]
方法与上文描述的那些相同,除了在照射后4
‑
5天施用lsec移植,并且在lsec移植后约10分钟给药tpom或罗米司亭。
[0775]
结果
[0776]
tpom和罗米司亭导致受照射的肝脏中移植的lsec的增殖和植入
[0777]
给药tpom或罗米司亭之后,在接受50gy肝脏照射(hir)和lsec移植的dppiv
‑
/
‑
敲除小鼠中观察到lsec植入(表1)。螺旋状dppiv染色表明肝窦中肝实质细胞之间lsec的再群体化(图6)。
[0778]
表1:靶向肝脏照射(59gy)之后tpom或罗米司亭给药后lsec植入的总结
[0779]
结果tpom罗米司亭在照射后24小时施用lsec移植时植入是是在照射后4
‑
5天施用lsec移植时植入是是
[0780]
实施例4:开发小鼠肝硬化模型以评价tpom对肝硬化小鼠中肝脏再生的影响
[0781]
目的:开发小鼠肝硬化模型以使得能够评价rwj
‑
800088在10gy的单次肝脏照射
(hir)之后对肝硬化小鼠中肝脏再生的影响。评价多个剂量水平的ccl4以确定适当的剂量水平来维持肝损伤而不引起死亡。这个研究中使用的条件用于实验5。
[0782]
材料和方法
[0783]
动物:将雄性c57bl/6dppiv敲除雄性小鼠(10
‑
14周)用四氯化碳(ccl4)每周两次腹腔内注射,持续最少12周,直到最多时30只小鼠中有5只死于ccl4注射。之后立即将动物随机分配至实验组中。
[0784]
肝脏照射(hir):利用小动物放射研究平台(sarrp,xstrahl inc.,suwanee,ga)进行图像引导的外部光束照射。通过管饲法给予小鼠泛影葡胺造影剂以改善胃肠(gi)道的可视化。大约2分钟之后,将小鼠放置在管状诊察台上,并且用2l/min纯氧中的~2%异氟烷(isothesia,usp)麻醉。获得锥形束计算机断层扫描(cbct),并且利用muriplan软件产生照射中叶和右叶的治疗计划。为了最小化毒性,每个具有相等剂量给药重量的肝脏靶标使用2弧进行照射。在目标叶内,选择等中心的位置以最小化gi道、脊柱和心脏的照射(对这些器官的最大剂量保持在10gy以下)。弧位置坐标如下所述(表2)。使用用于束硬化的1mm铜过滤器,以220kvp能量和13ma管电流的50gy x
‑
射线照射靶标(2.4
‑
2.5gy/min的剂量率)。
[0785]
表2:肝脏照射的参数
[0786] 诊察台开始诊察台结束龙门架开始龙门架结束中叶弧12020
‑
110100中叶弧2
‑
20
‑
20
‑
110100右叶弧14040
‑
20120右叶弧2
‑
40
‑
40
‑
20120
[0787]
测试物品的制备:通过称出1mg的rwj
‑
800088并将其溶解在1ml无菌生理盐水(对照物品)中来制备rwj
‑
800088储备溶液。将储备溶液储存在
‑
80℃下。在给药当天,将储备溶液解冻至室温,并且从储备溶液制备合适的剂量给药浓度的剂量给药溶液。将剂量给药溶液涡旋以确保剂量给药溶液的均质性。
[0788]
方法:将小鼠用ccl4处理(两次注射40%v/v,其余注射10%v/v持续11天,评价以确定适当剂量水平,以维持肝损伤而不导致死亡。
[0789]
实验的时间点:将小鼠用ccl4处理以诱发肝硬化。通过使用x
‑
射线辐射器(sarrp)以50gy照射肝硬化小鼠的肝脏(设置为时间0),然后给药rwj
‑
800088。3个月之后,将小鼠处死以收集血液和肝组织用于进一步分析。
[0790]
药物给药的时间/剂量:如下表3所示在hir之后10min皮下给药300μg/kg的rwj
‑
800088:
[0791]
表3:药物给药的时间和剂量
[0792][0793]
终点评价:
[0794]
·
e1
–
处死时评估的肝脏重量(hir后3个月)
[0795]
·
e2
–
处死时的肝脏组织学(hir后3个月)
[0796]
临床观察:兽医和研究人员每天对动物进行监测以确保将符合安乐死标准的动物从研究中移除。
[0797]
体重:在实验开始之前、实验期间每周和安乐死当天将动物称重。
[0798]
结果
[0799]
首先将小鼠用橄榄油中的40%ccl4(v/v)注射,但是许多小鼠在随后的2次注射之后死亡。然后对于这个实验的剩余部分,将剂量减少至10%。
[0800]
实施例5:tpom /
‑
移植的肝窦内皮细胞(lsec)和tpom /
‑
普乐沙福对肝硬化小鼠中放射诱发的肝病的影响
[0801]
目的:如50gy的单次肝脏照射(hir)之后在肝硬化小鼠中通过spect
‑
ct测量的,评价rwj
‑
80088 肝窦内皮细胞(lsec)&rwj
‑
80088 普乐沙福(照射前和照射后给药的cxcr4选择性抑制剂)对放射诱发的肝病的影响。adhgf作为阳性对照包括在内。
[0802]
材料和方法
[0803]
方法与上述实验4相同,除了在12周内将橄榄油中的ccl4剂量增加至20%。如50gy的单次肝脏照射(hir)之后在肝硬化小鼠中通过spect
‑
ct测量的,评价rwj
‑
800088 肝窦内皮细胞(lsec)、rwj
‑
800088 普乐沙福(照射前和照射后给药的cxcr4选择性抑制剂)对放射诱发的肝病的影响。adhgf为阳性对照。这些数据旨在为潜在肝病患者的临床研究提供临床前支持。
[0804]
测试物品的制备:如实验4所述制备rwj
‑
800088的剂量给药溶液。此外,通过细胞裂解收获腺病毒载体并通过cscl梯度离心纯化。通过感染不同稀释度的293细胞,然后对腺病毒六邻体进行免疫细胞化学染色来确定病毒颗粒的数量和感染单位的比例。从每1,000个病毒颗粒形成的噬菌斑数量计算感染滴度。细胞移植之后一天,通过尾静脉注射给予1
×
1011感染单位的腺病毒人肝生长因子(adhgf)
[0805]
将来自genzymecorporation的普乐沙福(mozobil)以20mg/ml的浓度包装在小瓶中。它是一种bicyclam化合物,作为cxcr4趋化因子受体拮抗剂,在多项较早研究中已显示其快速并有效地增加循环中的干细胞数量。
[0806]
实验的时间点:首先将小鼠用ccl4处理11周以诱发肝硬化。通过使用x
‑
辐射器(sarrp)以50gy照射肝硬化小鼠的肝脏(设置为时间0),然后给药rwj
‑
800088,与普乐沙福、肝窦内皮细胞(lsec)移植或腺病毒肝实质细胞生长因子(adhgf)组合。4个月之后,将小鼠处死以收集血液和肝组织用于进一步分析。
[0807]
药物给药的时间/剂量:在hir之后10min皮下给药300μg/kg的rwj
‑
800088。如下表4所示在不同时间点皮下给药5mg/kg的普乐沙福。在hir之后48小时通过脾内注射移植lsec。在lsec移植后72小时静脉内给药adhgf。
[0808]
表4:药物给药的时间和剂量
[0809][0810]
终点评价:
[0811]
·
e1
‑
肝脏的spect
‑
ct
[0812]
·
e2
‑
处死时评估的肝脏重量(hir后4个月)
[0813]
·
e3
‑
处死时的肝脏组织学(hir后4个月)
[0814]
结果
[0815]
如未受照射的叶比受照射的叶的重量比证明的,损伤后普乐沙福与rwj
‑
800088一起给药增加未受照射的叶的肥大。在照射前和照射后给药的普乐沙福降低针对rild的保护程度和肥大程度。rwj
‑
800088表现出类似于adhgf(阳性对照)的针对rild的保护趋势。见表5和图7。
[0816]
表5:未受照射的右叶重量与受照射的左叶重量的比率
[0817]
组右叶与左叶重量的平均比率sdnhir1.140.333hir tpom 后普乐沙福2.170.633前普乐沙福 hir tpom 后普乐沙福0.930.182hir lsec tpom1.35 1hir lsec adhgf1.790.944
[0818]
通过spect
‑
ct定量rild的程度(图8),用rwj
‑
800088与lsec移植物或普乐沙福治疗的小鼠免于rild,并且显示未受照射的叶的肥大增加。照射前和照射后的普乐沙福给药降低针对rild的保护程度和肥大程度。
[0819]
实施例6:对a型血友病小鼠肝脏放射治疗之后tpom /
‑
移植的肝窦内皮细胞(lsec)对因子viii产生的影响
[0820]
目的:评价在a型血友病小鼠模型(f8tm1kaz)中对肝脏右上叶和中叶50gy的靶向照射之后rwj
‑
800088对lsec植入和因子viii产生的影响。出于安全原因不可以用于人的adhgf用作阳性对照,因为已显示其在靶向肝脏照射和lsec移植之后导致lsec植入。
[0821]
材料和方法
[0822]
动物:将8
‑
16周龄雄性c57/bl6小鼠、8
‑
16周龄雌性和雄性b6129sf2/j小鼠(用于分离lsec的供体)以及8
‑
16周龄雌性和雄性血友病小鼠(f8
tm1kaz
)小鼠用于这个研究。将小鼠安置在不锈钢架(allentown,inc.,allentown,nj)上的微型隔离笼中,最多5只一组,总占地面积为500cm2。笼子使用外部水瓶和双喂料架(fisherscientific,hampton,nh)。将
这些笼子存放在储存架中,所述储存架为每个单独的笼子提供温度、湿度和通风控制(allentown,inc.)。bed
‑
o’cobs 1/8”(fisher scientific)用作每个笼子中的垫料。
[0823]
方法:方法与上述实验5相同,包括测试物品的制备(rwj
‑
800088和adhgf的溶液)、lsec的分离和移植以及肝脏照射。
[0824]
实验的时间点:使用x
‑
射线辐射器(sarrp)以50gy照射小鼠肝脏。照射后24小时,通过尾静脉将lsec(1
×
106个细胞/小鼠)注射至小鼠。在肝脏照射(hir)之后第60天,在每只小鼠的尾部切开一个切口并进行出血测试。
[0825]
药物给药的时间/剂量:在lsec移植之后10min皮下给药rwj
‑
800088(300μg/kg)。在lsec移植之后24小时腹腔内给药1
×
109pfu/小鼠的adhgf。治疗组如下表6所示。
[0826]
表6.
[0827][0828]
*10只用于lsec分离,5只用于出血测试和其他终点分析
[0829]
研究终点:进行尾部出血测试,其中评价30分钟过程中的出血程度和凝血时间。通过血液和肝脏中的蛋白印迹和mrna谱评价fviii蛋白水平以评价有产生fviii的功能性lsec植入的程度。还对肝脏进行免疫组织化学以对lsec中fviii的存在染色。
[0830]
结果
[0831]
a型血友病小鼠中的drabkin's出血时间测定
[0832]
通过切割尾部然后将尾部浸入2.0ml的drabkins试剂中来进行尾部出血测定。在对照组以及hir lsec awj
‑
800088或adhgf组中,出血在10min前停止,而未治疗和hir治疗的a型血友病组没有停止出血。使用hir lsec rwj
‑
800088和hir lsec adhgf时收集管中血红蛋白浓度的比较显示与fviii缺陷模型相比,血红蛋白损失显著减少。
[0833]
尾部出血后的存活率
[0834]
治疗后90天,小鼠接受尾部出血挑战。如图9所示,尾部出血挑战之后,100%的对照a型血友病小鼠在5天内死亡,而hir lsec rwj
‑
80088治疗组在尾部出血挑战后30天与对照相比表现出100%存活。注意这些存活曲线仅用于接受drabkin’s出血测试的动物。与对照组相比,adhgf小鼠在第5天、第15天和第23天死亡(死因未知)。
[0835]
此外,elisa分析显示与未治疗的a型血友病小鼠相比,在治疗的hir lsec jnj
‑
26366821或adhgf组中因子viii(fviii)的表达延长,对于血浆以pg/ml计(图10a)或者对于肝脏以pg/g计(图10b)。
[0836]
从免疫荧光成像也获得类似结果,其评价针对因子viii、lyve
‑1–
肝窦内皮细胞的选择性抗体、dapi
–
dna染色显示细胞以及fvii lyve
‑
1的合并区域的肝玻片(图11)。
[0837]
靶向肝脏照射(hir)之后lsec移植与rwj
‑
800088给药一起促进a型血友病小鼠中的功能性lsec植入和fviii产生。用功能性出血测定证实这一点,其中有与非a型血友病对照相似的出血和凝集时间减少。尾部出血挑战之后,100%的未治疗和hir治疗的血友病小鼠在5天内死亡,而hir lsec rwj
‑
800088治疗的血友病小鼠显示100%存活达30天。在hir lsec rwj
‑
800088治疗的血友病小鼠的血浆和肝脏中,因子viii mrna和活化蛋白的水平也有增加。通过免疫组织化学和免疫荧光成像也证实肝脏中因子viii的存在。这个研究为使用血小板生成素模拟物如rwj
‑
800088与lsec移植和hir联合治愈a型血友病的潜力提供概念证明。
[0838]
在靶向肝脏放射(hir)之后向a型血友病小鼠肝脏的右上叶和中叶给药rwj
‑
800088联合产生fviii的lsec促进功能性lsec的植入,所述功能性lsec产生fviii的程度足以使它们能够在尾静脉出血测试后凝集和存活。如通过elisa、蛋白印迹和免疫组织化学确定的循环血液和肝脏中fviii蛋白水平和mrna的测量也证实功能性lsec的成功植入。这个研究为使用血小板生成素模拟物与lsec移植和hir联合治愈a型血友病的潜力提供概念证明。
[0839]
实施例7:tpom和罗米司亭对dppiv敲除小鼠照射后移植的肝窦内皮细胞(lsec)和肝实质细胞植入的影响
[0840]
目的:评价rwj
‑
800088和罗米司亭对肝脏照射(hir)后移植的肝窦内皮细胞(lsec)和肝实质细胞植入的影响。
[0841]
材料和方法
[0842]
动物:在这个研究中使用8
‑
12周龄雄性二肽基肽酶iv敲除(dppiv
‑
/
‑
)小鼠和8
‑
12周龄雄性c57bl/6小鼠。
[0843]
方法:方法与上述实验5相同,包括测试物品的制备(rwj
‑
800088的溶液)、lsec的分离和移植以及肝脏照射。此外,罗米司亭购自药房,为250μg粉末。按照制造商的描述使用溶剂将其重构为注射溶液。重构之后,0.5ml溶液的可递送体积包含250μg的罗米司亭(500μg/ml)。
[0844]
实验设计
[0845]
研究a:在实验开始时将动物称重。使用小动物放射器平台(sarrp系统),雄性c57bl/6和dppiv ko小鼠(8
‑
12周龄)接受50gy至肝脏的右上叶和中叶。
[0846]
4或5天后,将小鼠用dppiv
5×
10^5个肝窦内皮细胞(lsec)脾内移植。然后如表7所示,在lsec移植之后10分钟向小鼠腹腔内注射300μg/kg的rwj
‑
800088或罗米司亭。
[0847]
表7
[0848]
组#治疗靶向放射(gy)剂量(μg/kg)剂量体积(μl)lsec(细胞/小鼠)n1rwj
‑
80008850300100μl5
×
10^542罗米司亭50300100μl5
×
10^54
[0849]
然后对小鼠进行监测,直至它们完全康复并返回笼子。对小鼠追踪2个月和5个月
并进行尸体剖检。将肝脏切除并制备冷冻切片。进行dppiv活性的免疫染色以检查肝脏中移植的dppiv
细胞的再群体化。
[0850]
研究b(仅罗米司亭的研究):研究在预备性肝放射的dppiv ko小鼠模型中单独的肝实质细胞(ht)以及存在罗米司亭的ht/lsec的植入和再群体化效率。研究设计如表8所示:
[0851]
表8
[0852][0853]
组1
‑
3:在第1天给予放射。单独的肝实质细胞(ht)和肝实质细胞(ht) lsec移植在照射后24小时进行。对于上述各组,移植后罗米司亭给药3天。
[0854]
组4
‑
6:在未放射小鼠中进行的单独的肝实质细胞(ht)和肝实质细胞(ht) lsec移植。对于上述各组,移植后罗米司亭给药3天。
[0855]
结果
[0856]
研究a:在收集的存活动物的肝组织中进行dppiv活性的免疫染色。在hir之后2个月,当rwj
‑
800088与hir和lsec联合给药时,与正常dppiv ko小鼠肝中没有阳性染色相比,观察到受照射的肝组织中lsec的再群体化,与罗米司亭治疗相似。此外,rwj
‑
800088和罗米司亭治疗的小鼠之间的染色模式有差异。它与冷冻组织的结构有关,其中一些组织与其他组织相比可能没有得到很好的维护。
[0857]
在hir之后2个月,我们还对用rwj
‑
80088治疗的另一只小鼠的4个不同肝叶进行染色。所有4个叶均显示阳性染色,而中叶被dppiv阳性细胞覆盖的面积最小。在hir之后5个月,仅两只rwj
‑
80088治疗的存活小鼠用于肝脏染色。一只小鼠的中叶、右叶和左叶显示广泛的dppiv阳性染色,但是在尾状叶中并不多。在另一只小鼠中,中叶和右叶显示强烈的dppiv染色,但是在左叶和尾状叶中并不多。这些结果表明移植到用rwj
‑
800088治疗的hir小鼠的lsec在肝脏中再群体化良好并稳定驻留。
[0858]
在这个研究中,放射靶向肝脏的中叶和右叶,其显示密集的dppiv染色。相比之下,在尾状叶中移植的lsec并不多。这个结果表明放射前提是招募移植的lsec的重要因素。
[0859]
研究a和研究b的总体总结结果:下表9总结研究a和b中不同治疗组中肝实质细胞和lsec的群体。
[0860]
表9
[0861][0862]
如组织学所评价的,这些数据证实tpom和罗米司亭都可以单独作用以促进肝脏照射后小鼠中lsec、肝实质细胞或者lsec和肝实质细胞的植入。这些结果表明tpom和罗米司亭对hir后的肝血管系统具有再生作用。
[0863]
本领域技术人员会理解,可以对描述的实施方案进行改变而不背离其广泛的发明概念。因此,应当理解本发明不限于所公开的特定实施方案,而是意图涵盖如本说明书定义的本发明的精神和范围内的修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。