hayatine及其类似物在制备mtorc1抑制剂中的应用
技术领域
1.本发明属于药物新用途技术领域,具体涉及hayatine及其类似物在制备mtorc1抑制剂中的应用。
背景技术:
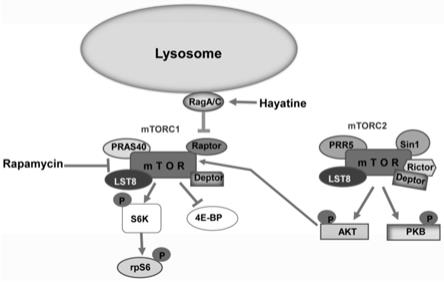
2.众所周知,mtor信号通路决定了细胞生长、增殖、血管生成、蛋白质翻译、能量稳态和脂质代谢
[1,2]
。mtor存在于两种复合物中:mtor复合物1(mtorc1),由raptor、lst8、pras40和deptor组成,通过p70s6k1和4e
‑
bp1的磷酸化调节蛋白质合成和相应细胞增殖
[3]
,而mtorc2由rictor、lst8、sin1、deptor和prr5组成,通过akt/pkb的磷酸化调节细胞存活
[4]
,如图1所示。据报道,异常的mtor信号与多种癌症密切相关,因此作为癌症治疗的热点治疗靶点引起了广泛的兴趣
[2]
。
[0003]
雷帕霉素及其类似物(rapamycin/rapalogs)因其在抑制mtorc1活性及其相关联的特定癌症临床前治疗中的成功使用而受到广泛关注,并成为肿瘤药物治疗的新热点。然而,雷帕霉素及其类似物具有典型的短暂反应,随后肿瘤生长会显著反弹(这一现象称为雷帕霉素耐药),被认为是抑制mtorc1而补偿性激活mtorc2诱导的akt过度活化所引起的。最近的研究表明,雷帕霉素和现有的雷帕霉素类似物并不能完全抑制mtorc1的活性,对mtorc2没有抑制作用,因为雷帕霉素及其类似物的治疗通常会导致补偿性mtorc2
‑
akt蛋白激酶信号通路的过度激活,从而大大降低其作为抗癌剂的益处
[5]
,如图1所示。为了解决这个问题,在临床试验中使用了atp竞争性mtor抑制剂,例如mtor选择性抑制剂(例如osi
‑
027
[6]
、ink
‑
128
[7]
和cc
‑
223
[8]
)和双重mtor/pi3k抑制剂(例如pf
‑
04691502
[9]
、bez235
[10]
和gsk2126458
[11]
),但出现了意想不到的副作用,包括皮疹、体重减轻、粘膜炎,抑郁症、血小板减少症和高脂血症等,再加上它们制备昂贵使其很难推广应用于临床的缺点,强调迫切需要确定在机理上与雷帕霉素/类似物和atp竞争性mtor抑制剂相区分的新型mtorc1抑制剂。
[0004]
此外,目前的mtorc1抑制剂如雷帕霉素及其化学类似物都是人工合成的,面临着不可避免的细胞毒性,甚至是致命后果所带来的巨大挑战
[12]
,同时也伴随着它们对mtorc1活性的不完全抑制作用及短暂抑制效应
[13]
。由于人们从天然化合物中得到了许多重要发现,从而开发出更有效和更安全的治疗药物
[14]
,因此,通过选择有效抑制mtorc1信号的天然化合物,发现新的、安全的抗肿瘤药物的重要性日益提高。
[0005]
mtorc1信号通路对细胞生长起着至关重要的作用
[15]
,其中mtorc1通过ps6k磷酸化核糖体蛋白s6(rps6)来促进合成和代谢过程
[16,17]
。越来越多的证据表明,s6k磷酸化,ps6k
‑
t389,能代表mtorc1的激活水平,因此被接受为筛选mtorc1抑制剂的标准方法
[18]
,而不是以前通过分析靶细胞中ps6水平来筛选mtorc1调控因子的细胞内筛选策略
[19]
。同时,进行了全基因组sirna细胞筛选,发现自噬可能导致溶酶体富集区的mtorc1减少,随后抑制mtorc1信号
[20]
。此外,meyer等人确定gpr137b是一种潜在的底物,它与rag gtpases特异性相互作用,从而调节mtorc1的溶酶体定位和活性
[21]
,强调了自噬在调节mtorc1活性中的重
要作用。因此,通过分析靶细胞中mtorc1在溶酶体上的定位和ps6k
‑
t389磷酸化的结合方法,可以更精确地分析mtorc1活性
[22]
,并使得用同样的方法筛选mtorc1抑制剂的前景更加有吸引力。然而,这种方法对每一种化合物的检测都需要一个长期的操作过程,成本很高,对其大规模应用有很大的影响,因此有必要以更经济、更现实的方式开发新的化合物筛选方法。
[0006]
因此,该领域的研究人员采用了另一种综合方法(vs)来提高筛选mtorc1抑制剂的效率
[18]
。他们开发了一种用于识别新的mtorc1抑制剂结构类似物的筛选模型,并发现了15种新的mtor激酶抑制剂,包括4种具有应用潜力的化合物(ic50值低于10μm)。此外,他们通过细胞研究和western印迹分析证明了这些化合物通过凋亡诱导细胞死亡,揭示了这些化合物具有临床应用潜力的特征
[18]
,但其产生假阳性的缺点仍然很明显
[23]
,这反映了在mtorc1抑制剂发现(尤其是在天然化合物中)方面迫切需要高效准确的筛选系统。最近,研究证实磷酸化的rps6决定了细胞大小的维持
[24]
。此外,blenis等人报告说,雷帕霉素/类似物和atp竞争结合型pi3k/mtor抑制剂
‑
ly294002,能够以ps6k依赖的方式在2
‑
3天内维持其对细胞大小的抑制作用
[25]
,这表明细胞大小在筛选天然mtorc1抑制化合物方面可能发挥作用。
技术实现要素:
[0007]
鉴于以上所述现有技术的缺点,本发明的目的在于提供以下技术方案:
[0008]
式i所示化合物在在制备mtorc1抑制剂中的应用,
[0009][0010]
其中r1和r6为h或c1
‑
c6烷基,所述c1
‑
c6烷基可进一步被卤素、羟基、氨基、氰基、羧基取代;
[0011]
r2、r3、r4、r5为h、c1
‑
c6烷基、c1
‑
c6烷氧基、羟基、硝基、氨基、卤素、氰基、羧基,所述c1
‑
c6烷基可进一步被卤素、羟基、氨基、氰基、羧基取代;同一苯环上,可具有一个或多个r2、r3、r4、r5取代基。
[0012]
进一步优选的所述的应用,其特征在于,式i化合物与蛋白质复合物raga/c相互作用。
[0013]
进一步优选的所述的应用,其特征在于,所述式i化合物为hayatine。
[0014]
本发明还提供另一技术方案,式i所示化合物在在制备预防和治疗由mtor介导的疾病的药物中的应用,所述疾病为癌症或免疫介导的疾病,优选的,所述癌症选自脑和神经血管肿瘤、头颈癌、乳腺癌、肺癌、间皮瘤、淋巴癌、胃癌、肾脏癌、肾癌、肝癌、卵巢癌、卵巢子
宫内膜异位症、睾丸癌、胃肠癌、前列腺癌、成胶质细胞瘤、皮肤癌、黑色素瘤、神经癌、脾癌、胰腺癌、血液增殖性病症、淋巴瘤、白血病、子宫内膜癌、宫颈癌、外阴癌、前列腺癌、阴茎癌、骨癌、肌肉癌、软组织癌、肠或直肠癌、肛门癌、膀胱癌、胆管癌、眼癌、胃肠道间质瘤以及神经内分泌肿瘤;所述免疫介导的疾病选自选自由心脏、肾脏、肝脏、骨髓、皮肤、角膜、肺、胰、小肠、肢体、肌肉、神经、十二指肠、小肠或胰岛细胞移植产生的抗性;由骨髓移植引起的移植物抗宿主病;类风湿性关节炎、系统性红斑狼疮、桥本氏甲状腺炎、多发性硬化症、重症肌无力、i型糖尿病、葡萄膜炎、过敏性脑脊髓炎以及肾小球肾炎,
[0015][0016]
其中r1和r6为h或c1
‑
c6烷基,所述c1
‑
c6烷基可进一步被卤素、羟基、氨基、氰基、羧基取代;
[0017]
r2、r3、r4、r5为h、c1
‑
c6烷基、c1
‑
c6烷氧基、羟基、硝基、氨基、卤素、氰基、羧基,所述c1
‑
c6烷基可进一步被卤素、羟基、氨基、氰基、羧基取代;同一苯环上,可具有一个或多个r2、r3、r4、r5取代基。
[0018]
进一步优选的,上述应用中,所述式i化合物为hayatine。
[0019]
本发明还提供另一技术方案,一种用于抑制mtorc1的药物制剂,其特征在于,包括治疗有效量的式i所示化合物和药学上可接受的辅料,
[0020][0021]
其中r1和r6为h或c1
‑
c6烷基,所述c1
‑
c6烷基可进一步被卤素、羟基、氨基、氰基、羧基取代;
[0022]
r2、r3、r4、r5为h、c1
‑
c6烷基、c1
‑
c6烷氧基、羟基、硝基、氨基、卤素、氰基、羧基,所述c1
‑
c6烷基可进一步被卤素、羟基、氨基、氰基、羧基取代;同一苯环上,可具有一个或多个r2、r3、r4、r5取代基。
[0023]
进一步优选的,所述药物制剂中所述式i化合物为hayatine。
[0024]
进一步优选的,所述的药物制剂为适用于胃肠道或非胃肠道给药的药物制剂。
[0025]
进一步优选的,所述的药物制剂为冻干剂、针剂、片剂、颗粒剂或胶囊剂。
[0026]
进一步优选的,所述药物制剂中式i化合物与蛋白质复合物raga/c相互作用。
[0027]
有益效果,本发明使用多种已建立的方案来确认hayatine抑制mtorc1的能力,还证实了hayatine对氨基酸诱导的mtorc1激活的抑制作用是由于其在mtorc1向溶酶体的易位下调中的作用。重要的是,发现hayatine具有与蛋白质复合物raga/c相互作用的结构新颖性,从而破坏了正常的mtorc1信号,这使得hayatine具有与当前mtorc1抑制剂完全不同的机制独特性。此外,hayatine靶向mtorc1信号复合物而不是mtor本身的这种显著特征可以防止补偿性mtorc2
‑
akt信号过度激活对肿瘤治疗的不利影响。
附图说明:
[0028]
图1为hayatine和rapamycin的作用机理图。
[0029]
图2为化合物筛选流程及hayatine对细胞作用的结果。
[0030]
图3为hayatine对mtorc1信号转导的影响。
[0031]
图4为hayatine对hct116细胞的影响。
[0032]
图5为hayatine对氨基酸诱导mtorc1活化的影响。
[0033]
图6为hayatine作用机制分析。
具体实施方式
[0034]
下面结合具体实施例来进一步描述本发明,但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0035]
下面结合具体实施方式对本专利的技术方案作进一步详细地说明。
[0036]
实施例1天然mtorc1抑制剂的筛选
[0037]
图2中a给出了虚拟筛选流程,建立了一个细胞大小依赖的选择模型来预测mtorc1抑制剂,其中141种天然化合物结合多种分类方法来筛选mtorc1抑制剂。为了避免消化酶等其他可能影响药物选择的因素,采用多发性骨髓瘤(h929)中的悬浮b淋巴细胞进行化合物鉴定。共有141个分子用于h929细胞,为了排除假阳性,选择了5种化合物(标记为#11,#17,#48,#153,#159)(图2中b),根据一个既定标准,要求mtorc1活性相关功能的抑制率大于20%
[18]
。为了避免影响细胞大小的急性细胞毒性效应,在进行上述化合物选择时,比较了化合物治疗后48小时的细胞死亡率,发现标记为#48的化合物hayatine能够显著改变细胞大小而不会引发细胞死亡(图2中c和图2中d)。随后,研究hayatine是否也会影响粘附性肿瘤细胞(如人类大肠肿瘤细胞(hct116))的细胞大小。h流式细胞仪结果证实,hayatine在悬浮细胞和贴壁细胞中都有显著的改变细胞大小的作用(图2中e和图1中f)。
[0038]
实施例2hayatine对mtorc1信号转导的影响
[0039]
为了评价hayatine对mtorc1信号转导的影响,通过检测pt389
‑
s6k蛋白表达和mtorc1诱导的自噬强弱,来测试hayatine是否可以作为一种潜在的mtorc1抑制剂。hayatine对h929和hct116细胞中mtorc1激酶的抑制活性是通过利用pt389
‑
s6k蛋白作为特
异性mtorc1底物的s6k磷酸化活性测定的(图3中a和图3中b)。如图3中c所示,hayatine的治疗可导致mtorc1活性的剂量依赖性抑制,表明hayatine作为一种有效的mtorc1抑制剂。为了检测hayatine是否影响mtorc1活性相关功能,我们使用荧光标记的lc3指示系统测量了hct116细胞的自噬数量,这是基于lc3在自噬形成过程中的一种明显的聚集现象,因为当自噬发生时lc3蛋白通常在胞浆中扩散到细胞膜上形成几个亮绿色荧光点。由于公认的概念是lc3蛋白荧光强度相当于自噬活性强弱,我们通过软件计算荧光强度来评估自噬数量,发现hayatine可以显著诱导自噬(图3中d和图3中e)。蛋白质定量的结果也证实了hayatine在自噬诱导中的上调作用,自噬抑制剂bafilmycin a1可对其进行特异性阻断(图3中f、图3中g和图3中h)。
[0040]
实施例3hayatine抑制癌细胞的生长和细胞迁移。
[0041]
其他mtorc1活性如控制细胞生长和迁移也与肿瘤的进展密切相关。为了进一步证实hayatine是有效的mtorc1抑制剂,我们进行了以下实验。首先,我们检测了hayatine对hct116细胞生长的影响。我们的结果表明,在细胞增殖试验(图4中a)和集落形成试验(图4中b和图4中c)中,hayatine均显著抑制hct116的细胞生长。随后,我们进行了伤口愈合实验,发现hayatine以剂量依赖性的方式阻碍细胞迁移(图4中d&图4中e),表明hayatine在下调肿瘤mtorc1活性中起着关键作用。
[0042]
实施例4hayatine阻断氨基酸诱导mtorc1活化。
[0043]
由于有报道称肿瘤mtorc1活性与环境刺激因子(包括葡萄糖、胰岛素和氨基酸)密切相关
[16]
,因此我们进一步探讨了hayatine是否参与环境因子诱导的mtorc1激活。为此,分别对上述mtorc1活性相关因素进行了测试。我们的数据显示,hayatine能强烈降低s6的磷酸化水平,从而减弱氨基酸或葡萄糖处理下mtorc1的激活(图5中a、图5中b、图5中c和图5中d),与之相反,hayatine在胰岛素(图5中e和图5中f)处理时没有明显变化,表明hayatine作为负调节剂起到了作用在氨基酸诱导的mtorc1激活中。为了进一步研究hayatine参与mtorc1失活的作用,我们在氨基酸刺激下,与hayatine治疗平行,拍摄hct116细胞的免疫荧光图像。我们的结果表明,hayatine显著抑制氨基酸诱导的mtorc1向溶酶体的转运(图5中g&图5中h),这与先前的报道一致,即溶酶体转运与mtorc1的激活密切相关
[20]
。
[0044]
实施例5hayatine作用机制分析
[0045]
进一步进行结构新颖性和药物相似性分析。hayatine的化学结构如图6中a所示。为了评估与已知的mtorc1激酶抑制剂(如雷帕霉素)相关的hit的新颖性,据报道,雷帕霉素通过向mtor招募fkbps来抑制mtorc1活性(图6中b),我们采用对接方式(http://zdock.umassmed.edu)预测raptor向溶酶体募集mtorc1所需的hayatine与raga/c
‑
lamtor复合物(6ehr)的结合方式。令我们惊讶的是,hayatine通过作为mtorc1复合物及其下游信号复合物raga/c之间的链接配体,证明了与目前已知的mtorc1抑制剂的显著差异,但并非作为雷帕霉素及其类似物直接与mtor相互作用,而抑制mtorc1信号传导(图6中c
‑
图6中e)。来自共免疫沉淀实验的数据进一步证实了hayatine破坏了ragc和raptor之间的蛋白联系,从而阻断了mtorc1下游信号传导(图6中f)。这些结果表明,hayatine的发现为mtorc1的抑制提供了一种新的机制,并为进一步优化临床应用提供了有价值的选择。
[0046]
综合以上实验结果可以看出,已使用多种已建立的方案来确认hayatine抑制mtorc1的能力(图3和4)。我们还证实了hayatine对氨基酸诱导的mtorc1激活的抑制作用是
由于其在mtorc1向溶酶体的易位下调中的作用(图5)。重要的是,我们发现hayatine具有与蛋白质复合物raga/c相互作用的结构新颖性,从而破坏了正常的mtorc1信号(图6),这使得hayatine具有与当前mtorc1抑制剂完全不同的机制独特性。此外,hayatine靶向mtorc1信号复合物而不是mtor本身的这种显著特征可以防止补偿性mtorc2
‑
akt信号过度激活对治疗的不利影响,即有效克服了当前临床应用中的雷帕霉素耐药的难题(图1)。
[0047]
参考文献:
[0048]
1.holroyd,a.k.and a.m.michie,the role of mtor
‑
mediated signaling in the regulation of cellular migration.immunol lett,2018.196:p.74
‑
79.
[0049]
2.kim,y.c.and k.l.guan,mtor:a pharmacologic target for autophagy regulation.j clin invest,2015.125(1):p.25
‑
32.
[0050]
3.laplante,m.and d.m.sabatini,mtor signaling in growth control and disease.cell,2012.149(2):p.274
‑
93.
[0051]
4.sarbassov,d.d.,et al.,phosphorylation and regulation of akt/pkb by the rictor
‑
mtor complex.science,2005.307(5712):p.1098
‑
101.
[0052]
5.brown,r.e.,et al.,morphoproteomics and biomedical analytics confirm the mtorc2/akt pathway as a resistance signature and activated erk and stat3 as concomitant prosurvival/antiapoptotic pathways in metastatic renal cell carcinoma(rcc)progressing on rapalogs:pathogenesis and therapeutic options.oncotarget,2016.7(27):p.41612
‑
41621.
[0053]
6.bhagwat,s.v.,et al.,preclinical characterization of osi
‑
027,a potent and selective inhibitor of mtorc1 and mtorc2:distinct from rapamycin.mol cancer ther,2011.10(8):p.1394
‑
406.
[0054]
7.li,c.,et al.,the preclinical evaluation of the dual mtorc1/2inhibitor ink
‑
128as a potential anti
‑
colorectal cancer agent.cancer biol ther,2015.16(1):p.34
‑
42.
[0055]
8.bendell,j.c.,et al.,a phase i dose
‑
escalation study to assess safety,tolerability,pharmacokinetics,and preliminary efficacy of the dual mtorc1/mtorc2 kinase inhibitor cc
‑
223in patients with advanced solid tumors or multiple myeloma.cancer,2015.121(19):p.3481
‑
90.
[0056]
9.yuan,j.,et al.,pf
‑
04691502,a potent and selective oral inhibitor of pi3k and mtor kinases with antitumor activity.mol cancer ther,2011.10(11):p.2189
‑
99.
[0057]
10.rodon,j.,et al.,phase 1/1b dose escalation and expansion study of bez235,a dual pi3k/mtor inhibitor,in patients with advanced solid tumors including patients with advanced breast cancer.cancer chemother pharmacol,2018.82(2):p.285
‑
298.
[0058]
11.wang,m.,et al.,[11c]gsk2126458 and[18f]gsk2126458,the first radiosynthesis of new potential pet agents for imaging of pi3k and mtor in cancers.bioorg med chem lett,2012.22(4):p.1569
‑
74.
[0059]
12.barlow,a.d.,et al.,rapamycin toxicity in min6 cells and rat and human islets is mediated by the inhibition of mtor complex 2(mtorc2).diabetologia,2012.55(5):p.1355
‑
65.
[0060]
13.shin,s.h.,et al.,synthetic lethality by targeting the ruvbl1/2
‑
ttt complex in mtorc1
‑
hyperactive cancer cells.sci adv,2020.6(31):p.eaay9131.
[0061]
14.koehn,f.e.and g.t.carter,the evolving role of natural products in drug discovery.nat rev drug discov,2005.4(3):p.206
‑
20.
[0062]
15.kim,j.and k.l.guan,mtor as a central hub of nutrient signalling and cell growth.nat cell biol,2019.21(1):p.63
‑
71.
[0063]
16.saxton,r.a.and d.m.sabatini,mtor signaling in growth,metabolism,and disease.cell,2017.169(2):p.361
‑
371.
[0064]
17.deng,l.,et al.,ubiquitination of rheb governs growth factor
‑
induced mtorc1 activation.cell res,2019.29(2):p.136
‑
150.
[0065]
18.wang,l.,et al.,discovering new mtor inhibitors for cancer treatment through virtual screening methods and in vitro assays.sci rep,2016.6:p.18987.
[0066]
19.hoffman,g.r.,et al.,a high
‑
throughput,cell
‑
based screening method for sirna and small molecule inhibitors of mtorc1 signaling using the in cell western technique.assay drug dev technol,2010.8(2):p.186
‑
99.
[0067]
20.mutvei,a.p.,et al.,rap1
‑
gtpases control mtorc1 activity by coordinating lysosome organization with amino acid availability.nat commun,2020.11(1):p.1416.
[0068]
21.gan,l.,et al.,the lysosomal gpcr
‑
like protein gpr137b regulates rag and mtorc1 localization and activity.nat cell biol,2019.21(5):p.614
‑
626.
[0069]
22.zhang,j.,et al.,a tuberous sclerosis complex signalling node at the peroxisome regulates mtorc1 and autophagy in response to ros.nat cell biol,2013.15(10):p.1186
‑
96.
[0070]
23.wang,j.,y.ge,and x.q.xie,development and testing of druglike screening libraries.j chem inf model,2019.59(1):p.53
‑
65.
[0071]
24.ruvinsky,i.and o.meyuhas,ribosomal protein s6 phosphorylation:from protein synthesis to cell size.trends biochem sci,2006.31(6):p.342
‑
8.
[0072]
25.fingar,d.c.,et al.,mammalian cell size is controlled by mtor and its downstream targets s6k1 and 4ebp1/eif4e.genes dev,2002.16(12):p.1472
‑
87.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。