1.本发明涉及中检测技术领域,涉及一种检测蛋白凝胶消化吸收特性动物模型的构建方法及应用。
背景技术:
2.随着人们消费理念的转变和对健康食品的追求不断提高,需要对食品的消化吸收特性进行评估。常见的消化方法分为体外模拟消化和动物体内消化。
3.wen s,zhou g,song s,et al.discrimination of in vitro and in vivo digestion products of meat proteins from pork,beef,chicken,and fish[j].proteomics,2015,15(21):3688
‑
3698公开的方法为:乳酸菌
‑
mtg酶共诱导条件下双蛋白乳的凝胶行为及其蛋白体外消化率和抗原性的研究。
[0004]
gallier s,cui j,olson t d,et al.in vivo digestion of bovine milk fat globules:effect of processing and interfacial structural changes.i.gastric digestion[j].food chemistry,2013,141(3):3273
‑
3281公开的方法为:采用提取蛋白或灌胃的方法并不适用于蛋白凝胶类食品,无法研究其结构对消化特性的影响。体外模拟消化虽然具有简便、低成本和不受动物实验伦理约束的优点被广泛用于食品消化特性的研究,但是对于具有一定立体结构的蛋白凝胶类食品来说,体外模拟消化可能并不能很好的模拟其在人体消化道内的消化行为。因此,蛋白凝胶类食品更适合应用大鼠体内消化模型对其消化特性进行探究。
[0005]
喂食是体内消化实验中很重要的一个环节。目前常用的喂食方法有灌胃法或将实验样品与标准饲料混合喂养,但是灌胃法只适用于液体样品或易溶的样品,不适用于凝胶食品,而将蛋白提取出来制作成混合饲料则不能体现出凝胶结构对消化特性的影响,因此需要设计出一种适用于蛋白凝胶类食品在大鼠体内消化的动物模型建立。
[0006]
同时,目前也缺少一套对蛋白凝胶类食品消化特性进行评价的方案,包括饲料转化率,蛋白质消化率,消化动力学,消化产物肽组学分析、氨基酸组成分析,以及血清代谢组学分析等。很多研究只关注了其中的几项研究,而不能完整的,系统的对其消化特性进行分析,因此本发明提出了一种适用于蛋白凝胶类食品的大鼠体内消化吸收方案,为研究蛋白凝胶类食品的营养特性提供参考。
技术实现要素:
[0007]
为解决上述技术问题,本发明提供一种基于人工胃肠系统的模拟动态消化吸收凝胶类食物的方法及应用。
[0008]
本发明提供所采用的技术方案是:
[0009]
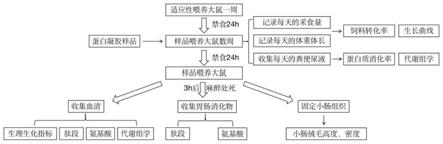
一种检测蛋白凝胶消化吸收特性动物模型的构建方法,所述方法包括以下步骤:
[0010]
1)选取sd大鼠,每只大鼠单独放在一个代谢笼中;
[0011]
2)第一阶段:标准饲料适应性喂养大鼠一周,禁食24h后;
[0012]
3)第二阶段:开始用蛋白凝胶样品喂养,每天固定时间投喂蛋白凝胶样品,自由饮水,次日早上相同时间收集剩余蛋白凝胶样品,称重后丢弃,另投喂蛋白凝胶;
[0013]
4)第三阶段:第二阶段结束后,禁食24h后,在第二阶段投喂蛋白凝胶样品的时间同样给每只大鼠投喂蛋白凝胶样品,3
‑
4小时后取出大鼠并用异氟烷气体处死,腹主动脉采集血液,收集大鼠胃和小肠中的消化物;
[0014]
完成检测蛋白凝胶消化吸收特性动物模型的构建。
[0015]
优选地,所述步骤1):大鼠规格为不少于5只体重在200
±
20g的雄性sd大鼠。
[0016]
优选地,所述步骤2):标准饲料是生长繁殖饲料ain93g的g型。
[0017]
优选地,所述步骤3)中,第二阶段蛋白凝胶样品的喂养时间大于一周,投喂蛋白凝胶样品量为95
‑
105g。
[0018]
进一步优选地,所述步骤3)中,第二阶段蛋白凝胶样品的喂养时间大于一周,投喂蛋白凝胶样品量为100g。
[0019]
优选地,所述步骤3)第二阶段中,每天对大鼠的体重和体长进行测量并收集粪便,称重后于
‑
80℃冷冻保存。
[0020]
优选地,所述步骤4)第三阶段中,投喂蛋白凝胶样品量为95
‑
105g,3
‑
4小时后取出大鼠并用5%异氟烷气体处死。
[0021]
进一步优选地,所述步骤4)第三阶段中,投喂蛋白凝胶样品量为100g。
[0022]
优选地,所述步骤4)第三阶段中,大鼠处死后,腹主动脉采集血液后离心后取上清液在
‑
80℃冷冻保存;收集大鼠胃和小肠中的消化物,沸水浴灭酶8
‑
12min后在
‑
80℃冷冻保存,剪取十二指肠近端1.0cm*1.0cm组织块,用生理盐水冲洗干净后投入固定液中固定24h,经处理后石蜡包埋,切片后用苏木精伊红染色观察小肠结构。
[0023]
进一步优选地,固定液为8
‑
12%甲醛水溶液(v/v)。
[0024]
优选地,所述方法制备的动物模型用于测定玉米凝胶的消化吸收特性,
[0025]
通过每天记录的体重和体长数据绘制大鼠的生长曲线;
[0026]
通过记录的每天的采食量和体重数据计算出饲料转化率;
[0027]
通过每天收集的粪便计算蛋白质消化率,收集的粪便和尿液样品做代谢组学分析;
[0028]
收集的血清做生理生化指标、肽段、氨基酸和代谢组学分析;
[0029]
收集的胃肠消化物做肽段和氨基酸分析;
[0030]
固定好的小肠组织染色拍照观察计算小肠绒毛高度和密度。
[0031]
本发明的有益效果是:
[0032]
1、本发明比灌胃法和混合饲料法更适合研究蛋白凝胶类食品的消化吸收特性。
[0033]
2、本发明可以探究蛋白凝胶类食品的结构对消化吸收特性的影响。
[0034]
3、本发明可以为蛋白凝胶类食品的消化吸收特性检测提供完整系统的方案。
附图说明
[0035]
图1鱼糜凝胶消化率;
[0036]
图2第二阶段记录的大鼠每天的体重曲线图;
[0037]
图3第二阶段记录的大鼠每天的体长曲线图;
[0038]
图4大鼠十二指肠he染色照片;
[0039]
图5检测蛋白凝胶消化吸收特性动物模型的构建方法流程图。
具体实施方式
[0040]
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅是帮助理解本发明,不应视为对本发明的具体限制。
[0041]
实施例1
[0042]
制备出一种蛋白凝胶,采用本发明提出的大鼠体内消化吸收模型分析其消化吸收特性。
[0043]
选取6只雄性sd大鼠,体重200
±
20g,喂食蛋白凝胶样品。在实验前进行了两个适应期。实验室内温度保持在22
±
3℃,自动控制光照
‑
暗交替12h。第一阶段是在一个金属丝底部的笼子里住一个星期。大鼠喂食标准实验室饲料(ain93g),自由饮水。第二阶段为每只大鼠在单独的代谢笼中饲养一周。各组大鼠分别饲喂相应的标准饲料或试验蛋白凝胶,每只大鼠每天饲喂100g标准饲料或试验蛋白凝胶,随机饮水,每天记录采食量,体重,体长,并收集粪便。实验前一天,将大鼠禁食24小时以清空胃肠道中的食糜。上午9时,每只大鼠仅提供100克实验蛋白凝胶,11时从笼中取出。然后,用5%异氟烷气体麻醉大鼠,12:30左右从腹主动脉采血至离心管。低速离心后,立即保存于
‑
80℃。将胃、肠内容物在液氮中迅速冷冻,然后在
‑
80℃保存。
[0044]
凝胶的制备方法包括:
[0045]
将200克解冻后的冷冻鱼糜用料理机斩拌1min,加入2.5%(w/w)nacl和mtgase(15u/g蛋白)与鱼糜混合斩拌3分钟,然后将斩拌好的鱼糜装入20毫米直径的肠衣中用密封好,并用二段式加热方法进行加热,即在90℃下加热30min,然后在40℃下加热2h。加热完成的鱼糜凝胶冷却至常温后放入4℃冰箱中保存。
[0046]
检测指标包括:
[0047]
1.消化率:
[0048]
将蛋白凝胶和收集到的大鼠粪便样品参照gb/t 6432
‑
2018 7.2测定粗蛋白含量并按如下公式计算蛋白质消化率:
[0049]
消化率(%)=(p凝胶
‑
p粪便)/p凝胶*100%
[0050]
其中,p凝胶为每只大鼠每天摄食的蛋白凝胶中的粗蛋白含量,g;p粪便为每只大鼠每天的粪便中的粗蛋白含量,g。
[0051]
2.饲料转化率:
[0052]
饲料转换率(%)=每只大鼠增加的体重(g)/每只大鼠摄食的蛋白凝胶(g)
[0053]
3.蛋白质功效比:
[0054]
蛋白质功效比(%)=大鼠增加的体重(g)/摄入的蛋白质质量(g)
[0055]
4.血清生理生化指标:
[0056]
4℃解融血清样本后,用深圳迈瑞bs
‑
420型全自动生化分析仪检测,检测试剂为深圳迈瑞配套生化试剂盒。
[0057]
5.肽段分析:
[0058]
取血清或胃肠消化液用ziptip移液管脱盐,然后采用反相液相色谱
‑
电喷雾电离
‑
gas(cur):30,source temperature:600℃,ionsapary voltage floating(isvf)
±
5500v(正负两种模式);tof ms scan m/z range:60
‑
1000da,product ion scan m/z range:25
‑
1000da,tof ms scan accumulation time 0.20s/spectra,product ion scan accumulation time 0.05s/spectra;二级质谱采用information dependent acquisition(ida)获得,并且采用high sensitivity模式,declustering potential(dp):
±
60v(正负两种模式),collision energy:35
±
15ev,ida设置如下exclude isotopes within 4da,candidate ions to monitor per cycle:10。
[0070]
wiff格式的原始数据经proteowizard转换成.mzxml格式,然后采用xcms软件进行峰对齐、保留时间校正和提取峰面积。对xcms提取得到的数据首先进行代谢物结构鉴定、数据预处理,然后进行实验数据质量评价,最后再进行数据分析。
[0071]
8.小肠he染色:
[0072]
将小肠用生理盐水冲洗干净后用10%甲醛水溶液(v/v)固定,经处理后石蜡包埋。切片后用苏木精伊红染色观察小肠结构。
[0073]
将喂养的样品及粪便进行凯氏定氮测定粗蛋白含量并计算消化率,结果如图1所示。
[0074]
将第二阶段记录的大鼠每天的体重、体长数据绘制成生长曲线图,如图2,3所示。
[0075]
蛋白凝胶在大鼠体内的饲料转化率和蛋白质功效比如表1所示。
[0076]
表1饲料转化率和蛋白质功效比
[0077][0078][0079]
蛋白凝胶喂养的大鼠血清中生理生化指标如表2所示。
[0080]
表2大鼠血清中生理生化指标结果
[0081][0082]
蛋白凝胶对大鼠血清,胃和小肠中的氨基酸及其衍生物浓度如表3所示。
[0083]
表3大鼠血清,胃和小肠中的氨基酸及其衍生物浓度
[0084][0085][0086]
胃和小肠消化液中的肽段来源和数量分析分别如表4和5所示。
[0087]
表4胃消化液中的肽段来源和数量分析
[0088]
[0089][0090]
表5小肠消化液中的肽段来源和数量分析
[0091]
蛋白质登记号肽段数量a8r0q220s4u1r319q9df4017a8r0q411a8r0q711d0etj27b6uv985d7riy22e9jmf52i6sn932
[0092]
大鼠血清和粪便中代谢物种类及含量分析如表6所示。
[0093]
表6血清和粪便中代谢物种类及含量分析
[0094]
[0095]
[0096]
[0097][0098]
大鼠十二指肠he染色照片及绒毛长度如图4所示,平均为205.15μm。
[0099]
由上结果可知,本发明提出的消化方案适用于蛋白凝胶类食品消化吸收特性的研究。
[0100]
本文中所描述的具体实施例仅仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。