1.本发明涉及一种生物素标记缓冲液,属于生物材料技术领域。
背景技术:
2.抗体可经过酶标记、荧光素标记或通过生物素标记获得标记抗体,是用于观察抗原抗体免疫复合物方面研究的手段。生物素与抗原、抗体等蛋白质结合后,不影响后者的免疫活性,但用酶标记时则结果有不同。因此近年来,生物素化的抗体在临床检测和免疫实验中的使用需求迅速增长。抗体生物素化目前主要是通过加入活化的生物素来实现,但是生物素与抗体在标记过程中常出现标记效率低的问题,通常需要大剂量的生物素用来标记抗体才可完成标记。
技术实现要素:
3.本发明的目的在于提供一种生物素标记缓冲液,可提高生物素标记抗体的效率,即添加更少的生物素用以完成抗体标记。
4.为达到上述目的,本发明提供如下技术方案:一种生物素标记缓冲液,所述生物素标记缓冲液包括以下组分:十二水合磷酸氢二钠、二水合磷酸二氢钠、三水合磷酸氢二钾、磷酸二氢钾、氯化钠、氯化钾;
5.所述生物素标记缓冲液的ph值为7.2~7.6;
6.其中,所述生物素标记缓冲液每1l水溶剂中溶解有所述十二水合磷酸氢二钠6~6.4g、二水合磷酸二氢钠0.6~0.9g、三水合磷酸氢二钾4~4.4g、磷酸二氢钾0.4~0.6g、氯化钠0.6~0.8g、氯化钾0.6~0.8g。
7.进一步地,所述生物素标记缓冲液中还包括表面活性剂tritonx~100及tween20,所述生物素标记缓冲液每1l水溶剂中溶解有tritonx~100 0.3ml、及tween20 0.2ml。
8.进一步地,所述水溶剂为体外诊断试剂用纯化水。
9.进一步地,所述生物素标记缓冲液使用的生物素为生物素~x~x~nhs,所述生物素~x~x~nhs为生物素~6~(生物氨基己酰氨基)己酸n~羟基琥珀酰亚胺酯。
10.进一步地,在使用所述生物素标记抗体时,所述抗体溶解在所述生物素标记缓冲液中,并在2℃~8℃环境下透析16h。
11.进一步地,所述抗体溶于所述生物素标记缓冲液的浓度为1.0~4.0mg/ml。
12.进一步地,将所述生物素溶解在含有所述抗体的生物素标记缓冲液中,于18~37℃中反应1h。
13.进一步地,所述生物素和所述抗体的摩尔比为1:5~1:10。
14.进一步地,所述生物素的溶剂为有机溶剂或者水溶液,所述有机溶剂为二甲基甲酰胺、二甲亚砜、吡啶中的一种或多种。
15.进一步地,所述生物素标记抗体后需在20mmol/l磷酸盐缓冲液中透析纯化。
16.本发明的有益效果在于:生物素标记缓冲液为低离子浓度缓冲液,该缓冲液中,离
子强度及缓冲环境使得抗体更加稳定,抗体与生物素更容易结合,从而使得标记使用的生物素与抗体之间比例更低,即使用更低剂量的生物素与抗体完成标记,生物素标记抗体的效率更高。且本发明的生物素标记缓冲液标记的重复性高于常规标记缓冲液,且具有背景低、信噪比高的优势。
17.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
附图说明
18.图1为ca15
‑
3生物素标记抗体检测不同浓度样本发光值比较图;
19.图2为ca72
‑
4生物素标记抗体检测不同浓度样本发光值比较图。
具体实施方式
20.下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
21.本发明提供一种生物素标记缓冲液,包括以下组分:十二水合磷酸氢二钠、二水合磷酸二氢钠、三水合磷酸氢二钾、磷酸二氢钾、氯化钠、氯化钾;
22.生物素标记缓冲液的ph值为7.2~7.6;
23.其中,生物素标记缓冲液每1l水溶剂中溶解有十二水合磷酸氢二钠6~6.4g、二水合磷酸二氢钠0.6~0.9g、三水合磷酸氢二钾4~4.4g、磷酸二氢钾0.4~0.6g、氯化钠0.6~0.8g、氯化钾0.6~0.8g,配置低离子浓度的缓冲液,可提高标记的效率,并减少使用的生物素、节约资源。
24.生物素标记缓冲液中还包括表面活性剂tritonx~100及tween20,生物素标记缓冲液每1l水溶剂中溶解有tritonx~100 0.3ml,及tween20 0.2ml。由于待生物素化的抗体上存在氨基,氨基不易被接近,从而可能造成抗体生物素化不足,加入表面活性剂tritonx~100和tween20可有效改善抗体生物素化不足的问题。表面活性剂可根据试剂使用情况对添加量进行增减,还可以为其他表面活性剂,在此不一一列举。
25.生物素标记缓冲液中水溶剂为体外诊断试剂用纯化水。
26.生物素标记缓冲液使用的生物素为生物素~x~x~nhs,生物素~x~x~nhs为生物素~6~(生物氨基己酰氨基)己酸n~羟基琥珀酰亚胺酯。使用标记有nhs的生物素,即已经活化过的生物素,它是可溶于水的,能够简单、有效地将溶液中的抗体进行生物素化。
27.在使用生物素标记抗体时,抗体溶解在生物素标记缓冲液中,抗体溶于生物素标记缓冲液后的浓度为1.0~4.0mg/ml,因为抗体的原溶液中含有叠氮钠、甘油等物质,会对后续生物素标记抗体造成影响,故,需将抗体在2℃~8℃环境下透析16h进行纯化以除去这些物质,进而得到纯化后抗体。
28.根据添加进生物素标记缓冲液中的生物素和抗体的摩尔比为1:5~1:10,计算出需要进行标记反应的生物素使用量。并将生物素溶解在有机溶剂或者水溶液中,将其加入在含有抗体的生物素标记缓冲液中,在18~37℃反应1h进行生物素标记抗体反应。需要说明的是,生物素溶解在含有抗体的生物素标记缓冲液中,即生物素溶解在抗体透析后的生物素标记缓冲液中。
29.反应完成后,在20mmol/l磷酸盐缓冲液中透析纯化,除去游离的生物素。
30.添加进生物素标记缓冲液中的生物素和抗体的摩尔比为1:5~1:10,使用较小剂量的生物素和抗体即可完成抗体生物素化。
31.生物素溶解在有机溶剂或者水溶液中,有机溶剂为二甲基甲酰胺、二甲亚砜、吡啶中的一种或多种。需要说明的是,生物素的溶剂还可以为其他溶剂,可根据实际需要进行选择,在此不一一赘述。
32.生物素标记抗体后需在20mmol/l磷酸盐缓冲液中透析纯化,透析时间可按照具体操作情况进行调整。对溶解有抗体的生物素缓冲液需要透析进行纯化,将溶液中残留的生物素祛除,还可以为其他的纯化方法。需要说明的是,此处使用的磷酸盐缓冲液为常规磷酸盐缓冲液,故对此不再赘述。
33.下面以具体实施例进行详细说明:
34.实施例1
35.称取以下试剂:
36.十二水合磷酸氢二钠:6g;
37.二水合磷酸二氢钠:0.6g;
38.三水合磷酸氢二钾:4g;
39.磷酸二氢钾:0.4g;
40.氯化钠:0.6g;
41.氯化钾:0.6g;
42.tritonx~100:0.3ml;
43.tween20:0.2ml;
44.量取适量体外诊断试剂用纯化水,将上述称量好的十二水合磷酸氢二钠、二水合磷酸二氢钠、三水合磷酸氢二钾、磷酸二氢钾、氯化钠、氯化钾依次加入体外诊断试剂用纯化水中,搅拌均匀使其充分溶解混匀;
45.加入tritonx~100及tween20搅拌均匀使其充分溶解混匀,用体外诊断试剂用纯化水定容至1l,然后,加入盐酸调节ph值到ph 7.2。
46.用0.45μm滤膜过滤后,得到生物素标记缓冲液,并将其置于2℃~8℃保存备用。
47.使用生物素标记缓冲液将待标记的抗体1mg稀释至2mg/ml浓度,而后将其转入透析袋(截留分子量8000~12000d),在生物素标记缓冲液中透析16h,环境温度保持在2℃~8℃。
48.添加0.56mg(分子量589)的生物素在95.1μl的有机溶剂二甲基甲酰胺中,使得配置的生物素浓度为10mmol/l。取6.6μl的浓度为10mmol/l的生物素加入到抗体含量为1mg的生物素标记缓冲液中,此时,抗体和生物素的摩尔比为1:10,18~37℃条件下反应1h。
49.标记反应结束后将标记抗体转入透析袋在离子浓度为20mmol/l、ph值为7.2的磷酸盐缓冲液中透析16h。
50.实施例2
51.称取以下试剂:
52.十二水合磷酸氢二钠:6.4g;
53.二水合磷酸二氢钠:0.9g;
54.三水合磷酸氢二钾:4.4g;
55.磷酸二氢钾:0.6g;
56.氯化钠:0.8g;
57.氯化钾:0.6~0.8g;
58.tritonx~100:0.3ml;
59.tween20:0.2ml;
60.量取适量体外诊断试剂用纯化水,将上述称量好的十二水合磷酸氢二钠、二水合磷酸二氢钠、三水合磷酸氢二钾、磷酸二氢钾、氯化钠、氯化钾依次加入体外诊断试剂用纯化水中,搅拌均匀使其充分溶解混匀;
61.加入tritonx~100及tween20搅拌均匀使其充分溶解混匀,用体外诊断试剂用纯化水定容至1l,然后,加入盐酸调节ph值到ph 7.2。
62.用0.45μm滤膜过滤后,得到生物素标记缓冲液,并将其置于2℃~8℃保存备用。
63.使用生物素标记缓冲液将待标记的抗体1mg稀释至2mg/ml浓度,而后将其转入透析袋(截留分子量8000~12000d),在生物素标记缓冲液中透析16h环境温度保持在2℃~8℃。
64.添加0.56mg(分子量589)的生物素在95.1μl的二甲基甲酰胺中,浓度即为10mmol/l。取6.6μl的浓度为10mmol/l的生物素加入到抗体含量为1mg的生物素标记缓冲液中,抗体和生物素的摩尔比为1:10,18~37℃条件下反应1h。
65.标记反应结束后将标记抗体转入透析袋在离子浓度为20mmol/l、ph值为7.2的磷酸盐缓冲液中透析16h。
66.实施例3
67.十二水合磷酸氢二钠:6g;
68.二水合磷酸二氢钠:0.6g;
69.三水合磷酸氢二钾:4g;
70.磷酸二氢钾:0.4g;
71.氯化钠:0.6g;
72.氯化钾:0.6g;
73.tritonx~100:0.3ml;
74.tween20:0.2ml;
75.量取适量体外诊断试剂用纯化水,将上述称量好的十二水合磷酸氢二钠、二水合磷酸二氢钠、三水合磷酸氢二钾、磷酸二氢钾、氯化钠、氯化钾依次加入体外诊断试剂用纯化水中,搅拌均匀使其充分溶解混匀;
76.加入tritonx~100及tween20搅拌均匀使其充分溶解混匀,用体外诊断试剂用纯化水定容至1l,然后,加入盐酸调节ph值到ph 7.2。
77.用0.45μm滤膜过滤后,得到生物素标记缓冲液,并将其置于2℃~8℃保存备用。
78.使用生物素标记缓冲液将待标记的抗体1mg稀释至2mg/ml浓度,而后将其转入透析袋(截留分子量8000~12000d),在生物素标记缓冲液中透析16h环境温度保持在2℃~8℃。
79.添加0.56mg(分子量589)的生物素在95.1μl的二甲基甲酰胺中,浓度即为10mmol/
l。取3.3μl浓度为10mmol/l的生物素加入到抗体含量为1mg的生物素标记缓冲液中,抗体和生物素的摩尔比为1:5,18~37℃条件下反应1h。
80.标记反应结束后将标记抗体转入透析袋在离子浓度为20mmol/l、ph值为7.2的磷酸盐缓冲液中透析16h。
81.实施例4
82.称取以下试剂:
83.十二水合磷酸氢二钠:6.4g;
84.二水合磷酸二氢钠:0.9g;
85.三水合磷酸氢二钾:4.4g;
86.磷酸二氢钾:0.6g;
87.氯化钠:0.8g;
88.氯化钾:0.6~0.8g;
89.tritonx~100:0.3ml;
90.tween20:0.2ml;
91.量取适量体外诊断试剂用纯化水,将上述称量好的十二水合磷酸氢二钠、二水合磷酸二氢钠、三水合磷酸氢二钾、磷酸二氢钾、氯化钠、氯化钾依次加入体外诊断试剂用纯化水中,搅拌均匀使其充分溶解混匀;
92.加入tritonx~100及tween20搅拌均匀使其充分溶解混匀,用体外诊断试剂用纯化水定容至1l,然后,加入盐酸调节ph值到ph 7.2。
93.用0.45μm滤膜过滤后,得到生物素标记缓冲液,并将其置于2℃~8℃保存备用。
94.使用生物素标记缓冲液将待标记的抗体1mg稀释至2mg/ml浓度,而后将其转入透析袋(截留分子量8000~12000d),在生物素标记缓冲液中透析16h环境温度保持在2℃~8℃。
95.添加0.56mg(分子量589)的生物素在95.1μl的二甲基甲酰胺中,浓度即为10mmol/l。取3.3μl浓度为10mmol/l的生物素加入到抗体含量为1mg的生物素标记缓冲液中,抗体和生物素的摩尔比为1:5,18~37℃条件下反应1h。
96.标记反应结束后将标记抗体转入透析袋在离子浓度为20mmol/l、ph值为7.2的磷酸盐缓冲液中透析16h。
97.使用实施例1至4制备获得的生物素标记抗体、及使用常规标记缓冲液制备获得的生物素标记抗体,对配对组合的抗原进行反应,实验数据记录在表1
‑
6,需要说明的是,实施例1至4中所用的抗体可以为ca15
‑
3抗体、ca72
‑
4抗体或其他抗体。
98.表1至表3为ca15
‑
3标记抗体实验数据,表4至表6为ca72
‑
4标记抗体实验数据。
99.将实施例1至4获得的生物素标记后的ca15
‑
3抗体使用缓冲液稀释成工作液,分别检测0浓度及80u/ml浓度的ca15
‑
3样本;使用0.1mol/l ph值为7.2的磷酸盐缓冲液(常规标记缓冲液)标记的ca15
‑
3抗体作为对照,同样检测0浓度及80u/ml浓度的ca15
‑
3样本,计算其信噪比,实验结果见表1。
100.表1 ca15
‑
3标记抗体信噪比
[0101][0102]
观察表1,常规标记缓冲液标记抗体信噪比明显低于本技术配置缓冲液的信噪比,且本技术配置缓冲液的底噪明显低于常规标记缓冲液,本技术配置缓冲液具有背景低,信噪比高的特点,抗体生物素化效果更好。
[0103]
分别将实施例1至4获得的生物素标记后的ca15
‑
3抗体使用缓冲液稀释成工作液,对0u/ml、5u/ml、20u/ml、80u/ml、200u/ml、及500u/ml浓度的ca15
‑
3样品进行发光值检测;使用0.1mol/l ph值为7.2的磷酸盐缓冲液(常规标记缓冲液)标记的ca15
‑
3抗体作为对照,同样对0u/ml、5u/ml、20u/ml、80u/ml、200u/m、及500u/ml浓度的ca15
‑
3样品进行发光值检测,实验数据见表2,并绘制成曲线对比图见图1。
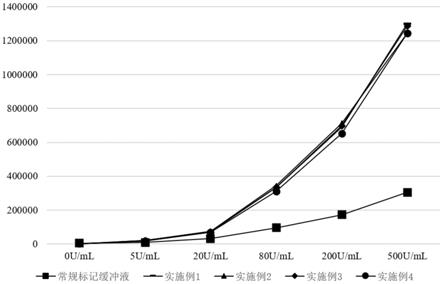
[0104]
表2 ca15
‑
3标记抗体测试样本数据
[0105][0106]
观察图1,可直观的看出常规标记缓冲液标记抗体与实施例1、实施例2、实施例3、实施例4配置的缓冲液标记抗体检测相同浓度的样本,常规标记缓冲液组的样本发光值曲线明显低于本技术的缓冲液的发光值曲线,本技术的生物素标记缓冲液标记效率更高。且实施例1、实施例2、实施例3、实施例4配置的缓冲液标记效果均高于常规标记缓冲液。
[0107]
将实施例1至4获得的生物素标记后的ca15
‑
3抗体使用缓冲液稀释成工作液,对0u/ml、80u/ml浓度的ca15
‑
3样本重复进行10次检验,计算标记抗体的重复性;使用0.1mol/l ph值为7.2的磷酸盐缓冲液(常规标记缓冲液)标记的ca15
‑
3抗体作为对照,统计学数据
和结果见表3。
[0108]
表3 ca15
‑
3标记抗体重复性检测
[0109][0110]
观察表3,常规标记缓冲液的cv值均>10%,而本技术配置的缓冲液cv值均<5%,本技术配置的缓冲液重复性明显高于常规标记缓冲液。
[0111]
将实施例1至4获得的生物素标记后的ca72
‑
4抗体使用缓冲液稀释成工作液,分别检测0u/ml、50u/ml浓度的ca72
‑
4样本;使用0.1mol/l ph值为7.2的磷酸盐缓冲液(常规标记缓冲液)标记的ca72
‑
4抗体做为对照,同样检测0u/ml、50u/ml浓度的ca72
‑
4样本,计算其信噪比,实验结果见表4。
[0112]
表4 ca72
‑
4标记抗体信噪比
[0113][0114]
观察表4,常规标记缓冲液标记抗体信噪比明显低于本技术配置缓冲液的信噪比,且本技术配置缓冲液的底噪明显低于常规标记缓冲液,本技术配置缓冲液具有背景低,信噪比高的特点,抗体生物素化效果更好。
[0115]
分别将实施例1至4获得的生物素标记后的ca72
‑
4抗体使用缓冲液稀释成工作液,对0u/ml、2u/ml、10u/ml、50u/ml、150u/ml、及300u/ml浓度的ca72
‑
4样品进行发光值检测;使用0.1mol/l ph值为7.2的磷酸盐缓冲液(常规标记缓冲液)标记的ca72
‑
4抗体做为对照,同样对0u/ml、2u/ml、10u/ml、50u/ml、150u/ml、及300u/ml浓度的ca72
‑
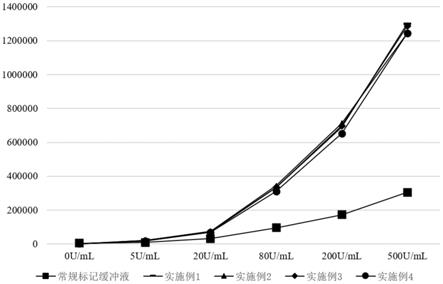
4样品进行发光值检测,实验数据见表5,并绘制成曲线对比图见图2。
[0116]
表5 ca72
‑
4标记抗体测试样本数据
[0117][0118]
观察图2,可直观的看出常规标记缓冲液标记抗体与实施例1、实施例2、实施例3、实施例4配置的缓冲液标记抗体检测相同浓度的样本,常规标记缓冲液组的样本发光值曲线明显低于本技术的缓冲液的发光值曲线,本技术的生物素标记缓冲液标记效率更高。且实施例1、实施例2、实施例3、实施例4配置的缓冲液标记效果均高于常规标记缓冲液。
[0119]
分别将实施例1至4获得的生物素标记后的ca72
‑
4抗体使用缓冲液稀释成工作液,对0u/ml、50u/ml浓度的ca72
‑
4样本重复进行10次检验,计算标记抗体的重复性;使用0.1mol/l ph值为7.2的磷酸盐缓冲液(常规标记缓冲液)标记的ca72
‑
4抗体做为对照,统计
学数据和结果见表6。
[0120]
表6 ca72
‑
4标记抗体重复性检测
[0121][0122][0123]
观察表6,常规标记缓冲液的cv值均>10%,而本技术配置的缓冲液cv值均<5%,本技术配置的缓冲液重复性明显高于常规标记缓冲液。
[0124]
综上,生物素标记缓冲液为低离子浓度缓冲液,该缓冲液中,离子强度及缓冲环境使得抗体更加稳定,抗体与生物素更容易结合,从而使得标记使用的生物素与抗体之间比例更低,即使用更低剂量的生物素与抗体完成标记,生物素标记抗体的效率更高。且本发明的生物素标记缓冲液标记的重复性高于常规标记缓冲液,且具有背景低、信噪比高的优势。
[0125]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0126]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。