1.本发明属于农业育种技术领域,特别涉及一种获得猕猴桃愈伤组织的同质突变体的方法。
背景技术:
2.在多年生且雌雄异株的猕猴桃中,一般采用枝条等营养器官进行诱变,但这种突变是单细胞性质的,而枝条上的芽点由多细胞组成,诱变完成后的植株是含有不同突变细胞和正常细胞的遗传杂合个体,往往以嵌合体的形式存在,很难得到性状稳定的突变植株。而且,诱变后植株会经历体细胞选择,即突变细胞和非突变细胞在生长发育过程中会发生竞争,由于突变细胞受到辐射的生理损伤或染色体损伤,其最初的有丝分裂往往受抑制或延迟,因此正常细胞总是占优势,在有顶端优势的植物当中,到了枝条上部生长锥中可能已经没有突变型细胞,植株恢复正常,造成突变性状消失,较难获得性状稳定的同质突变体。传统的方法通过短截修剪和多次嫁接等方法来分离突变体,往往需要3
‑
5年时间才能获得性状稳定的同质突变体,周期太长。而通过愈伤组织进行辐射诱变,只需5
‑
7个月即可分离得到同质突变体,提高效率7
‑
8倍,且不受季节影响,全年均可不间段进行。
技术实现要素:
3.为解决目前技术存在的缺陷和不足,本发明的目的在于提供一种获得猕猴桃愈伤组织的同质突变体的方法。该方法通过将猕猴桃愈伤组织进行辐射诱变并结合现有的猕猴桃组培体系,可以得到性状稳定的同质突变体,解决了嵌合变异以及体细胞选择的问题。
4.本发明的目的通过下述技术方案实现:一种获得猕猴桃愈伤组织的同质突变体的方法,包括如下步骤:
5.(1)将猕猴桃愈伤组织进行
60
co
‑
γ辐射处理,所述
60
co
‑
γ辐射处理的辐射剂量为0
‑
500gy;
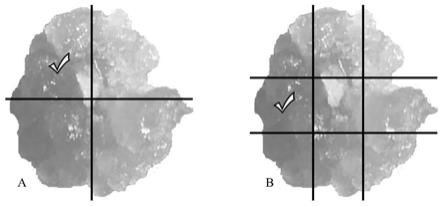
6.(2)将每块辐射处理后的所述猕猴桃愈伤组织按4分法分成4份(如图1所示),分别置于继代培养基上进行第一次继代培养15
‑
20d;
7.(3)将第一次继代培养后的所述猕猴桃愈伤组织按9分法分成9份(如图1所示),且每块所述猕猴桃愈伤组织只保留左侧边缘中间部位的1份用于继代培养,培养15
‑
20d;
8.(4)重复步骤(3)3
‑
5次后,按9分法取左侧边缘中间部位的1份用于预分化培养,培养时间20
‑
30d;
9.(5)待分化出芽后,每块愈伤组织按4分法取其中有芽点且生长状态好的1份,转移至分化培养基中进行分化培养,培养15
‑
20d;
10.(6)重复步骤(5)3
‑
5次后,得到长度高于3cm的芽;
11.(7)取步骤(6)中长度3
‑
5cm的芽进行嫩枝扦插,得到猕猴桃愈伤组织的同质突变体。
12.步骤(1)中,
13.所述猕猴桃愈伤组织通过如下方法获得;取2张滤纸置于培养皿中,加入5
‑
10ml液体继代培养基使滤纸湿透,将预培养的愈伤组织置于培养皿中,用封口膜封好,得到猕猴桃愈伤组织。
14.所述预培养的愈伤组织通过如下方法获得:取猕猴桃一年生未木质化枝条进行愈伤组织诱导,并通过继代培养基进行扩大培养,得到愈伤组织;将所述愈伤组织切成0.4*0.4cm的小方块,然后置于继代培养基上继续培养7
‑
10d,得到预培养的愈伤组织。
15.步骤(7)中,
16.所述嫩枝扦插通过如下方法进行:取长度3
‑
5cm的芽,用生根溶液将嫩芽基部浸泡1
‑
2h,然后直接扦插于蛭石(直径0.1
‑
0.3cm)当中,并覆膜保温。
17.所述蛭石优选直径0.1
‑
0.3cm的蛭石。
18.覆膜保温后,10
‑
20d便可生根,30
‑
40d后可以揭膜练苗,40
‑
50d后可移栽至3加仑的花盆进行苗期性状观察。
19.优选的,所述获得猕猴桃愈伤组织的同质突变体的方法还包括,步骤(8)通过表型观察结合srap等分子标记对所述猕猴桃愈伤组织的同质突变体进行验证。
20.步骤(8)中,
21.所述表型观察主要通过肉眼可见的表型(如叶片形态的变化及节间矩离的变化等)进行统计。
22.所述分子标记主要通过从分子水平初步验证变异的产生,辐谢诱变多属于dna大片段缺失变异,用分子标记的方法,较易检测到变异。
23.所述分子标记采用的引物如表1所示,其中上游引物10条,下游引物10条,1条上游引物和1条下游引物可以组合成一对鉴定引物对;上游引物和下游引物之间随机组合可以组成100对鉴定引物对;pcr反应程序为:95℃5min;94℃1min,35℃1min,72℃2min,5个循环;94℃1min,55℃1min,72℃2min,35个循环;72℃6min;pcr产物用3%的琼脂糖凝胶电泳进行分离。
24.本发明相对于现有技术具有如下的优点及效果:本发明通过猕猴桃愈伤组织进行辐射诱变结合现有的猕猴桃组培体系,可以得到性状稳定的同质突变体,解决了嵌合变异以及体细胞选择的问题,且只需5
‑
7个月即可分离得到同质突变体,提高效率7
‑
8倍,不受季节影响,全年均可不间段进行。
附图说明
25.图1是本发明实施例中猕猴桃愈伤组织继代培养的4分法和9分法的视图,其中,a为猕猴桃愈伤组织的4分法视图;b为猕猴桃愈伤组织的9分法视图,画“√”的部分为各分法的选择结果;
26.图2为本发明实施例中通过分子标记对11个所述猕猴桃愈伤组织的同质突变体的部分扩增的pcr反应结果;
27.图3为本发明实施例中从猕猴桃愈伤组织的同质突变体分离出的小叶突变体与对照组的对比结果图;
28.图4为本发明实施例中从猕猴桃愈伤组织的同质突变体分离出的矮化突变体与对照组的表型及节间距离对比结果图。
具体实施方式
29.下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
30.除非另有定义,否则本文中所用的全部技术术语和科学术语均具有如本发明所属领域普通技术人员通常理解的相同含义。
31.如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
32.如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由
…
构成”、或“由
…
构成”。
33.如本文所用,术语“室温”或“常温”是指温度为4~40℃,较佳地,25
±
5℃。
34.下列实施例中未注明具体条件的实验方法,通常按照常规条件。除非另外说明,否则百分比和份数按重量计算。
35.本发明提供的一种获得猕猴桃愈伤组织的同质突变体的方法,包括如下步骤:
36.(1)将猕猴桃愈伤组织进行
60
co
‑
γ辐射处理,所述
60
co
‑
γ辐射处理的辐射剂量为0
‑
500gy;
37.(2)将每块辐射处理后的所述猕猴桃愈伤组织按4分法分成4份(如图1所示),分别置于继代培养基上进行第一次继代培养15
‑
20d;
38.该继代培养基组分为:ms基本培养基,浓度32g/l的蔗糖、7.5g/l的琼脂,0.25mg/l的6
‑
苄氨基嘌呤,1mg/l的萘乙酸,光照培养条件为:16h/d光照和8h/d黑暗,光照强度5000lx。
39.(3)将第一次继代培养后的所述猕猴桃愈伤组织按9分法分成9份(如图1所示),且每块所述猕猴桃愈伤组织只保留左侧边缘中间部位的1份用于继代培养,培养15
‑
20d;
40.(4)重复步骤(3)3
‑
5次后,按9分法取左侧边缘中间部位的1份用于预分化培养,培养时间20
‑
30d;
41.(5)该预分化培养基组分为:ms基本培养基,浓度32g/l的蔗糖、7.5g/l的琼脂,3mg/l的玉米素,光照培养条件为:16h/d光照和8h/d黑暗,光照强度5000lx。待分化出芽后,每块愈伤组织按4分法取其中有芽点且生长状态好的1份,转移至分化培养基中进行分化培养,培养15
‑
20d;
42.该分化培养基组分为:ms基本培养基,浓度32g/l的蔗糖、7.5g/l的琼脂,0.5mg/l的玉米素,光照培养条件为:16h/d光照和8h/d黑暗,光照强度5000lx。
43.(6)重复步骤(5)3
‑
5次后,得到长度高于3cm的芽;
44.(7)取步骤(6)中长度3
‑
5cm的芽进行嫩枝扦插,得到猕猴桃愈伤组织的同质突变体。
45.步骤(1)中,
46.所述猕猴桃愈伤组织通过如下方法获得;取2张滤纸置于培养皿中,加入5
‑
10ml液体继代培养基使滤纸湿透,将预培养的愈伤组织置于培养皿中,用封口膜封好,得到猕猴桃愈伤组织。
47.所述预培养的愈伤组织通过如下方法获得:取猕猴桃(本技术实施例采用
‘
红阳’猕猴桃。可以理解的是,其他猕猴桃品种也适用于本技术实施例的技术方案)一年生未木质
化枝条进行愈伤组织诱导,并通过继代培养基进行扩大培养,得到愈伤组织;将所述愈伤组织切成0.4*0.4cm的小方块,然后置于继代培养基上继续培养7
‑
10d,得到预培养的愈伤组织。
48.步骤(7)中,
49.所述嫩枝扦插通过如下方法进行:取长度3
‑
5cm的芽,用生根溶液将嫩芽基部浸泡1
‑
2h,然后直接扦插于蛭石(直径0.1
‑
0.3cm)当中,并覆膜保温。
50.生根溶液的组分为:含有浓度为100mg/l的3
‑
吲哚丁酸和50mg/l的奈乙酸的溶液。生根溶液每次用量为刚好没过嫩芽基部1cm即可。
51.所述蛭石优选直径0.1
‑
0.3cm的蛭石。
52.覆膜保温后,10
‑
20d便可生根,30
‑
40d后可以揭膜练苗,40
‑
50d后可移栽至3加仑的花盆进行苗期性状观察。
53.优选的,所述获得猕猴桃愈伤组织的同质突变体的方法还包括,步骤(8)通过表型观察结合srap等分子标记对所述猕猴桃愈伤组织的同质突变体进行验证。
54.步骤(8)中,
55.所述表型观察主要通过肉眼可见的表型(如叶片形态的变化及节间矩离的变化等)进行统计。
56.所述分子标记主要通过从分子水平初步验证变异的产生,辐谢诱变多属于dna大片段缺失变异,用分子标记的方法,较易检测到变异。
57.所述分子标记采用的引物如下表1所示,其中上游引物10条,下游引物10条,1条上游引物和1条下游引物可以组合成一对鉴定引物对;上游引物和下游引物之间随机组合可以组成100对鉴定引物对;pcr反应程序为:95℃5min;94℃1min,35℃1min,72℃2min,5个循环;94℃1min,55℃1min,72℃2min,35个循环;72℃6min;pcr产物用3%的琼脂糖凝胶电泳进行分离。
58.表1 srap分子标记引物序列
[0059][0060]
图2为使用分子标记对部分突变体(11个)扩增的检测结果,其中:泳道m,d2000plus marker;泳道1,对照猕猴桃;泳道2~12,猕猴桃突变体,箭头所指为克隆得到的部分特异片段位置。
[0061]
图3为本发明实施例中从猕猴桃愈伤组织的同质突变体分离出的小叶突变体与对照组的对比结果图。从图3可以看出,分离出的小叶突变体形状稳定,叶片和对照相比显著变小,且经多次继代后仍能稳定的保持小叶的性状。
[0062]
图4为本发明实施例中从猕猴桃愈伤组织的同质突变体分离出的矮化突变体与对
照组的表型及节间距离对比结果图。从图4可以看出,分离出的矮化突变体,植株显著变小,节间矩离变短且性状稳定。
[0063]
在0
‑
500gy的
60
co
‑
γ辐射剂量范围内设11个辐射处理剂量,每个实验重复三次,对猕猴桃愈伤组织的致死率及分化率影响结果如表2
‑
1和表2
‑
2所示。
[0064]
从表2
‑
1和表2
‑
2可以看出,对11个不同辐射剂量下,猕猴桃愈伤组织的致死率及分化率进行分析显示:辐射剂量与致死率呈正相关,随着辐射剂量的增加致死率也逐步变大,猕猴桃愈伤组织对辐射的敏感性较低,低剂量的辐射对其影响较小,200gy下的致死率为33.3%,300gy下的致死率为57.5%;而辐射剂量与分化率则呈负相关,随着辐射剂量的增加分化率逐步降低,这可能是有害突变的增加所致,分化率在100gy下为77.8%,200gy下为61.1%;结合致死率和分化率,以100gy至200gy之间的辐射剂量为猕猴桃愈伤组织较适宜的诱变剂量。
[0065]
用分子标记对得到的猕猴桃愈伤组织的同质突变体再生植株进行检测,和野生型对照相比如出现差异条带则定义为发生变异,对三次实验得到的植株进行检测,猕猴桃愈伤组织的同质突变体再生植株的致变率结果如表3所示。
[0066]
从表3可以看出,对11个不同辐射剂量下,猕猴桃愈伤组织的致变率进行分析显示:辐射剂量与致变率呈正相关,随着辐射剂量的增加致变率也逐步变大,致变率在100gy下为35.9%,200gy下为78.2%,相达到300gy以上的时致变率达到100%,但剂量过高,得到的再生苗多为畸形苗,生产利用价值不大;结合致死率和分化率以及致变率,100gy至200gy之间的辐射剂量仍为猕猴桃愈伤组织较适宜的诱变剂量。
[0067]
本发明通过猕猴桃愈伤组织进行辐射诱变结合现有的猕猴桃组培体系,可以得到性状稳定的同质突变体,解决了嵌合变异以及体细胞选择的问题。
[0068]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
[0069]
表2
‑
1 60
co
‑
γ辐射处理后愈伤组织的致死率及分化率检测结果
[0070][0071]
表2
‑
2 60
co
‑
γ辐射处理后愈伤组织的致死率及分化率检测结果
[0072][0073]
表3不同辐射剂量下猕猴桃愈伤组织的同质突变体再生植株的致变率检测结果
[0074]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。