生物标志物
发明领域
1.本发明涉及生物标志物组,用于诊断活动性分枝杆菌感染和/或监测活动性分枝杆菌感染的进展或用于诊断不存在分枝杆菌感染,特别是,结核病。这种诊断和/或监测可以是活动性结核病患者与潜伏性、非进展性结核病患者或健康或患病患者之间的鉴别诊断,无论患者是否已经被表征为痰涂片阳性还是痰涂片阴性,和/或无论他们是否被表征为hiv阳性或hiv阴性。以上的涉及了肺和肺外结核分枝杆菌感染的所有方面,结核分枝杆菌是结核病的病原体。
2.发明背景
3.结核分枝杆菌(mycobacterium tuberculosis)可以说是世界上最“成功的病理微生物之一,并且是潜在致命传染病结核病(tb)的病原体。它也是世界范围内潜在可治愈传染病的主要死因,估计每年有200万相关死亡。
4.tb的发病机制很复杂,最初的感染是由于吸入气溶胶化的传染性结核分枝杆菌所致。对细菌性损伤的免疫反应决定了受感染的个体是否会继续发展为局部肺部疾病、潜伏性疾病(ltbi)或由于血源性传播而导致的播散性疾病。那些患潜伏性疾病的人仍然没有症状,但仍有可能演变/进展为活动性疾病(全部病例中的大约10%在其一生中会发生)。
5.据估计,世界上约有三分之一的人口感染了潜伏性或活动性结核病(tb)。2017年的数据报告了英国大约有6000例活动性结核病例。这代表了过去十年的整体上升趋势。对抗生素具有抗性的结核分枝杆菌分离株的数量也在增加。
6.肺tb是结核分枝杆菌感染最常见的的临床表现。症状通常包括伴有或不伴有咯血的慢性咳嗽、发烧、盗汗和体重减轻。只有患有活动性肺病的个体才具有传染性,因为他们有气溶胶化杆菌的能力。几乎任何其他器官系统的感染都可能发生,伴随着不同的临床表现。免疫功能低下的个体可能表现不典型。
7.该病原体已显示出急剧的死灰复燃,部分原因是撒哈拉以南非洲的hiv流行,因为这些个体的免疫反应受到损害。这有两方面的影响。首先,个体更有可能从预先存在的潜伏性疾病发展为活动性疾病,和其次,原发性感染更有可能表现为活动性疾病形式,伴随传染性增加。随着全球化程度的提高,这种可气溶胶化病原体的检测、预防和早期适当治疗正成为越来越重要的公共卫生优先事项。
8.尽管进行了广泛的研究,但目前对结核分枝杆菌的免疫反应和发病机制的了解仍然不完整。此外,现有的诊断和治疗方法是次优的。通过鉴定临床样本中的病原体(结核分枝杆菌)可明确诊断tb。这是通过延长的生物体培养或通过pcr分析来实现的。确诊的辅助手段包括:诊断成像(x射线或放射学扫描)、结核菌素皮肤测试(mantoux/heaf测试)和干扰素伽马释放试验(igra)。
9.快速确诊tb的现有障碍包括在实验室培养这种生长缓慢的微生物的难度(培养可能需要大约3至12周)或获得适用于pcr的含有分枝杆菌dna的样品的难度。后者在肺外tb的情况下可能需要进行侵入性采样,这很昂贵并且可能给患者带来额外的风险。
10.tb诊断领域的发展包括已经得到世界卫生组织认可的xpert mtb/rif测试。这用
于痰样品以诊断疑似活动性肺tb的病例,并检测利福平耐药突变,这是耐多药tb的标志物。然而,这种方法取决于获得的pcr阳性样品。
11.由于次优诊断工具的缘故,抗微生物联合化疗治疗通常在临床怀疑结合辅助诊断测试结果的基础上凭经验开始。这种方法的基本原理是双重的。患者接受抗微生物化疗的治疗试验,并且在肺tb的情况下,通过减少痰中的细菌载量来减少传播。
12.目前的诊断辅助手段包括:放射成像、igra和结核菌素皮肤测试(tst)。成像提供了关于是否存在典型特征的指导,而igra和tst通过查询对tb相关抗原的免疫反应来提供有关先前可能暴露于结核分枝杆菌的信息。对igra和tst测试的解释很复杂,并且受到许多因素的混淆。这些包括其中几个:先前暴露(潜伏疾病)、先前接种bcg或其他疫苗以及免疫抑制。然而,igra已日益成为tb低流行国家中一种公认的辅助工具,用于评估存在结核感染的可能性。不幸的是,成像、tst和igra测试无法明确诊断或排除活动性疾病的存在,且目前没有可用的测试可以鉴定或排除肺外tb的存在。
13.一些出版物强调了利用生物标志物组合作为tb诊断工具的潜力。wo 03/075016描述了血液中可检测的可溶性蛋白质,即可溶性cd抗原(“scd”)scd15、scd23、scd27和scd54的水平,在tb患者中可能会改变。来自美国胸科学会(ats)2010年国际会议的medscape medical news文章指出il
‑
15和mcp
‑
1的组合准确地将84%的受试者归类为活动性或潜伏性tb。chegou(2009年5月至6月举行的第二届igra全球研讨会)描述了生物标志物的组合是比单个生物标志物更有希望的结核病诊断,并建议测量egf、scd40l、mip
‑
1β、vegf、tgf
‑
α或il
‑
1α作为活动性tb的快速测试。wu等(2007)j immunol 178,3688
‑
3694表明了il
‑
8、foxp3和il
‑
12βmrna的表达提供了区分潜伏性结核分枝杆菌感染和活动性结核病的方法。
14.由于目前的tb诊断方法是次优的,因此可用于这种疾病的治疗方案也是次优的。由于这种病原体的胞内性质,以及在tb治疗领域缺乏足够的创新,在最单纯的病例中,结核病治疗的基础仍然是在长达数月的长时间内的联合性抗微生物化疗。对治疗的部分依从性可能导致抗菌药物的次优治疗水平,以及抗生素耐药性突变的微进化。因此,患者可能会在更长时间内保持传染性,并且传播频率会增加。这些耐药突变的发展,其中一些对所有已知的抗tb药物无反应(多重耐药),最近在一些国家引起了高度关注。
15.此外,对于使用次优诊断工具被诊断、并因此可能未感染结核分枝杆菌的患者,治疗选项使用侵入性的、可能使人虚弱且昂贵的疗法。这种治疗是不必要的,降低生活质量,并可能增加发生抗生素耐药性突变的可能性。因此,显然需要能够在呈现出tb样症状的患者中排除活动性tb的测试。
16.因此,非常需要鉴定更有效和高效的方法来明确排除活动性结核病和明确诊断活动性和潜伏性tb,特别是用于区分活动性结核病和潜伏性tb以及诊断肺外tb。
17.发明概述
18.根据本发明的第一个方面,提供了包含生物标志物ifnγ、il
‑
10、cd120b和cd14的组用于诊断活动性分枝杆菌感染和/或监测活动性分枝杆菌感染进展的用途。
19.根据本发明的再一个方面,提供了一种诊断个体中不存在活动性分枝杆菌感染的方法,包括
20.(a)从个体获得测试生物样品;
21.(b)定量如本文限定的生物标志物的含量;
22.(c)将所述含量输入通过算法产生的预测模型中,所述算法包括活动性分枝杆菌感染患者中每种生物标志物的相对含量;
23.(d)从所述模型获得针对不存在活动性分枝杆菌感染的可能性值。
24.根据本发明的再一个方面,提供了一种排除个体中存在活动性分枝杆菌感染和/或监测个体中活动性分枝杆菌感染进展的方法,包括
25.(a)从个体获得测试生物样品;
26.(b)定量如本文限定的生物标志物的含量;
27.(c)将测试样品中的生物标志物的含量与一个或多个对照样品中存在的含量进行比较,使得测试样品中的生物标志物水平的差异能指示不存在活动性分枝杆菌感染。
28.根据本发明的再一个方面,提供了一种测定个体中针对活动性分枝杆菌感染的抗分枝杆菌治疗的效率的方法,包括:
29.(a)从个体获得测试生物样品;
30.(b)定量如本文限定的生物标志物的含量;
31.(c)将测试样品中的生物标志物的含量与一个或多个对照样品中存在的含量进行比较,使得测试样品中的生物标志物水平的差异能指示对治疗的响应。
32.根据本发明的再一个方面,提供了一种治疗有需要的个体中的活动性分枝杆菌感染的方法,其中所述方法包括以下步骤:
33.(a)根据本文限定的方法,排除个体中活动性分枝杆菌感染的存在和/或监测个体中活动性分枝杆菌感染的进展;接着
34.(b)将抗分枝杆菌药物施用于活动性分枝杆菌感染阳性诊断事件中的所述个体。
35.根据本发明的再一个方面,提供了一种试剂盒,其包含能够对如本文限定的生物标志物进行检测和/或定量其含量的生物传感器,用于诊断活动性分枝杆菌感染、排除活动性分枝杆菌感染的存在,和/或监测活动性分枝杆菌感染的进展。
36.附图简述
37.图1:患者样品中的生物标志物表达
38.a)ifng(1181个样品)、b)il
‑
8(1180个样品)、c)il
‑
10(1181个样品)、d)il
‑
12p70(1181个样品)、e)cd14(599个样品)、f)cd120b(1181个样品)、g)cxcl9(1165个样品)和h)cxcl10(1181个样品)的表达水平的箱线图。样品获自5个独立的患者队列(cohort)。对于其中hiv状态是已知的那些样品,对于hiv阳性(h )和hiv阴性(h
‑
)患者的结果显示在分开的栏中。类似地,来自涂阳( )和涂阴(
‑
)患者的结果显示于不同的栏中。样品的浓度以ng/ml显示于y轴上。
39.图2:用于排除活动性tb的预测模型的初始评估
40.使用来自idea队列的570个患者样品的训练数据集生成了预测模型(表2)。使用a)灵活判别分析(fda)和b)c5.0分类模型(c5.0)来生成该模型。fda分析使用5bm生物标志物组,而c5.0模型使用7bm生物标志物组(参见图4)。接受者操作特征(roc)曲线是使用来自idea队列的246个患者样本的盲选的独立测试数据集计算的(表2)。虚线表示了who制定的用于活动性tb分类测试(排除)的高优先级目标产品特性2(tpp2)。95%置信区间显示为阴影。c)由c5.0和fda模型制作的活动性tb(y)和所有其他(n)的预测相对实际诊断的混淆表。d)a)和b)中显示的预测模型性能相对who目标产品特性2(tpp2)的总结。
41.图3:通过重新评估随机拆分对预测模型进行深入分析。
42.通过随机分成训练和测试(分别为样品的70%和30%,针对诊断、hiv状态和涂片结果进行平衡),将来自idea队列(表2)的原始训练和测试数据组合并重新采样100次。显示了通过将受过训练的模型应用于训练和测试数据在每次迭代中获得的曲线下面积(auc)值的分布。将结果绘制为箱线图。
43.图4:用于预测模型的生物标志物的重要性
44.fda(5bm)和c5.0(7bm)预测模型使用的生物标志物预测因子的平均相对变量重要性,将idea队列的10个随机拆分为训练和测试数据(分别为样品的70%和30%,针对诊断、hiv状态和涂片结果进行平衡)。
45.图5:使用前瞻性患者数据评估预测模型
46.预测模型是使用570个患者样品的训练数据集生成的(见图2)。a)灵活判别分析(fda)和b)c5.0分类模型(c5.0)用于生成模型。接受者操作特征(roc)曲线是使用179个患者样品的独立测试数据集计算的(见表5)。虚线表示了who制定的用于活动性tb分类测试(排除)的高优先级目标产品特性2(tpp2)。95%置信区间显示为阴影。c)由c5.0和fda模型制作的活动性tb(y)和所有其他(n)的预测相对实际诊断的混淆表。d)a)和b)中显示的预测模型性能相对who目标产品特性2(tpp2)的总结。
47.图6:5bm生物标志物组的接受者操作者特征(roc)曲线,如通过实施例3中所述的ella设备测量的。
48.图7:7bm生物标志物组的接受者操作者特征(roc)曲线,如通过实施例3中所述的ella设备测量的。
49.发明详述
50.根据本发明的第一个方面,提供了包含生物标志物ifnγ、il
‑
10、cd120b和cd14的组用于诊断活动性分枝杆菌感染和/或监测活动性分枝杆菌感染进展的用途。
51.在一个实施方案中,所述组另外包含cxcl10(ip
‑
10)。
52.因此,根据本发明的再一个方面,提供了包含生物标志物ifnγ、il
‑
10、cd120b、cd14和cxcl10(ip
‑
10)的组用于诊断活动性分枝杆菌感染和/或监测活动性分枝杆菌感染进展的用途。根据本发明的这个方面的组在本文中被称为5bm组。
53.在表4和5以及图2、3和5中呈现了数据,其显示了5bm组以高灵敏度和特异性鉴定那些活动性结核患者的能力。
54.因此,将认识到根据本发明的5bm组可以成功地鉴别诊断活动性分枝杆菌感染(如结核)患者与患病对照或健康对照患者。这样的诊断提供了特异性、灵敏度和准确性值,所述值在诊断有用参数内且匹配或超过世界卫生组织(who)针对此类测试的目标。
55.ifnγ是一种二聚化的可溶性细胞因子,其在人类中由ifng基因编码。ifnγ是巨噬细胞的重要激活剂,并且可以诱导ii类mhc表达。ifnγ单体由6个α螺旋的核心和c
‑
末端区域中的扩展未折叠序列组成。生物活性二聚体通过两个单体的反平行互锁形成。对ifnγ的细胞反应通过其与由干扰素γ受体1(ifngr1)和干扰素γ受体2(ifngr2)组成的异二聚受体相互作用而被激活,随后该结合激活jak
‑
stat途径。ifnγ还与细胞表面的糖胺聚糖硫酸乙酰肝素(hs)结合,并且ifnγ与hs的结合抑制其生物活性。
56.ifnγ与肉芽肿的形成有关,肉芽肿可由感染性或非感染性原因引起。肉芽肿的传
同种型。72个氨基酸的肽是培养中巨噬细胞分泌的主要形式。多种细胞表面受体能够结合il
‑
8,然而最著名的是cxcr1和cxcr2。在靶细胞中,il
‑
8诱导一系列迁移和吞噬所需的生理反应,如胞内ca
2
和胞吐作用的增加。
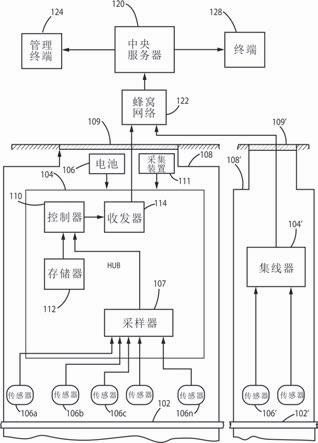
69.il
‑
12p70是p35和p40亚基的活性异二聚体,分别由il12a和il12b基因在人类中编码。il
‑
12参与t细胞的刺激、生长和功能,并可以刺激ifnγ和tnfα的产生。il
‑
12在自然杀伤细胞和t淋巴细胞的活动中起重要作用,并且有证据表明il
‑
2与nk细胞中il
‑
12的信号转导之间存在联系。il
‑
2刺激两种il
‑
12受体(il
‑
12r
‑
β1和il
‑
12r
‑
β2)的表达,维持nk细胞中参与il
‑
12信号传导的关键蛋白的表达。
70.趋化因子(c
‑
x
‑
c基序)配体9(cxcl9)是属于cxc趋化因子家族的小细胞因子,也称为由γ干扰素(mig)诱导的单核因子,并且是一种t细胞化学引诱剂,由ifnγ诱导。它与cxcl10和cxcl11密切相关,并通过与趋化因子受体cxcr3相互作用而发挥其功能。
71.根据本发明的再一个方面,提供了一种诊断个体中不存在活动性分枝杆菌感染的方法,包括:
72.(a)从个体获得测试生物样品;
73.(b)定量如本文限定的生物标志物的含量;
74.(c)将所述含量输入通过算法产生的预测模型中,所述算法包括活动性分枝杆菌感染患者中每种生物标志物的相对含量;
75.(d)从所述模型获得针对不存在活动性分枝杆菌感染的可能性值。
76.将认识到,根据本发明的某些方面,不存在活动性分枝杆菌感染可能指示存在潜伏的分枝杆菌感染或不存在分枝杆菌感染。替换地或另外地,不存在活动性分枝杆菌感染可能指示存在非分枝杆菌感染。
77.在一个实施方案中,所述个体是哺乳动物。在再一个实施方案中,所述哺乳动物是人类,如人类个体或人类受试者。
78.根据本发明的再一个方面,提供了一种排除个体中活动性分枝杆菌感染的存在和/或监测个体中活动性分枝杆菌感染进展的方法,包括
79.(a)从个体获得测试生物样品;
80.(b)定量如本文限定的生物标志物的含量;
81.(c)将测试样品中的生物标志物的含量与一个或多个对照样品中存在的含量进行比较,使得测试样品中的生物标志物水平的差异指示不存在活动性分枝杆菌感染。
82.将认识到,根据本发明的某些方法,排除活动性分枝杆菌感染的存在包括鉴定不存在活动性感染或存在潜伏的分枝杆菌感染。此外,排除活动性分枝杆菌感染的存在可以包括潜伏的分枝杆菌感染的诊断。替换地或另外地,排除活动性分枝杆菌感染的存在可以包括鉴定非分枝杆菌感染。
83.将进一步认识到,根据本发明的一些方面,监测活动性分枝杆菌感染的进展包括监测潜伏的分枝杆菌感染进展到活动性分枝杆菌感染。此外,这样的监测方面还可以包括确定潜伏的分枝杆菌感染进展到活动性分枝杆菌感染的可能性。
84.根据本发明的再一个方面,提供了一种测定个体中针对活动性分枝杆菌感染的抗分枝杆菌治疗功效的方法,包括:
85.(a)从个体获得测试生物样品;
86.(b)定量如本文限定的生物标志物的含量;
87.(c)将测试样品中的生物标志物的含量与一个或多个对照样品中存在的含量进行比较,使得测试样品中的生物标志物水平的差异指示对治疗的响应。
88.在本发明的一个实施方案中,获自个体的生物样品可以两次或更多次采集。在再一个实施方案中,个体可以是测试受试者或对照受试者。
89.在一个实施方案中,如本文限定的方法进一步包括检测两次或更多次采集的样品中的生物标志物的含量变化。
90.将认识到本文提及个体中活动性分枝杆菌感染的诊断、排除其存在、监测其进展、诊断其不存在或治疗包括提及所述共同感染hiv的个体。
91.将进一步认识到本文提及个体中活动性分枝杆菌感染的诊断、排除其存在、监测其进展、诊断其不存在或治疗包括来自所有种族和背景的个人。
92.本发明的生物标志物组具有提供优于现有结核病诊断测试的许多关键优势的潜力。这些包括从血清学样品快速诊断,这些样品相对容易获得,不需要与疾病特异性抗原过夜孵育。这对于肺外tb病例和儿科病例尤其重要。它还增强了在没有第3类实验室配置的情况下诊断tb的潜力。该数据还支持了对于免疫功能低下个体的增强的诊断能力。目前包括igras在内的基于免疫学的诊断辅助手段在诊断hiv感染者的结核病方面的敏感性和特异性较低,这主要是因为感染hiv的tb患者在对tb特异性抗原的反应中产生的γ干扰素数量少于hiv阴性tb患者(tsiouris等(2006)j clin microbiol.44(8):2844
‑
2850)。相比之下,由于高水平的特异性和灵敏度,预计本发明的生物标志物在免疫受损个体的结核病(包括肺外结核病)的诊断中具有很大的用途。生物标志物组还在患者组的关键临床鉴别之间提供更灵敏和更特定的鉴别。
93.因此,在一些实施方案中,本发明可用于免疫受损或hiv阳性个体中活动性分枝杆菌的诊断、排除存在、监测进展、诊断不存在或治疗。然而,还将认识到为了使本发明组用于活动性分枝杆菌感染的诊断、监测进展、诊断不存在或治疗,不需要进行个体hiv状态的确定。
94.在再一个实施方案中,本发明可以利用和/或包括临床数据或信息,如患者的hiv状态。因此,在一个实施方案中,本发明的生物标志物组进一步包括hiv状态。
95.此外,在一些实施方案中,本发明可用于小儿患者或不能产生痰或细支气管灌洗样品的那些其他患者中的活动性分枝杆菌感染的诊断、排除存在、监测进展、诊断不存在或治疗。因此,将理解本发明的组可用于肺外活动性分枝杆菌感染(例如肺外结核)的诊断、排除存在、监测进展、诊断不存在或治疗。
96.本发明的生物标志物组还提供了更好地理解对疾病的免疫反应的潜力,且因此就活动性疾病的免疫疗法的发展和暴露后预防的发展而言,提供了靶向免疫疗法的发展。
97.在一个实施方案中,活动性分枝杆菌感染是活动性结核病。
98.本文提及的“结核病(tuberculosis)”包括由病原体结核分枝杆菌的存在引起的传染病。对结核病的提及还包括对活动性有症状结核病感染和潜伏性无症状结核病感染(ltbi)的提及。大多数结核病感染实例主要局限于肺部(即肺结核),然而,大约四分之一的活动性结核病感染从肺部转移,引起其他类型的结核病,统称为肺外结核病。这通常在免疫抑制的人(即感染hiv的那些)和幼儿中更常见。
99.在一个实施方案中,活动性分枝杆菌感染是肺外结核病。
100.在一个实施方案中,分枝杆菌感染的存在的诊断或排除是以下之间的鉴别诊断:
101.(i)活动性结核患者与潜伏性、非进展性结核患者或患病患者或健康患者;和/或
102.(ii)(i)的患者组,无论他们是表征为涂片阳性或是涂片阴性;和/或
103.(iii)(i)和/或(ii)的患者组,无论他们是表征为hiv阳性或hiv阴性。
104.术语“生物标志物”是指过程、事件或状况的独特生物学或生物学衍生指标。生物标志物可以用于诊断方法中,例如活动性分枝杆菌疾病的临床筛查和预后评估、发展预测(例如从潜伏感染发展),和用于监测治疗结果、识别最有可能对特定治疗产生反应的患者、药物筛选和开发中。生物标志物及其用途对于新药物治疗的鉴定和药物治疗新靶点的发现是有价值的。特别地,本发明的生物标志物组具有有效监测对抗分枝杆菌疗法的免疫反应的潜力。例如,可以很容易地确定哪些患者有可能缩短疗程(目前针对敏感菌株的结核病治疗范围为6至12个月)。它们还可以形成有用的预测特征,其预测那些将发展为活动性疾病的人,从而允许有针对性地治疗潜伏感染者中的很可能会发展为活动性疾病的亚组。
105.鉴于本发明涉及传染病的诊断、排除存在、监测进展或诊断不存在的事实,分枝杆菌的耐药突变是特别关注的。例如,存在对特定形式的抗结核治疗具有抗性的某些结核病株,如耐利福平的结核病。本发明的上述“监测”方面因此至关重要,因为对治疗的无反应可以是结核病可能是耐利福平或耐多药结核病的早期迹象。在这种情况下,可以在更早的阶段采用替代治疗方案,这将使接受治疗的个体更有可能存活并减少传播。
106.在一个实施方案中,一种或多种生物标志物可以被生物通路中生物标志物上游或下游发现的分子或该分子的可测量片段替代。
107.在一个实施方案中,预测模型由算法生成,该算法包含每个生物标志物的相对量。然后可以将根据本发明量化的生物标志物的量输入所述预测模型中,并获得活动性分枝杆菌感染存在或不存在的似然值。
108.在一个实施方案中,通过测量每个样品中分析物生物标志物的浓度来进行如本文定义的生物标志物的检测和/或定量。在进一步的实施方案中,使用免疫学方法进行如本文定义的生物标志物的检测和/或定量。
109.将认识到在一个实施方案中,使用生物传感器或微分析、微工程化、微分离或免疫层析系统进行本文定义的生物标志物的检测和/或定量。
110.如本文使用的,术语“生物传感器”表示能够检测生物标志物存在的任何东西。本文描述了生物传感器的实例。
111.根据本发明的生物传感器可以包括一种或多种配体,如本文所述的,其能够特异性结合生物标志物。这样的生物传感器可用于检测和/或定量根据本发明的生物标志物或生物标志物组。
112.本文描述了用于结核病的诊断、排除存在和监测的诊断试剂盒。在一个实施方案中,试剂盒另外含有能够检测和/或定量生物标志物的生物传感器。
113.可以通过检测生物标志物或其片段,例如,具有c
‑
末端截短或具有n
‑
末端截短的片段,来进行生物标志物的检测和/或定量。片段合适地大于4个氨基酸长,例如,5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个氨基酸长。
114.例如,可以通过seldi或maldi
‑
tof直接检测生物标志物。或者,可以通过与一种或
多种能够特异性结合生物标志物的配体来直接或间接检测生物标志物,所述配体如抗体或其生物标志物结合片段,或其他肽,或配体,例如,适体,或寡核苷酸。配体可以具有可检测标记,如发光、荧光或放射性标记,和/或亲和标记。
115.例如,可以通过选自以下的一种或多种方法来进行检测和/或定量:seldi(
‑
tof)、maldi(
‑
tof)、基于1
‑
d凝胶的分析、基于2
‑
d凝胶的分析、质谱(ms)、反相(rp)lc、大小渗透(凝胶过滤)、离子交换、亲和性、hplc、uplc和其他基于lc或lc ms的技术。合适的lc ms技术包括基于lc或lc ms的技术。合适的lc ms技术包括(applied biosystems,ca,usa),或(applied biosystems,ca,usa)。还可以使用液相色谱(例如高压液相色谱(hplc)或低压液相色谱(lplc))、薄层色谱、nmr(核磁共振)光谱。
116.根据本发明的诊断,和/或监测的方法可以包括通过夹心免疫测定分析血浆、血清或全血样品,以检测生物标志物的存在或水平。这些方法还适用于临床筛选、预后、监测治疗结果、鉴定最可能响应特定治疗性治疗的患者、用于药物筛选和开发和鉴定用于药物治疗的新靶标。
117.可以使用免疫学方法来进行生物标志物的检测和/或定量,涉及能够特异性结合生物标志物的抗体或其片段。合适的免疫学方法包括夹心免疫测定,如夹心elisa,其中使用识别生物标志物上的不同表位的两种抗体来进行生物标志物的检测;放射免疫测定(ria),直接、间接或竞争性酶联免疫吸附测定(elisa)、酶免疫测定(eia)、荧光免疫测定(fia)、western印迹、免疫沉淀和任何基于颗粒的免疫测定(例如,使用金、银或乳胶颗粒、磁性颗粒或q
‑
点)。免疫学方法可以例如以微滴定平板或条带形式进行。
118.例如,根据本发明的免疫学方法可以基于以下方法。
119.酶(eia)免疫测定是作为放射免疫测定(ria)的替代方法而开发的。这些方法使用酶来标记抗体或靶抗原。eia的灵敏度接近ria,但没有放射性同位素带来的危险。最广泛使用的eia检测方法之一是酶联免疫吸附测定(elisa)。elisa方法可以使用两种抗体,其中一种是靶抗原特异性的,另一种与酶偶联,添加酶的底物导致化学发光或荧光信号的产生。
120.荧光免疫测定(fia)是指利用荧光标记或酶标记作用于底物形成荧光产物的免疫测定。荧光测量本质上比比色(分光光度)测量更灵敏。因此,fia方法比采用吸光度(光密度)测量的eia方法具有更高的分析灵敏度。
121.化学发光免疫测定利用化学发光标记,其被化学能量激发时产生光;使用光检测仪来测量发射。
122.因此根据本发明的免疫学方法可以使用公知的方法来进行。任何直接(例如,使用传感器芯片)或间接程序可以用于本发明的生物标志物的检测中。
123.生物素
‑
亲和素或生物素
‑
链霉亲和素系统是通用标记系统,其可适用于本发明的免疫学方法。用生物素标记一个结合配偶体(binding partner)(半抗原、抗原、配体、适体、抗体、酶等),用亲和素或链霉亲和素标记另一个配偶体(表面,例如孔、珠、传感器等)。这是用于免疫测定、基因探针测定和(生物)传感器的常规技术,但它是一种间接固定途径,而不是直接途径。例如,可以将本发明的生物标志物特异性的生物素化配体(例如抗体或适体)可以固定于亲和素或链霉亲和素表面上,然后可以将固定的配体暴露于含有或怀疑含有生物标志物的样品以检测和/或定量本发明的生物标志物。然后可以通过如本文所述的免疫学方法进行固定化抗原的检测和/或定量。
124.在可替换的实施方案中,配体(例如,抗体或适体)可以结合表面(例如,通过如上所述的生物素
‑
链霉亲和素结合或直接结合表面)并且可以直接进行固定化抗原的检测和/或定量,而无需其他检测步骤(例如,通过表面等离子体共振)。
125.如本文使用的术语“抗体”包括但不限于:多克隆、单克隆、双特异性、人源化或嵌合抗体,单链抗体,片段(如fab、f(ab')2、fv、二硫化物连接的fv、scfv、双抗体),由fab表达文库产生的片段,抗独特型(抗
‑
id)抗体和以上任何一种的表位结合片段。如本文使用的术语“抗体”还指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即,含有特异性结合抗原的抗原结合位点的分子。本发明的免疫球蛋白分子可以是任何类别(例如,igg、ige、igm、igd和iga)或亚类的免疫球蛋白分子。
126.疾病特异性的关键生物标志物的鉴定是诊断程序和治疗方案整合的核心。使用预测性生物标志物可以开发适当的诊断工具,如生物传感器;因此,在本发明的方法和使用中,可以使用生物传感器、微分析系统、微工程化系统、微分离系统、免疫层析系统或其他合适的分析装置进行检测和定量。生物传感器可以整合用于检测生物标志物的免疫学方法、电、热、磁、光学(例如全息图)或声学技术。使用此类生物传感器,可以检测到处于生物样品中发现的预期浓度的目标生物标志物。
127.因此,根据本发明的再一个方面,提供了一种用于诊断和/或监测结核病的装置,其包括生物传感器、微分析、微工程化、微分离和/或免疫层析系统,其配置成检测和/或定量本文限定的任一种生物标志物。
128.合适地,用于检测本发明的一种或多种生物标志物的生物传感器将生物分子识别与适当的手段结合以将样品中生物标志物的存在或定量的检测转化为信号。生物传感器可适用于“可替换站点”诊断测试,例如在病房、门诊部、外科、家庭、野外和工作场所。
129.用于检测本发明的一种或多种生物标志物的传感器包括声学、等离子体共振、全息和微工程化传感器。印迹识别元件、薄膜晶体管技术、磁声谐振器装置和其他新型声电系统可用于生物传感器中以检测本发明的一种或多种生物标志物。
130.可以根据上文所述的任一种技术来测量本发明的生物标志物的水平。在一个实施方案中,使用间接夹心免疫测定来检测和/或测量生物标志物。术语“间接”是指检测抗体没有与标记直接缀合的事实,意味着需要第三步将标记连接到检测抗体上。链霉亲和素
‑
生物素可用于将标记连接到检测抗体上。链霉亲和素
‑
生物素的使用允许将制造商生物素化的抗体与市售链霉亲和素
‑
标签缀合物结合使用。通过用标记物(例如荧光标记物的化学发光)直接标记检测抗体,可以减少测定步骤和获得结果的时间。
131.本发明的监测方法可用于监测活动性分枝杆菌感染的发作、进展、稳定、改善、缓解和/或对治疗干预的反应。还将理解监测还可以包括监测分枝杆菌感染的程度以检测疾病的严重程度。本发明的标志物可以区分潜伏性分枝杆菌感染和活动性分枝杆菌感染。例如,本发明在帮助诊断潜伏性疾病、活动性疾病和确定患有可能发展为活动性疾病的潜伏性疾病的患者方面具有很大的实用性。
132.在诊断方法中,排除根据本发明的传染病的存在、监测其进展或诊断其不存在,检测和/或定量来自测试手术者的生物样品中的生物标志物,可以进行两次或更多次。可以在两次或更多次采集的样品中的生物标志物水平之间进行比较。可以对在两次或更多次采集的样品中生物标志物水平的任何变化进行评估。生物标志物水平的调节可用作分枝杆菌感
染状态的指标。随着时间的推移,生物标志物水平的降低可能指示疾病的发作或进展,即疾病的恶化,而生物标志物水平的增加表明疾病的改善或缓解,反之亦然。
133.根据本发明的传感病的诊断、排除其存在、监测其进展或诊断其不存在的方法可以包括定量来自测试受试者的测试生物样品中的生物标志物并将所述测试样品中的生物标志物的水平与一个或多个对照进行比较。
134.在本文定义的本发明的任何一种方法中使用的对照可以包括一个或多个选自以下的对照样品:在来自健康个体的健康对照样品中发现的生物标志物水平、健康生物标志物水平;或健康的生物标志物范围;患有其他呼吸道感染的患者;非分枝杆菌感染患者;非tb分枝杆菌感染患者;和已知患有活动性或潜伏性tb的患者。
135.对于活动性分枝杆菌感染患者中增加的生物标志物,测试样品中生物标志物的水平相对于健康对照中的水平较高,指示活动性分枝杆菌感染的诊断;测试样品中生物标志物的水平相对于健康对照相等或较低,指示不存在活动性分枝杆菌感染。对于活动性分枝杆菌感染患者中降低的生物标志物,测试样品中生物标志物的水平相对于健康对照中的水平较低指示活动性分枝杆菌感染的诊断;测试样品中生物标志物的水平相对于健康对照相等或较低指示不存在活动性分枝杆菌感染。还将理解其中对照样品包括从患有活动性或潜伏性分枝杆菌感染的患者获得的样品时,活动性或潜伏性分枝杆菌感染的阳性诊断通常将需要与对照样品基本相似水平的生物标志物。
136.本文使用的术语“诊断”包括识别、确认、表征、鉴定不存在活动性分枝杆菌感染和/或排除活动性分枝杆菌感染的存在。根据本发明的监测和诊断方法可用于确认活动性分枝杆菌感染的存在;通过评估发作和进展来监测疾病的发展,或评估疾病的改善或消退。监测和诊断方法也可用于评估临床筛选、预后、治疗选择、治疗益处评价的方法,即用于药物筛选和药物开发。
137.有效的诊断和监测方法提供了非常强大的“患者解决方案”,通过建立正确的诊断、允许快速确定最合适的治疗(从而减少不必要的暴露于有害药物的副作用)来改善预后的潜力。在特定的实施方案中,不存在活动性分枝杆菌感染的诊断防止不必要地暴露于有害药物的副作用。
138.在另一个实施方案中,使用选自全血、血清、血浆、组织液、脑脊液(csf)、滑液、卵泡液、精液、羊水、乳汁、尿液、胸水、腹水、支气管肺泡灌洗液、唾液、痰、眼泪、汗液、淋巴液、抽吸物、骨髓抽吸物和粘液,或来自其的提取物或纯化物,或其稀释物的生物样品进行如本文所定义的本发明的方法。在特定的实施方案中,使用选自全血、血清或血浆的生物样品进行如本文定义的本发明的方法。在特定的实施方案中,如本文所定义的本发明的方法使用血清的生物样品进行。
139.将认识到如本文定义的方法的实施方案包括使用血清,如未激活的血清和/或已使用一种或多种疾病特异性抗原激活的血清,疾病特异性抗原诸如结核分枝杆菌特异性抗原或在诊断其他分枝杆菌疾病的情况下使用相关疾病的特异性抗原。
140.因此,根据本发明的再一个方面,提供了一种活动性分枝杆菌感染、活动性结核病或肺外结核病的排除、监测进展或诊断不存在的方法,包括:
141.(a)从个体获得测试生物样品;
142.(b)将所述血清样品分为使用疾病特异性抗原(如结核分枝杆菌特异性抗原)激活
的血清样品和未激活的血清样品;
143.(c)使用疾病特异性抗原(如结核分枝杆菌特异性抗原)激活所述血清样品;
144.(d)在每个激活的和未激活的血清样品中定量如本文限定的生物标志物的含量;
145.(e)将激活的血清样品中的生物标志物含量与非激活的血清样品中存在的含量进行比较,使得激活的血清样品中的生物标志物水平的差异指示:
146.(i)结核病的诊断;和/或
147.(ii)结核病感染的存在,而不是任何其他分枝杆菌感染。
148.如本文限定的根据本发明的方法可以使用的结核分枝杆菌特异性抗原是本领域已知的。这样的结核分枝杆菌特异性抗原可以包括,不限于,esat
‑
6和其他esat蛋白、cfp
‑
10和espc,或其片段或衍生物。在再一个实施方案中,可以使用灭活的结核分枝杆菌或其部分或片段或结核菌素纯化的蛋白质衍生物(ppd)来进行血清样品的激活。
149.根据本发明的再一个方面,提供了一种治疗有需要的个体中的活动性分枝杆菌感染的方法,其中所述方法包括以下步骤:
150.(a)根据本文限定的方法排除个体中活动性分枝杆菌感染的存在和/或监测个体中活动性分枝杆菌感染的进展;接着
151.(b)将抗分枝杆菌药物施用于对于活动性分枝杆菌感染处于阳性诊断事件中的所述个体。
152.将认识到根据本发明的这个方面的方法还可以利用排除活动性分枝杆菌感染存在的不存在诊断,以确定所述个体的合适治疗。在一些实施方案中,活动性分枝杆菌感染的不存在的诊断或存在被排除可以确定抗分枝杆菌药物的给药不是合适的。
153.在再一个实施方案中,活动性分枝杆菌感染是活动性结核病或肺外结核病,而抗分枝杆菌药物是抗结核病药物。
154.这样的抗结核病药物是本领域已知的并且可以包括,不限于:一种或多种选自以下的一线药物:乙胺丁醇、异烟肼、吡嗪酰胺、利福平;和/或一种或多种选自以下的二线药物:氨基糖苷类(例如阿米卡星、卡那霉素)、多肽(例如卷曲霉素、紫霉素、恩维霉素(enviomycin))、氟喹诺酮类(例如环丙沙星、左氧氟沙星、莫西沙星)、硫酰胺类(例如乙硫异烟胺、丙硫异烟胺(prothionamide))、环丝氨酸(closerin)或特立齐酮;和/或一种或多种选自以下的三线药物:利福布汀、大环内酯类(例如克拉霉素)、利奈唑胺、氨硫脲(thioacetazone)、硫利达嗪、精氨酸、维生素d和r207910。
155.根据本发明的再一个方面,提供一种能够检测和/或定量如本文限定的生物标志物的含量的试剂盒,用于活动性分枝杆菌感染的诊断、排除存在、监测进展和/或诊断不存在。合适地,根据本发明的试剂盒可以含有一种或多种选自以下组的成分:生物标志物或生物标志物的结构/形状模拟物特异性的配体、一个或多个对照、一种或多种试剂和一种或多种消耗品;任选与根据本文限定的任一个方法的试剂盒的使用说明书一起。在一个实施方案中,试剂盒诊断活动性分枝杆菌感染(如活动性结核病)的不存在。
156.在本文限定的试剂盒的一个实施方案中,活动性分枝杆菌感染是活动性结核病。在本文限定的试剂盒的再一个实施方案中,活动性分枝杆菌感染或活动性结核病是肺外结核病。
157.用于活动性分枝杆菌感染的生物标志物组的鉴定允许整合诊断程序和治疗方案。
目前,在确定有效治疗中存在明显的延迟,并且迄今为止不可能进行药物反应的快速评估。传统上,对于给定的治疗方法,许多结核病治疗需要治疗试验持续数周至数月。本发明的生物标志物组的检测可以用于在参与临床试验前筛选受试者。生物标志物提供了方式来指示治疗反应、未能响应、不利的副作用谱、药物依从性的程度和适当的血清或血浆药物水平的实现。生物标志物可以用于提供不良药物反应的警示。生物标志物可用于个性化治疗的开发,因为反应评估可以用于微调剂量、最小化处方药物的数量、减少获得有效治疗的延迟并避免药物不良反应。因此,通过监测本发明的生物标志物,可以精确地调整患者护理以匹配由患者的疾病和药物基因组学特征确定的需求,因此生物标志物可用于滴定最佳剂量、预测阳性治疗反应和识别那些有严重副作用高风险的患者。
158.基于生物标志物组的测试提供了“新”患者的一线评估,并在时间范围内和精确度方面,为准确和快速的诊断提供客观措施,这是使用当前主观措施无法实现的。
159.生物标志物监测方法、生物传感器和试剂盒作为患者监测工具也很重要,使医生能够确定复发是由于疾病恶化、患者依从性差或是耐药性引起的。特别地,本发明还可用于监测患者对服用特定药物(药剂)和/或接受特定治疗方案的依从性。
160.如果药物治疗被评估为不足,那么治疗可以恢复或增加;适当的话可以改变治疗。因为生物标志物对疾病状态是敏感的,它们提供了药物治疗影响的指示。
161.以下研究阐明了本发明。
162.材料和方法
163.样本获自foundation for innovative new diagnostics(find,日内瓦,瑞士)、igra in diagnostic evaluation of active tb(idea)研究和获自南非患者,详情如下。
164.find
165.自2003年以来,foundation for innovative new diagnostics(find,日内瓦,瑞士)已经策划了一个高质量、地域多样的样本库,以支持tb诊断测试的发展。
166.通过2014年10月的材料转让协议,find慷慨地提供了大量来自越南、秘鲁和南非的血清样本,用于此处呈现的工作。
167.find样品来自登记的具有tb体征和症状(咳嗽至少2周、发烧、体重减轻和盗汗)的成人。收集了基本人口统计数据,如年龄、体重和性别,以及临床元数据,如hiv状态并在某些病例中还收集了cd4细胞计数和病毒载量。培养阳性的受试者被认为是确诊的tb病例。排除tb的标准由find定义,包括培养和涂片阴性以及在2至3个月随访时在没有特定tb治疗的情况下症状消退。
168.idea(伦敦)
169.在英国(在常规临床实践中)进行了一项前瞻性多中心队列(cohort)研究,该研究对在伦敦、斯劳、莱斯特、伯明翰和牛津参与医院内的nhs门诊或住院服务时出现疑似活动性结核病的>1,012名成人(≥16岁,其中本发明人可获得816个样品)进行了研究。
170.在确定确诊之前,在二级医疗机构的诊断检查时招募患者。因此,此时确定了该研究的潜在参与者。研究人群在种族组合和合并症范围方面代表了全国结核病负担,并且包括足够数量的hiv感染患者,以可靠地确定igra在这一关键人群中的作用。
171.在研究期间进行采血(静脉穿刺)程序,并按照当地静脉穿刺指南进行。就诊和采血样与参与者的常规诊所预约同时进行。采血程序的频率和时机为三个设定的时间间隔。
在时间零(t0)的第一个样品,不迟于tb治疗开始后14天或同意后7天内,以较早发生者为准,这取决于患者的诊断。如果有临床指征,除了设定的时间间隔外,还进行了随访。在每个时间点采集35ml血样,用于测试和生物储存库中的储存(pbmc和血清)。
172.从所有同意的参与者那里收集了35ml量的血液样品进行测试;剩余样品被存储以重复预期的少量不确定结果并用于未来的研究。在伦敦帝国理工学院结核病研究单位,pbmc储存在液氮罐中,而血清和血浆储存在
‑
80℃冰箱中。在采集样品的同一天,血样以适当的un
‑
类型批准的包装运送到伦敦帝国理工学院(圣玛丽医院)的结核病研究单位进行检测。
173.在痰涂片阴性肺结核患者中,进行诊断性支气管镜检查并收集bal(支气管肺泡灌洗)作为常规临床护理的一部分。如果在该程序后留下一定量的bal样品,则将样品的等分试样冷冻保存并储存在研究生物储存库中。
174.从参与地点的临床诊断实验室收集从诊断样品生长的结核分枝杆菌阳性培养物样品。储存这些样品是为了随后在结核病的不同临床表型与感染分枝杆菌菌株的特征之间建立相关性。
175.将参与者归类为dosanjh等(ann intern med.2008年3月4日;148(5):325
‑
36)定义的最终诊断参考标准类别。
176.患者样品的分层
‑
idea队列
177.独立训练(570个患者样品)和测试(246个患者样品)数据集是从idea队列中盲选的。使用了与之前其他作者相同的诊断分组(dosanjh等(2008年)annals of internal medicine 148:325)1=活动性tb涂片阳性,2=活动性tb涂片阴性,4a=潜伏性tst阳性暴露阳性,4b=潜伏性tst阳性暴露阴性,4c=非
‑
tb tst阴性暴露阳性和4d=非
‑
tb tst阴性暴露阴性。这些组被分为hiv阳性和hiv阴性样品。数据列于下表1中。
178.表1
‑
患者样品的分层
‑
idea队列:
[0179][0180][0181]
显示了相应集合的贡献百分比,且括号中给出了样品的绝对数量。
[0182]
idea队列的种族多样性
[0183]
表2中显示了来自idea队列的训练和测试数据集的来自不同种族的患者样品的数量。样品是随机选择的,不考虑任何tb相关诊断。
[0184]
表2
‑
idea队列的种族多样性
[0185]
[0186]
[0187]
[0188][0189]
南非样品
[0190]
该研究在开普敦的高负担、发展中社区进行,在其相关的初级护理tb诊所的hiv和tb流行率很高。在获得开普敦市的相关批准后,以下站点用于招募患者:
[0191]
·
langa诊所
[0192]
·
gugulethu诊所
[0193]
·
weltevreden诊所
[0194]
·
vuyani诊所
[0195]
·
phumlani诊所
[0196]
有呼吸道症状就诊于上述诊所的患者由指定的研究护士招募参加研究。还从上述社区招募了健康志愿者。
[0197]
在基线时,受过训练的研究人员获得了预期参与者的书面知情同意。然后使用纳入和排除标准筛选参与者以评估参加研究的资格。
[0198]
记录了参与者的hiv状态。如果未知,则对参与者进行建议并使用快速诊断试剂盒检测hiv,根据国家指南。通过手指点刺获得大约25μl的血液。阳性快速检测结果使用第二手指点刺试验来确认。任何不一致的结果都通过hiv elisa测试确认(在这种情况下需要大约5毫升的血液)。完成检测后咨询,且任何新诊断的hiv感染者都转介到他们最近的arv机构进行进一步咨询和管理。
[0199]
genexpert/培养结果为阴性的健康志愿者和有症状的患者被送去进行胸部x光检查。
[0200]
随后从参与者收集以下样品:
[0201]
·
20ml血液
‑
通过离心获得血清。
[0202]
·
2个痰样品用于培养、dst和储存。
[0203]
·
1个尿样。
[0204]
血样用于测试各种生物标志物的存在,其代表暴露于结核分枝杆菌时的个体宿主免疫反应。
[0205]
非tb参与者在招募后8周进行随访,以审查临床症状和治疗。
[0206]
前瞻性收集的患者样品的分层
‑
南非队列
[0207]
179个前瞻性收集的患者样品被分为4个诊断组。sa1明确的活动性tb,sa2高度可能是活动性tb,sa3排除活动性tb,sa4健康。每个诊断组被分成hiv ve和hiv
‑
ve样品,如表3中所示。显示了每个组对总体队列的贡献百分比。每组中样品的绝对数量在括号中给出。
[0208]
表3
‑
前瞻性收集的患者样品的分层
‑
南非队列
[0209][0210]
如下进行间接夹心免疫测定:
[0211]
第1天:
[0212]
平板涂覆:
[0213]
将对目标生物标志物具有结合特异性的纯化抗体在不含蛋白质的缓冲液中稀释,并将设定体积添加到96孔微量滴定平板的每个孔中。将平板密封并在 4℃下孵育过夜;抗体通过被动吸收机制与平板结合。
[0214]
第2天
[0215]
封闭
[0216]
使用磷酸盐缓冲盐水(pbs)加0.05%tween
‑
20的溶液彻底洗涤平板,并在纸巾上吸收直至干燥。
[0217]
将免疫测定封闭缓冲液以超过测定中使用的其他试剂的设定体积添加到平板的每个孔中;这是为了封闭任何未使用的结合位点。
[0218]
将平板密封并在室温下在平板振荡器上孵育最少1小时。
[0219]
添加校准品/qc/测试样品
[0220]
使用磷酸盐缓冲盐水(pbs)加0.05%tween
‑
20的溶液彻底清洗平板,并在纸巾上吸收直至干燥。
[0221]
将设定体积的测定稀释剂添加到平板的每个孔中。
[0222]
将设定体积的校准品/qc/测试样品添加到平板的每个孔中。技术性重复的使用(使用重复两次或三次分析的运行校准品/qc/测试样品)用于了解测定的批内不精确性,并对产生的结果的可靠性给予置信度。
[0223]
校准品
[0224]
校准品是通过在测定稀释剂中稀释已知量的(重组)目标生物标志物而产生的人工样品。这种材料的连续稀释用于产生一系列校准物浓度,每批都要运行这些浓度。每次校准都应运行空白(纯分析稀释剂)。用于校准的浓度范围应根据预期在“未知”测试样品中检测到的浓度来选择。测量的信号可以在测定结束时相对已知浓度作图,以产生标准曲线;可以相对标准曲线读取测试样品中测得的信号以进行定量。
[0225]
质量控制(qc)
[0226]
qc材料是用于评估测定的准确性和不精确性的样品。
[0227]
在每个批次的开始和结束时运行多个级别(通常为3个)的qc材料。qc的3个级别应
包含跨越与测定相关的范围的不同浓度(通常为低、中和高浓度)。
[0228]
qc材料可以来自混合和等分的样品(如混合的人血清或血浆),或通过在测定缓冲液中稀释重组生物标志物产生的。将每个级别qc的多个相同小瓶储存在
‑
80℃。
[0229]
每批次运行一组新鲜的qc样品可以确定批次与批次间的不精确性。
[0230]
在每个批次的开始和结束时运行多个级别和多个qc样品,可以确定批次内的不精确性。
[0231]
一旦样品上样完成,将平板密封并在室温下在平板振荡器上孵育2小时。
[0232]
添加检测抗体
[0233]
使用磷酸盐缓冲盐水(pbs)加0.05%tween
‑
20的溶液彻底洗涤平板,并在纸巾上吸收直至干燥。
[0234]
将设定体积的生物素化检测抗体加入平板的每个孔中。
[0235]
将平板密封并在平板振荡器上在室温下孵育1小时。
[0236]
检测抗体应该对目标生物标志物上存在的与包被/捕获抗体不同的表位具有特异性。
[0237]
添加链霉亲和素
‑
标签缀合物
[0238]
要使用的标签/标记取决于技术;2
‑
位点免疫分析的传统标签包括但不限于:
[0239]
·
酶(辣根过氧化物酶)
[0240]
·
荧光团(荧光标签)
[0241]
·
镧系金属(用于时间分辨解离增强荧光免疫分析)
[0242]
·
化学发光标签
[0243]
·
放射性同位素
[0244]
使用磷酸盐缓冲盐水(pbs)加0.05%tween
‑
20的溶液彻底洗涤平板,并在纸巾上吸收直至干燥。
[0245]
将设定体积的链霉亲和素
‑
标签缀合物加入平板的每个孔中。
[0246]
将平板密封并在平板振荡器上在室温下孵育30min。
[0247]
读取
[0248]
在添加从测定中使用的标签产生信号所需的任何试剂后,可以读取平板。在双位点“夹心”免疫测定中,产生的信号量与样品中生物标志物的浓度成比例。
[0249]
可以使用标准曲线(通过将连续稀释的校准品材料中测量的信号作图产生的)用于估算qc/测试样品材料中的浓度。
[0250]
ella分析方案
[0251]
1.简单丛(plex)冻干质量控制制剂
[0252]
1.1ifnγ/il
‑
10/il
‑
8/cxcl
‑
9多重
[0253]
产品代码:894955/894956/894950/894951
[0254]
批号:1509071/1498073/1393853/1394497
[0255]
重悬容积(volume)(第二个小瓶被保存以备后用)(sd13批号#p150976)
[0256]
干扰素γ=1150μl
[0257]
il
‑
10=415μl
[0258]
il
‑
8=1200μl
[0259]
cxcl
‑
9=1000μl
[0260]
在滚筒混合器上混合15分钟。
[0261]
high对照的制备:在20ml universal中:将360μl每种对照浓缩物加入10.56ml稀释剂sd13中。轻轻混合。
[0262]
low对照的制备:在20ml universal中:将240μl high对照加入11.76ml稀释剂sd13中。
[0263]
为低和高qc准备了80
×
140μl等分试样。
‑
80℃冷冻。
[0264]
1.2ip
‑
10/il
‑
12p70/il
‑
6/tnfa多重
[0265]
产品代码:894949/894957/894968/894977
[0266]
批号:1400303/1392317/1422813/1493487
[0267]
重悬容积(volume)(第二个小瓶保存以备后用)(sd13批号#p150976)
[0268]
ip
‑
10=800μl
[0269]
il
‑
12p70=500μl
[0270]
il
‑
6=570μl
[0271]
tnfα=600μl
[0272]
在滚筒混合器上混合15分钟。
[0273]
high对照的制备:在20ml universal中:将360μl每种对照浓缩物加入10.56ml稀释剂sd13中。轻轻混合。
[0274]
low对照的制备:在20ml universal中:将240μl high对照加入11.76ml稀释剂sd13中。
[0275]
为低和高qc准备了80
×
140μl等分试样。
‑
80℃冷冻。
[0276]
1.3tnf rii(cd120b)单一
[0277]
产品代码:898106
[0278]
批号:1397402
[0279]
重悬容积(volume)=700μl样品稀释剂sd13(产品代码896098)仅将700μl sd13加入一个小瓶中(第二个小瓶保存以备后用)(sd13批号#p172465)
[0280]
在滚筒混合器上混合15分钟。
[0281]
high对照的制备:在20ml universal中:将360μl对照浓缩物加入11.64ml稀释剂sd13中。轻轻混合。
[0282]
low对照的制备:在20ml universal中:将240μl high对照加入11.76ml稀释剂sd13中。
[0283]
为低和高qc准备了80
×
140μl等分试样。
‑
80℃冷冻。
[0284]
1.4cd14单一
[0285]
产品代码:898078
[0286]
批号1398395
[0287]
重悬容积(volume)=500μl样品稀释剂sd13(产品代码896098)仅将500μl sd13加入一个小瓶中(第二个小瓶保存以备后用)(sd13批号#p172465)
[0288]
在滚筒混合器上混合15分钟。
[0289]
high对照的制备:在20ml universal中:将360μl对照浓缩物加入11.64ml稀释剂
sd13中。轻轻混合。
[0290]
low对照的制备:在20ml universal中:将240μl high对照加入11.76ml稀释剂sd13中。
[0291]
为低和高qc准备了80
×
140μl等分试样。
‑
80℃冷冻。
[0292]
2.ella样品分析
[0293]
2.1ella检测板、试剂和qc
[0294]
2.1.1检测板
[0295]
1. 72
‑
孔单一cd14
[0296]
2. 72
‑
孔单一
‑
cd120b(tnfr2/tnfrsf1b)
[0297]
3. 32
‑
孔4
‑
重ifnγ il
‑
10 il
‑
8 cxcl
‑9[0298]
4. 32
‑
孔4
‑
重ip10 il
‑
12p70 il
‑
6 tnfα
[0299]
并分开地:
[0300]
5. 72
‑
孔单一ifnγ
[0301]
2.1.2试剂
[0302]
每个检测板盒含有一瓶或多瓶即用的测定稀释剂sd13和洗涤缓冲液。
[0303]
2.1.3qc
[0304]
1.加标(spiked)血浆库2017(以100μl和250μl等分试样储存于
‑
80℃)
[0305]
2.proteinsimple低qc(2a=cd14,2b=cd120b,2c=ifng/il
‑
10/il
‑
8/cxcl
‑
9,2d=ip10/il
‑
12p70/il
‑
6/tnfa)(以250μl等分试样储存于
‑
80℃)
[0306]
3.proteinsimple高qc(3a=cd14,3b=cd120b,3c=ifng/il
‑
10/il
‑
8/cxcl
‑
9,3d=ip10/il
‑
12p70/il
‑
6/tnfa)(以250μl等分试样储存于
‑
80℃)
[0307]
2.2样品&批次格式
[0308]
样品来自全球不同地区。
[0309]
注:所有样品都视为有感染风险,并使用适当的ppe进行处理。
[0310]
样品在等待分析时储存在
‑
20℃下,分析完成后返回至
‑
20℃储存。
[0311]
2.2.1单一测定
[0312]
为每天的工作解冻132个样品。这些是使用2
×
cd14检测板和2
×
cd120b检测板进行分析的。每个检测板有用于66个未知物加开始的3个qc和结束的3个qc的空间。每天使用单个100μl加标库等分试样(或每天使用250μl加标库等分试样用于ifnγ单一分析)。
[0313]
2.2.2多重测定
[0314]
为每天的工作解冻56个样品。使用2
×
ifng 4
‑
重检测板和2
×
ip10 4
‑
重检测板对这些进行分析。每个检测板有用于28个未知物加开始的2个qc和结束的2个qc(加标库 开始的低qc,加标库 结束的高qc)。每天使用单个250μl加标库等分试样。
[0315]
2.3测定
[0316]
2.3.1单一(cd120b&cd14)
[0317]
将样品&qc在滚筒混合器上解冻至少15分钟。
[0318]
在eppendorf minifuge中以5000rpm离心样品5分钟。
[0319]
在eppendorf minifuge中以5000rpm离心qc 1分钟。
[0320]
单一检测板足够用于66个tb样品加每次运行开始和结束的3个qc。
[0321]
检测板1:cd120b(tnf rii)
[0322]
tb样品&加标库需要在测定稀释剂sd13中按1比10预稀释。
[0323]
对于tb样品,将10μl样品加入标记的2ml sarstedt试管中的90μl稀释剂sd13中。充分混合。
[0324]
对于加标库qc,将20μl样品加入标记的2ml sarstedt试管中的180μl稀释剂sd13中。充分混合。
[0325]
样品上样
[0326]
吸移50μl至每个孔中
[0327]
孔1&2=低和高qc(未稀释的)
[0328]
孔3=加标库qc(稀释的)
[0329]
孔4
‑
69=tb样品(稀释的)
[0330]
孔70=加标库qc(稀释的)
[0331]
孔71&72=低&高qc(未稀释的)
[0332]
吸移1ml洗涤缓冲液至检测板洗涤缓冲液存储器中。
[0333]
所有样品上样时,按照ellasop运行测定(参见以下部分3)。
[0334]
检测板2:cd14
[0335]
样品&加标库需要在测定稀释剂sd13中按1比5000预稀释。
[0336]
进一步稀释为cd120b测定制备的1比10稀释液。
[0337]
将10μl 1比10稀释液加入标记的2ml sarstedt试管中的90μl稀释剂sd13中=1比100稀释。充分混合。
[0338]
将5.1μl 1比100稀释液加入标记的2ml sarstedt试管中的250μl稀释剂sd13中=1比5000稀释。充分混合。
[0339]
样品上样
[0340]
吸移50μl至每个孔中
[0341]
孔1&2=低和高qc(未稀释的)
[0342]
孔3=加标库qc(稀释的)
[0343]
孔4
‑
69=tb样品(稀释的)
[0344]
孔70=加标库qc(稀释的)
[0345]
孔71&72=低&高qc(未稀释的)
[0346]
吸移1ml洗涤缓冲液至检测板洗涤缓冲液存储器中。
[0347]
所有样品上样时,按照ellasop运行测定(参见以下部分3)。
[0348]
检测板2完成时,使用第二批样品重复稀释&上样顺序。检测板3=cd120b,检测板4=cd14。
[0349]
检测板5:单一ifnγ
[0350]
将样品&qc在滚筒混合器上解冻至少15分钟。
[0351]
在eppendorf minifuge中以5000rpm离心样品5分钟。
[0352]
在eppendorf minifuge中以5000rpm离心qc 1分钟。
[0353]
单一检测板足够用于66个tb样品加每次运行开始和结束的3个qc。
[0354]
样品上样
[0355]
吸移25μl稀释剂13至每个孔中,除了孔1&2和71&72
[0356]
孔1&2=吸移50μl低和高qc(未稀释的)
[0357]
孔3=吸移25μl加标库qc
[0358]
孔4
‑
69=吸移25μl tb样品
[0359]
孔70=吸移25μl加标库qc
[0360]
孔71&72=吸移50μl低&高qc
[0361]
在平板振荡器上简短(5秒)振荡以混合。
[0362]
吸移1ml洗涤缓冲液至检测板洗涤缓冲液存储器中。
[0363]
当所有样品上样完成,按照ella sop运行测定(参见以下部分3)。
[0364]
检测板1完成时,使用第二批样品重复上样顺序。
[0365]
2.3.2多重(infγ&ip104
‑
重)
[0366]
将样品&qc在滚筒混合器上解冻至少15分钟。
[0367]
在eppendorf minifuge中以5000rpm离心样品5分钟。
[0368]
在eppendorf minifuge中以5000rpm离心qc 1分钟。
[0369]
多重检测板足够用于28个tb样品加每次运行开始和结束的2个qc。
[0370]
检测板1:ifnγ il
‑
10 il
‑
8 cxcl
‑9[0371]
tb样品&加标库需要在测定稀释剂sd13中按1比2稀释。
[0372]
使用multipette吸移25μl测定稀释剂sd13至所有孔中(除了需要proteinsimple qc的那些),然后吸移25μl样品或加标库至孔中。
[0373]
样品上样
[0374]
吸移25μl测定稀释剂sd13至每个孔中,除了孔1&32
[0375]
孔1=低qc50μl(未稀释的)
[0376]
孔2=加标库qc 25μl(稀释的)
[0377]
孔3
‑
30=tb样品25μl(稀释的)
[0378]
孔31=加标库qc25μl(稀释的)
[0379]
孔32=高qc50μl(未稀释的)
[0380]
将平板在平板振荡器上温和混合5秒钟。
[0381]
吸移1ml洗涤缓冲液至检测板洗涤缓冲液存储器中。
[0382]
当所有样品&洗涤缓冲液已经加完时,按照ella sop运行测定(参见以下部分3)。
[0383]
检测板2:ip10 il
‑
12p70 il
‑
6 tnfα
[0384]
tb样品&加标库需要在测定稀释剂sd13中按1比2稀释。
[0385]
使用multipette吸移25μl测定稀释剂sd13至所有孔中(除了需要proteinsimple qc的那些),然后吸移25μl样品或加标库至孔中。
[0386]
样品上样
[0387]
吸移25μl测定稀释剂sd13至每个孔中,除了孔1&32
[0388]
孔1=低qc50μl(未稀释的)
[0389]
孔2=加标库qc 25μl(稀释的)
[0390]
孔3
‑
30=tb样品25μl(稀释的)
[0391]
孔31=加标库qc25μl(稀释的)
[0392]
孔32=高qc50μl(未稀释的)
[0393]
将平板在平板振荡器上温和混合5秒钟。
[0394]
吸移1ml洗涤缓冲液至检测板洗涤缓冲液存储器中。
[0395]
当所有样品&洗涤缓冲液已经加完时,按照ella sop运行测定(参见以下部分3)。
[0396]
检测板2完成时,用第二批样品重复上样顺序。检测板3=ifng 4
‑
重,检测板4
‑
ip10 4重。
[0397]
3.proteinsimple ella免疫测定分析仪的操作
[0398]
3.1仪器制造商
[0399]
该仪器由proteinsimple(biotechne子公司)制造。
[0400]
3.2检测说明
[0401]
ella仪器能够以最少的用户操作时间执行单一或多重免疫测定。测定在含有微流体通道网络的固体微量滴定板大小的检测板中进行。检测板配置为对于单个生物标志物测量72个样品,或对于多达4个生物标志物测量16或32个样品。
[0402]
ella检测板经过工厂校准。样品(如果需要预先稀释)、qc和洗涤缓冲液由操作员加载到检测板中。对仪器进行编程并装入检测板。整个免疫测定程序是完全自动化的。结果可在大约90分钟内获得。
[0403]
每个样品都单独上样,但在“玻璃纳米反应器”(gnr)中重复三次进行测量。
[0404]
该测定按照制造商的说明运行。
[0405]
结果
[0406]
实施例1
‑
预测模型在不同诊断组中的性能
‑
idea队列:
[0407]
每组(如上分层)中正确诊断患者的百分比是从使用5bm和7bm生物标志物组生成的预测模型计算的。表4显示了这些模型和生物标志物组中每一个的预测性能。可以看出,使用两个生物标志物组生成的预测模型都能够正确诊断活动性tb。
[0408]
表4
‑
预测模型在不同诊断组中的性能
‑
idea队列:
[0409][0410][0411]
正确诊断的患者的分数显示于括号中。
[0412]
实施例2
‑
预测模型在不同诊断组中的性能
‑
sa队列
[0413]
在与实施例1中呈现的idea队列无关的队列的每组(如上分层)中,正确诊断患者的百分比是使用5bm和7bm生物标志物组从预测模型计算的。表5显示了这些模型和生物标志物组中每一个的预测性能。可以看出,使用两个生物标志物组生成的预测模型都能够正确诊断活动性tb。
[0414]
表5
‑
预测模型在不同诊断组中的性能
‑
sa队列:
[0415][0416]
正确诊断的患者的分数显示于括号中。
[0417]
实施例3
‑
使用ella设备的预测模型的性能
[0418]
为了进一步验证5bm和7bm生物标志物组的益处,我们对称为ella(由proteinsimple制造)的独立下一代elisa设备进行了进一步评估。ella使用荧光化学,其不同于上文描述的使用电化学发光的评估。
[0419]
本测试通过从4个国家(西班牙、英国、南非和巴西)的结核病诊所提供的总共1376个样品进行验证,样品包括出现结核病症状的人和对照者。
[0420]
本测试是按照上文提供的方案在ella设备上进行。
[0421]
5bm和7bm生物标志物组的结果分别如以下以及图6和7中所示:
[0422]
表6
‑
预测模型在ella设备上的性能
[0423][0424]
如上所述,预测模型是在来自早期研究的数据集上训练的。来自ella测定的数据使用稳健的线性回归转换进行转换。表6以及图6和7中显示的数据表明两种预测模型(5bm和7bm)都表现良好,并且与之前生成的数据一致。值得注意的是,ella设备使用完全不同的检测化学。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。