一种老黄酶oye2蛋白及其在铬污染中的应用
技术领域
1.本发明涉及一种老黄酶oye2蛋白及其在铬污染中的应用,属于重金属防治领域。
背景技术:
2.土壤和地下水中的铬(cr)污染是国际上最关注的环境问题之一,其主要来源于铬盐生产、电镀、鞣革、颜料生产、采矿和冶金等行业。铬在环境中存在两种稳定的铬氧化态:六价铬和三价铬;与六价铬cr(vi)相比,三价铬cr(iii)溶解性低、迁移能力弱和生物毒性低。因此,水中铬污染治理的有效策略之一就是将六价铬cr(vi)还原成三价铬cr(iii)。其中微生物还原六价铬cr(vi)被看作是一种具有很大应用潜力的方法,但微生物修复过程仍存在周期较长的缺点,且利用微生物进行原位修复时受环境因子影响大,与土著微生物存在相互竞争,造成修复效果不稳定。
3.目前有大量的研究报道利用六价铬还原酶修复土壤和治理污染地下水,如利用漆酶修复ddt污染的土壤、土壤酶修复铅污染土壤、固定化酶修复被农药污染的土壤、硝化细菌产生的酶对地下水进行脱氮处理等。对于cr(vi)污染,有大量研究报道了cr(vi)还原酶,如来源于escherichia coli的nfsa和yief酶,其最大还原速率分别为0.25和5.0μmol/min/mg;pseudomonas putida kt2400中的chrr其最大还原速率为8.8μmol/min/mg。这些蛋白酶均能在一定条件下实现cr(vi)的有效还原,但是离大规模工业应用尚有较大差距。因此,急需一种高效治理水体中的铬污染的方法,以满足大规模工业应用。
技术实现要素:
4.为了得到一种高效治理水体中铬污染的方法,本发明提供了一种六价铬还原酶及其在治理水体铬污染中的应用。所述应用,是指向六价铬污染水体中投放所述六价铬还原酶,将高水溶性的六价铬还原成低水溶性的三价铬,通过降低其迁移性达到治理目的。
5.本发明提供了一种酶法降解六价铬的方法,所述方法为,将氨基酸序列如seq id no.1所示的六价铬还原酶添加至含有六价铬的反应体系当中进行降解。
6.在本发明的一种实施方式中,编码所述六价铬还原酶的核苷酸序列如seq id no.2所示。其在genbank中注释结果为核黄素氧化还原酶/nadh氧化酶,该蛋白属于oye2家族成员,本发明将其命名为cyc1。
7.在本发明的一种实施方式中,所述六价铬还原酶来源于corynebacterium crenatum sypa5
‑
5。
8.在本发明的一种实施方式中,反应体系中,所述六价铬还原酶的添加量至少为0.1u/mg六价铬cr(vi)。
9.在本发明的一种实施方式中,所述六价铬还原酶的投放量至少为0.1u/mg六价铬cr(vi)。
10.在本发明的一种实施方式中,当污染水体中的铬浓度≤100mg/l时,六价铬还原酶的投放量为0.1u/mg cr(vi)。根据动力学最大速度vmax=30.39umol cr(vi)/min/mg酶蛋
白折算。
11.在本发明的一种实施方式中,降解反应条件为:在ph 6~12的条件下进行。
12.在本发明的一种实施方式中,所述酶的最适作用ph值为8.5。
13.在本发明的一种实施方式中,降解反应在25
‑
40℃的温度下进行。
14.在本发明的一种实施方式中,所述六价铬还原酶的最适作用温度为30℃。
15.本发明还提供了一种重组大肠杆菌,所述重组大肠杆菌含有上述氨基酸序列如seq id no.1所示的六价铬还原酶。
16.在本发明的一种实施方式中,编码所述六价铬还原酶的核苷酸序列如seq id no.2所示。
17.在本发明的一种实施方式中,所述重组大肠杆菌以e.coli bl21(de3)为表达宿主,以pxmj
‑
19为表达载体。
18.本发明还提供了一种全细胞降解六价铬的方法,所述方法为,将含有氨基酸序列如seq id no.1所示的六价铬还原酶的微生物细胞添加至含有六价铬的反应体系当中进行降解。
19.在本发明的一种实施方式中,所述反应体系为污水环境。
20.在本发明的一种实施方式中,编码所述六价铬还原酶的核苷酸序列如seq id no.2所示。
21.在本发明的一种实施方式中,所述微生物细胞是重组大肠杆菌。
22.在本发明的一种实施方式中,所述重组大肠杆菌以e.coli bl21(de3)为表达宿主,以pxmj
‑
19为表达载体。
23.在本发明的一种实施方式中,所述重组大肠杆菌在反应体系中的添加量至少为1%(v/v)。
24.本发明还提供了一种提高大肠杆菌对六价铬的降解能力的方法,所述方法为,在大肠杆菌中表达氨基酸序列如seq id no.1所示的六价铬还原酶。
25.在本发明的一种实施方式中,编码所述六价铬还原酶的核苷酸序列如seq id no.2所示。
26.本发明还提供了氨基酸序列如seq id no.1所示的六价铬还原酶,或含有核苷酸序列如seq id no.2所示的六价铬还原酶的重组载体,或含有氨基酸序列如seq id no.1所示的六价铬还原酶的微生物细胞在制备降解六价铬的产品中的应用。
27.在本发明的一种实施方式中,所述重组载体是以pet
‑
28a、pdxw
‑
10、pxmj
‑
19为表达载体。
28.在本发明的一种实施方式中,所述微生物细胞以细菌或真菌为宿主细胞。
29.在本发明的一种实施方式中,所述微生物细胞是以e.coli bl21、e.coli jm109、corynebacterium crenatum sypa5
‑
5或corynebacterium atcc 13032为宿主细胞。
30.在本发明的一种实施方式中,所述产品为化学品。
31.本发明还提供一种能快速去除废水中cr(vi)的六价铬还原酶的制备方法,将上述六价铬还原酶基因cyc1构建到表达载体上,并利用原核表达系统制备高活性的铬还原酶cyc1。
32.在本发明的一种实施方式中,以corynebacterium crenatum sypa 5
‑
5基因组为
模板,设计如下引物,通过pcr扩增获得铬还原酶基因cyc1的核酸序列(如seq id no.2所示),将核酸序列构建到pxmj
‑
19载体上,并转化bl21大肠杆感受态细胞,所得重组菌经诱导表达,分离纯化得到目的蛋白。所涉及的引物序列如下:
33.f:5
’‑
agcttaaaggaggacaaccgtgcaccaccaccaccaccacctccaagctgt
‑3’
34.r:5
’‑
agccaagtgaattcttaaagtacgtagtc
‑3’
。
35.有益效果
36.(1)本发明提供的来源于corynebacterium crenatum sypa5
‑
5的铬还原酶对cr(vi)具有较强的还原作用,能快速去除废水中的cr(vi)。
37.(2)采用本发明的方法,在未添加本发明的六价铬还原酶的废水中,cr(vi)浓度未发生明显变化,加入本发明的六价铬还原酶的废水中cr(vi)浓度降到62mg/l,还原率达38%,能快速有效地去除废水中的六价铬。因此,利用这类酶中的一种或多种制成六价铬还原酶处理含cr(vi)废水具有工业化应用潜力。
附图说明
38.图1:本发明实施例1中cr(vi)还原基因cyc1的pcr扩增结果电泳图谱;其中,m:核酸marker;泳道1、2、3和4:cyc1pcr扩增产物。
39.图2:本发明实施例1中表达载体pxmj
‑
19双酶切结果电泳图;其中,m:核酸marker;泳道1、2:pxmj
‑
19双酶切(ecor i和hind iii)。
40.图3:本发明实施例2中铬还原酶cyc1粗酶液的sds
‑
page图;其中,m:蛋白marker;泳道1:pxmj19空载对照;泳道2:15℃诱导cyc1蛋白表达;泳道3:20℃诱导cyc2蛋白表达;泳道4:25℃诱导cyc1蛋白表达;泳道5:30℃诱导cyc1蛋白表达。
41.图4:本发明实施例2中铬还原酶cyc1纯化后的sds
‑
page图;其中,m:蛋白marker;泳道1:30℃诱导cyc1蛋白表达;泳道2:25℃诱导cyc2蛋白表达;泳道3:20℃诱导cyc1蛋白表达。
42.图5:本发明实施例3中温度对六价铬还原酶活性的影响。
43.图6:本发明实施例3中ph值对六价铬还原酶活性的影响。
44.图7:本发明实施例3中不同金属离子对六价铬还原酶活性的影响。
45.图8:本发明实施例3中不同浓度的cr(vi)对六价铬还原酶活性的影响。
46.图9:本发明实施例3中重组菌对cr(vi)的降解情况。
47.图10:本发明实施例4中六价铬还原酶对含cr(vi)废水的还原情况。
具体实施方式
48.corynebacterium crenatum sypa 5
‑
5是本实验室选育的一株l
‑
精氨酸高产菌,钝齿棒杆菌(corynebacterium crenatum)sypa5
‑
5记载于公开号为cn1441055a的专利申请文本中,保藏编号为cgmcc no.0890(此菌株在专利申请文本中的菌株编号为sdnn403,发明人在实验过程中将其重新编号为sypa5
‑
5);基于前期转录组和蛋白组数据分析,发现六价铬还原酶(cyc1)在高溶氧相对于低溶氧条件下表达水平上调。为了进一步研究cyc1的抗氧化胁迫功能,于是构建了cyc1过表达菌株和敲除菌,发现cyc1蛋白具有极强的氧化还原性质。以cyc1为研究对象,分析cyc1的圆二色谱结构,用swiss
‑
model建模分析,检测其对cr
(vi)的还原能力,验证了cyc1的结构与功能。该cyc1蛋白对cr(vi)具有较强的还原作用,能快速去除废水中cr(vi)的作用,在含有cr(vi)废水处理中具有重要的应用价值。
49.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecular cloning:a laboratory manual,2001),或按照制造厂商说明书建议的条件。
50.下述实施例中所涉及的培养基如下:
51.lb液体培养基(g/l):5酵母粉、10胰蛋白胨、10氯化钠。
52.lb固体培养基:在lb液体培养基的基础上,添加1.5~2.0%的琼脂粉。
53.下述实施例中所涉及的检测方法如下:
54.蛋白浓度的检测:
55.利用bradford试剂盒测定蛋白浓度,以牛血清蛋白作为标准品。
56.cr(vi)浓度的检测:
57.二苯碳酰二肼法,抽取待测样品0.3ml,添加2.5ml 0.12m的浓硫酸溶液,向上述混合物中加入体积为0.2ml二苯碳酰二肼(丙酮溶解),使其最终浓度达到0.4mm,在543nm吸光度下检测。
58.下述实施例中所涉及的基因组dna和相关质粒的提取方法:
59.corynebacterium crenatum sypa5
‑
5提取基因组dna时根据上海捷瑞细菌基因组dna快速提取试剂盒说明书操作。质粒提取时将培养适当浓度的菌液离心后去除上清液,谷氨酸棒杆菌为革兰氏阳性菌,其重组菌株提取质粒时,需要添加适量的溶菌酶于37℃水浴0.5h,大肠杆菌的重组菌株提取质粒时无需加入溶菌酶,采用捷瑞小型质粒提取试剂盒提取,详细操作参照说明书。
60.下述实施例中所涉及的大肠杆菌感受态制备与化学转化法如下:
61.制备大肠杆菌化转感受态细胞,采用takara公司的感受态细胞制备试剂盒competent cell preparation kit,详细操作参照说明书。采用42℃热击化转至e.coli bl21,经过抗生素抗性平板筛选获得阳性转化子,提取质粒进行pcr验证及送至金唯智生物科技公司测序验证。
62.实施例1:构建可表达cr(vi)还原酶基因cyc1的基因工程菌
63.1、cyc1基因的克隆
64.目的基因(核苷酸序列如seq id no.2所示)通过采用高保真酶phantar max(p515)dna polymerases进行pcr扩增,pcr体系为50μl的标准反应体系,pcr扩增程序为:95℃预变性5min;95℃变性30s;退火温度一般设置为58~60℃,30~60s;72℃延伸按照每分钟扩增1500bp基因设置时间;变性至延伸程序30个循环;72℃再延伸5min;4℃保存。pcr结束后将pcr产物进行核酸电泳,进行验证及胶回收纯化,结果如图1所示。回收后与线性化载体表达载体pxmj
‑
19进行双酶切,结果如图2所示;使用clonexpress ii one step cloning kit连接后化转e.coli bl21(de3)感受态细胞,挑取阳性转化子提取质粒进行pcr验证及测序验证。
65.制备得到可表达六价铬还原酶cyc1的基因工程菌e.coli bl21(de3)/pxmj
‑
19
‑
cyc1。
66.将空载pxmj
‑
19质粒按照上述方法导入大肠杆菌e.coli bl21(de3)感受态细胞
中,制备得到对照菌株e.coli bl21(de3)/pxmj
‑
19。
67.实施例2:六价铬还原酶cyc1蛋白的表达和纯化
68.1、六价铬还原酶cyc1蛋白的诱导表达
69.将实施例1制备得到的基因工程菌e.coli bl21(de3)/pxmj
‑
19
‑
cyc1、e.coli bl21(de3)/pxmj
‑
19对照菌株分别划线至含有chl
r
的lb固体培养基上,在37℃、12h的条件下进行活化后,挑取单菌落,分别接入10ml含有chl
r
的lb液体培养基小瓶中,在30℃、180rpm培养16~24h后,分别制备得到种子液;
70.将制备得到的种子液按1%(v/v)接种量转接至4瓶50ml含有chl
r
的lb液体培养基中,分别在30℃、180rpm培养4~5h后,添加异丙基β
‑
d
‑1‑
硫代半乳糖苷(iptg)至终浓度为1mmol
·
l
‑1,分别在15℃、20℃、25℃、30℃,180rpm条件下诱导表达16~18h后,制备得到不同温度诱导下的发酵液;
71.分别将制备得到的发酵液在4℃、8000rpm条件下离心10min收集菌体细胞。
72.分别将收集的细胞采用0.1mol
·
l
‑1的pbs缓冲液(ph 7.4)洗涤两次后,重新悬浮于pbs缓冲液(ph 7.4)中,控制菌体浓度(菌体浓度为:od
600
=6.0)一致的情况下,采用超声破碎仪破碎,破碎液4℃下离心20min,收集上清,sds
‑
page分析蛋白表达情况,结果如图3所示,从图3可知,六价铬还原酶cyc1蛋白在30℃诱导表达效果最佳;剩余粗酶液用于后续的酶活测定。
73.制备得到含有不同温度诱导表达下的六价铬还原酶cyc1的粗酶液。
74.2、六价铬还原酶cyc1蛋白的纯化
75.分别将步骤1制备得到的含有六价铬还原酶cyc1的粗酶液采用0.45μm滤膜过滤后,采用ni
‑
nta蛋白纯化柱进行纯化去除杂蛋白,重组酶cyc1末端带有his标签能够与纯化柱上的ni
进行鳌合,梯度洗脱,采用不同浓度的咪唑缓冲液梯度洗脱,结合于纯化柱上的纯化蛋白被洗脱下来,进而达到纯化酶。然后将cyc1纯酶液做sds
‑
page分析,如图4所示,由图4可知,六价铬还原酶cyc1蛋白在30℃诱导表达效果最佳。
76.利用bradford试剂盒测定30℃诱导表达下的六价铬还原酶cyc1蛋白浓度,以牛血清蛋白作为标准品。
77.六价铬还原酶cyc1纯酶的比酶活数据在含有在20mm mops—naoh缓冲液中其中包含100mm nad(p)h、10mm fmn、1mm cro3和10mm cacl2,加入50μl cyc1纯酶,在30℃、ph=8.5的条件下反应1min,通过二苯碳酰二肼法检测cr(vi)含量,结果如表1所示。
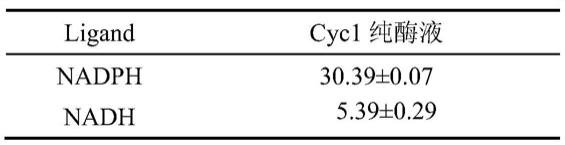
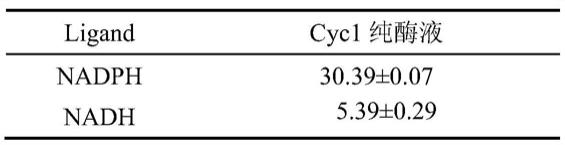
78.表1 cyc1纯酶液在不同配体下对cr(vi)还原的比酶活(u/mg)
[0079][0080]
实施例3:六价铬还原酶cyc1纯酶的活性分析
[0081]
下述实验采用的是实施例2的步骤2得到的30℃条件下诱导菌株表达后经纯化的cyc1纯化酶。
[0082]
1、温度对六价铬还原酶cyc1纯酶的活性影响
[0083]
将六价铬还原酶cyc1纯酶分别在25、27、30、33、35、37、40、42、45℃处理30min,并
取样检测六价铬还原酶的活性。
[0084]
检测方法为:在20mm mops—naoh缓冲液中,所述缓冲液中包含100mm nad(p)h、10mm fmn、1mm cro3和10mm cacl2,加入50μl cyc1纯酶,ph=8.5的条件反应1min,通过二苯碳酰二肼法检测cr(vi)含量。
[0085]
结果如图5所示,六价铬还原酶cyc1纯酶在30℃时具有最大的活性,27℃及33℃时有比较高的活性,分别为最大活性的83%和84%;25℃和42℃时其活性为最大活性的40%和32%;由此可知,六价铬还原酶在较宽的温度范围内均具有活性。
[0086]
2、ph对六价铬还原酶cyc1纯酶的活性影响
[0087]
不同ph值(6、7、8、8.5、9、10、11、12)条件下对六价铬还原酶的活性进行了检测。
[0088]
检测方法为:在20mm mops—naoh缓冲液中,所述缓冲液中包含100mm nad(p)h、10mm fmn、1mm cro3和10mm cacl2,加入50μl cyc1纯酶,在30℃条件反应1min,通过二苯碳酰二肼法检测cr(vi)含量。
[0089]
结果如图6所示,六价铬还原酶在ph值为8.5时具有最大的活性,ph在8及9时有比较高的活性,分别为最大活性的60%和91%。ph在6和10时其活性为最大活性的10%和5%。由此可知,六价铬还原酶对ph要求是比较专一。
[0090]
3、金属离子对六价铬还原酶cyc1纯酶的活性影响
[0091]
不同金属离子(na
、k
、mg
2
、mn
2
、zn
2
、ca
2
、cu
2
、edta)条件下对六价铬还原酶cyc1纯酶的活性进行了检测。
[0092]
具体方法如下:10mm不同金属离子(浓度为:10mm)在20mm mops—naoh缓冲液中,所述缓冲液中包含100mm nad(p)h、10mm fmn和1mm cro3,加入50μl cyc1纯酶,在30℃、ph=8.5的条件反应1min,通过二苯碳酰二肼法检测cr(vi)含量。
[0093]
结果如图7所示,六价铬还原酶cyc1纯酶在ca
2
条件下具有最大的活性,在mg
2
比较高的活性,为最大活性的60%。由此可知,六价铬还原酶cyc1纯酶对离子的要求是比较专一.
[0094]
4、不同浓度的cr(vi)对六价铬还原酶活性的影响
[0095]
在不同cr(vi)浓度条件下对六价铬还原酶cyc1纯酶的活性进行了检测。
[0096]
具体方法如下:在20mm mops—naoh缓冲液中,所述缓冲液中包含100mm nad(p)h、10mm fmn和50μl cyc1纯酶,分别加入0.1mm、0.2mm、0.3mm、0.4mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1.0mm的cro3,体系在30℃、ph=8.5的条件反应1min,通过二苯碳酰二肼法检测cr(vi)含量。
[0097]
结果如图8所示,六价铬还原酶cyc1纯酶在cr(vi)浓度>0.4mm时具有最大的活性,km值为0.2mm。
[0098]
5、重组菌株对cr(vi)降解作用
[0099]
将实施例2制备得到基因工程菌e.coli bl21(de3)/pxmj
‑
19
‑
cyc1、e.coli bl21(de3)/pxmj
‑
19对照菌株的发酵液,按1%(v/v)的接种量转接至已添加1.0mm cro3的50ml lb液体培养基中,在30℃、180rpm条件下培养24小时,通过二苯碳酰二肼法每隔4个小时检测cr(vi)的含量,结果如图9所示。
[0100]
结果表明,基因工程菌e.coli bl21(de3)在导入外源cyc1基因后,显著增强了该菌株降解cr(vi)的能力。
[0101]
实施例4:六价铬还原酶cyc1纯酶在含cr(vi)废水处理中的应用
[0102]
具体步骤如下:
[0103]
(1)从无锡某处废水场取一定量的含cr(vi)废水,通过二苯碳酰二肼方法对cr(vi)高灵敏性定量检测,对该废水进行了理化性质检测,确定了废水中含有cr(vi),并且该废水中的六价铬cr(vi)的浓度,为100mg/l。
[0104]
(2)将实施例2制备的六价铬还原酶cyc1纯酶(步骤2得到的30℃条件下诱导菌株表达后经纯化的cyc1纯化酶)按0.1u/mg cr(vi)的投加量(即1u)加入其中,30℃,ph为8.5的条件下处理6小时,测定其中残余cr(vi)浓度,并设置不添加六价铬还原酶的对照组,结果如图10所示。
[0105]
由图10可知,在未添加六价铬还原酶的废水中,cr(vi)浓度未发生明显变化,加入六价铬还原酶的废水中cr(vi)浓度降到62mg/l,还原率达38%,能快速有效地去除废水中的六价铬。
[0106]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。