角膜假体装置和套件及其使用的外科方法
1.发明背景
2.影响角膜的疾病是全世界失明的主要原因,其总体重要性仅次于白内障。根据世界卫生组织表示,每年报告大约200万新病例。世界上有5000多万人因角膜损伤或疾病导致一只或两只眼睛失明。视敏度的下降影响更多人。
3.由于各种原因,目前针对角膜失明和疾病的解决方案只解决了5%
‑
10%的病例。到目前为止,大多数患者都接受了角膜移植术治疗——这是一种依靠于移植从死者身上获取的角膜组织的手术程序。由于各种原因,所有基于植入物的人工角膜解决方案都未能解决这一潜在问题。由于风险、复杂性和成本,这些被选择性地用作不适合于角膜移植或角膜移植失败的患者的最后手段。目前角膜失明的解决方案分为角膜移植术(角膜移植)和角膜假体(人工角膜)。
4.在角膜移植手术期间,移植物取自最近去世的捐赠者,捐赠者没有已知的疾病或其他可能影响捐赠组织存活机会或受捐者健康的因素。角膜移植术的缺点是缺乏供体组织、运作角膜库的复杂性和成本以及仅针对某些情况的有限适用性。例如,导致血管化(血管侵入角膜组织)的角膜疾病和损伤不适合角膜移植术。多次移植还会导致排斥/失败的风险增高。
5.当使用人工角膜时,这种手术程序被称为角膜假体(keratoprosthesis)。传统上,推荐在患者经历一次或多次供体角膜移植失败后进行角膜假体植入。虽然不同类型的角膜假体已被fda批准有限使用(参见salvador
‑
culla等人的《功能生物材料杂志(journal of functional biomaterial)》,2016年7月13日,其中对角膜假体领域的最新进展进行了综述),但是目前市场上唯一可行的解决方案是boston kpro(波士顿角膜假体)。boston kpro仅被fda批准用于角膜移植术无法解决的病例。这是由于许多并发症以及需要由熟悉boston kpro的眼科医生进行密切和终生监测造成的。为了防止炎症,终生外用类固醇,如醋酸泼尼松龙对所有kpro眼睛都是必要的。
6.关于已知的角膜假体选择存在很多缺点和失败,包括各种术后并发症,这些并发症主要是装置介入前眼房生理机能的结果。大多数患者(60%
‑
75%)发展为青光眼,眼内压升高,这可能导致失明、视野受限和白内障。此外,已知的角膜假体的生物融合性(biointegration)差,需要每天滴抗生素、终生使用外用类固醇进行治疗以及眼科医生的强化终身随访。
7.在植入已知的角膜假体后,进入眼睛的内部部分以执行诸如白内障和视网膜手术的外科手术程序至多是非常有限的。因此,主要的角膜假体手术通常与包括植入青光眼过滤装置以及白内障手术(用合成眼内晶状体(lens)替换晶状体)的其他手术程序相结合,使得手术程序时间更长、更危险且成本更高。
8.wo 2016/199139公开了一种角膜假体组件,包括中心光学芯;和包含至少一个多孔生物相容性层的周边裙部(peripheral skirt),以及在人工角膜手术程序中使用该角膜假体组件的方法。
9.发明概述
10.本发明提供了一种角膜假体,包括:(a)中心光学芯,其包括具有前表面和后表面的中心光学晶状体;和(b)围绕所述中心光学芯的周边裙部,该周边裙部包含至少一种生物相容性聚合物,并且具有能够放置在眼睛的结膜下方和巩膜上方的宽度;其中所述中心光学芯包括从前表面径向延伸(即环绕、围绕前表面)的前边缘、以及从后表面径向延伸(即环绕、围绕后表面)并位于后表面下方的后边缘;其中所述前边缘包括至少两个缝合孔和至少两个进入口(access port);并且其中所述后边缘包括至少两个延伸凸缘。
11.术语“角膜假体”应理解为包括当替换有需求的受试者的患病角膜时,在角膜假体手术中使用的人工角膜。术语“角膜假体组件”、“人工角膜”和“人工角膜组件”在本文中可互换使用。因此,本发明的人工角膜包括位于本发明的人工角膜的中心处的中心光学芯和围绕所述光学芯定位的周边裙部,除其他用途外,该中心光学芯还用于覆盖眼睛的前眼房,该周边裙部穿过结膜
‑
眼球筋膜复合体下方的前巩膜。
12.本发明的人工角膜(本发明的角膜假体)的术语“中心光学芯”提供组件的中心部分,该中心部分包括角膜假体的覆盖眼睛的前眼房的中心光学晶状体(在患病角膜环钻(trephination)之后)。所述中心光学晶状体具有前表面(形成晶状体的顶部部分的表面)和后表面(形成晶状体的底部部分的表面)。
13.在一些实施例中,光学晶状体由柔性聚合物形成。在其他实施例中,光学晶状体由刚性聚合物形成。在一些实施例中,光学晶状体由丙烯酸透明聚合物制成,该聚合物根据受试者的需要具有不同的屈光度。
14.在一些实施例中,所述中心光学晶状体由丙烯酸、硅酸盐或其他透明、耐用的聚合物及其任意组合形成。
15.光学晶状体可选地还包括排斥沉积物的外层。该外层可以由类似于隐形眼镜的硅水凝胶形成。
16.在一些实施例中,所述光学晶状体具有的直径的范围为大约3mm至大约15mm。在其他实施例中,所述中心光学晶状体具有的直径至少为3mm。在其他实施例中,所述中心光学晶状体具有的直径至少为5mm。在其他实施例中,所述中心光学晶状体具有的直径至少为7mm。在其他实施例中,所述中心光学晶状体具有的直径在大约3mm至大约6mm的范围内。在另外的实施例中,所述中心光学晶状体具有的直径在6mm至14mm的范围内。
17.在另外的实施例中,所述中心光学晶状体具有范围为大约500微米到3000微米的厚度。在其他实施例中,所述中心光学晶状体具有范围为大约500微米至2500微米的厚度。在另外的实施例中,所述中心光学晶状体具有范围为大约500微米到1500微米的厚度。
18.在其他实施例中,所述中心光学晶状体具有的屈光度的范围在大约10到大约70屈光度。
19.本发明的角膜假体的光学芯还包括从光学晶状体的前表面径向延伸并围绕光学晶状体的前边缘,以及从光学晶状体的后表面径向向下/在光学晶状体的后表面下方延伸并围绕光学晶状体的后边缘。
20.前边缘包括至少两个缝合孔(即边缘宽度上的孔,其用于通过外科缝合线将本发明的角膜假体缝合到受试者的眼睛中)和至少两个进入口(即在边缘宽度上刻出的孔或拱形结构(arch),该孔或拱形结构例如在外科植入程序中使用,以进入待被治疗的眼睛的位于本发明的角膜假体下面的部分。进入口还允许在植入本发明的角膜假体之后,在受试者
的眼睛中进行手术后操作程序)。
21.在一些实施例中,所述前边缘包括从光学晶状体的前表面径向延伸并围绕光学晶状体的近侧区域以及从近侧区域延伸并围绕近侧区域的远侧区域,所述近侧区域由透明(transparent)/透光(clear)材料(例如它所围绕的光学晶状体的材料)形成并且是一致和均匀的,,该远侧区域包括所述至少两个缝合孔和至少两个进入口。前边缘的透明/透光近侧区域在移植本发明的角膜假体时为外科医生提供帮助,从而所述外科医生可以将本发明的角膜假体适当地放置在环钻角膜(trephined cornea)中的合适位置处。此外,由于本发明的角膜假体的这一部分在装置移植时是可见的,因此这提供了这样的美学特征,即使得具有移植物的眼睛在视觉上类似于健康的正常眼睛。在一些另外的实施例中,所述远侧区域由与近侧区域相似的材料形成。在其他实施例中,所述远侧区域由与近侧区域不同的材料形成。在一些实施例中,所述前边缘包括至少三个缝合孔。在其他实施例中,所述前边缘包括至少四个缝合孔。在其他实施例中,所述前边缘包括至少六个缝合孔。在另外的实施例中,所述前边缘包括至少两对缝合孔。在另外的实施例中,所述前边缘包括至少三对缝合孔。
22.在一些实施例中,所述缝合孔以彼此相距预定的距离定位在前边缘上。在一些实施例中,所述成对的缝合孔以彼此相距预定的距离定位在前边缘上。
23.在一些实施例中,所述前边缘包括至少三个进入口。在一些实施例中,所述前边缘包括至少四个进入口。在一些实施例中,所述前边缘包括至少六个进入口。在一些实施例中,所述前边缘包括3、4、5、6、7、8、9、10或15个进入口。
24.在另外的实施例中,所述进入口以彼此相距预定的距离定位在前边缘上。
25.在一些实施例中,所述前边缘还包括至少一种生物相容性聚合物。位于前边缘上的所述生物相容性聚合物(在一些实施例中,在前边缘上形成的孔口中)允许前边缘与眼睛组织的生物同化。
26.在一些实施例中,所述前边缘具有至少1mm的宽度。在一些实施例中,所述前边缘具有至少2mm的宽度。在一些实施例中,所述前边缘具有至少3mm的宽度。在一些实施例中,所述前边缘具有至少5mm的宽度。当提到前边缘的宽度时,应该理解为指的是所述边缘与所述前表面的接触点和沿着所述边缘的曲率的最远点之间的距离。
27.后边缘从晶状体的表面径向延伸并位于其下方,并且包括至少两个延伸凸缘,每个凸缘从边缘的宽度向下延伸。后边缘允许将所述中心光学芯放入有需求的受试者的环钻角膜中,从而穿过接受者角膜的宽度。从边缘的宽度向下延伸的所述至少两个凸缘使本发明的角膜假体固定保持到环钻角膜中,使得在手术程序过程中或手术程序后,它不会移动、被挤出或推出环钻角膜。在一些实施例中,所述后边缘包括至少三个延伸凸缘。在一些实施例中,所述后边缘包括至少四个延伸凸缘。在一些实施例中,所述后边缘包括至少五个延伸凸缘。在一些实施例中,所述后边缘包括至少六个延伸凸缘。在一些实施例中,所述后边缘包括2、3、4、5、6、7、8、9、10或15个延伸凸缘。
28.在一些实施例中,所述延伸凸缘以彼此相距预定的距离定位在后边缘上。
29.在其他实施例中,所述后边缘具有至少1mm的宽度(即,从晶状体的表面径向延伸,形成在晶状体的表面下方延伸的不包括所述凸缘的径向边缘的部分)。在其他实施例中,所述后边缘具有至少2mm的宽度。在其他实施例中,所述后边缘具有至少3mm的宽度。在其他实
施例中,所述后边缘具有至少4mm的宽度。在其他实施例中,所述后边缘具有至少5mm的宽度。在其他实施例中,所述后边缘具有至少6mm的宽度。在其他实施例中,所述后边缘具有至少7mm的宽度。在其他实施例中,所述后边缘具有至少8mm的宽度。在其他实施例中,所述后边缘具有至少9mm的宽度。在其他实施例中,所述后边缘具有的宽度为1、2、3、4、5、6、7、8、9mm。当提到后边缘的宽度时,应该理解为指的是所述边缘与所述后表面的接触点和其沿着所述边缘的曲率的最远点之间的距离。
30.在一些实施例中,所述前边缘由与光学晶状体和后边缘中的至少一者相同的材料形成。在其他实施例中,所述后边缘由与光学晶状体和前边缘中的至少一者相同的材料形成。在一些其他实施例中,光学芯的所述元件,即光学晶状体、前边缘和后边缘都由相同的材料制成。在一些其他实施例中,光学芯的所述元件,即光学晶状体、前边缘和后边缘都由不同的材料制成。
31.术语“周边裙部”应该理解为包括本发明的角膜假体的一部分,该部分从光学晶状体的前表面延伸,基本上径向包围本发明的角膜假体组件的中心光学芯的所有周界。所述裙部包括至少一个生物相容性层,如上文和下文所定义的。
32.在一些实施例中,所述周边裙部朝向眼睛的结膜延伸。在另外的实施例中,所述周边裙部以能够将其放置在眼睛的结膜下面的方式形成。将裙部放置在结膜下方是在将结膜从其角膜缘锚定处切开(这一手术程序称为环切(peritomy))并将其抬起以形成容纳所述裙部的空间之后执行的。
33.在一些实施例中,所述周边裙部具有的宽度至少为3mm。在其他实施例中,所述周边裙部具有的宽度在3mm至9mm之间。在其他实施例中,所述周边裙部具有的宽度在大约4mm至大约6mm的范围内。
34.在一些实施例中,所述周边裙部具有的厚度在大约100微米至大约2000微米的范围内。
35.在一些实施例中,所述周边裙部的所述至少一种生物相容性聚合物是至少一种多孔生物相容性聚合物。
36.在一些实施例中,所述周边裙部的所述至少一种多孔生物相容性聚合物具有至少0.1μm的孔隙(pore)。在一些实施例中,所述周边裙部的所述至少一种多孔生物相容性聚合物具有的孔隙在大约0.1至10μm之间。在一些实施例中,所述周边裙部的所述至少一种多孔生物相容性聚合物具有的孔隙是大约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0μm。在一些实施例中,在所述周边裙部的外表面上形成另外的孔隙,所述另外的孔隙在大约0.1至10μm之间。在一些实施例中,在所述周边裙部的外表面上形成另外的孔隙,所述另外的孔隙为大约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0μm。在一些实施例中,所述另外的孔隙具有预定的设计图案。
37.在另外的实施例中,所述周边裙部的所述至少一种生物相容性聚合物是非编织织物(nonwoven fabric)。
38.在另外的实施例中,所述周边裙部的所述生物相容性聚合物包含纳米纤维。在一些实施例中,所述纳米纤维具有的直径在大约200nm至4μm之间。在一些实施例中,所述纳米
纤维具有的直径在大约500nm至2μm之间。
39.在一些实施例中,所述周边裙部的所述至少一种生物相容性聚合物通过选自以下中的至少一种工艺形成,即拉伸、静电纺丝(electrospinning)、自组装、模板合成和热致相分离及其任意组合。在一些实施例中,所述周边裙部的所述至少一种生物相容性聚合物通过静电纺丝工艺形成。
40.在进一步的实施例中,所述周边裙部的所述至少一种生物相容性聚合物选自聚(dte碳酸酯)、聚己内酯(pcl)、聚乳酸(pla)、聚氨酯、聚碳酸酯、聚
‑
l
‑
乳酸(plla)、聚(dl
‑
丙交酯
‑
共
‑
己内酯)、聚(乙烯
‑
共
‑
乙酸乙烯酯)乙酸乙烯酯、聚(甲基丙烯酸甲酯)、聚(碳酸亚丙酯)、聚(偏二氟乙烯)、聚丙烯腈、聚己内酯、聚羧甲基硅烷、聚乳酸、聚苯乙烯、聚乙烯吡咯烷酮、聚乙烯醇(pva)、聚环氧乙烷(peo)、聚氯乙烯(pvc)、透明质酸(ha)、壳聚糖、藻酸盐、聚羟基丁酸酯及其共聚物、尼龙11、醋酸纤维素、羟基磷灰石、聚(3
‑
羟基丁酸
‑
共
‑3‑
羟基戊酸)、聚(dl
‑
丙交酯)、聚己内酯和聚(l
‑
丙交酯)或其任意组合。
41.术语“多孔生物相容性层”应理解为包括任何类型的层(或膜),所述层(或膜)由这样的材料形成,即该材料能够执行其关于医学治疗(即角膜假体)的期望功能,而不会在该治疗的接受者或受益者中引起任何不期望的局部或全身影响,但在该特定情况下产生最合适的有益细胞或组织反应,并优化该治疗的临床相关性能。本发明的组件的裙部的生物相容性层允许植入的人工角膜和与其接触的组织和谐共存,而不会引起有害的变化。该层是多孔的,具有至少约0.1μm的孔径(当提到孔径时,应该理解为与平均孔径相关)。
42.在一些实施例中,所述多孔生物相容性层是纤维状多孔生物相容性层(即该层或膜由纤维形成),其具有至少大约2μm的孔径。
43.在一些实施例中,至少一个多孔生物相容性层具有宽度在大约2μm具至大约100μm之间的孔隙。
44.在其他实施例中,所述至少一个多孔生物相容性层是聚合物层。因此,在该实施例中,裙部的层或膜由至少一种聚合物材料制成。
45.在其他实施例中,所述至少一个多孔生物相容性层是非编织织物。因此,在该实施例中,裙部的所述层或膜是由长纤维制成的、通过化学、机械、加热或溶剂处理结合在一起的织物状材料。
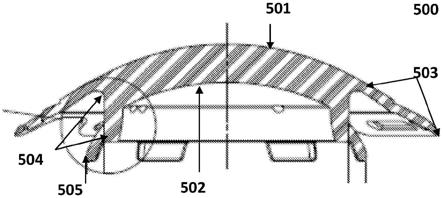
46.在另外的实施例中,所述多孔生物相容性层包含纳米纤维。因此,在该实施例中,裙部由直径小于2000纳米的纤维形成。在一些实施例中,纳米纤维通过以下任何类型的工艺生产,即包括但不限于熔融加工、界面聚合、静电纺丝、抗溶剂诱导的聚合物沉淀、静电纺纱(electrostatic spinning)、催化合成及其任何组合。
47.在另外的实施例中,所述至少一个多孔生物相容性层包含聚(dte碳酸酯)、聚己内酯(pcl)、聚乳酸(pla)、聚氨酯、聚碳酸酯、聚
‑
l
‑
乳酸(plla)、聚(dl
‑
丙交酯
‑
共
‑
己内酯)、聚(乙烯
‑
共
‑
乙酸乙烯酯)乙酸乙烯酯、聚(甲基丙烯酸甲酯)、聚(碳酸亚丙酯)、聚(偏二氟乙烯)、聚丙烯腈、聚己内酯、聚羧甲基硅烷、聚乳酸、聚苯乙烯、聚乙烯吡咯烷酮、聚乙烯醇(pva)、聚环氧乙烷(peo)、聚氯乙烯(pvc)、透明质酸(ha)、壳聚糖、藻酸盐、聚羟基丁酸酯及其共聚物、尼龙11、醋酸纤维素、羟基磷灰石、聚(3
‑
羟基丁酸
‑
共
‑3‑
羟基戊酸)、聚(dl
‑
丙交酯)、聚己内酯和聚(l
‑
丙交酯)或其任意组合。
48.在一些另外的实施例中,所述多孔生物相容性层包含电纺纳米纤维。在另一个实
施例中,所述至少一个多孔生物相容性层通过静电纺丝工艺形成。
49.术语“静电纺丝”或“电纺(electrospun)”或其任何语言偏差应理解为包括使用电荷从液体中提取非常细(通常在微米或纳米级)纤维的工艺。也可以从熔融前体进行静电纺丝;这种方法确保没有溶剂被带入最终产品中。使用静电纺丝工艺生产的纤维具有增加的表面积与体积比。已知影响电纺纤维的各种因素包括但不限于溶液粘度、表面张力、电场强度和距离。
50.在典型的静电纺丝工艺中,将足够高的电压施加到聚合物材料(聚合物溶液、其单体前体、溶胶
‑
凝胶前体、颗粒悬浮液或熔体)的液滴上,液体主体带电,并且静电斥力抵消表面张力,并且液滴被拉伸,在临界点,液体流从表面喷出。如果液体的分子内聚力足够高,则不会发生流破碎(如果发生,则电喷雾液滴)并形成带电液体射流。当射流在飞行中变干时,随着电荷迁移到纤维表面,电流模式从欧姆变为对流。然后,由在纤维的小弯曲处引发的静电排斥引起的鞭动(whipping)过程拉长射流,直到射流最终沉积在接地的收集器上。由这种弯曲不稳定性引起的纤维伸长和变细导致形成具有纳米级直径的均匀纤维。
51.可以应用于静电纺丝工艺的生物相容性聚合物包括但不限于聚(dte碳酸酯)、聚己内酯(pcl)、聚乳酸(pla)、聚氨酯、聚碳酸酯、聚
‑
l
‑
乳酸(plla)、聚(dl
‑
丙交酯
‑
共
‑
己内酯)、聚(乙烯
‑
共
‑
乙酸乙烯酯)乙酸乙烯酯、聚(甲基丙烯酸甲酯)、聚(碳酸亚丙酯)、聚(偏二氟乙烯)、聚丙烯腈、聚己内酯、聚羧甲基硅烷、聚乳酸、聚苯乙烯、聚乙烯吡咯烷酮、聚乙烯醇(pva)、聚环氧乙烷(peo)、聚氯乙烯(pvc)、透明质酸(ha)、壳聚糖、藻酸盐、聚羟基丁酸酯及其共聚物、尼龙11、醋酸纤维素、羟基磷灰石或其任意组合。可生物降解和生物相容性的聚合物包括但不限于聚(3
‑
羟基丁酸
‑
共
‑3‑
羟基戊酸)、聚(dl
‑
丙交酯)、聚氨酯、聚己内酯和聚(l
‑
丙交酯)或其任意组合。
52.电纺纤维通常比使用常规纺丝技术生产的纤维小几个数量级。通过优化参数,例如:i)溶液的固有性质,包括溶剂的极性和表面张力、聚合物链的分子量和构象以及溶液的粘度、弹性和电导率;和ii)操作条件,如电场强度、喷丝头与收集器之间的距离以及溶液的进料速率,静电纺丝能够产生直径薄至几十纳米的纤维。影响电纺纤维性能的其他参数包括聚合物的分子量、分子量分布和结构(支链、线性等)、溶液性质(粘度、电导率和表面张力)、电势、流速和浓度、毛细管和收集屏之间的距离、环境参数(腔室内的温度、湿度和空气速度)、目标屏(收集器)的运动等。高度多孔纤维的制造可以通过将射流直接静电纺丝到低温液体中来实现。由于温度引起的聚合物和溶剂之间的相分离以及在冷冻干燥条件下溶剂的蒸发,在每根纤维的表面上形成了明确的孔隙。
53.已经开发了几种方法来将电纺纤维组织成对齐的阵列。例如,电纺纤维可以通过用一对由空隙隔开的导电基板代替单片收集器来对齐成单轴阵列。在这种情况下,纳米纤维倾向于被拉伸穿过垂直于电极边缘定向的间隙。研究还表明,成对的电极可以在绝缘基底(如石英或聚苯乙烯)上形成图案,因此单轴对齐的纤维可以逐层堆叠成3d晶格。通过控制电极图案和/或施加高电压的顺序,还可以产生由对齐良好的纳米纤维组成的更复杂的结构。
54.电纺纳米纤维也可以直接沉积在各种物体上,以获得具有明确和可控形状的基于纳米纤维的结构体。此外,人们可以在静电纺丝后将对齐的或随机取向的纳米纤维膜手动加工成各种类型的结构:例如,通过卷起纤维膜来制造管,或者通过冲压纤维膜来制备具有
可控直径的盘状物。
55.本发明涉及本领域已知的任何静电纺丝技术,包括《静电纺丝(electrospinning)》,j.stanger、n.tucker、和m.staiger,i
‑
smithers rapra publishing(英国),《静电纺丝和纳米纤维导论(an introduction to electrospinning and nanofibers)》,s.ramakrishna、k.fujihara、w
‑
e teo,world scientific publishing co.pte ltd.(2005年6月),《微纤维和纳米纤维的静电纺丝:分离和过滤工艺中的基本原理和应用(electrospinning of micro
‑
and nanofibers:fundamentals and applications in separation and filtration processes)》,y.fillatov、a.budyka和v.kirichenko(译者:d.letterman),begell house inc.,纽约,美国,2007年,所有这些都通过引用以其整体并入本文。
56.合适的静电纺丝技术被公开在例如以下国际专利申请中:公开号为wo 2002/049535、wo 2002/049536、wo 2002/049536、wo 2002/049678、wo 2002/074189、wo 2002/074190、wo 2002/074191、wo 2005/032400和wo 2005/065578,这些专利申请的内容通过引用特此并入。应当理解,尽管根据本发明的当前优选实施例的描述特别强调静电纺丝技术,但这并不旨在将本发明的范围限制于静电纺丝技术。适用于本实施例的其他纺丝技术的代表性示例包括但不限于湿法纺丝技术、干法纺丝技术、凝胶纺丝技术、分散纺丝技术、反应纺丝技术或粘性纺丝技术。这些和其他纺丝技术在本领域中是已知的,并且被公开在例如美国专利号为:us3,737,508、us3,950,478、us3,996,321、us4,189,336、us4,402,900、us4,421,707、us4,431,602、us4,557,732、us4,643,657、us4,804,511、us5,002,474、us5,122,329、us5,387,387、us5,667,743、us6,248,273和us6,252,031中公开,这些专利的内容通过引用特此并入。
57.在一些实施例中,本发明的角膜假体进一步包含至少一种药物活性剂。
58.在其他实施例中,所述至少一种药物活性剂被掺入以下的至少一种中:周边裙部、前边缘、后边缘及其任何组合。
59.在一些实施例中,所述至少一种药物活性剂选自抗生素、蛋白质、i型胶原、纤连蛋白或tgf
‑
βg、肝素、生长因子、抗体、抗代谢物、化疗剂及其任意组合。
60.在一些实施例中,所述光学芯和周边裙部彼此机械附接(使用例如用于将芯附接到裙部的机械装置,例如,诸如连接它们的层带或缝合线)。在其他实施例中,所述光学芯和周边裙部彼此化学附接(使用例如任何胶合或连接部件,使用热量或压力等将它们熔合在一起)。
61.本发明还提供了一种套件,包括:角膜假体,其包括:(a)中心光学芯,所述中心光学芯包括具有前表面和后表面的中心光学晶状体;和(b)围绕所述中心光学芯的周边裙部,所述周边裙部包含至少一种生物相容性聚合物,并且具有能够放置在眼睛的结膜下和巩膜上的宽度;其中所述中心光学芯包括从前表面径向延伸的前边缘和从后表面径向延伸并位于后表面下方的后边缘;其中所述前边缘包括至少两个缝合孔和至少两个进入口;并且其中所述后边缘包括至少两个延伸凸缘;以及标记工具,该标记工具包括呈所述中心光学芯的形状的聚合物表面,所述标记工具具有突出于聚合物表面下方的凸起(bump),该凸起位于所述至少两个缝合孔、中心光学芯的至少两个进入口和环钻边缘的位置处。在一些实施例中,本发明的所述套件还包括沉积在如上所述的在聚合物表面下方突出的凸起上的眼科
墨水。在其他实施例中,本发明的所述套件还包括具有长形杆部分的卡扣工具(snapping tool),其中卡扣工具的端部部分是成角度的。所述卡扣工具允许执行外科手术程序的外科医生将本发明的角膜假体定位并装配到受试者的环钻角膜中。在一些实施例中,本发明的套件还包括用于在将角膜假体植入受试者的外科手术程序中使用的使用说明。
62.在移除角膜患病部分的环钻之后,由于光学芯是透明的,因此本发明套件中使用的标记工具使得执行外科手术程序的外科医生能够准确地知道缝合孔在眼表面上的位置,从而将缝合线非常容易地插入到本发明植入的角膜假体的缝合孔所在的确切位置。此外,进入口的标记使得执行外科手术程序的外科医生清楚地知道和看到在将要植入的本发明的角膜假体下面可以进入眼睛的前眼房的位置,而不会对眼睛或组件造成任何损伤破裂。环钻边缘的标记允许外科医生将环钻工具精确地放置在本发明的角膜假体的光学中心芯的位置和尺寸上,使得本发明的组件精确配合。
63.本发明还提供了一种用于将角膜假体植入有需求的受试者中的外科手术程序,包括以下步骤:(1)提供本文公开的套件;(2)在所述受试者的眼睛中执行360度环切;(3)执行上皮清创;(3)用手术标记物标记角膜的中心;(4)使用套件的标记工具,以角膜的中心的标记作为参考来标记受试者的眼睛上的缝合孔和进入口;(5)在所标记的缝合孔中预先放置角膜锚定缝合线;(6)前眼房(在前眼中)内注射麻醉剂和/或肾上腺素和/或黏弹性眼科植入装置(ophthalmic viscosurgical device,ovd)(其一旦打开就固定眼睛的形态,从而在整个手术程序中形成安全、封闭的腔室);(7)环钻并去除中心病变角膜;(8)通过将眼睛中制造的缝合线与本发明的角膜假体中的缝合孔系在一起来接近本发明的角膜假体(这允许将角膜假体装配到眼表上);(9)采用平衡盐溶液(bss)的ovd交换(从而用生理液体填充前眼);(10)用缝合线(可降解的)和可选的用纤维蛋白放置在结膜下,将结膜封闭地系在角膜假体裙部和边缘上。该步骤在手术程序完成时封闭眼睛和眼表。
64.附图简述
65.关于本发明的主题在说明书的结束部分被特别指出并被清楚地要求保护。然而,在与附图一起阅读时,通过参考以下详细描述可以最好的理解本发明关于操作的组织和方法两者以及其目的、特征和优点,在附图中:
66.图1由仰视图(该装置的开放后部部分)示出了本发明的角膜假体的中心光学芯。
67.图2由仰视图(该装置的开放后部部分)示出了本发明的角膜假体的中心光学芯。
68.图3由顶视图(该装置的前部部分)示出了本发明的角膜假体的中心光学芯。
69.图4示出了本发明的角膜假体。
70.图5a
‑
图5b示出了本发明的角膜假体的中心光学芯的横截面(图5a)及其细节(图5b)。
71.图6示出了在植入后的26周中,在nzw兔中的植入的本发明的角膜假体的临床评估结果。
72.图7a
‑
图7d示出了植入有本发明的角膜假体的nsw兔组织变化过程和组织学。植入的眼睛嵌在spurr块中。每个块通过眼的中心被矢状地一分为二,并用苏木精和伊红(h&e)和马森三色(mt)染色。
73.图8a
‑
图8j示出了使用本发明的角膜假体和套件进行的本发明的角膜植入手术程序。
74.将理解的是,为了说明的简单和清楚,图中所示的元件不一定按比例绘制。例如,为了清楚起见,一些元件的尺寸可能相对于其他元件被放大。此外,在认为适当的情况下,参考数字可以在多个图中重复以指示对应的或类似的元件。
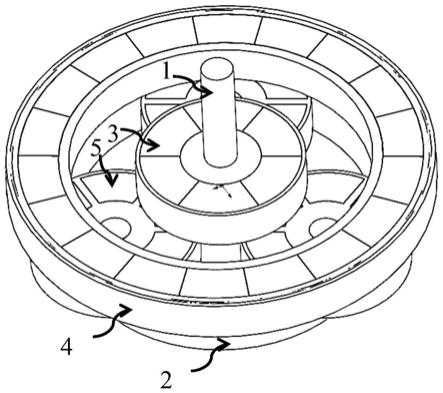
75.本发明的详细描述
76.在以下详细描述中,阐述了许多具体细节以便提供对本发明的透彻理解。然而,本领域技术人员将理解,可以在没有这些具体细节的情况下实践本发明。在其他情况下,没有详细描述公知的方法、手术程序和部件,以免模糊本发明。
77.图1示出了本发明的角膜假体(100)的光学中心芯的仰视图(从本发明的装置的后部开口部分看的视图),示出了光学晶状体(101),从所述光学晶状体(从其前表面)环绕延伸的前边缘(102)。前边缘示出了缝合孔(103)和进入口(104)。此外,后边缘示出为(105),在光学晶状体下方并围绕光学晶状体(从其后表面)延伸,并且凸缘(106)从所述后边缘延伸。该图还示出了进入口的标记(107)。
78.图2示出了本发明的角膜假体(200)的光学中心芯的底侧视图(从本发明的装置的后部开口部分看的视图),示出了光学晶状体(201),从所述光学晶状体(从其前表面)环绕延伸的前边缘(202)。前边缘示出了缝合孔(203)和进入口(204)。此外,后边缘示出为(205),在光学晶状体下方并围绕光学晶状体(从其后表面)延伸,并且凸缘(206)从所述后边缘延伸。该图还示出了进入口的标记(207)。
79.图3示出了本发明的角膜假体(300)的光学中心芯的俯视图(从本发明的装置的前侧看的视图),示出了光学晶状体(301),从所述光学晶状体(从其前表面)环绕延伸的前边缘(302)。前边缘示出了缝合孔(303)和进入口(304)。此外,后边缘示出为(305),在光学晶状体下方并围绕光学晶状体(从其后表面)延伸,并且凸缘(306)从所述后边缘延伸。该图还示出了进入口的标记(307)。
80.图4示出了本发明的角膜假体(400),示出了围绕所述中心光学芯的周边裙部(401)(被放置在前边缘的远侧区域)。该图还示出了光学晶状体(402),后边缘(403)从该光学晶状体围绕其后表面并在其后表面下方延伸。所述后边缘示出了凸缘(405)。该图还示出了前边缘的环绕光学晶状体并从光学晶状体延伸的近侧区域(406)和远侧区域(404)。
81.图5a示出了本发明的角膜假体(500)的中心光学芯的横截面,示出了光学晶状体的前表面(501)和光学晶状体的后表面(502)。该图以横截面的形式示出了从光学晶状体的前表面延伸的前边缘(503)的宽度,在光学晶状体的后表面下方延伸的后边缘(504)的宽度和凸缘(505)。在前边缘和后边缘之间形成的空间能够容纳环钻角膜的边缘,从而在受试者的眼睛上将装置牢固地保持就位,缝合增强了装置在眼睛中的稳定性。
82.图5b示出了图5a的本发明的角膜假体的中心光学芯的横截面的细节,示出了后边缘宽度(506)和凸缘(507)。
83.示例1:本发明的角膜假体在nzw兔体内进行活检(vivo examination)
84.将本发明的角膜假体单侧地植入8只兔体内,并随访6个月。完成后,记录了无炎症排斥反应的逐渐融合。
85.方法:八只雄性nzw兔接受了本发明的角膜假体的单侧眼内植入,而对侧眼作为未治疗的对照,所有这些都在良好的实验室规范指导下进行。对8只动物进行为期6个月的临床观察以评估安全性,在此期间,通过裂隙灯活组织镜检视法(slit
‑
lamp bio
‑
microscopy)反复监测该眼睛。终止时,眼睛将被摘除并进行组织学评估。
86.结果:临床证据显示逐渐融合和炎症反应的停止。眼睛全都完好无损,完整性没有被明显破坏或没有眼房水渗漏。动物表现出常规地使用植入的眼睛。一些动物表现出医源性(手术诱发的)白内障。图6显示了在植入后26周中,在nzw兔中的植入的本发明的角膜假体在结膜炎症反应、前眼房(ac)反应、结膜和虹膜充血方面的临床评估结果。组织学数据和载玻片证明该装置与眼壁无缝且持久的组织融合(图7a
‑
图7d)。,低度和逐渐减少的炎症反应的临床和组织病理学发现加上周边裙部的逐渐融合证明了短期和中期的安全性。
87.图8a
‑
图8j示出了使用本发明的套件和角膜假体的外科手术程序。在图8a中,进行了360度的环切,抬起结膜和眼球筋膜两者;图8b示出了去除上皮细胞层。图8c示出了使用专用标记工具标记天然角膜中心和缝合孔。图8d示出了通向前眼房的用于输注的两个端口的产生及工具,之后眼睛被填充粘弹性材料;图8e示出了锚定缝合线
‑
三条角膜缘缝合线被预先放置,用于以120度间隔进行光学锚定,如标记所标示;图8f示出了实施中心角膜环钻;图8g示出了收紧锚定缝合线,从而移动角膜假体,使其接近天然角膜残余物,便于其插入;图8h显示了如何使用卡扣工具将光学区插入环钻空间;图8i示出了将生物融合周边裙部放置在裸露的巩膜上,并将结膜和眼球筋膜放回并将其缝合就位;图8j示出在植入的眼睛中,粘弹性物质被bss(平衡盐溶液)替代。
88.虽然本文已经图示和描述了本发明的某些特征,但是本领域普通技术人员现在将想到许多修改、替换、改变和等同物。因此,应当理解,所附权利要求旨在覆盖落入本发明的真实精神内的所有这样的修改和改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。