ardisiacrispin b在制备预防或治疗炎症性肠病的药物中的应用
技术领域
[0001] 本发明涉及中药技术领域,具体涉及ardisiacrispin b在制备预防或治疗炎症性肠病的药物中的应用。
背景技术:
[0002]
炎症性肠病(ibd)由溃疡性结肠炎(uc)和克罗恩病(cd)组成,是一种慢性胃肠道炎症,该类患者胃肠道结构、功能被长期损害,并且会增加患结肠癌的风险,典型的临床症状包括患者体重减轻、腹泻、便血等。目前,ibd已经成为全球性的消化系统疾病,在美洲、欧洲、亚洲等地的发病率越来越高。ibd的发病机制并不明确,通常被认为是由于遗传与环境因素相互作用、肠道屏障被破坏、免疫功能失调、炎性细胞浸润等等而导致的疾病。常用于治疗ibd患者的药物有氨基水杨酸类、糖皮质激素类、生物疗法、免疫抑制剂类等,这些药物在治疗ibd患者有着很好的疗效,但关于它们的不良作用也有所报道。因此,研究一种疗效确切且副作用小的药物具有巨大的发展前景。
[0003]
ardisiacrispin b(百两金素b)是齐墩果烷型五环三萜类皂苷,其结构式如图2所示,化学名称为西克拉敏a3
‑
o
‑
α
‑
鼠李吡喃糖
‑
(1
→
2)
‑
β
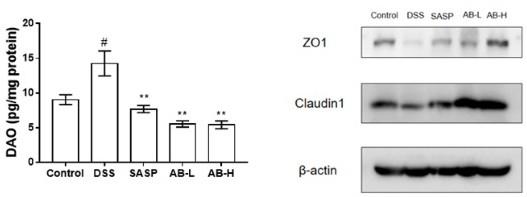
‑
d
‑
葡萄吡喃糖
‑
(1
→
4)
‑
[β
‑
d
‑
葡萄吡喃糖
‑
(1
→
2)
‑
]
‑
α
‑
l
‑
阿拉伯吡喃糖苷。该成分存在于走马胎、朱砂根、百两金等多种植物中,现代研究表明其具有抗炎、抗肿瘤活性。目前针对ardisiacrispin b的研究主要涉及提取纯化工艺及质量检测,尚未见ardisiacrispin b在制备预防或治疗炎症性肠病的药物中的文献报道。
技术实现要素:
[0004]
鉴于此,本发明的目的在于提供ardisiacrispin b在制备预防或治疗炎症性肠病的药物中的应用。
[0005]
本发明所述的炎症性肠病(ibd)包括溃疡性结肠炎和克罗恩病。ibd是一种肠道非特异性溃疡性疾病,其具体的发病机制尚不明确,现代研究认为可能与肠道菌群失调、免疫调节紊乱、环境因素、遗传因素等有关。目前的研究表明肠道屏障通透性增加与炎症反应在发病过程中是基本的原因,肠道屏障被破坏以及被激活的炎症相关细胞因子成为了形成溃疡的关键性因素,因此,可以通过保护肠道屏障和抗炎来抑制结肠炎的发生。
[0006]
本发明通过葡聚糖硫酸钠(dextran sulfate sodium,dss)诱导ibd小鼠模型,根据体重将雄性c57bl/6j小鼠随机分组,分为对照组、模型组(dss)、柳氮磺胺吡啶组(sasp)、ardisiacrispin b低剂量组(ab
‑
l)、ardisiacrispin b高剂量组(ab
‑
h)。对照组小鼠饮用蒸馏水,其余组则自由饮用2%dss,诱导小鼠结肠炎。每天腹腔注射ardisiacrispin b(ab),灌胃sasp,对照组和dss组则腹腔注射等量的磷酸盐缓冲液(pbs),直至实验结束,解剖小鼠,收集结肠用于elisa检测、蛋白质印迹实验和制作病理切片。结果显示:ardisiacrispin b(ab)能够减轻dss诱导后小鼠结肠的病理性改变,并且能够上调zo1、claudin1蛋白,dao、
epo细胞因子表达水平,下调炎症因子如il
‑
6、tnf
‑
α、et
‑
1,并且显著抑制jak2/stat3通路、tlr4/nf
‑
κb/myd88通路蛋白的表达,表明ardisiacrispin b可以通过保护肠道屏障、抑制炎症因子的表达,从而抑制dss诱导的小鼠结肠炎症,为临床治疗ibd提供更有利的药效学依据。
[0007]
本发明还提供了一种预防或治疗治疗炎症性肠病的药物,包含有效含量的ardisiacrispin b和药学上可接受的载体。本发明预防或治疗炎症性肠病的药物可经本领域常规方法制备成适宜的剂型。优选的,所述药物的剂型为片剂、胶囊、粉剂、注射剂或颗粒剂。
[0008]
本发明与现有技术相比,具有如下优异效果:本发明提供了ardisiacrispin b在制备预防或治疗炎症性肠病的药物中的新用途,通过建立葡聚糖硫酸钠(dextran sulfate sodium, dss)诱导的ibd小鼠模型,探讨ardisiacrispin b对ibd小鼠的治疗作用及其机制,结果显示,ardisiacrispin b可以通过保护肠道屏障、抑制炎症因子的表达,从而抑制dss诱导的小鼠结肠炎症,为临床治疗ibd提供了一种疗效确切且副作用小的新的药物。
附图说明
[0009]
图1为动物实验设计流程图;图2为ardisiacrispin b的化学结构图;图3为各组小鼠体重、dai评分和结肠长度数据图;图4为各组小鼠结肠病理切片图;图5为各组小鼠dao和zo1、claudin1的蛋白表达数据图;图6为各组小鼠结肠中il
‑
6、epo、tnf
‑
α、et
‑
1细胞因子表达数据图;图7为各组小鼠结肠中tlr4、nf
‑
κb、myd88、jak2、stat3蛋白的表达图。
具体实施方式
[0010]
下面通过具体实施方式来进一步说明本发明,以下实施例为本发明具体的实施方式,但本发明的实施方式并不受下述实施例的限制。
[0011]
一、材料与方法1.1材料ardisiacrispin b(成都普瑞化学标准有限公司,lot:200116,缩写:ab),葡聚糖硫酸钠(dss,mw:36 ~ 50 kda,lot:s5036),柳氮磺胺吡啶(medchemexpress,sasp,lot:33816),磷酸盐缓冲液(美伦生物,pbs,lot:ma0015
‑
feb
‑
25g2),细胞裂解液(美伦生物,lot:ma0151
‑
jun
‑
18e),天津安诺瑞康:il
‑
6(385210802)、tnf
‑
α(569210802)、epo(266210802)、dao(252210802)、et
‑
1(260210802),affinity:zo1(af5145)、claudin1(af0127)、jak2(af6022)、stat3(af6294)、myd88(af5195)、β
‑
actin(t0022),tlr4 (abclonal,293072),nf
‑
κb ( cell signal technology,8242s)。
[0012]
1.2方法1.2.1动物分组造模雄性c57bl/6j小鼠(28~35天)购自广东省实验动物中心,适应性喂养2周后,根据
小鼠的体重随机分组,每组8只,分别是正常组(蒸馏水组)、dss组、柳氮磺胺吡啶(sasp:dss sasp 200mg/kg)、ardisiacrispin b高剂量组(ab
‑
h:dss ab 0.6mg/kg)、ardisiacrispin b低剂量组(ab
‑
l:dss ab 0.2mg/kg)。用蒸馏水将dss配制成2%的溶液让小鼠自由饮用,正常组则饮用蒸馏水,连续给予7天后撤去dss,换上蒸馏水停止造模,继续给药,两天后处死小鼠取材。sasp采用灌胃(10ml/kg)给药,ab采用腹腔注射(10 ml/kg)给药,其余组则腹腔注射给予等剂量的pbs,每日给药1次,直至实验结束,实验设计流程如图1所示。
[0013]
1.2.2疾病活动指数评分每天对小鼠进行称重、观察小鼠的精神状态、粪便粘稠度和出血情况,进行疾病活动指数评分。疾病活动指数评分是根据小鼠的体重下降百分比(体重不变为0分,下降1%
‑
5%为1分,下降5%
‑
10%为2分,10%
‑
15%为3分,大于15%为4分)、粪便粘稠度(粪便松散较干为1分,松散偏湿为2分,腹泻偏干为3分,腹泻偏湿为4分)、粪便出血情况(粪便隐血较少为1分,隐血较多为2分,出血较少为3分,明显出血为4分)。
[0014]
1.2.3取材与样本处理将小鼠麻醉后摘眼球取血,3000 g/min离心,收集血清,在
‑
80℃保存。处死后立即剖开腹腔,取出结肠与盲肠,拍照、测量长度,取一小段结肠用4%的多聚甲醛固定24小时后,用酒精梯度洗脱,石蜡包埋,连续切片4μm后he染色,光学显微镜下观察结肠组织的病理学变化,其余的分别用磷酸盐缓冲液和细胞裂解液提取组织匀和浆提取结肠蛋白。
[0015]
1.2.4酶联免疫试剂盒检测称取结肠组织,加入10倍量预冷的磷酸盐缓冲液,用冷冻研磨机研磨,5000g/min离心10min取上清得到组织匀浆。提取的结肠组织匀浆,按照说明书,用于il
‑
6、dao、epo、tnf
‑
α、et
‑
1试剂盒的检测。
[0016]
1.2.5蛋白质印迹实验称取结肠组织,加入10倍量的细胞裂解液后用冷冻研磨机研磨,在冰上裂解30min,5000g/min离心10min取上清,得到结肠蛋白原液,并且用蛋白质分析试剂盒测定蛋白浓度。将等量的蛋白浓度(40μg)在8%~10%十二烷基硫酸钠聚丙烯酰胺凝胶上进行分离,然后转移到聚偏二氟乙烯(pvdf)上进行封闭、敷育一抗和二抗,最后用化学发光(ecl)试剂盒检测膜印迹。
[0017]
1.2.6统计分析所有数据均表示为平均值
±
标准误差(mean
±
sem)。采用student’s t检验比较两组间的统计学差异,p<0.05水平上具有统计学意义。
[0018]
2结果2.1ab具有缓解dss诱导的小鼠结肠炎的作用ab可以缓解dss诱导的小鼠体重下降,减轻粪便粘稠和出血程度,减小dai评分。在实验中可以观察到,正常组小鼠粪便无异常,dss组小鼠粪便腹泻及出血程度严重,并且在小鼠肛门处带有血便,ab组小鼠粪便粘稠度及便血情况有明显的改善,肛门较干净。与正常组比较,在给予dss第3d时,dss组小鼠粪便开始变得黏稠松散,在第5d时体重逐渐下降,dai评分逐渐升高(p<0.01),解剖后结肠长度明显缩短(p<0.01)。与dss组比较,sasp和ab组体重降低得到明显缓解,(p<0.01),dai评分显著下降(p<0.01),结肠长度显著延长(p<0.01),并且ab
‑
l和ab
‑
h的体重、dai、和结肠长度均程剂量依赖的量效关系,结果如图3所
示。
[0019]
2.2 ab对dss诱导的小鼠结肠炎组织病理学的作用正常小鼠的结肠结构完整,充满柱状细胞、杯状细胞,形状规则,排列整齐,未见溃疡及炎性细胞浸润。dss组小鼠结肠结构被严重破坏,隐窝结构被破坏,杯状细胞丢失,黏膜及黏膜下炎性细胞浸润。与dss组比较,sasp和ab组具有较好的组织学外观,结构相对完整,并且ab
‑
l和ab
‑
h组以剂量依赖的方式减少炎性浸润,如图4所示。
[0020]
2.3 ab保护dss诱导的小鼠肠道屏障与正常组对比,dss组小鼠二胺氧化酶(dao)水平显著上调(p<0.05),而给药后dao水平显著下调(p<0.01)。结果表明,ab可以显著逆转dss对小鼠dao异常增加的影响。通过蛋白质印迹实验表明,dss诱导后的结肠炎小鼠zo1、claudin1蛋白表达显著下调,ab则可以显著上调。结果表明,dss诱导的结肠炎小鼠肠道屏障被明显破坏,肠道通透性增加,紧密连接蛋白zo1、claudin1的表达明显下调,而经过ab给药后小鼠肠道屏障得到明显保护作用,如图5所示。
[0021]
2.4 ab通过抗炎抑制肠道炎症通过elisa试剂盒检测小鼠结肠il
‑
6、epo、tnf
‑
α、et
‑
1等炎症相关细胞因子表达水平,与正常组对比,dss组il
‑
6(p<0.05)、tnf
‑
α(p<0.05)、et
‑
1(p<0.01)表达水平显著升高,epo水平显著下降(p<0.01)。与dss组比较,给药后il
‑
6(p<0.01)、tnf
‑
α(p<0.01)、et
‑
1(p<0.01)表达水平显著下调,epo表达显著上升(p<0.05)。通过蛋白质印迹实验分析,dss诱导的结肠炎小鼠相关炎症蛋白如tlr4、nf
‑
κb、myd88、jak2、stat3蛋白的表达明显增强,而ab给药后小鼠的炎症相关蛋白表达被明显抑制。结果表明,ab通过下调炎症相关的细胞因子和蛋白表达来抑制炎症,因此具有显著的抗炎作用,如图6、7所示。
[0022]
3结论本发明采用自由饮用dss成功诱导小鼠产生结肠炎模型,临床症状和病理变化与人类结肠炎相似,饮用了dss的小鼠出现了不同程度的体重下降、腹泻、粪便出血、结肠长度缩短等症状,经ab给药后的小鼠在dai、结肠长度等方面有很大的改善作用,因此,ab对于结肠炎小鼠具有一定的保护作用。肠道上皮肠道屏障被破坏,通透性增加是ibd的发病机制之一。肠道屏障包括机械屏障、化学屏障、微生物屏障、免疫屏障等,在肠道中共同发挥着作用。dss诱导后,小鼠相关紧密连接蛋白如闭合蛋白claudin 1、带状闭合蛋白zo 1等被破坏,肠黏膜上皮绒毛标志酶二胺氧化酶dao异常增加,肠道通透性增加,屏障功能受损,而给药后小鼠紧密连接蛋白得到保护,表达相对应上调,dao表达水平正常。il
‑
6是由巨噬细胞、淋巴细胞、内皮细胞、肥大细胞等细胞分泌的重要促炎细胞因子,是ibd的中心细胞因子,介导机体炎症反应,il
‑
6与tnf
‑
α是ibd发病过程中重要的抗凋亡因子之一。tnf
‑
α能诱导趋化因子,使中性粒细胞聚集,激活上皮细胞,增强炎症反应,肠道损伤越严重则其表达量越高。epo是促红细胞生成素,能够显著下调炎症因子如il
‑
6、il
‑
1β等的表达,从而减轻炎症反应。dss诱导的小鼠结肠il
‑
6、tnf
‑
α、et
‑
1表达增加,epo表达下调,同时jak2/stat3蛋白的表达被激活,而给ab给药后则下调il
‑
6、tnf
‑
α、et
‑
1的表达水平,达到抗炎的效果。此外,研究表明,toll样受体的功能在ibd的发展过程中起到重要作用,tlr4信号通路参与ibd的发病与治疗过程。脂多糖lps具有促进炎症反应和释放炎症因子的作用,在ibd的发病过程中,当toll样受体如tlr4识别并结合lps后,即激活下游信号转导分子nf
‑
κb、myd88,诱导炎症
因子的合成与释放,导致机体形成炎症反应。ab能够显著下调tlr4/nf
‑
κb/myd88通路的蛋白表达水平,在炎症性肠病中,有效的阻止tlr4/nf
‑
κb/myd88蛋白的激活及炎症因子的释放,从而抑制炎症反应,达到抗炎和保护肠道的作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。