1.本发明涉及一种包覆细胞的磁性微凝胶及其制备方法与应用,属于生物医药材料领域。
背景技术:
2.目前细胞在注射过程中会由于剪切力会造成的细胞膜损伤,或者由于体内复杂流体流动不断受到高剪切应力引起的细胞坏死,抑或由于宿主免疫细胞导致的细胞溶解并凋亡,目前常采用微米级海藻酸盐颗粒在细胞表面通过化学反应生成微凝胶的方式对活细胞进行包封,从而形成保护膜来保护细胞。理想微凝胶颗粒应该由均匀的网络结构组成,使被封装的细胞能够在一个可控的微环境中被稳定地包裹。由于微凝胶的单分散性、大小、形貌及微结构对细胞的性质和功能有重要影响,因此,利用液滴微流体技术强大的微液滴生产及操控能力,可以对海藻酸盐微凝胶的大小、形状和形态进行精确控制。目前已知对细胞进行海藻酸盐微凝胶包覆的技术包括如下四种方法:
3.方法一、海藻酸钠溶液被油相乳化成小海藻酸钠水滴,并与氯化钙中的ca
2
离子交联形成海藻酸盐微凝胶;
4.方法二、采用水不溶性碳酸钙纳米颗粒分散在海藻钠溶液中,碳酸钙纳米颗粒及海藻酸钠的混合溶液被切割形成微液滴,在酸性条件下溶解碳酸钙产生ca
2
离子,再与海藻酸钠溶液交联形成海藻酸盐微凝胶;
5.方法三、通过油相输送氯酸钙或醋酸颗粒,与海藻酸钠溶液均匀混合后发生交联形成海藻酸盐微凝胶;
6.方法四、以水溶性乙二胺四乙酸二钠钙(简称edta
‑
二钠钙,又为ca
‑
edta)的形式输送钙离子,乳化海藻酸盐和复合物混合均匀后,被氟化碳油(溶有乙酸)切割形成液滴后在酸性条件ca
‑
edta解离释放ca
2
离子,与海藻酸钠溶液交联形成海藻酸盐微凝胶。
7.但是这些海藻酸盐微凝胶包覆的技术存在以下缺点:
8.1、方法一中存在离子交联过程中钙离子会立即接触海藻酸链,导致交联反应发生在钙离子均匀分布之前,导致微凝胶的厚度不均匀;同时钙离子与海藻酸链快速反应通常会导致微流控装置内不受控制的凝胶化,堵塞微流控管道;
9.2、方法二中由于碳酸钙纳米颗粒的水不溶性,在酸溶解碳酸钙后导致钙离子在液滴内的不均匀分布,导致液滴内产生均匀性的凝胶过程;同时颗粒聚集时微流体堵塞微流控的通道,限制了微凝胶可获得的尺寸范围;
10.3、方法三中由于油相输送氯酸钙或醋酸颗粒,交联发生在钙离子均匀分布之前,降低了产生的微凝胶的均匀性;
11.4、方法四虽然解决了钙离子均匀分布的问题,但是在生物体内的ca
‑
藻酸盐微凝胶主要通过涉及扩散和迁移的机制递送治疗性细胞,导致大多数静脉内递送的细胞被困在肺和网状内皮系统中,多达60%的细胞甚至无法到达靶位;ca
‑
藻酸盐微凝胶的细胞封装率低,通常为20%~30%,导致大量无细胞的微凝胶的产生,严重影响治疗效果;最后上述方
法都缺乏一种有效的体内成像技术来对细胞进行实时跟踪,导致无法实现治疗效果的无创监测及长期评估。
技术实现要素:
12.本发明的目的是提供一种包覆细胞的磁性微凝胶及其制备方法与应用。
13.本发明制备方法可控,制得的产品具有超顺磁性,具有t1/t2双模态mri医疗成像能力,成像更为清晰。
14.本发明提供的一种包覆细胞的磁性微凝胶的制备方法,包括如下步骤:1)将细胞与氧化铁纳米颗粒子在细胞培养液中进行共培养,得到表面粘附磁性纳米颗粒的细胞;
15.2)将所述表面粘附磁性纳米颗粒的细胞与藻酸盐水溶液混合,形成分散相;通过pdms微流控设备,用连续相对所述分散相进行切割,形成微液滴;在所述pdms微流控设备中,所述微液滴中释放fe
3
和藻酸盐水溶液进行交联反应,即得到包覆细胞的磁性微凝胶。
16.本发明中,所述细胞为本领域中所有常规的治疗性细胞。
17.上述的制备方法中,所述氧化铁纳米颗粒选自fept@fe3o4核/壳磁性纳米粒子。
18.本发明中,所述fept@fe3o4核/壳磁性纳米粒子的具体制备方法,包括如下步骤:
19.将乙酰丙酮铂、1,2
‑
十六烷二醇和1
‑
十八烯混合,并在惰性气氛保护中,加入油酸、油胺和乙酰丙酮铁,得到混合物1;将所制备的混合物加热至回流,待混合物冷却至室温(25℃)后,离心取沉淀,得到产物,将产物分散到环己烷中;3,4
‑
二羟基肉桂酸(dhca,ph为3~12)和四氢呋喃(thf)混合,加热到50℃,得到混合物2;然后将bmnp(磁性纳米粒子)/thf溶液滴加到所述混合物2中反应,冷却至室温;加入naoh溶液离心,取黑色沉淀即为所述fept@fe3o4核/壳磁性纳米粒子,黑色沉淀溶于去离子水中,置于4℃冰箱中备用。
20.上述的制备方法中,所述共培养的温度可为4℃,时间可为1~6小时。
21.本发明中,步骤1)中,所述氧化铁纳米粒子的使用量为本领域常规的用量,即在毒性范围内即可;具体实施例中所述氧化铁纳米粒子的浓度具体可为20~40μg/ml,浓度为250μg/ml产生毒性。
22.上述的制备方法中,所述分散相的进料速度可为50~60μl/min,具体可为50μl/min或50~55μl/min。
23.上述的制备方法中,所述分散相中所述氧化铁纳米颗粒子浓度可为10~20μg/ml。
24.上述的制备方法中,所述fe
3
与所述藻酸盐的质量比可为1/250~1/1000;
25.所述藻酸盐选自海藻酸、海藻酸钾和海藻酸钠中的至少一种。
26.上述的制备方法中,所述连续相和所述分散相的进料流速比可为1/3~1/4。
27.上述的制备方法中,所述连续相由氟化硅油中加入表面活性剂和乙酸形成;其中,所述乙酸占所述连续相总量的体积百分比可为0.05~5%,具体可为1%、0.05~1%、1~5%或0.5~2.5%,所述表面活性剂占所述连续相总量的质量百分比可为0.5%~1.5%,具体可为1%、1%~1.5%、0.5%~1%或0.75%~1.25%,余量为氟化硅油;
28.所述表面活性剂选自peg、span80、span60、span20、span40、tween85和pva中的至少一种。
29.本发明中,所述peg为本领域常用的分子量为200~20000,具体可为peg
‑
200、peg
‑
400、peg
‑
600、peg
‑
800、peg
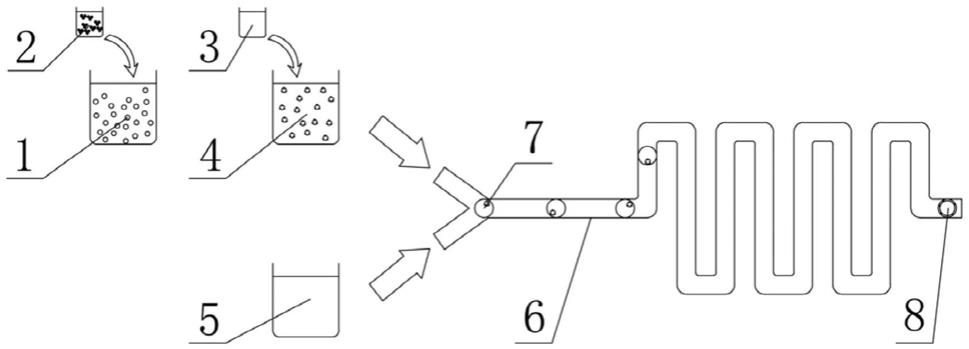
‑
1000、peg
‑
1500、peg
‑
2000、peg
‑
4000、peg
‑
6000、peg
‑
8000、
peg
‑
10000或peg
‑
20000。
30.上述的制备方法中,所述pdms微流控设备由y型管道和蛇形管道通过渐缩管道连接组成;
31.所述渐缩管道的入口端至出口端的管径逐渐减小,且所述渐缩管道的入口端与所述y型管道末端管径相等,所述渐缩管道的入口端管径至出口端的管径缩小比为3/4~3/5。
32.上述的制备方法中,所述蛇形管道采用多段u型管道组成;
33.所述u型管道数量具体为3~4段;
34.所述渐缩管道中部装有二次环形磁场发生器,所述二次环形磁场发生器的磁场旋转方向与所述渐缩管道旋转方向相同。
35.本发明还提供了上述的制备方法制备得到的所述包覆细胞的磁性微凝胶。
36.本发明所述包覆细胞的磁性微凝胶应用于制备具有如下1)
‑
3)任一功能的细胞治疗与诊断的细胞预处理产品中;
37.1)双模态医学成像(即mri的t1和/或t2成像);
38.2)治疗性细胞可控释放;
39.3)在外磁场下,含有细胞的微凝胶进行磁导航。
40.本发明进一步提供了一种上述的pdms微流控设备。
41.所述pdms微流控设备由y型管道和蛇形管道通过渐缩管道连接组成;
42.所述渐缩管道的入口端至出口端的管径逐渐减小,且所述渐缩管道的入口端与所述y型管道末端管径相等,所述渐缩管道的入口端管径至出口端的管径缩小比为3/4~3/5。
43.进一步的,所述蛇形管道采用多段u型管道组成;
44.所述u型管道数量具体为3~4段;
45.所述渐缩管道中部装有二次环形磁场发生器,所述二次环形磁场发生器的磁场旋转方向与所述渐缩管道旋转方向相同。
46.本发明具有以下优点:
47.(1)所用fept@fe3o4核/壳磁性纳米粒子采用peg表面修饰,具有亲水性,与细胞具有较好的生物相容性,同时能均匀分布藻酸盐的水溶液中,有利于形成藻酸盐和核/壳磁性纳米粒子均匀的混合物,防止出现意外的凝胶;
48.(2)采用fept@fe3o4核/壳磁性纳米粒子有利于增加微凝胶携带细胞的概率,从原先钙离子的10%~20%提高到80~90%;
49.(3)当乙酸释放h
使ph值为酸性时,fept@fe3o4核/壳磁性纳米粒子分解使fe
3
均匀析出,由于fe
3
产生于细胞表面,有利于从内而外实现对藻酸盐交联过程的控制;
50.(4)采用蛇形结构的设计采用多段u型管形成的微流控管道,使生产的fe
‑
藻酸盐微凝胶表现出完美的球形形态,平均直径为61μm,使微凝胶易于与宿主组织融合,并促进细胞从微凝胶向组织的转移。
51.(5)fe
3
的配位体个数为6个,相比ca
2
的配位体个数为2个,因此凝胶化效率更为显著;
52.(6)水凝胶层的厚度可通过改变海藻酸钠/与fe
3
的比例来轻松调节,控制凝胶化的厚度可以有效提高微凝胶的抗剪切效果;
53.(7)细胞和微凝胶上残余的fept@fe3o4核/壳磁性纳米粒子具有超顺磁性,保证了
微凝胶群在系统的血管和/或组织间隙中航行时无团聚的性能,同时微凝胶群可以通过外部磁场进行磁驱动来引导细胞的传输;
54.(8)fe
‑
藻酸盐微凝胶存在的超顺磁性bmnp(具有高饱和磁化强度)和fe
3
离子顺磁性已被工程化到应用中,具有t1/t2双模态mri医疗成像能力,成像更为清晰。
附图说明
55.图1为本发明操作流程及装置结构示意图。
56.图2为本发明的pdms微流控设备结构示意图。
57.图3为本发明中藻酸盐的凝胶反应示意图。
58.1细胞培养液,2 fept@fe3o4核/壳磁性纳米粒子,3藻酸盐,4分散相,5连续相,6pdms微流体装置,601y形管道,602蛇形管道,603渐缩管道,7微液滴,701藻酸盐液态膜,702乙酸电离产生的h
,703 fe
3
,704 fe
‑
藻酸盐交联的微凝胶,8包覆细胞的磁性微凝胶。
59.图4为细胞覆盖率图;其中图4(a)为caco3纳米粒子包覆;图4(b)为fe3o4纳米粒子包覆。
60.图5为本发明实施例1中的t1/t2成像图;其中图5(a)为t1成像图;图5(b)为t2成像图。
具体实施方式
61.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
62.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
63.下述实施例中,藻酸盐均采用海藻酸酸钠。
64.下述实施例中,fept@fe3o4核/壳磁性纳米粒子的制备方法具体包括如下步骤:1、将乙酰丙酮铂(0.5mmol,阿拉丁),1,2
‑
十六烷二醇(1.5mmol)和20ml 1
‑
十八烯混合在一个三颈烧瓶中,并在氮气流下磁搅拌(1600rpm),得到混合物1;将混合物1加热至80℃,80℃加热30min;然后在氮气保护下向烧瓶中加入油酸(0.5mmol)、油胺(0.5mmol)和乙酰丙酮铁(3mmol,阿拉丁);将所制备的混合物加热至300℃,再回流30min,待混合物冷却至室温(25℃)后,用乙醇洗涤3次,离心(6000rpm)10min,取离心后的沉淀,得到产物,最后将产物再分散到环己烷中备用;
65.2、疏水bmnps的水相转移:将50mg 3,4
‑
二羟基肉桂酸(dhca,sigma
‑
aldrich)和6ml四氢呋喃(thf)磁力搅拌(1600rpm),加热到50℃,得到混合物2;然后将磁性fe3o4纳米粒子(20mg)/thf(1ml)溶液滴加到混合物2中,滴料后反应3h,冷却至室温,加入500μl离心管中,并加入0.5mol naoh溶液,3000rpm离心10min,取黑色沉淀即为fept@fe3o4核/壳磁性纳米粒子,黑色沉淀溶于去离子水中,置于4℃冰箱中备用。
66.如图1所示,包覆细胞的磁性微凝胶及其制备方法与应用装置示意图。
67.包括细胞培养液1,fept@fe3o4核/壳磁性纳米粒子2,藻酸盐3,分散相4,连续相5和pdms微流体装置6。
68.进一步的,所述连续相由氟化硅油中加入表面活性剂和容易溶解在极性和非极性溶剂中的乙酸形成,对于使fept@fe3o4核/壳磁性纳米粒子的fe3o4壳发生部分解离并释放出精确的fe
3
铁离子以用于微米级液滴的凝胶化是必不可少的。
69.进一步的,fept@fe3o4核/壳磁性纳米粒子的浓度优选为20~80μgml
‑1,选用浓度为20μgml
‑1。
70.进一步的,fe
3
与藻酸盐的质量比例优选为1/250~1/1000,选取质量比例1/250,能有效控制微凝胶的厚度,有利于形成完美球形的包覆细胞的磁性微凝胶。
71.进一步的,分散相的进料速度为50~60μl/min;选取进料速度为50μl/min。
72.进一步的,连续相由氟化硅油中加入表面活性剂和乙酸形成;其中,所述乙酸占总量的体积百分比为0.05~5%,所述表面活性剂占总量的质量百分比为0.5%~1.5%,更进一步可为1%;
73.表面活性剂选自peg、span80、span60、span20、span40、tween85和pva中的至少一种。
74.进一步的,连续相和分散相的进料流速比例优选为1/3~1/4,选取进料流速比例优选为1/3,有利于形成均匀的藻酸盐液滴。
75.如图2所示,pdms微流控设备结构示意图。
76.所述pdms微流控设备6由y型管道601、蛇形管道602和渐缩管道603组成。
77.进一步的,渐缩管道603的管径逐渐减小,且渐缩管道603的入口端与y型管道601末端管径相等,渐缩管道603的入口端管径至出口端的管径缩小比为选为3/4~3/5,选取管径缩小比例3/4,有利于防止液滴体积减小阻塞pdms微流体装置6通道。
78.以亚微米级磁性微凝胶为例,本发明的工作过程如下:
79.将fept@fe3o4核/壳磁性纳米粒子加入细胞培养液中预涂细胞,用藻酸盐水溶液充分分散fept@fe3o4核/壳磁性纳米粒子吸附的细胞,充分搅拌混合形成分散相,细胞上覆盖藻酸盐液态膜。
80.鼠骨髓基质细胞(msc)在dulbecco’s modified eagle medium培养基(dmem,gibco life technologies,grand island,ny,usa)中生长,并辅以10%(v/v)胎牛血清(fbs,safc biosciences,lenexa,ks)和1%(v/v)青霉素/链霉素。细胞在无菌条件下每2天分裂一次,并在37℃和5%co2下孵育。
81.通过注射泵调节连续相和分散相的流速,通过连续相切割分散相在y型管道601内生成尺寸均匀的微液滴,所述微液滴中包含表面粘附fept@fe3o4核/壳磁性纳米粒子的细胞、藻酸盐以及细胞的水溶液。
82.在蛇形管道602和渐缩管道603中,乙酸电离产生的h
702扩散到藻酸盐包被的细胞中,与fept@fe3o4核/壳磁性纳米粒子2的fe3o4壳反应,释放的fe
3
703与藻酸盐液态膜701发生交联生成fe
‑
藻酸盐交联的微凝胶704,经过蛇形管道602和渐缩管道603后形成包覆细胞的磁性微凝胶8。
83.凝胶化后,在全氟碳油中加入体积百分比为20%的pfo(中文名称为聚(9,9
‑
二辛基芴
‑
2,7
‑
二基)),将微凝胶转移到水介质中,然后离心(1000rpm,1分钟)。由此产生的油相被丢弃,由此产生的铁微凝胶重新悬浮在细胞培养基中。
84.制备完成后,从尾动脉注射包覆细胞的磁性微凝胶。通过使用体外磁场,远程控制包覆细胞的磁性微凝胶,使其在复杂的生物流体中以高精确度导航至目标区域,实现最小的微创方式来递送细胞。
85.为了通过反馈控制在复杂的生物环境中完成导航,需要在体内跟踪和实时监测微
凝胶的运动,对此无创模态成像是一种有效的手段。由于fept@fe3o4核/壳磁性纳米粒子具有超顺磁性和高饱和磁化强度,同时fe
3
具有顺磁性,这将使包覆细胞的磁性微凝胶具有双重t1/t2 mri成像的能力,最终获得更强且更清晰的mri图像。
86.实施例1
87.实验条件:
88.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/250;
89.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/3;连续相为氟化硅油中加入乙酸和peg800形成,其中乙酸占连续相总量的体积百分比为1%(1.575μg/min),peg800占连续相总量的质量为1%(0.153mg/min)
90.(3)渐缩管道603的管径相比之前管径逐渐减小,u型管管径为120μm,管径缩小比例为3/4;
91.(4)蛇形管道602的设计采用3段u型管道组成。
92.将20μg/ml的fept@fe3o4核/壳磁性纳米粒子加入细胞培养液中,再加入20wt%的藻酸盐水溶液加入细胞培养液1,充分搅拌混合形成分散相4。通过注射泵调节连续相和分散相的流速,通过连续相切割分散相在y型管道601内生成微液滴,微液滴包含藻酸盐和细胞的水溶液。在蛇形管道和渐缩管道603中,乙酸电离产生的h
702扩散到藻酸盐包被的细胞中,与fept@fe3o4核/壳磁性纳米粒子2的fe3o4壳反应,释放的fe
3
703与藻酸盐液态膜701发生交联生成fe
‑
藻酸盐交联的微凝胶704,经过蛇形管道602和渐缩管道603后形成包覆细胞的磁性微凝胶8。
93.制备完成后,从尾动脉注射包覆细胞的磁性微凝胶。通过使用体外磁场,远程控制包覆细胞的磁性微凝胶的运动轨迹,使其在复杂的生物流体中以高精确度导航至目标区域,实现最小的微创方式递送细胞。
94.经过现场调试,经过10min后,pdms微流体装置达到稳定工作状态,稳定时微凝胶中细胞的封装率为90%,包覆细胞的磁性微凝胶的尺寸范围为50~70μm,平均直径为61μm。从老鼠尾动脉注射包覆细胞的磁性微凝胶,可远程控制液滴运动,并实现t1/t2双重mri成像。
95.实施例2
96.实验条件:
97.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/1000;
98.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/3;连续相与本发明实施例1中相同;
99.(3)渐缩管道603的管径相比之前管径逐渐减小,u型管管径为120μm,管径缩小比例为3/4;
100.(4)蛇形管道602的设计采用3段u型管道组成。
101.其余装置和条件与实施例1相同,按照实施例1的方式进行包覆细胞的磁性微凝胶制造,经过现场调试,经过10min后,pdms微流体装置达到稳定工作状态,稳定时微凝胶中细胞的封装率为80%,包覆细胞的磁性微凝胶的尺寸范围为45~60μm,平均直径为52μm。从老鼠尾动脉注射包覆细胞的磁性微凝胶,可远程控制微凝胶运动,并实现t1/t2双重mri成像。
102.实施例3
103.实验条件:
104.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/250;
105.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/4;连续相与本发明实施例1中相同;
106.(3)渐缩管道603的管径相比之前管径逐渐减小,u型管管径为120μm,管径缩小比例为3/4;
107.(4)蛇形管道602的设计采用3段u型管道组成。
108.其余装置和条件与实施例1相同,按照实施例1的方式进行包覆细胞的磁性微凝胶制造,经过现场调试,经过15min后,pdms微流体装置达到稳定工作状态,稳定时微凝胶中细胞的封装率为88%,包覆细胞的磁性微凝胶的尺寸范围为48~65μm,平均直径为58μm。从老鼠尾动脉注射包覆细胞的磁性微凝胶,可远程控制微凝胶运动,并实现t1/t2双重mri成像。
109.实施例4
110.实验条件:
111.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/250;
112.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/3;连续相与本发明实施例1中相同;
113.(3)渐缩管道603的管径相比之前管径逐渐减小,u型管管径为120μm,管径缩小比例为3/5;
114.(4)蛇形管道602的设计采用3段u型管道组成。
115.其余装置和条件与实施例1相同,按照实施例1的方式进行包覆细胞的磁性微凝胶8制造,经过现场调试,经过10min后,pdms微流体装置达到稳定工作状态,稳定时微凝胶中细胞的封装率为90%,包覆细胞的磁性微凝胶的尺寸范围为47~63μm,平均直径为55μm。从老鼠尾动脉注射包覆细胞的磁性微凝胶,可远程控制微凝胶运动,并实现t1/t2双重mri成像。
116.实施例5
117.实验条件:
118.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/250;
119.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/3;连续相与本发明实施例1中相同;
120.(3)渐缩管道603的管径相比之前管径逐渐减小,u型管管径为120μm,管径缩小比例为3/4;
121.(4)蛇形管道602的设计采用4段u型管道组成。
122.其余装置和条件与实施例1相同,按照实施例1的方式进行包覆细胞的磁性微凝胶制造,经过现场调试,经过10min后,pdms微流体装置达到稳定工作状态,稳定时微凝胶中细胞的封装率为90%,包覆细胞的磁性微凝胶的尺寸范围为55~70μm,平均直径为62μm。从老鼠尾动脉注射包覆细胞的磁性微凝胶,可远程控制微凝胶运动,并实现t1/t2双重mri成像。
123.对比例1
124.实验条件:
125.(1)乙二胺四乙酸二钠钙中ca
2
与藻酸盐3的质量比例为1/250;
126.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/3;连续相与本发明实施例1中相同;
127.(3)渐缩管道603的管径相比之前管径逐渐减小,u型管管径为120μm,管径缩小比例为3/4;
128.(4)蛇形管道602的设计采用3段u型管道组成。
129.将20μg/ml的乙二胺四乙酸二钠钙加入细胞培养液1中,再加入20wt%的藻酸盐水溶液3加入细胞培养液1,充分搅拌混合形成分散相4。通过注射泵调节连续相5和分散相4的流速,通过连续相5切割分散相4在y型管道601内生成微液滴,微液滴中包含藻酸盐及细胞7的水溶液。在蛇形管道602和渐缩管道603中,乙酸电离产生的h
702扩散到上述微液滴中,乙二胺四乙酸二钠钙解离释放的ca
2
与藻酸盐3发生交联,最终制造出包覆细胞的磁性微凝胶。
130.经过现场调试,经过10min后,pdms微流体装置达到稳定工作状态,稳定时微凝胶中细胞的封装率为30%,包覆细胞的磁性微凝胶的尺寸范围为78~90μm,平均直径为85μm。从老鼠尾动脉注射包覆细胞的磁性微凝胶,无法远程控制液滴运和t1/t2双重mri成像。
131.对比例2
132.实验条件:
133.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/100;
134.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/3;连续相与本发明实施例1中相同;
135.(3)渐缩管道603的管径相比之前管径逐渐减小,u型管管径为120μm,管径缩小比例为3/4;
136.(4)蛇形管道602的设计采用3段u型管道组成。
137.其余装置和条件与实施例1相同,按照实施例1的方式进行包覆细胞的磁性微凝胶制造,经过现场调试,经过10min后,pdms微流体装置达到稳定工作状态,稳定时微凝胶中细胞的封装率为91%,但是微凝胶的整体尺寸变大,包覆细胞的磁性微凝胶的尺寸范围为70~90μm,平均直径为83μm,不利于细胞治疗。从老鼠尾动脉注射微覆细胞的磁性凝胶包,可远程控制凝胶包运动,可实现t1/t2双重mri成像。
138.对比例3
139.实验条件:
140.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/250;
141.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/5;连续相与本发明实施例1中相同;
142.(3)渐缩管道603的管径相比之前管径逐渐减小,u型管管径为120μm管径缩小比例为3/4;
143.(4)蛇形管道602的设计采用3段u型管道组成。
144.其余装置和条件与实施例1相同,按照实施例1的方式进行微凝胶包覆细胞的磁性液滴制造,经过现场调试,pdms微流体装置无法达到稳定工作状态。
145.对比例4
146.实验条件:
147.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/250;
148.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/3;连续相与本发明实施例1中相同;
149.(3)渐缩管道603的管径相比之前管径相同,u型管管径为120μm;
150.(4)蛇形管道602的设计采用3段u型管道组成。
151.其余装置和条件与实施例1相同,按照实施例1的方式进行微凝胶包覆细胞的磁性液滴制造,经过现场调试,经过10min后,pdms微流体装置无法达到稳定工作状态,会不时出现液滴重叠的现象,导致部分液滴形状从球体变形为橄榄球体。微凝胶中细胞的封装率为87%,包覆细胞的磁性微凝胶的尺寸范围为59~75μm,平均直径为65μm。从老鼠尾动脉注射微凝胶包覆细胞的磁性液滴8,可远程控制液滴运动,但是t1/t2双重mri成像不清晰。
152.对比例5
153.实验条件:
154.(1)fept@fe3o4核/壳磁性纳米粒子中fe
3
与藻酸盐的质量比例为1/250;
155.(2)分散相的流速为50μl/min,且连续相和分散相的流速比为1/3;连续相与本发明实施例1中相同;
156.(3)渐缩管道(603)的管径相比之前管径逐渐减小,u型管管径为120μm,管径缩小比例为3/4;
157.(4)蛇形管道602的设计采用6段u型管道组成。
158.其余装置和条件与实施例1相同,按照实施例1的方式进行微凝胶包覆细胞的磁性液滴制造,经过现场调试,经过10min后,pdms微流体装置达到稳定工作状态,稳定时微凝胶中细胞的封装率为91%,微凝胶包覆细胞的磁性液滴的尺寸范围为55~72μm,平均直径为65μm。从老鼠尾动脉注射微凝胶包覆细胞的磁性液滴,可远程控制液滴运动,并实现t1/t2双重mri成像。
159.上述实验结果可知,说明了对比例5中相对于本发明实施例1中u形管数量的增加对于细胞包覆影响不大,因为u型管数量达到3
‑
4个,细胞封装率就达到了90%。但是u型管的数量更多,封装率仅提高了1%,但是细胞的运动路程却增加了一倍,这样封装的时间就会增加,所以为了提高微流控设备的细胞封装效率,本发明u形管数量优选为3
‑
4个。
160.虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。