本申请要求于2019年2月4日提交的美国临时专利申请号62/800,995的权益,其通过引用整体并入本文。
技术领域
本文描述了使用过氧化物酶体增殖物激活受体δ(PPARδ)激动剂治疗或预防脂肪酸氧化障碍(FAOD)的方法。
背景技术
健康的线粒体对正常的细胞活动至关重要。线粒体功能障碍会驱动包括急性病况和慢性疾病在内的多种医学病症的发病机制。线粒体功能的不同方面,例如,生物能量学、动力学和细胞信号传导已被充分描述,而这些活性的损伤可能有助于疾病的发病机制。线粒体功能的损伤会导致一系列称为脂肪酸氧化障碍的病症。PPARδ是配体激活转录调节因子的核调节超家族的成员,在全身表达。PPARδ激动剂诱导与脂肪酸氧化和线粒体生物发生相关的基因。PPARδ还具有抗炎性质。
技术实现要素:
在一方面,本文描述了用于治疗哺乳动物的脂肪酸氧化障碍(FAOD)的方法,包括向所述患有脂肪酸氧化障碍(FAOD)的哺乳动物施用过氧化物酶体增殖物激活受体δ(PPARδ)激动剂化合物。
在另一方面,本文描述了一种用于改善患有脂肪酸氧化障碍(FAOD)的哺乳动物的全身脂肪酸氧化的方法,包括向所述患有脂肪酸氧化障碍(FAOD)的哺乳动物施用过氧化物酶体增殖物激活受体δ(PPARδ)激动剂化合物。
在另一方面,本文描述了一种调控患有脂肪酸氧化障碍(FAOD)的哺乳动物的过氧化物酶体增殖物激活受体δ(PPARδ)活性的方法,包括向所述患有脂肪酸氧化障碍(FAOD)的哺乳动物施用增殖物激活受体δ(PPARδ)激动剂化合物。
在一些实施方案中,调控过氧化物酶体增殖物激活受体δ(PPARδ)活性包括将过氧化物酶体增殖物激活受体δ(PPARδ)激活。
在一些实施方案中,调控过氧化物酶体增殖物激活受体δ(PPARδ)活性包括提高过氧化物酶体增殖物激活受体δ(PPARδ)活性。
在又一方面,本文描述了一种用于增加患有脂肪酸氧化障碍(FAOD)的哺乳动物的脂肪酸氧化(FAO)的方法,包括向所述患有脂肪酸氧化障碍(FAOD)的哺乳动物施用增殖物激活受体δ(PPARδ)激动剂化合物。
在一些实施方案中,所述过氧化物酶体增殖物激活受体δ(PPARδ)激动剂化合物以一定量施用于所述哺乳动物,所述量足以使所述哺乳动物的FAO能力正常化、上调涉及FAO的任一种酶或蛋白质的基因表达,或其组合。
在一些实施方案中,使所述哺乳动物的FAO能力正常化包括提高FAO能力至足以减轻或降低本文所述的任一种脂肪酸氧化障碍的任一种症状的严重性。
在一方面,本文描述了一种用于治疗哺乳动物的脂肪酸氧化障碍(FAOD)的方法,包括向所述患有FAOD的哺乳动物施用过氧化物酶体增殖物激活受体δ(PPARδ)激动剂化合物。
在一些实施方案中,治疗FAOD包括改善所述哺乳动物的全身脂肪酸氧化(FAO)、改善所述哺乳动物的运动耐力、减少疼痛、减少疲劳或其组合。
在一些实施方案中,改善所述哺乳动物的运动耐力包括增加在大约12分钟的步行测试中步行的距离。在一些实施方案中,在该大约12分钟的步行测试中所步行的距离增加至少约1米、至少约5米、至少约10米、至少约20米、至少约30米、至少约40米、至少约50米、至少约60米、至少约70米、至少约80米、至少约90米、至少约100米,或超过约100米。
如本文所用,术语“约”是指在所述值±10%以内。
在一些实施方案中,改善所述哺乳动物的运动耐力包括降低在大约12分钟的步行测试中的心率。在一些实施方案中,心率降低:每分钟1次心跳、每分钟2次心跳、每分钟3次心跳、每分钟4次心跳、每分钟5次心跳、每分钟至少约10次心跳,或每分钟至少约20次心跳。
在一些实施方案中,改善所述哺乳动物的运动耐力包括降低所测得的呼吸交换率(RER)。
在一些实施方案中,改善所述哺乳动物的全身脂肪酸氧化包括增加所述哺乳动物的脂肪酸氧化(FAO)。在一些实施方案中,增加所述哺乳动物的脂肪酸氧化(FAO)包括增加所述哺乳动物在食用包含富含13C的脂肪酸的膳食后从所述哺乳动物呼出的13CO2量。在一些实施方案中,与被喂食包含富含13C的脂肪酸的膳食且未被施用PPARδ激动剂化合物的哺乳动物相比,呼出的13CO2量增加至少约5%、约10%、约15%、约20%、约25%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或超过约90%。在一些实施方案中,与未被喂食包含富含13C的脂肪酸的膳食的哺乳动物相比,呼出的13CO2量增加至少约5%、约10%、约15%、约20%、约25%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或超过约90%。在一些实施方案中,与未被喂食包含富含13C的脂肪酸的膳食且未被施用PPARδ激动剂化合物的哺乳动物相比,呼出的13CO2量增加至少约5%、约10%、约15%、约20%、约25%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或超过约90%。
在一些实施方案中,向所述哺乳动物施用所述PPARδ激动剂化合物使所述哺乳动物的FAO能力正常化、上调涉及FAO的任一种酶或蛋白质的基因表达、提高涉及FAO的酶或蛋白质的活性,或其组合。
在一些实施方案中,所述过氧化物酶体增殖物激活受体δ(PPARδ)激动剂化合物以一定量施用于所述哺乳动物,所述量足以提高涉及FAO的突变的酶或蛋白质的活性。在一些实施方案中,所述过氧化物酶体增殖物激活受体δ(PPARδ)激动剂化合物以一定量施用于所述哺乳动物,所述量足以提高涉及FAO的突变但催化活性的酶或蛋白质的活性。
在一些实施方案中,所述脂肪酸氧化障碍包括涉及长链脂肪酸进入线粒体的酶或蛋白质的缺陷、影响膜结合酶的长链脂肪酸的线粒体内β氧化缺陷、影响线粒体基质酶的短链和中链脂肪酸的β氧化缺陷、涉及电子从线粒体β氧化转移到呼吸链的酶或蛋白质的缺陷,或其组合。
在一些实施方案中,所述脂肪酸氧化障碍(FAOD)包括肉碱转运蛋白缺乏症、肉碱/酰基肉碱移位酶缺乏症、肉碱棕榈酰转移酶缺乏症1型、肉碱棕榈酰转移酶缺乏症2型、戊二酸血症2型、长链3-羟酰基辅酶A脱氢酶缺乏症、中链酰基辅酶A脱氢酶缺乏症、短链酰基辅酶A脱氢酶缺乏症、短链3-羟酰基辅酶A脱氢酶缺乏症、三功能蛋白缺乏症或极长链酰基辅酶A脱氢酶缺乏症,或其组合。
在一些实施方案中,所述脂肪酸氧化障碍包括肉碱棕榈酰转移酶II(CPT2)缺乏症、极长链酰基辅酶A脱氢酶(VLCAD)缺乏症、长链3-羟酰基辅酶A脱氢酶(LCHAD)缺乏症、三功能蛋白(TFP)缺乏症;或其组合。
在另一方面,本文描述了一种提高哺乳动物中的线粒体脂肪酸β氧化途径的酶或蛋白质的活性的方法,包括向具有线粒体脂肪酸β氧化途径的酶或蛋白质的突变或缺乏的哺乳动物施用PPARδ激动剂化合物。
在又一方面,本文描述了一种提高哺乳动物中的线粒体脂肪酸β氧化途径的酶或蛋白质的活性的方法,包括向具有线粒体脂肪酸β氧化途径的酶或蛋白质的活性缺乏的哺乳动物施用PPARδ激动剂化合物。
在一些实施方案中,所述线粒体脂肪酸β氧化途径的酶或蛋白质的活性缺乏是由线粒体脂肪酸β氧化途径的任一种酶或蛋白质的突变导致。
在一些实施方案中,所述线粒体脂肪酸β氧化途径的酶或蛋白质是短链酰基辅酶A脱氢酶(SCAD)、中链酰基辅酶A脱氢酶(MCAD)、长链3-羟酰基辅酶A脱氢酶(LCHAD)、极长链酰基辅酶A脱氢酶(VLCAD)、线粒体三功能蛋白(TFP)、肉碱转运蛋白(CT)、肉碱棕榈酰转移酶I(CPT I)、肉碱-酰基肉碱移位酶(CACT)、肉碱棕榈酰转移酶II(CPT II)、分离的长链L3-羟基辅酶A脱氢酶、中链L3-羟基辅酶A脱氢酶、短链L3-羟基辅酶A脱氢酶、中链3-酮脂酰辅酶A硫解酶或长链3-酮脂酰辅酶A硫解酶(LCKAT)。
在一些实施方案中,所述突变是MCAD的K304E;VLCAD的L540P、V174M、E609K或其组合;TFPα亚基(HADHA)的E510Q;TFPβ亚基(HADHB)的R247C;或它们的组合。
在一些实施方案中,所述突变是编码VLCAD的基因中的核苷酸突变。在一些实施方案中,所述突变是842C>A、848T>C、865G>A、869G>A、881G>A、897G>T、898A>G、950T>C、956C>A、1054A>G、1096C>T、1097G>A、1117A>T、1001T>G、1066A>G、1076C>T,1153C>T、1213G>C、1146G>C、1310T>C、1322G>A、1358G>A、1360G>A、1372T>C、1258A>C、1388G>A、1405C>T、1406G>A、1430G>A、1349G>A、1505T>C、1396G>T、1613G>C、1600G>A、1367G>A、1375C>T、1376G>A、1532G>A、1619T>C、1804C>A、1844G>A、1825G>A、1844G>A、1837C>G或其组合。
在一些实施方案中,所述哺乳动物具有一个或多个通常与脂肪酸氧化障碍相关的症状。在一些实施方案中,通常与脂肪酸氧化障碍相关的症状包括但不限于:肌酸激酶(CPK)水平升高、肝功能障碍、心肌病、低血糖、横纹肌溶解症、酸中毒、肌张力降低(张力减退)、肌无力、运动不耐受或其组合。
在一些实施方案中,所述PPARδ激动剂结合至细胞PPARδ且激活细胞PPARδ,并且基本上不激活细胞过氧化物酶体增殖物激活受体-α(PPARα)和细胞过氧化物酶体增殖物激活受体-γ(PPARγ)。在一些实施方案中,所述PPARδ激动剂化合物是苯氧基烷基羧酸化合物。在一些实施方案中,所述PPARδ激动剂化合物是苯氧基乙酸化合物、苯氧基丙酸化合物、苯氧基丁酸化合物、苯氧基戊酸化合物、苯氧基己酸化合物、苯氧基辛酸化合物、苯氧基壬酸化合物或苯氧基癸酸化合物。
在一些实施方案中,所述PPARδ激动剂化合物是苯氧基乙酸化合物或苯氧基己酸化合物。在一些实施方案中,所述PPARδ激动剂化合物是烯丙氧基苯氧基乙酸化合物。
在一些实施方案中,所述PPARδ激动剂是选自下组的化合物:(Z)-[2-甲基-4-[3-(4-甲基苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吡唑-1-基)丙-1-炔基]苯基]-3-(4-三氟甲基苯基)-烯丙氧基]苯氧基]乙酸;(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吗啉-4-基)丙炔基]苯基]-3-(4-三氟甲基苯基)烯丙氧基]-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基苯基]-丙酸;{4-[3,3-双-(4-溴-苯基)-烯丙氧基]-2-甲基-苯氧基}-乙酸;或其药学上可接受的盐。
在一些实施方案中,所述PPARδ激动剂是选自下组的化合物:(Z)-[2-甲基-4-[3-(4-甲基苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吡唑-1-基)丙-1-炔基]苯基]-3-(4-三氟甲基苯基)-烯丙氧基]苯氧基]乙酸;(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吗啉-4-基)丙炔基]苯基]-3-(4-三氟甲基苯基)烯丙氧基]-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基苯基]-丙酸;{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苄硫基]-2-甲基-苯氧基}-乙酸;{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苯硫基]-2-甲基-苯氧基}-乙酸;{4-[3,3-双-(4-溴-苯基)-烯丙氧基]-2-甲基-苯氧基}-乙酸;2-[2-甲基-4-[[3-甲基-4-[[4-(三氟甲基)苯基]甲氧基]苯基]硫]苯氧基]-乙酸;(S)-4-[顺-2,6-二甲基-4-(4-三氟甲氧基-苯基)哌嗪-1-磺酰基]-茚满-2-羧酸或其甲苯磺酸盐(KD-3010);4-丁氧基-a-乙基-3-[[[2-氟-4-(三氟甲基)苯甲酰基]氨基]甲基]-苯丙酸(TIPP-204);2-[2-甲基-4-[[[4-甲基-2-[4-(三氟甲基)苯基]-5-噻唑基]甲基]硫]苯氧基]-乙酸(GW-501516);2-[2,6二甲基-4-[3-[4-(甲基硫)苯基]-3-氧代-1(E)-丙烯基]苯氧基]-2-甲基丙酸(GFT-505);{2-甲基-4-[5-甲基-2-(4-三氟甲基-苯基)-2H-[1,2,3]三唑-4-基甲基硫基(sylfanyl)]-苯氧基}-乙酸;(R)-3-甲基-6-(2-((5-甲基-2-(4-(三氟甲基)苯基)-1H-咪唑-1-基)甲基)苯氧基)己酸;(R)-3-甲基-6-(2-((5-甲基-2-(6-(三氟甲基)吡啶-3-基)-1H-咪唑-1-基)甲基)苯氧基)己酸;2-(2-甲基-4-(((2-(4-(三氟甲基)苯基)-2H-1,2,3-三唑-4-基)甲基)硫)苯氧基)乙酸;以及(R)-2-(4-((2-乙氧基-3-(4-(三氟甲基)苯氧基)丙基)硫)苯氧基)乙酸;或其药学上接收的盐。
在一些实施方案中,所述PPARδ激动剂是选自下组的化合物:(Z)-[2-甲基-4-[3-(4-甲基苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吡唑-1-基)丙-1-炔基]苯基]-3-(4-三氟甲基苯基)-烯丙氧基]苯氧基]乙酸;(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吗啉-4-基)丙炔基]苯基]-3-(4-三氟甲基苯基)烯丙氧基]-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基苯基]-丙酸;{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苄硫基]-2-甲基-苯氧基}-乙酸;{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苯硫基]-2-甲基-苯氧基}-乙酸;以及{4-[3,3-双-(4-溴-苯基)-烯丙氧基]-2-甲基-苯氧基}-乙酸;或其药学上可接受的盐。
在一些实施方案中,所述PPARδ激动剂是(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸(化合物I)或其药学上可接受的盐。
在一些实施方案中,(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸或其药学上可接受的盐以约10mg至约500mg、约50mg至约200mg或约75mg至约125mg的剂量施用至所述哺乳动物。
在一些实施方案中,所述PPARδ激动剂是(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸或其药学上可接受的盐,并且以约10mg至约500mg的剂量施用至所述哺乳动物。在一些实施方案中,所述PPARδ激动剂是(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸或其药学上可接受的盐,并且以约50mg至约200mg的剂量施用至所述哺乳动物。在一些实施方案中,所述PPARδ激动剂是(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸(化合物I)或其药学上可接受的盐,并且以约75mg至约125mg的剂量施用至所述哺乳动物。
在一些实施方案中,PPARδ激动剂(例如化合物I或其药学上可接受的盐)全身施用至所述患有脂肪酸氧化障碍(FAOD)的哺乳动物。在一些实施方案中,所述PPARδ激动剂经口服、通过注射或经静脉内施用至所述哺乳动物。在一些实施方案中,所述PPARδ激动剂以口服溶液、口服悬浮液、粉末、丸剂、片剂或胶囊的形式施用至所述哺乳动物。
在一方面,本文描述了一种药物组合物,其包含PPARδ激动剂和至少一种药学上可接受的赋形剂。在一些实施方案中,所述药物组合物被配制成通过静脉内施用、皮下施用、口服施用、吸入、鼻腔施用、皮肤施用或眼部施用而施用至哺乳动物。在一些实施方案中,所述药物组合物被配制成通过静脉内施用、皮下施用或口服施用而施用至哺乳动物。在一些实施方案中,所述药物组合物被配制成通过口服施用而施用至哺乳动物。在一些实施方案中,所述药物组合物呈片剂、丸剂、胶囊、液体、悬浮液、凝胶、分散液、溶液、乳液、软膏或洗剂的形式。在一些实施方案中,所述药物组合物呈片剂、丸剂或胶囊的形式。
在一方面,本文描述了一种治疗或预防任一种本文所述的脂肪酸氧化障碍(FAOD)的方法,包括向有需要的哺乳动物施用治疗有销量的PPARδ激动剂。
在任何前述方面中是进一步的实施方案,其中所述有效量的PPARδ激动剂(例如化合物I或其药学上可接受的盐)是:(a)全身施用至所述哺乳动物;并且/或者(b)口服施用至所述哺乳动物;并且/或者(c)静脉内施用至所述哺乳动物;并且/或者(d)通过注射施用至所述哺乳动物;并且/或者(e)非全身或局部施用至所述哺乳动物。
在任何前述方面中是进一步的实施方案,其包括所述有效量的PPARδ激动剂(例如化合物I或其药学上可接受的盐)的单次施用,包括进一步的实施方案,其中所述PPARδ激动剂(例如化合物I或其药学上可接受的盐)每日一次施用至所述哺乳动物或者在一天的时间跨度内多次施用至所述哺乳动物。在一些实施方案中,所述PPARδ激动剂(例如化合物I或其药学上可接受的盐)以连续的给药时间表施用。在一些实施方案中,所述PPARδ激动剂以连续的每日给药时间表施用。
在涉及治疗疾病或病况的任何前述方面中是进一步的实施方案,其包括除了施用PPARδ激动剂(例如化合物I或其药学上可接受的盐)之外,还施用至少一种另外的药剂。在各个实施方案中,每种药剂以任意顺序施用,包括同时施用。
在一些实施方案中,所述至少一种另外的治疗剂是泛醇、泛醌、烟酸、核黄素、肌酸、L-肉碱、乙酰-L-肉碱、生物素、硫胺素、泛酸、吡哆醇、α-硫辛酸、正庚酸、CoQ10、维生素E、维生素C、甲基钴胺素、亚叶酸、N-乙酰基-L-半胱氨酸(NAC)、锌、亚叶酸/甲酰四氢叶酸钙、白藜芦醇或其组合。在一些实施方案中,所述至少一种另外的治疗剂是奇数链脂肪酸、奇数链脂肪酮、L-肉碱或其组合。在一些实施方案中,所述至少一种另外的治疗剂是三庚酸甘油酯(triheptanoin)、正庚酸、甘油三酯,或其盐,或其组合。
在任何本文公开的实施方案中,所述哺乳动物是人。
在一些实施方案中,所述PPARδ激动剂(例如化合物I或其药学上可接受的盐)施用至人。在一些实施方案中,所述PPARδ激动剂(例如化合物I或其药学上可接受的盐)口服施用。
提供了制品,其包括包装材料、在所述包装材料内的本文所述的化合物或其药学上可接受的盐以及说明PPARδ激动剂(例如化合物I或其药学上可接受的盐)的标签,被用于调控PPARδ的活性,或用于治疗、预防或减轻将会受益于PPARδ活性调控的脂肪酸氧化障碍(FAOD)的一种或多种症状。
本文所述的化合物、方法和组合物的其他目的、特征和优势将从以下详细说明中变得显而易见。然而应当理解,该详细说明和具体示例在示出具体实施方案的同时仅以说明的方式给出,因为对于本领域技术人员而言,在本公开内容的精神和范围内的各种变化和修改将从该详细说明中变得显而易见。
附图说明
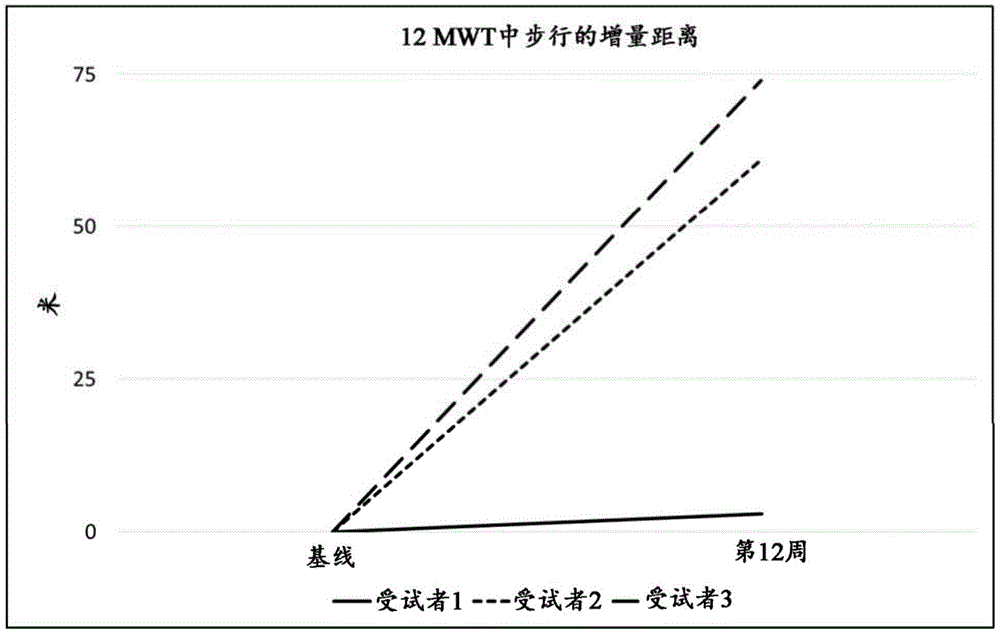
图1显示了在基因诊断为长链FAOD且有肌病症状的患者中化合物1(50mg每日一次,持续12周)对12分钟步行测试的作用。
具体实施方式
线粒体是脂肪酸和甘油三酯通过被称为β氧化的一系列四种酶反应而氧化的主要场所。β氧化途径是一个循环过程,其中每当一个循环完全完成时,两个羧基末端的碳原子作为乙酰辅酶A单元从脂肪酸中释放出来。乙酰辅酶A可以进入柠檬酸循环,并且电子载体将电子递送到电子传递链。脂肪酸氧化(FAO)既产生乙酰辅酶A以促进三羧酸(TCA)循环和生酮作用,也还原黄素腺嘌呤二核苷酸(成为FADH2)和烟酰胺腺嘌呤二核苷酸(称为NADH);这些还原产物直接进入呼吸链。随着酰基辅酶A变短,其理化性质发生变化。为了能够完全降解脂肪酸,β氧化机制具有不同的链长特异性酶。大多数β氧化酶的遗传缺陷已被鉴定和表征(参见例如,S.M.Houten,等人,The Biochemistry and Physiology of Mitochondrial Fatty Acidβ-Oxidation and Its Genetic Disorders.Annual Review of Physiology 2016 78:1,23-44)。
FAO对肌肉中ATP的产生至关重要,尤其是在运动期间。脂肪酸的来源因运动强度而异,其中游离脂肪酸的贡献随着运动强度的增加而增加。在一些情况下,涉及FAO的任何酶的突变都会导致各种临床症状,尤其是在禁食期间和需要高能量的器官中。在婴儿期,在一些情况下,患者会出现心脏症状,例如扩张型或肥厚型心肌病和/或心律失常。或者,在一些情况下,FAO缺陷表现为较轻、较晚(“成人”)发病的疾病,其特征是运动诱发的肌病和横纹肌溶解症。几乎所有涉及FAO的酶和转运蛋白的人类遗传缺陷都已被描述。
在大多数FAO缺陷中,致病突变的特征是导致蛋白质缺失或无功能,或残留酶活性水平不一。PPAR(PPAR-α、PPAR-δ、PPAR-γ)因其对FAO的转录调节而为人所知。在一些情况下,PPAR的激活会触发涉及FAO的酶的基因表达上调,导致经治疗细胞中的残留酶活性的增加和由此的FAO通量纠正。这是对于CPT2中有缺陷的情况。CPT2是一种线粒体内膜酶,与其外膜对应物CPT1一起参与将长链脂肪酸从细胞溶质转移到线粒体基质。使用PPAR激动剂苯扎贝特(bezafibrate),可以在培养的携带CPT2基因轻度突变的患者成纤维细胞中实现缺陷酶的药理学增强(Djouadi,F.等人Pediatr.Res.54,446–451,2003)。苯扎贝特是一种泛PPAR激动剂,对三种受体亚型中的任何一种都具有有限的选择性。在使用培养的患者肌肉细胞的随访研究中(Djouadi,F.等人J.Clin.Endocrinol.Metab.90,1791–1797,2005),特异性激动剂PPARδ(GW072)和较低程度的PPARα(GW 7647)刺激了对照成肌细胞中的FAO。然而,当在CPT2缺陷型成肌细胞中测试时,苯扎贝特和该PPARδ激动剂都能够恢复FAO,而PPARα没有效果。PPARδ选择性激动剂增加了残留的CPT2活性,并使缺陷细胞的长链酰基肉碱产生正常化。在一些实施方案中,选择性PPARδ激动剂是用于纠正FAO缺陷的治疗选择。
在一些情况下,残留酶活性的药理学拯救可能会延伸到其他FAO基因缺陷,例如VLCAD,因为PPAR信号传导途径控制β氧化途径的多种酶。例如,使用PPARδ激动剂化合物MA-0211,在源自具有极长链酰基辅酶A脱氢酶(VLCAD)、长链3-羟酰基辅酶A脱氢酶(LCHAD)和线粒体三功能蛋白(TFP)缺乏的患者的成纤维细胞中观察到脂肪酸氧化的改善(参见Goddeeris,M.等人,ANovel Small-Molecule PPARδModulator for the Treatment of Fatty Acid Oxidation Disorders.Poster Session presented at INFORM:International Network for Fatty Acid Oxidation Research and Management;Rio de Janeiro,Brazil,2017年9月4日)。
使用VLCAD缺陷型细胞系FB833,以下PPARδ激动剂化合物显示出增加VLCAD酶活性:2-[2-甲基-4-[[[4-甲基-2-[4-(三氟甲基)苯基]-5-噻唑基]甲基]硫]苯氧基]乙酸(GW501516)、[4-[[[2-[3-氟-4-(三氟甲基)苯基]-4-甲基-5-噻唑基]甲基]硫]-2-甲基苯氧基]乙酸(GW0742,又名GW610742)和[4-[3-(4-乙酰基-3-羟基-2-丙基苯氧基)丙氧基]苯氧基]乙酸(L-165,0411)(参见国际公开号WO18093839的图20和21)。
用化合物1的体外研究已表明了其引起人和大鼠肌肉细胞系中脂肪酸氧化的剂量依赖性增加的能力。此外,化合物1治疗使对于体内脂肪酸代谢(CPT1b)和线粒体生物发生(PGC1α)而言重要的途径中的多种已知的PPARδ调节基因的表达模式发生改变。
在从患有由于极长链酰基辅酶A脱氢酶(VLCAD)缺乏症而引起的FAOD的有症状患者获得的培养的成纤维细胞的体外研究中,化合物1增加了VLCAD酶活性。在一些实施方案中,化合物1增加患有FAOD的受试者的FAO途径中的突变但催化活性的酶和转运蛋白的活性。在一些实施方案中,化合物1增加患有由于极长链酰基辅酶A脱氢酶(VLCAD)缺乏症而引起的FAOD的有症状患者的FAO途径中的突变但催化活性的酶和转运蛋白的活性。在一些实施方案中,化合物1改善全身脂肪酸氧化,从而降低VLCAD患者的疾病严重性。
在一些实施方案中,本文描述了涉及脂肪酸β氧化途径的酶的残留酶活性的药理学拯救的方法。在一些实施方案中,携带突变的某些细胞预期具有一些残留酶活性。例如,在一些实施方案中,VLCAD的低残留酶活性在从携带错义突变的患者获得的成纤维细胞中观察到(Goetzman ES.Advances in the Understanding and Treatment of Mitochondrial Fatty Acid Oxidation Disorders.Curr Genet Med Rep.2017;5(3):132–142)。在一些实施方案中,本文描述了提高患有FAOD的哺乳动物中涉及脂肪酸β氧化途径的一种或多种酶的残留酶活性的方法,包括向患有FAOD的哺乳动物施用PPARδ激动剂(例如化合物1或其药学上可接受的盐)。在一些实施方案中,本文描述了将患有FAOD的哺乳动物中涉及脂肪酸β氧化途径的一种或多种酶的残留酶活性提高针对没有FAOD的哺乳动物观察到的酶活性水平的约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约75%、约80%、约95%、约100%或超过100%的方法,包括向患有FAOD的哺乳动物施用PPARδ激动剂(例如化合物1或其药学上可接受的盐)。
在一些实施方案中,FAO能力的缺乏通过将鉴定为患有FAOD的哺乳动物的FAO能力与没有FAOD的哺乳动物(即,对照)的FAO能力相比较来衡量。在一些实施方案中,本文描述了提高患有FAOD的哺乳动物的FAO能力的方法,包括向患有FAOD的哺乳动物施用PPARδ激动剂(例如化合物1或其药学上可接受的盐)。在一些实施方案中,本文描述了将患有FAOD的哺乳动物的FAO能力提高针对没有FAOD的哺乳动物观察到的水平的约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约75%、约80%、约95%、约100%或超过100%的方法。在一些实施方案中,本文描述了将患有FAOD的哺乳动物的FAO能力提高至与针对没有FAOD的哺乳动物观察到的水平基本相似的水平的方法,包括向患有FAOD的哺乳动物施用PPARδ激动剂(例如化合物1或其药学上可接受的盐)。在一些实施方案中,本文描述了将患有FAOD的哺乳动物的FAO能力恢复(即正常化)至与针对没有FAOD的哺乳动物观察到的水平基本相似的水平的方法,包括向患有FAOD的哺乳动物施用PPARδ激动剂(例如化合物1或其药学上可接受的盐)。
在一些实施方案中,向患有FAOD的哺乳动物施用PPARδ激动剂(例如化合物1或其药学上可接受的盐)使涉及脂肪酸β氧化途径的一种或多种蛋白质或酶的活性的缺乏恢复(即正常化)。在一些实施方案中,恢复活性包括将活性提高至在没有FAOD的哺乳动物中观察到的基本相似水平。
在一些实施方案中,本文描述了用于治疗脂肪酸氧化(FAO)障碍的方法和组合物。在一些实施方案中,FAO障碍由涉及FAO的基因中的突变导致。在一些实施方案中,突变导致基因编码无功能蛋白质或活性降低的蛋白质。在一些实施方案中,方法包括施用过氧化物酶体增殖物激活受体δ(PPARδ)。在一些实施方案中,施用PPARδ增加涉及FAO的基因的表达。在一些实施方案中,施用PPARδ增加涉及FAO的蛋白质的活性。
在一些实施方案中,本文所述的方法包括治疗由感兴趣的基因中的突变导致的FAO障碍。在一些实施方案中,突变是基因突变。在一些实施方案中,突变是错义突变、无义突变、插入、缺失、重复、移码突变、重复扩增、剪接突变或全基因缺失。在一些实施方案中,FAO障碍由感兴趣的基因中的一个或多个突变导致。
在一些实施方案中,感兴趣的基因是涉及脂肪酸氧化的基因。在一些实施方案中,感兴趣的基因编码涉及脂肪酸氧化的蛋白质。在一些实施方案中,感兴趣的基因编码具有肉碱穿梭功能的蛋白质。在一些实施方案中,感兴趣的基因编码在脂肪酸氧化循环中发挥功能的蛋白质。在一些实施方案中,感兴趣的基因编码具有辅助酶功能的蛋白质。在一些实施方案中,感兴趣的基因的突变编码活性增加的蛋白质。在一些实施方案中,感兴趣的基因的突变编码活性降低的蛋白质。
在一些实施方案中,本文所述的方法包括治疗由感兴趣的基因中的突变导致的FAO障碍,其中感兴趣的基因编码具有肉碱穿梭功能的蛋白质。编码具有肉碱穿梭功能的蛋白质的示例性基因包括但不限于CPT1A、CPT1B、SLC25A20、CPT2和SLC22A5。在一些实施方案中,突变在CPT1A中。在一些实施方案中,突变在CPT1B中。在一些实施方案中,突变在SLC25A20中。在一些实施方案中,突变在CPT2中。在一些实施方案中,突变在SLC22A5中。在一些实施方案中,突变在选自CPT1A、CPT1B、SLC25A20、CPT2和SLC22A5的一个或多个基因中。
CPT1A也称肉碱棕榈酰转移酶1A,其编码CPT1A蛋白。CPT1B也称肉碱棕榈酰转移酶1B,其编码CPT1B蛋白。CTP1是线粒体外膜蛋白并催化酰基辅酶A向酰基肉碱的酯基转移。在一些实施方案中,突变在CPT1A中。在一些实施方案中,在CPT1A中的突变导致CPT1A的活性降低或丧失。在一些实施方案中,突变在CPT1A中,CPT1A包括NCBI参考编号NM_001031847.2中所示的序列。在一些实施方案中,在CPT1A中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在CPT1A中的突变翻译至CPT1A中选自以下的氨基酸位置:R123、C304、T314、R316、F343、R357、E360、A414、D454、G465、P479、L484、Y498、G709和G710,其中氨基酸对应于SEQ ID NO:6的位置123、304、314、316、343、357、360、414、454、465、479、484、498、709和710。在一些实施方案中,在CPT1A中的突变翻译至SEQ ID NO:6的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至CPT1A中的氨基酸位置的在CPT1A中的突变包括但不限于R123C、C304W、T314I、R316G、F343V、R357W、E360G、395del、A414V、D454G、G465W、P479L、L484P、Y498C、G709E和G710E。
在一些实施方案中,突变在CPT1B中。在一些实施方案中,突变在CPT1B中,CPT1B包括NCBI参考编号NM_004377.3中所示的序列。在一些实施方案中,在CPT1B中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在CPT1B中的突变翻译至CPT1B中选自以下的氨基酸位置:I66、G320、S427、E531和S664,其中氨基酸对应于SEQ ID NO:7的位置66、320、427、531和664。在一些实施方案中,在CPT1B中的突变翻译至SEQ ID NO:7的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至CPT1B中的氨基酸位置的在CPT1B中的突变包括但不限于I66V、G320D、S427C、E531K和S664Y。
SLC25A20也称溶质载体家族25成员20或肉碱酰基肉碱移位酶(CACT),其编码CACT蛋白。CACT执行酰基肉碱跨线粒体内膜的转运,以交换游离肉碱分子。在一些实施方案中,突变在SLC25A20中,SLC25A20包括NCBI参考编号NM_000387.6中所示的序列。在一些实施方案中,在SLC25A20中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在SLC25A20中的突变翻译至CACT中选自以下的氨基酸位置:R133、D231和Q238,其中氨基酸对应于SEQ ID NO:8的133、231和238。在一些实施方案中,在SLC25A20中的突变翻译至SEQ ID NO:8的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至CACT中的氨基酸位置的在SLC25A20中的突变包括但不限于R133W、D231H和Q238R。
CPT2也称肉碱O-棕榈酰转移酶2,其编码CPT2蛋白。CPT2是外周线粒体内膜蛋白,通过将酰基肉碱重新转化为酰基辅酶来完成脂肪酸氧化循环。在一些实施方案中,突变在CPT2中。在一些实施方案中,突变在CPT2中,CPT2包括NCBI参考编号NM_000098.3中所示的序列。在一些实施方案中,在CPT2中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在CPT2中的突变翻译至CPT2中选自以下的氨基酸位置:P50、S113、R151、Y210、D213、M214、P227、R296、F383、F448、Y479、R503、G549、Q550、D553、G600、P604、Y628和R631,其中氨基酸对应于SEQ ID NO:9的位置50、113、151、210、213、214、227、296、383、448、479、503、549、550、553、600、604、628和631。在一些实施方案中,在CPT2中的突变翻译至SEQ ID NO:9的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至CPT2中的氨基酸位置的在CPT2中的突变包括但不限于P50H、S113L、R151Q、Y210D、D213G、M214T、P227L、R296Q、F383Y、F448L、Y479F、R503C、G549D、Q550R、D553N、G600R、P604S、Y628S和R631C。
SLC22A5也称溶质载体家族22成员5,其编码OCTN2蛋白。OCTN2的功能是跨质膜转运肉碱。在一些实施方案中,突变在SLC22A5中。在一些实施方案中,突变在SLC22A5中,SLC22A5包括NCBI参考编号NM_001308122.1中所示的序列。在一些实施方案中,在SLC22A5中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在SLC22A5中的突变翻译至OCTN2中选自以下的氨基酸位置:G12、G15、P16、F17、R19、L20、S26、S28、N32、A44、P46、C50、T66、R75、R83、S93、L95、G96、D115、D122、V123、E131、A142、P143、V151、R169、V175、M177、M179、L186、M205、N210、Y211、A214、T219、S225、R227、F230、S231、T232、G234、A240、G242、P247、R254、R257、T264、L269、S280、R282、W283、A301、I312、E317、I348、W351、S355、Y358、S362、L363、P398、R399、S412、V439、T440、A442、F443、V446、Y447、V448、Y449、E452、P455、G462、S467、T468、S470、R471、L476、P478、R488和L507S,其中氨基酸对应于SEQ ID NO:10的12、15、16、17、19、20、26、28、32、44、46、50、66、75、83、93、95、96、115、122、123、131、142、143、151、169、175、177、179、186、205、210、211、214、219、225、227、230、231、232、234、240、242、247、254、257、264、269、280、282、283、301、312、317、348、351、355、358、362、363、398、399、412、439、440、442、443、446、447、448、449、452、455、462、467、468、470、471、476、478、488和507。在一些实施方案中,在SLC22A5中的突变翻译至SEQ ID NO:10的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至OCTN2中的氨基酸位置的在SLC22A5中的突变包括但不限于4–557del、G12S、G15W、P16L、F17L、R19P、L20H、22del、S26N、S28I、N32S、A44V、P46L、P46S、C50Y、T66P、R75P、R83L、S93W、L95V、G96A、D115G、117–557del、D122Y、V123G、E131D、132–557del、140–557del、A142S、P143L、V151M、R169P、R169Q、R169W、V175M、M177V、M179L、L186P、M205R、N210S、Y211C、A214V、T219K、S225L、R227H、F230L、S231F、T232M、G234R、A240T、G242V、P247R、254–557del、R254Q、256–557del、R257W、T264M、T264R、L269P、275–557del、S280F、282–557del、R282Q、W283C、W283R、289–557del、295–557del、A301D、I312V、E317K、319–557del、I348T、W351R、S355L、Y358N、S362L、L363P、387–557del、394del、P398L、R399Q、R399W、S412G、V439G、T440M、A442I、F443V、V446F、Y447C、V448L、Y449D、E452K、P455R、G462V、S467C、T468R、S470F、R471C、R471H、R471P、L476R、P478L、R488C、R488H和L507S。
在一些实施方案中,本文所述的方法包括治疗由感兴趣的基因中的突变导致的FAO障碍,其中感兴趣的基因编码在脂肪酸氧化循环中发挥功能的蛋白质。编码在脂肪酸氧化循环中发挥功能的蛋白质的示例性基因包括但不限于ACADVL、ACADM、ACADS、HADHA、HADHB、ECHS1、HADH、ACAA2、ACAT1、ACADL和ACAD9。在一些实施方案中,突变在ACADVL中。在一些实施方案中,突变在ACADM中。在一些实施方案中,突变在ACADS中。在一些实施方案中,突变在HADHA中。在一些实施方案中,突变在HADHB中。在一些实施方案中,突变在ECHS1中。在一些实施方案中,突变在HADH中。在一些实施方案中,突变在ACAA2中。在一些实施方案中,突变在ACAT1中。在一些实施方案中,突变在ACADL中。在一些实施方案中,突变在ACAD9中。在一些实施方案中,突变在选自ACADVL、ACADM、ACADS、HADHA、HADHB、ECHS1、HADH、ACAA2、ACAT1、ACADL和ACAD9的一个或多个基因中。
ACADVL也称极长链酰基辅酶A脱氢酶,其编码VLCAD蛋白。VLCAD是乙酰辅酶A脱氢酶家族的成员,可从长链酰基辅酶A代谢乙酰辅酶A。在一些实施方案中,突变在ACADVL中。在一些实施方案中,突变在ACADVL中,ACADVL包括SEQ ID NO:11中所示的序列。核苷酸序列中的示例性突变包括但不限于128G>A、194C>T、215C>T、439C>T、473C>A、476A>G、455G>A、481G>A、482C>T、520G>A、553G>A、622G>A、637G>C、520G>A、652G>A、535G>T、728T>G、A739G、740A>C、c.637G>A、753-2A>C、7790>T、664G>C、689C>T、739A>C颠换、842C>A、848T>C、865G>A、869G>A、881G>A、897G>T、898A>G、950T>C、956C>A、1054A>G、1096C>T、1097G>A、1117A>T、1001T>G、1066A>G、1076C>T、1153C>T、1213G>C、1146G>C、1310T>C、1322G>A、1358G>A、1360G>A、1372T>C、1258A>C、1388G>A、1405C>T、1406G>A、1430G>A、1349G>A、1505T>C、1396G>T、1613G>C、1600G>A、1367G>A、1375C>T、1376G>A、1532G>A、1619T>C、1804C>A、1844G>A、1825G>A、1844G>A和1837C>G。在一些实施方案中,核苷酸序列中的突变是842C>A、848T>C、865G>A、869G>A、881G>A、897G>T、898A>G、950T>C、956C>A、1054A>G、1096C>T、1097G>A、1117A>T、1001T>G、1066A>G、1076C>T,1153C>T、1213G>C、1146G>C、1310T>C、1322G>A、1358G>A、1360G>A、1372T>C、1258A>C、1388G>A、1405C>T、1406G>A、1430G>A、1349G>A、1505T>C、1396G>T、1613G>C、1600G>A、1367G>A、1375C>T、1376G>A、1532G>A、1619T>C、1804C>A、1844G>A、1825G>A、1844G>A、1837C>G或其组合。在一些实施方案中,在ACADVL中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ACADVL中的突变翻译至VLCAD中选自以下的氨基酸位置:P65、S72、P147、T118、Q119、A161、V134、G145、G208、A213、E218、L243、K247、T260、G222、T230、V283、G289、M300、R366、I373、M334、I356、A359、R385、K382、M437、G439、G441、I420、R450、D466、R459、R511、L540、E609、R615和R613,其中氨基酸对应于SEQ ID NO:22的位置65、72、147、118、119、161、134、145、208、213、218、243、247、260、222、230、283、289、300、366、373、334、356、359、385、382、437、439、441、420、450、466、459、511、540、609、615和613。在一些实施方案中,在ACADVL中的突变翻译至SEQ ID NO:22的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至VLCAD中的氨基酸位置的在ACADVL中的突变包括但不限于G3D、P65L、S72F、P147S、T118N、Q119R、G152D、A121T、A161V、V134M、G145S、G168R、A173P、V174M、E178K、G179W、L203R、K207E、K207T、A213T、T220M、G222R、T2301、K247Q、A281D、G289R、G250D、G254E、K259N、M300V、V277A、M312V、R326C、R326H、I333F、M334R、I356V、A359V、R345W、D365H、K382N、M437T、G401D、R413Q、D414N、F418L、G423E、R429W、R429Q、C437Y、R450H、L462P、D466Y、R538P、E454K、R456H、R459W、R459Q、R511Q、L5621、R575Q、R615Q和R613G。在一些实施方案中,翻译至VLCAD中的氨基酸位置的在ACADVL中的突变是L540P、V174M、E609K或其组合。
ACADM也称中链特异性酰基辅酶A脱氢酶,其编码MCAD蛋白。MCAD是乙酰辅酶A脱氢酶家族的成员,可从中链酰基辅酶A代谢乙酰辅酶A。在一些实施方案中,突变在ACADM中。在一些实施方案中,突变在ACADM中,ACADM包括SEQ ID NO:12中所示的序列。在一些实施方案中,在ACADM中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ACADM中的突变翻译至MCAD中选自以下的氨基酸位置:R53、Y67、I78、C116、T121、M149、T193、G195、R206、C244、S245、G267、R281、G310、M326、K329、S336、Y352和I375,其中氨基酸对应于SEQ ID NO:23的位置53、67、78、116、121、149、193、195、206、244、245、267、281、310、326、329、336、352和375。在一些实施方案中,在ACADM中的突变翻译至SEQ ID NO:23的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至MCAD中的氨基酸位置的在ACADM中的突变包括但不限于R53C、Y67H、I78T、115–116del、C116Y、T121I、M149I、T193A、G195R、R206L、C244R、S245L、G267R、R281T、G310R、M326T、K329E、S336R、Y352C和I375T。在一些实施方案中,翻译至MCAD中的氨基酸位置的在ACADM中的突变是K304E。
ACADS也称短链特异性酰基辅酶A脱氢酶,其编码SCAD蛋白。SCAD是乙酰辅酶A脱氢酶家族的成员,可从短链酰基辅酶A代谢乙酰辅酶A。在一些实施方案中,突变在ACADS中。在一些实施方案中,突变在ACADS中,ACADS包括SEQ ID NO:13中所示的序列。在一些实施方案中,在ACADS中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ACADS中的突变翻译至SCAD中选自以下的氨基酸位置:R46、G90、G92、R107、W177、A192、R325、S353、R380和R383,其中氨基酸对应于SEQ ID NO:24的位置46、90、92、107、177、192、325、353、380和383。在一些实施方案中,在ACADS中的突变翻译至SEQ ID NO:24的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至SCAD中的氨基酸位置的在ACADS中的突变包括但不限于R46W、G90S、G92C、104del、R107C、W177R、A192V、R325W、S353L、R380W和R383C。
HADHA也称羟酰基辅酶A脱氢酶三功能多酶复合体亚基α,其编码蛋白质MTPα。MTPα是MTP的亚基,位于线粒体内膜处并且代谢长链中间体。在一些实施方案中,突变在MTPα中。在一些实施方案中,突变在HADHA中,HADHA包括SEQ ID NO:14中所示的序列。在一些实施方案中,在MTPα中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在HADHA中的突变翻译至MTPα中选自以下的氨基酸位置:V282、I305、L341和E510,其中氨基酸对应于SEQ ID NO:25的位置282、305、341和510。在一些实施方案中,在HADHA中的突变翻译至SEQ ID NO:25的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至MTPα中的氨基酸位置的在HADHA中的突变包括但不限于V282D、I305N、L341P和E510Q。在一些实施方案中,翻译至MTPα中的氨基酸位置的在HADHA中的突变是E510Q。
HADHB也称羟酰基辅酶A脱氢酶三功能多酶复合体亚基β,其编码蛋白质MTPβ。MTPβ是MTP的亚基。在一些实施方案中,突变在MTPβ中。在一些实施方案中,突变在HADHB中,HADHB包括SEQ ID NO:15中所示的序列。在一些实施方案中,在MTPβ中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在HADHB中的突变翻译至MTPβ中选自以下的氨基酸位置:G59、R61、R117、L121、T133、D242、R247、D263、G280、P294、G301和R444,其中氨基酸对应于SEQ ID NO:26的位置59、61、117、121、133、242、247、263、280、294、301和444。在一些实施方案中,在HADHB中的突变翻译至SEQ ID NO:26的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至MTPβ中的氨基酸位置的在HADHB中的突变包括但不限于G59D、R61C、R61H、R117G、L121P、T133P、D242G、R247H、259–270del、D263G、G280D、P294L、P294R、G301S和R444K。在一些实施方案中,翻译至MTPβ中的氨基酸位置的在HADHB中的突变是R247C。
ECHS1也称短链烯酰-辅酶A水合酶,其编码短链蛋白质-巴豆酸酶蛋白。巴豆酸酶的功能是在脂肪酸氧化过程中代谢脂肪酸以生成乙酰辅酶A。在一些实施方案中,突变在巴豆酸酶中。在一些实施方案中,突变在ECHS1中,ECHS1包括SEQ ID NO:16中所示的序列。在一些实施方案中,在巴豆酸酶中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ECHS1中的突变翻译至巴豆酸酶中选自以下的氨基酸位置:A2、F33、R54、N59、I66、E77、G90、A132、A138、D150、A158、Q159、G195、C225、K273和E281,其中氨基酸对应于SEQ ID NO:27的位置2、33、54、59、66、77、90、132、138、150、158、159、195、225、273和281。在一些实施方案中,在ECHS1中的突变翻译至SEQ ID NO:27的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至巴豆酸酶中的氨基酸位置的在ECHS1中的突变包括但不限于A2V、F33S、R54H、N59S、I66T、E77Q、G90R、A132T、A138V、D150G、A158D、Q159R、G195S、C225R、K273E和E281G。
HADH也称短链(S)-3-羟酰基-CoA脱氢酶,其编码短链蛋白-SCHAD蛋白。SCHAD在短链脂肪酸的β氧化中发挥功能。在一些实施方案中,突变在SCHAD中。在一些实施方案中,突变在HADH中,HADH包括SEQ ID NO:17中所示的序列。在一些实施方案中,在SCHAD中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在HADH中的突变翻译至SCHAD中选自以下的氨基酸位置:A40、D57和P258,其中氨基酸对应于SEQ ID NO:28的位置40、57和258。在一些实施方案中,在HADH中的突变翻译至SEQ ID NO:28的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至SCHAD中的氨基酸位置的在HADH中的突变包括但不限于A40T、D57E和P258L。
ACAA2也称中链3-酮脂酰-辅酶A硫解酶,其编码短链蛋白-MCKAT蛋白。MCKAT催化酮脂酰-辅酶A。在一些实施方案中,突变在SCHAD中。在一些实施方案中,突变在ACAA2中,ACAA2包括SEQ ID NO:18中所示的序列。在一些实施方案中,在MCKAT中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ACAA2中的突变翻译至SEQ ID NO:29的一个或多个不同的氨基酸位置。
ACAT1也称乙酰乙酰辅酶A硫解酶或乙酰辅酶A乙酰转移酶1,其编码乙酰辅酶A乙酰转移酶蛋白。乙酰辅酶A乙酰转移酶在酮体代谢中发挥功能。在一些实施方案中,突变在乙酰乙酰辅酶A硫解酶中。在一些实施方案中,突变在ACAT1中,ACAT1包括SEQ ID NO:19中所示的序列。在一些实施方案中,在乙酰乙酰辅酶A硫解酶中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ACAT1中的突变翻译至乙酰乙酰辅酶A硫解酶中选自以下的氨基酸位置:N93、G152、N158、G183、T297、A301、I312、A333、G379和A380,其中氨基酸对应于SEQ ID NO:30的位置93、152、158、183、297、301、312、333、379和380。在一些实施方案中,在ACAA1中的突变翻译至SEQ ID NO:30的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至乙酰乙酰辅酶A硫解酶中的氨基酸位置的在ACAA1中的突变包括但不限于85del、N93S、G152A、N158D、G183R、T297M、A301P、I312T、A333P、G379V和A380T。
ACADL也称长链酰基辅酶A脱氢酶,其编码LCAD蛋白。LCAD催化直链脂肪酸的β氧化。在一些实施方案中,突变在LCAD中。在一些实施方案中,突变在ACADL中,ACADL包括SEQ ID NO:20中所示的序列。在一些实施方案中,在LCAD中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ACADL中的突变翻译至SEQ ID NO:31的一个或多个不同的氨基酸位置。
ACAD9也称酰基辅酶A脱氢酶家族成员9,其编码ACAD9蛋白。ACAD9是ACAD家族的成员,作用于包含14-20个碳原子的脂肪酸。在一些实施方案中,突变在ACAD9中。在一些实施方案中,突变在ACAD9中,ACAD9包括SEQ ID NO:21中所示的序列。在一些实施方案中,在ACAD9中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ACAD9中的突变翻译至ACAD9中选自以下的氨基酸位置:F44、R127、R193、A220、S234、R266、C271、G303、A326、V384、E413、R414、R417、R469W、R518、R532和L606,其中氨基酸对应于位置44、127、193、220、234、266、271、303、326、384、413、414、417、469、518、532和606。在一些实施方案中,在ACAD9中的突变翻译至SEQ ID NO:32的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至ACAD9中的氨基酸位置的在ACAD9中的突变包括但不限于F44I、R127K、R193W、A220V、S234F、R266Q、C271G、G303S、A326T、V384M、E413K、R414C、R417C、R469、R518H、R532W和L606H。
在一些实施方案中,本文所述的方法包括治疗由感兴趣的基因中的突变导致的FAO障碍,其中感兴趣的基因编码具有辅助酶功能的蛋白质。编码具有辅助酶功能的蛋白质的示例性基因包括但不限于ECI1、ECI2、DECR1和ECH1。在一些实施方案中,突变在ECI1中。在一些实施方案中,突变在ECI2中。在一些实施方案中,突变在DECR1中。在一些实施方案中,突变在ECH1中。在一些实施方案中,突变在选自ECI1、ECI2、DECR1和ECH1的一个或多个基因中。
ECI1也称烯酰-辅酶Aδ异构酶1,其编码蛋白质DCI。DCI是参与不饱和脂肪酸的β氧化的线粒体酶。在一些实施方案中,突变在DCI中。在一些实施方案中,突变在ECI1中,ECI1包括SEQ ID NO:33中所示的序列。在一些实施方案中,在DCI中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ECI1中的突变翻译至SEQ ID NO:37的一个或多个不同的氨基酸位置。
ECI2也称烯酰-辅酶Aδ异构酶2,其编码蛋白质PECI。PECI是参与不饱和脂肪酸的β氧化的线粒体酶。在一些实施方案中,突变在PECI中。在一些实施方案中,突变在ECI2中,ECI2包括SEQ ID NO:34中所示的序列。在一些实施方案中,在PECI中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ECI2中的突变翻译至SEQ ID NO:38的一个或多个不同的氨基酸位置。
DECR1也称2,4-二烯酰-辅酶A还原酶,其编码蛋白质DECR。DECR参与在偶数和奇数位置具有双键的不饱和脂肪烯酰-辅酶A酯的代谢。在一些实施方案中,突变在DECR中。在一些实施方案中,突变在DECR1中,DECR1包括SEQ ID NO:35中所示的序列。在一些实施方案中,在DECR中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在DECR1中的突变翻译至DECR中选自以下的氨基酸位置:N148、Y199、S210和K214,其中氨基酸对应于SEQ ID NO:35的位置148、199、210和214。在一些实施方案中,在DECR1中的突变翻译至SEQ ID NO:39的一个或多个不同的氨基酸位置。在一些实施方案中,翻译至ACAD9中的氨基酸位置的在DECR1中的突变包括但不限于N148A、Y199A、S210A和K214A。
ECH1也称烯酰-辅酶A水合酶1,其编码蛋白质ECH1。ECH1在脂肪酸氧化途径的辅助步骤中发挥功能。在一些实施方案中,突变在ECH1中。在一些实施方案中,突变在ECH1中,ECH1包括SEQ ID NO:36中所示的序列。在一些实施方案中,在ECH1中的突变是肽序列中的突变。在一些实施方案中,突变导致错义置换、无义置换(*)、编码沉默置换、缺失(del)、插入(ins)或移码(fs)。在一些实施方案中,在ECH1中的突变翻译至SEQ ID NO:40的一个或多个不同的氨基酸位置。
肌肉组织是在大多数动物中发现的包含肌肉细胞的软组织。肌肉细胞含有蛋白质细丝,在一些情况下,蛋白质细丝相互滑过并产生收缩,从而改变肌肉细胞的长度和形状。肌肉的功能是产生力量和运动。身体有三种类型的肌肉:a)骨骼肌(负责移动四肢和身体外部区域的肌肉);b)心肌(心脏的肌肉);c)平滑肌(位于动脉壁和肠壁中的肌肉)。
如本文所用,术语“肌肉细胞”是指有助于肌肉组织的任何细胞。成肌细胞、卫星细胞、肌管和肌原纤维组织都包括在术语“肌肉细胞”中,并且在一些实施方案中,使用本文所述的方法进行治疗。在一些情况下,肌肉细胞作用是在骨骼肌、心肌和平滑肌中诱发的。
骨骼肌或随意肌通常通过肌腱锚定在骨骼上,并且通常用于影响骨骼运动,例如移动或保持姿势。尽管骨骼肌的某些控制通常作为无意识反射保持(例如,姿势肌肉或横膈膜),但骨骼肌会对有意识的控制做出反应。平滑肌或不随意肌位于器官和结构例如食道、胃、肠、子宫、尿道和血管的壁内。与骨骼肌不同,平滑肌不受有意识控制。心肌也是一种不随意肌,但在结构上更类似于骨骼肌,并且仅存在于心脏中。心肌和骨骼肌有横纹,因为它们含有肌节,这些肌节组装成高度规则的束状布置。相比之下,平滑肌细胞的肌原纤维不在肌节中布置,因此没有横纹。
骨骼肌进一步分为两大类型:I型(或“慢缩肌”)和II型(或“快缩肌”)。I型肌纤维具有致密的毛细血管并富含线粒体和肌红蛋白,这使I型肌肉组织呈现出特征性的红色。在一些情况下,I型肌纤维携带更多氧气并使用脂肪或碳水化合物作为燃料维持有氧活动。I型肌纤维长时间收缩,但力量很小。II型肌纤维细分为三个主要亚型(IIa、IIx和IIb),它们的收缩速度和产生的力各不相同。II型肌纤维收缩迅速而有力,但很快疲劳,因此在肌肉收缩变得疼痛之前只产生短暂的无氧爆发性活动。
使用对氧化磷酸化复合体具有特异性的荧光标记抗体,例如来自Life Technologies的抗-OxPhox复合体Vd亚基抗体,或在活细胞染色中使用线粒体特异性染料,例如来自Life Technologies的Mito-tracker探针,经由组织切片染色通过线粒体质量和体积来测量线粒体的生物发生。在一些情况下,还可以通过使用诸如QPCR的技术监测一种或多种与线粒体生物发生相关的转录因子(如PGC1a、NRF1或NRF2)的基因表达来测量线粒体的生物发生。
在一些方面,将PPARδ激动剂以治疗有效量施用于受试者(例如,人)。如本文所用,术语“有效量”或“治疗有效量”是指引发所需生物学或医学反应,例如减轻或缓解所治疗病况的症状的活性成分的量。在本发明的一些实施方案中,所施用的PPARδ激动剂的量取决于各种因素,包括但不限于受试者的体重、受试者病况的性质和/或程度等。
化合物
过氧化物酶体增殖物激活受体δ(PPARδ)激动剂化合物是脂肪酸、脂质、蛋白质、肽、小分子或其他化学实体,其与细胞PPARδ结合并引发下游反应,即基因转录(天然基因转录或报告构建体基因转录),相当于内源性配体如视黄酸,或相当于标准参考PPARδ激动剂如卡巴环素(carbacyclin)。
在实施方案中,PPARδ激动剂是选择性激动剂。如本文所用,选择性PPARδ激动剂被视为化学实体,其结合至且激活细胞PPARδ并且基本上不激活细胞过氧化物酶体增殖物激活受体-α(PPARα)和-γ(PPARγ)。如本文所用,选择性PPARδ激动剂是具有至少10倍最大激活(相比于内源性受体配体)的化学实体,其中相对于PPARα和PPARγ中的任一者或两者,以大于100倍的效能激活PPARδ。在进一步的实施方案中,选择性PPARδ激动剂是化学实体,其结合至且激活人细胞PPARδ并且基本上不激活人PPARα和PPARγ中的任一者或两者。在进一步的实施方案中,选择性PPARδ激动剂是化学实体,相对于PPARα和PPARγ中的任一者或两者,其以至少约10倍、或约20倍、或约30倍、或约40倍、或约50倍、或约100倍的效能激活PPARδ。
在一些实施方案中,本文考虑的选择性PPARδ激动剂化合物能够同时接触PPARδ的VAL312和ILE328(hPPARδ编号)位置处的氨基酸残基。在一些实施方案中,选择性PPARδ激动剂化合物能够同时接触VAL298、LEU303、VAL312和ILE328(hPPARδ编号)位置处的氨基酸残基。
本文中的“激活”被定义为上述的下游反应,在PPAR的情况下是基因转录。在一些情况下,基因转录被间接测量为反映所研究的特定PPAR亚型的激活的蛋白质的下游产生。或者,在一些情况下,使用人工报告构建体来研究细胞中表达的单个PPAR的激活。在一些实施方案中,待研究的特定受体的配体结合结构域与产生方便的实验室读数的转录因子的DNA结合结构域(例如酵母GAL4转录因子DNA结合结构域)融合。在一些情况下,融合蛋白与影响萤光素酶蛋白表达的Gal4增强子一起转染到实验室细胞系中。当这种体系被转染到实验室细胞系中时,受体激动剂与融合蛋白的结合将导致光发射。
在一些实施方案中,选择性PPARδ激动剂例示了在选择性表达PPARδ的细胞中有上述基因转录谱,而在选择性表达PPARγ或PPARα的细胞没有该谱。在一个实施方案中,细胞分别表达人PPARδ、PPARγ和PPARα。
在进一步的实施方案中,PPARδ激动剂具有小于约5μm的EC50值,如通过下文所述的PPAR瞬时反式激活测定所确定的。在一个实施方案中,EC50值小于约1μm。在另一实施方案中,EC50值小于约500nM。在另一实施方案中,EC50值小于约100nM。在另一实施方案中,EC50值小于约50nM。
在一些情况下,PPAR瞬时反式激活测定基于将分别编码嵌合测试蛋白和报告蛋白的两种质粒瞬时转染到人HEK293细胞中。在一些情况下,嵌合测试蛋白是来自酵母GAL4转录因子的DNA结合结构域(DBD)与人PPAR蛋白的配体结合结构域(LBD)的融合物。除了配体结合袋外,PPAR-LBD部分还具有天然激活结构域,使融合蛋白能够作为PPAR配体依赖性转录因子发挥作用。GAL4 DBD将指导嵌合蛋白仅与Gal4增强子结合(在HEK293细胞中不存在)。报告质粒含有驱动萤火虫萤光素酶蛋白表达的Gal4增强子。转染后,HEK293细胞表达GAL4-DBD-PPAR-LBD融合蛋白。该融合蛋白将进而与控制萤光素酶表达的Gal4增强子结合,并且在没有配体的情况下什么也不做。在添加PPAR配体的细胞后,萤光素酶蛋白将以对应于PPAR蛋白的激活的量产生。添加合适的底物后,通过光发射来测量萤光素酶蛋白的量。
细胞培养和转染:在一些情况下,使HEK293细胞在DMEM 10%FCS中生长。在一些情况下,在转染前一天将细胞接种在96孔板中,以在转染时达到50-80%的汇合度。在一些情况下,使用FuGene转染试剂,根据制造商的说明,每孔共转染0.8mg DNA,其含有0.64mg pM1a/gLBD、0.1mg pCMVbGal、0.08mg pGL2(Gal4)5和0.02mg pADVANTAGE。在一些情况下,允许细胞表达蛋白质48小时,然后添加化合物。
质粒:在一些情况下,人PPARδ是使用由分别来自人肝脏、脂肪组织和胎盘的mRNA逆转录合成的cDNA,通过PCR扩增获得的。在一些实施方案中,扩增的cDNA被克隆到pCR2.1中并测序。在一些情况下,每个PPAR同种型的配体结合结构域(LBD)是通过PCR生成的(PPARδ:aa 128–C端),并通过将框中的片段亚克隆到载体pM1中而与酵母转录因子GAL4的DNA结合结构域(DBD)融合(Sadowski等人,(1992),Gene 118,137),生成质粒pM1αLBD、pM1γLBD和pM1δ。在一些情况下,随后融合物通过测序来验证。在一些情况下,通过将编码GAL4识别序列的5个重复序列的寡核苷酸(Webster等人,(1988),Nucleic Acids Res.16,8192)插入载体pGL2启动子(Promega)中,生成质粒pGL2(GAL4)5,来构建报告蛋白。pCMVbGal在一些情况下是从Clontech购买的,而pADVANTAGE在一些情况下是从Promega购买的。
化合物:在一些情况下,将化合物溶解在DMSO中并在添加到细胞时以1:1000稀释。在一些情况下,以0.001至300μM的浓度范围对化合物进行四重测试。在一些情况下,将细胞用化合物处理24小时,然后进行萤光素酶测定。在一些情况下,每种化合物在至少两个独立的实验中进行测试。
萤光素酶测定:在一些情况下,吸出包含测试化合物的培养基,并且在一些情况下,将包含1mM Mg 和Ca 的100μl PBS添加到每个孔中。在一些实施方案中,根据制造商的说明(Packard Instruments)使用LucLite试剂盒进行萤光素酶测定。在一些情况下,光发射通过在Packard LumiCounter上计数进行量化。为了测量β-半乳糖苷酶活性,在一些情况下,将来自每种转染裂解物的25ml上清液转移到新的微板中。在一些实施方案中,使用来自Promega的试剂盒在微孔板中进行β-半乳糖苷酶测定并在Labsystems Ascent Multiscan读数器中读取。在一些情况下,将β-半乳糖苷酶数据用于标准化(转染效率、细胞生长等)萤光素酶数据。
统计方法:在一些情况下,化合物的活性计算为与未处理样品相比的倍数诱导。在一些实施方案中,对于每种化合物,功效(最大活性)作为与Wy14,643对于PPARα、罗格列酮对于PPARγ和卡巴环素对于PPARδ相比的相对活性给出。EC50是产生50%最大观察活性的浓度。在一些情况下,使用GraphPad PRISM 3.02(GraphPad Software,San Diego,CA)通过非线性回归计算EC50值。
在进一步的实施方案中,PPARδ激动剂具有小于约1000g/mol的分子量、或小于约950g/mol的分子量、或小于约900g/mol的分子量、或小于约850g/mol的分子量、或小于约800g/mol的分子量、或小于约750g/mol的分子量、或小于约700g/mol的分子量、或小于约650g/mol的分子量、或小于约600g/mol的分子量、或小于约550g/mol的分子量、或小于约500g/mol的分子量、或小于约450g/mol的分子量、或小于约400g/mol的分子量、或小于约350g/mol的分子量、或小于约300g/mol的分子量、或小于约250g/mol的分子量。在另一实施方案中,PPARδ激动剂具有大于约200g/mol的分子量、或大于约250g/mol的分子量、或大于约250g/mol的分子量、或大于约300g/mol的分子量、或大于约350g/mol的分子量、或大于约400g/mol的分子量、或大于约450g/mol的分子量、或大于约500g/mol的分子量、或大于约550g/mol的分子量、或大于约600g/mol的分子量、或大于约650g/mol的分子量、或大于约700g/mol的分子量、或大于约750g/mol的分子量、或大于约800g/mol的分子量、或大于约850g/mol的分子量、或大于约900g/mol的分子量、或大于约950g/mol的分子量、或大于约1000g/mol的分子量。在一些实施方案中,本段中上述的任何上限和下限被组合。
在一些实施方案中,PPARδ激动剂是任何以下公开的专利申请中公开的PPARδ激动剂化合物:WO 97/027847、WO 97/027857、WO 97/028115、WO 97/028137、WO 97/028149、WO 98/027974、WO 99/004815、WO 2001/000603、WO 2001/025181、WO 2001/025226、WO 2001/034200、WO 2001/060807、WO 2001/079197、WO 2002/014291、WO 2002/028434、WO 2002/046154、WO 2002/050048、WO 2002/059098、WO 2002/062774、WO 2002/070011、WO 2002/076957、WO 2003/016291、WO 2003/024395、WO 2003/033493、WO 2003/035603、WO 2003/072100、WO 2003/074050、WO 2003/074051、WO 2003/074052、WO 2003/074495、WO 2003/084916、WO 2003/097607、WO 2004/000315、WO 2004/000762、WO 2004/005253、WO 2004/037776、WO 2004/060871、WO 2004/063165、WO 2004/063166、WO 2004/073606、WO 2004/080943、WO 2004/080947、WO 2004/092117、WO 2004/092130、WO 2004/093879、WO 2005/060958、WO 2005/097098、WO 2005/097762、WO 2005/097763、WO 2005/115383、WO 2006/055187、WO 2007/003581和WO 2007/071766(其中每一个的这些PPARδ激动剂化合物并入本文)。
在一些实施方案中,PPARδ激动剂是任何以下公开的专利申请中公开的PPARδ激动剂化合物:WO2014/165827;WO2016/057660;WO2016/057658;WO2017/180818;WO2017/062468;和WO/2018/067860(其中每一个的这些PPARδ激动剂化合物并入本文)。
在一些实施方案中,PPARδ激动剂是任何以下公开的专利申请中公开的PPARδ激动剂化合物:美国专利申请公开号20160023991、20170226154、20170304255和20170305894(其中每一个的这些PPARδ激动剂化合物并入本文)。
在一些实施方案中,PPARδ激动剂化合物是苯氧基烷基羧酸化合物。在一些实施方案中,苯氧基烷基羧酸化合物是2-甲基苯氧基烷基羧酸化合物。
在一些实施方案中,PPARδ激动剂化合物是苯氧基烷基羧酸化合物,即,苯氧基乙酸化合物、苯氧基丙酸化合物、苯氧基丙烯酸化合物、苯氧基丁酸化合物、苯氧基丁烯酸化合物、苯氧基戊酸化合物、苯氧基戊烯酸化合物、苯氧基己酸化合物、苯氧基己烯酸化合物、苯氧基辛酸化合物、苯氧基辛烯酸化合物、苯氧基壬酸化合物、苯氧基壬烯酸化合物、苯氧基癸酸化合物或苯氧基癸烯酸化合物。在一些实施方案中,PPARδ激动剂化合物是苯氧基乙酸化合物或苯氧基己酸化合物。在一些实施方案中,PPARδ激动剂化合物是苯氧基乙酸化合物。在一些实施方案中,苯氧基乙酸化合物是2-甲基苯氧基乙酸化合物。
在一些实施方案中,PPARδ激动剂化合物是苯氧基己酸化合物。
在一些实施方案中,PPARδ激动剂化合物是苯氧基乙酸化合物、((苯甲酰胺基甲基)苯氧基)己酸化合物、((杂芳基甲基)苯氧基)己酸化合物、甲基硫代苯氧基乙酸化合物或烯丙氧基苯氧基乙酸化合物。
在一些实施方案中,PPARδ激动剂化合物是((苯甲酰胺基甲基)苯氧基)己酸化合物。
在一些实施方案中,PPARδ激动剂化合物是((杂芳基甲基)苯氧基)己酸化合物。在一些实施方案中,PPARδ激动剂化合物是((咪唑基甲基)苯氧基)己酸化合物。在一些实施方案中,PPARδ激动剂化合物是咪唑-1-基甲基苯氧基己酸化合物。在一些实施方案中,PPARδ激动剂化合物是6-(2-((2-苯基-1H-咪唑-1-基)甲基)苯氧基)己酸。
在一些实施方案中,PPARδ激动剂化合物是烯丙氧基苯氧基乙酸化合物。在一些实施方案中,烯丙氧基苯氧基乙酸化合物是4-烯丙氧基-2-甲基苯氧基)乙酸化合物。
在一些实施方案中,PPARδ激动剂化合物是甲基硫代苯氧基乙酸化合物。在一些实施方案中,PPARδ激动剂化合物是4-(甲硫基)苯氧基)乙酸化合物。
在一些实施方案中,PPARδ激动剂化合物是选自下组的苯氧基烷基羧酸化合物:(Z)-[2-甲基-4-[3-(4-甲基苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吡唑-1-基)丙-1-炔基]苯基]-3-(4-三氟甲基苯基)-烯丙氧基]苯氧基]乙酸;(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸(化合物1);(E)-[2-甲基-4-[3-[4-[3-(吗啉-4-基)丙炔基]苯基]-3-(4-三氟甲基苯基)烯丙氧基]-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基苯基]-丙酸;{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苄硫基]-2-甲基-苯氧基}-乙酸;{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苯硫基]-2-甲基-苯氧基}-乙酸;以及{4-[3,3-双-(4-溴-苯基)-烯丙氧基]-2-甲基-苯氧基}-乙酸;(R)-3-甲基-6-(2-((5-甲基-2-(4-(三氟甲基)苯基)-1H-咪唑-1-基)甲基)苯氧基)己酸;(R)-3-甲基-6-(2-((5-甲基-2-(6-(三氟甲基)吡啶-3-基)-1H-咪唑-1-基)甲基)苯氧基)己酸;(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸(化合物1);2-{4-[({2-[2-氟-4-(三氟甲基)苯基]-4-甲基-1,3-噻唑-5-基}甲基)硫基]-2-甲基苯氧基}-2-甲基丙酸(索格列扎;GW677954);2-[2-甲基-4-[[3-甲基-4-[[4-(三氟甲基)苯基]甲氧基]苯基]硫]苯氧基]-乙酸;2-[2-甲基-4-[[[4-甲基-2-[4-(三氟甲基)苯基]-5-噻唑基]甲基]硫]苯氧基]-乙酸(GW-501516);[4-[[[2-[3-氟-4-(三氟甲基)苯基]-4-甲基-5-噻唑基]甲基]硫]-2-甲基苯氧基]乙酸(GW0742,也称GW610742);2-[2,6二甲基-4-[3-[4-(甲基硫)苯基]-3-氧代-1(E)-丙烯基]苯氧基]-2-甲基丙酸(elafibranor;GFT-505);{2-甲基-4-[5-甲基-2-(4-三氟甲基-苯基)-2H-[1,2,3]三唑-4-基甲基硫基]-苯氧基}-乙酸;以及[4-({(2R)-2-乙氧基-3-[4-(三氟甲基)苯氧基]丙基}硫基)-2-甲基苯氧基]乙酸(seladelpar;MBX-8025);(S)-4-[顺式-2,6-二甲基-4-(4-三氟甲氧基-苯基)哌嗪-1-磺酰基]-茚满-2-羧酸或其甲苯磺酸盐(KD-3010);(2s)-2-{4-丁氧基-3-[({[2-氟-4-(三氟甲基)苯基]羰基}氨基)甲基]苄基}丁酸(TIPP-204);[4-[3-(4-乙酰基-3-羟基-2-丙基苯氧基)丙氧基]苯氧基]乙酸(L-165,0411);2-(4-{2-[(4-氯苯甲酰基)氨基]乙基}苯氧基)-2-甲基丙酸(苯扎贝特);或其药学上可接受的盐。
在另一实施方案中,PPARδ激动剂是选自下组的2-甲基苯氧基烷基羧酸化合物:(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸(化合物1);2-{4-[({2-[2-氟-4-(三氟甲基)苯基]-4-甲基-1,3-噻唑-5-基}甲基)硫基]-2-甲基苯氧基}-2-甲基丙酸(索格列扎;GW677954);2-[2-甲基-4-[[3-甲基-4-[[4-(三氟甲基)苯基]甲氧基]苯基]硫]苯氧基]-乙酸;2-[2-甲基-4-[[[4-甲基-2-[4-(三氟甲基)苯基]-5-噻唑基]甲基]硫]苯氧基]-乙酸(GW-501516);[4-[[[2-[3-氟-4-(三氟甲基)苯基]-4-甲基-5-噻唑基]甲基]硫]-2-甲基苯氧基]乙酸(GW0742,也称GW610742);2-[2,6二甲基-4-[3-[4-(甲基硫代)苯基]-3-氧代-1(E)-丙烯基]苯氧基]-2-甲基丙酸(elafibranor;GFT-505);{2-甲基-4-[5-甲基-2-(4-三氟甲基-苯基)-2H-[1,2,3]三唑-4-基甲基硫基]-苯氧基}-乙酸;以及[4-({(2R)-2-乙氧基-3-[4-(三氟甲基)苯氧基]丙基}硫基)-2-甲基苯氧基]乙酸(seladelpar;MBX-8025)。
在另一实施方案中,PPARδ激动剂是选自下组的化合物:(S)-4-[顺式-2,6-二甲基-4-(4-三氟甲氧基-苯基)哌嗪-1-磺酰基]-茚满-2-羧酸或其甲苯磺酸盐(KD-3010);(2s)-2-{4-丁氧基-3-[({[2-氟-4-(三氟甲基)苯基]羰基}氨基)甲基]苄基}丁酸(TIPP-204);[4-[3-(4-乙酰基-3-羟基-2-丙基苯氧基)丙氧基]苯氧基]乙酸(L-165,0411);以及2-(4-{2-[(4-氯苯甲酰基)氨基]乙基}苯氧基)-2-甲基丙酸(苯扎贝特)。
在另一实施方案中,PPARδ激动剂是选自下组的化合物:索格列扎;洛贝格列酮(lobeglitazone);萘格列酮(netoglitazone);和爱沙列酮(isaglitazone);2-(4-{2-[(4-氯苯甲酰基)氨基]乙基}苯氧基)-2-甲基丙酸(苯扎贝特);2-[2-甲基-4-[[3-甲基-4-[[4-(三氟甲基)苯基]甲氧基]苯基]硫]苯氧基]-乙酸(参见WO 2003/024395);(S)-4-[顺式-2,6-二甲基-4-(4-三氟甲氧基-苯基)哌嗪-1-磺酰基]-茚满-2-羧酸或其甲苯磺酸盐(KD-3010);4-丁氧基-a-乙基-3-[[[2-氟-4-(三氟甲基)苯甲酰基]氨基]甲基]-苯丙酸(TIPP-204);2-[2-甲基-4-[[[4-甲基-2-[4-(三氟甲基)苯基]-5-噻唑基]甲基]硫]苯氧基]-乙酸(GW-501516);2-[2,6二甲基-4-[3-[4-(甲基硫)苯基]-3-氧代-1(E)-丙烯基]苯氧基]-2-甲基丙酸(GFT-505);{2-甲基-4-[5-甲基-2-(4-三氟甲基-苯基)-2H-[1,2,3]三唑-4-基甲基磺酰基]-苯氧基}-乙酸;以及[4-({(2R)-2-乙氧基-3-[4-(三氟甲基)苯氧基]丙基}硫基)-2-甲基苯氧基]乙酸(seladelpar;MBX-8025)。
在另一实施方案中,PPARδ激动剂是(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸(化合物1):
(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸的化学合成的示例可见于PCT申请公开号WO 2007/071766的实施例10。
化合物1对全部三种人PPAR亚型(hPPAR)进行了测试:hPPARα、hPPARγ和hPPARδ,使用测试这种活性的体外测定。相比于PPARα和PPARγ,化合物1对PPARδ表现出明显更高的选择性(分别高至少约100倍和至少约400倍)。在一些情况下,化合物1充当PPARδ的完全激动剂,但仅充当PPARα和PPARγ二者的部分激动剂。在一些情况下,化合物1在测试这种活性的反式激活测定中对PPARα和/或PPARγ显示出可忽略的活性。
在一些实施方案中,化合物1不显示任何人类视黄醇X受体(hRXR)活性,也未显示对核受体FXR、LXRα或LXRβ的活性。作为PPARδ的完全激动剂和PPARα和PPARγ二者的部分激动剂。
在一些实施方案中,PPARδ激动剂是(Z)-[2-甲基-4-[3-(4-甲基苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-苯氧基]乙酸:
(Z)-[2-甲基-4-[3-(4-甲基苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-苯氧基]乙酸的化学合成的示例可见于PCT申请公开号WO 2007/071766的实施例3。
在一些实施方案中,PPARδ激动剂是(E)-[2-甲基-4-[3-[4-[3-(吡唑-1-基)丙-1-炔基]苯基]-3-(4-三氟甲基苯基)-烯丙氧基]苯氧基]乙酸:
(E)-[2-甲基-4-[3-[4-[3-(吡唑-1-基)丙-1-炔基]苯基]-3-(4-三氟甲基苯基)-烯丙氧基]苯氧基]乙酸的化学合成的示例可见于PCT申请公开号WO 2007/071766的实施例4。
在一些实施方案中,PPARδ激动剂(E)-[2-甲基-4-[3-[4-[3-(吗啉-4-基)丙炔基]苯基]-3-(4-三氟甲基苯基)烯丙氧基]-苯氧基]乙酸:
(E)-[2-甲基-4-[3-[4-[3-(吗啉-4-基)丙炔基]苯基]-3-(4-三氟甲基苯基)烯丙氧基]-苯氧基]乙酸的化学合成的示例可见于PCT申请公开号WO 2007/071766的实施例20。
在一些实施方案中,PPARδ激动剂是(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸:
(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸的化学合成的示例可见于PCT申请公开号WO 2007/071766的实施例46。
在一些实施方案中,PPARδ激动剂是(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基苯基]-丙酸:
(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基苯基]-丙酸的化学合成的示例可见于PCT申请公开号WO 2007/071766的实施例63。
在一些实施方案中,PPARδ激动剂是{4-[3,3-双-(4-溴-苯基)-烯丙氧基]-2-甲基-苯氧基}-乙酸:
{4-[3,3-双-(4-溴-苯基)-烯丙氧基]-2-甲基-苯氧基}-乙酸的化学合成的示例可见于PCT申请公开号WO 2004/037776的实施例10。
在一些实施方案中,PPARδ激动剂是{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苄硫基]-2-甲基-苯氧基}-乙酸:
{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苄硫基]-2-甲基-苯氧基}-乙酸的化学合成的示例可见于PCT申请公开号WO 2007/003581的实施例9。
在一些实施方案中,PPARδ激动剂是{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苯硫基基]-2-甲基-苯氧基}-乙酸:
{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苯硫基]-2-甲基-苯氧基}-乙酸的化学合成的示例可见于PCT申请公开号WO 2007/003581的实施例35。
因此,在一个实施方案中,PPARδ激动剂是选自下组的化合物:(Z)-[2-甲基-4-[3-(4-甲基苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吡唑-1-基)丙-1-炔基]苯基]-3-(4-三氟甲基苯基)-烯丙氧基]苯氧基]乙酸;(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[2-甲基-4-[3-[4-[3-(吗啉-4-基)丙炔基]苯基]-3-(4-三氟甲基苯基)烯丙氧基]-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸;(E)-[4-[3-(4-氯苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基苯基]-丙酸;{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苄硫基]-2-甲基-苯氧基}-乙酸;{4-[3-异丁氧基-5-(3-吗啉-4-基-丙-1-炔基)-苯硫基]-2-甲基-苯氧基}-乙酸;以及{4-[3,3-双-(4-溴-苯基)-烯丙氧基]-2-甲基-苯氧基}-乙酸;或其药学上可接受的盐。
在进一步的实施方案中,PPARδ激动剂是(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸或其药学上可接受的盐。在一些实施方案中,PPARδ激动剂是(E)-[4-[3-(4-氟苯基)-3-[4-[3-(吗啉-4-基)丙炔基]苯基]烯丙氧基]-2-甲基-苯氧基]乙酸钠盐。
在进一步的实施方案中,PPARδ激动剂是化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、化合物14、化合物15或化合物16,公开于Wu等人,Proc Natl Acad Sci USA 2017年3月28日,114(13)E2563-E2570中。
在进一步的实施方案中,PPARδ激动剂是(R)-3-甲基-6-(2-((5-甲基-2-(4-(三氟甲基)苯基)-1H-咪唑-1-基)甲基)苯氧基)己酸或(R)-3-甲基-6-(2-((5-甲基-2-(6-(三氟甲基)吡啶-3-基)-1H-咪唑-1-基)甲基)苯氧基)己酸,或其药学上可接受的盐。
在进一步的实施方案中,PPARδ激动剂是(R)-3-甲基-6-(2-((5-甲基-2-(4-(三氟甲基)苯基)-1H-咪唑-1-基)甲基)苯氧基)己酸或其药学上可接受的盐。在一些实施方案中,PPARδ激动剂是(R)-3-甲基-6-(2-((5-甲基-2-(4-(三氟甲基)苯基)-1H-咪唑-1-基)甲基)苯氧基)己酸的半硫酸盐。在一些实施方案中,PPARδ激动剂是(R)-3-甲基-6-(2-((5-甲基-2-(4-(三氟甲基)苯基)-1H-咪唑-1-基)甲基)苯氧基)己酸的葡甲胺盐。
在进一步的实施方案中,PPARδ激动剂是(R)-3-甲基-6-(2-((5-甲基-2-(6-(三氟甲基)吡啶-3-基)-1H-咪唑-1-基)甲基)苯氧基)己酸或其药学上可接受的盐。在一些实施方案中,PPARδ激动剂是(R)-3-甲基-6-(2-((5-甲基-2-(6-(三氟甲基)吡啶-3-基)-1H-咪唑-1-基)甲基)苯氧基)己酸的半硫酸盐。在一些实施方案中,PPARδ激动剂是(R)-3-甲基-6-(2-((5-甲基-2-(6-(三氟甲基)吡啶-3-基)-1H-咪唑-1-基)甲基)苯氧基)己酸的葡甲胺盐。
在进一步的实施方案中,PPARδ激动剂是2-(2-甲基-4-(((2-(4-(三氟甲基)苯基)-2H-1,2,3-三唑-4-基)甲基)硫)苯氧基)乙酸或其药学上可接受的盐。
在进一步的实施方案中,PPARδ激动剂是(R)-2-(4-((2-乙氧基-3-(4-(三氟甲基)苯氧基)丙基)硫)苯氧基)乙酸或其药学上可接受的盐。
关于PPARδ激动剂的术语“药学上可接受的盐”是指PPARδ激动剂的盐,其不会对其所施用的哺乳动物造成明显刺激并且基本上不会消除化合物的生物活性和特性。Handbook of Pharmaceutical Salts:Properties,Selection and Use.International Union of Pure and Applied Chemistry,Wiley-VCH 2002.S.M.Berge,L.D.Bighley,D.C.Monkhouse,J.Pharm.Sci.1977,66,1-19.P.H.Stahl和C.G.Wermuth编,Handbook of Pharmaceutical Salts:Properties,Selection and Use,Weinheim/Zürich:Wiley-VCH/VHCA,2002。在一些实施方案中,药用盐比非离子物质在胃液和肠液中的溶解性通常更高并且溶解更快,因此可用于固体剂型。此外,因为它们的溶解度通常是pH值的函数,所以在消化道的一个或另一个部分中选择性溶解是可能的,在一些情况下,这种能力被作为延迟和持续释放行为的一个方面来操纵。此外,由于成盐分子在一些情况下与中性形式处于平衡状态,因此在一些情况下调节通过生物膜的通路。
在一些实施方案中,药学上可接受的盐通常通过使游离碱与合适的有机或无机酸反应或通过使酸与合适的有机或无机碱反应来制备。在一些实施方案中,该术语用于指代本发明的任何化合物。代表性盐包括以下盐:乙酸盐、苯磺酸盐、苯甲酸盐、碳酸氢盐、硫酸氢盐、酒石酸氢盐、硼酸盐、溴化物、依地酸钙、右旋樟脑磺酸盐、碳酸盐、氯化物、克拉维酸盐、柠檬酸盐、二盐酸盐、依地酸盐、乙二磺酸盐、丙酸酯月桂硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、葡糖酸盐、谷氨酸盐、羟乙酰氨基苯砷酸盐、己基间苯二酸盐、海巴明盐(hydrabamine)、氢溴酸盐、盐酸盐、羟基萘甲酸盐、碘化物、羟乙基磺酸盐、乳酸盐、乳糖醛酸盐、月桂酸盐、苹果酸盐、马来酸盐、扁桃酸盐、甲磺酸盐、甲基溴化物、甲基硝酸盐、甲基硫酸盐、马来酸单钾盐、粘酸盐、萘磺酸盐、硝酸盐、n-甲基葡糖胺、草酸盐、双羟萘酸盐(思波酸盐)、棕榈酸盐、泛酸盐、磷酸盐/二磷酸盐、聚半乳糖醛酸盐、钾盐、水杨酸盐、钠盐、硬脂酸盐、次乙酸盐、琥珀酸盐、鞣酸盐、酒石酸盐、茶氯酸盐、甲苯磺酸盐、三乙基碘化物(triethiodide)、三甲基铵和戊酸盐。当存在酸性取代基如-CO2H时,在一些情况下会形成铵盐、吗啉鎓盐、钠盐、钾盐、钡盐、钙盐等用作剂型。当存在碱性基团如氨基或碱性杂芳基如吡啶基时,在一些情况下会形成酸性盐,如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐、三氟乙酸盐、三氯乙酸盐、乙酸盐、草酸盐、马来酸盐、丙酮酸盐、丙二酸盐、琥珀酸盐、柠檬酸盐、酒石酸盐、富马酸盐、扁桃酸盐、苯甲酸盐、肉桂酸盐、甲磺酸盐、乙磺酸盐、苦味酸盐等,并且包括与Berge等人,Journal of Pharmaceutical Sciences,Vol.66(1),1-19页(1977)中列出的药学上可接受的盐相关的酸。
某些术语
除非另有说明,否则本申请中使用的以下术语具有以下给出的定义。术语“包括”以及其他形式的使用不是限制性的。本文使用的章节标题仅用于组织目的,不应被解释为限制所描述的主题。
如本文所用,关于制剂、组合物或成分的术语“可接受的”是指对被治疗的受试者的总体健康没有持续的有害影响。
如本文所用,术语“调节”是指直接或间接与靶标相互作用以改变靶标的活性,仅作为示例包括增强靶标的活性,抑制靶标的活性,限制靶标的活性,或扩展靶标的活性。
如本文所用,术语“调节剂”是指直接或间接与靶标相互作用的分子。相互作用包括但不限于激动剂、部分激动剂、反向激动剂、拮抗剂、降解剂或其组合的相互作用。在一些实施方案中,调节剂是拮抗剂。在一些实施方案中,调节剂是降解剂。
如本文所用,术语“施用”及类似词语是指在一些情况下能够将化合物或组合物递送至所需生物作用位点的方法。这些方法包括但不限于口服途径、十二指肠内途径、肠胃外注射(包括静脉内、皮下、腹膜内、肌肉内、血管内或输注)、局部和直肠施用。本领域技术人员熟悉可用于本文所述化合物和方法的施用技术。在一些实施方案中,本文所述的化合物和组合物口服施用。
如本文所用,术语“共同施用”等意在包括向单个患者施用所选择的治疗剂,并且旨在包括其中通过相同或不同施用途径或在同时或不同时间施用药剂的治疗方案。
如本文所用,术语“有效量”或“治疗有效量”是指施用的药剂或化合物的足量,其将在一定程度上缓解正在治疗的疾病或病况的一种或多种症状。结果包括减少和/或缓解疾病的体征、症状或原因,或生物系统的任何其他期望的改变。例如,用于治疗用途的“有效量”是提供疾病症状的临床显著减少所需的包含本文公开的化合物的组合物的量。在任何个别情况下,适当的“有效”量任选地使用例如剂量递增研究等技术确定。
如本文所用,术语“增强”是指增加或延长所需效果的效力或持续时间。因此,关于增强治疗剂的效果,术语“增强”是指在效力或持续时间方面增加或延长其他治疗剂对系统的效果的能力。如本文所用,“增强有效量”是指足以增强另一种治疗剂在所需系统中的效果的量。
如本文所用,术语“药物组合”是指由超过一种活性成分的混合或组合产生的产品,并且包括活性成分的固定和非固定组合。术语“固定组合”是指活性成分,例如本文所述的化合物或其药学上可接受的盐与共用药剂二者以单一实体或剂量的形式同时施用于患者。术语“非固定组合”是指活性成分,例如本文所述的化合物或其药学上可接受的盐与共用药剂剂作为单独的实体同时、并行或依次(没有特定的间隔时间限制)施用于患者,其中这样的施用在患者体内提供了两种化合物的有效水平。后者也适用于鸡尾酒疗法,例如三种或更多种活性成分的施用。
术语“试剂盒”和“制品”用作同义词。
术语“受试者”或“患者”包括哺乳动物。哺乳动物的示例包括但不限于哺乳动物类的任何成员:人,非人类灵长类动物如黑猩猩、以及其他猿和猴物种;农场动物,如牛、马、绵羊、山羊、猪;家养动物,如兔、狗和猫;实验室动物,包括啮齿类动物,例如大鼠、小鼠和豚鼠等。在一方面,哺乳动物是人。
如本文所用,术语“治疗”包括缓解、减轻或改善疾病或病况的至少一种症状,预防另外的症状,抑制疾病或病况,例如阻止疾病或病况的发展、缓解疾病或病况、引起疾病或病况的消退、缓解由疾病或病况引起的状况,或预防性和/或治疗性地停止疾病或病况的症状。
药物组合物
在一些实施方案中,将本文所述的化合物配制成药物组合物。使用一种或多种药学上可接受的无活性成分以常规方式配制药物组合物,这些无活性成分有助于将活性化合物加工成药用制剂。合适的配方取决于所选择的施用途径。例如,本文所述的药物组合物的综述可见于Remington:The Science and Practice of Pharmacy,第19版(Easton,Pa.:Mack Publishing Company,1995);Hoover,John E.,Remington’s Pharmaceutical Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.和Lachman,L.编,Pharmaceutical Dosage Forms,Marcel Decker,New York,N.Y.,1980;以及Pharmaceutical Dosage Forms and Drug Delivery Systems,第7版(Lippincott Williams&Wilkins1999)中,该公开内容通过引用并入本文。
在一些实施方案中,本文所述的化合物单独施用或在药物组合物中与药学上可接受的载体、赋形剂或稀释剂联合施用。在一些情况下,本文所述的化合物和组合物的施用通过能够将化合物递送至作用部位的任何方法来实现。这些方法包括但不限于经由肠内途径(包括口服、胃或十二指肠饲管、直肠栓剂和直肠灌肠剂)、肠胃外途径(注射或输注,包括动脉内、心内、皮内、十二指肠内、髓内、肌肉内、骨内、腹膜内、鞘内、血管内、静脉内、玻璃体内、硬膜外和皮下)、吸入、透皮、经粘膜、舌下、口腔和局部(包括表皮、皮肤、灌肠剂、滴眼剂、滴耳剂、鼻内、阴道)施用来递送,但在一些情况下,最合适的途径取决于例如接受者的病况和病症。仅举例来说,在一些情况下,本文所述的化合物通过例如手术期间的局部输注、局部施加例如乳膏或软膏、注射、导管或植入物而局部施用于需要治疗的区域。在一些情况下,施用是通过直接注射到病变组织或器官的部位。
在本发明的一些实施方案中,PPARδ激动剂包括在药物组合物中。如本文所用,术语“药物组合物”是指包含药物活性成分(例如PPARδ激动剂)和至少一种载体的液体或固体组合物,优选固体(例如,颗粒状粉末),其中所有成分在施用量下通常在生物学上是合乎需要的。
在一些情况下,掺入PPARδ激动剂的药物组合物采取药学上可接受的任何物理形式。特别优选的是用于口服施用的药物组合物。在此类药物组合物的一个实施方案中,掺入有效量的PPARδ激动剂。
在一些情况下,遵循通常用于药物科学的配制药物组合物的已知方法。考虑了所有常用类型的组合物,包括但不限于片剂、咀嚼片、胶囊和溶液。然而,PPARδ激动剂的量最好定义为有效量,即为需要此类治疗的受试者提供所需剂量的PPARδ激动剂的量。如本文所述的任何PPARδ激动剂均以任何所需的组合物形式配制。
在一些情况下,通过在胶囊中将PPARδ激动剂与合适的稀释剂混合并填充适量的混合物来制备胶囊。常用的稀释剂包括惰性粉状物质,如许多不同种类的淀粉、粉状纤维素,尤其是结晶和微晶纤维素,糖例如果糖、甘露醇和蔗糖、谷物面粉和类似的可食用粉末。
在一些情况下,通过直接压片、湿法制粒或干法制粒制备片剂。其配方通常包含稀释剂、粘合剂、润滑剂和崩解剂,以及PPARδ激动剂。典型的稀释剂包括例如各种类型的淀粉、乳糖、甘露醇、高岭土、磷酸钙或硫酸钙、无机盐例如氯化钠和糖粉。粉状纤维素衍生物也是有用的。典型的片剂粘合剂是诸如淀粉、明胶等物质和诸如乳糖、果糖、葡萄糖等糖。天然和合成树胶也很方便,包括阿拉伯树胶、藻酸盐、甲基纤维素、聚乙烯吡咯烷等。在一些情况下,聚乙二醇、乙基纤维素和蜡也可用作粘合剂。
在一些情况下,片剂制剂中的润滑剂有助于防止片剂和冲头粘在模具中。在一些情况下,润滑剂选自诸如滑石、硬脂酸镁和硬脂酸钙等固体、硬脂酸和氢化植物油。
片剂崩解剂是在润湿时溶胀以破碎片剂并释放化合物的物质。它们包括淀粉、粘土、纤维素、藻酸盐(align)和树胶。更具体地,例如,在一些情况下,使用玉米和马铃薯淀粉、甲基纤维素、琼脂、膨润土、木纤维素、粉状天然海绵、阳离子交换树脂、海藻酸、瓜尔胶、柑橘渣和羧甲基纤维素,以及十二烷基硫酸钠。
肠溶制剂通常用于保护活性成分免受胃中强酸性内容物的影响。此类制剂是通过用在酸性环境中不溶而在碱性环境中可溶的聚合物膜包衣固体剂型来产生的。示例性膜是邻苯二甲酸乙酸纤维素、聚醋酸乙烯邻苯二甲酸酯、羟丙基甲基纤维素邻苯二甲酸酯和醋酸羟丙基甲基纤维素琥珀酸酯。
片剂通常用作为调味剂和密封剂的糖包衣。在一些情况下,还通过在制剂中使用大量味道怡人的物质(例如甘露醇)将PPARδ激动剂配制成咀嚼片。
在一些情况下,使用透皮贴剂。通常,贴剂包含树脂组合物,其中活性化合物将溶解或部分溶解,并通过保护组合物的膜与皮肤保持接触。其他更复杂的贴剂组合物也可使用,特别是那些具有穿透有无数孔的膜的贴剂组合物,药物通过渗透作用被泵送通过所述孔。
在其中在药物组合物中包含PPARδ激动剂的任何实施方案中,此类药物组合物在一些情况下呈适合口服使用的形式,例如作为片剂、糖锭、锭剂、水性或油性悬浮液、可分散的粉剂或颗粒剂、乳剂、硬胶囊或软胶囊、糖浆或酏剂。在一些情况下,旨在用于口服使用的组合物是根据任何已知方法制备的,并且在一些情况下,此类组合物包含一种或多种选自甜味剂、调味剂、着色剂和防腐剂的试剂,以提供药学上优良且可口的制剂。在一些情况下,片剂含有与适用于制造片剂的药学上可接受的无毒赋形剂混合的活性成分。这些赋形剂包括例如惰性稀释剂,例如碳酸钙、碳酸钠、乳糖、磷酸钙或磷酸钠;造粒剂和崩解剂,例如玉米淀粉或海藻酸;粘合剂,例如淀粉、明胶或阿拉伯胶;和润滑剂,例如硬脂酸镁、硬脂酸或滑石粉。在一些情况下,片剂是未包衣的,或者在一些情况下,它们通过已知技术包衣以延迟在胃肠道中的崩解和吸收,从而提供更长时间的持续作用。例如,在一些情况下,使用延时材料如单硬脂酸甘油酯或二硬脂酸甘油酯。
给药方法和治疗方案
在一个实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)用于制备用于治疗哺乳动物的脂肪酸氧化障碍(FAOD)的药物。用于在需要此类治疗的哺乳动物中治疗本文所述的任何疾病或病况的方法涉及向所述哺乳动物施用包含治疗有效量的PPARδ激动剂(例如化合物1或其药学上可接受的盐)、活性代谢物、前药的药物组合物。
在某些实施方案中,施用含有本文所述化合物的组合物用于预防性和/或治疗性治疗。在某些治疗应用中,将组合物以足以治愈或至少部分阻止疾病或病况的至少一种症状的量施用至已罹患疾病或病况的患者。这种用途的有效量取决于疾病或病况的严重性和病程、先前的疗法、患者的健康状况、体重和对药物的反应,以及治疗医师的判断。治疗有效量任选地通过包括但不限于剂量递增和/或剂量范围临床试验的方法确定。
在预防性应用中,将含有PPARδ激动剂(例如化合物1或其药学上可接受的盐)的组合物施用于易患特定疾病、病症或病况或处于特定疾病、病症或病况风险中的患者。这样的量被定义为“预防有效量或剂量”。在这种用途中,精确的量还取决于患者的健康状况、体重等。当用于患者时,该用途的有效量将取决于疾病、病症或病况的严重性和病程、先前的疗法、患者的健康状况和对药物的反应,以及治疗医师的判断。在一方面,预防性治疗包括向哺乳动物(该哺乳动物以前经历过所治疗疾病的至少一种症状并且目前处于缓解期)施用包含PPARδ激动剂(例如化合物1或其药学上可接受的盐)的药物组合物,以防止疾病或病况的症状复发。
在其中患者的病况没有改善的某些实施方案中,根据医生的判断,PPARδ激动剂(例如化合物1或其药学上可接受的盐)的施用是长期施用的,即,持续一段延长的时间,包括在患者的整个生命期间,以改善或以其他方式控制或限制患者的疾病或病况的症状。
在其中患者的状态有改善的某些实施方案中,所施用的药物的剂量被暂时降低或暂时中止一段时间(即“药物假期”)。在特定实施方案中,药物假期的长度为2天至1年之间,以示例的方式包括2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天或超过28天。以示例的方式,在药物假期期间的剂量降低约10%-100%,以示例的方式包括约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%和约100%。
一旦患者的病况出现改善,则根据需要施用维持剂量。随后,在特定实施方案中,根据症状,将施用剂量或频率或两者降低至保持改善的疾病、病症或病况的水平。然而,在某些实施方案中,患者在任何症状复发时都需要长期的间歇性治疗。
在一方面,对于需要采用PPARδ激动剂(例如化合物1或其药学上可接受的盐)的疗法的患有FAOD的人,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用一次。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用两次。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用三次。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每隔一天施用一次。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每周施用两次。
在一些情况下,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用一次、每日施用两次、每日施用三次或更多次。在一些情况下,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用两次。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日、每天、每隔一天、每周5天、每周一次、每隔一周、每月两周、每月三周、每月一次、每月两次、每月三次,或更频繁施用。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用两次,例如,早晨和晚上。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)施用至少1天、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、18个月、2年、3年、4年、5年、10年或更久。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用两次,持续至少或约1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月或更久。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)每日施用一次、每日施用两次、每日施用三次、每日施用四次或每日施用多于四次,持续至少或约1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月或更久。
通常,用于治疗人的本文所述的疾病或病况的PPARδ激动剂(例如化合物1或其药学上可接受的盐)的剂量常在每剂约0.1mg/kg体重至约10mg/kg体重范围内。在一个实施方案中,所需剂量方便地以单一剂量或同时(或在短时间段内)或以适当间隔施用的分剂量提供,例如作为每日两个、三个、四个或更多个子剂量。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)方便地以每日一次同时(或在短时间段内)施用的分剂量提供。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)方便地以每日两次等份施用的分剂量提供。
在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)以每剂约0.1mg至约10mg/kg体重的剂量口服施用于人。
在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)以连续的给药时间表施用于人。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)以连续的每日给药时间表施用于人。
术语“连续给药时间表”是指以规则的时间间隔施用特定治疗剂。在一些实施方案中,连续给药时间表是指以规则间隔施用特定治疗剂,且没有来自特定治疗剂的任何药物假期。在一些其他实施方案中,连续给药时间表是指以循环方式施用特定治疗剂。在一些其他实施方案中,连续给药时间表是指在药物施用循环中施用特定治疗剂,然后是来自特定治疗剂的药物假期(例如,清除期或不施用药物的其他此类时间段)。例如,在一些实施方案中,治疗剂在一周中每日一次、每日两次、每日三次、每周一次、每周两次、每周三次、每周四次、每周五次、每周六次、每周七次、每隔一天、每三天、每四天、每日进行施用,随后一周不施用治疗剂;在两周中每日施用,随后一或两周不施用治疗剂;在三周中每日施用,随后一、二或三周不施用治疗剂;在四周中每日施用,随后一、二、三或四周不施用治疗剂;每周施用治疗剂,随后一周不施用治疗剂;或每两周施用治疗剂,随后两周不施用治疗剂。在一些情况下,每日施用是每日一次。在一些情况下,每日施用是每日两次。在一些情况下,每日施用是每日三次。在一些情况下,每日施用是每日超过三次。
术语“连续的每日给药时间表”是指每天在每日大致相同的时间每天施用特定的治疗剂。在一些情况下,每日施用是每日一次。在一些情况下,每日施用是每日两次。在一些情况下,每日施用是每日三次。在一些情况下,每日施用是每日超过三次。
在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)的量每日施用一次。在一些其他实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)的量每日施用两次。在一些其他实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)的量每日施用三次。
在其中未观察到人的疾病或病况状态改善的某些实施方案中,将PPARδ激动剂(例如化合物1或其药学上可接受的盐)的每日剂量提高。在一些实施方案中,每日一次给药时间表改变为每日两次给药时间表。在一些实施方案中,采用每日三次给药时间表来增加所施用的PPARδ激动剂(例如化合物1或其药学上可接受的盐)的量。在一些实施方案中,增加通过吸入施用的频率以在更规律的基础上提供重复的高Cmax水平。在一些实施方案中,增加施用频率以提供维持的或更规律的PPARδ激动剂(例如化合物1或其药学上可接受的盐)暴露。在一些实施方案中,增加施用频率以在更规律的基础上提供重复的高Cmax水平并提供维持的或更规律的PPARδ激动剂(例如化合物1或其药学上可接受的盐)暴露。
在任何前述方面是包括单次施用有效量的PPARδ激动剂(例如化合物1或其药学上可接受的盐)的进一步实施方案,包括如下的进一步实施方案:其中PPARδ激动剂(i)每日一次;或(ii)在一天的时间范围内多次施用。
在任何前述方面是包括多次施用有效量的PPARδ激动剂(例如化合物1或其药学上可接受的盐)的进一步实施方案,包括如下的进一步实施方案:其中(i)PPARδ激动剂在单个剂量中连续或间歇施用;(ii)多次施用之间的时间为每6小时;(iii)每8小时向哺乳动物施用PPARδ激动剂;(iv)每12小时向哺乳动物施用PPARδ激动剂;(v)每24小时向哺乳动物施用PPARδ激动剂。在进一步或替代的实施方案中,方法包括药物假期,其中PPARδ激动剂的施用暂时中止,或者所施用的PPARδ激动剂的剂量暂时降低;在药物假期结束时,PPARδ激动剂的给药恢复。在一个实施方案中,药物假期的长度从2天到1年不等。
通常,用于向人施用的PPARδ激动剂或其药学上可接受的盐的合适剂量将在约0.1mg/kg每日至约25mg/kg每日(例如约0.2mg/kg每日、约0.3mg/kg每日、约0.4mg/kg每日、约0.5mg/kg每日、约0.6mg/kg每日、约0.7mg/kg每日、约0.8mg/kg每日、约0.9mg/kg每日、约1mg/kg每日、约2mg/kg每日、约3mg/kg每日、约4mg/kg每日、约5mg/kg每日、约6mg/kg每日、约7mg/kg每日、约8mg/kg每日、约9mg/kg每日、约10mg/kg每日、约15mg/kg每日、约20mg/kg每日,或约25mg/kg每日)的范围内。替代地,用于向人施用的PPARδ激动剂或其药学上可接受的盐的合适剂量将在约0.1mg/日至约1000mg/日;约1mg/日至约400mg/日;或约1mg/日至约300mg/日的范围内。在其他实施方案中,用于向人施用的PPARδ激动剂或其药学上可接受的盐的合适剂量将为约1mg/日、约2mg/日、约3mg/日、约4mg/日、约5mg/日、约6mg/日、约7mg/日、约8mg/日、约9mg/日、约10mg/日、约15mg/日、约20mg/日、约25mg/日、约30mg/日、约35mg/日、约40mg/日、约45mg/日、约50mg/日、约55mg/日、约60mg/日、约65mg/日、约70mg/日、约75mg/日、约80mg/日、约85mg/日、约90mg/日、约95mg/日、约100mg/日、约125mg/日、约150mg/日、约175mg/日、约200mg/日、约225mg/日、约250mg/日、约275mg/日、约300mg/日、约325mg/日、约350mg/日、约375mg/日、约400mg/日、约425mg/日、约450mg/日、约475mg/日,或约500mg/日。在一些情况下,剂量每日施用超过一次(例如每日两次、三次、四次或更多次)。在一个实施方案中,用于向人施用的PPARδ激动剂或其药学上可接受的盐的合适剂量为约100mg每日两次(即总共约200mg/日)。在另一实施方案中,用于向人施用的PPARδ激动剂或其药学上可接受的盐的合适剂量为约50mg每日两次(即总共约100mg/日)。
在一些实施方案中,基于关于个体治疗方案的许多变量,每日剂量或剂型中活性物质的量低于或高于本文所示的范围。在各种实施方案中,每日剂量和单位剂量根据许多变量而改变,包括但不限于待治疗的疾病或病况、施用方式、个体受试者的要求、待治疗的疾病或病况的严重性、人的身份(例如,体重)和施用的特定附加治疗剂(如果适用),以及从业者的判断。
此类治疗方案的毒性和治疗功效通过细胞培养物或实验动物中的标准药学程序确定,包括但不限于LD50和ED50的确定。毒性作用与治疗作用的剂量比为治疗指数,用LD50与ED50的比值表示。在某些实施方案中,从细胞培养物测定和动物研究获得的数据用于制定用于哺乳动物(包括人)的治疗有效每日剂量范围和/或治疗有效单位剂量。在一些实施方案中,PPARδ激动剂的每日剂量在包括具有最小毒性的ED50的循环浓度范围内。在某些实施方案中,每日剂量范围和/或单位剂量在该范围内变化,取决于所采用的剂型和所采用的施用途径。
在一些实施方案中,在向受试者施用治疗有效剂量的PPARδ激动剂后,没有观察到不良作用的水平(NOAEL)为每千克体重至少1、10、20、50、100、500或1000mg(mpk)PPARδ激动剂。在一些示例中,被施用PPARδ激动剂的大鼠的7天NOAEL为至少约200、300、400、500、600、700、800、900、1000、1500或2000mpk。在一些示例中,被施用PPARδ激动剂的狗的7天NOAEL为至少约10、20、30、40、50、60、70、80、90、100、200、500mpk。
在一些实施方案中,用本文所述的PPARδ激动剂化合物(例如化合物1或其药学上可接受的盐)治疗哺乳动物的脂肪酸氧化障碍(FAOD)的方法导致一个或多个结果量度的改善。在一些实施方案中,结果量度包括但不限于患者报告的结果(PRO)、运动耐力、全身脂肪酸氧化(例如13CO2产生)、血液酰基肉碱谱和血液炎症细胞因子。在一些实施方案中,通常在施用PPARδ激动剂(例如化合物1或其药学上可接受的盐)之前确定基线评估。通过在用PPARδ激动剂化合物治疗期间进行的重复评估以及与基线评估和/或任何先前评估的比较来评估结果量度的改善。在一些实施方案中,改善至少或约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%。在一些实施方案中,本文所述的PPARδ激动剂(例如化合物1或其药学上可接受的盐)的改善为至少或约0.5X、1.0X、1.5X、2.0X、2.5X、3.0X、3.5X、4.0X、5.0X、6.0X、7.0X、8.0X、9.0X、10X或超过10X。在一些实施方案中,改善是与对照相比较。在一些实施方案中,对照是未接受PPARδ激动剂(例如化合物1或其药学上可接受的盐)的个体。在一些实施方案中,对照是未接受PPARδ激动剂(例如化合物1或其药学上可接受的盐)的全剂量的个体。在一些实施方案中,对照是个体在接受PPARδ激动剂(例如化合物1或其药学上可接受的盐)之前的基线。
在一些实施方案中,患者报告的结果(PRO)用问卷测量。在一些实施方案中,问卷涵盖与所治疗的病症相关的健康概念。在一些实施方案中,问卷涵盖与所治疗的病症相关的健康概念,例如但不限于:身体机能、身体疼痛、由于身体健康问题导致的角色限制、由于个人或情绪问题导致的角色限制、情绪状况、社会功能、精力/疲劳和总体健康认知,包括对健康变化的认知。
在一些实施方案中,结果量度通过评估运动耐力的测试来评估。在一些实施方案中,通过运动测试评估运动耐力。运动测试包括但不限于次极量跑步机、步行测试(例如但不限于6分钟;12分钟步行)、跑步测试、跑步机和测力运动测试。在一些实施方案中,运动测试与感知用力度博格量表结合使用。在一些实施方案中,运动测试根据美国胸科学会(ATS)提出的指南进行。
在一些实施方案中,测量呼吸交换率(RER)以评估运动耐力。RER是新陈代谢中产生的二氧化碳(CO2)量与使用的氧气(O2)之间的比率。在一些实施方案中,该比率是通过比较呼出气体与室内空气来确定的。
PPAR激动剂已在临床试验中表现出增加13CO2产生的能力(Gillingham,M.B.,等人,Journal of Inherited Metabolic Disease,第40卷,第6期,2017年11月,831-843;Riserus,U.,等人Diabetes 2008年2月;57(2):332-339;其各自的此类方案并入本文)。在一些实施方案中,稳定同位素方法用于测量体内残留脂肪酸氧化能力。13CO2的富集仅通过一轮完整的脂肪酸氧化发生。代表性方案如下。禁食过夜后获取禁食血样。早餐前,测量静息间接量热。然后给予受试者含有17-mg/kg 13C-油酸的膳食(例如奶昔)。在13C-油酸施用之前(时间0)和13C-油酸施用之后的1、2、3、4、5、6、7和8小时每小时收集呼吸样品。使用Delta Plus IRMS(Finnigan MAT,Bremen,德国)以13C/12C的比率测量呼吸样品中的13C。回收率计算为13C除以施用的13C剂量。呼吸中过量13C的量是对患有长链脂肪酸氧化障碍的受试者中残余脂肪酸氧化能力的量度。
在一些实施方案中,用合适的13CO2呼吸样品测试测量用本文所述的PPARδ激动剂化合物(例如化合物1或其药学上可接受的盐)治疗的患有FAOD的受试者中脂肪酸氧化的改善。在一些实施方案中,合适的13CO2呼吸样品测试包括以下步骤:1)为受试者提供包含富含13C的脂肪酸的膳食;2)在进食后向受试者施用PPARδ激动剂化合物或其药学上可接受的盐;以及3)以规律的间隔收集受试者的呼吸样品,并测量呼吸样品中13CO2与12CO2的相对量。在一些实施方案中,呼吸样品大约每小时收集一次。在一些实施方案中,膳食富含13C标记的脂肪酸,其中脂肪酸是丁酸、己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、山萮酸、木蜡酸、癸烯酸、月桂烯酸、肉豆蔻油酸、棕榈油酸、油酸、反油酸、反型异油酸、鳕油酸、芥酸、巴西烯酸、神经酸、亚油酸、α-亚麻酸、γ-亚麻酸、哥伦比亚酸、十八碳四烯酸、二十碳三烯酸、二高-γ-亚麻酸、花生四烯酸、二十碳五烯酸、二十二碳五烯酸或二十二碳六烯酸。
在一些实施方案中,本文描述了一种用于测量患有脂肪酸氧化障碍(FAOD)的人的全身脂肪酸氧化的方法,包括:给患有脂肪酸氧化障碍(FAOD)的人喂食包含富含13C的脂肪酸的膳食并测量从此人呼出的13CO2的量,其中患有脂肪酸氧化障碍(FAOD)的人正经历PPARδ激动剂化合物的治疗。
在一些实施方案中,本文描述了一种用于测量患有脂肪酸氧化障碍(FAOD)的人的全身脂肪酸氧化的变化的方法,包括以下步骤:1)提供富含13C标记的脂肪的膳食;2)将PPARδ激动剂化合物或其药学上可接受的盐施用于人;3)以规律的间隔从此人收集呼吸样品,并测量呼吸样品中13CO2的含量。
在一些实施方案中,呼吸样品中13CO2的量用作诊断以指导用PPARδ激动剂化合物治疗患有FAOD的受试者。例如,如果受试者或个体在施用PPARδ激动剂化合物后13CO2的量发生至少指定百分比或水平的变化,则受试者或个体继续使用本文所述的PPARδ激动剂(例如化合物1或其药学上可接受的盐)治疗。在一些实施方案中,呼吸样品中13CO2的中度增加可能需要增加向受试者施用的PPARδ激动剂化合物的量、增加施用PPARδ激动剂化合物的频率,或两者。
在一些情况下,13CO2的量的变化为相比于基线至少或约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%。在一些情况下,变化在开始用PPARδ激动剂化合物(例如化合物1或其药学上可接受的盐)治疗后的至少或约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、12小时、16小时、20小时、1天、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月或超过4个月发生。在一些情况下,如果在开始用PPARδ激动剂化合物(例如化合物1或其药学上可接受的盐)治疗后的至少或约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、12小时、16小时、20小时、1天、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月或超过4个月13CO2的量的变化为相比于基线至少或约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%,则继续包含PPARδ激动剂化合物(例如化合物1或其药学上可接受的盐)的治疗方案。在一些情况下,变化是13CO2的水平的增加。
在一些实施方案中,13CO2的量随时间的增加表明受试者响应于PPARδ激动剂化合物(例如化合物1或其药学上可接受的盐)。在一些情况下,如果以13CO2水平计13CO2的量的变化为相比于基线至少或约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%,则受试者响应于PPARδ激动剂化合物(例如化合物1或其药学上可接受的盐)。在一些情况下,在施用本文所述的PPARδ激动剂(例如化合物1或其药学上可接受的盐)后的至少或约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、12小时、16小时、20小时、1天、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月或超过4个月发生13CO2的量的变化。在一些情况下,如果在开始用PPARδ激动剂化合物(例如化合物1或其药学上可接受的盐)治疗后的至少或约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、12小时、16小时、20小时、1天、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月或超过4个月13CO2的量的变化为相比于基线至少或约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或超过95%,则受试者有响应。在一些情况下,变化是呼吸样品中13CO2的量随时间增加。
联合治疗
在某些情况下,将PPARδ激动剂(例如化合物1或其药学上可接受的盐)与一种或多种其他治疗剂联合施用是合适的。
在一个实施方案中,PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物的治疗效果通过施用佐剂而增强(即,佐剂本身的治疗益处较小,但与另一治疗药剂联合时,对患者的总的治疗益处被增强)。或者,在一些实施方案中,患者经历的益处通过施用PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物以及同样具有治疗益处的另一药剂(其还包括治疗方案)而增加。
在一个特定实施方案中,PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物与第二治疗剂共同施用,其中PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物和第二治疗剂调节所治疗的疾病、病症或病况的不同方面,由此提供比单独施用任一治疗剂更大的总体益处。
在任何情况下,无论所治疗的疾病、病症或病况如何,患者经历的总体益处是两种治疗剂的简单加和,或患者经历协同益处。
在某些实施方案中,当PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物与一种或多种另外的药剂(例如另外的治疗有效的药物、佐剂等)联合施用时,不同治疗有效剂量的PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物将用于配制药物组合物和/或用于治疗方案。在联合治疗方案中使用的药物和其他药剂的治疗有效剂量任选地通过与上文针对活性物本身所述的方式类似的方式确定。此外,本文所述的预防/治疗方法包括有节奏给药的使用,即提供更频繁的低剂量以最小化毒副作用。在一些实施方案中,联合治疗方案包括如下的治疗方案:其中PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物的施用在用本文所述的第二药剂治疗之前、期间或之后开始,并持续直到用第二药剂治疗期间的任何时间或用第二药剂治疗结束之后。还包括如下的治疗:其中PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物和联合使用的第二药剂同时施用,或在不同时间施用,和/或在治疗期间以减小或增大的间隔施用。联合治疗进一步包括周期性治疗,其在不同的时间开始和结束以帮助患者的临床管控。
应理解,用于治疗、预防或缓解有待减轻的病况的剂量方案根据许多因素(例如受试者所患的疾病、病症或状况;受试者的年龄、体重、性别、饮食和医疗状况)而变化。因此,在一些情况下,实际采用的剂量方案与本文所述的剂量方案不同,并且在一些实施方案中,脱离本文所述的剂量方案。
对于本文所述的联合疗法,共同施用的化合物的剂量是变化的,取决于所采用的共同药物的类型、所采用的具体药物、所治疗的疾病或病况等。在另外的实施方案中,当与一种或多种其他治疗剂共同施用时,PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物与一种或多种其他治疗剂同时施用或顺序施用。
在联合疗法中,多种治疗剂(其中一种是PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物)以任何顺序施用或甚至同时施用。如果同时施用,则仅举例而言,多种治疗剂以单个同一形式或多个形式提供(例如作为单个药丸或作为两个单独的药丸)。
PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物以及联合疗法在疾病或病况发生之间、期间或之后施用,并且施用包含PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物的组合物的时间可以变化。因此,在一个实施方案中,化合物I或其药学上可接受的盐或溶剂化物作为预防性药物使用,并且连续施用至倾向于发展出病况或疾病的受试者,以便防止疾病或病况的发生。在另一实施方案中,PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物在症状出现期间或之后尽快施用。在特定实施方案中,PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物在检测到或怀疑疾病或病况出现后在可行时尽快施用,并且持续治疗该疾病所需的时长。在一个实施方案中,治疗所需的时长是可变的,并且调整治疗时长以适应每个受试者的特定需要。例如,在特定实施方案中,PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物,或含有化合物1或其药学上可接受的盐或溶剂化物的制剂施用至少2周、约1个月至约5年。
用于联合疗法的示例性药剂
在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)与用于治疗脂肪酸氧化障碍的一种或多种另外的疗法联合施用。
在某些实施方案中,至少一种另外的疗法与PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物同时施用。在某些实施方案中,至少一种另外的疗法的施用频率低于PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物。在某些实施方案中,至少一种另外的疗法的施用频率超过PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物。在某些实施方案中,至少一种另外的疗法在PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物的施用之前施用。在某些实施方案中,至少一种另外的疗法在PPARδ激动剂(例如化合物1)或其药学上可接受的盐或溶剂化物的施用之后施用。
在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)与泛醇、泛醌、烟酸、核黄素、肌酸、L-肉碱、乙酰-L-肉碱、生物素、硫胺素、泛酸、吡哆醇、α-硫辛酸、正庚酸、CoQ10、维生素E、维生素C、甲基钴胺素、亚叶酸、白藜芦醇、N-乙酰基-L-半胱氨酸(NAC)、锌、亚叶酸/甲酰四氢叶酸钙或其组合联合施用。
在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)与琥珀酸或其盐,或三琥珀酰甘油或其盐联合施用。在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)与国际PCT公开号WO 2017/184583中所述的化合物联合施用。
在一些实施方案中,PPARδ激动剂(例如化合物I或其药学上可接受的盐)与抗氧化剂联合施用。
在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)与奇数链脂肪酸、奇数链脂肪酮、L-肉碱或其组合联合施用。
在一些实施方案中,PPARδ激动剂(例如化合物1或其药学上可接受的盐)与三庚酸甘油脂、正庚酸、甘油三酯,或其盐,或其组合联合施用。
在一些实施方案中,PPARδ激动剂与烟酰胺腺嘌呤二核苷酸(NAD )途径调节剂联合施用。NAD 在细胞内起许多重要作用,包括在由ADP生成ATP的氧化磷酸化中充当氧化剂。增加细胞内NAD 浓度将增强线粒体内的氧化能力,从而增加营养物氧化并促进能量供应,这是线粒体的主要作用。在一些实施方案中,NAD 调节剂靶向聚ADP核糖聚合酶(PARP)、氨基羧基粘康酸酯半醛脱羧酶(ACMSD)和N'-烟酰胺甲基转移酶(NNMT)。
试剂盒和制品
本文描述了用于治疗个体的脂肪酸氧化障碍(FAOD)的试剂盒,包括向所述个体施用PPARδ激动剂(例如化合物1或其药学上可接受的盐)。
对于在本文所述的治疗应用中的使用,本文还描述了试剂盒和制品。在一些实施方案中,此类试剂盒包括载体、包装或容器,其被区室化以容纳一个或多个容器,如小瓶、管等,每个容器包括用于本文所述方法的单独要素中的一个。合适的容器包括例如瓶、小瓶、注射器和试管。在一些情况下,容器由各种材料如玻璃或塑料形成。
本文提供的制品包含包装材料。药物包装材料的示例包括但不限于泡罩包装、瓶、管、吸入器、泵、袋、小瓶、容器、注射器、瓶,以及适用于所选制剂和预期施用和治疗模式的任何包装材料。本文提供的化合物和组合物的多种制剂被考虑作为用于受益于PPARδ调节的脂肪酸氧化障碍(FAOD)的任何治疗的多种治疗方式。
容器任选地具有无菌进入端口(例如容器是具有可被皮下注射针刺穿的塞子的静脉内溶液袋或小瓶)。此类试剂盒任选地包含化合物以及与其在本文所述的方法中的使用相关的标识描述或标签或说明。
试剂盒通常将包括一个或多个另外的容器,每个容器具有一种或多种从商业和用户角度来看对于本文所描述的化合物的使用所需的各种材料(例如试剂,任选地呈浓缩形式,和/或装置)。此类材料的非限制性实例包括但不限于缓冲液、稀释剂、过滤器、针头、注射器;载体、包装、容器、小瓶和/或列出内容物和/或使用说明的管标签,以及带有使用说明的包装插页。通常还将包括一组说明书。
在一些实施方案中,标签在容器上或与容器相关联。在一些情况下,当形成标签的字母、数字或其他字符附着、模制或蚀刻到容器本身时,标签位于容器上;在一些情况下,当标签存在于也容纳容器的器皿或载体中时,标签与容器相关联,例如作为包装插页。在一些情况下,标签用于说明将用于特定的治疗应用的内容物。在一些情况下,标签表明内容物例如在本文描述的方法中的使用说明。
在某些实施方案中,包含PPARδ激动剂(例如化合物1或其药学上可接受的盐)的药物组合物存在于包装或分配器装置中,其在一些情况下包含一种或多种单位剂型。在一些情况下,该包装例如包含金属或塑料箔,例如泡罩包装。在一些情况下,包装或分配器装置附有施用说明。在一些情况下,包装或分配器还附有与容器相关联的通知,其格式由监管药品制造、使用或销售的政府机构规定,该通知反映了该机构批准该药物形式用于人类或兽医施用。例如,在一些情况下,此类通知是美国食品和药物管理局批准的处方药标签或批准的产品插页。在一些情况下,还制备包含在相容的药物载体中配制的本文提供的化合物的组合物,将其置于合适的容器中,并标记用于治疗指定病症。
实施例
以下实施例仅出于说明的目的提供,并不限制本文提供的权利要求的范围。
实施例1:细胞系和培养
受试者在获得来自受试者和/或法定监护人的书面知情同意书的情况下,在临床上进行成纤维细胞培养物的皮肤活检。从患者的皮肤活检中获得具有与脂肪酸氧化障碍(FAOD)相关的任何一种基因和/或蛋白质的突变的成纤维细胞,同时从健康个体中获得野生型(WT)成纤维细胞。
在一些情况下,成纤维细胞获自已确认诊断为脂肪酸氧化障碍(FAOD)(例如MCAD、VLCAD、CPT1、CACT、CPT2、LCHAD和/或线粒体TFP缺陷或突变)的受试者,或者在一些情况下,它们是从商业来源购买的,例如购自科里尔医学研究所(403Haddon Avenue,Camden,New Jersey 08103)。
细胞培养和治疗使细胞在含有高葡萄糖水平的Dulbecco改良Eagle培养基(DMEM)(Corning Life Sciences,Manassas,VA)中或没有葡萄糖的DMEM中生长48-72小时。两种培养基都补充有胎牛血清、谷氨酰胺、青霉素和/或链霉素。在一些实验中,在分析参数之前,将成纤维细胞与N-乙酰半胱氨酸、白藜芦醇、mitoQ、Trolox(维生素E的水溶性类似物)或苯扎贝特一起温育。
将PPARδ激动剂化合物溶解在磷酸盐缓冲盐水PBS中,作为储备溶液。当培养物达到约85-90汇合时,将一定量的化合物直接适当地添加到烧瓶中的细胞培养基中。允许培养物在37℃下生长48小时,然后收获。将收获的细胞沉淀物储存在-80℃,直到进行免疫和酶测定分析。也将1mL至1.5mL培养基样品储存在-80℃用于酰基肉碱。
实施例2:测量线粒体呼吸
用Seahorse XFe96细胞外流量分析仪(Sea horse Bioscience,Billerica,MA)测量氧气消耗率(OCR)。
简而言之,设备含有对氧气浓度变化敏感的荧光团,其使得能够准确测量细胞色素c氧化酶(复合体IV)在OXPHOS期间将一个O2分子还原为两个H2O分子的速率。将细胞以80,000个细胞/孔的密度接种在96孔Seahorse组织培养微板中的生长介质中。为了确保细胞数目相同,将细胞接种在预包被有Cell-Tak(BD Biosciences,San Jose,CA)的细胞培养板中。所有细胞系都以每个细胞系四到八个孔测量。然后,重复整组实验。在运行Seahorse测定之前,在没有CO2的情况下在未缓冲的DMEM中将细胞温育1小时。测量初始OCR以建立基线(基础呼吸)。还在注射300nM羰基氰化物4-(三氟甲氧基)苯腙(FCCP)(Seahorse XF细胞线粒体压力试剂盒,Santa Clara,CA)后确定最大呼吸。
实施例3:ATP产生测定
ATP产生通过生物发光测定使用来自PerkinElmer Inc,Waltham,MA的ATP测定试剂盒(ATPlite试剂盒)根据制造商的说明来确定。
实施例4:蛋白质印迹
使细胞在T175烧瓶中生长,并在90-95%汇合时通过胰蛋白酶消化收获、沉淀并储存在-80℃用于蛋白质印迹。使用DCTM蛋白质测定试剂盒(Bio-Rad Laboratories)将样品中的蛋白质含量量化以进行数据标准化。
对于细胞裂解物,将沉淀物重悬于150–250μL具有蛋白酶抑制剂混合物(Roche Diagnostics,Mannheim,德国)的RIPA缓冲液中。将匀浆保持在冰上30min,每10min进行摇晃,并离心。上清液用于蛋白质印迹。对于线粒体,将沉淀物重悬在150–250μL含有250mM蔗糖、2mM EDTA、蛋白酶抑制剂混合物(Roche Diagnostics,Mannheim,德国)和0.5μM曲古菌素A(Sigma-Aldrich Co.,St.Louis,MO)的Tris缓冲液(pH 7.4)中,均质化并离心。丢弃沉淀物并离心上清液。将所得含有线粒体的沉淀物重悬在50mM Tris缓冲液(pH 7.4)中,超声处理并再次离心。
将细胞裂解物或线粒体如前所述用于蛋白质印迹(Goetzman,E.S.等人,Expression and characterization of mutations in human very long-chain acyl-CoA dehydrogenase using a prokaryotic system.Mol.Genet.Metab.91,138-147,(2007))。简而言之,将10或20μg蛋白质加载在凝胶上。电泳后,将凝胶印迹在硝化纤维素膜上,将该膜与以下各项温育:兔抗ND6多克隆抗体(1:100),Santa Cruz Biotechnology,Dallas,TX;兔抗NDUFV1多克隆抗体(1:100),Santa Cruz Biotechnology,Dallas,TX;兔抗ACAD9抗血清(1:500),Cocalico Biologicals Inc.,PA;啮齿动物抗总OXPHOS混合抗体(1:250),Abcam,Cambridge,MA;鼠抗线粒体融合蛋白1(MFN1)单克隆抗体(1:100),Abcam,Cambridge,MA;鼠抗发动蛋白相关蛋白1(DRP1)单克隆抗体(1:100),Abcam,Cambridge,MA;兔抗极长链酰基辅酶A脱氢酶(VLCAD)抗血清(1:1,000),Cocalico Biologicals Inc.,PA;兔抗电压依赖性阴离子通道1(VDAC1)单克隆抗体(1:1,000),Abcam,Cambridge,MA;鼠抗葡萄糖相关蛋白75(Grp75)单克隆抗体(1:250),Abcam,Cambridge,MA;兔抗葡萄糖相关蛋白78(Grp78)多克隆抗体(1:250),Abcam,Cambridge,MA;鼠抗DNA损伤诱导转录物3(DDIT3)单克隆抗体(1:250),Abcam,Cambridge,MA;山羊抗肌醇1,4,5-三磷酸受体3(IP3R)多克隆抗体(1:50),Santa Cruz Biotechnology,Dallas,TX;或IgG-HRP缀合抗体,Bio-Rad,Hercules,CA。用丽春红S(Sigma-Aldrich Co.,St.Louis,MO)或鼠β-肌动蛋白单克隆抗体(1:10,000)(Sigma-Aldrich Co.,St.Louis,MO)或鼠抗甘油醛3-磷酸脱氢酶(GAPDH)单克隆抗体(1:15,000)(Abcam,Cambridge,MA)对膜的染色被用于验证等量加载。
实施例5:免疫荧光显微术和线粒体膜电位(ΔΨ)
将细胞与抗体抗VLCAD(1:1000)、抗Nrf2(1:100)或抗NF-kB(1:1000)在4℃下温育过夜。用TBST短暂洗涤后,将细胞与来自Invitrogen的驴抗兔二抗Alexa Fluor 488一起温育。用DAPI对细胞核进行免疫染色。然后使用封固剂将盖玻片封固,之后使用Olympus Confocal FluoroView1000显微镜以60倍的放大率拍摄图像。
实施例6:脂肪酸氧化(FAO)通量分析
通过量化在24孔板中培养的成纤维细胞中从缀合至无脂肪酸白蛋白的9,10-[3H]棕榈酸酯(PerkinElmer,Waltham,MA)产生的3H2O的来进行脂肪酸氧化(FAO)通量分析。
FAO通量分析的代表性非限制性示例在Bennett,M.J.Assays of fatty acid beta-oxidation activity.Methods Cell Biol 80,179–197,(2007)中有述。在一些实施方案中,将300,000个成纤维细胞铺板在6孔板中的每孔中并使其在具有10%胎牛血清的DMEM中生长24小时。然后将生长培养基更换为相同的培养基或不含葡萄糖的该培养基,并且使成纤维细胞如所述生长48小时。随后,将细胞用PBS洗涤一次,然后在37℃下与在具有1μ/ml肉碱和2mg/mlα-环糊精的0.5mL无葡萄糖DMEM中制备的50nmol油酸酯中的0.34μCi[9,10-3H]油酸酯(45.5Ci/mmol;Perkin Elmer,Waltham,MA)温育2小时。将脂肪酸如所述用α-环糊精溶解(Watkins,P.A.,Ferrell,E.V.Jr.,Pedersen,J.I.&Hoefler,G.Peroxisomal fatty acid beta-oxidation in HepG2 cells.Arch Biochem Biophys 289,329–336(1991))。温育后,在含有750μL阴离子交换树脂(AG 1X 8,醋酸盐,100–200Mesh,BioRad,Richmond,CA)的柱上将释放的3H2O从油酸酯分离。在培养介质过柱后,用750μL水洗涤该板,该水也转移到柱中。然后用750μL水洗涤树脂两次。所有洗脱液都收集在闪烁小瓶中,并与5mL闪烁液(Eco-lite,MP)混合,然后在氚窗口中的贝克曼闪烁计数器中计数。进行一式四份测定,其中一式三份空白(无细胞孔)。标准品包含50μL等分的温育混合物,以及2.75mL的去离子水和5mL的闪烁液。
实施例7:细胞活力测定
采用3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺基苯基)-2H-四唑鎓(MTS)测定试剂盒根据制造商的说明(Abcam,Cambridge,MA)评价细胞活力。在FLUOstar Omega读板仪中在490nm处读取吸光度。
实施例8:凋亡测定
采用Alexa 488膜联蛋白V/死细胞凋亡试剂盒根据制造商的说明(Invitrogen,Grand Island,NY)评价凋亡。试剂盒含有标记有荧光团和碘化丙啶(PI)的膜联蛋白V。膜联蛋白V可以通过与暴露在细胞质膜外叶上的磷脂酰丝氨酸结合来识别凋亡细胞,而PI通过与核酸结合而对死细胞进行染色。在Becton Dickinson FACSAria II流式细胞仪(BD Biosciences,San Jose,CA)中测定荧光。
实施例9:确定酰基肉碱水平
酰基肉碱分析使用适当的串联质谱(MS/MS)方案进行。
实施例10:ETF荧光减少ACAD活性测定
已经描述了用于在组织和细胞培养物中以皮摩尔水平测量ACAD酶活性的酶测定。采用从猪肝中分离出的关键成分ETF(电子转移黄素蛋白)的测定方案已经被公开(Vockley等人,Mammalian branched-chain acyl-CoA dehydrogenases:molecular cloning and characterization of recombinant enzymes,Methods Enzymol.2000;324:241-58;其此类测定用过引用并入本文)。
实施例11:测量VLCAD表达水平
使用标准qRT-PCR方案监测增加量的PPARδ激动剂化合物对VLCAD缺陷或突变型细胞中ACADVL基因表达的影响。使用TaqManTM基因表达Master Mix(来自ThermoFisher Scientific),经由具有Applied Biosystems StepOnePlus的qRT-PCR来量化经或未经PPARδ激动剂化合物治疗的患者的具有VLCAD缺陷的成纤维细胞细胞系的ACADVL(MIM:609575)的信使RNA转录水平。参考样品是没有VLCAD缺陷的成纤维细胞。人GAPDH用作内源性对照。使用ACADVL和GAPDH的商业引物,并使用TaqManTM基因表达测定(ThermoFisher Scientific),其由一对未标记的PCR引物和一个TaqMan探针组成,该TaqMan探针在5'端带有FAMTM或VIC(R)染料标签并在3'端带有小沟结合物(MGB)和非荧光猝灭剂(NFQ)。比较了参考样品、经或未经PPARδ激动剂化合物治疗的经处理VLCAD缺陷细胞系之间样品的相对量RQ。
实施例12:联合疗法
PPARδ激动剂可以与用于脂肪酸氧化障碍(FAOD)的其他疗法联合使用。在一些实施方案中,将PPARδ激动剂化合物与以下中的一种或多种联合施用于患有FAOD的个体:泛醇、泛醌、烟酸、核黄素、肌酸、L-肉碱、乙酰-L-肉碱、生物素、硫胺素、泛酸、吡哆醇、α-硫辛酸、正庚酸、三庚酸甘油酯、甘油三酯、或其盐、CoQ10、维生素E、维生素C、甲基钴胺素、亚叶酸、N-乙酰基-L-半胱氨酸(NAC)、锌、亚叶酸/甲酰四氢叶酸钙。
当功效大于单独的任一药剂或当任一药物所需的剂量减少从而改善副作用谱时,联合治疗是有利的。
实施例13:脂肪酸氧化障碍的临床试验
下面描述了人的脂肪酸氧化障碍(FAOD)临床试验的非限制性示例。
目的:本研究的目的是:评估用化合物1或其药学上可接受的盐或溶剂化物对患有FAOD的受试者进行12周治疗的安全性和耐受性;研究化合物1或其药学上可接受的盐或溶剂化物在用化合物1或其药学上可接受的盐或溶剂化物治疗的患有FAOD的受试者中的药代动力学;研究化合物1或其药学上可接受的盐或溶剂化物在用化合物1或其药学上可接受的盐或溶剂化物治疗的患有FAOD的受试者中的药效学作用。
干预:患者以单药或组合方式被每日施用10-2000mg化合物1或其药学上可接受的盐或溶剂化物。在一个群组中,患者将接受50mg化合物1或其药学上可接受的盐或溶剂化物,每日一次总共12周。在另一群组中,患者将接受100mg化合物1或其药学上可接受的盐或溶剂化物,每日一次总共12周。考虑了其他群组。
化合物1或其药学上可接受的盐或溶剂化物将作为胶囊包装在瓶中。
具体说明:患者将被每日一次口服给予化合物1或其药学上可接受的盐或溶剂化物。
合格性:18岁以上,患有FAOD。
纳入标准:确诊以下之一:肉碱棕榈酰转移酶II缺乏症(CPT2)、极长链酰基辅酶A脱氢酶缺乏症(VLCAD)、长链3-羟酰基辅酶A脱氢酶缺乏症(LCHAD)或三功能蛋白缺乏症(TFP)。
在血液或培养的成纤维细胞中诊断的酰基肉碱谱。
基因分型中有至少一个等位基因不是终止密码子或移码。
尽管治疗,仍有以下临床表现中任一个的证据:由至少相隔3个月获得的高于ULN的至少2个血液CPK水平所证明的慢性升高的肌酸激酶(CPK)、心肌病史、入组前12个月内发生低血糖、横纹肌溶解或心肌病恶化的临床事件。
目前遵循避免禁食的稳定饮食方案,如筛选期间获得的3天饮食记录所证明的。
入组前至少30天有稳定的治疗方案。
整个研究中预期且愿意保持稳定饮食和医疗。
能走动且能够进行研究运动测试。
足够的肾功能,如使用Cockcroft-Gault公式估计的肾小球滤过率(eGFR)≥60mL/min/1.73m2所定义的。
能够服用胶囊。
排除标准:出现以下任一项的受试者将不会纳入研究:
-不稳定或未良好控制的疾病,如通过以下中的一项或多项确定的:超声心动图在筛选时有活动性或恶化心肌病的证据;存在急性横纹肌溶解症状,且血清CPK升高与肌病急性加重一致;来自其潜在疾病的急性危象的证据。
-目前服用抗凝剂。
-具有除了与脂肪酸氧化障碍相关的运动异常之外的可能干扰结果量度的运动异常。
-在1个月内或在5个半衰期内(取长者)用研究药物治疗。
-研究人员认为在研究期间可能需要改变管理或可能干扰本研究的实施或安全性的显著伴随临床疾病的证据。(对于控制良好的稳定慢性病况,如受控的高血压(BP<140/90mmHg)甲状腺疾病、控制良好的1型或2型糖尿病(HbA1c<8%)、高胆固醇血症、胃食管反流,或药物控制(除了三环类抗抑郁药)的抑郁症,只要症状和药物预计不会有损安全性或干扰本研究的测试和解释,则是可以接受的)。
-除原位皮肤癌之外的癌症病史
-在筛选前3个月内因任何重大医疗病况而住院(由主要研究者认定)。
-任何可能降低药物吸收的病况(例如,胃切除术)
-临床显著的肝病史,如通过ALT、GGT或TB升高所证明的。
-筛选时乙型肝炎表面抗原(HBsAg)或丙型肝炎或HIV阳性。
-在筛选的6个月内,每周定期饮酒超过14次(1次=150mL葡萄酒或360mL啤酒或45mL烈酒)的历史。
研究人员认为可能会增加与研究参与或研究产品施用相关的风险或可能干扰研究结果解释的任何其他严重的急性或慢性医学或精神病况或实验室异常。
主要结果量度:安全性终点包括:不良事件的次数和严重性。在以下中在第12周时的绝对值、相对于基线的变化发生以及临床显著变化发生率:实验室安全性测试;心电图;仰卧生命体征;特别感兴趣的事件(横纹肌溶解症)的评价,以及肌肉损伤实验室参数(包括总CPK、细胞醛缩酶和心脏特异性肌钙蛋白(cTn))的临床显著变化。
药代动力学终点包括:使用混合血浆的化合物1的血浆浓度和代谢物鉴别。
药效学终点包括:以下各项在第12周时绝对值和相对于基线的变化:全身脂肪酸氧化(13CO2产生)和血液酰基肉碱(UHPLC-MS/MS法)。
次要结果量度:在以下中评估在用化合物1或其药学上可接受的盐或溶剂化物治疗12周后相对于基线的变化:次最大跑步机运动耐力;在12分钟步行测试中行走的距离;36项简表调查(SF-36)总分和分量表(问题3-12)。疲劳影响量表评分(每次访视)相对于基线的变化。简明疼痛表(简短形式)(每次访视)相对于基线的变化。血液炎症细胞因子(sE-选择蛋白;GM-CSF;ICAM-1/CD54;IFNα;IFNγ;IL-1α;IL-1β;IL-4;IL-6;IL-8;IL-10;IL-12p70;IL-13;IL-17A/CTLA-8;IP-10/CXCL10;MCP-1/CCL2;MIP-1α/CCL3;MIP-1β/CCL4;sP-选择蛋白;TNFα的多重免疫测定)。
用化合物1得到的FAOD临床试验结果
总体来说,参与该研究的受试者对化合物1的耐受性良好。
在每日一次接受50mg化合物1或其药学上可接受的盐或溶剂化物共12周的受试者中观察到运动能力的改善。在12分钟步行测试期间,受试者能够增加步行距离。图1显示了化合物1对这组受试者的12分钟步行测试的影响的结果。在同一组受试者中,在运动的最后10分钟期间观察到心率下降。
在每日一次接受50mg化合物1或其药学上可接受的盐或溶剂化物共12周的受试者中观察到呼出13CO2增加的趋势。
本文描述的实施例和实施方案仅用于说明目的,并且向本领域技术人员建议的各种修改或改变都被包括在本申请的精神和范围内以及所附权利要求的范围内。
实施例14:序列
表1.肉碱穿梭基因
表2.肉碱穿梭蛋白质
表3.脂肪酸氧化循环基因
表4.脂肪酸氧化循环蛋白质
表5.辅助酶基因
表6.辅助酶
本文用于企业家、创业者技术爱好者查询,结果仅供参考。