1.本发明涉及医药材料领域,特别涉及去除同种或异种生物材料的免疫原性的方法。
背景技术:
2.心脏瓣膜疾病是一种具有高发病率及高致死率的疾病,全世界范围内心脏瓣膜疾病率随着老年化的日益加重,正逐年攀升,已成为世界范围内危及生命的主要医疗保健问题之一。晚期瓣膜性疾病导致丧失自我修复功能,瓣膜置换术成为唯一的手术选择。全世界每年进行近30万例瓣膜置换手术,预计到2050年这个数字将增加两倍。目前人造心脏瓣膜主要由机械心脏瓣膜和生物假体心脏瓣膜两大类型组成,并已广泛应用了几十年。两种人造瓣膜各有优缺点;机械瓣膜耐久高,可以达到二十年以上,但是其容易形成血栓,需要终生抗凝。而生物心脏瓣膜由于其较机械瓣膜有更低的血栓形成性,从而避免了终生抗凝的需要,并且能表现出与天然瓣膜相似的优良的血流动力学特性而越来越多地被临床采用,但是生物心脏的耐久性较差,使用寿命只有10
‑
15年,导致患者需承受再次开胸手术的痛苦。
3.生物心脏瓣膜耐久性较差的原因与生物瓣膜的免疫原性相关。由于生物瓣膜材料属于异种组织材料,不可避免的会有免疫原性,从而发生排斥反应。为了掩盖组织抗原性,异种组织瓣膜在植入前都要经过戊二醛固定。然而戊二醛存在众所周知的缺点,残存的戊二醛显示出阻止宿主细胞附着、迁移和增殖的细胞毒性作用从而增加钙化和组织疲劳的风险;此外戊二醛交联过后的生物瓣膜材料无法在体内生长和重塑,限制了其进一步的临床应用。如年轻人或者小孩随着生长,需要多次置换瓣膜,导致生活质量的严重下降。最近的研究表明,戊二醛固定后的抗原性掩盖是不完全的,会导致慢性移植物特异性免疫反应,从而限制了瓣膜的寿命。
4.来自异种组织的细胞往往被机体视为外来物,从而发生免疫排斥反应攻击外来细胞,导致细胞的失活和死亡,从而导致组织瓣膜的钙化和衰败。为了防止生物瓣膜的钙化和衰败,脱细胞化已被提出作为一种降低组织抗原性的方法,从而获得更好的组织相容性、重塑和长期持久性。
5.目前生物瓣膜的细胞去除方案,主要包括物理方法(如通过低渗和高渗反复交替、反复冻融、冷冻干燥、超高压等)、化学方法(高浓度的离子、非离子、两性离子洗涤剂(triton x
‑
100(曲那通x
‑
100),十二烷基硫酸钠(sds)、3
‑
[(3
‑
胆酰胺丙基)二甲基氨基]
‑1‑
丙磺酸盐(chaps)等)和酶的方法(胰蛋白酶和核酸酶(dnase和rnase)等)脱去细胞。
[0006]
目前国内外运用得最广的是洗涤剂加上酶法进行脱细胞,其中两性离子洗涤剂(triton x
‑
100(曲那通x
‑
100),十二烷基硫酸钠(sds)运用最广。
[0007]
虽然国内外有多种免疫原性去除的方法,但仍存在一些问题:(1)相应的化学试剂可引起细胞外基质三维结构的破坏,对脱细胞组织的力学性能有负面影响;(2)目前的处理方法无法满足生物瓣膜免疫原性去除的要求,残留的碱基以及细胞外基质抗原依然会引起
免疫反应;(3)其相应的处理时间持续较长,特别是单一或者仅两者方法结合的,其处理过程均在一周以上。
[0008]
因此,如何快速高效的去除异种生物瓣膜的细胞成分及免疫原性,维持异种生物瓣膜完整的细胞外基质结构,并保证其良好的生物力学性能,具有重要的现实意义。
技术实现要素:
[0009]
有鉴于此,本发明采用新型两性离子去污剂烷基聚氧乙烯醚硫酸钠(aes)进行生物瓣膜的免疫原性去除处理。
[0010]
为了实现上述发明目的,本发明提供以下技术方案:
[0011]
本发明提供的去除同种或异种生物材料的免疫原性的方法,包括如下步骤:
[0012]
步骤1:取同种或异种生物材料经第一漂洗后,与杀菌剂混合,获得杀菌后的生物材料;
[0013]
步骤2:取步骤1制得的所述杀菌后的生物材料与洗涤剂混合,经第二漂洗后再分别经dna酶和rna酶处理,经第三漂洗,保存,灭菌;
[0014]
所述洗涤剂包括aes。
[0015]
在本发明的一些具体实施方案中,所述杀菌剂包括新洁尔灭。
[0016]
在本发明的一些具体实施方案中,所述杀菌剂的浓度为0.1%。
[0017]
在本发明的一些具体实施方案中,所述洗涤剂包括含抗生素的pbs配制的3%aes;所述杀菌后的生物材料与所述洗涤剂的质量体积比为1:5;所述抗生素包括青霉素和链霉素,所述青霉素的浓度包括100u/ml;所述链霉素的浓度包括100μg/ml。
[0018]
在本发明的一些具体实施方案中,步骤2所述混合具体为:于37℃下处理24h,每12h换液一次。
[0019]
在本发明的一些具体实施方案中,步骤2中所述dna酶的浓度包括2~3u/ml;所述rna酶的浓度包括0.02~0.03mg/ml,所述rna酶还包括2.5mm的mg
2
和0.1mm的ca
2
。
[0020]
在本发明的一些具体实施方案中,步骤2中所述处理具体为:37℃震荡处理24h,每12h换液一次。
[0021]
在本发明的一些具体实施方案中,步骤1或步骤2中的所述漂洗采用的漂洗剂包括抗生素无菌pbs液或无菌蒸馏水,所述抗生素无菌pbs液中抗生素包括青霉素和链霉素,所述青霉素的浓度包括100u/ml;所述链霉素的浓度包括100μg/ml;
[0022]
所述第一漂洗的次数至少为3次,每次10min;
[0023]
所述第二漂洗的次数至少为3次,每次10min,漂洗的同时摇动洗去残余的aes;
[0024]
所述第三漂洗具体为:25℃
±
5℃下漂洗24h,每8h换液一次。
[0025]
基于上述研究,本发明还提供了所述的方法制得的同种或异种生物材料。
[0026]
本发明还提供了所述的同种或异种生物材料在制备治疗疾病的生物材料中的应用。
[0027]
本发明采用洗涤剂和酶结合的方法,充分利用新型洗涤剂的破膜和溶解蛋白的优势,同时利用核酶的特异性分解作用,有效去除细胞成分和细胞外基质抗原物质。达到时间短,去除免疫原性效果好的优势。
附图说明
[0028]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0029]
图1示aes处理后的he染色结果;
[0030]
图2示tritonx
‑
100处理后的he染色结果;
[0031]
图3示dna含量检测结果;
[0032]
图4示通过新型去污剂aes对牛心包的免疫原性去除率;
[0033]
图5示通过tritonx
‑
100对牛心包的免疫原性去除率;
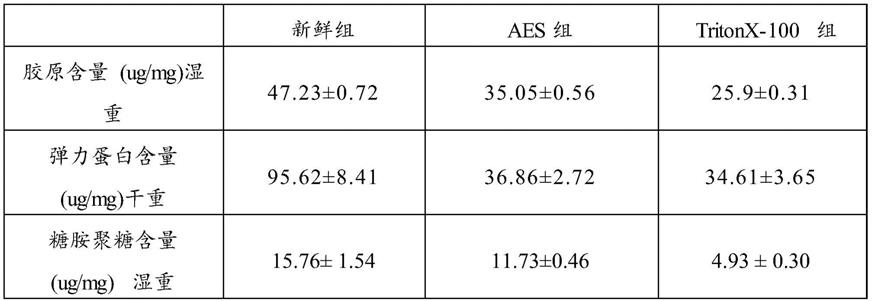
[0034]
图6示厚度的检测结果;
[0035]
图7示弹性模量的检测结果;
[0036]
图8示最大拉伸应力的检测结果;
[0037]
图9示热皱缩温度的检测结果;
[0038]
图10示胶原含量湿重的的检测结果;
[0039]
图11示弹力蛋白含量干重的的检测结果;
[0040]
图12示糖胺聚糖含量湿重的的检测结果;
[0041]
图13示aes处理56天牛心包大鼠皮下包埋模型;
[0042]
图14示tritonx
‑
100处理大鼠皮下包埋模型;
[0043]
图15示aes大鼠皮下模型he染色8周;
[0044]
图16示tritonx
‑
100大鼠皮下模型he染色8周。
具体实施方式
[0045]
本发明公开了去除同种或异种生物材料的免疫原性的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
[0046]
本发明一种新型生物瓣膜免疫原性去除方案是按以下步骤操作:
[0047]
1)样品制备:牛心包由当地屠宰场提供,标本在屠宰场采集。取出样品后侵入预冷的pbs溶液中保存,于4小时内运送至实验室。含抗生素无菌pbs液(青霉素和链霉素,浓度分别为100u/ml,100ug/ml)清洗多次,浸入0.1%新洁尔灭30min,含抗生素无菌pbs冲洗心包10min x 3次,低温4℃保存。
[0048]
2)免疫原性去除处理:50ml无菌离心管加入使用含抗生素的pbs配制的3%aes约35ml,将材料放于离心管中,盖上盖子,37℃下处理24小时,每12小时换液一次。使用含抗生素的无菌pbs液漂洗10min x3次并摇动洗去残余的aes溶液;3u/ml的dna酶/0.03mg/ml的rna酶(加2.5mm的mg
2
、0.1mm的ca
2
)37℃震荡处理24小时,每12小时换液一次。室温下使用含抗生素的无菌pbs液漂洗24小时,每8小时换液一次。
[0049]
3)保存灭菌:置入75%酒精中保存,密闭封口,竖立存放,25kgyγ射线照射灭菌。
[0050]
所述的制备方法中,其关键点在于洗涤剂和酶的结合方法,利用洗涤剂的初步作用后,细胞外基质抗原被去除,细胞膜破裂,细胞基本破碎,大部分细胞成分也被冲洗掉,但
是还有细胞核的染色体、dna、rna、破碎的磷脂等小物质停留在生物材料内,需要进一步的dnase
‑
i及rnase
‑
a作用,去除绝大部分的核酸物质;最后再通过反复的无菌pbs溶液漂洗,去除残留的碱基片段,达到满意的免疫原性去除效果。
[0051]
所述的制备方法中,其关键点在于新洁尔灭浸泡。本发明中,新洁尔灭浸泡可以起到较好的杀菌效果,防止后续处理和保存过程中出现细菌的污染。
[0052]
所述的制备方法中,其关键点在于洗涤剂的浓度和作用时间和温度:在生物瓣膜免疫原性去除过程中,这些参数的调整取决去所选材料的种类和材料的部位,对于生物材料的细胞含量不同,组织结构致密程度的不同,可以相应的上调或下调各浓度、时间和温度,达到最佳的免疫原性去除效果。
[0053]
所述的制备方法中,核酶使用其关键点在于其浓度(2
‑
3u/mldnase
‑
i及0.02
‑‑
0.03mg/ml rnase
‑
a)和工作时间18h到24h左右。具体浓度和时间的选择根据所选材料的特性决定。核酶的处理过程中,需注意浓度和作用时间,过高的浓度和过久的时间可以导致细胞外基质结构的损害。
[0054]
本发明提供的去除同种或异种生物材料的免疫原性的方法中,所用原料及试剂均可由市场购得。
[0055]
下面结合实施例,进一步阐述本发明:
[0056]
实施例1前期处理
[0057]
牛心包由当地屠宰场提供,标本在屠宰场采集。取出样品后侵入预冷的pbs溶液中保存,于4小时内运送至实验室。含抗生素无菌pbs液(青霉素和链霉素,浓度分别为100u/ml,100ug/ml)清洗多次,浸入0.1%新洁尔灭30min,含抗生素无菌pbs冲洗心包10min x 3次,低温4℃保存。
[0058]
实施例2样品修剪
[0059]
用放大镜观察有无明显刀伤,剪去所有不符合要求的区域,用剪刀、镊子仔细拨除材料基质上的脂肪组织,镊子与材料平行夹取,以免损伤材料,此过程动作应尽量轻柔,最大限度的保护组织纤维不被破坏,以免影响其力学性能。
[0060]
实施例3免疫原性去除处理
[0061]
50ml无菌离心管加入使用含抗生素的pbs配制的3%aes约35ml,将材料放于离心管中,盖上盖子,37℃下处理24小时,每12小时换液一次。使用含抗生素的无菌pbs液漂洗10min x3次并摇动洗去残余的aes溶液;3u/ml的dna酶/0.03mg/ml的rna酶(加2.5mm的mg
2
、0.1mm的ca
2
)37℃震荡处理24小时,每12小时换液一次。室温下使用含抗生素的无菌pbs液漂洗24小时,每8小时换液一次。
[0062]
实施例4保存灭菌
[0063]
置入75%酒精中保存,密闭封口,竖立存放,25kgyγ射线照射灭菌。
[0064]
对比例
[0065]
将实施例3中的aes替换为tritonx
‑
100,其余操作同实施例1~实施例4。
[0066]
结果例1
[0067]
组织学染色
[0068]
he染色:样品在4%多聚甲醛中浸泡1d,然后埋入石蜡中进行切片。h&e染色用于定性评估脱细胞效果和观察组织大体结构。
[0069]
定量化学分析
[0070]
分别用dna检测试剂盒、羟脯氨酸检测试剂盒(南京建工a030
‑2‑
1中国).dmmb检测试剂盒(genmed gms19239.2 usa).弹力蛋白检测试剂盒(biocolor uk)对每个样品的dna含量、ecm的三种主要成分胶原、弹性蛋白和gag进行定量,详见说明书。在上述实验中,每组测试6个样本。
[0071]
抗天然牛心包血清的产生
[0072]
参考leigh g.griffiths方案,所有操作均按照中南大学湘雅二医院动物护理和使用指南进行。抗牛心包血清是用均质新鲜牛心包免疫新西兰大白兔(n=6),在84天收集血清,在
‑
80℃保存。
[0073]
抗原检测
[0074]
采用elisa法检测残留蛋白提取物的抗原性。用兔抗天然牛心包血清进行检测。
[0075]
力学性能测试
[0076]
将各组材料裁剪成1cm*5cm长条状(n=20),应用电子拉力测验机(美国,instron,电子万能材料试验机),测量并记录每个样品的厚度和拉伸长度。设定拉伸速率为50mm/min,得到每个样品的应力
‑
应变曲线图,再计算出材料的弹性模量(mpa)、最大拉伸应力(mpa)。
[0077]
热稳定性能测试
[0078]
将各组材料裁剪成1cm*5cm长条状(n=5),以蒸馏水为介质,从20℃开始加热,每分钟升高5℃,应用hg
‑
1皮革收缩温度测试仪(四川成都大承兴数字系统公司)测定。
[0079]
皮下包埋
[0080]
动物实验按照中南大学湘雅二医院动物保护与使用委员会指南进行。将样品切成1
×
1cm的薄片,经辐照灭菌,然后用灭菌过的pbs彻底冲洗。每只sd大鼠随机皮下植入1组样本(每组6个)。先将200g雄性大鼠腹腔注射戊巴比妥钠麻醉(剂量为1ml kg
‑
1),剃去大鼠背部毛发。用手术剪刀在每只老鼠的背部创建1个手术切口。植入后,手术缝合切口。植入56天后,取出样品,用4%多聚甲醛固定以进一步表征。
[0081]
如图1、图2所示,aes处理后光镜下未见明显细胞核存在,且纤维排列规则。而tritonx
‑
100处理后光镜下可见少许细胞核以及核碎片存在。
[0082]
如图3所示,经免疫原性去除处理后,生物组织材料的dna残留量显著降低,达到中华人民共和国医药行业标准(<100ng/mg)。且aes处理和triton处理dna含量有明显差异。
[0083]
如图4、图5所示,过新型去污剂aes对牛心包的免疫原性去除率可达到94%以上。与之相比,tritonx
‑
100对于抗原的去除率仅有80%左右。
[0084]
表1 力学性能数据
[0085] 新鲜组aes组triton组厚度(mm)0.51
±
0.050.49
±
0.130.603
±
0.14弹性模量(mpa)160.52
±
33.78210
±
52.55175.14
±
39.81最大拉伸应力(mpa)15.81
±
3.5619.79
±
4.7012.76
±
5.18热皱缩温度(℃)68.8
±
0.269.44
±
0.2568.84
±
0.32
[0086]
统计学结果已经在图中表示,*表示p<0.05,**表示p<0.01
[0087]
表1结果表明:aes处理后力学性能各指标未降低,甚至还有略微增加,维持了良好
的力学性能。与triton相比有明显的力学和热皱缩优势。
[0088]
表2 细胞外基质含量:
[0089][0090]
统计学结果已经在图中表示,*表示p<0.05,**表示p<0.01
[0091]
图6~12以及表2结果表明:aes处理后细胞外基质含量除了弹力蛋白有所下降,胶原和糖胺聚糖未出现大幅度下降,与triton方案比有比较大优势。
[0092]
结果例2
[0093]
动物实验按照中南大学湘雅二医院动物保护与使用委员会指南进行。将样品切成1
×
1cm的薄片,经辐照灭菌,然后用灭菌过的pbs彻底冲洗。每只sd大鼠随机皮下植入样本。先将200g雄性大鼠腹腔注射戊巴比妥钠麻醉(剂量为1mlkg
‑
1),剃去大鼠背部毛发。用手术剪刀在每只老鼠的背部创建1个手术切口。植入后,手术缝合切口。植入56天后,取出样品,用4%多聚甲醛固定以进一步表征。
[0094]
图13示aes处理56天牛心包大鼠皮下包埋模型;图14示tritonx
‑
100处理大鼠皮下包埋模型,可见组织有部分降解。表明aes相比tritonx
‑
100局部炎症反应较轻,降解较少,组织植入较稳定,未见明显排斥。
[0095]
图15示aes大鼠皮下模型he染色8周:可见大量成纤维细胞的浸润,表示具有良好的生物相容性。未见明显的纤维囊出现,表示炎症反应低。有利于未来生物瓣膜的长久植入和再生。图16示tritonx
‑
100大鼠皮下模型he染色8周:可见大量纤维囊出现,表示炎症反应明显。纤维囊可以反应局部炎症反应的程度,并且阻碍组织的再生。
[0096]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。