多隔室大胶囊装置
1.相关申请的交叉引用
2.本技术根据美国法典第35篇第119条(e)款要求2019年4月3日提交的美国临时申请序列号62/828,915的权益,所述临时申请的公开内容以引用的方式整体并入本文。
技术领域
3.所公开的实施方案涉及多隔室大胶囊装置。
背景技术:
4.递送生物产物的治疗装置可用于治疗代谢障碍,诸如糖尿病。治疗装置可能够植入以在延长时间段内提供生物产物,诸如胰岛素。这些装置中的一些包括用于将用于产生期望生物产物的细胞、包含细胞的基质或其内的其他期望治疗剂容纳在其内的大胶囊装置。
技术实现要素:
5.在一个实施方案中,一种大胶囊装置包括:第一外膜、第二外膜和设置在所述第一外膜与所述第二外膜之间的第一半可透性膜。一级隔室由所述第一半可透性膜和所述第一外膜形成,并且所述一级隔室被构造来容纳第一细胞群。二级隔室由所述第一半可透性膜和所述第二外膜形成。所述一级隔室和所述二级隔室穿过所述第一半可透性膜流体连通。
6.在另一个实施方案中,一种大胶囊装置包括:一级隔室,所述一级隔室被构造来容纳第一细胞群;以及二级隔室。所述一级隔室和所述二级隔室穿过设置在所述一级隔室与所述二级隔室之间的第一半可透性膜流体连通。
7.在又另一个实施方案中,一种使用大胶囊装置的方法包括:将第一细胞群装载到大胶囊装置的一级隔室中;以及在所述一级隔室与所述大胶囊装置的二级隔室之间施加压差,以使滤液穿过第一半可透性膜从所述一级隔室流动到所述二级隔室。
8.在又另一实施方案中,一种使用大胶囊装置的方法包括:将第一细胞群装载到大胶囊装置的一级隔室中;以及使辅助剂穿过第一半可透性膜从所述大胶囊装置的二级隔室流入所述一级隔室。
9.本文提供的另一方面是一种植入式大胶囊装置,所述装置包括:第一外膜;第二外膜;以及第一半可透性膜,所述第一半可透性膜附接在所述第一外膜与所述第二外膜之间;其中所述第一半可透性膜和所述第一外膜连接以形成一级隔室,所述一级隔室被构造来提供用于容纳细胞群的一级隔室;其中所述第一半可透性膜和所述第二外膜连接以形成二级隔室;其中所述细胞群包括胰腺祖细胞、内分泌细胞或β细胞或其任何组合;并且其中所述装置包括穿过所述第一外膜、所述第二外膜和所述第一半可透性膜的多个通孔。在一些实施方案中,所述第一外膜、所述第二外膜和所述第一半可透性膜被构造来阻挡所述细胞群离开所述装置。
10.在一些实施方案中,所述装置还包括:第二半可透性膜,所述第二半可透性膜附接
在所述第一半可透性膜与所述第二外膜之间以在所述一级隔室与所述二级隔室之间形成三级隔室。在一些实施方案中,所述第一半可透性膜的液压渗透率大于所述第一外膜的液压渗透率、所述第二外膜的液压渗透率或两者。在一些实施方案中,所述第一半可透性膜的液压渗透率比所述第一外膜的液压渗透率、所述第二外膜的液压渗透率或两者大至少约25%。在一些实施方案中,所述第一半可透性膜的液压渗透率大于所述第二半可透性膜的液压渗透率。在一些实施方案中,所述第一半可透性膜的液压渗透率小于所述第二半可透性膜的液压渗透率。在一些实施方案中,所述第一半可透性膜的孔隙率大于所述第一外膜的孔隙率、所述第二外膜的孔隙率或两者。在一些实施方案中,所述第一半可透性膜的孔隙率比所述第一外膜的孔隙率、所述第二外膜的孔隙率或两者大至少约25%。在一些实施方案中,所述第一半可透性膜的孔隙率大于所述第二半可透性膜的孔隙率。在一些实施方案中,所述第一半可透性膜的孔隙率小于所述第二半可透性膜的孔隙率。在一些实施方案中,对于给定材料和偏压(例如,浓度梯度和/或压差),第一半可透性膜的通量大于对于相同材料和偏压,第一外膜的通量、第二外膜的通量或两者。在一些实施方案中,对于给定材料和偏压(例如,浓度梯度和/或压差),第一半可透性膜的通量比对于相同材料和偏压,第一外膜的通量、第二外膜的通量或两者大至少约25%。在一些实施方案中,对于给定材料和偏压(例如,浓度梯度和/或压差),第一半可透性膜的通量大于对于相同材料和偏压,第二半可透性膜的通量。在一些实施方案中,对于给定材料和偏压(例如,浓度梯度和/或压差),第一半可透性膜的通量小于对于相同材料和偏压,第二半可透性膜的通量。在一些实施方案中,所述装置还包括:一级端口,所述一级端口与所述一级隔室流体连通;二级端口,所述二级端口与所述二级隔室流体连通;或其任何组合。在一些实施方案中,所述装置还包括:一级端口,所述一级端口与所述一级隔室流体连通;二级端口,所述二级端口与所述二级隔室流体连通;三级端口,所述三级端口与所述三级隔室流体连通;或其任何组合。在一些实施方案中,所述一级端口、所述二级端口或所述三级端口中的至少一者为可密封的或可重新密封的。
11.本文提供的另一方面是一种植入式大胶囊装置,其包括:一级隔室,所述一级隔室被构造来容纳一个或多个细胞;以及二级隔室,其中所述一级隔室和所述二级隔室被第一半可透性膜分开,其中所述二级隔室和所述第一半可透性膜被构造来:i)过滤来自所述一级隔室的滤液,或者ii)向所述一级隔室内的一个或多个细胞提供辅助剂,或者i)和ii)两者;并且其中所述一个或多个细胞以每μl体积约103至约106个细胞的范围囊封在所述装置内。
12.在一些实施方案中,所述装置还包括:三级隔室,其中所述三级隔室和所述二级隔室被第二半可透性膜分开,其中所述第二半可透性膜被构造来:i)过滤来自所述三级隔室的滤液,或者ii)向所述三级隔室内的一个或多个细胞提供辅助剂,或者i)和ii)两者。在一些实施方案中,所述装置还包括如下中的至少一者:一级端口,所述一级端口与所述一级隔室流体连通;或二级端口,所述二级端口与所述二级隔室流体连通。在一些实施方案中,所述装置还包括如下中的至少一者:一级端口,所述一级端口与所述一级隔室流体连通;二级端口,所述二级端口与所述二级隔室流体连通;或三级端口,所述三级端口与所述三级隔室流体连通。在一些实施方案中,所述一级端,口、所述二级端口或所述三级端口中的至少一者为可密封的或可重新密封的。在一些实施方案中,其中所述装置包括多个通孔,所述多个
通孔从所述装置的一侧穿过分层膜延伸至所述装置的相对侧。
13.在一些实施方案中,一个或多个所述通孔被所述膜的结合部分围绕以形成密封件。在一些实施方案中,所述装置包括三个或更多个密封件。在一些实施方案中,所述装置包括两个或更多个自相交密封件。在一些实施方案中,所述装置包括两个或更多个椭圆形密封件。在一些实施方案中,所述密封件通过粘合剂、环氧树脂、焊接、其任何组合和/或任何其他适当的结合方法形成。在一些实施方案中,所述第一半可透性膜被构造来阻挡所述一个或多个细胞通过。在一些实施方案中,所述一级隔室和所述二级隔室被构造来阻挡所述一个或多个细胞通过。在一些实施方案中,所述一级隔室、所述二级隔室和所述三级隔室被构造来阻挡所述一个或多个细胞通过。
14.本文提供的另一方面是一种方法,其包括:提供大胶囊装置,所述大胶囊装置包括被构造来容纳一个或多个细胞的一级隔室以及二级隔室,其中所述一级隔室和所述二级隔室被第一半可透性膜分开,其中所述二级隔室和所述半可透性膜被构造来:i)过滤来自所述一级隔室的滤液,或者ii)向所述一级隔室内的一个或多个细胞提供辅助剂,或者i)和ii)两者;将所述大胶囊装置预血管化;将一个或多个细胞装载到所述一级隔室中;以及向所述二级隔室施加压力以将滤液从所述一级隔室移除。
15.在一些实施方案中,将所述滤液从所述一级隔室移除。在一些实施方案中,所述方法还包括:将辅助剂施用到所述一级隔室、所述二级隔室或两者中。在一些实施方案中,所述辅助剂包括药物、产氧物质、抗凝剂、营养物或其任何组合。在一些实施方案中,施用所述辅助剂是在向所述二级隔室施加负压之后执行的,但也可使用相对于所述大胶囊装置的另一隔室对所述二级隔室提供期望压差的任何方法。在一些实施方案中,所述方法还包括:对所述一级隔室、所述二级隔室或两者充气。在一些实施方案中,在将所述大胶囊装置预血管化之前对所述一级隔室、所述二级隔室或两者执行充气。在一些实施方案中,所述方法还包括:密封所述一级隔室、所述二级隔室或两者。在一些实施方案中,所述方法还包括:重新密封所述一级端口、所述二级端口或两者。在一些实施方案中,外壳还包括:三级隔室,所述三级隔室被第二半可透性膜与所述二级隔室分开,并且其中所述方法还包括:将一个或多个细胞装载到所述三级隔室中。在一些实施方案中,所述方法还包括:将辅助剂施用到所述一级隔室、所述二级隔室或所述三级隔室或其任何组合中。在一些实施方案中,所述方法还包括:对所述一级隔室、所述二级隔室或所述三级隔室或其任何组合充气。在一些实施方案中,所述方法还包括:密封所述一级隔室、所述二级隔室或所述三级隔室或其任何组合。在一些实施方案中,所述方法还包括:重新密封所述一级端口、所述二级端口、所述三级端口或其任何组合。
16.本文提供的另一方面是一种方法,其包括:提供大胶囊装置,所述大胶囊装置包括:第一外膜;第二外膜;以及第一半可透性膜,所述第一半可透性膜附接在所述第一外膜与所述第二外膜之间;其中所述第一半可透性膜和所述第一外膜连接以形成被构造用于容纳细胞群的一级隔室;并且其中所述第一半可透性膜和所述第二外膜连接以形成二级隔室;将所述大胶囊装置预血管化;将一个或多个细胞装载到所述一级隔室中;以及向所述二级隔室施加压差以将滤液从所述一级隔室移除。
17.在一些实施方案中,将所述滤液从所述一级隔室移除。在一些实施方案中,所述方法还包括:将辅助剂施用到所述一级隔室、或所述二级隔室或两者中。在一些实施方案中,
所述辅助剂包括药物、产氧物质、抗凝剂、营养物或其任何组合。在一些实施方案中,施用所述辅助剂是在对所述二级隔室施加负压或其他压差之后执行的。在一些实施方案中,所述方法还包括:对所述一级隔室、或所述二级隔室或两者充气。在一些实施方案中,在将所述大胶囊装置预血管化之前对所述一级隔室、或所述二级隔室或两者执行充气。在一些实施方案中,所述方法还包括:密封所述一级隔室、或所述二级隔室或两者。在一些实施方案中,所述方法还包括:重新密封所述一级端口、所述二级端口或两者。在一些实施方案中,所述大胶囊装置还包括:三级隔室,所述三级隔室被第二半可透性膜与所述二级隔室分开,并且其中所述方法还包括:将一个或多个细胞装载到所述三级隔室中。在一些实施方案中,所述方法还包括:将辅助剂施用到所述一级隔室、所述二级隔室或所述三级隔室或其任何组合中。在一些实施方案中,将所述滤液从所述一级隔室、所述三级隔室或两者移除。在一些实施方案中,所述方法还包括:对所述一级隔室、所述二级隔室、所述三级隔室或其任何组合充气。在一些实施方案中,所述方法还包括:密封所述一级隔室、所述二级隔室或所述三级隔室或其任何组合。在一些实施方案中,所述方法还包括:重新密封所述一级端口、所述二级端口、所述三级端口或其任何组合。
18.应当理解,前述概念和以下讨论的另外的概念可以以任何合适的组合来布置,因为本公开在此方面不受限制。此外,当结合附图考虑时,通过以下各种非限制性实施方案的详细描述,本公开的其他优点和新颖特征将变得显而易见。
19.在本说明书和通过引用并入的文献包括冲突和/或不一致的公开内容的情况下,以本说明书为准。如果通过引用并入的两个或更多个文献包括相对于彼此冲突和/或不一致的公开内容,则应以具有较晚有效日期的文献为准。
附图说明
20.附图并不意图是按比例绘制的。在附图中,在各个附图中示出的每个相同或几乎相同的部件可由相同的数字表示。为了清楚起见,并未在每个附图中标记每个部件。在附图中:
21.图1a示出根据一些实施方案的大胶囊装置的顶视图;
22.图1b示出图1a的大胶囊装置的透视剖视图;
23.图1c示出图1a的大胶囊装置的端口的透视剖视图;
24.图1d示出图1a的大胶囊装置的膜层的透视剖视图;
25.图2a示出根据一些实施方案的包括三个内部隔室的大胶囊装置的横截面示意图;
26.图2b示出图2a的大胶囊装置的分解横截面示意图;
27.图3示出根据一些实施方案的包括三个内部隔室的大胶囊装置的分解横截面示意图;
28.图4a示出根据一些实施方案的包括两个内部隔室的大胶囊装置的横截面示意图;
29.图4b示出图3a的大胶囊装置的分解横截面示意图;
30.图5a至图5c示出根据一些实施方案的使用包括三个隔室的大胶囊装置进行血管化、细胞填充、过滤和施加辅助剂的横截图示。
具体实施方式
31.一些大胶囊装置被构造用于在没有来自周围组织的预血管化支持的情况下将细胞植入宿主中。然而,通过此类装置植入的细胞通常在植入与血管化之间的时间段期间遭受缺氧或营养不良。由于血管化通常跨越一周或更长,因此此类有害细胞状况通常造成细胞坏死以及随后免疫原性细胞碎片外流,这触发最终导致装置发生故障的异物反应。相比之下,在引入任何细胞物质之前,预血管化装置在空的时被植入到体内以与宿主整合成一体。此类装置已示出实现更大细胞存活率。
32.虽然有利,但本发明人已认识到将细胞装载到被宿主组织包围并与所述宿主组织整合成一体的大胶囊装置中迄今已被证明是困难的。首先,将细胞引入到预血管化大胶囊装置中通常在装置内使用超滤和加压和/或非常高浓度的细胞,以在装置内提供期望量的细胞。虽然超滤和加压可将有效细胞密度引入到装置中,但在超滤期间通过膜施加的力可导致装置与新形成的微脉管系统分离和/或由于组织创伤造成的异物反应加剧。此外,将大浓度的细胞装载在大胶囊装置内可在装载期间对细胞表面施加剪切力。这可导致细胞聚集,从而可在装置内部内形成阻塞,这可损坏细胞并且/或者抑制装置装载到期望有效细胞密度。
33.鉴于上述内容,本发明人已认识到与大胶囊装置相关联的益处,所述大胶囊装置包括多个至少部分地共延内部隔室,所述多个至少部分地共延内部隔室通过设置在这些隔室之间的一个或多个半可透性内部膜彼此流体连通。这种构造可允许隔室中的至少一个被构造来接受期望的一个或多个细胞群,而其他隔室中的至少一个(例如,二级隔室)可与包含细胞的一个或多个隔室流体连通。这可允许来自包括细胞的一个或多个隔室的滤液穿过半可透性膜流入一个或多个其他隔室(例如,二级隔室)。在一些实例中,可将此滤液从此二级隔室移除。此二级隔室也可用于将期望辅助剂引入到装置中,所述辅助剂然后可穿过位于隔室之间的半可透性膜流入包括细胞的一个或多个隔室。这种装置可在填充过程中基本上阻止和/或至少减少对装置周围的整合组织及包含在其中的细胞的损伤。
34.在一个实施方案中,大胶囊装置可由第一外膜和第二外膜形成。第一外膜和第二外膜可以任何适当的方式彼此结合以在第一外膜与第二外膜之间形成内部体积。例如,至少部分地围绕膜的周边延伸的第一外膜和第二外膜的一部分可直接或间接地彼此结合。例如,膜可沿着其自由边缘折叠并结合,使得单个膜用作第一外膜和第二外膜。可替代地,两个分开的外膜可结合在沿着其整个周边延伸的部分处,但可使用利用膜材料形成内部体积的任何适当方法。在任一种情况下,大胶囊装置还可包括设置在第一外膜与第二外膜之间的至少第一半可透性膜,所述至少第一半可透性膜将内部体积分成穿过第一半可透性膜彼此流体连通的一级隔室和二级隔室。第一隔室可被构造来容纳可装载到一级隔室中的第一细胞群。因此,大胶囊装置可被构造成使得来自一级隔室的滤液可流入二级隔室并且/或者可将辅助剂引入到二级隔室中,所述辅助剂然后可流入细胞所在的一级隔室,如下文所详述。
35.在一些实施方案中,大胶囊装置还可包括设置在第一半可透性膜与第二外膜之间的至少第二半可透性膜。二级隔室可形成在第一半可透性膜与第二半可透性膜之间,并且三级隔室可形成在第二半可透性膜与第二外膜之间。因此,三级隔室可穿过第二半可透性膜与二级隔室流体连通。另外,在一些实施方案中,二级隔室可设置在一级隔室与三级隔室
之间。在一些实施方案中,三级隔室也可被构造来容纳第二细胞群。因此,类似于上文所述,滤液也可从三级隔室流入二级隔室中并且/或者辅助剂可从二级隔室流入三级隔室。根据特定实施方案,第二细胞群可与保持在大胶囊装置的一级隔室中的细胞群相同和/或不同。
36.应当理解,在大胶囊装置的各个隔室之间流动的滤液和/或辅助剂可偏压以便以任何适当方式在隔室之间流动。例如,在一些实施方案中,可在相邻隔室之间施加压差以诱导滤液和/或辅助剂从一个隔室流动到另一个隔室。例如,一个隔室内的压力可由于材料流入隔室而增大,并且/或者相邻隔室内的压力可使用施加到此隔室的真空而减小。在任一种情况下,可控制静压、压差、流速、施加到细胞的剪切应力和/或其他适当的操作参数以避免细胞聚集和/或死亡。例如,在一些实施方案中,两个相邻隔室之间的压差可保持低于阈值压力以帮助维持细胞活力。此外,在其中施加辅助剂的一些实施方案中,可将辅助剂引入到二级隔室中,然而,在二级隔室与包括细胞群的相邻隔室之间可存在很小到没有压差。在这种实施方案中,由于辅助剂的因辅助剂的浓度梯度诱导的扩散引起的扩散,辅助剂可流入这些其他隔室,其中辅助剂在二级隔室内的浓度大于辅助剂在包括细胞群的相邻隔室中的浓度。
37.可在将细胞群装载到大胶囊装置的隔室中使用的适当类型的滤液可包括但不限于细胞培养基、藻酸酯、细胞外基质蛋白、富血小板血浆、凝血酶、聚(乙烯醇)、聚(乙二醇)、丙二醇、冷冻保存溶液和果胶。当然,应当理解,可使用与宿主和细胞群体生物相容的任何适当类型的滤液,因为本公开不限于任何特定类型的滤液。
38.在其中已将辅助剂提供给大胶囊装置的二级隔室的实施方案中,辅助剂可对应于任何适当的药剂,因为本公开不限于任何特定药剂。例如,在一些实施方案中,可能期望提供促进细胞氧合的药剂、用于宿主的二级治疗剂和/或为大胶囊装置提供期望功能的任何其他适当药剂。因此,辅助剂可包括治疗剂,诸如药物、产氧物质、抗凝剂、营养物、抗炎药、类固醇、生长因子、前药、免疫调节分子、分化因子、其任何组合和/或任何其他适当药剂,因为本公开并不以这种方式受限制。
39.如上所述,在一些情况下,在引入细胞群之前将大胶囊装置预血管化可能是有利的。同样,这可改进营养物向设置在装置内部内的细胞的流动,增加废物和/或治疗剂从装置流出到宿主,并且/或者还可减少对装置植入的纤维化反应的发生。因此,在一些实施方案中,大胶囊装置可在第一时间段内植入并被预血管化。在这种实施方案中,第一膜和第二膜中的至少一者被构造来使得能够将装置内的细胞血管化。在一些实施方案中,第一膜和第二膜中的至少一者被构造来在不存在免疫抑制疗法的情况下,或在与不支持这种血管化的可比较装置相比免疫抑制疗法减少的情况下,实现、支持或允许将装置内和周围的细胞血管化。在一些情况下,这可包括使用多个通孔,所述多个通孔从大胶囊装置的第一表面穿过居间膜延伸到大胶囊装置的第二相对表面。在这种实施方案中,脉管系统可长入并穿过这些通孔。
40.在此预血管化时段期间,对装置充气以帮助将大胶囊装置的膜和相关联隔室维持在适当构型中,以用于随后将细胞群装载到装置中可能是有利的。因此,在一些实施方案中,可在植入装置之前、期间和/或之后将流体引入到大胶囊装置的一个或多个隔室中以对一个或多个隔室充气。这可包括对大胶囊装置的一级隔室、二级隔室和/或三级隔室充气。可用于对大胶囊装置的各个隔室充气的适当类型的流体可包括但不限于氧气、盐水、细胞
培养基、藻酸酯、脱乙酰壳多糖、右旋糖、全氟化碳、其组合和/或能够对装置充气的任何其他适当流体。在一些情况下,大胶囊装置的外膜可被构造来在植入期间将充气流体保持在装置的内部内,以阻止膜结构在预血管化时段期间塌缩。然后可让大胶囊装置处于植入达适当时间段,以允许大胶囊装置与周围组织整合在一起,并且允许脉管系统建立通向大胶囊装置的期望营养物流。然后大胶囊装置的一个或多个隔室可装载有一个或多个期望细胞群,如下文进一步所述。
41.在本文公开的各种大胶囊装置的一些实施方案中,第一外膜和第二外膜中的至少一者是半可透性的。例如,外膜中的任一者可为半可透性的,而另一者可为基本上不可透性的,或者两者均可为半可透性的。在一些实施方案中,第一膜、第二膜或两者的半可透性被构造来保护细胞免受免疫攻击和/或阻挡细胞群离开装置,同时允许由细胞产生的期望的生物产物以及由细胞使用和产生的废物和营养物通过。在一些实施方案中,第一膜、第二膜或两者的半可透性被构造来在没有免疫抑制疗法的情况下保护细胞免受免疫攻击。因此,第一外膜、第二外膜或两者可被构造成对装置内的一个或多个细胞群、包含在装置内的滤液、辅助剂或其任何组合是基本上不可透性的。
42.除外膜的相对持久性之外,位于大胶囊装置的内部体积内的一个或多个半可透性膜还可适当地被构造来控制一种或多种材料在大胶囊装置的各个隔室之间的流动。例如,在本文所述的各种实施方案中,设置在装置的内部体积内的第一半可透性膜、第二半可透性膜和/或任何适当数量的半可透性膜对从一个隔室流动到另一个隔室的滤液、待提供到装置内部中的辅助剂或两者可为基本上可透性的。此外,内部半可透性膜对设置在大胶囊装置内的一个或多个细胞群也可为基本上不可透性的。因此,内部半可透性膜可被构造来阻止细胞在相邻隔室之间流动,同时允许滤液和/或辅助剂在其间流动。
43.鉴于上述内容,内部半可透性膜(诸如第一半可透性膜和/或第二半可透性膜)的液压渗透率、孔径和/或孔隙率可不同于大胶囊装置的第一外膜和/或第二外膜的液压渗透率、孔径和/或孔隙率。例如,第一半可透性膜和/或第二半可透性膜的液压渗透率可大于第一外膜和第二外膜中的一者或两者的液压渗透率。这可对应于内部半可透性膜相对于外膜的增加的孔隙率、孔径或材料参数的其他适当差异。类似地,根据特定实施方案,第一外膜和第二外膜可具有彼此相等或不同液压渗透率、孔径和/或孔隙率。例如,如果不同材料容纳在由第一外膜和第二外膜形成的分开隔室中,诸如容纳不同细胞群,则第一外膜所表现出的液压渗透率可小于或大于第二外膜的液压渗透率,以提供针对每种细胞群单独地定制的膜性质的期望组合。类似地,在使用多个内部半可透性膜,诸如设置在两个外膜之间的第一半可透性膜和第二半可透性膜的情况下,内部半可透性膜可表现出相同和/或不同液压渗透率、孔径和/或孔隙率。例如,第一半可透性膜的液压渗透率可大于或小于第二半可透性膜的液压渗透率。
44.鉴于上述内容,在一些实施方案中,内部半可透性膜(诸如设置在两个外膜之间的第一半可透性膜和/或第二半可透性膜)所表现出的液压渗透率可比一个或两个外膜的液压渗透率大至少约25%、30%、35%、40%、45%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。涵盖在任何前述百分比之间延伸的范围。例如,内部半可透性膜的液压渗透率可比一个或两个外膜的液压渗透率大约25%与100%之间。在一些实施方案中,液压渗透率的这种差异可与内部半可透性膜抵靠其设置以形成对应隔室的外膜有关。当然,也
设想到大于和小于上述那些的液压渗透率,因为本公开并不以这种方式受限制。
45.可以任何适当方式测量各种膜的上述相对液压渗透率。例如,对于如本领域已知的给定样品几何形状,不同膜材料的相对液压渗透率可使用恒定压头或恒定压力、使用适当流体(诸如水)的测量值进行测量。当然,可使用任何适当的流量测试方法、计算或建模方法来确定膜的相对液压渗透率,因为本公开不限于其中测量这些相对参数的特定方法。
46.类似于上文所述,为了提供大胶囊装置的各种膜的相对渗透率的期望差异,在一些实施方案中,大胶囊装置的内部半可透性膜中的一者或多者的孔隙率和/或孔径可大于第一外膜和第二外膜中的一者或两者的孔隙率和/或孔径。同样,在一些实施方案中,这种差异可与相邻外膜有关。在任一种情况下,内部半可透性膜的孔隙率和/或孔径可比外膜中的一者或两者的孔隙率和/或孔径大至少约25%、30%、35%、40%、45%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。涵盖在任何前述百分比之间延伸的范围。例如,内部半可透性膜的孔隙率和/或孔径可比一个或两个外膜的孔径和/或孔隙率大约25%与100%之间。除前述之外,在一些实施方案中,第一半可透性膜的孔隙率和/或孔径可不同于设置在外膜之间的第二半可透性膜的孔隙率和/或孔径。
47.鉴于材料参数的上述差异,在预定压差和/或浓度梯度下预定材料跨内部半可透性膜的通量可大于在相同压差和/或浓度梯度下相同材料跨一个或两个外膜的通量。类似地,取决于期望应用,第一外膜和第二外膜可表现出相同或不同液压性质。因此,材料在特定压差和/或浓度梯度下跨大胶囊装置的第一外膜和第二外膜的通量可彼此基本上相同或不同。例如,在相同偏压下,跨第一外膜的通量可小于或大于跨第二外膜的通量。类似地,材料跨设置在装置的外膜之间的第一半可透性膜的通量可不同于(即,小于或大于)材料跨第二半可透性膜的通量。材料跨不同膜的通量的差异可比相对通量的差异大约5%。可经历这种通量差异的适当材料可包括但不限于胰岛素、小分子治疗剂、生长因子、抗体、抗体片段、免疫调节因子、补体复合体、细胞片段、酶、藻酸酯、盐水和细胞培养基。同样,预定材料跨各种膜的相对通量可使用任何适当的流量测试方法、计算或建模方法(包括例如恒定压头或压差测量、跨膜的浓度梯度测量和/或任何其他适当的方法)来测量,因为本公开不限于如何测量相对通量。
48.应当理解,本文所述的渗透率、孔径、孔隙率、相对通量和其他材料参数的各种关系可适用于大胶囊装置的所述实施方案中的任一个。然而,还应当理解,本公开并非仅限于这些特定范围的材料性质和相对性能参数。例如,内部半可透性膜和外膜两者可表现出大于或小于本文所述的特定范围和关系的渗透率、孔径、孔隙率、相对通量和其他材料参数的范围,因为本公开不以这种方式受限制。
49.大胶囊装置的各种膜,包括外膜和/或内部半可透性膜,可由任何适当的生物相容性材料形成。生物相容性材料对容纳在大胶囊装置内的细胞、滤液、辅助剂或其任何组合可为基本上惰性的。生物相容性材料可包括合成聚合物或天然存在的聚合物。在一些实施方案中,聚合物还可为线性聚合物、交联聚合物、网络聚合物、加聚物、缩聚物、弹性体、纤维聚合物、热塑性聚合物、不可降解聚合物、前述的组合和/或任何其他适当类型的聚合物,因为本公开并不以这种方式受限制。适当类型的聚合物可包括聚氯乙烯(pvc)、聚乙烯(pe)、聚丙烯(pp)、聚甲基丙烯酸甲酯(pmma)、聚苯乙烯(ps)、聚四氟乙烯(ptfe)、膨胀型聚四氟乙烯(eptfe)、聚氨酯(pu)、聚酰胺(尼龙)、聚对苯二甲酸乙二醇酯(pet)、聚醚砜(pes)、聚醚
酰亚胺(pei)、聚偏二氟乙烯(pvdf)、聚己内酯(pcl)、聚(乳酸
‑
共
‑
乙醇酸)(plga)、聚
‑
l
‑
丙交酯(plla)、前述各项的任何组合和/或任何其他适当的聚合物材料。用于由上述聚合物材料形成一个或多个多孔膜中的合成方法可包括但不限于膨胀、溶剂浇铸、浸渍沉淀和相分离、电纺、产生等网状网络的方法、产生小梁网络的方法或形成多孔聚合物膜的任何其他适当方法。在一些实施方案中,多孔聚合物膜的烧结可用于改变膜的孔隙率,所述孔隙率进而可用于调谐大胶囊装置的孔隙率和通量性质。因此,在一些实施方案中,外半可透性膜和/或内半可透性膜的任何期望组合可使用任何适当的烧结方法来烧结或不烧结,这取决于特定膜材料。
50.虽然上文提到了聚合物材料,但设想到其中膜至少部分地由非聚合物材料制成的实施方案。例如,适当的膜材料可包括陶瓷材料、聚合物陶瓷复合材料和/或能够在所植入大胶囊装置中用作膜的任何其他适当材料,因为本公开不限于形成膜的任何特定材料。
51.如本文所述的大胶囊装置的内膜和外膜可由多孔膜材料制成,所述多孔膜材料被构造来允许材料(诸如生物产物)运输通过膜,所述材料所具有的分子量小于约3000kda、2000kda、1000kda、500kda、400kda、300kda、200kda、100kda、50kda、40kda、30kda、20kda、10kda、6kda、5kda、4kda、3kda、2kda、1kda和/或任何其他适当范围的分子量,这取决于期望应用。例如,大胶囊装置的一个或多个膜可被构造来允许分子量为约5.8kda的胰岛素流动通过膜。
52.为了提供期望选择性,与本文公开的大胶囊装置一起使用的多孔膜可具有开放多孔结构,其平均孔径大于或等于约1nm、5nm、10nm、15nm、20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、200nm、300nm和/或任何其他适当的大小范围。对应地,本文所述的各种膜的平均孔径可具有小于或等于2500nm、2000nm、1700nm、1500nm、1400nm、1300nm、1200nm、1100nm、1000nm、900nm、800nm、700nm、600nm、500nm、400nm、300nm、200nm、100nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm和/或任何其他适当大小范围的平均孔径。设想到前述的组合,包括例如介于或等于1nm和20nm、1nm和2500nm之间和/或任何其他适当组合的平均孔径。当然,虽然上文描述了具体平均孔径,但应当理解,可针对本文所述的各种膜使用任何适当的平均孔径,包括大于和小于上述那些的平均孔径。
53.为了提供大胶囊装置的足够强度和/或刚度,可由足够硬的材料制成各种膜。期望硬度可通过材料杨氏模量、厚度和整体构造的适当组合来提供,其可与装置的期望渗透率平衡。用于本文所述的各种膜的适当杨氏模量可为至少105pa、106pa、107pa、108pa、109pa、10
10
pa和/或大于和小于这些范围的任何其他适当模量。当然,设想到前述杨氏模量之间的范围,包括例如介于或等于约106pa和10
10
pa之间的杨氏模量。
54.在一些实施方案中,可能期望包括在大胶囊装置内所包括的一个或多个膜是亲水性的,以促进将细胞装载到大胶囊装置中和/或促进一种或多种滤液、生物复合物、治疗剂或其他材料流入、流出装置的不同隔室和/或在所述不同隔室之间流动。另外,当装置被定位在体内时,亲水性外膜还可减少纤维化的发生。因此,大胶囊装置的内膜和外膜可由亲水性材料制成和/或用亲水性涂层处理。用于形成亲水性涂层的适当材料可包括但不限于适当的亲水性聚合物、聚乙二醇、聚乙烯醇、聚多巴胺、它们的任何组合和/或能够在膜上形成涂层的任何其他适当亲水材料。
55.本文所述的大胶囊装置的各种实施方案中所述的膜可使用任何适当的结合方法
彼此结合,因为本公开并不以这种方式受限制。例如,可使用粘合剂、环氧树脂、焊接或其他基于熔合的技术(例如,超声结合、激光结合、物理结合、热结合等)、使用框架或夹具的机械夹紧和/或任何其他适当的结合方法来将相邻的膜彼此结合。在一个特定实施方案中,可使用加热的工具将相邻的膜结合,所述加热的工具用于以预定压力和/或力将两个或更多个膜抵靠彼此按压或撞击达设定熔合时间。鉴于上述内容,应当理解,本公开不限于使用任何特定的方法来将膜结合在一起。
56.如本文所述的大胶囊装置可具有内部体积、外部尺寸和/或其他适当物理参数的任何适当组合。例如,由大胶囊装置的外膜包围的内部体积可介于或等于40μl和250μl之间。大胶囊装置的宽度或最大横向尺寸也可介于约20mm与80mm之间。另外,为了提供期望的氧气扩散到大胶囊装置的内部以支持其中所包含的细胞,从装置的外部到包括细胞群的装置的内部部分的最大氧气扩散距离可小于50μm、100μm、150μm、200μm、250μm、300μm、350μm、400μm、450μm或500μm。对应地,整体装置和/或装置内的隔室的最大厚度或垂直于最大横向尺寸的尺寸可小于50μm、100μm、150μm、200μm、250μm、300μm、350μm、400μm、450μm或500μm。此外,在一些实施方案中,装置的外表面积与体积之比可大于或等于约20cm
‑1、40cm
‑1、60cm
‑1、80cm
‑1、100cm
‑1、120cm
‑1或150cm
‑1。还设想到在各种尺寸和参数的任何前述值之间延伸的范围。另外,尽管上文给出了整体大胶囊装置的特定参数范围,但设想到大于和小于上述那些的操作参数和尺寸,因为本发明不限于任何特定大小或构造。
57.如下文所详述,在一些实施方案中,大胶囊装置内的隔室可形成为使得这些隔室的内部体积被细分成多个互连通道,所述多个互连通道在一些实施方案中可被成形为类似于管腔,尽管也可使用通道的任何适当形状或构型。通道可具有大于或等于40μm、50μm、100μm、200μm、300μm、400μm和/或任何其他适当尺寸的内最大横向尺寸,诸如内径。对应地,通道可具有小于或等于800μm、700μm、600μm、500μm、400m和/或任何其他适当尺寸的内最大横向尺寸。设想到前述的组合,包括例如介于或等于40μm和800μm之间的多个通道的内最大横向尺寸。此外,形成装置的各种隔室的互连通道的密度可在装置的横向平面内具有大于或等于约10个通道/cm2、15个通道/cm2、20个通道/cm2、25个通道/cm2、30个通道/cm2、35个通道/cm2、40个通道/cm2、45个通道/cm2、50个通道/cm2、60个通道/cm2、70个通道/cm2、80个通道/cm2、90个通道/cm2、100个通道/cm2、110个通道/cm2、120个通道/cm2、130个通道/cm2、140个通道/cm2、150个通道/cm2、175个通道/cm2或200个通道/cm2的每单位面积密度。还设想到在任何上述通道密度之间延伸的范围,包括例如介于或等于约10个通道/cm2和200个通道/cm2之间的通道密度。尽管还可设想到大于和小于上述范围的密度。
58.虽然上文描述了与大胶囊装置及其制造材料相关的具体尺寸和关系,但应当理解,设想到大于和小于上述那些的尺寸和关系,因为本公开并不以这种方式受限制。因此,取决于期望应用,可针对装置使用任何适当大小、构造和/或相对性能参数。
59.在一些实施方案中,包含在大胶囊装置的隔室内的细胞群可为胰岛素分泌细胞群。在一些实施方案中,细胞群包含至少一种衍生自干细胞衍生细胞的细胞。在一些实施方案中,至少一种细胞是基因修饰细胞。在一些情况下,与经基因工程化的可比较细胞相比,至少一种细胞经基因工程化以在植入装置后降低受试者的免疫反应。在一些实施方案中,细胞群是干细胞衍生细胞,其能够进行葡萄糖刺激的胰岛素分泌(gsis)。例如,适当的细胞群可包括胰腺祖细胞、内分泌细胞、β细胞、包含前述一种或多种细胞的基质、或其任何组
合。此外,基质可包含分离胰岛细胞、来自胰腺的分离细胞、来自组织的分离细胞、干细胞、干细胞衍生细胞、诱导多潜能细胞、分化细胞、转化细胞或表达系统,其可合成一种或多种生物产物。任选地,在一些实施方案中,基质可包含支持合成一种或多种生物产物的第一类型细胞的第二类型细胞。在一些实施方案中,可对细胞进行囊封,之后将其置于基质内。在这种实施方案中,可将细胞囊封在微胶囊中、或可适形地包被细胞。然而,也可使用裸的(即未包被的)细胞。
60.根据特定实施方案,可将治疗有效密度的细胞装载到大胶囊装置的一个或多个隔室中。设置在隔室内的适当的细胞密度可大于或等于约1000个细胞/μl、10,000个细胞/μl、50,000个细胞/μl、100,000个细胞/μl、500,000和/或任何其他适当的细胞密度。设置在隔室内的适当细胞密度还可小于或等于约1,000,000个细胞/μl、500,000个细胞/μl、100,000个细胞/μl、50,000个细胞/μl、10,000个细胞/μl和/或任何其他适当的细胞密度。设想到前述的组合,包括介于约1000个细胞/μl与1,000,000个细胞/μl之间的细胞密度。当然,也可使用大于和小于上述那些的细胞密度,这取决于期望应用和所使用的细胞类型。
61.本文所述的大胶囊装置可植入受试者体内不同部位。在一个实例中,可通过腹膜外或直肌后植入来将装置植入受试者体内。在其他实例中,可通过网膜内植入来放置装置。在另一个实例中,可通过皮下植入来放置装置。在另一个实例中,可通过肝上植入来放置装置。在一些情况下,可使用任何适当的固定方法(包括例如施加组织粘合剂)来将本文所述的大胶囊装置固定在体内的植入部位处。适当的组织粘合剂可包括但不限于血纤维蛋白、氰基丙烯酸酯、聚乙二醇、基于白蛋白的粘合剂、基于聚合物的粘合剂和/或任何其他适当的粘合剂。在另一个实例中,可使用富含血小板的血浆和/或任何其他适当的固定方法来固定装置,因为本公开并不以这种方式受限制。
62.转向附图,进一步详细描述特定非限制性实施方案。应当理解,相对于这些实施方案描述的各种系统、部件、特征和方法可单独地和/或以任何期望组合来使用,因为本公开不限于仅本文所述的特定实施方案。
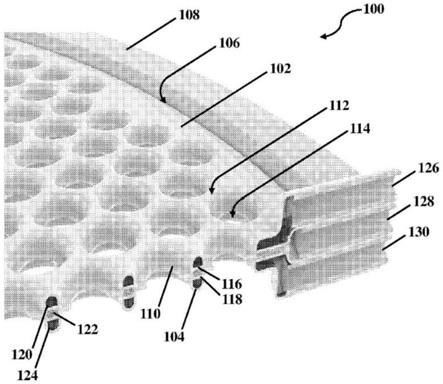
63.图1a至图1d示出了被构造来囊封细胞群的植入式大胶囊装置100的一个实施方案。同样,细胞群可包括胰腺祖细胞、内分泌细胞、β细胞和/或本文所述的任何其他适当细胞群中的至少一种。在所描绘的实施方案中,大胶囊装置具有在平行于装置取向的横向平面的方向上延伸的大致平坦的平面构型。图中描绘的大胶囊装置具有大致圆形平面形状,然而也可设想到其他形状,包括正方形、矩形、六边形、三角形和/或任何其他适当形状,包括非平面构型,因为本公开并不以这种方式受限制。
64.大胶囊装置100包括设置在第二外膜104上的第一外膜102。第一外膜和第二外膜的至少一部分可彼此结合以形成设置在外膜之间的内部体积。例如,如图所示,第一外膜和第二外膜可至少在围绕膜的周边或其他适当部分延伸的部分106处彼此结合,以形成期望内部体积。在一些实施方案中,装置还可包括附接到整体装置的一个或多个部分的框架108。在所描绘的实施方案中,框架附接到大胶囊装置的外部周边并且围绕所述外部周边延伸。然而,也可设想到框架仅围绕装置的周边的一部分延伸的情况。框架可使用任何适当方法来附接到外膜,所述任何适当方法包括但不限于粘合剂、环氧树脂、机械紧固件、热结合和/或任何其他适当结合方法,因为本发明并不以这种方式受限制。
65.如先前所述,本文所述的大胶囊装置可包括两个或更多个内部隔室,所述两个或
更多个内部隔室在与大胶囊装置通常可在其中延伸的平面平行的平面内至少部分地彼此共延。此外,在一些实施方案中,两个或更多个隔室可基本上沿着它们平行于此平面的整个横向区域彼此共延。图1a至图1d所示的实施方案是包括一级隔室120、二级隔室122和三级隔室124的三隔室装置。为清楚起见,已示出单组隔室。然而,应当理解,也可设想到包括设置在大胶囊装置的不同部分中的多组相关联隔室的大胶囊装置,因为本公开不限于其中使用在装置的整个表面区域上延伸的单组隔室的装置。下文进一步描述了膜和这些隔室的特定布置。
66.如图所示,大胶囊装置100可包括第一外膜102、第二外膜104、第一半可透性膜116和第二半可透性膜118。所述装置还可包括一级隔室120、二级隔室122和三级隔室124。在所描绘的实施方案中,第一半可透性膜抵靠第一外膜设置,第二半可透性膜抵靠第一半可透性膜与第一外膜相对设置,并且第二外膜抵靠第二半可透性膜与第一外膜和第一半可透性膜相对设置。各种膜可使用任何先前所述的结合方法来彼此结合和/或以其他方式连接。因此,第一半可透性膜可附接在第一外膜与第二半可透性膜之间,第二半可透性膜可附接在第一半可透性膜与第二外膜之间。此外,膜可被适当地成形和布置成使得第一半可透性膜和第一外膜在第一半可透性膜与第一外膜的相对表面之间形成一级隔室。对应地,第二半可透性膜和第二外膜可协作以在第二半可透性膜与第二外膜的相对表面之间形成二级隔室。第一半可透性膜和第二半可透性膜还可在第一半可透性膜与第二半可透性膜的相对表面之间形成三级隔室。
67.虽然在图中示出了用于各种膜的单个连续膜,但在一些实施方案中,第一外膜102、第二外膜104、第一半可透性膜116和第二半可透性膜118中的一者或多者可由用于形成整体膜的多个连接膜制成。
68.鉴于上述结构,一级隔室120和二级隔室122可被第一半可透性膜116分开。类似地,三级隔室124和二级隔室122可被第二半可透性膜118分开。因此,在使用三个隔室的实施方案中,二级隔室设置在一级隔室与三级隔室之间。此外,一级隔室、二级隔室和/或三级隔室可在其横截面积的至少一部分,并且在一些实施方案中基本上全部上相对于平行于整体大胶囊装置在其中延伸的平面的横向平面彼此共延。由于位于装置内部内的第一半可透性膜和第二半可透性膜被构造成可对至少一些材料(诸如滤液和/或辅助剂)渗透,因此一级隔室可穿第一半可透性膜与二级隔室流体连通,并且二级隔室和三级隔室可穿过第二半可透性膜流体连通。
69.如先前所述,在一些实施方案中,大胶囊装置100可包括跨装置的平坦表面分布的多个通孔114。通孔可从大胶囊装置的第一外部表面延伸到大胶囊装置的相背对外部表面,所述通孔在所描绘的实施方案中可对应于从第一外膜102的外部表面延伸到第二外膜104的相背对外部表面的通孔。通孔可被对应的结合部分110包围。结合部分可包括第一外膜和第二外膜的结合部分,以及定位在外膜(诸如第一半可透性膜116和第二半可透性膜118)之间的任何中间内部膜。围绕每个通孔的结合部分可在装置的内部与通孔之间形成密封件。与具有平坦构型的装置相比,这些通孔的使用可允许每单位面积存在更多细胞,因为可在整个基质中向细胞提供增加量的营养物以支持其生存能力和活性。具体地,当植入体内时,通孔可允许脉管系统在装置周围生长并穿过通孔。相比之下,没有通孔的典型装置受限于在装置的顶部表面和底部表面上形成的脉管系统。通孔的最大横向尺寸(诸如直径)可在平
行于整体装置的最大横向尺寸在其中延伸的横向平面的横向平面中在其最窄点处测量。可适当地选择通孔的大小、数量和/或密度,以在定位于体内时提供装置的期望性能。
70.在一些实施方案中,一级隔室120、二级隔室122和三级隔室124中的至少一者可包括连续隔室。可替代地,一级隔室120、二级隔室122和三级隔室124中的至少一者可包括可具有任何适当形状的多个连续互连隔室。例如,图中所示的内部隔室对应于多个互连通道112,所述多个互连通道112对应于设置在膜的相邻结合部分110之间的隔室的内部体积,所述相邻结合部分110对应于位于装置的面上的多个通孔114的位置。然而,应当理解,可针对内部隔室中的每一个使用互连体积和/或单个连续体积的任何适当布置和/或形状,因为本公开并不以这种方式受限制。
71.在上述实施方案中,一级隔室120、三级隔室124或两者可被构造来提供用于容纳可彼此相同或不同的一个或多个细胞群的体积。对应地,二级隔室122可被构造来将滤液从一级隔室、二级隔室或两者移除。二级隔室还可被构造来向一级隔室、三级隔室或两者提供辅助剂。因此,在所描绘的实施方案中,第一外膜102、第二外膜104、第一半可透性膜116和第二半可透性膜118中的每一者可被构造来阻挡细胞群通过。第一半可透性膜还可被构造来允许滤液从一级隔室传递到二级隔室。类似地,第二半可透性膜可被构造来允许滤液从三级隔室传递到二级隔室。第一半可透性膜和/或第二半可透性膜也可被构造来允许辅助剂从三级隔室分别传递到一级隔室和三级隔室。
72.还如图1a至图1b所示,大胶囊装置100还可包括至少一个端口,所述至少一个端口在装置的外部与包含在其中的一个或多个隔室之间提供流体连通。例如,一级端口126可与一级隔室120流体连通,二级端口128可与二级隔室122流体连通,三级端口130可与三级隔室124流体连通。在一些实施方案中,一级端口、二级端口和三级端口中的至少一者,并且在一些情况下每一者可为可密封的或可重新密封的,以在大胶囊装置的相关联内部隔室与外部之间提供选择性流体连通。一级端口、二级端口、三级端口或其任何组合可被构造来能够经由皮肤进入。在任一种情况下,各种端口可提供进入装置的相关联内部隔室的通路,使得可将细胞群引入到相关联隔室中,可将滤液从相关联隔室移除,并且/或者可通过端口中的一个或多个将辅助剂引入到相关联隔室中,如下文进一步描述。
73.虽然实施方案在使用端口的图中已被示出,但本公开不限于包括端口的大胶囊装置。例如,还设想到可被完全密封而无需使用一级端口、二级端口或三级端口的大胶囊装置的实施方案。
74.图2a至图2b示出大胶囊装置100的简化示意图和分解示意图,所述大胶囊装置100包括第一外膜102和第二外膜104,并且第一半可透性膜和第二半可透性膜设置在其间。如先前所述,膜和内部半可透性膜可被适当地布置并彼此结合以在装置的内部内形成先前描述的一级隔室120、二级隔室122和三级隔室124。此外,这些分开膜中的每一者在结合区内的平面堆叠布置在示意图中清楚地示出。在替代性实施方案中,如图3所示,设置在装置的内部内的第一半可透性膜和第二半可透性膜可形成为单个整合膜。在所描绘的实施方案中,半可透性膜被成形为设置在相对的第一外膜与第二外膜之间的细长管腔。因此,当膜结合在一起时,整合膜的与第一外膜相邻的上部部分可用作第一半可透性膜116,并且整合膜的与第二外膜相邻的下部部分可用作第二半可透性膜118。另外,虽然分开的第一外膜和第二外膜在图中已被示出,但应当理解,也可设想到其中已被折叠以用作第一外膜和第二外
膜的单个膜的实施方案。
75.虽然上述实施方案包括三个隔室,但在一些实施方案中,大胶囊装置100可不包括第二半可透性膜118。在这种实施方案中,装置可仅包括一级隔室和对应的二级隔室。例如,在图4a和图4b中,大胶囊装置100可被构造来囊封细胞群,如先前所述。所述装置可包括第一外膜102、第二外膜104和设置在第一外膜与第二外膜之间的第一半可透性膜116。因此,第一半可透性膜和第一外膜可在其间形成一级隔室,并且第一半可透性膜和第二外膜可在其间形成二级隔室。类似于上述三隔室实施方案,大胶囊装置可包括一个或多个端口,诸如分别与一级隔室和二级隔室流体连通以在装置的外部与内部隔室之间提供流体连通的一级端口和二级端口。同样,在一些实施方案中,这些端口可为可密封的或可重新密封的。
76.一级隔室120和二级隔室122可通过第一半可透性膜116彼此分开,并且可通过第一半可透性膜彼此流体连通。在这个实施方案中,一级隔室、二级隔室或两者可被构造来提供容纳一个或多个细胞群的体积。另外,二级隔室可被构造来将滤液从一级隔室移除,向一级隔室提供辅助剂,或两者,如先前所述。
77.鉴于上述内容,第一外膜102、第二外膜104和第一半可透性膜116中的每一者可被构造来阻挡包含在装置内的细胞群通过。第一半可透性膜还可被构造来允许滤液穿过第一半可透性膜从一级隔室120传递到二级隔室122。另外,第一半可透性膜可被构造来允许辅助剂穿过第一半可透性膜从二级隔室传递到一级隔室,如先前所述。
78.为清楚起见,关于图5a至图5c描述了使用包括三个内部隔室(即,一级隔室、二级隔室和三级隔室)的大胶囊装置的方法。然而,下文描述的方法和材料的相对流适用于包括两个、三个、四个或任何数量的隔室的装置,因为本公开不限于使用仅包括两个或三个相关联隔室的装置。
79.图5a至图5c描绘了通过包括多个通孔114的装置的一部分截取的大胶囊装置100的剖面,所述多个通孔114类似于上文关于图1a至图1d所述的通孔。因此,大胶囊装置可包括第一外膜102和第二外膜104以及第一半可透性膜116和第二半可透性膜118,所述第一半可透性膜116和第二半可透性膜118协作以形成一级隔室120、二级隔室122和三级隔室124。如下文进一步详述,大胶囊装置的使用可包括以下中的一者或多者的任何适当组合:植入装置;将装置预血管化以形成围绕装置和/或穿过装置的通孔延伸的微脉管系统132;将一个或多个细胞群装载到一级隔室和/或二级隔室中;在二级隔室与一级隔室和/或三级隔室之间施加压差以将滤液136从一级隔室和/或三级隔室移除;以及将辅助剂138装载到二级隔室中,所述辅助剂138然后可流入一级隔室和/或三级隔室。
80.如上所述,在一些情况下,在将大胶囊装置100预血管化之后,可将一个或多个细胞群134装载到一级隔室120和/或三级隔室124中,但也可设想到其中使用大胶囊装置而无需预血管化的情况。如图5a所示,预血管化装置可通过植入装置达预定血管化时段来执行,在所述预定血管化时段期间微脉管系统可围绕装置和/或穿过通孔114生长。血管化时段可大于或等于1天、2天、3天、4天、5天、6天、7天、8天、9天、10天或任何其他适当时间段。血管化时段也可小于或等于10周、9周、8周、7周、6周、5周、4周、3周、2周、1周和/或任何其他适当时间段。设想到前述的组合,包括例如介于或等于1天和10周之间的血管化时段。当然,设想到大于和小于上述那些的血管化时段,因为本公开并不以这种方式受限制。
81.在一些情况下,在血管化时段期间对装置的隔室充气以将隔室维持在期望膨胀构
型可能是有利的。因此,在大胶囊装置的预血管化时段期间,可对一级隔室120、二级隔室122、三级隔室124或其任何组合充气。例如,流体可穿过一个或多个相关联端口(未示出)流入一级隔室、二级隔室和/或三级隔室。可用于对隔室充气的适当流体可包括任何适当的生物相容性流体。在一些实施方案中,基于外部膜和/或内部半可透性膜的对应性质,流体可能够保留在装置的内部,所述外部膜和/或内部半可透性膜可被构造来将流体保留在装置的内部。用于对隔室充气的适当流体的若干实例可包括但不限于氧气、盐水、细胞培养基、藻酸酯、脱乙酰壳多糖、右旋糖、全氟化碳及其组合。在装置的血管化期间,一旦充气到期望压力、体积和/或其他适当参数,与一级隔室、二级隔室和三级隔室相关联的端口就可被密封以将相关联隔室维持在期望充气构型中。在血管化之后,可重新打开端口,并且可以任何适当方式移除用于对隔室充气的流体。
82.如先前所述,在一些实施方案中,一级隔室120和三级隔室124中的至少一者可被构造来容纳一个或多个细胞群134并将其保留在其中。同样,一级隔室和二级隔室122可被第一半可透性膜116分开。类似地,二级隔室和三级隔室可被第二半可透性膜118分开。第一半可透性膜和第二半可透性膜可被构造来过滤来自一级隔室和/或三级隔室的滤液136。因此,当将细胞群装载到一级隔室和/或三级隔室中时,在装载期间与细胞群组合的滤液136可穿过相关联的第一半可透性膜和/或第二半可透性膜从一级隔室和/或三级隔室流入二级隔室。材料向二级隔室中的流动可通过在二级隔室与一级隔室和三级隔室中的至少一者或两者之间施加的压差来协助。此压差可使用施加到二级隔室的吸力、归因于材料流入一级隔室和/或三级隔室的压力的增加、前述的组合和/或施加偏压以致使滤液流入二级隔室的任何其他适当方法来提供。另外,在一些实施方案中,滤液可在装载过程期间和/或在装载过程之后穿过相关联端口(未描绘)移除。细胞的这种装载和滤液的移除可经由皮肤完成,但本公开不限于仅穿过经由皮肤可进入的端口移除滤液。同样,虽然三隔室装置已在图中被描绘,但上述方法也可应用于包括两个隔室和/或任何其他适当数量的隔室的装置,因为本公开并不以这种方式受限制。
83.在将期望细胞群134装载到大胶囊装置100中和/或移除滤液136之后,可向可设置在一级隔室120和/或三级隔室124内的一个或多个细胞群提供辅助剂138。例如,辅助剂可穿过相关联端口(未描绘)引入到二级隔室122中。然后,辅助剂可穿过相关联的第一半可透性膜116和第二半可透性膜118从二级隔室流入一级隔室和/或三级隔室。辅助剂从二级隔室流入一级隔室和三级隔室可能是由于因相邻隔室之间的浓度梯度和/或因相邻隔室之间的归因于辅助剂流入二级隔室的压差造成的扩散造成的。类似于移除滤液,在一些实施方案中,可经由皮肤将辅助剂138装载到二级隔室中,但也可设想到引入辅助剂的其他方法。在一个特定实施方案中,提供辅助剂可通过将内置管材与二级隔室的位于皮下的端口连接并且使辅助剂穿过端口流入二级隔室并且然后流入一级隔室和二级隔室来执行。皮下放置的端口可包括血管进入端口。当然,还设想到穿过一个或多个相关联端口将辅助剂直接装载到一级隔室和/或三级隔室中的实施方案。如先前所述,辅助剂可包括抗炎药、产氧物质、分化因子、抗凝因子、营养物、其任何组合和/或任何其他适当药剂,因为本公开并不以这种方式受限制。
84.在上述实施方案中,辅助剂可以周期性间隔被提供一次或多次。可经由二级隔室将辅助剂提供给细胞的周期性间隔可大于或等于1分钟、2分钟、5分钟、10分钟、20分钟、30
分钟、1小时、2小时、5小时、10小时、1天、2天、5天和/或任何其他适当时间间隔。对应地,辅助剂的施加之间的时间间隔可小于或等于60周、50周、20周、10周、5周、1周、5天、2天、1天和/或任何其他适当时间间隔。设想到前述范围的组合,包括例如介于或等于1分钟和60周之间的时间间隔。当然,也设想到大于和小于上述那些的时间间隔,因为本公开并不以这种方式受限制。
85.如上所述,在一些实施方案中,可在大胶囊装置100的两个或更多个隔室之间施加压差以有利于以下中的一者或多者:使细胞流入隔室中;使滤液和/或辅助剂在隔室之间流动;使滤液从隔室的端口流出;和/或使辅助剂穿过端口流动并流入相关联隔室。例如,在预血管化装置之后,可在二级隔室122与一级隔室120和三级隔室124中的一者或两者之间施加压差,以将滤液138从一级隔室和三级隔室移除。在二级隔室与一级隔室和/或三级隔室之间施加压差可与装载细胞群134同时或在这之后进行。另外,可将负压和/或正压施加到相关联隔室以生成期望压差。例如,可向隔室施加抽吸或真空,材料可流入另一隔室以增加该隔室内的压力,可使用上述的组合和/或任何其他适当方法来生成期望压差,因为本发明不限于此。此外,在一些情况下,可使用浓度梯度来诱导材料在隔室之间的流动。例如,可将大浓度的辅助剂设置在二级隔室内,所述大浓度的辅助剂然后可扩散到可具有较低浓度的辅助剂的其他相邻隔室中。
86.虽然可施加任何适当压差以在大胶囊装置的各个部分内生成期望材料流,但在一些实施方案中,施加在两个相邻隔室之间的压差可大于或等于约1atm、1.25atm、1.3atm、1.35atm、1.4atm、1.45atm、1.5atm和/或任何其他适当压差。对应地,压差可以小于或等于3atm、2.75atm、2.5atm、2.25atm、2atm、1.9atm、1.8atm、1.6atm和/或另一适当的压差。设想到上述范围的组合,包括例如介于或等于约1atm和3atm之间的压差。当然,应当理解,取决于特定应用,可使用任何适当压差,包括大于和小于上述那些的压差。
87.虽然已结合各种实施方案和实例描述了本发明教义,但本发明教义并不意图受限于此类实施方案和实例。相反,本发明教义涵盖如本领域技术人员将了解的各种替代、修改和等效物。因此,前面描述和附图仅作为实例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。