一种与绵羊f17大肠杆菌相关的mirna及其应用
技术领域
1.本发明涉及一种与绵羊f17大肠杆菌相关的mirna及其应用,属于基因工程技术领域。
背景技术:
2.据了解,腹泻型大肠杆菌是一类能够广泛引起人类和动物腹泻的常见病原之一。f17大肠杆菌是一种革兰氏阴性菌,能够引起初生羔羊大规模的腹泻,致死率高。随着养羊产业的快速现代化和规模化发展,大肠杆菌病成为制约羊产业快速发展的重要因素之一。为了提高羔羊成活率,促使中国羊产业快速健康发展,从遗传角度攻克大肠杆菌病的发病机制,从而提高羔羊对大肠杆菌的抗性是目前急需解决的难题。
3.microrna(mirna)是一类约由19
‑
22个核苷酸组成的内源性单链非编码小分子rna,几乎参与细胞所有的生命活动过程。据研究表明mirna通过调节大部分蛋白质编码基因来影响若干主要的生物学途径。然而,目前缺少调控绵羊f17大肠杆菌病的mirna标志物。
技术实现要素:
4.本发明所要解决的技术问题是,克服现有技术的不足而提供一种与绵羊f17大肠杆菌相关的mirna及其应用,可以通过对靶基因的负调控来调控小肠上皮细胞抗f17大肠杆菌的感染;可以更加深入地探究sbd2在绵羊小肠上皮细胞抗f17大肠杆菌感染中的作用及其调控机制的研究,为防御素在生产上的应用提供一定的理论依据,提高羔羊抗f17大肠杆菌的能力,提高养羊业的经济效益。
5.为了实现上述目的,本发明采用了以下技术方案:
6.本发明提供了一种与绵羊f17大肠杆菌相关的mirna,所述mirna的靶基因为sbd2,其ncbi登录号为nm_001198545.1,其核苷酸序列如seq id no.1所示。
7.本发明还提供了一种与绵羊f17大肠杆菌相关的mirna,所述mirna为mir
‑
299
‑
5p,其核苷酸序列如seq id no.2所示。
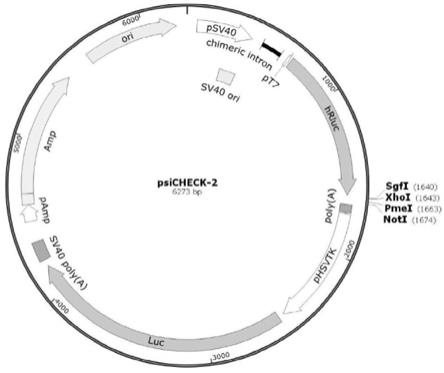
8.本发明在湖羊羔羊小肠上皮细胞感染f17大肠杆菌,约6h后检测其基因表达情况,从中筛选出f17大肠杆菌关键基因sbd2,然后通过生物信息学预测与基因sbd2具有靶向关系的mirna,即:mir
‑
299
‑
5p。
9.本发明还提供了上述与绵羊f17大肠杆菌相关的mirna在绵羊抗f17大肠杆菌感染中的应用。
10.所述的绵羊为湖羊,优选3~5日龄湖羊羔羊的小肠上皮细胞。f17大肠杆菌感染羔羊小肠上皮细胞的时间为0h和6h。
11.上述与绵羊f17大肠杆菌相关的mir
‑
299
‑
5p,在研究湖羊小肠上皮细胞抗f17大肠杆菌感染中的应用,所述mir
‑
299
‑
5p通过对靶基因sbd2的负调控来调控湖羊小肠上皮细胞抗f17大肠杆菌的感染。
12.本发明通过qrt
‑
pcr验证发现,mir
‑
299
‑
5p在湖羊小肠上皮细胞感染f17大肠杆菌
约6h后的相对表达量与基因sbd2的相对表达量呈强负相关,初步判断mir
‑
299
‑
5p与基因sbd2存在靶向关系。
13.上述应用包括mir
‑
299
‑
5p减少黏附至湖羊小肠上皮细胞上的f17大肠杆菌数量。
14.上述应用包括mir
‑
299
‑
5p用来抑制小肠上皮细胞感染f17大肠杆菌的能力。这样,mir
‑
299
‑
5p能够提高小肠上皮细胞抗f17大肠杆菌感染小肠上皮细胞的能力。
15.上述mirna包括mir
‑
299
‑
5p可作为制备预防、缓解或治疗绵羊f17大肠杆菌病的一个新的分子药物靶点。
16.与现有技术相比,本发明的优点是提供了一种与绵羊f17大肠杆菌相关的分子标志物mir
‑
299
‑
5p,可以通过对其靶基因sbd2的负调控来控制小肠上皮细胞f17大肠杆菌的感染,还可以更加深入的探究sbd2在湖羊小肠上皮细胞抗f17大肠杆菌感染中的作用及其调控机制,为防御素在生产上的应用提供一定的理论依据,进而提高羔羊抗f17大肠杆菌病的能力,提高养羊业的经济效益。本发明所公开的mir
‑
299
‑
5p还应用于为研发因f17大肠杆菌引起的疾病的抗细菌药物提供了一个新的药物靶点,可用于评价提高养羊业的经济效益。
附图说明
17.图1为本发明中psicheck
‑
2质粒图谱。
18.图2为本发明中f17大肠杆菌感染湖羊小肠上皮细胞前后mir
‑
299
‑
5p表达水平的示意图。其中与对照组相比,*表示0.01<p<0.05,**表示p<0.01。
19.图3为本发明中mir
‑
299
‑
5p mimics转染效率的验证结果示意图。
20.图4为本发明中mir
‑
299
‑
5p inhibitor转染效率的验证结果示意图。
21.图5为本发明中野生型载体鉴定结果示意图。其中a表示psicheck
‑
2,b表示野生型载体,c表示psicheck
‑
2双酶切,d~e表示野生型载体双酶切,f表示sbd2
‑3’‑
utr双酶切,1、2、3表示野生型载体菌落pcr。
22.图6为本发明中mir
‑
299
‑
5p靶位点预测图。
23.图7为本发明中野生型、突变型载体测序峰图。
24.图8为本发明中双荧光素酶活性检测结果示意图。
25.图9为本发明中mir
‑
299
‑
5p对sbd2相对表达量的影响示意图。
26.图10为本发明中mir
‑
299
‑
5p对sbd2蛋白表达的影响示意图。
27.图11为本发明中mir
‑
299
‑
5p抗f17大肠杆菌感染小肠上皮细胞的能力示意图。
具体实施方式
28.下面结合实施例对本发明的技术方案做进一步的详细说明:本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护权限不限于下述的实施。下列实施例中未注明具体条件的实验方法,按照本领域常规方法和条件,或商品说明书选择。下列实施例所涉及的试剂及材料均为市购,此处不一一列举。
29.实施例1mirna预测及筛选
30.在3~5日龄湖羊羔羊小肠上皮细胞感染f17大肠杆菌,约6h后采用qrt
‑
pcr技术检测其基因表达情况,筛选出关键基因sbd2。再利用targetscan和rnahybrid等生物信息软件
预测靶向调控sbd2的mirna,分别为oar
‑
mir
‑
299
‑
5p、oar
‑
mir
‑
370
‑
3p、oar
‑
mir
‑
412
‑
5p和oar
‑
mir
‑
541
‑
5p,同时利用qrt
‑
pcr技术对所预测的mirna进行初步筛选。sbd2的靶标mirna具体筛选方法如下:用浓度为1
×
107cfu/ml的f17大肠杆菌分别去感染湖羊小肠上皮细胞,6h后提取细胞总rna,反转录为cdna后,进行qrt
‑
pcr,以检测oar
‑
mir
‑
299
‑
5p、oar
‑
mir
‑
370
‑
3p、oar
‑
mir
‑
412
‑
5p和oar
‑
mir
‑
541
‑
5p的相对表达量。所得数据经spss 25.0分析,并由graphpad prsim 6绘制成图表(见图2)。结果表明,oar
‑
mir
‑
541
‑
5p在f17大肠杆菌感染小肠上皮细胞前后变化不明显,无统计学意义(p>0.05),oar
‑
mir
‑
370
‑
3p相对表达量在f17大肠杆菌感染小肠上皮细胞后极显著升高(p<0.01),oar
‑
mir
‑
299
‑
5p和oar
‑
mir
‑
370
‑
3p相对表达量在f17大肠杆菌感染小肠上皮细胞后极显著降低(p<0.01)。
31.实施例2sbd2的3
’‑
utr区扩增
32.2.1引物设计
33.根据genebank库中绵羊β防御素2(sbd2)的3
’‑
utr序列,利用primer 5.0软件设计引物,并在所设引物的上、下游5
′
端分别插入xhoⅰ和notⅰ酶切位点。引物由擎科生物技术(北京)有限公司,引物设计如表1所示。
34.表1 sbd2
‑3’‑
utr的引物
[0035][0036]
2.2pcr扩增sbd2片段
[0037]
以湖羊小肠上皮细胞的dna为模板,利用max dna polymerase高保真酶(takara)进行pcr扩增,具体反应液配制见表2。
[0038]
表2 pcr反应液
[0039][0040]
上述pcr反应液的配制均在冰上进行操作,配置好反应液后,瞬时离心,置于pcr仪中,进行如下反应:
[0041][0042]
得到的pcr产物利用sanprep柱式pcr产物纯化试剂盒(生工)纯化回收目的片段,然后送至擎科生物技术(北京)有限公司测序。
[0043]
实施例3双荧光素酶报告载体构建
[0044]
3.1psicheck
‑
2质粒提取
[0045]
吸取psicheck
‑
2质粒(takara),稀释后涂布于含amp 的lb固体培养基上,置于培养箱中37℃培养12
‑
16h,然后挑取单个菌落至含amp 的lb液体培养基灭菌离心管中,摇床振荡12
‑
16h,根据无内毒素质粒小提中量试剂盒endofree mini plasmid kit ii(天根)提取质粒,然后送至擎科生物技术(北京)有限公司测序,其图谱如图1所示。
[0046]
3.2sbd2
‑3’‑
utr与psicheck
‑
2质粒的酶切
[0047]
将上述回收的目的片段sbd2
‑3’‑
utr和psicheck
‑
2质粒分别用quickcut
tm
xho
ꢀⅰ
和quickcut
tm
not
ꢀⅰ
酶进行双酶切,其反应液配制见表3。
[0048]
表3双酶切反应液
[0049][0050]
反应体系置于pcr仪中于37℃孵育30min,然后利用sanprep柱式pcr产物纯化试剂盒再次纯化回收。
[0051]
3.3目的片段和质粒的连接
[0052]
将上步得到的纯化产物通过dna ligation kit ver.2.1试剂盒(takara),按照psicheck
‑
2质粒:目的片段=1:8的摩尔比混合,瞬时离心后置于pcr仪中16℃连接过夜得到连接产物,具体混合比例见表4。
[0053]
表4质粒连接反应液
[0054][0055]
3.4连接产物的转化与阳性克隆鉴定
[0056]
(1)提前将感受态细胞dh5α(takara)置于冰上解冻,开启水浴锅至42℃,soc培养基水浴融化。
[0057]
(2)吸取10μl连接产物加至100μl感受态细胞中,置于冰上静置30min。
[0058]
(3)42℃水浴锅中热激1min,立即取出冰浴2min,加入预热好的soc培养基1ml,摇床37℃振荡1h至soc培养基完全混匀。
[0059]
(4)吸取50μl菌液,涂布至含amp 的lb固体培养基上,置于培养箱中37℃培养12
‑
16h。
[0060]
(5)挑取多个单菌落至含amp 的lb液体培养基的灭菌离心管中,摇床振荡12
‑
16h。
[0061]
(6)采用无内毒素质粒小提中量试剂盒endofree mini plasmid kit ii(天根)提取质粒,再做酶切鉴定,将鉴定为阳性的质粒送至擎科生物技术(北京)有限公司测序。
[0062]
psicheck
‑
2野生型和突变型载体构建与鉴定:pcr扩增靶基因sbd2的3
’‑
utr序列,并用quickcut
tm
not i和quickcut
tm
xho i限制性内切酶酶切具有良好特异性的目的产物,连接至psicheck
‑
2双荧光素酶报告载体,质粒测序检测靶基因sbd2的3
’‑
utr片段是否成功插入载体。结果如图5所示,菌液pcr扩增验证产物经电泳后发现条带位置与目的片段位置大小相符,得到测序序列与原始序列比对结果一致,说明psicheck
‑
2报告载体构建成功。
[0063]
利用pcr突变的方法,在野生型载体基础上,设计靶序列突变引物:
[0064]
sbd2
‑
wut
–
f:
[0065]
gtccttagacagagcgtctaaaatttcacccggaataaatttt
[0066]
g
[0067]
sbd2
‑
wut
‑
r:
[0068]
caaaatttattccgggtgaaattttagacgctctgtctaaggacmir
‑
299
‑
5p靶位点预测及突变位点如图6所示:
[0069]
利用fast site
‑
directed mutagenesis kit快速定点突变试剂盒(天根)突变,将taaacca突变成tcacccg,具体步骤如下:
[0070]
以野生型载体为模板,扩增含突变位点的质粒,然后利用fastalteration dna polymerase进行扩增,并最终得到带有缺口的突变质粒。利用dpn
ꢀⅰ
消化甲基化的模板质粒,留下刚刚扩增得到的突变质粒,然后将其转化进入受体菌后,突变质粒的缺口会得到修复,从而使其能够进行复制。将质粒送南京擎科生物科技有限公司测序鉴定,测序峰图如图7所示。
[0071]
实施例4mir
‑
299
‑
5p与sbd2靶向关系验证
[0072]
4.1 293t细胞复苏与传代
[0073]
细胞复苏
[0074]
(1)将293t细胞从液氮保温桶中取出,放进pe手套中,在37℃水浴锅中迅速晃动至冻液解冻。
[0075]
(2)将冻存管里的细胞转移至灭菌离心管中,并加入等量培养液,反复吹打。
[0076]
(3)1200rpm离心5min。弃去上清液,再用pbs缓冲液轻轻冲洗细胞3次,离心,弃上清液。
[0077]
(4)用培养液重悬沉淀细胞,转入培养瓶中(培养瓶中事先加入少量培养液),培养液补足至5ml。
[0078]
(5)在倒置显微镜观察,放入co2培养箱培养,24h后换液。
[0079]
细胞传代
[0080]
(1)小心吸出旧培养液,用pbs缓冲液轻轻冲洗3次,弃去废液。
[0081]
(2)加入胰酶0.5ml(覆盖培养皿表面即可)消化细胞,置于co2培养箱中消化5min,沿培养瓶壁加入等量培养液,反复吹打贴壁细胞,终止消化,转移至灭菌离心管中。
[0082]
(3)1200rpm离心5min,弃去上清液,用pbs轻轻冲洗3次,离心,弃去废液。
[0083]
(4)加入培养液,轻轻吹打制成细胞悬液,转移至培养瓶中,补足至5ml。
[0084]
(5)在倒置显微镜下观察,放入co2培养箱。
[0085]
4.2双荧光素酶报告基因检测
[0086]
将293t细胞接种至细胞培养板中,待细胞生长融合度达60%
‑
80%时,进行细胞转染。根据jetprime转染试剂(polyplus)和mirna说明(吉玛基因),具体转染实验分组如下:
[0087]
第一组:psicheck
‑2‑
sbd2
‑
mut mir
‑
299
‑
5p mimics
[0088]
第二组:psicheck
‑2‑
sbd2
‑
mut mir
‑
299
‑
5p mimics
‑
nc
[0089]
第三组:psicheck
‑2‑
sbd2
‑
wt mir
‑
299
‑
5p mimics
[0090]
第四组:psicheck
‑2‑
sbd2
‑
wt mir
‑
299
‑
5p mimics
‑
nc
[0091]
(1)弃去转染培养板中的培养液,用不加双抗的pbs缓冲液清洗3次。
[0092]
(2)每次使用前以5
×
cell lysis buffer:ddh2o=1:4混合液,置于冰上备用。
[0093]
(3)从
‑
70℃中取出luciferase substrate,以stop&reaction buffer:renilla substrate=50:1,混匀,室温避光备用。
[0094]
(4)弃去清洗液后,每孔加入1
×
cell lysis buffer 100μl,室温静置5~10min,吹打细胞裂解产物后收集至1.5ml灭菌离心管中,12000rpm离心2min,取上清液用于后续检测。
[0095]
(5)将100μl luciferase substrate平衡至室温后加至酶标板中,小心吸取20μl细胞裂解产物至酶标板中,迅速混匀后立即至荧光检测仪检测firely luciferase报告基因活性。
[0096]
(6)在以上反应液中加入100μl新鲜配制的renilla底物工作液,迅速混匀后检测renilla substrate报告基因活性。
[0097]
采用双荧光素酶报告系统验证靶向关系:将构建成功的野生型psicheck
‑2‑
sbd2
‑
wt和突变型psicheck
‑2‑
sbd2
‑
mut双荧光素酶报告载体分别跟mir
‑
299
‑
5p mimics和negative control转染至293t细胞,通过酶标仪检测双荧光素酶荧光活性,结果如图8所示,转染mir
‑
299
‑
5p和psicheck
‑2‑
sbd2
‑
wt质粒的组荧光素酶活性与对照组的荧光素酶的活性比较,呈现差异极显著(p<0.01),转染psicheck
‑2‑
mut质粒的组荧光素酶活性与对照组的荧光素酶的活性比较,呈现差异不显著,综合以上结果,说明mir
‑
299
‑
5p的靶基因是sbd2。
[0098]
实施例5mirna功能验证
[0099]
5.1湖羊小肠上皮细胞培养与转染
[0100]
将生长状态良好的小肠上皮细胞均匀接种于细胞培养板,待细胞生长融合度至30%
‑
50%时,根据jetprime转染试剂说明书、mirna使用说明,将mir
‑
299
‑
5p mimics、mir
‑
299
‑
5p mimics
‑
nc、mir
‑
299
‑
5p inhibitor、mir
‑
299
‑
5p inhibitor
‑
nc分别转染至小肠上
皮细胞,具体操作如下:
[0101]
(1)弃细胞板中原有培养基,用pbs清洗2遍,每遍30s左右,每孔加入1ml培养基;
[0102]
(2)将mirna稀释到buffer缓冲液中涡旋5s;
[0103]
(3)加入4μl jetprime转染试剂,涡旋1s,短暂离心;室温下孵育15min;
[0104]
(4)将以上转染混合液均匀滴加到细胞板中;
[0105]
(5)轻轻地前后和左右摇晃细胞板,在37℃下孵育。
[0106]
5.2细胞总rna提取
[0107]
参考trnzol总rna提取试剂(天根)提取,具体步骤如下:
[0108]
(1)弃去细胞培养板中的旧培养液,用不含双抗的pbs缓冲液轻轻洗3次,然后加trnzol裂解液,室温放置裂解15min。收集裂解细胞液至无酶离心管中。
[0109]
(2)每1ml trnzol裂解液加入200μl氯仿,涡旋振荡15s,然后室温静置5min。
[0110]
(3)将冷冻离心机提前空转预冷至4℃,将无酶离心管中细胞液12000rpm,4℃离心15min。
[0111]
(4)此时样品分三层,将上层水相转移至新的1.5ml的无酶离心管中。
[0112]
(5)向离心管中加入与收集的水相溶液等体积的异丙醇,充分混匀,在室温下静置10min。
[0113]
(6)然后12000rpm,4℃离心10min,弃去上清液。
[0114]
(7)贴壁加入不少于所加trizol体积的75%的乙醇(用0.1%的depc水配制),上下颠倒洗涤,12000rpm,4℃离心5min,弃去上清液,然后瞬时离心,用枪头吸出剩余的液体。
[0115]
(8)室温放置2
‑
3min晾干,加入rnase free water(30
‑
60μl),反复吹打混匀,彻底溶解rna。
[0116]
(9)酶标仪测浓度,
‑
80℃保存。
[0117]
5.3mirna反转录与qrt
‑
pcr
[0118]
mir
‑
299
‑
5p的上游引物和茎环引物在诺唯赞生物科技有限公司官网设计(表5),擎科生物技术(北京)有限公司合成,下游通用引物由mirna universalqpcr master mix试剂盒(诺唯赞)自带。用u6基因作为内参检测mirna表达量。引物序列如下:
[0119]
表5引物信息表
[0120][0121]
采用mirna 1st strand cdna synthesis kit(by stem
‑
loop)(诺唯赞)试剂盒说明书反应体系如下:
[0122]
(1)配制基因组dna去除体系混合液(冰上操作):
[0123][0124]
轻轻震混,42℃,孵育2min;
[0125]
(2)配置反转录反应体系(冰上操作):
[0126][0127]
(3)pcr反应条件:25℃ 5min,50℃ 15min,85℃ 5min;
[0128]
(4)pcr产物于
‑
20℃保存,用于后续qrt
‑
pcr检测。
[0129]
参照mirna universalqpcr master mix试剂盒说明书,反应体系如下(冰上配制):
[0130][0131]
设置反应程序:95℃ 5min,95℃ 10s,60℃ 15s,40个循环;melt curve。
[0132]
5.4f17大肠杆菌菌种的复苏及培养
[0133]
复苏菌种时,将甘油菌从超低温冰箱取出,使用时应置于低温或0℃冰浴中,用接种环或牙签挑取少许冻结的菌种到平皿上,37℃培养8~12h即可。用完将菌种尽快放回超低温冰箱,接种时挑取表面已融化部分即可,不可全溶,因为反复冻融会导致细胞壁破裂。用灭菌枪头挑取单个菌落,送入添加培养基的灭菌离心管中,封好管口,37℃摇床200r/min培养。
[0134]
5.5黏附试验
[0135]
待小肠上皮细胞长至30%
‑
50%汇合度时,根据jetprime转染试剂说明书、mirna使用说明,将mir
‑
299
‑
5p mimics、mir
‑
299
‑
5p mimics
‑
nc、mir
‑
299
‑
5p inhibitor、mir
‑
299
‑
5p inhibitor
‑
nc分别转染至小肠上皮细胞,24h后,将步骤5.4培养的f17大肠杆菌菌液于4℃离心10min,弃去培养基,加入不含血清和抗生素的f12培养基使得f17大肠杆菌稀释至1
×
107cfu/ml,向每个细胞孔中加入1ml的菌液。将培养板置于37℃,5%co2培养箱培养3h,收集黏附后的上清液,保存至
‑
80℃备用。用pbs缓冲液轻洗3次,弃废液。向各个孔中加入300μl 0.5%的triton x
‑
100裂解液,裂解30min后,收集裂解液,再加200μl洗涤后收集洗涤液2次,共收集700μl液体于1.5ml灭菌离心管中,振荡混匀,倍比稀释,取稀释液涂布至lb培养皿上,倒置于37℃恒温培养箱中过夜培养,将黏附在细胞上的菌落数进行计数。
[0136]
5.6酶联免疫吸附剂测定(elisa)
[0137]
参考绵羊β防御素2(β
‑
defensins 2)酶联免疫分析(elisa)检测试剂盒说明书,具体实验步骤如下:
[0138]
(1)从步骤5.5中的
‑
80℃超低温冰箱中取出保存的样品,离心20min左右(2000
‑
3000rpm),收集上清液。
[0139]
(2)标准品的加样:标准品孔各加不同浓度的标准品50μl。
[0140]
(3)加样:分别设空白孔、待测样品孔。在酶标包被板上空白孔加50μl样品稀释液,待测样品孔中先加样品稀释液40μl,然后再加各不同浓度梯度和时间梯度的待测样品10μl,轻轻晃动混匀。
[0141]
(4)加酶:每孔加入酶标试剂100μl,空白孔除外。
[0142]
(5)温育:用封板膜封板后置37℃温育60min。
[0143]
(6)配液:将20倍浓缩洗涤液用蒸馏水20倍稀释后备用。
[0144]
(7)洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,如此重复5次,拍干。
[0145]
(8)显色:每孔先加入显色剂a50μl,再加入显色剂b50μl,轻轻震荡混匀,37℃避光显色15min。
[0146]
(9)终止:每孔加终止液50μl,终止反应。
[0147]
(10)测定:以空白孔调零,450nm波长依序测量各孔的吸光度(od值)。测定应在加终止液后15min以内进行。
[0148]
mir
‑
299
‑
5p对sbd2表达的影响:将mir
‑
299
‑
5p的模拟物和抑制物转染至小肠上皮细胞,然后提取细胞总rna,反转录为cdna后,进行qrt
‑
pcr检测sbd2的相对表达量。所得数据经spss 25.0分析,并由graphpad prsim 6绘制成图表(见图9和图10)。如图9所示,mir
‑
299
‑
5p的mimics较对照组,sbd2的相对表达量极显著降低(p<0.01),mir
‑
299
‑
5p的inhibitor较对照组,sbd2的相对表达量极显著升高(p<0.01)。如图10所示,mir
‑
299
‑
5p的mimics较对照组,sbd2的蛋白表达量极显著降低(p<0.01),mir
‑
299
‑
5p的inhibitor较对照组,sbd2的蛋白相对表达量极显著升高(p<0.01)。
[0149]
mir
‑
299
‑
5p抗f17大肠杆菌感染小肠上皮细胞的能力:将mir
‑
299
‑
5p的模拟物和抑制物转染至小肠上皮细胞,进行黏附实验,通过计算黏附至小肠上皮细胞上的菌落数,检测mir
‑
299
‑
5p对小肠上皮细胞抗f17大肠杆菌感染的能力。结果如图11所示,转染mimics组的小肠上皮细胞上黏附的菌落数极显著高于转染对照组的菌落数(p<0.01),转染inhibitor组的小肠上皮细胞上黏附的菌落数极显著低转染对照组的菌落数(p<0.01),说明mir
‑
299
‑
5p调控小肠上皮细胞抗f17大肠杆菌感染的能力。
[0150]
以上所述,仅为本发明中的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉该技术的人在本发明所揭露的技术范围内,可理解想到的变换或替换,都应涵盖在本发明的包含范围之内,因此,本发明的保护范围应该以权利要求书的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。