局部雷帕霉素制剂及其在治疗面部血管纤维瘤和其他皮肤病中的用途
发明领域
1.本发明涉及用于治疗面部血管纤维瘤和其他皮肤疾病和病症的局部雷帕霉素组合物和相关方法。
背景技术:
2.患有皮肤病的患者可能不愿与他人进行互动,并可能触发回避应对机制。可能会阻止他们完全参与或根本不参与社交和娱乐活动或就业。最终,明显的症状可能会改变患者看待自己以及未来的方式。研究已表明,成功治疗严重的皮肤病可以改善患者的症状并改变他们的外貌,从而可以改善心理症状并提高生活质量。
3.结节性硬化症(tsc)是一种由tsc1(错构瘤蛋白)或tsc2(薯球蛋白)基因突变引起的遗传性疾病。tsc1和tsc2基因产物在细胞内形成络合物,其作用是抑制哺乳动物雷帕霉素靶标(mtor)的活性。mtor信号通路刺激细胞增殖以及细胞存活。在tsc疾病状态下,tsc1或tsc2基因产物是有缺陷的,该抑制性络合物无法形成,导致mtor活性不受调节。
4.tsc的特征是患者身体许多部位将生长出许多非癌性肿瘤。这些肿瘤可能发生在皮肤、大脑、肾脏和其他器官中,在特定情况下会导致严重的健康问题。几乎所有受影响的人都有皮肤异常,包括浅色的异常皮肤斑块、皮肤隆起和增厚的区域以及指甲下的生长。面部肿瘤称为面部血管纤维瘤,发生在90%以上被诊断为tsc的患者中。它们在3到4岁左右开始出现,不会自发改善,如不及时治疗,将会导致面部毁容。
5.目前用于面部血管纤维瘤的治疗包括血管激光、化学换肤、磨皮和电干燥等。尽管此类治疗在改善面部外观方面相对有效,但结果往往不尽如人意。此外,这些方法成本高、不舒服,并且经常需要定期重复以防止复发。
6.雷帕霉素是一种大环内酯类抗生素,也被称为“西罗莫司”。nishimura,t.等人(2001)am.j.respir.crit.care med.163:498
‑
502和美国专利号6,384,046和6,258,823中进一步记载了雷帕霉素及其衍生物。在美国,雷帕霉素/西罗莫司自1999年起获得fda批准,并由惠氏(辉瑞)以商品名市售用于预防器官排斥和肾移植。以口服溶液(1mg/ml)或片剂(多种规格)的形式提供。雷帕霉素/西罗莫司于2015年5月进一步获批用于治疗淋巴管肌瘤病(lam therap.)。
7.us 2010/0305150(诺华公司)记载了用于预防和治疗神经皮肤疾病的雷帕霉素衍生物,例如由tsc介导的那些,包括结节性硬化症,以及由1型神经纤维瘤病(nf
‑
1)介导的那些。
8.us 7,416,724(密歇根大学董事会)记载了结节性硬化症患者的治疗方法,包括向所述受试者给予有效量的雷帕霉素。
9.us 6,958,153(惠氏公司)记载了使用大环内酯抗生素或免疫抑制性大环内酯治疗皮肤病,包括局部组合物中配制的雷帕霉素并且显示出在高浓度雷帕霉素(2.2%至8%)下在人受试者中的功效性。
10.us 2012/0022095(innova dermaceuticals,也公开为us 2013/0225630和us2013/0225631)记载了治疗面部血管纤维瘤和皮肤血管病变的方法,通常使用包含0.1%重量至2%重量雷帕霉素的局部雷帕霉素组合物。在使用1%雷帕霉素软膏(每天两次)对面部局部给药6周后,患有tsc的受试者红斑减少并且皮肤质地得到改善。血清雷帕霉素水平未达到检测水平(参考范围4
‑
20ng/ml)。
11.wo 2012/142145 a1(陶氏制药科技(dow pharmaceutical sciences))描述了用雷帕霉素治疗表现出毛细血管扩张、通常与面部区域炎症相关的血管扩张皮肤状况。潜在可治疗示例性病症包括红斑痤疮和其他皮肤病,例如毛发角化病、血管纤维瘤、鲜红斑痣。
12.wo 2018031789 a1(德克萨斯大学系统董事会)描述了用于治疗面部血管纤维瘤或其他皮肤病变的局部雷帕霉素组合物(按重量计0.1%至5%,液体乙二醇和皮肤病学上可接受的载体)。
13.2015年发表的一篇综述分析了目前使用局部雷帕霉素治疗tsc面部血管纤维瘤的数据。balestri等人,j.eur.acad.derm.venereology(2015),29(1),14
‑
20。共考虑了16份涉及84名患者的报告,其中94%的患者报告其病变获得改善。该研究指出,在范围为0.003%至1%的雷帕霉素浓度范围内,使用了几种不同的制剂,例如软膏、凝胶、溶液和乳膏。
14.一项早期试验研究了低剂量(0.003%或0.015%)局部雷帕霉素治疗tsc患者面部血管纤维瘤的安全性和功效。koenig等人,drugs in r&d(2012),12(3),121
‑
126。这是一项小型研究(23名受试者),其中根据主观度量对功效进行评估,即患者自我报告评估治疗是否改善其病症、使其恶化或无效。基于此类度量,联合治疗组中少于(但几乎)一半的患者报告有所改善。作者指出,结果未达到统计学意义,这意味着不能排除单独使用赋形剂的治疗作用。
15.truchuelo等人,derm.online j.(2012)8:15描述了使用乳膏基质中配制的1%局部雷帕霉素治疗由tsc引起的面部血管纤维瘤,血管纤维瘤的大小和密度得到快速改善。
16.bougueon等人(2016)描述了在二甘醇单乙醚中溶解的雷帕霉素(0.1%)配制为乳膏,用于治疗tsc患者的血管纤维瘤。bougueon等人int.j.pharma.(2016)509(1),279
‑
284。
17.尽管已经做出相当大的努力来开发用于治疗面部血管纤维瘤和其他皮肤疾病和病症的有效的局部雷帕霉素制剂,但仍需对局部制剂进行改进,其在化学上稳定雷帕霉素,抵抗非酶氧化降解,并且在物理上,无需冷却或冷藏,在室温下可防止晶体形成和生长长达一年或更长时间。此外,需实现物理化学稳定性,同时增加雷帕霉素向皮肤真皮的递送,皮肤是治疗血管纤维瘤和其他皮肤疾病和病症的目标区域。本公开内容介绍了满足该需要的呈凝胶组合物形式的雷帕霉素的局部制剂。
技术实现要素:
18.本公开内容介绍了化学和物理稳定的局部雷帕霉素组合物及其用于治疗皮肤病况、疾病或病症的方法,优选用于治疗面部血管纤维瘤和与mtor信号传导异常激活相关的其他皮肤病变的方法。此处所述的具有化学和物理稳定性的局部雷帕霉素组合物也有利地不含刺激性醇例如乙醇和异丙醇,与含有此类赋形剂的组合物相比,提供了刺激性较小的
局部组合物。此外,本文所述的局部雷帕霉素组合物有效地将治疗相关量的雷帕霉素递送至皮肤的目标层,即真皮。
19.在实施方案中,本公开内容介绍了用于局部给药的凝胶组合物,其由雷帕霉素在形成凝胶结构的基质、溶剂、抗氧化剂、适于维持组合物的ph值小于或等于ph 6的缓冲剂、以及一种或多种选自表面活性剂、湿润剂、螯合剂和防腐剂的可选赋形剂的均质混合物中的稳定悬浮液组成。
20.在实施方案中,所述形成凝胶结构的基质选自羟乙基纤维素(hec)和聚(丙烯酸)(paa)。根据本文所述的任何实施方案,聚(丙烯酸)可以是交联的聚(丙烯酸)。在所述形成凝胶结构的基质为hec的实施方案中,hec可以以0.5至5%w/w,优选约1
‑
2%w/w,或1
‑
1.75%w/w的量存在,基于所述组合物的总重量进行计算。在所述形成凝胶结构的基质为paa的实施方案中,paa可以以约0.1至3%w/w、0.1至2.25%w/w或0.25至0.75%w/w的量存在,基于所述组合物的总重量进行计算。
21.在实施方案中,所述溶剂选自丙二醇(pg)、二甲基异山梨醇(dmi)和二甘醇单乙醚,它们也可以通过其商品或tc来指代。在实施方案中,基于所述组合物的总重量进行计算,pg以约5
‑
25%w/w,优选约10
‑
15%w/w的量存在。在实施方案中,基于所述组合物的总重量进行计算,dmi或tc以约5
‑
25%w/w,优选6
‑
8%w/w的量存在。
22.根据任何一个前述实施方案,优选的抗氧化剂是丁基化羟基茴香醚(bha)。
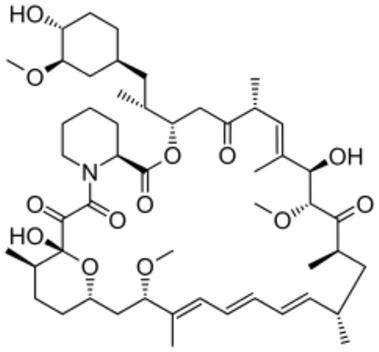
23.根据任何一个前述实施方案,所述组合物还可包含表面活性剂。在实施方案中,所述表面活性剂选自聚山梨醇酯80、聚山梨醇酯60、聚山梨醇酯40、聚山梨醇酯20、peg
‑
40硬脂酸酯、硬脂醇聚醚
‑
20(steareth
‑
20)、硬脂醇聚醚
‑
100(steareth
‑
100)、鲸蜡醇聚醚
‑
20(ceteth
‑
20)、鲸蜡硬脂醇聚醚
‑
20(ceteareth
‑
20),和十二烷基硫酸钠,优选聚山梨醇酯80。基于所述组合物的总重量进行计算,所述表面活性剂可以以约0.005至1%w/w,优选0.01至0.10%w/w的量存在。
24.根据任何一个前述实施方案,所述组合物还可包含防腐剂。在实施方案中,所述防腐剂为苯甲醇。在实施方案中,基于所述组合物的总重量进行计算,苯甲醇以约0.5%至3%w/w,优选0.5%至1.5%w/w的量存在。
25.根据任何一个前述实施方案,雷帕霉素为微粉化雷帕霉素。在实施方案中,所述微粉化雷帕霉素由具有在1
‑
5微米或2
‑
3微米范围内的d50定义的粒度分布(psd)的微粉化雷帕霉素颗粒组成。在进一步的方面,psd进一步由1
‑
2微米或1.2
‑
1.5微米范围内的d10和4
‑
8微米范围内的d90定义。所述微粉化雷帕霉素颗粒可以以约0.05%w/w至2.0%w/w的量存在。在某些实施方案中,所述微粉化雷帕霉素颗粒的存在量约为0.1%w/w,0.3%w/w、1.0%w/w或2.0%w/w,基于所述组合物的总重量进行计算。
26.在实施方案中,所述组合物包含羟乙基纤维素(hec)作为所述形成凝胶结构的基质、作为溶剂的二甲基异山梨醇(dmi)和作为抗氧化剂的丁基化羟基茴香醚(bha),其中所述雷帕霉素组合物在5℃下至少三个月保持化学降解稳定性及晶体生长物理稳定性。
27.在实施方案中,所述组合物包含羟乙基纤维素(hec)作为所述形成凝胶结构的基质,tc作为溶剂,以及作为抗氧化剂的丁基化羟基茴香醚(bha),其中所述雷帕霉素组合物在5℃下至少三个月保持化学降解稳定性及晶体生长物理稳定性。
28.在实施方案中,所述组合物包含羟乙基纤维素(hec)作为所述形成凝胶结构的基
acral hyperkeratosis)、毛囊角化过度症、先导发育不良伴屈光不正相关的毛囊角化过度症(ollicular hyperkeratosis associated with pilodental dysplasia with refractive errors)、疖病、尖锐湿疣、牙龈肥大、肉芽肿、良性家族性天疱疮、单纯性血管瘤、犬遗传性足跖角化过度(hereditary footpad hyperkeratosis as afflicting dogs)、疱疹、荨麻疹、化脓性汗腺炎、多汗症、持久性豆状角化过度病、脱色斑、鱼鳞病、脓疱病、色素性失禁症、婴幼儿血管瘤、幼年型息肉综合征、卡波西肉瘤、卡波西形血管内皮瘤、瘢痕疙瘩、微囊性淋巴管畸形、瘢痕疙瘩疤痕病、毛囊角化病侏儒症相关皮肤病、毛发角化病、kid综合征、静脉畸形骨肥大综合征(klippel
‑
trenaunay syndrome)、雀斑或肝斑、小脑发育不良性神经节细胞瘤综合征(lhermitte
‑
ducliosis syndrome)、扁平毛发苔癣、苔癣样角化病(包括扁平苔藓、硬化性苔藓)、慢性糜烂性口腔苔藓、狼疮、局限性淋巴管瘤、黑色素瘤、默克尔细胞癌、转移性黑色素瘤、微囊性淋巴管畸形、粟疹或热疹、挤奶者结节(milker’s nodule)、传染性软疣、muir
‑
torre综合征、多发性微小指状角化过度症、蝇蛆病(包括疖性蝇蛆病和迁移性蝇蛆病)、内瑟顿综合征、1型神经纤维瘤病(也称为“nf1”或多发性神经纤维瘤病)的皮肤和真皮表现、蜘蛛痣、非黑色素瘤皮肤癌、olmsted综合征、甲癣(包括白癣、足癣、甲癣、手癣、股癣、体癣、头癣、面癣、须癣、叠瓦癣、黑癣、花斑癣、隐匿性癣)、口腔扁平苔藓、由gvhd引起的口腔黏膜疾病、过度生长综合征、先天性厚甲症、脂膜炎、甲沟炎、虱病、类天疱疮、寻常型天疱疮、甲周和甲下纤维瘤、黑斑息肉综合征(peutz
‑
jeghers syndrome)、紫外线辐射引起的光老化、色素斑(包括例如斑痣和咖啡牛乳色斑、糠疹、跖角化过度综合征、普罗特斯综合征,普罗特斯样综合征、外阴瘙痒症,银屑病、热源性肉芽肿、马福奇综合征中的难治性血管内皮瘤、雷夫叙姆病、酒渣鼻、合征、鳞状细胞癌、静止性皮炎、sturge
‑
weber综合征、毛细血管扩张、毛上皮瘤、滴虫病、结节性硬化症的皮肤肿瘤表现、阴道酵母菌感染、血管畸形(包括鲜红斑和淋巴管瘤)、寻常型白癜风、疣、干皮病和着色性干皮病。
37.本公开内容还介绍了任何上述实施方案的局部雷帕霉素组合物,其用于治疗皮肤病况、疾病或病症的方法中,所述皮肤病况、疾病或病症选自bhd综合征、皮肤t细胞淋巴瘤(ctcl)、衰老或衰老引起的皮肤萎缩、1型神经纤维瘤病(也称为“nf1”或多发性神经纤维瘤病)的皮肤和真皮表现、口腔扁平苔藓、由gvhd引起的口腔黏膜疾病、先天性厚甲症、sturge
‑
weber综合征、血管畸形(包括鲜红斑和淋巴管瘤)。
38.本公开内容还介绍了一种用于在需接受该治疗的受试者中治疗皮肤病况、疾病或病症的方法,所述方法包括将本文所述的局部雷帕霉素组合物以薄薄一层组合物覆盖受影响区域的合适的量给予受试者皮肤的受影响区域。在实施方案中,所述皮肤病况、疾病或病症选自黑棘皮病、痤疮、光化性角化病、过敏性结膜炎、ameloonychohypohidrotic综合征、血管角化瘤、法布里病中的血管角化瘤、血管瘤(包括樱桃状血管瘤、老年性血管瘤、蜘蛛状血管瘤、草莓状血管瘤和丛状血管瘤)、足癣、特应性皮炎、细菌性阴道病、龟头炎、brr综合征、基底细胞癌、基底细胞痣综合征、bhd综合征、水疱橡胶泡痣综合征、臭汗症、bss综合征、大疱性类天疱疮、老茧、念珠菌病、痈病、海绵状淋巴管瘤、蜂窝组织炎、脑萎缩相关皮肤病、唇炎肉芽肿病、conradi
‑
eltinermann病、角质皮肤硬化综合征相关的皮肤病、考登病、卡斯尔曼皮肤病、皮肤幼虫移行症、皮肤结节病、皮肤t细胞淋巴瘤(ctcl)、褥疮、衰老或衰老引起的皮肤萎缩、皮炎(包括接触性皮炎、药物性皮炎、过敏性皮炎、钱币状皮炎、口周皮炎、神
经性皮炎、脂溢性皮炎和特应性皮炎)、隆突性皮肤纤维肉瘤、皮肤癣菌病、弥漫性微囊性淋巴管畸形、盘状红斑狼疮、汗疱性湿疹、先天性角化不良、脓疮、湿疹、疣状表皮发育不良、单纯性大疱性表皮松解症、表皮松解性鱼鳞病、上皮痣(包括疣状痣、序列性痣、炎性线状疣状表皮痣和皮脂腺痣)、丹毒、多形性红斑、变异性红斑角化病、乳房外佩吉特病、家族性圆柱瘤病、家族性多发性盘状纤维瘤、丝虫病、局灶性肢端角化过度、毛囊角化过度症、先导发育不良伴屈光不正相关的毛囊角化过度症、疖病、尖锐湿疣、牙龈肥大、肉芽肿、良性家族性天疱疮、单纯性血管瘤、犬遗传性足跖角化过度、疱疹、荨麻疹、化脓性汗腺炎、多汗症、持久性豆状角化过度病、脱色斑、鱼鳞病、脓疱病、色素性失禁症、婴幼儿血管瘤、幼年型息肉综合征、卡波西肉瘤、卡波西形血管内皮瘤、瘢痕疙瘩、微囊性淋巴管畸形、瘢痕疙瘩疤痕病、毛囊角化病侏儒症相关皮肤病、毛发角化病、kid综合征、静脉畸形骨肥大综合征、雀斑或肝斑、小脑发育不良性神经节细胞瘤综合征、扁平毛发苔癣、苔癣样角化病(包括扁平苔藓、硬化性苔藓)、慢性糜烂性口腔苔藓、狼疮、局限性淋巴管瘤、黑色素瘤、默克尔细胞癌、转移性黑色素瘤、微囊性淋巴管畸形、粟疹或热疹、挤奶者结节、传染性软疣、muir
‑
torre综合征、多发性微小指状角化过度症、蝇蛆病(包括疖性蝇蛆病和迁移性蝇蛆病)、内瑟顿综合征、1型神经纤维瘤病(也称为“nf1”或多发性神经纤维瘤病)的皮肤和真皮表现、蜘蛛痣、非黑色素瘤皮肤癌、olmsted综合征、甲癣(包括白癣、足癣、甲癣、手癣、股癣、体癣、头癣、面癣、须癣、叠瓦癣、黑癣、花斑癣、隐匿性癣)、口腔扁平苔藓、由gvhd引起的口腔黏膜疾病、过度生长综合征、先天性厚甲症、脂膜炎、甲沟炎、虱病、类天疱疮、寻常型天疱疮、甲周和甲下纤维瘤、黑斑息肉综合征、紫外线辐射引起的光老化、色素斑(包括例如斑痣和咖啡牛乳色斑、糠疹、跖角化过度综合征、普罗特斯综合征,普罗特斯样综合征、外阴瘙痒症,银屑病、热源性肉芽肿、马福奇综合征中的难治性血管内皮瘤、雷夫叙姆病、酒渣鼻、鳞状细胞癌、静止性皮炎、sturge
‑
weber综合征、毛细血管扩张、毛上皮瘤、滴虫病、结节性硬化症的皮肤肿瘤表现、阴道酵母菌感染、血管畸形(包括鲜红斑和淋巴管瘤)、寻常型白癜风、疣、干皮病和着色性干皮病。在实施方案中,所述皮肤病况、疾病或病症选自bhd综合征、皮肤t细胞淋巴瘤(ctcl)、衰老或衰老引起的皮肤萎缩、1型神经纤维瘤病(也称为“nf1”或多发性神经纤维瘤病)的皮肤和真皮表现、口腔扁平苔藓、由gvhd引起的口腔黏膜疾病、先天性厚甲症、sturge
‑
weber综合征、血管畸形(包括鲜红斑和淋巴管瘤)。
39.本公开内容还介绍了一种用于在需要这种治疗的人受试者中治疗面部血管纤维瘤的方法,所述方法包括将本文所述的局部雷帕霉素组合物以薄薄一层组合物覆盖受影响区域的合适的量给予受试者皮肤的受影响区域。
40.本公开内容还介绍了一种用于制备本文所述的局部雷帕霉素组合物的方法,所述方法包括:在第一个容器中将抗氧化剂溶解在溶剂中,随后边连续混合边加入凝胶基质来制备溶剂相;在第二个容器中通过将表面活性剂、防腐剂、缓冲剂和任何可用赋形剂溶解在水中以便制备水相;在连续混合下将微粉化雷帕霉素分散到所述水相中,对所述水相进行高剪切均化,且在连续混合下将所述溶剂相与所述水相合并直至所述溶剂相和所述水相形成均匀的凝胶组合物。
41.还提供了一种包含本文所述的局部雷帕霉素组合物的制品或包装。在所述制品或包装的实施方案中,所述组合物包含在密封的或可密封的具有环氧树脂涂层的铝管中。
附图说明
42.图1a
‑
c显示了使用(a)等度方法使用0.2mg/ml雷帕霉素标准品稀释液,(b)梯度方法使用0.2mg/ml雷帕霉素标准品,和(c)梯度方法使用15g/ml山高雷帕霉素(secorapamycin)的hplc色谱图。
43.图2显示了在5℃、25℃和40℃下、在ph 3、5和无缓冲条件下储存1周后雷帕霉素ph稳定性筛选的结果。
44.图3显示了在5℃、25℃和40℃下储存1周后,溶剂(10%)和温度对雷帕霉素稳定性的影响。pg,丙二醇;tc,二甘醇单乙醚dmi,二甲基。
具体实施方式
45.本公开内容涉及局部雷帕霉素组合物及其在面部血管纤维瘤和其他与mtor信号传导异常激活相关的皮肤病变治疗方法中的应用。术语“雷帕霉素”和“西罗莫司”可互换使用,是指由吸水链霉菌产生的大环内酯,分子式为c
51
h
79
no
13
,分子量为914.172g/mol,cas号为53123
‑
88
‑
9。本公开内容介绍了改进的局部凝胶制剂,其表现出活性成分雷帕霉素的物理和化学稳定性。例如,本文描述的组合物表现出优异的物理化学稳定性并且在环境温度下对雷帕霉素晶体生长和化学降解都是稳定的。此处所述的具有物理化学稳定性的组合物进一步改善了剂量均匀性,以及更有效地将雷帕霉素递送至皮肤的目标真皮层。此处描述的制剂对雷帕霉素的降解具有化学稳定性,包括其降解为山高雷帕霉素a或b,山高雷帕霉素a或b在本文所述局部制剂的背景下特别不利,因为山高雷帕霉素可能作为mtor的不良激活剂,信号通路试图通过雷帕霉素的治疗应用受到抑制。
46.目前,有两种商业化的液体雷帕霉素溶液,一种是口服的,一种是注射的。口服溶液是一种含有磷脂赋形剂混合物的水性基质,所述磷脂赋形剂混合物包含卵磷脂、乙二醇、向日葵油、抗坏血酸棕榈酸酯、大豆脂肪酸、乙醇和聚山梨酯80。在2
‑
8℃下储存。可注射的雷帕霉素溶液(西罗莫司脂化物,雷帕霉素的二甲基丙酸酯)是含有dl
‑
α
‑
生育酚和柠檬酸的在酒精和丙二醇的非水溶液。在2
‑
8℃下储存。因此,这两种市售雷帕霉素制剂都需进行冷藏,以便长期储存和保持稳定。相比之下,本文所述的局部制剂提供在室温(25℃)下物理和化学稳定至少6个月,优选长达1年或更长时间的雷帕霉素凝胶组合物。
47.在二甘醇单乙醚中溶解(浓度0.1%)并在商业保湿剂vanicream
tm
中配制成霜剂的雷帕霉素已被实验性地用于治疗tsc患者的血管纤维瘤(truchuelo等人.derm.online j.(2012)8:15)。与在vanicream
tm
中配制的雷帕霉素相比,本文所述的局部制剂提供了物理和化学稳定的雷帕霉素凝胶组合物,其向皮肤真皮层提供优异的药物递送。
48.与参考制剂相比,本文所述制剂的此类及其他有利特性提供了雷帕霉素向皮肤改进的靶向递送。
49.局部雷帕霉素组合物
50.本公开内容介绍了包含微粉化雷帕霉素的凝胶组合物形式的局部雷帕霉素制剂及其制备方法。雷帕霉素为白色至灰白色粉末,一般认为不溶于水,溶解度极低,仅为2.6μg/ml。雷帕霉素易溶于苯甲醇、氯仿、丙酮和乙腈。雷帕霉素的异构体是已知的,例如异构体b和异构体c,其结构如美国专利号7,384,953中所示。
51.通常,雷帕霉素是b和c异构体的混合物。在溶液中,雷帕霉素异构体b和c相互转化并达到平衡。文献中常见的惯例为描绘以b异构体的形式的雷帕霉素的结构,其形式如下所示。
[0052][0053]
在本文所述组合物和方法的实施方案中,api是雷帕霉素,其异构体b∶c比率小于30∶1或小于35∶1。在实施方案中,api是雷帕霉素,其异构体b∶c比率大于30∶1或大于35∶1。在一个实施方案中,雷帕霉素的异构体c的含量为3.5%至10%。
[0054]
作为对非酶促氧化降解敏感并且水溶性较差的药物,雷帕霉素在制剂方面面临诸多挑战。此外,正如以下试验内容所述,发现雷帕霉素悬浮液制剂易于形成和生长固体晶体,这对获得稳定均质的雷帕霉素悬浮液的目标造成了额外的挑战。
[0055]
本文提供的凝胶组合物中雷帕霉素颗粒的粒度分布(psd)由1
‑
5微米范围内的d50定义。d50参数是指对应于50%处的累积粒度分布的粒度值,它表示50%样品以下的颗粒大小。在实施方案中,所述制剂的雷帕霉素组分可进一步由d10和d90参数定义,其表示对应于10%或90%的累积粒度分布的粒度值。在实施方案中,本文描述的凝胶组合物的雷帕霉素的粒度分布(psd)由0.5
‑
1.6微米范围内的d10、
[0056]1‑
5微米范围内的d50和4
‑
8微米范围内的d90定义。psd可以通过本领域已知的方法确定,例如通过激光衍射。此处所述的局部制剂雷帕霉素psd必须保持在上文指定的相对较窄的范围内,以确保分散在所述凝胶组合物中的药物颗粒的含量均一性。例如,由药物颗粒的沉降或团聚所证明的含量均一性的缺乏可导致给药错误和生物利用度降低,从而不利地影响所述组合物的安全性和功效。
[0057]
可用于获得具有所需psd的雷帕霉素颗粒的微粉化药物颗粒的方法包括喷射研磨、湿磨、球磨和高压均化。
[0058]
如下文实施例中详细描述的,申请人测试了多种局部组合物,其包含以羟乙基纤维素(hec)、聚(丙烯酸)和鲸蜡硬脂醇聚醚
‑
20/十八十六醇形式的形成凝胶或乳膏结构的基质。术语“聚(丙烯酸)”和“聚丙烯酸”在本文中可互换使用,并且“paa”在本文中可用作这些术语的缩写。paa也以商品名carbomer
tm
为人所知。每种形成凝胶或乳膏结构的基质(在本文中可简称为“凝胶基质”或“乳膏基质”)均使用预配制测试中作为雷帕霉素的主要溶剂所确定的三种溶剂之一进行配制。它们是丙二醇(pg)、二甘醇单乙醚( 或tc)和二甲基异山梨醇(dmi)。预配制工作还确定雷帕霉素在存在抗氧化剂的酸性ph值下最稳定。预配制研究进一步确定作为抗氧化剂的丁基化羟基茴香醚(bha)优于维生素e。在不同的温度
条件下,对各种制剂随时间推移的物理和化学稳定性进行了测试。这项工作确定了四种先导凝胶组合物具有必要的物理化学稳定性。开展进一步的体内测试,以便确定安全性(最大耐受剂量)和功效(雷帕霉素递送至皮肤真皮层的量)。如以下实施例部分所示,与vanicream
tm
中的雷帕霉素制剂相比,先导制剂可有效地向皮肤真皮层递送10至100倍更多的雷帕霉素。
[0059]
因此,本公开内容提供了局部雷帕霉素凝胶组合物,其由雷帕霉素在形成凝胶结构的基质、溶剂、抗氧化剂、适于维持组合物酸性ph小于或等于6的缓冲剂以及一种或多种选自表面活性剂、湿润剂、螯合剂和防腐剂的可选赋形剂的均质混合物中的稳定悬浮液组成。
[0060]
在实施方案中,所述组合物的ph在5.5和6.0之间,或ph在4和5之间。
[0061]
在实施方案中,微粉化雷帕霉素以0.05%w/w至2.0%w/w的量存在于凝胶组合物中。在一些实施方案中,雷帕霉素以0.1%w/w、0.3%w/w或1.0%w/w的量存在于凝胶组合物中。在实施方案中,微粉化雷帕霉素包含小于10%的雷帕霉素异构体c。在实施方案中,微粉化雷帕霉素的粒度分布(psd)由1.2
‑
1.5微米范围内的d10、2.4
‑
2.8微米范围内的d50,4.5
‑
5微米范围内d90所定义。
[0062]
在实施方案中,所述凝胶组合物包含羟乙基纤维素(hec)或paa作为形成凝胶结构的基质以及选自二甲基异山梨醇(dmi)、二甘醇单乙醚(transcutol或tc)和丙二醇(pg)的溶剂。在一个实施方案中,所述形成凝胶结构的基质为paa,所述溶剂选自二甲基异山梨醇(dmi)、二甘醇单乙醚(transcutol或tc)和丙二醇(pg)。在一个实施方案中,所述形成凝胶结构的基质为羟乙基纤维素(hec)且所述溶剂是丙二醇。在一些实施方案中,paa是卡波姆(carbomer),例如具有800至1000,优选950
‑
1000范围内的分子量卡波姆,例如卡波姆
tm
980。所述形成凝胶结构的基质,对于hec,可以约0.5至5%w/w,优选约1
‑
2%w/w,或1
‑
1.75%w/w的量存在,基于所述组合物的总重量进行计算,或对于paa,约0.1至3%w/w,0.1至2.25%w/w,或0.25至0.75%w/w。基于对于dmi或tc的组合物的总重量进行计算,所述溶剂可以约5
‑
25%w/w,优选6
‑
8%w/w的量存在,或对于pg,以约5
‑
25%w/w,优选约10
‑
15%w/w的量存在。
[0063]
在实施方案中,所述抗氧化剂可选自α生育酚,也称为生育酚或维生素e、抗坏血酸、抗坏血酸棕榈酸酯、丁基化羟基茴香醚、丁基羟基甲苯、柠檬酸一水合物、异抗坏血酸、油酸乙酯、富马酸、苹果酸、单硫代甘油、磷酸、焦亚硫酸氢钾、丙酸、没食子酸丙酯、抗坏血酸钠、亚硫酸氢钠、焦亚硫酸钠、亚硫酸钠、柠檬酸一水合物、酒石酸和百里酚。在实施方案中,优选的抗氧化剂是丁基化羟基茴香醚(bha)。
[0064]
在实施方案中,所述组合物包含一种或多种选自表面活性剂、湿润剂、螯合剂和防腐剂的可选赋形剂。通常,可选赋形剂的存在量小于2%w/w。本公开内容中的所有重量百分比均基于所述凝胶组合物的总重量进行计算。
[0065]
在实施方案中,所述组合物不包含矿物油、失水山梨醇倍半油酸酯、凡士林、地蜡、对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、peg
‑
6油酸酯和聚乙氧基化蓖麻油中的一种或多种。
[0066]
在所述组合物包含表面活性剂的实施方案中,所述表面活性剂可选自聚山梨醇酯,优选聚山梨醇酯80(“ps80”,也称为tween
tm
80、脱水山梨糖醇单油酸酯或聚氧乙烯脱水山梨糖醇油酸酯);聚乙二醇(peg)脂肪酸酯,包括月桂酸、油酸和硬脂酸的酯,包括单酯例
如peg
‑
8月桂酸酯、peg
‑
8油酸酯、peg
‑
8硬脂酸酯、peg
‑
9油酸酯、peg
‑
10月桂酸酯、peg
‑
10油酸酯、peg
‑
12月桂酸酯、peg
‑
12油酸酯、peg
‑
15油酸酯、peg
‑
20月桂酸酯和peg
‑
20油酸酯,和二酯,例如peg
‑
20二月桂酸酯、peg
‑
20二油酸酯、peg
‑
20二硬脂酸酯、peg
‑
32二月桂酸酯和peg
‑
32二油酸酯,以及任何上述单酯和二酯的混合物。在进一步的实施方案中,所述表面活性剂可以选自苯扎氯铵、苄索氯铵、十六烷基氯化吡啶、十二烷基三甲基溴化铵、十二烷基硫酸钠、二烷基甲基苄基氯化铵、依酚氯铵、溴化度米芬、磺基琥珀酸钠的二烷基酯、磺基琥珀酸钠二辛酯钠、胆酸钠和牛磺胆酸钠。在实施方案中,所述表面活性剂以小于0.10%w/w的量存在。优选的表面活性剂包括聚山梨醇酯80。
[0067]
在所述组合物包含湿润剂的实施方案中,所述湿润剂可选自海藻酸铵环甲硅油、甘油、聚葡萄糖、丙二醇、透明质酸钠、乳酸钠、山梨糖醇、海藻糖、三醋精、三乙醇胺和木糖醇。
[0068]
在所述组合物包含螯合剂的实施方案中,所述螯合剂可选自柠檬酸一水合物、依地酸二钾、依地酸二钠、依地酸二钠钙、依地酸、富马酸、苹果酸、麦芽酚、依地酸钠和依地酸三钠。
[0069]
在所述组合物包含防腐剂的实施方案中,所述防腐剂也可以是抗微生物剂,例如抗菌剂或抗真菌剂。适当的防腐剂包括苯扎氯铵、苯甲酸、苯甲醇、硼酸、溴硝丙二醇、丁基化羟基茴香醚、对羟基苯甲酸丁酯、二氧化碳、西曲溴铵、氯化十六烷基吡啶、氯丁醇、氯己定、氯丁醇、氯甲酚、氯二甲酚、甲酚、二甲醚、对羟基苯甲酸乙酯、甘油、海克替啶、咪脲、异丙醇、乳酸、单硫代甘油、苯氧乙醇、苯乙醇、苯甲酸钾、焦亚硫酸钾、山梨酸钾、丙酸、没食子酸丙酯、丙二醇、乙酸钠、苯甲酸钠、硼酸钠、乳酸钠、焦亚硫酸钠、丙酸钠、亚硫酸钠、山梨酸和依地酸。在实施方案中,所述防腐剂以小于1.5%w/w的量存在。优选的防腐剂是苯甲醇。
[0070]
在实施方案中,所述凝胶组合物包含0.1
‑
2.0%w/w雷帕霉素,或约0.1%w/w、0.3%w/w、1%w/w或2.0%w/w的雷帕霉素,羟乙基纤维素作为凝胶基质,作为溶剂的丙二醇,以及作为抗氧化剂的丁基化羟基茴香醚(bha)。在实施方案中,所述凝胶基质和溶剂一起占所述组合物的约15%w/w。在实施方案中,所述凝胶组合物进一步包含0.01至0.10%w/w的聚山梨醇酯80和0.5至1.5%w/w的苄醇。在实施方案中,所述凝胶组合物在5℃和25℃下至少6个月且在40℃下至3个月对雷帕霉素晶体生长物理稳定并且对非酶促雷帕霉素降解产物的形成,保持化学稳定性。所述组合物的示例性具体实施方案在下表a
‑
a2中提供。
[0071]
表a示例性的0.1%、1.0%、2.0%的雷帕霉素凝胶组合物
[0072][0073]
表a1 0.3%计量组成的雷帕霉素局部凝胶,包装在15克涂有环氧树脂的铝管中。
[0074][0075][0076]
表a2 1.0%计量组成的雷帕霉素局部凝胶,包装在15克涂有环氧树脂的铝管中。
[0077][0078]
在一些实施方案中,所述凝胶组合物包含0.1
‑
2.0%w/w微粉化雷帕霉素、作为凝胶基质的聚(丙烯酸)、作为溶剂的dmi和作为抗氧化剂的bha。在实施方案中,所述凝胶基质和溶剂一起占所述组合物的约8%w/w。在实施方案中,所述凝胶组合物进一步包含0.01至0.10%w/w聚山梨醇酯80和0.5至1.5%w/w苯甲醇。在实施方案中,所述凝胶组合物在5℃下至少6个月并且在25℃或40℃下至少2个月对雷帕霉素晶体生长物理稳定以及对非酶促雷帕霉素降解产物的形成保持化学稳定性。
[0079]
在一些实施方案中,所述凝胶组合物包含0.1
‑
2.0%w/w微粉化雷帕霉素、作为凝胶基质的聚(丙烯酸)、作为溶剂的tc和作为抗氧化剂的bha。在实施方案中,所述凝胶基质和溶剂一起占所述组合物的约8%w/w。在实施方案中,所述凝胶组合物进一步包含0.01至0.10%w/w聚山梨醇酯80和0.5至1.5%w/w苯甲醇。在实施方案中,所述凝胶组合物在5℃下至少6个月并且在25℃或40℃下至少2个月对雷帕霉素晶体生长物理稳定以及对非酶促雷帕霉素降解产物的形成保持化学稳定性。
[0080]
在一些实施例中,所述凝胶组合物包含0.1
‑
2.0%w/w微粉化雷帕霉素、作为凝胶基质的聚(丙烯酸)、作为溶剂的丙二醇和作为抗氧化剂的bha。在实施方案中,所述凝胶基质和溶剂一起占所述组合物的约13%w/w。在实施方案中,所述凝胶组合物进一步包含0.01至0.10%w/w的聚山梨醇酯80和0.5至1.5%w/w的苯甲醇。在实施方案中,所述凝胶组合物在5℃下至少6个月并且在25℃或40℃下至少1个月对雷帕霉素晶体生长物理稳定以及对非酶促雷帕霉素降解产物的形成保持化学稳定性。
[0081]
在制备本文所述的凝胶组合物的示例性方法中,凝胶在两相(溶剂相和水相)中混合,溶剂相含有凝胶基质、溶剂和抗氧化剂,水相含有微粒雷帕霉素分散在包含缓冲剂、表面活性剂、防腐剂和任何可选的赋形剂的酸化水溶液(ph 4
‑
6)中的悬浮液。根据示例性方法,所述凝胶组合物可被描述为溶剂相和水相的均匀混合物,溶剂相包含形成凝胶结构的基质或“凝胶基质”、溶剂和抗氧化剂,以及水相包含悬浮液中的雷帕霉素微粉化颗粒、缓冲剂、水和一种或多种——当存在时——的任选赋形剂。
[0082]
例如,如下制备组合物。将溶剂相和水相分别制备,然后合并。通过将抗氧化剂溶
解在溶剂中,然后在连续混合下加入凝胶基质来制备溶剂相。通过将缓冲剂、表面活性剂、防腐剂和任何可选赋形剂溶解在纯化水中,然后在连续混合下将微粉化雷帕霉素分散到水相中,然后使水相经受高剪切均质化来制备水相。随后在连续混合下将溶剂相与水相合并,直到溶剂相和水相形成均匀的凝胶组合物。
[0083]
在更详细的示例性方法中,将抗氧化剂bha加入溶剂丙二醇中,并混合溶解。一旦bha完全溶解在溶剂中,在连续混合下加入凝胶基质羟乙基纤维素。将表面活性剂、聚山梨醇酯80、防腐剂、苯甲醇、缓冲剂、柠檬酸钠/柠檬酸和螯合剂依地酸二钠依次加入单独容器或器皿中的纯净水中,使每种成分在添加下一成分前充分溶解。然后在连续混合下将微粉化雷帕霉素加入水相中直至分散。然后,使用高剪切均化器,例如罗斯高剪切均化器将水相均化30分钟。均化后,例如使用lightnin混合器,立即对水相进行连续混合,然后加入溶剂相,并保持连续混合约45分钟以使凝胶水合。
[0084]
在更详细的示例性方法中,将抗氧化剂bha加入溶剂丙二醇中,并混合溶解。一旦bha完全溶解在溶剂中,在连续混合下加入凝胶基质羟乙基纤维素。在单独的容器或器皿中,将表面活性剂、聚山梨醇酯80、防腐剂、苯甲醇、缓冲剂、柠檬酸钠/柠檬酸和螯合剂依地酸二钠依次加入纯净水中,使每种成分在加入下一成分前充分溶解。然后在连续混合下将微粉化雷帕霉素加入水相中直至分散。然后,使用高剪切均化器,例如罗斯高剪切均化器将水相均化30分钟。均化后,例如使用lightnin混合器,立即对水相进行连续混合,然后加入溶剂相,并保持连续混合约45分钟以使凝胶水合。
[0085]
本公开内容还提供了制品或包装,其包含容纳在密封或可密封的涂有环树脂的铝管中的如本文所述的局部雷帕霉素凝胶组合物。在实施方案中,所述组合物在5℃下至少6个月并且在25℃或40℃下至少1、2、3、5或6个月物理和化学稳定。
[0086]
使用方法
[0087]
本公开内容还介绍了用于将雷帕霉素局部递送至受试者所需的皮肤组织,特别是皮肤的真皮层的组合物。本公开内容还介绍了通过向受试者的皮肤给予有效量的本文所述的局部雷帕霉素凝胶组合物来治疗需要这种治疗的受试者的皮肤病况、疾病或病症的方法。在本文所述方法的上下文中,术语“治疗”(treat),“治疗”(treatment)和“治疗”(treating)是指皮肤病变的严重性、持续时间或进展的减少,例如通过临床参数来评估,包括以下一项或多项临床参数:红斑存在和/或范围、平均病变大小、受影响区域内病变的数量和密度以及受累百分比(percent involvement)。在实施方案中,“治疗”还可以包括减少新的皮肤病变的出现,例如面部血管纤维瘤、血管瘤、血管畸形、化脓性肉芽肿、原发性毛细血管扩张、家族性多发性盘状纤维瘤和樱桃状血管瘤。
[0088]
需要治疗的受试者优选为人受试者。在实施方案中,受试者是被诊断患有lam或结节性硬化症(tsc)的人受试者。在实施方案中,有需要的受试者是患有选自血管瘤、血管畸形、化脓性肉芽肿、原发性毛细血管扩张症、家族性多发性盘状纤维瘤和樱桃状血管瘤的皮肤病况、疾病或病症的受试者。在实施方案中,血管畸形是鲜红斑或淋巴管瘤。在实施方案中,所需的受试者诊断为患有普罗特斯综合征、brooke
‑
speigler综合征、皮脂腺痣、表皮痣、口腔扁平苔藓、螯炎肉芽肿、1型神经纤维瘤病、过度生长综合征或牙龈肥大的人类患者。在本公开的上下文中,术语“患者”通常是指具有诊断的人受试者。
[0089]
在实施方案中,所述皮肤病况、疾病或病症选自黑棘皮病、痤疮、光化性角化病、过
敏性结膜炎、ameloonychohypohidrotic综合征、血管角化瘤、法布里病中的血管角化瘤、血管瘤(包括樱桃状血管瘤、老年性血管瘤、蜘蛛状血管瘤、草莓状血管瘤和丛状血管瘤)、足癣、特应性皮炎、细菌性阴道病、龟头炎、brr综合征、基底细胞癌、基底细胞痣综合征、bhd综合征、水疱橡胶泡痣综合征、臭汗症、bss综合征、大疱性类天疱疮、老茧、念珠菌病、痈病、海绵状淋巴管瘤、蜂窝组织炎、脑萎缩相关皮肤病、唇炎肉芽肿病、conradi
‑
eltinermann病、角质皮肤硬化综合征相关的皮肤病、考登病、卡斯尔曼皮肤病、皮肤幼虫移行症、皮肤结节病、皮肤t细胞淋巴瘤(ctcl)、褥疮、衰老或衰老引起的皮肤萎缩、皮炎(包括接触性皮炎、药物性皮炎、过敏性皮炎、钱币状皮炎、口周皮炎、神经性皮炎、脂溢性皮炎和特应性皮炎)、隆突性皮肤纤维肉瘤、皮肤癣菌病、弥漫性微囊性淋巴管畸形、盘状红斑狼疮、汗疱性湿疹、先天性角化不良、脓疮、湿疹、疣状表皮发育不良、单纯性大疱性表皮松解症、表皮松解性鱼鳞病、上皮痣(包括疣状痣、序列性痣、炎性线状疣状表皮痣和皮脂腺痣)、丹毒、多形性红斑、变异性红斑角化病、乳房外佩吉特病、家族性圆柱瘤病、家族性多发性盘状纤维瘤、丝虫病、局灶性肢端角化过度、毛囊角化过度症、先导发育不良伴屈光不正相关的毛囊角化过度症、疖病、尖锐湿疣、牙龈肥大、肉芽肿、良性家族性天疱疮、单纯性血管瘤、犬遗传性足跖角化过度、疱疹、荨麻疹、化脓性汗腺炎、多汗症、持久性豆状角化过度病、脱色斑、鱼鳞病、脓疱病、色素性失禁症、婴幼儿血管瘤、幼年型息肉综合征、卡波西肉瘤、卡波西形血管内皮瘤、瘢痕疙瘩、微囊性淋巴管畸形、瘢痕疙瘩疤痕病、毛囊角化病侏儒症相关皮肤病、毛发角化病、kid综合征、静脉畸形骨肥大综合征、雀斑或肝斑、小脑发育不良性神经节细胞瘤综合征、扁平毛发苔癣、苔癣样角化病(包括扁平苔藓、硬化性苔藓)、慢性糜烂性口腔苔藓、狼疮、局限性淋巴管瘤、黑色素瘤、默克尔细胞癌、转移性黑色素瘤、微囊性淋巴管畸形、粟疹或热疹、挤奶者结节、传染性软疣、muir
‑
torre综合征、多发性微小指状角化过度症、蝇蛆病(包括疖性蝇蛆病和迁移性蝇蛆病)、内瑟顿综合征、1型神经纤维瘤病(也称为“nf1”或多发性神经纤维瘤病)的皮肤和真皮表现、蜘蛛痣、非黑色素瘤皮肤癌、olmsted综合征、甲癣(包括白癣、足癣、甲癣、手癣、股癣、体癣、头癣、面癣、须癣、叠瓦癣、黑癣、花斑癣、隐匿性癣)、口腔扁平苔藓、由gvhd引起的口腔黏膜疾病、过度生长综合征、先天性厚甲症、脂膜炎、甲沟炎、虱病、类天疱疮、寻常型天疱疮、甲周和甲下纤维瘤、黑斑息肉综合征、紫外线辐射引起的光老化、色素斑(包括例如斑痣和咖啡牛乳色斑、糠疹、跖角化过度综合征、普罗特斯综合征,普罗特斯样综合征、外阴瘙痒症,银屑病、热源性肉芽肿、马福奇综合征中的难治性血管内皮瘤、雷夫叙姆病、酒渣鼻、合征、鳞状细胞癌、静止性皮炎、sturge
‑
weber综合征、毛细血管扩张、毛上皮瘤、滴虫病、结节性硬化症的皮肤肿瘤表现、阴道酵母菌感染、血管畸形(包括鲜红斑和淋巴管瘤)、寻常型白癜风、疣、干皮病和着色性干皮病。
[0090]
在实施方案中,所述皮肤病况、疾病或病症选自bhd综合征、皮肤t细胞淋巴瘤(ctcl)、衰老或衰老引起的皮肤萎缩、1型神经纤维瘤病(也称为“nf1”或多发性神经纤维瘤病)的皮肤和真皮表现、口腔扁平苔藓、由gvhd引起的口腔黏膜疾病、先天性厚甲症、sturge
‑
weber综合征、血管畸形(包括鲜红斑和淋巴管瘤)。
[0091]
本文所述的局部雷帕霉素组合物可有效地将治疗有效量的雷帕霉素递送至有需要的受试者的皮肤真皮层。在实施方案中,在小型猪试验中,以20mg剂量给予的本文所述组合物可有效地将16
‑
41μg雷帕霉素递送至1g皮肤真皮层。
[0092]
本文所述的组合物在将治疗有效量的雷帕霉素递送至受试者皮肤,同时避免全身
暴露(systemic exposure)的方法中特别有用。优选地,通过本文所述的局部组合物给予雷帕霉素的受试者在所述组合物给予受试者的皮肤后12至24小时内将表现出低于1或2ng/ml的雷帕霉素血液水平。
[0093]
在实施方案中,本文所述组合物中雷帕霉素量可确保有效治疗面部血管纤维瘤或其他皮肤病变,包括血管瘤、血管畸形、化脓性肉芽肿、原发性毛细血管扩张症、家族性多发性盘状纤维瘤和樱桃状血管瘤。
[0094]
在实施方案中,雷帕霉素的有效量是根据本文所述的局部雷帕霉素组合物给药方法所给予皮肤的量。例如,根据本文所述的方法,给予受影响区域的组合物的量通常在约5立方厘米(cm3)、或约5
‑
20cm3、或约15
‑
20cm3的范围内。根据本文所述的方法,将所述组合物以薄薄一层覆盖受组合物影响区域的适当量,例如优选每天一次或每天两次,以约5
‑
20cm3或约15
‑
20cm3的量给予受影响的区域,该区域是包括待治疗的病变的皮肤区域。在实施方案中,每天给予一次。在实施方案中,将所述局部雷帕霉素组合物局部给予患者的受影响区域,例如面部。在实施方案中,使用泵分配限定量的所述组合物,例如约1gm(或约5
‑
20cm3或约15
‑
20cm3)。将分配的量给予皮肤的受影响区域并使其保持,优选过夜,而无需润湿或洗涤。在实施方案中,所述组合物每天给予一次。在实施方案中,所述组合物每天给药两次或三次。所述组合物优选在室温下储存和使用。
[0095]
其他实施方案从以下实施例中将变得显而易见,这些实施例在某些主要方面说明了本发明,但无意以任何方式限制本发明的范围。
[0096]
实施例
[0097]
以下部分描述了满足上述需求的局部雷帕霉素组合物的制剂。实施例描述了将雷帕霉素作为活性药物成分(api)配制在半固体组合物中的独特挑战,包括解决以下难题:获得api在组合物中的均匀悬浮液、保护api在储存中和升高的温度下随时间推移免受化学降解,以及避免制剂中api的晶体生长。以下实施例进一步以本文所述的化学和物理稳定组合物的形式提供了这些问题的解决方案。
[0098]
进行预配制工作以建立合适的溶剂系统。实施例1描述了所测试的溶剂和为进一步配制而选择的三种先导溶剂。这些初步研究还确定了所述组合物将采用雷帕霉素的稳定均匀悬浮液的形式。实施例2和3描述了为获得具有相关稳定性的组合物而进行的实验。
[0099]
预配制工作还涉及开发用于检测雷帕霉素和任何降解产物的可靠、稳健的hplc方法、ph稳定性测试、局部溶剂筛选、溶剂相容性测试和抗氧化剂筛选。在完成预配制阶段后,开始开发原型雷帕霉素制剂。包括制备用于在40℃下1个月后进行稳定性测试(基于外观和粘度)的8
‑
10种含有雷帕霉素的乳膏和凝胶赋形剂。对6
‑
8种活性制剂进行配方测试,以初步测试水性赋形剂基质中的外观、粘度和ph值。在25℃和5℃或40℃下储存1个月和3个月,根据预配制数据针对最理想的预配制开展下游测试。此类实验产生了四种先导制剂,并描述在以下实施例1
‑
3中。
[0100]
针对雷帕霉素对皮肤的耐受性和递送,在临床前小型猪模型中对先导制剂进行测试。总之,这些实验表明,与vanicream
tm
制剂相比,所有四种先导制剂都能有效地向皮肤递送更高量的雷帕霉素。这些实验描述在以下实施例4中。
[0101]
实施例1:预配制
[0102]
通过高压液相色谱分析(hplc)使用改进的等度方法检测雷帕霉素,从而有效地检
测雷帕霉素的一种可能的杂质/降解产物——山高雷帕霉素。在agilent 1200仪器上使用紫外
‑
可见光检测器进行hplc分析。两种hplc方法的规格如表1所示。第一种方法被称为rap_1_lc.m,在0.05至0.4mg/ml的范围内呈线性,相关系数>0.999,重复进样时的相对标准偏差(rsd)百分比小于2%,使其足以进行预配制工作。图1a所示为在稀释剂前沿或靠近稀释剂前沿进行洗脱时雷帕霉素标准物的hplc色谱图,其中含有可能的杂质/降解产物山高雷帕霉素。为了更准确地检测山高雷帕霉素,采用10%~55%的乙腈梯度,梯度时间为2.5~15分钟;实施时间也延长至35分钟。此外,基于ph稳定性筛选(下文讨论)的结果,将乙酸盐缓冲液替换为ph 4.5的20mm磷酸盐缓冲液。由于该方法在55℃下运行时间较长,因此降低了缓冲液的ph值以最大程度地减少分析过程中降解的可能性。该方法在表1中命名为rap_2_lc.m。rap_2_lc.m梯度方法在0.05至0.4mg/ml的范围内呈线性,相关系数>0.999。重复进样的rsd百分比<2%。图1b显示了含有0.2mg/ml雷帕霉素的色谱图,以及仅纯15g/ml山高雷帕霉素的色谱图(图1c)。山高雷帕霉素以相对于主要雷帕霉素峰~0.7的相对保留时间(rrt)进行洗脱(图1a
‑
b)。基于这些结果,rap_2_lc.m梯度方法被认为可以用于原型制剂开发和测试中的雷帕霉素分析。
[0103]
表1.用于预配制和制剂分析的hplc方法。
[0104][0105]
接下来,我们使用1:1乙醇:水混合物测试了雷帕霉素的ph稳定性,其中雷帕霉素具有>0.1mg/ml的溶解度。制备ph 3、5和7的20mm柠檬酸盐缓冲液。除ph 7缓冲液外,这些缓冲液可与50%乙醇混溶。不是降低缓冲液浓度以获得更高的ph值,而是用未缓冲的水制备第三种溶液。使用带有thermo scientific电极的orion 710a ph计进行ph测量。制备ph 3、5和7的0.1mg/ml雷帕霉素溶液,并在5℃、25℃和40℃下储存1周。结果如图2所示,表明雷帕
霉素在酸性ph下更稳定。
[0106]
我们接下来测试了雷帕霉素在十种不同溶剂中的溶解度,如表2所示。溶解度筛选通过重量分析进行。在玻璃小瓶中,将已知量的api加入到已知量的溶剂中,并在室温下用小瓶旋转器(vwr)旋转样品。如果api完全溶解,则添加额外的已知量。在测定重量分析结果(即大于%w/w或小于%w/w)之前,将样品在最后一次添加api后旋转至少48小时。这些测试表明,雷帕霉素在二甲基异山梨醇(dmi)和二甘醇单乙醚(tc)中的溶解度最高。
[0107]
表2.通过重量分析得出的雷帕霉素在各种溶剂中的溶解度。
[0108]
溶剂雷帕霉素溶解度%w/w丙二醇(pg)<0.75peg 400<1.5二甘醇单乙醚(tc)>13二甲基异山梨醇(dmi)>7轻质液体石蜡<0.3中链甘油三酯<0.1己二酸二异丙酯<1.0己二醇<1.0辛基十二烷醇<1.0肉豆蔻酸异丙酯<0.1
[0109]
雷帕霉素在tc和dmi中的饱和溶解度分别为15.5%和20.6%w/w。为评估溶剂对雷帕霉素水溶性的影响,在水和所选溶剂的10%溶液中测量饱和溶解度。所有溶液都用ph 4.5的5mm柠檬酸盐缓冲液进行缓冲。pg对溶解度的影响可以忽略不计,而tc和dmi使溶解度增加了1.5
‑
2.0g/ml。结果总结在表3中。
[0110]
表3.雷帕霉素在10%共溶剂水溶液中的溶解度,各种不同的溶剂用5mm柠檬酸盐缓冲。
[0111]
溶剂(用ph 4.5的5mm柠檬酸盐缓冲)雷帕霉素溶解度,mcg/ml水2.910%丙二醇(pg)2.910%二甘醇单乙醚(tc)4.610%二甲基异山梨醇(dmi)5.2
[0112]
我们接下来测试了雷帕霉素在丙二醇(pg)、二甘醇单乙醚(tc)和二甲基异山梨醇(dmi)三种不同溶剂中的稳定性,如图3所示。在dmi、tc和pg三种溶剂中的每一种中制备雷帕霉素溶液(0.2%w/w),并在5℃、25℃和40℃下储存1周。图3显示雷帕霉素与丙二醇(pg)最相容,而与二甲基异山梨醇(dmi)的相容性最差。
[0113]
我们接下来进行抗氧化剂筛选以鉴定稳定雷帕霉素的抗氧化剂。由于1周后在二甘醇单乙醚(tc)中有明显降解,并且tc会生成过氧化物,因此选择它作为抗氧化剂筛选的溶剂。在二甘醇单乙醚中制备含有以下抗氧化剂的雷帕霉素溶液(0.2%w/w):(1)不含抗氧化剂;(2)0.01%丁基羟基茴香醚(bha);(3)0.002%dl
‑
α
‑
生育酚(维生素e);(4)0.01%bha 0.002%维生素e。储存1、2和4周后的结果见表4。
[0114]
表4.不同温度下对雷帕霉素溶液稳定性的抗氧化作用。
[0115][0116][0117]
在加入抗氧化剂后,在两个温度下和所有时间点的溶液稳定性获得显著改善。使用在40℃下4周的数据来计算两种抗氧化剂及其相互作用(box等人,1978)对测定值的主要影响。bha( 23.8)的积极效果是维生素e积极效果的两倍e( 11.6)。相互作用具有负值(
‑
9.8),因为维生素e是一种弱抗氧化剂,并且当结合使用维生素e与bha时,其不会显著提高单独使用bha时的测定值。基于这些结果及其水溶性,选择bha作为雷帕霉素制剂的抗氧化剂。
[0118]
综上所述,预配制工作的主要结果表明:(1)雷帕霉素在酸性ph下最稳定;确定了三种有前景的溶剂,丙二醇(pg)、二甘醇单乙醚(或tc)和二甲基异山梨醇(dmi);bha被证明是一种适合维持雷帕霉素稳定性的抗氧化剂;并且基于溶解性和溶液稳定性,适合面部应用的水基制剂需要是悬浮制剂。
[0119]
实施例2:乳膏和凝胶赋形剂制剂
[0120]
制备了一系列的1个乳膏和2个凝胶。系列1(凝胶1a、1b和1c)的凝胶使用羟乙基纤维素(hec),系列2的凝胶(凝胶2a、2b和2c)使用卡波姆980作为结构形成剂。乳膏系列(乳膏a、乳膏b、乳膏c)使用鲸蜡硬脂醇聚醚
‑
20和十八十六醇,如下表5中详述。所测试制剂之间的另一个主要区别在于溶剂。“a”型凝胶和乳膏使用二甲基异山梨醇(dmi),“b”型的凝胶和乳膏使用二甘醇单乙醚(或tc),“c”型的凝胶和乳膏使用丙二醇(pg)。
[0121]
表5:针对结构形成成分筛选出的乳膏和凝胶基质赋形剂
[0122][0123]
*纤维素羟乙基醚250hxx(ashland)
[0124]
**聚氧乙烯20十八十六烷基醚
[0125]
每种赋形剂基质均使用预配制工作中确定的三种溶剂之一进行配制:“a”代表7.5%w/w dmi,“b”代表7.5%w/w tc,“c”代表12.5%w/w pg。下表总结了赋形剂组成,其中许多组合物按照功能进行颜色编码。本文件后面将描述活性制剂的配混技术。
[0126]
最初在40℃下测试了9种制剂中每一种的雷帕霉素稳定性,持续1个月,以观察外观和粘度的变化。用brookfield旋转粘度计测量粘度。每类制剂参数为:羟乙基纤维素凝胶:(1)rv粘度计,粘度计#14,12rpm;(2)卡波姆凝胶:lv粘度计,升降支架,转子#95,3rpm;(3)乳膏:lv粘度计,升降支架,转子#95,0.3rpm。如表6和表7所示,ph、粘度或外观没有显着变化。
[0127]
将九种制剂中的每一种也进行3个冷冻/解冻循环:在
‑
20℃下3天,然后在室温下4天,并在每个循环后评价外观。未发现外观变化。基于这些结果,所有九种赋形剂都适合与微粉化雷帕霉素配混。
[0128]
表6.在40℃下的初始雷帕霉素载体测试结果。
[0129]
制剂ph粘度,cp外观凝胶1a4.5523,900透明至半透明的软凝胶凝胶1b4.4724,800透明至半透明的软凝胶凝胶1c4.4624,300透明至半透明的软凝胶凝胶2a5.6285,200透明粘稠凝胶凝胶2b5.8393,500透明粘稠凝胶凝胶2c5.85115,000透明粘稠凝胶乳膏a4.45530,000白色至灰白色的均质乳膏乳膏b4.52504,000白色至灰白色的均质乳膏乳膏c4.51511,000白色至灰白色的均质乳膏
[0130]
7.在40℃下1个月后的雷帕霉素载体稳定性测试结果。
[0131]
制剂ph粘度,cp外观凝胶1a4.4123,200透明至半透明的软凝胶凝胶1b4.6524,600透明至半透明的软凝胶凝胶1c4.5624,100透明至半透明的软凝胶凝胶2a5.6684,600透明粘稠凝胶凝胶2b5.7793,600透明粘稠凝胶凝胶2c5.79112,000透明粘稠凝胶乳膏a4.39556,000白色至灰白色的均质乳膏乳膏b4.65517,000白色至灰白色的均质乳膏乳膏c4.64519,000白色至灰白色的均质乳膏
[0132]
实施例3:雷帕霉素的配混和稳定性测试
[0133]
以下总结了称重100
‑
300g的雷帕霉素制剂的配混步骤。在配混过程中,通过显微镜检查小样品来检查api分散均匀性。对于api配混,使用不锈钢螺旋桨叶片(1.5英寸直径)和ika eurostar 200高架混合器进行低剪切混合。使用10mm不锈钢转子
‑
定子头的glh均质器进行高剪切混合。
[0134]
凝胶1:羟乙基纤维素(hec)基质
[0135]
应按照以下制备步骤获得羟乙基纤维素凝胶基质:在主容器中,加入水(预留5%用于冲洗)、柠檬酸盐(酸和盐)、edta、甘油(如果使用)、聚山梨醇酯80和苯甲醇;在高架混合器上用螺旋桨叶片搅拌直至均匀;添加api;混合直至固体分散(10
‑
20分钟);使用10mm转
子/定子均质机开始高剪切混合,继续均质至少20分钟,均质后返回螺旋桨混合;在单独的浆液容器中,将溶剂(二甲基异山梨醇、二甘醇单乙醚或丙二醇)、bha、苯氧乙醇(如果使用)和hec一起合并,并进行混合,直至聚合物浆液均匀光滑;将浆液容器的内容物倒入主容器中,用螺旋桨叶片搅拌,用预留的冲洗水将浆液容器中的残留物冲洗到主容器中;提高混合速度,使得hec水合时保持凝胶移动;并将制剂混合至少60分钟。如果需要,使用不锈钢刮刀进行侧刮以使hec水合。
[0136]
凝胶2:卡波姆980基质
[0137]
卡波姆980凝胶基质的形成需要以下制备步骤:在主容器中,加入水(预料5%用于冲洗)、edta、甘油(如果使用)、聚山梨醇酯80和苯甲醇;在高架搅拌器上用螺旋桨叶片混合直至均匀;添加api;混合直至固体分散(~10
‑
20分钟);使用10mm转子/定子均质机开始高剪切混合,继续均质至少20分钟,在达到均质后,返回到螺旋桨混合;在一个单独的浆料容器中,将溶剂(二甲基异山梨醇、二甘醇单乙醚或丙二醇)、bha和苯氧基乙醇(如果使用)合并、并混合直至溶剂相均匀且光滑;将溶剂容器的内容物加入到主容器中,用螺旋桨叶片搅拌,通过预留的水冲洗溶剂容器中的残留物,冲入主容器中,并混合制剂至少10分钟;将卡波姆980粉末缓慢加入主容器并混合至少45分钟;添加完成后,加入氢氧化钠溶液,并随着凝胶稠度提高而增加螺旋桨速度,如果需要,使用不锈钢刮刀进行侧刮。凝胶的ph值应为5.5
‑
6.0;根据需要通过额外混合来调节ph值。
[0138]
乳膏基质赋形剂
[0139]
卡拉姆980凝胶基质的形成需要以下制备步骤:在主容器中加入水、edta、甘油(如果使用)、柠檬酸盐(酸和盐)和10%的鲸蜡硬脂醇聚醚
‑
20;在高架混合器上用螺旋桨叶片搅拌直至均匀;加入api并混合直至固体分散(~10
‑
20分钟);使用10mm转子/定子均质机开始高剪切混合,继续进行均质操作至少20分钟,均质后返回螺旋桨混合,将主容器内容物加热至60
‑
65℃;在一个单独的脂质容器中,将润肤剂、十八十六醇、剩余的鲸蜡硬脂醇聚醚
‑
20、bha和对羟基苯甲酸酯混合,加热至60
‑
65℃,并混合直到脂质容器的内容物均匀以保持温度在60
‑
65℃;将脂质容器的内容物添加到主容器中,用螺旋桨叶片搅拌;将制剂混合至少10分钟,并使用10mm转子/定子均质器开始高剪切混合;在继续高剪切混合的同时冷却主容器;当主容器内容物的温度达到45℃时,停止高剪切混合,返回螺旋桨混合;继续混合,根据需要用不锈钢刮刀侧刮,直到达到30℃。
[0140]
对于原型活性制剂,雷帕霉素浓度为1.0%w/w,或10mg/ml。根据雷帕霉素方法和预配制工作的经验,采用以下方法进行提取:将0.5g制剂加入25ml烧瓶中(0.2mg/ml雷帕霉素);使用含有0.05%柠檬酸的50%乙腈(hplc稀释剂)确保在稀释剂中的溶解性和稳定性;通过温和的加热来分散乳膏制剂。由于各制剂基质内的主要区别在于溶剂,所以选择来自各制剂基质(凝胶1、凝胶2或乳膏)的赋形剂。选择“b”制剂进行提取确认,因为其含有二甘醇单乙醚,其在三种溶剂中可以中等水平溶解雷帕霉素。使用以下步骤测试凝胶提取:将0.5g凝胶1b或凝胶2b赋形剂添加到容量瓶;加入1ml 5mg/ml雷帕霉素的乙腈溶液,向小瓶中加入15ml hplc稀释剂并涡旋以分散/溶解凝胶;加入一个小搅拌棒,搅拌15分钟;取走搅拌棒,用hplc稀释剂将烧瓶定容并混合;并通过0.45微米尼龙注射器过滤器将等分试样过滤至琥珀色hplc小瓶中进行分析。
[0141]
根据以下测试步骤进行乳膏提取:向容量瓶中加入0.5g乳膏b赋形剂;加入
1ml5mg/ml雷帕霉素乙腈溶液,向小瓶中加入15ml hplc稀释剂并涡旋分散乳膏;将烧瓶置于50℃水浴中,轻轻旋转以间歇融化/分散乳膏;从水浴中移除,加入一个小搅拌棒并混合15分钟;取下搅拌棒,加入hplc稀释剂至略低于填充线,让烧瓶静置20分钟以达到温度平衡;用hplc稀释剂将烧瓶定容,混合,并通过0.45微米尼龙注射器过滤器将等分试样过滤到琥珀色hplc小瓶中进行分析。提取实验以一式两份进行,结果如表8所示。
[0142]
表8.不同赋形剂中的雷帕霉素制剂的提取和回收。
[0143]
赋形剂回收百分比,提取1回收百分比,,提取1凝胶1b99.3100.1凝胶2b100.4100.3乳膏b100.699.2
[0144]
所有的回收结果都在99%和101%之间。基于这些结果,该提取方法被认为适用于雷帕霉素活性制剂。
[0145]
选择七种制剂与1%微粉化雷帕霉素配混:凝胶1a;凝胶1b;凝胶1c;凝胶2a;凝胶2b;凝胶2c;和乳膏c。决定集中研究凝胶制剂,部分原因在于乳膏发生团聚。保留乳膏b,以便提供对比数据。表9显示了初始结果,该初始结果是通过将7种制剂中的每一种与雷帕霉素配混并使用上述提取方法测试制剂的顶层、中间层和底层中药物含量的均匀性所获得的。
[0146]
表9.7种原型1.0%雷帕霉素制剂的初始测试。
[0147][0148]1按从上、中、下的顺序排列
[0149]
每种凝胶制剂都证明了雷帕霉素在整个组合物中的均匀分布,并且相应载体的ph值或粘度没有显着变化。相比之下,乳膏的含量均一性较差(%rsd为9.0)。乳膏c的显微镜检查显示制剂中存在大的细晶颗粒团聚体。通过该过程检查雷帕霉素颗粒分散体的微观质
量。对于乳膏c,仅在添加油相后,雷帕霉素分散体才会显示出团聚迹象,即使在高剪切混合时也是如此。
[0150]
在25℃或40℃下储存1个月后,接下来对六种制剂中的各种雷帕霉素稳定性进行测试(表10)。对于任何凝胶制剂,雷帕霉素的含量均一性、赋形剂ph值或粘度或整体外观没有显着变化。未发现新的杂质峰,包括任何山高雷帕霉素的形成。
[0151]
虽然乳膏c的含量均一性未发生显著变化,但有两个结果在目标浓度90
‑
110%之外。这是由于微粉化雷帕霉素颗粒的团聚而使制剂具有低含量均一性的特征。在乳膏c中也观察到雷帕霉素晶体生长的证据。
[0152]
表10.7种原型1.0%雷帕霉素制剂的1个月稳定性结果。
[0153][0154]1从上到下依次排列。没有观察到新的杂质。所有水平的异构体杂质均与api一致,约为2.2面积%。
[0155]
接下来,我们通过将每种凝胶制剂在5℃、25℃或40℃下储存1个月后进行显微镜检查来评估雷帕霉素晶体生长。凝胶1a和1b显示出在较高温度下晶体生长的证据,如表11
所示。
[0156]
表11.基质赋形剂中雷帕霉素晶体生长的显微观察 /
‑
[0157][0158]
dmi:二甲基异山梨醇,tc:二甘醇单乙醚,pg:丙二醇,hec:羟乙基纤维素,paa:聚(丙烯酸),商品名为卡波姆。
[0159]
观察到雷帕霉素晶体生长在25
‑
100微米(长度)范围内的证据,为矩形晶体和现场细颗粒的消耗量。在保留赋形剂中未观察到晶体,包括那些暴露于冻融循环的制剂。由于在赋形剂样品中没有看到晶体,这似乎并非赋形剂问题(即赋形剂发生沉淀)。凝胶1b的晶体形成量最大,因此从进一步分析中排除。
[0160]
在25℃或40℃下储存3个月后,进一步测试其余五种制剂的雷帕霉素稳定性(表12);以及在5℃、25℃和40℃下储存3个月后的晶体生长(表13)。没有任何制剂在5℃下显示出晶体生长,但在25℃或40℃下储存3个月后,凝胶1c是唯一没有显示出晶体生长的制剂。
[0161]
表12.其余4个原型1.0%雷帕霉素制剂的三个月稳定性结果。
[0162][0163][0164]1从上到下依次排列。没有观察到新的杂质。所有水平的异构体杂质均与api一致,约为2.2面积%。
[0165]
2 2个月观察到的晶体生长证据。
[0166]
表13.在5℃、25℃或40℃下3个月后的雷帕霉素晶体生长。
[0167][0168]
dmi:二甲基异山梨醇,tc:二甘醇单乙醚,pg:丙二醇,hec:羟乙基纤维素,paa:聚(丙烯酸),商品名为卡波姆。
[0169]
*这是在1个月的时间点观察到的。
[0170]
**这是在2个月的时间点观察到的。
[0171]
凝胶1c的示范雷帕霉素批次
[0172]
在凝胶1c(pg/hec)中制备不同浓度的微粉化雷帕霉素0.1%、1.0%和2.0%w/w的批次。基于上述经处理的原型批次,这些开发批次以2.0kg规模生产。使用lightnin混合器和ultra turrex均质器开展批量混合。使用柠檬酸钠/柠檬酸制备示范批次,以便将酸性ph保持在ph 3
‑
5的范围内,并含有bha作为抗氧化剂。其他赋形剂包括作为防腐剂的苯甲醇、ps80和edta。来自开发批次的原料药产品装入三种类型的管中:1)层压盲端管(项目#7347);层压鼻尖管(项目#7336);和涂有环氧树脂的铝质盲端管(项目#7343)。对三个示范批次的0.1%、1.0%和2.0%雷帕霉素成品开展分析测试表明,每个批次在以下方面均令人满意,其物理外观为白色至灰白色凝胶、不含外来颗粒、api(雷帕霉素)的量,api粒度测定为每5毫克样品中的颗粒数大于50微米、ph、粘度以及苯甲醇和bha的量。
[0173]
在5℃、25℃和40℃下监测用于三种雷帕霉素浓度的层压板盲端管和涂有环氧树脂的铝管的稳定性。层压板盲端管中的三种浓度雷帕霉素的1个月分析总结在表14中,三种不同雷帕霉素浓度制剂的6个月数据稳定性结果在表15中提供。
[0174]
表14.层压板盲端管中含有的雷帕霉素的1个月稳定性数据。
[0175][0176]
表15.储存在涂有环氧树脂的铝管中的示范批次的6个月雷帕霉素稳定性数据。
[0177][0178]1所有含量测定均以%w/w记录到标签要求:苯甲醇=1.0%w/w,bha(丁基化羟基茴香醚):0.01%w/w
[0179]2在示范批次的制造或初始测试期间,雷帕霉素参考标准品不可用。针对输入的微粉化雷帕霉素(apotex sir160397)测定药物产品。这种材料的效力取自未微粉化材料的coa,不考虑研磨过程中的损失。当针对参考标准(apotex yt38
‑
012,99.3%)测定微粉化雷帕霉素批次sir160397时,测定微粉化雷帕霉素的效力为94%。
[0180]
np=未执行
[0181]
实施例4.凝胶制剂的耐受性和皮肤渗透性
[0182]
5天皮肤耐受性研究
[0183]
选择小型猪作为模型系统,因为它适用于测试皮肤药物。进行为期5天的研究以评估凝胶制剂1c(“凝胶1c”)每日一次局部皮肤给药的最大耐受剂量(mtd)。治疗是仅赋形剂(0%雷帕霉素)和0.3%的1%和2%雷帕霉素。
[0184]
在第一次给予测试凝胶的前一天,从每只动物的躯干的背面和侧面剪下毛发。根据需要进行进一步剪断。小心翼翼地最大限度地延长剪断和给予之间的时间段,从而最大限度地减少皮肤机械应力所造成的干扰。大腿背部未经处理的皮肤可作为对照。将两只雄性哥廷根spf小型猪在其背部的8个测量为3x3厘米(9平方厘米)的区域做标记。每天(每24小时)将测试凝胶给予每只动物的两个指定区域(重复)中的每一个,持续5天,如表16所示。将测试凝胶均匀涂抹在指定区域上并轻轻按摩进入皮肤。仅当在下一次给予前的第二天早上出现可见的凝胶残留物时才冲洗给药部位。在这些情况下,用浸有温水的纱布或纸巾进行冲洗。八个给予部位未被覆盖。温度保持在21℃ /
‑
3℃。房间从06:00到18:00被照亮,以产生12小时的光/暗循环。动物每天喂食两次并且可以随意饮水。
[0185]
表16.治疗计划
[0186][0187]
监测死亡率、临床症状、皮肤反应、体重和食物消耗。剂量(ml/kg体重)为每10%皮肤表面积的测试区域为0.75ml/kg,等于19.5mg/cm2(1ml测试样品对应于1g)。根据2015年7月28日通过的oecd化学品测试指南第404号:“急性皮肤刺激/腐蚀”,对任何皮肤刺激进行评分。以下是用于评估红斑和焦痂形成的评分水平。
[0188][0189]
记录任何其他皮肤反应(例如,脱皮、开裂、结痂、脱落、坏死),并根据内部sop程序对所涉及的区域进行如下评分:
[0190][0191]
在本研究过程中没有死亡或动物被处死,并且在整个研究期间没有观察到临床症状。没有观察到皮肤反应。对食物消耗没有明显影响,除了一只动物在凝胶1c给予期间体重减轻(3%);但是,这被视为偶然因素,与毒理学无关,因为变化小于10%,并且没有相关的食物消耗方面的减少或观察到任何异常的临床症状。为期5天的研究的结论表明,每天一次通过皮肤给予小型猪0(赋形剂)、0.3、1和2%的雷帕霉素凝胶1c制剂,没有临床观察、注意到雷帕霉素相关皮肤反应或对体重或食物消耗的明显影响,表明所有三种浓度的雷帕霉素凝胶1c制剂以及赋形剂凝胶制剂本身都是耐受性良好。
[0192]
四种雷帕霉素制剂的皮肤渗透
[0193]
使用四种局部雷帕霉素制剂和一种在vanicream
tm
基质中的1%雷帕霉素制剂,对小型猪进行单次皮肤剂量adme(吸收、分布、代谢和排泄))的研究。研究中使用了五头雄性哥廷根小型猪,并按照fda对产品测试的要求,保持在标准化条件下进行经验证的皮肤adme
测试。在研究中进行测试的四种局部制剂被视为制剂1凝胶1c(pg/hec)、制剂2凝胶2a(dmi/paa)、制剂3凝胶2b(tc/paa)和制剂4凝胶2c(pg/paa)。在该研究中,所有测试的雷帕霉素制剂都以白色至灰白色的紧致凝胶为特征。vanicream基质中的雷帕霉素制剂含有1%的雷帕霉素。vanicream基质制剂的特点是白色乳膏。所有雷帕霉素制剂均在5℃下储存。adme研究实验设计如表17所示。
[0194]
表17.在小型猪中比较四种局部雷帕霉素制剂与商购的1%雷帕霉素vanicream
tm
制剂的实验设计。
[0195][0196]
通过以均匀层直接给予皮肤,每12小时 /
‑
30分钟每天两次经皮肤给药雷帕霉素制剂。在第一次给予之前,通过用小动物剪刀紧密修剪毛发来准备背侧面。小心避免擦伤皮肤。每个部位大约5厘米x5厘米,放置在脊柱两侧的大致相同位置。通过用浸泡在反渗透(ro)水中的纱布轻轻擦拭该部位,然后用干纱布除去残留的测试材料(暴露11小时38分钟后至11小时51分钟)。在预定安乐死前,按照相同方式冲洗测试部位。给药的第一天被指定为第1天。
[0197]
每天进行两次死亡率/发病率检查。在第1周和第1天每天进行一次笼边观察;在第1天给予后1至3小时进行观察。在随机化当天进行详细的临床观察。在随机化当天和第1天记录个体体重。在第2天(给予雷帕霉素凝胶制剂后12小时 /
‑
30分钟)通过注射戊巴比妥钠对动物执行安乐死。安乐死后,从每只动物身上收集了4个皮肤穿刺活检(每个部位的全层皮肤的两个8毫米活检样本)。对每个活检样品进行称重,然后在液氮中冷冻。将活检组织分离成皮肤层(例如表皮、真皮等),并使用超高效液相色谱串联质谱(uhplc
‑
ms/ms)方法,利用shimadzu 结合正电子电离(es1 )模式的applied biosystems/mds sciex api 5500uhplc
‑
ms/ms系统对雷帕霉素浓度进行分析。该方法使用0.2ml提取样品在
1至5000ng/ml(4至20,000ng/g皮肤组织)的浓度范围内进行校准。通过蛋白质沉淀提取猪皮中的雷帕霉素和内标物(is,子囊霉素),并用1:1(v:v)dmso:acn提取。acn是指乙腈。使用watson实验室信息管理系统(lims)和microsoft excel进行统计分析(包括回归分析)和描述性统计(包括算术平均值和标准偏差)。
[0198]
对于组织分离,将冷冻的活检样品在室温下解冻。移除皮下脂肪组织和/或肌肉(如果存在)。通过使用blenderm
tm
最多20次胶带剥离,从穿孔活检中去除角质层。通过在皮肤上摩擦并立即采用胶带。这是小心进行的,以免去除表皮层。用于去除角质层的所有胶带都保存在单独的、唯一标记的冷冻管中,并储存在设定保持
‑
70℃的冰箱中。然后使用手术刀和镊子刮取活检样品以从真皮去除表皮层。收集表皮层并将其置于单独的、唯一标记的冷冻管中,称重并储存在设定保持为
‑
70℃的冰箱中。称重剩余的真皮层,放置在具有唯一标记的单独冷冻管中,并储存在设置保持为
‑
70℃的冰箱中。对被切片的每一层组织使用单独的镊子和解剖刀。在处理每个活检样本之间用酒精清洁镊子。每个活检样本的三个分离层,各层都在具有唯一标记的单独冷冻管中,被运送到生物分析实验室进行分析。
[0199]
结果
[0200]
在研究中没有注意到临床症状或早期死亡。在完整的全层活检穿孔和全层活检穿孔的分离的皮肤层(角质层、表皮和真皮)中测量雷帕霉素的浓度。表18和19所示分别为雷帕霉素浓度和完整活检样品重量的汇总信息。由于胶带占用于测定角质层中雷帕霉素浓度的大部分重量,因此该浓度并不能准确反映皮肤屏障层中雷帕霉素的实际浓度。因此,不应认为该结果与从本研究中评估的其他组织层获得的结果具有可比性。
[0201]
表18.小型猪活检样本中雷帕霉素浓度(ng/g皮肤组织)的总结。
[0202][0203]
a
从包括角质层、表皮、真皮、和皮下脂肪的全层活检穿孔测量的浓度。
[0204]
b
从分离的皮肤层测量的浓度。
[0205]
c
用于收集角质层的胶带条的重量。大部分重量归因于胶带条并且无法准确确定角质层的实际重量。
[0206]
d
从4次单独测量计算的平均浓度。
[0207]
表19.小型猪中全活检组织样品的重量(g皮肤组织)。
[0208][0209][0210]
所有测试制剂在表皮和真皮层中产生可测量的雷帕霉素浓度。与vanicream
tm
中1%雷帕霉素对照组相比,所有四种雷帕霉素测试制剂(凝胶1c、2a
‑
c)向皮肤的所有层和全层活检递送显著更高浓度的雷帕霉素。制剂2(凝胶2a)向真皮层递送最高量的雷帕霉素,大约是vanicream
tm
中1%雷帕霉素对照组的10倍。制剂1(凝胶ic)向表皮递送最高量的雷帕霉素,与制剂2(凝胶2a)相比,其量约为2倍,与vanicream
tm
中1%雷帕霉素对照组相比,其量约为100倍。制剂3(凝胶2b)和制剂4(凝胶2c)分别向真皮层和表皮层发送大约等量的雷帕霉素。重要的是,制剂3和4递送至真皮的雷帕霉素的量是vanicream
tm
中1%雷帕霉素对照组的约10倍,递送至表皮的量是vanicream
tm
对照组的约20倍。真皮是雷帕霉素治疗面部血管纤维瘤的重要活性部位,根据这些结果,对真皮中测定的雷帕霉素量进行排序,制剂从高到低的顺序是:凝胶2a>凝胶2c>凝胶2b>凝胶1c。
[0211]
本发明的各种实施方案在以上详细的说明书和实例中进行了描述。尽管这些描述直接公开了上述实施方案,但是应当理解,本领域技术人员可以想到本文示出和描述的具体实施方案的修改和变化。落入所公开的描述和实施例范围的任何此类修改和变化也旨在包括在其中。除非另有说明,应当理解,说明书和权利要求书中使用的词语和短语对于本技术领域的普通技术人员而言具有其普遍和清晰的含义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。