抗gal3抗体及其用途
1.相关申请的交叉引用
2.本技术要求2019年1月30日提交的美国临时申请系列号62/798945和2019年1月30日提交的美国临时申请系列号62/798949的权益,其中每个通过引用以其整体并入本文。
3.序列表的参考
4.本技术与电子格式的序列表一起提交。序列表以题目为seq list immut003.txt的文件的提供,该文件创建并且最后在2020年1月29日保存,大小为146561字节。序列表的电子格式中的信息通过引用以其整体并入本文。
技术领域
5.在一些实施方式中,本文公开了特异性结合至gal3并且破坏gal3和tim
‑
3之间的相互作用且促进t细胞或天然杀伤(nk)细胞增殖的抗体(或“抗gal3抗体”)。本文还公开了利用抗体以引起免疫应答的方法和治疗方法。本文还公开了通过使组织与特异性结合至gal3的抗体接触来减少组织中纤维化或其倾向的方法。本文还描述了在减少组织中一种或多种纤维化生物标志物表达的条件下,通过特异性结合至gal3的抗体来破坏gal3
‑
tim
‑
3相互作用的方法。
背景技术:
6.半乳糖凝集素
‑
3(gal3)是凝集素或碳水化合物结合蛋白,对β
‑
半乳糖苷具有特异性。在人细胞中,gal3在细胞核、细胞质、细胞表面中以及在细胞外空间中表达并且可以找到。t
‑
细胞免疫球蛋白和含有结构域的粘蛋白
‑
3(tim
‑
3)是在免疫细胞比如t细胞、树突细胞、nk细胞和单核细胞上表达的蛋白质。
技术实现要素:
7.在一些实施方式中,本文公开了特异性结合至gal3并且破坏gal3和tim
‑
3之间的相互作用的抗体(或“抗gal3抗体”)。在一些实施方式中,本文公开了特异性结合至gal3并且促进t细胞或天然杀伤细胞增殖的抗体。在一些实施方式中,本文还公开了利用抗体引起免疫应答的方法和治疗方法。
8.本文提供的本发明的实施方式通过以下编号的替代方式进行描述:
9.1.一种诱导免疫激活的方法,其包括:
10.在破坏gal3和tim
‑
3之间的相互作用的条件下,使包括gal3
‑
表达细胞和tim
‑
3表达细胞的多种细胞与抗体接触,其中抗体特异性结合至gal3,其中gal3
‑
表达细胞在结合至抗体时表达诱导免疫激活的细胞因子,并且其中抗体不是imt001。
11.2.根据替代方式1所述的方法,其中细胞因子是干扰素。
12.3.根据替代方式2所述的方法,其中干扰素是ifnγ。
13.4.根据替代方式3所述的方法,其中ifnγ产生是通过同种型抗体的150%、160%、170%、180%、190%、200%或更多的ifnγ产生。
14.5.根据替代方式1所述的方法,其中细胞因子是白细胞介素。
15.6.根据替代方式5所述的方法,其中白细胞介素是il
‑
2。
16.7.根据替代方式1
‑
6的任一项所述的方法,其中免疫激活包括cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞、天然杀伤细胞或其组合的增殖。
17.8.根据替代方式1
‑
7的任一项所述的方法,其中免疫激活包括多种细胞内m1巨噬细胞群的增加。
18.9.根据替代方式1
‑
8的任一项所述的方法,其中免疫激活包括多种细胞内m2巨噬细胞群的减少。
19.10.一种促进t细胞或天然杀伤(nk)细胞增殖的方法,其包括:
20.在实现多种细胞中t细胞和/或nk细胞增殖的条件下,使包括t细胞、nk细胞和gal3
‑
表达细胞的多种细胞与抗体接触,其中抗体特异性结合至gal3,并且其中抗体不是imt001。
21.11.根据替代方式10所述的方法,其中多种细胞进一步包括tim
‑
3表达细胞。
22.12.根据替代方式11所述的方法,其中抗体进一步破坏gal3和tim
‑
3的相互作用。
23.13.一种诱导免疫激活的方法,其包括:
24.在破坏gal3和tim
‑
3之间的相互作用的条件下,将包括gal3
‑
表达细胞和tim
‑
3表达细胞的多种细胞与抗体接触,其中抗体特异性结合至gal3,并且其中gal3
‑
tim
‑
3相互作用被减少至小于70%、小于60%、小于59%、小于50%、小于40%、小于34%、小于30%、小于20%、小于14%、小于10%、小于7%、小于5%、小于4%或小于1%。
25.14.根据替代方式13所述的方法,其中相互作用发生在选自区域145
‑
168、160
‑
177或165
‑
184的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置145
‑
168、160
‑
177或165
‑
184。
26.15.根据替代方式13所述的方法,其中相互作用发生在选自区域149
‑
156、152
‑
168、163
‑
169、163
‑
177或163
‑
171的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置149
‑
156、152
‑
168、163
‑
169、163
‑
177或163
‑
171。
27.16.根据替代方式13
‑
15的任一项所述的方法,其中相互作用发生在选自区域91
‑
111或82
‑
111的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置91
‑
111或82
‑
111。
28.17.根据替代方式13
‑
15的任一项所述的方法,其中相互作用发生在选自区域91
‑
111、107
‑
117、96
‑
102、100
‑
106或92
‑
119的tim
‑
3的一个或多个残基处,本文残基位置对应于seq id no:2的位置91
‑
111、107
‑
117、96
‑
102、100
‑
106或92
‑
119。
29.18.根据替代方式13
‑
17的任一项所述的方法,其中tim
‑
3是人tim
‑
3。
30.19.根据替代方式1
‑
18的任一项所述的方法,其中gal3
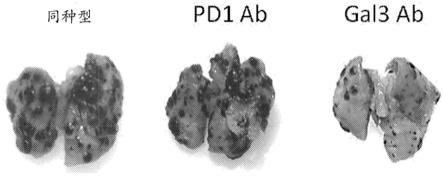
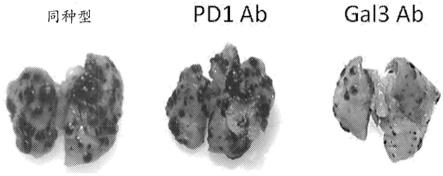
‑
表达细胞是肿瘤细胞。
31.20.根据替代方式1
‑
19的任一项所述的方法,其中多个细胞位于肿瘤微环境(tme)内。
32.21.根据替代方式1
‑
20的任一项所述的方法,其中抗体诱导tme内肿瘤细胞的减少。
33.22.根据替代方式1
‑
21的任一项所述的方法,其中多种细胞进一步包括肿瘤浸润淋巴细胞(til)。
34.23.根据替代方式1
‑
22的任一项所述的方法,其中多种细胞进一步包括cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞或其组合。
35.24.根据替代方式1、10、13或22的任一项所述的方法,其中接触进一步诱导til增殖。
36.25.根据替代方式1、10、13或23的任一项所述的方法,其中接触进一步诱导cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞或其组合的增殖。
37.26.根据替代方式1、10、13或22
‑
25的任一项所述的方法,其中接触进一步包括m1巨噬细胞增殖的增加。
38.27.根据替代方式1、10、13或22
‑
26的任一项所述的方法,其中接触进一步包括tme内m2巨噬细胞群的减少。
39.28.根据替代方式1
‑
27的任一项所述的方法,其中抗体结合至对应于seq id no:1的残基1
‑
20的gal3区域内的至少一个氨基酸残基。
40.29.根据替代方式1
‑
27的任一项所述的方法,其中抗体结合至对应于seq id no:1的残基41
‑
91的gal3区域内的至少一个氨基酸残基。
41.30.根据替代方式1
‑
27或29的任一项所述的方法,其中抗体结合至对应于seq id no:1的残基41
‑
71的gal3区域内的至少一个氨基酸残基。
42.31.根据替代方式1
‑
27或29的任一项所述的方法,其中抗体结合至对应于seq id no:1的残基71
‑
91的gal3区域内的至少一个氨基酸残基。
43.32.根据替代方式1
‑
31的任一项所述的方法,其中抗体结合至肽_1、肽_4、肽_5、肽_6、肽_7或肽_8内的至少一个氨基酸残基。
44.33.根据替代方式1
‑
32的任一项所述的方法,其中抗体包括小于1nm、1.2nm、2nm、5nm、10nm、13.5nm、15nm、20nm、25nm或30nm的k
d
。
45.34.根据替代方式1
‑
33的任一项所述的方法,其中抗体包括人源化抗体。
46.35.根据替代方式1
‑
34的任一项所述的方法,其中抗体包括全长抗体或其结合片段。
47.36.根据替代方式1
‑
35的任一项所述的方法,其中抗体包括双特异性抗体或其结合片段。
48.37.根据替代方式1
‑
36的任一项所述的方法,其中抗体包括单价fab’、二价fab2、单链可变片段(scfv)、双抗体、微抗体、纳米抗体、单结构域抗体(sdab)或骆驼化抗体或其结合片段。
49.38.根据替代方式1
‑
37的任一项所述的方法,其中抗体包括igg框架。
50.39.根据替代方式1
‑
38的任一项所述的方法,其中抗体包括igg1、igg2或igg4框架。
51.40.根据替代方式1
‑
39的任一项所述的方法,其中抗体进一步包括fc突变。
52.41.根据替代方式1
‑
33或35
‑
40的任一项所述的方法,其中抗体包括嵌合抗体。
53.42.根据替代方式1、10或13的任一项所述的方法,其进一步包括在接触步骤之前向受试者施用抗体。
54.43.根据替代方式42所述的方法,其中受试者被诊断具有癌症。
55.44.根据替代方式43所述的方法,其中癌症是实体瘤。
56.45.根据替代方式44所述的方法,其中癌症是乳腺癌、结肠直肠癌、肾癌、肝癌或肺癌。
57.46.根据替代方式43所述的方法,其中癌症是血液系统恶性肿瘤。
58.47.根据替代方式43
‑
46的任一项所述的方法,其中癌症是转移性癌症。
59.48.根据替代方式43
‑
46的任一项所述的方法,其中癌症是复发的或难治癌症。
60.49.根据替代方式42
‑
48的任一项所述的方法,其中抗体被配制用于全身施用。
61.50.根据替代方式42
‑
49的任一项所述的方法,其中抗体被配制用于肠胃外施用。
62.51.根据替代方式42
‑
50的任一项所述的方法,其中抗体与另外治疗剂组合施用。
63.52.根据替代方式51所述的方法,其中抗体和另外治疗剂同时施用。
64.53.根据替代方式51所述的方法,其中抗体和另外治疗剂依次施用。
65.54.根据替代方式53所述的方法,其中抗体在施用另外治疗剂之前施用。
66.55.根据替代方式53所述的方法,其中抗体在施用另外治疗剂之后施用。
67.56.根据替代方式51
‑
55的任一项所述的方法,其中另外治疗剂包括免疫检查点调节剂。
68.57.根据替代方式51
‑
55任一项所述的方法,其中另外治疗剂包括化疗剂、靶向治疗剂、激素治疗剂或基于干细胞的治疗剂。
69.58.根据先前替代方式的任一项所述的方法,其中受试者是人。
70.59.根据替代方式58所述的方法,其中抗体在外科手术之前或之后施用。
71.60.根据替代方式58所述的方法,其中抗体以与辐射疗法结合、在辐射疗法之前或在辐射疗法之后施用。
72.61.根据先前替代方式的任一项所述的方法,其中抗体具有的k
d
高于抗体imt001的k
d
。
73.62.一种减少组织中纤维化或其倾向的方法,其包括:
74.在使得组织中纤维化生物标志物的表达水平降低的条件下,使组织与特异性结合gal3抗体的抗体接触。
75.63.根据替代方式62所述的方法,其中组织进一步包括tim
‑
3表达细胞。
76.64.根据替代方式63所述的方法,其中抗体进一步破坏gal3和tim
‑
3的相互作用。
77.65.根据替代方式63所述的方法,其中抗体不破坏gal3和tim
‑
3的相互作用。
78.66.根据替代方式62
‑
65的任一项所述的方法,其中至少一种纤维化生物标志物包括α
‑
平滑肌肌动蛋白(α
‑
sma)。
79.67.根据替代方式62
‑
65的任一项所述的方法,其中至少一种纤维化生物标志物包括纤连蛋白。
80.68.根据替代方式62
‑
65的任一项所述的方法,其中至少一种纤维化生物标志物包括α
‑
平滑肌肌动蛋白(α
‑
sma)和纤连蛋白。
81.69.根据替代方式62
‑
68的任一项所述的方法,其中组织是肾组织或肝组织。
82.70.根据替代方式62
‑
68的任一项所述的方法,其中组织选自由以下组成的组:肝组织、肾组织、皮肤组织、肺组织、心脏组织、脑组织、肠组织、骨髓组织和软组织。
83.71.根据替代方式62
‑
70的任一项所述的方法,其中用抗体治疗的组织中至少一种纤维化生物标志物的表达小于用migg2b抗体治疗的对照组织中至少一种纤维化生物标志
物的表达。
84.72.根据替代方式62
‑
71的任一项所述的方法,其中抗体导致组织中细胞外基质蛋白的积累降低。
85.73.根据替代方式72所述的方法,其中细胞外基质蛋白包括胶原。
86.74.根据替代方式73所述的方法,其中组织包括产生胶原的细胞。
87.75.根据替代方式74所述的方法,其中产生胶原的细胞是成纤维细胞。
88.76.根据替代方式75所述的方法,其中成纤维细胞由纤维发生细胞因子激活。
89.77.根据替代方式76所述的方法,其中纤维发生细胞因子是tgf
‑
β1。
90.78.根据替代方式62
‑
77的任一项所述的方法,其中组织具有升高的tgf
‑
β1表达。
91.79.根据替代方式62
‑
78的任一项所述的方法,其中抗体包括人源化抗体。
92.80.根据替代方式62
‑
79的任一项所述的方法,其中抗体包括全长抗体或其结合片段。
93.81.根据替代方式62
‑
79的任一项所述的方法,其中抗体包括双特异性抗体或其结合片段。
94.82.根据替代方式62
‑
79的任一项所述的方法,其中抗体包括嵌合抗体。
95.83.根据替代方式62
‑
82的任一项所述的方法,其中抗体结合至对应于seq id no:1的残基1
‑
20的gal3区域内的至少一个氨基酸残基。
96.84.根据替代方式62
‑
82的任一项所述的方法,其中抗体结合至对应于seq id no:1的残基41
‑
91的gal3区域内的至少一个氨基酸残基。
97.85.根据替代方式62
‑
82或84的任一项所述的方法,其中抗体结合至对应于seq id no:1的残基41
‑
71的gal3区域内的至少一个氨基酸残基。
98.86.根据替代方式62
‑
82或84的任一项所述的方法,其中抗体结合至对应于seq id no:1的残基71
‑
91的gal3区域内的至少一个氨基酸残基。
99.87.根据替代方式62
‑
86的任一项所述的方法,其中抗体结合至肽_1,肽_4,肽_5,肽_6,肽_7或肽8内的至少一个氨基酸残基。
100.88.根据替代方式62
‑
87的任一项所述的方法,其中抗体包括小于1nm、1.2nm、2nm、5nm、10nm、13.5nm、15nm、20nm、25nm或30nm的kd。
101.89.根据替代方式62
‑
88的任一项所述的方法,其中抗体包括单价fab’、二价fab2、单链可变片段(scfv)、双抗体、微抗体、纳米抗体、单结构域抗体(sdab)或骆驼化抗体或其结合片段。
102.90.根据替代方式62
‑
89的任一项所述的方法,其中抗体包括igg框架。
103.91.根据替代方式62
‑
90的任一项所述的方法,其中抗体包括igg1、igg2或igg4框架。
104.92.根据替代方式62
‑
91的任一项所述的方法,其中抗体进一步包括fc突变。
105.93.根据替代方式62
‑
92的任一项所述的方法,其进一步包括在接触步骤之前向受试者施用抗体。
106.94.根据替代方式93所述的方法,其中受试者被诊断具有纤维化疾病。
107.95.根据替代方式94所述的方法,其中纤维化疾病是肾纤维化。
108.96.根据替代方式94所述的方法,其中纤维化疾病是肝纤维化。
109.97.根据替代方式93
‑
96的任一项所述的方法,其中抗体被配制用于全身施用。
110.98.根据替代方式93
‑
96的任一项所述的方法,其中抗体被配制用于肠胃外施用。
111.99.根据替代方式93
‑
98的任一项所述的方法,其中受试者是哺乳动物。
112.100.根据替代方式64和66
‑
99的任一项所述的方法,其中gal3
‑
tim
‑
3相互作用减小至小于70%、小于60%、小于59%、小于50%、小于40%、小于34%、小于30%、小于20%、小于14%、小于10%、小于7%、小于5%、小于4%或小于1%。
113.101.根据替代方式100所述的方法,其中相互作用发生在选自区域145
‑
168、160
‑
177或165
‑
184的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置145
‑
168、160
‑
177或165
‑
184。
114.102.根据替代方式100所述的方法,其中相互作用发生在选自区域149
‑
156、152
‑
168、163
‑
169或163
‑
171的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置149
‑
156、152
‑
168、163
‑
169或163
‑
171。
115.103.根据替代方式100
‑
102的任一项所述的方法,其中相互作用发生在选自区域90
‑
122或82
‑
111的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置90
‑
122或82
‑
111。
116.104.根据替代方式100
‑
102的任一项所述的方法,其中相互作用发生在选自区域91
‑
111、107
‑
117、96
‑
102、100
‑
106或92
‑
119的tim
‑
3的一个或多个残基处,本文残基位置对应于seq id no:2的位置91
‑
111、107
‑
117、96
‑
102、100
‑
106或92
‑
119。
117.105.用于治疗受试者中免疫相关疾病的抗gal3抗体,其中抗gal3抗体诱导免疫系统的激活。
118.106.根据替代方式105所述的用于治疗免疫相关疾病的抗gal3抗体,其中抗gal3抗体抑制gal3和tim
‑
3之间的相互作用。
119.107.根据替代方式105或106所述的用于治疗免疫相关疾病的抗gal3抗体,其中免疫系统的激活包括cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞、nk细胞、m1巨噬细胞或其组合的增殖。
120.108.根据替代方式105
‑
107的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中免疫系统的激活包括m2巨噬细胞的减少。
121.109.根据替代方式105
‑
108的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中免疫相关疾病是癌症。
122.110.根据替代方式109所述的用于治疗免疫相关疾病的抗gal3抗体,其中癌症是乳腺癌、结肠直肠癌、肾癌、肝癌、肺癌或血液系统恶性肿瘤。
123.111.根据替代方式109或110所述的用于治疗免疫相关疾病的抗gal3抗体,其中癌症是转移性癌症、复发癌症或难治癌症。
124.112.根据替代方式109
‑
111的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中抗gal3抗体与另外治疗剂,比如免疫检查点调节剂、化疗剂、靶向治疗剂、激素治疗剂、基于干细胞的治疗剂、外科手术或辐射疗法组合施用。
125.113.根据替代方式105
‑
108的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中免疫相关疾病是纤维化,并且抗gal3抗体导致组织中细胞外基质蛋白的积累降低。
126.114.根据替代方式113所述的用于治疗免疫相关疾病的抗gal3抗体,其中细胞外
基质蛋白包括胶原。
127.115.根据替代方式113或114所述的用于治疗免疫相关疾病的抗gal3抗体,其中降低受试者中至少一种纤维化生物标志物的表达水平,和其中至少一种纤维化生物标志物包括α
‑
sma、纤连蛋白或二者。
128.116.根据替代方式113
‑
115的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中组织选自由以下组成的组:肝组织、肾组织、皮肤组织、肺组织、心脏组织、脑组织、肠组织、骨髓组织和软组织。
129.117.根据替代方式113
‑
116的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中纤维化是肾纤维化、肝纤维化、肺纤维化、心脏纤维化或血管纤维化。在一些实施方式中,这可以iv或皮下施用。
130.118.根据替代方式105
‑
117的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中抗gal3抗体被配制用于全身施用、肠胃外施用、静脉内施用或皮下施用。
131.119.根据替代方式105
‑
118的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中受试者是人。
132.120.根据替代方式1
‑
104的任一项所述的方法,其中抗gal3抗体选自由以下组成的组的一种或多种:2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8和mimt001。
133.121.根据替代方式1
‑
104的任一项所述的方法,其中抗gal3抗体是具有来自2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8和mimt001的一种或多种内的cdr的1、2、3、4、5或6个cdr的抗体。
134.121.根据替代方式1
‑
104的任一项所述的方法,其中抗gal3抗体是imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006
‑
8。
135.122.根据替代方式105
‑
119的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中抗gal3抗体选自由以下组成的组:2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8和mimt001。
136.123.根据替代方式105
‑
119的任一项所述的用于治疗免疫相关疾病的抗gal3抗体,其中抗gal3抗体是imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006
‑
8。
137.124.至少包括图35a
‑
36b的抗体的任一种内的hcdr3的抗gal3抗体。
138.125.根据替代方式124所述的抗gal3抗体,其进一步包括图35a
‑
36b的抗体的任一种内的所有3种hcdr。
139.126.根据替代方式125所述的抗gal3抗体,其进一步包括图35a
‑
36b的抗体的任一种内的所有3种lcdr。
140.127.一种抗gal3抗体,其包括图36a内重链序列的任一种,或与其至少80%同一性
的序列。
141.128.一种抗gal3抗体,其包括图36b内轻链序列的任一种,或与其至少80%同一性的序列。
142.129.根据替代方式128所述的抗gal3抗体,其进一步包括图36a内重链序列的任一种,或与其至少80%同一性的序列。
143.130.一种包括6个cdr的抗gal3抗体,其中6个cdr,在它们的组合序列中,与图35a和35b内任何组的6个cdr是至少80%同一性的。
144.131.一种抗gal3抗体,其包括来自图38的至少一个cdr。
145.132.一种抗gal3抗体,其包括来自图38的至少两个cdr。
146.133.一种抗gal3抗体,其包括来自图38的至少三个cdr
147.134.一种抗gal3抗体,其包括来自图38的至少四个cdr。
148.135.一种抗gal3抗体,其包括来自图38的至少五个cdr。
149.136.一种抗gal3抗体,其包括来自图38的至少五个cdr。
150.137.一种抗gal3抗体,其包括来自图38的六个cdr,并且其中所有六个来自单个bin(single bin)。
151.138.一种抗gal3抗体,其包括来自图38的六个cdr,或在它们的整个序列中,与其是至少80%同一性的一组6个cdr。
附图说明
152.除了以上描述的特征之外,从以下附图和示例性实施方式的描述中附加特征和变化将变得显而易见。应当理解,这些附图描绘了典型的实施方式并且不旨在限制范围。
153.图1a
‑
c阐释了共免疫沉淀测定的结果,指示人gal3(hgal3)特异性拉下人tim
‑
3(htim
‑
3)。图1a显示了用编码ha标记的htim
‑
3的质粒和编码hgal3、hgal9或hceacam1的质粒共转染的293t细胞中的tim
‑
3表达。图1b显示了hgal9、hgal3或hceacam1的表达。图1c显示了hgal3而不是ceacam1,在共转染的293t细胞中拉下ha标记的htim
‑
3。结果还显示了人gal9(hgal9)拉下htim
‑
3,但拉下伴随着蛋白质聚集(图1b),指示hgal9和htim
‑
3之间的结合可以是非特异性的。
154.图2显示了使用包括与higg的fc部分融合的htim
‑
3细胞外结构域(htim
‑
3fc)的融合蛋白质的拉下试验的结果。结果显示了gal3和tim
‑
3之间的结合是特异性的。如该图中显示的,htim
‑
3fc而不是hfc或hpd1fc从293t细胞中拉下过度表达的、flag标记的hgal3蛋白质。
155.图3显示细胞粘合试验的结果,指示hgal3和htim
‑
3之间的特异性相互作用。如图中显示的,与用hvista fc或hpd1 fc涂布的板相比,显著更高数量的表达hgal3的a20细胞(a20 gal3细胞)能够粘附至用htim
‑
3fc涂布的板。结果还指示了与用人vista fc(hvista fc)涂布的板或用htim
‑
3fc涂布的板相比,更高数量的a20 pdl1细胞能够粘附至用hpd1fc涂布的板。
156.图4a显示了通过流式细胞术分析的活a20细胞(左侧的峰)和死a20细胞(右侧的峰)。
157.图4b
‑
c显示了用抗hfc apc抗体染色的活细胞(图4b)和死细胞(图4c)的流式细胞
术分析的结果。在第1组中,不用mtim
‑
3fc蛋白质孵育a20 gal3细胞,作为对照;第2组中,用mtim
‑
3fc蛋白质孵育a20 gal3细胞;在第3、4、5组中,除了mtim
‑
3fc蛋白质之外,还添加抗小鼠tim
‑
3多克隆抗体(r&d system,minneapolis,mn)(第3组)、单克隆抗体rmt3
‑
23(bio x cell,west lebanon,nh)(第4组)、单克隆抗体215015(r&dsystems)(第5组)以测试这些抗体是否可阻断gal3和tim3的结合。
158.图5a
‑
c显示了elisa结果,指示gal3对tim
‑
3的特异性结合。在图5a中,显示了用10ug/ml的mgal3涂布板,mgal3多克隆抗体(mgal3pab)和单克隆抗体imt001,而不是单克隆抗体m3/38,阻断gal3和tim3之间的相互作用。图5b显示了乳糖阻断gal9,而不是gal3,结合至tim
‑
3,指示gal3和tim3之间的结合是不依赖糖的结合。图5c显示了抗体rmt3
‑
23阻断磷脂酰丝氨酸(ps),而不是gal3,结合至tim
‑
3,指示结合至gal3的tim
‑
3上的表位不同于结合至ps的那些。
159.图6a
‑
b显示了过度表达的gal3抑制t细胞激活。图6a显示了小鼠a20细胞克隆#41、#31和#15过度表达gal3。图6b显示了当这些细胞与小鼠do11.10 t细胞混合时,与亲本a20细胞相比,产生少得多il
‑
2。
160.图7a
‑
e显示了gal3抗体具有肺转移模型中抗肿瘤活性。图7a显示了b16f10肿瘤细胞上gal3的高表达。图7b显示了三个治疗组的整个肺的代表性图像。图7c显示了左肺叶表面上的转移集落(colony)的数量(平均值
±
sem)。图7d和图7e显示了不同治疗组的肺重量和体重(平均值
±
sem)。与用同种型对照治疗的动物相比,用单克隆抗人gal3抗体治疗的动物显示了肿瘤数量显著减少(p<0.01)(图7b)并且如肺重量指示的肿瘤负担少得多(p<0.05)(图7d)。然而,用pd1抗体治疗的动物没有显示该肺转移模型中肿瘤数量或负担的显著减少(p>0.05)。图7e显示了用pd1抗体或gal3抗体治疗的动物与对照组具有相似的体重,指示没有与任一抗体的施用相关的副作用。
161.图8a
‑
c显示了4t1原位肿瘤诱导的肺转移中gal3抗体的抗肿瘤活性。图8a显示了已经用4t1细胞植入的并且然后用对照抗体(“同种型”)或imt001治疗的小鼠的肺上转移的肿瘤集落的图像。在30天周期期间在第0、3、7、10和14天腹膜内施用抗体。当处死小鼠时在第30天拍摄图像。图8b显示了在相同周期期间这些小鼠的体重测量。图8c显示了在第30天这些小鼠的左肺叶表面上转移的肿瘤集落的数量。
162.图9显示了用renca肿瘤细胞植入的和用gal3抗体治疗的小鼠中的肿瘤生长。与用renca肿瘤细胞植入的和用同种型对照抗体(“iso”)治疗的小鼠相比,用gal3抗体(“imt001”)治疗的小鼠显示了减少得多的肿瘤尺寸(p<0.05),而抗小鼠pd
‑
1抗体29f没有影响(p>0.05)。
163.图10显示了用mc38结肠癌细胞植入的和用抗gal3抗体治疗的小鼠中的肿瘤生长。与用mc38肿瘤细胞植入的和用同种型对照抗体(“iso”)小治疗的鼠相比,用gal3抗体(“imt001”)治疗的小鼠显示了减少得多的肿瘤大小(p<0.05)。
164.图11a
‑
d显示了表位作图的结果。合成源自hgal3蛋白质序列的肽阵列(图11a)并且用抗gal3抗体imt001进行斑点印迹(图11b)。肽5和6显示了良好信号,指示抗gal3单克隆抗体,imt001可结合至这些肽。为了进一步绘制这些肽上imt001的结合表位,合成源自这些肽序列的几种更短的肽(图11c)并且通过elisa测量它们与imt001的结合(图11d)。具有序列gqappgaypg(seq id no:28)的肽产生了最高信号。
165.图12总结了来自用表达各种淋巴细胞标志物:cd3、cd4、cd8、cd19或dx5的b16f10细胞植入的小鼠的免疫细胞的数量。已经用同种型对照抗体或imt001治疗这些小鼠。
166.图13a
‑
b显示了免疫组织化学(ihc)测定中人肺癌的肿瘤相关的巨噬细胞上gal3表达。imt001用于染色人肺癌冷冻切片以检测肿瘤相关的巨噬细胞上gal3表达。图13a显示了来自染色鳞状的细胞癌的结果和图13b显示来自腺癌染色的结果。
167.图14a
‑
c显示了人m2巨噬细胞(图14c)而不是树突细胞(dc)(图14a)或m1巨噬细胞(图14b)上检测gal3的表达。
168.图15a
‑
d显示了小鼠巨噬细胞/t细胞反应中gal3抗体(“imt001”)的免疫活性。图15b显示了与对照(图15a)相比,检测通过ihc在小鼠巨噬细胞系raw264.7上的gal3表达。图15c显示了使用imt001染色的细胞通过流式细胞术在小鼠巨噬细胞系上gal3的表达。抗gal3抗体imt001而不是抗小鼠pd
‑
1抗体29f,增强了raw巨噬细胞/do11.10 t细胞混合反应中的il
‑
2产生(图15d)。
169.图16阐释了通过gal3结合抗体的gal3
‑
tim3相互作用阻断的elisa评估。结果阐释了gal3
‑
靶向的抗体展示出gal3
‑
tim3结合的不同阻断。显示了在抗体不存在的情况下tim3
‑
gal3结合的百分比。
170.图17a
‑
17b阐释了结合至gal3的肽片段的抗gal3抗体的elisa评估。图17a:抗体mab1、mab3、mab4和mab5;图17b:抗体mab2、mab3、mab6和mab7。结果阐释了gal3
‑
靶向的抗体展示出gal3
‑
tim3结合的不同阻断。
171.图18阐释了结合至gal3的抗gal3抗体的elisa竞争结合评估。结果阐释了gal3
‑
靶向的抗体mab1(801)和mab4(804)而不是mab5(805)双向竞争结合至gal3。
172.图19a
‑
c阐释了抗gal3抗体结合和解离动力学与gal3的生物层干涉测量评估(gal3结合抗体亲和力)。图19a:mab1;kd=13.5nm。
173.图19b:mab4;kd=1.2nm。图19c:mab5;kd=32nm。
174.图20阐释了t
‑
细胞抗原特异性应答性的gal3增强的cmv抗原回忆(antigen recall)试验评估。结果阐释了gal
‑
3靶向抗体通过cmv
‑
诱导的抗原回忆展示出不同的t
‑
细胞激活。
175.图21a
‑
c阐释了介导tim3和gal3之间的相互作用的gal3和tim3区域的maldi
‑
ms鉴定。注意,氨基酸编号基于在信号肽的加工后成熟的蛋白质。还参见表2。图21a阐释了结合界面中涉及的潜在序列。图21b阐释了相互作用中涉及的潜在残基。图21c阐释了各自tim
‑
3和gal3上绘制的序列位置。注意,氨基酸编号基于在信号肽的加工后的成熟蛋白质。
176.图22显示了来自在输尿管结扎以后用imt001和migg2b(对照)抗体治疗14天的雄性单侧尿道梗阻(uuo)小鼠或不用抗体治疗的假(sham)的肾组织裂解物中纤维化标志物,α
‑
平滑肌肌动蛋白(α
‑
sma)和纤连蛋白的蛋白质印迹分析。gapdh用作负载对照。
177.图23显示了来自非肥胖糖尿病和炎症(n
‑
if)小鼠的肝组织裂解物中纤维化标志物,α
‑
sma和纤连蛋白的蛋白质印迹分析。用imt001、抗gal3抗体和migg2b(对照)抗体40天治疗动物。gapdh用作负载对照。
178.图24.在3μg/ml通过elisa评估半乳糖凝集素
‑
3靶向抗体阻断gal3和tim3的结合的能力。条表示平均值 /
‑
标准偏差。
179.图25.gal3肽与结合阻断gal3
‑
tim3的gal3
‑
靶向抗体的能力的比对。
180.图26.通过抗体竞争鉴定半乳糖凝集素
‑
3结合抗体。值表示抑制,如通过生物层干扰仪评估的。
181.图27.在滴定系列中通过elisa评估人源化抗gal3抗体对gal3
‑
tim3的阻断。绘制的值表示平均值 /
‑
标准偏差。
182.图28a
‑
d.用皮下mbt2肿瘤移植的和用对照、imt001、抗pd
‑
l1抗体或其组合(图28a),或用对照、imt001、抗pd
‑
1抗体或其组合(图28c)治疗的小鼠的肿瘤体积。抗pd
‑
l1(图28b)或抗pd
‑
1(图28d)的肿瘤体积的图表示每天测量各个动物。
183.图29a
‑
d.通过大体组织学(gross histology)(图29a)和列举的(enumerated)(图29b)评估用人igg4(huigg4)或imt001
‑
4治疗的正常的和stam
‑
cdaa小鼠中肝细胞癌形成。箭头强调了具有肿瘤的区域。评估肝样品的苏木精和伊红染色切片的肿瘤形成(图29c)。箭头强调了具有肿瘤的区域。定量了用huigg4或imt001
‑
4治疗的stam
‑
cdaa小鼠的血清中α
‑
胎蛋白(图29d)。圆圈指示每只动物的平均值,线指示每组的平均值。
184.图30a
‑
d.来自用同种型对照或mimt001治疗的nash肝纤维化的mcd小鼠模型的肝的苏木精和伊红染色切片(图30a)。基于图像量化测量脂肪变性、肝细胞气球样变、小叶炎症或nafld活性评分(nas)的组织学发现(图30b)。来自如(a)中治疗的小鼠的天狼猩红(picosirius red)染色的肝样品(图30c)。基于图像量化天狼猩红(sirius red)染色(图30d)。条表示7只动物的均值 /
‑
均值的标准误差。
185.图31a
‑
b.来自用同种型对照或imt001
‑
4治疗的肝纤维化的胆碱缺陷的l
‑
氨基限定的高脂肪饮食(cdaa
‑
hfd)stam模型的天狼猩红染色的肝样品(图31a)。基于图像量化天狼猩红染色(图31b)。条表示来自7只动物中的每只的5个领域的均值 /
‑
均值的标准误差。
186.图32a
‑
c.评估来自小鼠单侧输尿管梗阻(uuo)模型中用同种型对照、imt001
‑
4、imt001
‑
6或二甲双胍治疗的小鼠的肾纤维化kim
‑
1和ngal的血清标志物(图32a)和天狼猩红染色的肾样品(图32b)。基于图像的天狼猩红染色量化(图32c)。条表示来自每组七只动物中的每只三次评的均值 /
‑
均值的标准误差。点表示个体动物平均天狼猩红染色,条指示均值组值。
187.图33a
‑
b.用同种型对照或mimt001治疗的uuo后第一天治疗的肾样品中胶原蛋白1a1(col1a1)沉积的ihc评估(图33a)。黑色箭头对应于纤维胶原沉积的区域。基于图像定量(图33b)。条表示来自每组7只动物的每只的10个领域的均值 /
‑
均值的标准误差。
188.图34a
‑
b.用同种型对照或mimt001治疗的博莱霉素
‑
诱导的肺纤维化小鼠模型中肺纤维化的masson三色染色评估(图34a)。组织切片的ashcroft评分(图34b)。条表示来自每组8只动物的每只的10个领域的均值 /
‑
均值的标准误差。
189.图35a描绘了抗gal3抗体的各种实施方式的vh cdr区域的一些实施方式。在一些实施方式中,本文提供的任何方法或组合物可包括一个或多个本文提供的cdr,包括它们的1、2或3个。
190.图35b描绘了抗gal3抗体的各种实施方式的vl cdr区域的一些实施方式。在一些实施方式中,本文提供的任何方法或组合物可包括一个或多个本文提供的cdr,包括它们的1、2或3个。
191.图36a描绘了抗gal3抗体的各种实施方式的完全vh区域的一些实施方式。在一些实施方式中,本文提供的任何方法或组合物可包括这些vh区域的任何一个。
192.图36b描绘了抗gal3抗体的各种实施方式的完全vl区域的一些实施方式。在一些实施方式中,本文提供的任何方法或组合物可包括这些vl区域的任何一个。
193.图37描绘了各种gal3抗体(包括完全重链或κ链序列)的一些实施方式。在一些实施方式中,其他图中提供的vh/vl和/或cdr的任何一个或多个可以与图37中相关序列的任何一个或多个配对(例如,igg4部分或κ序列)。
194.图38描绘了抗gal3抗体的各种实施方式的vh cdr或vl cdr区域的一些实施方式的比对。在一些实施方式中,本文提供的任何方法或组合物可使用图38中提供的共有cdr的任何1、2、3、4、5或6个。
195.详细描述
196.半乳糖凝集素
‑
3(gal3、gal3或gal
‑
3)在多种细胞类型中表达,并且参与广泛的生理和病理过程,其包括细胞粘附、细胞激活和化学吸引、细胞周期、细胞凋亡、细胞生长和分化以及肿瘤进展和转移。gal3在肿瘤细胞上和肿瘤微环境,例如肿瘤相关巨噬细胞,尤其是m2巨噬细胞中表达。进一步,它还牵涉促进成纤维细胞增殖和转化并且介导胶原蛋白产生的多种促纤维化因子的激活。此外,gal3被认为在包括肝、肾、肺和心肌的各种组织的纤维发生中起关键作用。
197.tim
‑
3是在免疫细胞上,尤其是在t细胞上表达的分子,并且可以通过与gal3的相互作用抑制免疫应答,例如t细胞信号传导。抗gal3抗体干扰gal3和tim
‑
3之间的相互作用并且激活免疫应答。
198.肿瘤通常与作为富集巨噬细胞的反应性基质(stroma)的一部分的免疫浸润有关。肿瘤相关的巨噬细胞(tam)通过促进新血管形成和基质(matrix)降解在促进肿瘤生长中发挥重要作用。当与肿瘤相关时,巨噬细胞表明向两种表现型不同的巨噬细胞亚群:m1巨噬细胞或m2巨噬细胞之一的功能极化。已知m1巨噬细胞产生促炎症反应细胞因子并且在细胞破坏中发挥积极作用,而m2巨噬细胞主要清除碎片并且促进血管生成和伤口修复。从而,许多具有大量tam的肿瘤具有增加的肿瘤生长速率、局部增殖和远处转移。m2巨噬细胞群体表现型类似于促进肿瘤生长和发展的tam群体。在一些情况下,除了表达gal3以外,m2巨噬细胞还表达选自由以下组成的组中的一种或多种细胞表面标志物:cd206、il
‑
4r、il
‑
1ra、decoy il
‑
1rll、il
‑
10r、cd23、巨噬细胞清除受体a和b、ym
‑
1、ym
‑
2、低密度受体有关的蛋白质1(lrp1)、il
‑
6r、cxcr1/2、cd136、cd14、cd1a、cd1b、cd93、cd226、(fcyr)和pd
‑
l1。
199.组织纤维化是渐进性衰弱性疾病,其特征在于细胞外基质(ecm)蛋白质比如胶原蛋白和纤连蛋白的大量积累,导致组织瘢痕形成、器官损伤、器官功能下降和随后的器官衰竭。组织纤维化可位于肾、肝、肺、心脏、皮肤、胰腺、肠、眼、神经系统、关节、肌腱、纵隔或腹膜后腔。组织纤维化的特征包括上皮和内皮损伤和功能障碍;肌成纤维细胞(mfb)、平滑肌细胞和星状细胞的异常增殖;以及ecm沉积。细胞因子、趋化因子、生长因子和血管生成因子的存在进一步调节促纤维化过程中产生ecm的细胞的激活。
200.已知半乳糖凝集素
‑
3(gal3)在细胞增殖、粘附、分化、血管生成和细胞凋亡中发挥重要作用。此外,它还涉及促进成纤维细胞增殖和转化并且介导胶原蛋白产生的各种促纤维化因子的激活。此外,gal3被认为在包括肝、肾、肺和心肌的各种组织的纤维发生中起关键作用。
201.在一些实施方式中,本文公开了用抗gal3抗体减少组织中纤维化或其倾向的方
法。在一些实施方式中,减少组织中纤维化或其倾向包括防止在正常组织中发生纤维化。在一些实施方式中,减少组织中的纤维化或其倾向包括减缓或阻止纤维化组织中纤维化进展。在一些实施方式中,减少组织中纤维化或其倾向包括减少纤维化组织中的纤维化程度的量。在一些实施方式中,减少组织中的纤维化或其倾向包括消除纤维化组织中的纤维化。
202.在一些实施方式中,本文还描述了通过监测一种或多种纤维化生物标志物来监测组织纤维化进展的方法。在另外的情况下,本文公开了用抗gal3抗体治疗组织纤维化的方法,其中抗gal3抗体破坏gal3和tim
‑
3之间的相互作用。
203.在以下详细的描述中,参考了构成其一部分的附图。在附图中,除非上下文另有说明,否则相似的符号通常确定相似的组分。在详细描述、附图和权利要求中描述的阐释性实施方式并不意味着是限制性的。在不脱离本文提出的主题的精神或范围的情况下,可以利用其他实施方式,并且可以做出其他改变。将容易理解,本公开的方面,如本文一般描述的和在附图中阐释的,可以以各种不同配置进行布置、代替、组合、分离和设计,所有这些都被本文明确地预期。
204.除非另有定义,本文使用的技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同。为了本公开的目的,以下术语定义如下。
205.本文使用的冠词“一个”和“一种”指该冠词的语法对象的一个或多于一个(例如,至少一个)。通过示例,“一种元素”意味着一种元素或多于一种元素。
[0206]“约”意思是提及质量、水平、值、数量、频率、百分数、尺寸、大小、量、重量或长度的变化和30、25、20、15、10、9、8、7、6、5、4、3、2或1%一样多的质量、水平、值、数量、频率、百分数、尺寸、大小、量、重量或长度。
[0207]
在整个本说明书中,除非上下文另有要求,否则词语“包括”、“包含”和“含有”将被理解为暗示包括所陈述的步骤或元素或步骤或元素的组,但不排除任何其他步骤或元素或步骤或元素的组。“由
……
组成”意味着包括并限于跟随短语“由
……
组成”的任何内容。因此,短语“由
……
组成”指示列出的元素是必需的或强制性的,并且可不存在其他元素。“基本上由
……
组成”意味着包括伴随短语列出的任何元素,并且限于不干扰或有助于列出的元素的公开中指定的活性或动作的其他元素。因此,短语“基本上由
……
组成”指示列出的元素是必需的或强制性的,但其他要素是可选的,并且取决于它们是否实质性影响列出的元素的活性或动作可能存在或不存在。
[0208]
在一些实施方式中,提供了抗gal3抗体或其结合片段或包括抗gal3抗体或其结合片段的组合物。在一些实施方式中,提供了使用抗gal3抗体或其结合片段或包括抗gal3抗体或其结合片段的组合物在体外或体内阻断或破坏gal3和tgf
‑
β受体之间的相互作用的方法。在一些实施方式中,使用抗gal3抗体或其结合片段或包括抗gal3抗体或其结合片段的组合物阻断或破坏gal3和tim
‑
3之间的相互作用的方法用于治疗、治愈或预防受试者的疾病或障碍。在一些实施方式中,疾病或障碍是癌症、乳腺癌、结肠直肠癌、肾癌、肝癌、肺癌或血液系统恶性肿瘤。在一些实施方式中,在一些实施方式中,癌症是转移性癌症、复发癌症或难治癌症。在一些实施方式中,抗体与另外治疗剂,比如免疫检控点抑制剂、化疗剂、靶向治疗剂、激素治疗剂或基于干细胞的治疗剂组合施用。在一些实施方式中,疾病或障碍是组织比如肝组织、肾组织、皮肤组织、肺组织、心脏组织、脑组织、肠组织、骨髓组织或软组织中的纤维化。
[0209]
如本文使用的,术语“个体”、“受试者”和“患者”意味着任何哺乳动物或鸟类。在一些实施方式中,哺乳动物是人。在一些实施方式中,哺乳动物是非人的,包括但不限于农场动物(例如牛、猪、马、鸡等)、运动动物、宠物、灵长类动物、狗、猫、小鼠和大鼠。这些术语均不要求或仅限于特征在于卫生保健工作者(例如医生、注册护士、执业护士、医师助理、医护人员或临终关怀工作者)的监督(例如持续或间歇性)的状况。
[0210]
如本文使用的,本文互换地使用的术语“多肽”、“肽”和“蛋白质”指任何长度的氨基酸的聚合物。聚合物可以是线性的、环状的或支化的,它可以包括修饰的氨基酸,并且它可以被非氨基酸中断。术语还涵盖已经被修饰的氨基酸聚合物,例如,经硫酸化、糖基化、脂质化、乙酰化、磷酸化、碘化、甲基化、氧化、蛋白水解加工、磷酸化、异戊二烯化、外消旋化、硒化、转移
‑
rna介导的添加氨基酸为蛋白质,比如精氨酸化、泛素化或任何其他操作,比如与标记组分缀合。
[0211]
如本文使用的,术语“氨基酸”指天然和/或非天然或合成氨基酸,包括甘氨酸和d或l光学异构体二者,以及氨基酸类似物和肽模拟物。
[0212]“源自”指定蛋白质的多肽或氨基酸序列指多肽的来源。优选地,多肽具有与在序列中编码的多肽的氨基酸序列基本上相同的氨基酸序列或其部分,其中该部分由至少10
‑
20个氨基酸、或至少20
‑
30个氨基酸组成、或至少30
‑
50个氨基酸组成,或可与序列中编码的多肽免疫地鉴定。该术语还包括从指定的核酸序列表达的多肽。
[0213]
如本文使用的,术语“抗体”旨在包括具有适合并且识别表位的特定形状的任何含多肽链的分子结构,其中一种或多种非共价结合相互作用稳定分子结构和表位之间的复合。本发明中利用的抗体可以是多克隆抗体,尽管单克隆抗体是优选的,因为它们可以通过细胞培养或重组来复制并且可以被修饰以降低它们的抗原性。
[0214]
除了完整的免疫球蛋白(或其重组对应物),包括表位结合位点的免疫球蛋白片段或“结合片段”(例如,fab'、f(ab')2、单链可变片段(scfv)、双抗体、微抗体、纳米抗体、单域抗体(sdab)或其他片段)可用作本发明中的抗体部分。这种抗体片段可通过蓖麻蛋白、胃蛋白酶、木瓜蛋白酶或其他蛋白酶裂解从整个免疫球蛋白产生。可以利用重组免疫球蛋白技术设计最小免疫球蛋白。例如,用于本发明的“fv”免疫球蛋白可以通过经肽连接体(例如,聚甘氨酸或不形成α螺旋或β片状基序的另一序列)将可变轻链区连接至可变重链区来产生。纳米抗体或单域抗体还可源自可替选的生物体,比如单峰驼、骆驼、美洲驼、羊驼或鲨鱼。在一些实施方式中,抗体可以是缀合物,例如聚乙二醇化抗体、药物、放射性同位素或毒素缀合物。针对特定表位或表位组合的单克隆抗体将允许靶向和/或消耗表达标志物的细胞群体。可以利用各种技术使用单克隆抗体来筛选表达标志物的细胞群体,并且包括使用抗体包被的磁珠进行磁分离、使用附着在固体基质(即,板)上的抗体“淘选”和流式细胞术(例如美国专利号5,985,660,本文通过参考以其整体明确地并入)。
[0215]
如本文使用的,适用于非人(例如啮齿动物或灵长类动物)抗体的术语“人源化”是杂合免疫球蛋白、免疫球蛋白链或其片段,其含有源自非人免疫球蛋白的最少序列。
[0216]
抗体的“可变区”指单独或组合的抗体轻链可变区或抗体重链可变区。如本领域已知的,重链和轻链的可变区各自由通过三个也称为高变区的互补决定区(cdr)连接的四个框架区(fr)组成,并且有助于形成抗体的抗原结合位点。如果受试者可变区的变体是期望的,特别是具有cdr区外(即,在框架区中)的氨基酸残基中的置换,可以通过比较受试者可
变区与含有与受试者可变区相同规范类别中的cdr1和cdr2序列的其他抗体的可变区来鉴定适当的氨基酸置换,优选保守氨基酸置换(chothia和lesk,j mol biol196(4):901
‑
917,1987)。
[0217]
在一些实施方式中,通过解析抗体的结构和/或解析抗体
‑
配体复合物的结构来完成cdr的明确描绘和包括抗体结合位点的残基的鉴定。在一些实施方式中,这可以通过本领域技术人员已知的各种技术的任一种,比如x射线晶体学来完成。在一些实施方式中,可以采用各种分析方法来鉴定或模拟(approximate)cdr区。在一些实施方式中,可以采用各种分析方法来鉴定或模拟cdr区。这种方法的示例包括但不限于kabat定义、chothia定义、imgt方法(lefranc等,2003)dev comp immunol.27:55
‑
77)、计算程序比如paratome(kunik等,2012,nucl acids res.w521
‑
4)、abm定义和构象定义。
[0218]
kabat定义是抗体中编号残基的标准,并且通常用于鉴定cdr区。参见,例如,johnson&wu,2000,nucleic acids res.,28:214
‑
8。chothia定义类似于kabat定义,但chothia定义考虑了某些结构环区域的位置。参见,例如,chothia等,1986,j.mol.biol.,196:901
‑
17;chothia等,1989,nature,342:877
‑
83。abm定义使用由模型抗体结构的oxford molecular group产生的一套集成的计算机程序。参见,例如,martin等,1989,proc natl acad sci(usa),86:9268
‑
9272;“abm.tm.,a computer program for modeling variable regions of antibodies”,oxford,uk;oxford molecular,ltd。abm定义使用知识数据库和ab initio方法的组合建模来自一级序列的抗体的三级结构,比如由samudrala等,1999,“ab initio protein structure prediction using a combined hierarchical approach”,proteins,structure,function and genetics suppl.,3:194
‑
198中描述的那些。接触定义基于可用的复合物晶体结构的分析。参见,例如maccallum等,1996,j.mol.biol.,5:732
‑
45。在另一方法中,本文称为cdr的“构象定义”,cdr的位置可以被鉴定为对抗原结合做出焓贡献的残基。参见,例如,makabe等,2008,journal of biological chemistry,283:1156
‑
1166。还有其他cdr边界定义可能不严格遵循以上方法之一,但仍将与至少一部分kabat cdr重叠,尽管根据特定残基或残基组不会显著影响抗原结合的预测或实验发现,它们可被缩短或延长。如本文使用的,cdr可以指由本领域已知的任何方法,包括方法的组合定义的cdr。本文使用的方法可以利用根据这些方法中的任一种定义的cdr。在含有多于一个cdr的一些实施方式中,cdr可以按照kabat、chothia、extended、imgt、paratome、abm和/或构象定义中的任一种,或任何前述的组合来定义。在一些实施方式中,可变区的残基编号使用imgt编号系统编号。在本文提供的序列中,cdr根据imgt绘制(https://world wide web.ebi.ac.uk/ipd/imgt/hla/align.html)。
[0219]
如本领域已知的,抗体的“恒定区”指单独或组合的抗体轻链的恒定区或抗体重链的恒定区。
[0220]
如本文使用的,关于抗体的术语“竞争”意思是第一抗体或其抗原结合部分,以与第二抗体或其抗原结合部分的足够相似的方式结合表位,使得与在第二抗体不存在的情况下第一抗体的结合相比,在第二抗体存在的情况下第一抗体与其同源表位的结合结果可检测地减少。其中第二抗体与其表位的结合在第一抗体存在的情况下也可检测地减少的替代方案可以但不一定是这种情况。即,第一抗体可以抑制第二抗体与其表位的结合,而第二抗体不抑制第一抗体与其相应表位的结合。然而,每种抗体可检测地抑制另一抗体与其同源
表位或配体的结合的情况,无论是在相同、更大还是更小程度上,抗体被称为彼此“交叉竞争”,用于结合它们各自的表位。本发明涵盖竞争和交叉竞争抗体。无论这种竞争或交叉竞争发生的机制(例如,位阻、构象变化或结合至共同表位或其部分)如何,基于本文提供的教导,技术人员将认识到,涵盖这种竞争和交叉竞争抗体并且可以用于本文公开的方法。
[0221]“优先地结合”或“特异性结合”(本文可互换地使用的)至表位的抗体是本领域理解很好的术语,并且确定这种特异性或优先结合的方法也是本领域熟知的。如果与分子与可选细胞或物质相比,分子与特定细胞或物质反应或缔合更频繁和/或更迅速地,和/或具有更长的持续时间和/或更大的亲和力,则称该分子展现出“特异性结合”或“优先地结合”。如果与抗体结合至其他物质比,抗体结合具有更大亲和力和/或亲合力(avidity),和/或更容易地,和/或具有更长的持续时间,则抗体“特异性结合”或“优先地结合”至靶。例如,特异或优先结合至cfd表位的抗体是与抗体结合至其他cfd表位或非cfd表位比,具有更大亲和力和/或亲合力,和/或更容易地,和/或具有更长的持续时间结合该表位的抗体。通过阅读该定义还可以理解,例如,特异或优先结合至第一靶的抗体(或部分或表位)可以或不可以特异或优先的合第二靶。因此,“特异结合”或“优先结合”不一定需要(尽管它可以包括)排他结合。通常,但不一定,提及结合意味着优先结合。
[0222]
如本文使用的,“基本上纯的”指至少50%纯的(即,不含污染物)、更优选地至少90%纯的、更优选地至少95%纯的、还更优选地至少98%纯的,最优选地至少为99%纯的物质(material)。
[0223]“宿主细胞”包括个体细胞或细胞培养物,其可以是或已经是用于并入多核苷酸插入物的载体的受体。宿主细胞包括单个宿主细胞的子代,并且由于自然、意外或故意突变,子代可不一定与原始亲本细胞完全相同(在形态或基因组dna互补中)。宿主细胞包括用本发明的多核苷酸体内转染的细胞。
[0224]
如本领域已知的,术语“fc区”用于定义免疫球蛋白重链的c
‑
末端区。“fc区”可以是天然序列fc区或变体fc区。尽管免疫球蛋白重链fc区的边界可能不同,但人igg重链fc区通常定义为从位置cys226或从pro230处的氨基酸残基延伸至其羧基末端。fc区中残基的编号是如kabat中的eu索引编号。kabat等,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md.,1991。免疫球蛋白的fc区通常包含两个恒定结构域,ch2和ch3。如本领域已知的,fc区可以以二聚体或单体形式存在。
[0225]
如本文使用的,“载体”意味着能够在宿主细胞中递送并且优选地表达一个或多感兴趣的基因或序列的构建体。载体的示例包括但不限于病毒载体、裸露的dna或rna表达载体、质粒、粘粒或噬菌体载体、与阳离子冷凝剂相关的dna或rna表达载体、封装在脂质体中的dna或rna表达载体,以及某些真核细胞,比如生产细胞。
[0226]
如本文使用的,“表达调控序列”意味着指导核酸转录的核酸序列。表达调控序列可以是启动子,比如组成型或诱导型启动子,或增强子。表达调控序列可操作地连接至待转录的核酸序列。
[0227]
如本文使用的,“药学上可接受的载体”或“药学上可接受的赋形剂”包括当与活性成分组合时允许该成分保持生物活性并且不与受试者的免疫系统反应的任何材料。示例包括但不限于任何标准药物载体,比如磷酸盐缓冲溶液、水、乳剂比如油/水乳液、各种类型的
润湿剂、去污剂比如聚山梨醇酯20以防止聚集和糖比如蔗糖作为冷冻保护剂。用于气溶胶或肠胃外施用的优选的稀释剂是磷酸盐缓冲液(pbs)或正常(0.9%)盐水。包括这种载体的组合物通过熟知的常规方法配制(参见,例如,remington'spharmaceutical sciences,第18版,a.gennaro,ed.,mack publishing co.,easton,pa.,1990和remington,the science and practice of pharmacy,第20版,mack publishing,2000)。
[0228]
如本文使用的,术语“k
结合”指抗体(或生物偶联物)与抗原结合的速率常数。具体地,使用全长抗体和/或fab抗体片段(即单价)和cfd测量速率常数(k
结合
和k
解离
)和平衡解离常数。
[0229]
如本文使用的,术语“k
解离”指抗体(或生物偶联物)从抗体/抗原复合物解离的速率常数。
[0230]
如本文使用的,术语“k
d”指抗体
‑
抗原(或生物偶联物
‑
抗原)相互作用的平衡解离常数。
[0231]
如本文使用的,术语“治疗”(和本领域中很好理解的)意味着用于在受试者的病症中获得有益或期望的结果,包括临床结果的方法。有益的或期望的临床结果可包括但不限于减轻或改善一种或多种症状或病症、减轻疾病的程度、稳定(即,不恶化)疾病状态、预防疾病的传递或传播、延迟或减慢疾病进展、改善或减轻疾病状态、减轻疾病复发和缓解,无论是部分的还是全部的,无论是可检测的还是不可检测的。如本文使用的“治疗”还包括预防性治疗。治疗方法包括向受试者施用治疗有效量的活性剂。施用步骤可由单次施用组成或可包括一系列施用。将组合物以足以治疗患者的量和持续时间施用至受试者。治疗周期的长度取决于多种因素,比如病症的严重程度、患者的年龄和遗传特征、活性剂的浓度、治疗中使用的组合物的活性或其组合。还应当理解,用于治疗或预防的试剂的有效剂量可以在特定治疗或预防方案的过程中增加或减少。通过本领域已知的标准诊断测定可以导致剂量的变化并且变得显而易见。在一些实施方式中,可能需要长期施用。
[0232]
术语“施用”包括口服施用、局部接触、作为栓剂施用、静脉内、腹膜内、肌内、病灶内、鞘内、鼻内或皮下施用,或植入缓释装置,例如微型渗透泵至受试者。通过任何途径,包括肠胃外和经粘膜(例如,颊、舌下、腭、牙龈、鼻、阴道、直肠或经皮)施用。肠胃外施用包括例如,静脉内、肌内、小动脉内、皮内、皮下、腹膜内、心室内和颅内。其他递送方式包括但不限于使用脂质体制剂、静脉内输注、透皮贴剂等。通过“共同施用”意思是在施用本文所述的第二化合物同时,刚好在其之前或刚好在其之后施用本文所述的第一化合物。
[0233]
如本文使用的,术语“治疗性靶”指在调节其活性后可以提供疾病表型(例如,纤维化或癌症)的调节(例如,通过调节表达、生物活性等)的基因或基因产物。如通篇所使用的,“调节”意思是指所指现象的增加或减少(例如,生物活性的调节指生物活性的增加或生物活性的减少)。
[0234]
本文可互换地使用的术语“癌症”、“瘤”、“肿瘤”和“癌”指展现出相对自主生长的细胞,以便它们展示出异常生长表型,其特征在于细胞增殖显著失去控制。一般而言,本技术中用于检测或治疗的感兴趣的细胞包括癌前(例如良性)、恶性、转移前、转移和非转移细胞。癌细胞的检测是特别感兴趣的。在“正常细胞”的上下文中使用的术语“正常”意思是指未转化表型的细胞或展现出被检查组织类型的非转化细胞的形态。“癌性表型”通常指是癌细胞特征的各种生物现象中的任一种,该现象可随癌症类型而变化。癌性表型通常通过例
如,细胞生长或增殖(例如,不受控制的生长或增殖)、细胞周期调节、细胞移动性、细胞
‑
细胞相互作用或转移等中的异常来鉴定。
[0235]
术语“肿瘤微环境”指其中肿瘤存在的细胞环境,包括肿瘤细胞和周围血管、免疫细胞、成纤维细胞、骨髓源性炎症性细胞、淋巴细胞、信号传导分子和细胞外基质。
[0236]
术语“免疫细胞”指参与特异性识别抗原的造血来源的细胞。免疫细胞包括抗原呈递细胞(apc),比如树突细胞或巨噬细胞、b细胞、t细胞、天然杀伤细胞和骨髓细胞,比如单核细胞、巨噬细胞、嗜酸性粒细胞、肥大细胞、嗜碱性粒细胞和粒细胞。
[0237]
术语“免疫应答”指t细胞介导的、nk细胞介导的、巨噬细胞介导的和/或b细胞介导的免疫应答。示例性免疫应答包括b细胞应答(例如,抗体产生)、nk细胞应答或t细胞应答(例如,细胞因子产生和细胞毒性)和细胞因子反应性细胞,例如巨噬细胞的激活。术语“激活免疫应答”指使用本领域技术人员已知的方法增强t细胞介导的和/或b细胞介导的免疫应答的水平。在一些实施方式中,增强水平是至少20
‑
50%、可替选地至少60%、至少70%、至少80%、至少90%、至少100%、至少120%、至少150%或至少200%。
[0238]
如本文使用的,术语“转化生长因子β受体”(tgf
‑
b受体)指在细胞表面上表达的对蛋白质转化生长因子β(tgf
‑
b)特异性的丝氨酸/苏氨酸激酶受体的家族。tgf
‑
b和受体之间的相互作用触发信号传导途径,其负责许多功能,包括但不限于细胞生长、分化(例如干细胞、免疫细胞)、细胞凋亡、稳态、趋化性、炎症和免疫细胞激活。
[0239]
如本文使用的,术语“纤维化”指其中由于细胞外基质比如胶原蛋白质的不受调节的产生而导致组织或器官硬化或疤痕的医学病症。纤维化与慢性炎症有关,其中免疫细胞比如巨噬细胞向成纤维细胞发信号以在应答中表达细胞外基质蛋白。这种信号传导是通过比如tgf
‑
b途径的途径实现的,尽管也还有其他促纤维化途径。纤维化包括但不限于肝纤维化、桥接纤维化、肝硬化、肾纤维化、肺纤维化、特发性肺纤维化、囊性纤维化、心血管纤维化、动脉纤维化、静脉血栓形成、心脏纤维化、肺动脉纤维化、关节纤维化、克罗恩氏病、杜普伊特伦氏挛缩、瘢痕疙瘩、纵隔纤维化、骨髓纤维化、佩罗尼氏病、肾原性系统性纤维化、进行性大量纤维化、腹膜后腔纤维化或系统性硬化。
[0240]
术语“%w/w”或“%wt/wt”意味着根据成分或试剂的重量占组合物总重乘以100表达的百分比。
[0241]
在一些实施方式中,本文公开了诱导免疫激活的方法,包括使抗gal3抗体与包括gal3
‑
表达细胞和tim
‑
3表达细胞的多种细胞接触。在一些实施方式中,本文公开了减少纤维化的方法,包括使包括gal3
‑
表达细胞和至少一种纤维化生物标志物的组织与抗gal3抗体接触足够时间以减少组织中至少一种纤维化生物标志物的表达。在一些实施方式中,抗gal3抗体导致减少组织中一种或多种细胞外基质蛋白,包括但不限于胶原蛋白的积累。
[0242]
在一些情况下,在结合至抗gal3抗体后,gal3
‑
表达细胞表达诱导免疫激活的细胞因子。在一些情况下,细胞因子是干扰素。在一些情况下,干扰素是ifnγ。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的110%、120%、130%、140%、150%、160%、170%、180%、190%、200%、300%、400%、500%、600%或更多。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的150%。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的160%。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的170%。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的180%。在一些情况下,ifnγ产生是同种型抗体的ifnγ
产生的190%。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的200%。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的大于200%。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的大于300%。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的大于400%。在一些情况下,ifnγ产生是同种型抗体的ifnγ产生的大于500%。在一些情况下,细胞因子是白细胞介素。在一些情况下,白细胞介素是il
‑
2。
[0243]
在一些情况下,免疫激活包括cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒性t细胞、天然杀伤(nk)细胞或其组合的增殖。在一些情况下,免疫激活包括cd3 t淋巴细胞的增殖。在某些情况下,免疫激活包括cd4 t辅助细胞的增殖。在某些情况下,免疫激活包括cd8 细胞毒性t细胞的增殖。在某些情况下,免疫激活包括nk细胞的增殖。在某些情况下,免疫激活包括t细胞和nk细胞的增殖。
[0244]
在一些情况下,免疫激活包括多种细胞内m1巨噬细胞群的增加。在一些情况下,免疫激活包括多种细胞内m2巨噬细胞群的减少。在一些情况下,免疫激活包括多种细胞内m1巨噬细胞群的增加和多种细胞内m2巨噬细胞群的减少。
[0245]
在一些情况下,抗gal3抗体结合至gal3并且破坏gal3和tim
‑
3之间的相互作用。在一些情况下,gal3和tim
‑
3之间的相互作用的破坏包括部分抑制gal3和tim
‑
3之间的相互作用。在一些情况下,gal3和tim
‑
3之间的相互作用的破坏包括完全抑制gal3和tim
‑
3之间的相互作用。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于99%、小于95%、小于90%、小于85%、小于80%、小于75%、小于70%、小于65%、小于60%、小于59%、小于55%、小于50%、小于45%、小于40%、小于34%、小于30%、小于25%、小于20%、小于14%、小于10%、小于7%、小于5%、小于4%、小于3%、小于2%或小于1%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于70%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于60%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于59%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于50%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于40%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于34%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于30%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于20%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于14%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于10%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于7%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于5%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于4%。在一些情况下,gal3
‑
tim
‑
3相互作用被减少至小于1%。
[0246]
在一些情况下,gal3和tim
‑
3之间的相互作用发生在选自区域145
‑
168、160
‑
177或165
‑
184的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置145
‑
168、160
‑
177或165
‑
184。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域145
‑
168的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置145
‑
168。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域160
‑
177的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置160
‑
177。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域165
‑
184的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置165
‑
184。在一些情况下,gal3和tim
‑
3之间的相互作用发生在选自区域149
‑
156、152
‑
168、163
‑
169或163
‑
171的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置149
‑
156、152
‑
168、163
‑
169或163
‑
171。在一些情况下,gal3和tim
‑
3之间的相互
作用发生在来自区域149
‑
156的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置149
‑
156。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域152
‑
168的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置152
‑
168。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域163
‑
169的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置163
‑
169。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域163
‑
171的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置163
‑
171。
[0247]
在一些情况下,gal3和tim
‑
3之间的相互作用发生在选自区域91
‑
111或82
‑
111的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置91
‑
111或82
‑
111。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域91
‑
111的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置91
‑
111。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域82
‑
111的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置82
‑
111。在一些情况下,gal3和tim
‑
3之间的相互作用发生在选自区域91
‑
111、107
‑
117、96
‑
102、100
‑
106或92
‑
119的tim
‑
3的一个或多个残基处,本文残基位置对应于seq id no:2的位置91
‑
111、107
‑
117、96
‑
102、100
‑
106或92
‑
119。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域91
‑
111的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置91
‑
111。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域107
‑
117的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置107
‑
117。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域96
‑
102的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置96
‑
102。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域100
‑
106的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置100
‑
106。在一些情况下,gal3和tim
‑
3之间的相互作用发生在来自区域92
‑
119的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置92
‑
119。在一些情况下,tim
‑
3是人tim
‑
3。
[0248]
在一些实施方式中,本文公开了促进t细胞或天然杀伤(nk)细胞增殖的方法,包括使多个细胞包括t细胞、nk细胞和gal3
‑
表达细胞与抗gal3抗体接触足够的时间以促进多种细胞中t细胞或nk细胞的增殖。在一些实施方式中,本文公开了促进t细胞和天然杀伤细胞(nk)细胞增殖的方法,包括使包括t细胞、nk细胞和gal3
‑
表达细胞的多种细胞与抗gal3抗体接触足够的时间以促进多种细胞中t细胞和nk细胞的增殖。在一些实施方式中,多种细胞进一步包括tim
‑
3表达细胞。在一些实施方式中,抗gal3抗体结合至gal3并且破坏gal3和tim
‑
3之间的相互作用。在一些实施方式中,抗gal3抗体结合至gal3并且破坏gal3和tim
‑
3之间的相互作用。在一些实施方式中,抗gal3抗体结合至gal3并且破坏gal3和tim
‑
3之间的相互作用大于25%、大于50%、大于100%或大于200%。
[0249]
在一些实施方式中,多种细胞进一步包括肿瘤浸润淋巴细胞(til)。在一些情况下,多种细胞进一步包括cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞或其组合。在一些情况下,多种细胞进一步包括cd3 t淋巴细胞。在一些情况下,多种细胞进一步包括cd4 t辅助细胞。在一些情况下,多种细胞进一步包括cd8 细胞毒素t细胞。在一些情况下,多种细胞进一步包括cd3 t淋巴细胞和cd4 t辅助细胞。在一些情况下,多种细胞进一步包括cd3 t淋巴细胞和cd8 细胞毒素t细胞。在一些情况下,多种细胞进一步包括cd4 t辅助细胞、
cd8 细胞毒素t细胞。在一些情况下,多种细胞进一步包括cd3 t淋巴细胞、cd4 t辅助细胞和cd8 细胞毒素t细胞。
[0250]
在一些实施方式中,接触进一步诱导til增殖。在一些情况下,接触进一步诱导cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞或其组合的增殖。在一些情况下,接触进一步诱导cd3 t淋巴细胞的增殖。在一些情况下,接触进一步诱导cd4 t辅助细胞的增殖。在一些情况下,接触进一步诱导cd8 细胞毒素t细胞的增殖。在一些情况下,接触进一步诱导cd3 t淋巴细胞和cd4 t辅助细胞的增殖。在一些情况下,接触进一步诱导cd3 t淋巴细胞和cd8 细胞毒素t细胞的增殖。在一些情况下,接触进一步诱导cd4 t辅助细胞和cd8 细胞毒素t细胞的增殖。在一些情况下,接触进一步诱导cd3 t淋巴细胞、cd4 t辅助细胞和cd8 细胞毒素t细胞的增殖。
[0251]
在一些实施方式中,接触进一步包括m1巨噬细胞增殖的增加。在一些实施方式中,接触进一步包括tme内m2巨噬细胞群的减少。在一些实施方式中,接触进一步包括tme内m1巨噬细胞增殖的增加和m2巨噬细胞群的减少。
[0252]
在一些实施方式中,抗gal3抗体结合至对应于seq id no:1的残基1
‑
20的gal3区域内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至对应于seq id no:1的残基41
‑
91的gal3区域内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至对应于seq id no:1的残基41
‑
71的gal3区域内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至对应于seq id no:1的残基71
‑
91的gal3区域内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至肽_1、肽_4、肽_5、肽_6、肽_7或肽_8内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至肽_1内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至肽_4内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至肽_5内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至肽_6内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至肽_7内的至少一个氨基酸残基。在一些情况下,抗gal3抗体结合至肽_8内的至少一个氨基酸残基。
[0253]
在一些实施方式中,抗gal3抗体包括小于1nm、小于1.2nm、小于2nm、小于5nm、小于10nm、小于13.5nm、小于15nm、小于20nm、小于25nm或小于30nm的结合亲和力(k
d)
。在一些实施方式中,抗gal3抗体包括小于1nm的k
d
。在一些实施方式中,抗gal3抗体包括小于1.2nm是k
d
。在一些实施方式中,抗gal3抗体包括小于2nm的k
d
。在一些实施方式中,抗gal3抗体包括小于5nm的k
d
。在一些实施方式中,抗gal3抗体包括小于10nm的k
d
。在一些实施方式中,抗gal3抗体包括小于13.5nm的k
d
。在一些实施方式中,抗gal3抗体包括小于15nm的k
d
。在一些实施方式中,抗gal3抗体包括小于20nm的k
d
。在一些实施方式中,抗gal3抗体包括小于25nm的k
d
。在一些实施方式中,抗gal3抗体包括小于30nm的k
d
。
[0254]
在一些实施方式中,抗gal3抗体包括人源化抗体。在其他实施方式中,抗gal3抗体包括嵌合抗体。在一些情况下,抗gal3抗体包括全长抗体或其结合片段。在一些情况下,抗gal3抗体包括双特异性抗体或其结合片段。在一些情况下,抗gal3抗体包括单价fab’、二价fab2、单链可变片段(scfv)、双抗体、微抗体、纳米抗体、单域抗体(sdab)或骆驼化抗体或其结合片段。
[0255]
在一些实施方式中,抗gal3抗体是双特异性抗体或其结合片段。示例性双特异性抗体形式包括但不限于杵
‑
入
‑
臼(knobs
‑
into
‑
holes)(kih)、不对称再工程化技术
‑
免疫球
蛋白(art
‑
ig)、triomab quadroma、双特异性单克隆抗体(bimab、bsmab、bsab、bsmab、bs
‑
mab或bi
‑
mab)、酶标仪、基于t细胞受体的抗体的双特异性衔接(beat)、双特异性t细胞衔接剂(bite)、双克隆、fab
‑
scfv
‑
fc、二合一/双重作用fab(daf)、finomab、scfv
‑
fc
‑
(fab)
‑
融合、对接和锁定(dnl)、adaptir(以前的scorpion)、串联双抗体(tandab)、双亲和性再靶向(dart)、纳米抗体、三体、串联scfv(tafv)、三头、串联dab/vhh、三重dab/vhh或四价dab/vhh。在一些情况下,抗gal3抗体是双特异性抗体或其结合片段,其包括brinkmann和kontermann,“the making of bispecific antibodies,”mabs 9(2):182
‑
212(2017)的图2中阐释的双特异性抗体形式。
[0256]
在一些实施方式中,抗gal3抗体包括选自igm、igg(例如,iggl、igg2、igg3或igg4)、iga或ige的框架区。在一些情况下,抗gal3抗体包括igm框架。在一些情况下,抗gal3抗体包括igg(例如,iggl、igg2、igg3或igg4)框架。在一些情况下,抗gal3抗体包括iggl框架。在一些情况下,抗gal3抗体包括igg2框架。在一些情况下,抗gal3抗体包括igg4框架。在一些实施方式中,抗gal3抗体可进一步包括fc突变。在一些实施方式中,图37中的fc区或κ区的任何一个或多个可以与本文,包括图35a
‑
36b的任何cdr、vh/vl序列配对。
[0257]
在一些实施方式中,抗gal3抗体包括框架区中,例如,ch1结构域、ch2结构域、ch3结构域、铰链区或其组合中的一个或多个突变。在一些情况下,一个或多个突变调节fc受体相互作用,例如,以增加fc效应子功能比如adcc和/或补体依赖性细胞毒性(cdc)。在一些情况下,一个或多个突变稳定抗体和/或增加抗体的半衰期。在另外情况下,一个或多个突变调节糖基化。
[0258]
在一些实施方式中,fc区包括调节fc受体相互作用,例如以增强效应子功能例如adcc和/或cdc的一个或多个突变。这种实施方式中,当突变时调节效应子功能的示例性残基包括s228、s239、k326、a330、i332或e333,其中残基位置对应于iggl并且残基编号是根据kabat编号(kabat等1991sequences of proteins of immunological interest的eu索引)。在一些实施方式中,一个或多个突变包括s228p、s239d、k326w、a330l、i332e、e333a、e333s或其组合。在一些情况下,一个或多个突变包括s228p、s239d、i332e或其组合。在一些情况下,一个或多个突变包括s228p、s239d、a330l、i332e或其组合。在一些情况下,一个或多个突变包括k326w、e333s或其组合。在一些情况下,突变包括e333a。在一些实施方式中,fc区是igg4 fc区。在一些实施方式中,s228p突变在igg4的铰链区中。在一些实施方式中,s228p突变通过阻止fab臂交换来增强igg4的稳定性。
[0259]
在一些实施方式中,抗gal3抗体包括量化为与imgt精选的人种系抗体相比总体序列相似性的人源化抗体的人源化评分。在一些实施方式中,抗gal3抗体包含量化为人源化抗体与imgt策划的(curated)人种系抗体相比的总体序列相似性的人源化评分。在一些实施方式中,抗gal3抗体包括70以上、80以上、81以上、82以上、83以上、84以上、85以上、86以上、87以上、88以上、89以上、90以上或95以上的人源化评分。在一些实施方式中,抗gal3抗体包括80以上的人源化评分。在一些实施方式中,抗gal3抗体包括83以上的人源化评分。在一些实施方式中,抗gal3抗体包括85以上的人源化评分。在一些实施方式中,抗gal3抗体包括87以上的人源化评分。在一些实施方式中,抗gal3抗体包括90以上的人源化评分。在一些情况下,抗gal3抗体包括70以上、80以上、81以上、82以上、83以上、84以上、85以上、86以上、87以上、88以上、89以上、90以上或95以上,任选地80以上、85以上或87以上的重链的人源化
评分。在一些情况下,抗gal3抗体包括70以上、80以上、81以上、82以上、83以上、84以上、85以上、86以上、87以上、88以上、89以上、90以上或95以上,任选地80以上、83以上或85以上的轻链的人源化评分。
[0260]
在一些实施方式中,抗gal3抗体包括如本文提供的互补决定区(cdrs)。在一些实施方式中,cdr是抗体重链(vh)的部分。在一些实施方式中,cdr是轻链(vl)的部分。在一些实施方式中,vh包括vh cdr1、vh cdr2和/或vh cdr3。在一些实施方式中,vh cdr1包括seq id no:37
‑
64的序列之一。在一些实施方式中,vh cdr2包括seq id no:65
‑
92的序列之一。在一些实施方式中,vh cdr3包括seq id no:93
‑
120的序列之一。在一些实施方式中,vl包括vl cdr1、vl cdr2和/或vl cdr3。在一些实施方式中,vl cdr1包括seq id no:121
‑
148的序列之一。在一些实施方式中,vl cdr2包括seq id no:149
‑
176的序列之一。在一些实施方式中,vl cdr3包括seq id no:177
‑
204的序列之一。在一些实施方式中,vh包括seq id no:205
‑
232的序列之一。在一些实施方式中,vl包括seq id no:233
‑
260的序列之一。在一些实施方式中,抗gal3抗体包括higg4恒定区。在一些实施方式中,higg4恒定区包括seq id no:261、263、265或267内的higg4恒定区序列。在一些实施方式中,抗gal3抗体包括hκ恒定区。在一些实施方式中,hκ恒定区包括seq id no:262、264266或268内的hκ恒定区序列。
[0261]
在一些实施方式中,抗gal3包括图35a
‑
b、36a
‑
b或37中描绘的序列。在一些实施方式中,抗gal3抗体选自由以下组成的组:2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8和mimt001(imt001)。在一些实施方式中,抗gal3抗体是2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8或mimt001或其任何组合。在一些实施方式中,抗gal3抗体是mimt001(imt001)。在一些实施方式中,抗gal3抗体不是mimt001(imt001)。在一些实施方式中,抗gal3抗体是4a11.2b5。在一些实施方式中,抗gal3抗体是mimt001和/或4a11.2b5。在一些实施方式中,抗gal3抗体包括来自mimt001和/或4a11.2b5的1、2或3个hcdr。在一些实施方式中,抗gal3抗体包括来自mimt001和/或4a11.2b5的1、2或3个lcdr。在一些实施方式中,抗gal3抗体包括来自mimt001和/或4a11.2b5的1、2或3个hcdr和来自mimt001和/或4a11.2b5的1、2或3个lcdr。在一些实施方式中,抗gal3抗体包括来自mimt001和/或4a11.2b5的1、2或3个hcdr和来自mimt001和/或4a11.2b5的1、2或3个lcdr,可替选地具有其中1、2、3、4、5、6、7或8个氨基酸置换。在一些实施方式中,抗gal3抗体包括来自mimt001和/或4a11.2b5的1、2或3个hcdr和来自mimt001和/或4a11.2b5的1、2或3个lcdr,并且进一步包括mimt001和/或4a11.2b5 vh和vl序列(如图36a和36b内显示的)或与vh和vl序列是至少80、85、90、91、92、93、94、95、96、97、98、99或100%同一性的序列。
[0262]
在一些实施方式中,抗gal3抗体是imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006
‑
8的任何一种。在一些实施方式中,抗gal3抗体是imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8的任何一种。在一些实施方式中,抗gal3抗体包括来自imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8的任何一种的1、2或3个hcdr。在一些实施方式中,抗gal3抗体包括来自imt001
‑
4、
imt006
‑
1、imt006
‑
5和/或imt006
‑
8的任何一种的1、2或3个lcdr。在一些实施方式中,抗gal3抗体包括来自imt001
‑
4,imt006
‑
1,imt006
‑
5和/或imt006
‑
8的任何一种的1、2或3个hcdr和来自imt001
‑
4,imt006
‑
1,imt006
‑
5和/或imt006
‑
8的任何一种的1、2或3个lcdr。在一些实施方式中,抗gal3抗体包括来自imt001
‑
4,imt006
‑
1,imt006
‑
5和/或imt006
‑
8的任何一种的1、2或3个hcdr和来自imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8的任何一种的1、2或3个lcdr,可替选地具有其中1、2、3、4、5、6、7或8个氨基酸置换。在一些实施方式中,抗gal3抗体包括来自imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8的任何一种的1、2或3个hcdr和来自imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8的任何一种的1、2或3个lcdr,并且进一步包括imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8 vh和vl序列的任何一种(如图36a和36b内显示的)或与vh和vl序列是至少80、85、90、91、92、93、94、95、96、97、98、99或100%同一性的序列。
[0263]
在一些实施方式中,抗gal3抗体与以下的一种或多种竞争结合:2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8和mimt001(imt001)。
[0264]
在一些实施方式中,抗gal3抗体至少包括图35a
‑
36b的抗体的任何一种内的hcdr3。在一些实施方式中,抗gal3抗体其进一步包括图35a
‑
36b的抗体的任何一种内的所有3个hcdr。在一些实施方式中,抗gal3抗体进一步包括图35a
‑
36b的抗体的任何一种内的所有3个lcdr。
[0265]
在一些实施方式中,抗gal3抗体包括图36a内重链序列的任何一种,或与其是至少80%同一性的序列,比如85、90、91、92、93、94、95、96、97、98、99或100%同一性的序列。
[0266]
在一些实施方式中,抗gal3抗体包括图36b内轻链序列的任何一种,或与其是至少80%同一性的序列,比如85、90、91、92、93、94、95、96、97、98、99或100%同一性的序列。在一些实施方式中,抗gal3抗体进一步包括图36a内重链序列的任何一种,或与其是至少80%同一性的序列,比如85、90、91、92、93、94、95、96、97、98、99或100%同一性的序列。
[0267]
在一些实施方式中,抗gal3抗体包括6个cdr,其中在它们的组合序列中,6个cdr与图35a和35b内任何6个cdr组是至少80%同一性的,比如85、90、91、92、93、94、95、96、97、98、99或100%同一性的。
[0268]
在一些实施方式中,抗gal3抗体包括至少一个来自图38的cdr(具有1、2或3个氨基酸保守置换)。抗gal3抗体包括至少两个来自图38的cdr(具有1、2或3个氨基酸保守置换)。抗gal3抗体包括至少三个来自图38的cdr(具有1、2或3个氨基酸保守置换)(具有1、2或3个氨基酸保守置换)。抗gal3抗体包括至少四个来自图38的cdr(具有1、2或3个氨基酸保守置换)。抗gal3抗体包括至少五个来自图38的cdr(具有1、2或3个氨基酸保守置换)。抗gal3抗体包括六个来自图38的cdr(具有1、2或3个氨基酸保守置换)。在一些实施方式中,抗gal3抗体包括六个来自图38的cdr,并且其中所述六个来自单个bin。在一些实施方式中,抗gal3抗体包括六个来自图38的cdr,或在它们的整个序列中,一组与其至少80%同一性的6个cdr。
[0269]
在一些实施方式中,是诱导免疫激活的方法,其包括以下、基本上由以下组成或由以下组成:在破坏gal3和tim
‑
3之间的相互作用的条件下,使包括gal3
‑
表达细胞和tim
‑
3表
达细胞的多种细胞与抗体接触,其中抗体特异性结合至gal3,其中gal3
‑
表达细胞在结合至抗体时表达诱导免疫激活的细胞因子。在一些实施方式中,细胞因子是干扰素或白细胞介素。在一些实施方式中,细胞因子是ifnγ或il
‑
2。在一些实施方式中,免疫激活包括cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞、天然杀伤细胞或其组合的增殖。在一些实施方式中是促进t细胞或nk细胞增殖的方法,其包括以下、基本上由以下组成或由以下组成:在实现多种细胞中t细胞和/或nk细胞增殖的条件下,使包括t细胞、nk细胞和gal3
‑
表达细胞的多种细胞与抗体接触,其中抗体特异性结合至gal3。在一些实施方式中,是诱导免疫激活的方法,其包括以下、基本上由以下组成或由以下组成:在破坏gal3和tim
‑
3之间的相互作用的条件下,使包括gal3
‑
表达细胞和tim
‑
3表达细胞的多种细胞与抗体接触,其中抗体特异性结合至gal3,并且其中gal3
‑
tim
‑
3相互作用被减少至小于70%、小于60%、小于59%、小于50%、小于40%、小于34%、小于30%、小于20%、小于14%、小于10%、小于7%、小于5%、小于4%或小于1%。在一些实施方式中,是减少组织中纤维化或其倾向的方法,其包括以下、基本上由以下组成或由以下组成:在使得组织中纤维化生物标志物的表达水平降低的条件下,使组织与特异性结合抗gal3抗体的抗体接触。在一些实施方式中,是抗gal3抗体用于治疗受试者的免疫有关疾病,其中抗gal3抗体诱导免疫系统的激活。在一些实施方式或任何前述实施方式中,抗gal3抗体选自由以下组成的组:2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8和mimt001(imt001)。在一些实施方式中,抗gal3抗体是2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8或mimt001或其任何组合。在一些实施方式或任何前述实施方式中,抗gal3抗体是mimt001(imt001)。在一些实施方式或任何前述实施方式中,抗gal3抗体不是mimt001(imt001)。在一些实施方式或任何前述实施方式中,抗gal3抗体是4a11.2b5、imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8。在一些实施方式或任何前述实施方式中,抗gal3抗体是mimt001、4a11.2b5、imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8。在一些实施方式或任何前述实施方式中,抗gal3抗体是imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006
‑
8的一种或多种。
[0270]
在一些实施方式或任何前述实施方式中,抗gal3抗体不是mimt001(imt001)。在一些实施方式或任何前述实施方式中,抗gal3抗体是imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8。
[0271]
关于各种抗体的性质,注意imt001
‑
4、imt006
‑
1和imt006
‑
5是人源化抗体。mimt001是来自衍生自imt001的鼠抗体。4a11.2b5是来自衍生自imt006
‑
1和imt006
‑
5的原始鼠抗体。mimt001、2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10都是鼠抗体。imt001
‑
4、imt006
‑
1、imt006
‑
5和imt006
‑
8都是人源化抗体。
[0272]
治疗方法
[0273]
在一些实施方式中,本文公开了诱导免疫激活的方法,包括以下、基本上由以下组成或由以下组成:在破坏gal3和tim
‑
3之间相互作用的条件下,使包括gal3
‑
表达细胞和tim
‑
3表达细胞、基本上由gal3
‑
表达细胞和tim
‑
3表达细胞组成或由gal3
‑
表达细胞和tim
‑
3表达细胞的多种细胞与抗体接触。在一些实施方式中,抗体是抗gal3抗体。
[0274]
在一些实施方式中,本文公开了减少纤维化的方法,其包括使包括gal3
‑
表达细胞和至少一种纤维化生物标志物的组织与抗gal3抗体接触足够时间以减少组织中至少一种纤维化生物标志物的表达。在一些情况下,抗gal3抗体导致组织中一种或多种细胞外基质蛋白,包括但不限于胶原蛋白的积累减少。
[0275]
在一些实施方式中,抗gal3抗体不是imt001。在一些实施方式中,抗体是imt001。在一些实施方式中,抗gal3抗体是4a11.2b5。在一些实施方式中,抗gal3抗体是imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006
‑
8。
[0276]
在一些实施方式中,抗gal3抗体抑制或破坏gal3和tim
‑
3的相互作用。在一些实施方式中,gal3
‑
tim
‑
3相互作用被减少至99%、95%、90%、80%、78%、70%、66%、60%、56%、52%、50%、40%、30%、29%、27%、20%、19%、17%、10%、5%、4%、3%、2%、1%、0%、约99%、约95%、约90%、约80%、约78%、约70%、约66%、约60%、约56%、约52%、约50%、约40%、约30%、约29%、约27%、约20%、约19%、约17%、约10%、约5%、约4%、约3%、约2%、约1%、约0%、小于99%、小于95%、小于90%、小于80%、小于78%、小于70%、小于66%、小于60%、小于56%、小于52%、小于50%、小于40%、小于30%、小于29%、小于27%、小于20%、小于19%、小于17%、小于10%、小于5%、小于4%、小于3%、小于2%或小于1%。
[0277]
在一些实施方式中,抗gal3抗体不抑制或破坏gal3和tim
‑
3之间的相互作用。
[0278]
在一些实施方式中,相互作用发生在选自区域145
‑
168、160
‑
177或165
‑
184的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置145
‑
168、160
‑
177或165
‑
184。在一些实施方式中,相互作用发生在选自区域149
‑
156、152
‑
168、163
‑
169或163
‑
171的gal3的一个或多个残基处,其中残基位置对应于seq id no:1的位置149
‑
156、152
‑
168、163
‑
169或163
‑
171。在一些实施方式中,相互作用发生在选自区域90
‑
122或82
‑
111的tim
‑
3的一个或多个残基处,其中残基位置对应于seq id no:2的位置90
‑
122或82
‑
111。在一些实施方式中,相互作用发生在选自区域91
‑
111、107
‑
117、96
‑
102、100
‑
106或92
‑
119的tim
‑
3的一个或多个残基处,本文中残基位置对应于seq id no:2的位置91
‑
111、107
‑
117、96
‑
102、100
‑
106或92
‑
119。
[0279]
在一些实施方式中,在结合至抗体后gal3
‑
表达细胞表达诱导免疫激活的细胞因子。如本文使用的,术语“细胞因子”指参与细胞信号传导的小蛋白质、多肽或肽。细胞因子包括但不限于趋化因子、干扰素、白细胞介素、淋巴因子、肿瘤坏死因子、ccl1、ccl2、ccl3、ccl4、ccl5、ccl6、ccl7、ccl8、ccl9、ccl11、ccl12、ccl13、ccl14、ccl15、ccl16、ccl17、ccl18、ccl19、ccl20、ccl21、ccl22、ccl23、ccl24、ccl25、ccl26、ccl27、ccl28、cxcl1、cxcl2、cxcl3、cxcl4、cxcl5、cxcl6、cxcl7、cxcl8、cxcl9、cxcl10、cxcl11、cxcl12、cxcl13、cxcl14、cxcl15、cxcl16、cxcl17、cx3cl1、xcl1、xcl2、infα、infβ、infγ、il
‑
1、il
‑
2、il
‑
3、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
8、il
‑
9、il
‑
10、il
‑
11、il
‑
12、il
‑
13、il
‑
14、il
‑
15、il
‑
16、il
‑
17、il
‑
18、il
‑
19、il
‑
20、il
‑
21、il
‑
22、il
‑
23、il
‑
24、il
‑
25、il
‑
26、il
‑
27、il
‑
28、il
‑
29、il
‑
30、il
‑
31、il
‑
32、il
‑
33、il
‑
34、il
‑
35、il
‑
36、il
‑
37、il
‑
38、gm
‑
csf、tnfα、tnfβ、tnfγ、tnfsf4、tnfsf5、tnfsf6、tnfsf7、tnfsf8、tnfsf9、tnfsf10、tnfsf11、tnfsf12、tnfsf13、tnfsf13b、tnfsf14、tnfsf15、tnfsf18或tnfsf19,或其任何组合。
[0280]
在一些实施方式中,细胞因子是干扰素。在一些实施方式中,干扰素是ifnγ。在一些实施方式中,抗体导致的ifnγ产生是来自同种型抗体的ifnγ产生的100%、150%、160%、170%、180%、190%、200%、300%、400%、500%、600%、700%、800%、900%、1000%或更多。在一些实施方式中,细胞因子是白细胞介素。在一些实施方式中,白细胞介素是il
‑
2。
[0281]
在一些实施方式中,免疫系统的免疫激活或激活包括以下、基本上由以下组成或由以下组成:cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞、tfh细胞、th3细胞、th17细胞、天然杀伤t(nkt)细胞或天然杀伤(nk)细胞或其组合的增殖。在一些实施方式中,免疫系统的免疫激活或激活包括以下、基本上由以下组成或由以下组成:促进t细胞或nk细胞增殖。在一些实施方式中,免疫系统的免疫激活或激活包括以下、基本上由以下组成或由以下组成:多种细胞内m1巨噬细胞、嗜中性粒细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞或树突细胞群体的增加。在一些实施方式中,免疫系统的免疫激活或激活包括以下、基本上由以下组成或由以下组成:多种细胞内m2巨噬细胞群体的减少。
[0282]
在一些实施方式中,tim
‑
3是人tim
‑
3。
[0283]
在一些实施方式中,多种细胞包括以下、基本上由以下组成或由以下组成:肿瘤细胞。在一些实施方式中,多种细胞位于肿瘤微环境(tme)内并且包括以下、基本上由以下组成或由以下组成:肿瘤细胞和免疫细胞。在一些实施方式中,tme包括肿瘤细胞、免疫细胞、癌相关成纤维细胞、源自髓性的抑制因子细胞、嗜中性粒细胞、肿瘤浸润淋巴细胞(til)或其任何组合。在一些实施方式中,多种细胞包括以下、基本上由以下组成或由以下组成:cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞、tfh细胞、th3细胞、th17细胞、天然杀伤t(nkt)细胞、天然杀伤(nk)细胞、m1巨噬细胞、嗜中性粒细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞或树突细胞。在一些实施方式中,抗tim
‑
3抗体诱导tme内肿瘤细胞的减少。
[0284]
在一些实施方式中,抗体结合至对应于seq id no:1的残基1
‑
20的gal3区域内的至少一个氨基酸残基。在一些实施方式中,抗体结合至对应于seq id no:1的残基41
‑
91的gal3区域内的至少一个氨基酸残基。在一些实施方式中,抗体结合至对应于seq id no:1的残基41
‑
71的gal3区域内的至少一个氨基酸残基。在一些实施方式中,抗体结合至对应于seq id no:1的残基71
‑
91的gal3区域内的至少一个氨基酸残基。
[0285]
在一些实施方式中,抗体结合至肽_1、肽_2、肽_3、肽_4、肽_5、肽_6、肽_7、肽_8、肽_9、肽_10、肽_11、肽_12、肽_13、肽_14、肽_15、肽_16、肽_17、肽_18、肽_19、肽_20、肽_21、肽_22、肽_23或肽_24或其任何组合内的至少一个氨基酸残基。
[0286]
在一些实施方式中,抗体包括1fm、10fm、100fm、1pm、10pm、100pm、1nm、1.2nm、2nm、5nm、10nm、13.5nm、15nm、20nm、25nm、30nm、100nm、200nm、300nm、400nm、500nm、1μm、10μm、100μm、约1fm、约10fm、约100fm、约1pm、约10pm、约100pm、约1nm、约1.2nm、约2nm、约5nm、约10nm、约13.5nm、约15nm、约20nm、约25nm、约30nm、约100nm、约200nm、约300nm、约400nm、约500nm、约1μm、约10μm、约100μm、小于1fm、小于10fm、小于100fm、小于1pm、小于10pm、小于
100pm、小于1nm、小于1.2nm、小于2nm、小于5nm、小于10nm、小于13.5nm、小于15nm、小于20nm、小于25nm、小于30nm、小于100nm、小于200nm、小于300nm、小于400nm、小于500nm、小于1μm、小于10μm、或小于100μm的k
d
。
[0287]
在一些实施方式中,抗体包括人源化抗体。在一些实施方式中,抗体包括全长抗体或其结合片段。在一些实施方式中,抗体包括双特异性抗体或其结合片段。在一些实施方式中,抗体包括单价fab’、二价fab2、单链可变片段(scfv)、双抗体、微抗体、纳米抗体、单结构域抗体(sdab)或骆驼化抗体或其结合片段。在一些实施方式中,抗体包括igg框架。在一些实施方式中,抗体包括igg1、igg2或igg4框架。在一些实施方式中,抗体进一步包括fc突变。在一些实施方式中,抗体包括嵌合抗体。
[0288]
在一些实施方式中,抗gal3抗体选自由以下组成的组:2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8和mimt001(imt001)。在一些实施方式中,抗gal3抗体是mimt001(imt001)。在一些实施方式中,抗gal3抗体不是mimt001(imt001)。在一些实施方式中,抗gal3抗体是4a11.2b5。在一些实施方式中,抗gal3抗体是mimt001和/或4a11.2b5。在一些实施方式中,抗体与一种或多种这些抗体(包括imt001
‑
4、imt006
‑
1、imt006
‑
5和/或imt006
‑
8的任何一种)竞争结合至gal3。在一些实施方式中,抗体是以下的一种或多种:imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006
‑
8。在一些实施方式中,用于方法的抗体包括来自以下一种或多种的一个或多个cdr:imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006
‑
8。在一些实施方式中,用于方法的抗体包括来自以下的一种或多种的一个或多个vh、vl或vh和vl:imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006
‑
8。
[0289]
在一些实施方式中,方法进一步包括在接触步骤之前向受试者施用抗gal3抗体。
[0290]
在一些实施方式中,受试者被诊断具有癌症。
[0291]
在一些实施方式中,癌症是实体瘤。在一些实施方式中,癌症是乳腺癌、结肠直肠癌、肾癌、肝癌、肺癌、前列腺癌、黑素瘤、膀胱癌、子宫癌、胰腺癌、甲状腺癌、脑癌、骨癌、肉瘤或胃癌。在一些实施方式中,肺癌是非小细胞肺癌(nsclc)、肺腺癌、鳞状细胞癌、大细胞癌或小细胞肺癌(sclc)。
[0292]
在一些实施方式中,癌症是血液系统恶性肿瘤,包括但不限于白血病、非霍奇金淋巴瘤、霍奇金淋巴瘤、多发性骨髓瘤、急性淋巴细胞白血病、急性骨髓性白血病、慢性淋巴细胞白血病、慢性骨髓性白血病、急性单核细胞白血病或其任何组合。
[0293]
在一些实施方式中,癌症是转移性癌症。在一些实施方式中,癌症是复发癌症或难治癌症。癌症或肿瘤的分期用于确定患者内癌症或肿瘤的扩散进展。实体瘤分类的公认标准是tnm分类标准,其基于肿瘤的大小(t)、扩散至淋巴结的程度(n)和转移(m)来区分肿瘤。这些分类进一步分为期,其中0期生长是非恶性瘤,局部含有i期和ii期肿瘤,iii期肿瘤已扩散至附近的淋巴结,并且iv期肿瘤已转移。虽然tnm标准是广泛使用的分类方法,但也可以采用可代表特定癌症类型行为的可替选的或改进的标准。相应地,虽然这些标准可用于确定进展,但癌症或肿瘤的早期或晚期的预后独立于特定分类。
[0294]
在一些实施方式中,本文公开了通过使组织与抗体接触减少受试者的组织中纤维
化或其倾向的方法。在一些实施方式中,抗体特异性结合gal3或是抗gal3抗体。在一些实施方式中,接触诱导组织中待减少的至少一种纤维化生物标志物的表达水平。在一些实施方式中,组织包括至少一种tim
‑
3表达细胞。在一些实施方式中,抗gal3抗体破坏gal3和tim
‑
3的相互作用。在一些实施方式中,抗gal3抗体不破坏gal3和tim
‑
3的相互作用。
[0295]
在一些实施方式中,减少组织中纤维化或其倾向包括防止正常组织中发生纤维化。在一些实施方式中,减少组织中纤维化或其倾向包括减缓或阻止纤维化组织中纤维化的进展。在一些实施方式中,减少组织中纤维化或其倾向包括减少纤维化组织中纤维化程度的量。在一些实施方式中,减少组织中纤维化或其倾向包括消除纤维化组织中的纤维化。
[0296]
在一些实施方式中,本文还描述的是通过监测一种或多种纤维化生物标志物监测组织纤维化的进展的方法。在一些实施方式中,本文公开了用抗gal3抗体治疗组织纤维化的方法,其中抗gal3抗体破坏gal3和tim
‑
3之间的相互作用。
[0297]
在一些实施方式中,至少一种纤维化生物标志物包括以下、基本上由以下组成或由以下组成:α
‑
平滑肌肌动蛋白(α
‑
sma)、纤连蛋白、胶原蛋白、胶原蛋白i、胶原蛋白iii、胶原蛋白iv、弹性蛋白、层粘连蛋白、透明质酸、或蛋白聚糖,或其任何组合。在一些实施方式中,至少一种纤维化生物标志物包括以下、基本上由以下组成或由以下组成:α
‑
平滑肌肌动蛋白(α
‑
sma)。在一些实施方式中,至少一种纤维化生物标志物包括以下、基本上由以下组成或由以下组成:成纤连蛋白。在一些实施方式中,至少一种纤维化生物标志物包括以下、基本上由以下组成或由以下组成:α
‑
平滑肌肌动蛋白(α
‑
sma)和纤连蛋白。
[0298]
在一些实施方式中,组织选自由以下组成的组:肝组织、肾组织、皮肤组织、肺组织、心脏组织、脑组织、结直肠组织、肠组织、骨髓组织、乳腺组织、前列腺组织、膀胱组织、子宫组织、胰腺组织、甲状腺组织、肌肉组织、胃组织和软组织。在一些实施方式中,组织是肾组织或肝组织。
[0299]
在一些实施方式中,用抗gal3抗体治疗的组织中至少一种纤维化生物标志物的表达小于用migg2b抗体治疗的对照组织中至少一种纤维化生物标志物的表达。
[0300]
在一些实施方式中,抗gal3抗体导致组织中细胞外基质(ecm)蛋白质的累积减少。在一些实施方式中,细胞外基质包括以下、基本上由以下组成或由以下组成:集聚蛋白、巢蛋白、钙粘着蛋白、网格蛋白、胶原蛋白、防御素、弹性蛋白、巢蛋白(entactin)、原纤蛋白、纤连蛋白、角蛋白、层粘连蛋白、微管
‑
肌动蛋白交联因子1、sparc样蛋白、nesprin(nesprin
‑
1、nesprin
‑
2、nesprin
‑
3)、纤维鞘相互作用蛋白、肌间蛋白、伴肌动蛋白、血小板亲和蛋白、整联蛋白、踝蛋白、输出蛋白、转运蛋白、腱生蛋白、口角炎蛋白、分拣蛋白有关的受体、张力蛋白或肌联蛋白,或其任何组合。在一些实施方式中,细胞外基质蛋白包括以下、基本上由以下组成或由以下组成:胶原蛋白。在一些实施方式中,组织包括以下、基本上由以下组成或由以下组成:产生胶原蛋白的细胞。在一些实施方式中,产生胶原的细胞是成纤维细胞。在一些实施方式中,成纤维细胞由纤维发生细胞因子激活。在一些实施方式中,纤维发生细胞因子是tgf
‑
β、tgf
‑
β1、il
‑
1β、tnf
‑
α或gm
‑
csf。在一些实施方式中,组织具有升高的纤维发生细胞因子表达。
[0301]
在一些实施方式中,抗体结合至对应于seq id no:1的残基1
‑
20的gal3区域内的至少一个氨基酸残基。在一些实施方式中,抗体结合至对应于seq id no:1的残基41
‑
91的gal3区域内的至少一个氨基酸残基。在一些实施方式中,抗体结合至对应于seq id no:1的
残基41
‑
71的gal3区域内的至少一个氨基酸残基。在一些实施方式中,抗体结合至对应于seq id no:1的残基71
‑
91的gal3区域内的至少一个氨基酸残基。
[0302]
在一些实施方式中,受试者被诊断具有纤维化疾病或纤维化。在一些实施方式中,受试者被诊断具有纤维化疾病。在一些实施方式中,纤维化疾病是肾纤维化。在一些实施方式中,纤维化疾病是肝纤维化。在一些实施方式中,抗体被配制用于全身施用。在一些实施方式中,抗体被配制用于肠胃外施用。在一些实施方式中,受试者是哺乳动物。
[0303]
在一些实施方式中,纤维化疾病或纤维化是肝纤维化、桥接纤维化、肝硬化、肾脏(肾)纤维化、肺纤维化、特发性肺纤维化、囊性纤维化、心血管纤维化、动脉纤维化、静脉血栓形成、关节纤维化、克罗恩氏病、杜普伊特伦氏挛缩、瘢痕疙瘩、纵隔纤维化、骨髓纤维化、佩罗尼氏病、肾原性系统性纤维化、进行性大量纤维化、腹膜后腔纤维化或系统性硬化。在一些实施方式中,纤维化疾病是肾(肾)纤维化。在一些实施方式中,纤维化疾病是肝纤维化。
[0304]
在一些实施方式中,方法涉及结合至gal3,但是破坏gal3和tim
‑
3之间的相互作用的抗体。这可能是gal3和tim
‑
3之间相互作用区的直接梗阻,也可能是间接改变,比如导致gal3的构象变化的结合,使其不再与tim
‑
3结合或与tim
‑
3一起是活性的。其也可以通过结合至gal3的第一部分产生,其中抗体的一些其他部分阻碍或改变了gal3与tim
‑
3的相互作用。
[0305]
在一些实施方式中,公开了制造药物或组合物中抗gal3抗体的使用。在一些实施方式中,药物或组合物用于治疗免疫有关的疾病。在一些实施方式中,药物或组合物用于治疗癌症。在一些实施方式中,药物或组合物用于治疗纤维化疾病或纤维化。
[0306]
在一些实施方式中,是抗gal3抗体用于治疗受试者的疾病。在一些实施方式中,抗gal3抗体抑制gal3和tim
‑
3之间的相互作用。在一些实施方式中,抗gal3抗体不抑制gal3和tim
‑
3之间的相互作用。
[0307]
在一些实施方式中,抗gal3抗体用于治疗疾病,其中疾病是免疫有关的,和其中抗gal3抗体诱导受试者的免疫系统的激活。在一些实施方式中,免疫有关的疾病是自身免疫性疾病。在一些实施方式中,免疫有关的疾病是免疫缺陷。在一些实施方式中,免疫缺陷是免疫衰老、体液免疫缺陷、b细胞缺陷、t细胞缺陷、嗜中性细胞减少症、无脾或补体缺陷。在一些实施方式中,免疫系统的激活包括cd3 t淋巴细胞、cd4 t辅助细胞、cd8 细胞毒素t细胞、tfh细胞、th3细胞、th17细胞、天然杀伤细胞t(nkt)细胞、nk细胞或m1巨噬细胞,或其组合的增殖。在一些实施方式中,免疫系统的激活包括m2巨噬细胞的减少。
[0308]
在一些实施方式中,抗gal3抗体用于治疗疾病,其中疾病是癌症并且抗tim
‑
3抗体用于治疗癌症。
[0309]
在一些实施方式中,抗gal3抗体用于治疗疾病,其中疾病是纤维化疾病或纤维化。在一些实施方式中,抗gal3抗体用于治疗导致组织中细胞外基质蛋白的积累减少的疾病。
[0310]
在一些实施方式中,用于治疗疾病的抗gal3抗体以与另外治疗剂,比如免疫检查点调节剂、化疗剂、靶向治疗剂、激素治疗剂、基于干细胞的治疗剂、外科手术或辐射疗法组合施用。
[0311]
在一些实施方式中,抗体被配制用于全身施用。在一些实施方式中,抗体被配制用于肠胃外、皮下、肌内、皮内或静脉内施用,或其任何组合。
[0312]
在一些实施方式中,抗gal3抗体以与另外治疗剂组合向受试者施用。在一些实施方式中,另外治疗剂包括免疫治疗剂。在一些实施方式中,另外治疗剂包括免疫检查点调节剂。在一些实施方式中,另外治疗剂包括化疗剂、靶向治疗剂、激素治疗剂或基于干细胞的治疗剂。
[0313]
在一些实施方式中,另外治疗剂包括免疫治疗剂。在一些实施方式中,免疫疗法是过继性细胞疗法。示例性过继性细胞疗法包括来自adaptimmune的afp tcr、mage
‑
a10 tcr或ny
‑
eso
‑
tcr;来自unum therapeutics的actr087/利妥昔单抗;来自juno therapeutics的抗bcma car
‑
t细胞疗法、抗cd19“武装的(armored)”car
‑
t细胞疗法、jcar014、jcar018、jcar020、jcar023、jcar024或jtcr016;来自celgene/juno therapeutics的jcar017;来自intrexon的抗cd19 car
‑
t细胞疗法;来自kite pharma的抗cd19 car
‑
t细胞疗法、axicabtagene ciloleucel、kite
‑
718、kite
‑
439或ny
‑
eso
‑
1t
‑
细胞受体疗法;来自sorrento therapeutics的抗cea car
‑
t疗法;来自tnk therapeutics/sorrento therapeutics的抗psma car
‑
t细胞疗法;来自atara biotherapeutics的ata520;来自aurora biopharma的au101和au105;来自cell medica的baltaleucel
‑
t(cmd
‑
003);来自bluebird bio的bb2121;来自bellicum pharmaceuticals的bpx
‑
501、bpx
‑
601或bpx
‑
701;来自kiromic的bsk01;来自immunocore的imcgp100;来自jounce therapeutics的jtx
‑
2011;来自lion biotechnologies的ln
‑
144或ln
‑
145;来自mustang bio的mb
‑
101或mb
‑
102;来自celyad的nkr
‑
2;来自celgene的pnk
‑
007;来自novartis pharmaceuticals的tisagenlecleucel
‑
t或来自tessa therapeutics的tt12。
[0314]
在一些实施方式中,免疫疗法是基于树突细胞的疗法。
[0315]
在一些实施方式中,免疫疗法包括基于细胞因子的疗法,包括例如,白细胞介素(il)比如il
‑
2、il
‑
15或il
‑
21;干扰素(ifn)
‑
α或粒细胞巨噬细胞集落
‑
刺激因子(gm
‑
csf)。
[0316]
在一些实施方式中,免疫疗法包括免疫检控点调节剂。示例性免疫检控点调节剂包括pd
‑
1调节剂比如来自bristol
‑
myers squibb的尼伏鲁单抗(opdivo)、来自merck的培布利珠单抗(keytruda)、来自agenus的agen2034、来自beigene的bgb
‑
a317、来自boehringer
‑
ingelheim pharmaceuticals的bl
‑
754091、来自cbt pharmaceuticals的cbt
‑
501(杰诺单抗(genolimzumab))、来自incyte的incshr1210、来自janssen research&development的jnj
‑
63723283、来自medimmune的medi0680、来自macrogenics的mga 012、来自novartis pharmaceuticals的pdr001、来自pfizer的pf
‑
06801591、来自regeneron pharmaceuticals/sanofi的regn2810(sar439684)或来自tesaro的tsr
‑
042;ctla
‑
4调节剂比如伊匹单抗(yervoy)或来自agenus的agen 1884;pd
‑
l1调节剂比如来自astrazeneca的德瓦鲁单抗(durvalumab)(imfinzi)、来自genentech的阿特珠单抗(atezolizumab)(mpdl3280a)、来自emd serono/pfizer的阿维单抗(avelumab)、来自cytomx therapeutics的cx
‑
072、来自novartis pharmaceuticals的faz053、来自3d medicine/alphamab的kn035、来自eli lilly的ly3300054或来自emd serono的m7824(抗pd
‑
l1/tgfβ捕获);lag3调节剂比如来自bristol
‑
myers squibb的bms
‑
986016、来自novartis pharmaceuticals的imp701、来自novartis pharmaceuticals的lag525或来自regeneron pharmaceuticals的regn3767;ox40调节剂比如来自bristol
‑
myers squibb的bms
‑
986178、来自glaxosmithkline的gsk3174998、来自agenus/incyte的incagn1949、来自medimmune的
medi0562、来自pfizer的pf
‑
04518600或来自genentechp的rg7888;gitr调节剂比如来自novartis pharmaceuticals的gwn323、来自agenus/incyte的incagn1876、来自medimmune的medi1873、来自merck的mk
‑
4166或来自leap therapeutics的trx518;kir调节剂比如来自bristol
‑
myers squibb的利瑞鲁单抗;或tim调节剂比如来自novartis pharmaceuticals的mbg453或来自tesaro的tsr
‑
022。
[0317]
在一些实施方式中,另外治疗剂包括化疗剂。示例性化疗剂包括但不限于烷化剂比如环磷酰胺、二氯甲基二乙胺、苯丁酸氮芥、左旋溶肉瘤素、达卡巴嗪或亚硝基脲;蒽环类比如柔红霉素、多柔比星、表柔比星、伊达比星、米托蒽醌或戊柔比星;细胞骨架破坏剂比如紫杉醇、多西他赛、凯素或泰索帝;埃坡霉素;组蛋白脱乙酰酶抑制剂比如伏立诺他或罗米地新;拓扑异构酶i抑制剂比如依立替康或拓扑替康;拓扑异构酶ii抑制剂比如足叶乙甙、替尼泊苷或他氟泊苷;激酶抑制剂比如硼替佐米、厄洛替尼、吉非替尼、伊马替尼、威罗菲尼或维莫德吉;核苷酸类似物和前体类似物比如阿扎胞苷、咪唑硫嘌呤、卡培他滨、阿糖胞苷、脱氧氟尿苷、氟脲嘧啶、吉西他滨、羟基脲、巯基嘌呤、甲氨蝶呤或硫鸟嘌呤;基于铂的试剂比如卡铂、顺铂或奥沙利铂;类视黄醇比如维生素a酸、阿利维a酸或贝沙罗汀;或长春花生物碱和衍生物比如长春花碱、长春新碱、长春地辛或长春瑞滨。
[0318]
在一些实施方式中,另外治疗剂包括基于激素的治疗剂。示例性基于激素的治疗剂包括但不限于芳香酶抑制剂比如来曲唑、阿那曲唑、依西美坦或氨鲁米特;促性腺素
‑
释放激素(gnrh)类似物比如亮丙瑞林或戈舍瑞林;选择性雌激素受体调节剂(serm)比如它莫西芬、雷洛昔芬、托瑞米芬或氟维司群;抗雄激素比如氟他胺或比卡鲁胺;孕激素比如乙酸甲地孕酮或乙酸甲羟孕酮;雄激素比如氟羟甲基睾丸素;雌激素比如雌激素二乙基己烯雌酚(des)、雌二醇制剂或聚雌二醇磷酸;或生长激素抑制素类似物比如奥曲肽。
[0319]
在一些实施方式中,另外治疗剂是一线治疗剂。
[0320]
在一些实施方式中,抗gal3抗体和另外治疗剂同时施用。在一些实施方式中,抗gal3抗体和另外治疗剂依次施用。在一些实施方式中,抗gal3抗体在施用另外治疗剂之前向受试者施用。在一些实施方式中,抗gal3抗体在施用另外治疗剂之后向受试者施用。
[0321]
在一些实施方式中,另外治疗剂和抗gal3抗体被配制为单独的剂量。
[0322]
在一些实施方式中,受试者已经经历外科手术。在一些情况下,抗gal3抗体和任选地另外治疗剂在外科手术之前向受试者施用。在一些实施方式中,抗gal3抗体和任选地另外治疗剂在外科手术之后向受试者施用。
[0323]
在一些实施方式中,受试者已经经历辐射。在一些实施方式中,抗gal3抗体和任选地另外治疗剂在辐射治疗期间或之后向受试者施用。在一些情况下,抗gal3抗体和任选地另外治疗剂在经历辐射之前向受试者施用。
[0324]
在一些实施方式中,受试者是哺乳动物。在一些实施方式中,受试者是人。
[0325]
在一些实施方式中,本文公开了通过使组织与特异性结合至gal3的抗体接触减少组织中纤维化或其倾向的方法。在一些实施方式中,本文还描述了在减少组织中一种或多种纤维化生物标志物的表达的条件下通过特异性结合至gal3的抗体破坏gal3
‑
tim
‑
3相互作用的方法。
[0326]
在某些实施方式中,本文公开了减少组织中纤维化或其倾向的方法,包括:在使得组织中降低纤维化生物标志物的表达水平的条件下,使组织与特异性结合至gal3抗体的抗
体接触抗体。在一些实施方式中,组织进一步包括tim
‑
3表达细胞。在一些实施方式中,抗体进一步破坏gal3和tim
‑
3的相互作用。在一些实施方式中,抗体不破坏gal3和tim
‑
3的相互作用。在一些实施方式中,至少一种纤维化生物标志物包括α
‑
平滑肌肌动蛋白(α
‑
sma)。在一些实施方式中,至少一种纤维化生物标志物包括纤连蛋白。在一些实施方式中,至少一种纤维化生物标志物包括α
‑
平滑肌肌动蛋白(α
‑
sma)和纤连蛋白。在一些实施方式中,组织是肾组织或肝组织。在一些实施方式中,组织选自由以下组成的组:肝组织、肾组织、皮肤组织、肺组织、心脏组织、脑组织、肠组织、骨髓组织和软组织。在一些实施方式中,用抗体治疗的组织中至少一种纤维化生物标志物的表达小于用migg2b抗体治疗的对照组织中至少一种纤维化生物标志物的表达。在一些实施方式中,抗体导致组织中细胞外基质蛋白的积累降低。在一些实施方式中,细胞外基质蛋白包括胶原。在一些实施方式中,组织包括产生胶原的细胞。在一些实施方式中,产生胶原的细胞是成纤维细胞。在一些实施方式中,成纤维细胞由纤维发生细胞因子激活。在一些实施方式中,纤维发生细胞因子是tgf
‑
β1。在一些实施方式中,组织具有升高的tgf
‑
β1表达。
[0327]
抗体产生
[0328]
在一些实施方式中,抗gal3抗体通过标准方案通过用抗原组合物注射生产动物来产生。参见,例如,harlow和lane,antibodies:a laboratory manual,cold spring harbor laboratory,1988。当利用整个蛋白质或蛋白质的较大部分时,抗体可以通过用蛋白质和合适的佐剂(例如,弗氏、弗氏完全、水包油乳液等)免疫生产动物来产生。当利用较小的肽时,将肽与较大的分子缀合以制备免疫刺激缀合物是有利的。商业上可获得的用于这种用途的常用缀合蛋白包括牛血清白蛋白(bsa)和匙孔血蓝蛋白(klh)。为了产生针对特定表位的抗体,可以利用源自完整序列的肽。可替选地,为了产生针对蛋白质靶的相对短的肽部分的抗体,如果将多肽连接至载体蛋白,比如卵白蛋白、bsa或klh,则可以引起优异的免疫应答。
[0329]
多克隆或单克隆抗gal3抗体可以从已经基因改变以产生人免疫球蛋白的动物产生。转基因动物可以通过最初产生不产生动物的天然抗体的“敲除”动物,并且用人抗体基因座稳定转化动物(例如,通过使用人的人工染色体)来产生。在这种情况下,然后通过动物仅制造人抗体。用于产生这种动物并且从其中衍生抗体的技术在美国专利号6,162,963和6,150,584中描述,通过引用完全并入本文。这种抗体可称为人异种抗体。
[0330]
可替选地,抗gal3抗体可以从含有人可变区的噬菌体文库产生。参见美国专利号6,174,708,通过引用完全并入本文。
[0331]
在本文公开的一些实施方式的一些方面中,抗gal3抗体由杂交瘤产生。
[0332]
对于单克隆抗gal3抗体,可以通过分离刺激的免疫细胞,比如来自接种动物的脾的那些来形成杂交瘤。然后这些细胞可融合至永生细胞,比如骨髓瘤细胞或转化细胞,其能够在细胞培养物中无限地复制,从而产生永生化的分泌免疫球蛋白的细胞系。利用的永生细胞系可被选择为缺乏利用某些营养素所必需的酶。许多这种细胞系(比如骨髓瘤)是本领域技术人员已知的,并且包括,例如:胸苷激酶(tk)或次黄嘌呤
‑
鸟嘌呤磷酸基转移酶(hgprt)。这些缺陷允许根据它们在例如次黄嘌呤氨基蝶呤胸苷培养基(hat)上的生长能力来选择融合细胞。
[0333]
另外,抗gal3抗体可以通过基因工程化产生。
[0334]
本文公开的抗gal3抗体可具有降低的诱导人中非期望的免疫应答的倾向,例如,
过敏性休克,并且还可展示出引发将防止用抗体治疗剂或显像剂重复剂量的免疫应答(例如,人
‑
抗
‑
鼠
‑
抗体“hama”应答)的降低的倾向。这种抗gal3抗体包括但不限于人源化、嵌合或异种人抗gal3抗体。
[0335]
嵌合抗gal3抗体可以,例如,通过将从鼠(或其他动物来源的)杂交瘤克隆获得的鼠可变轻链和重链区(vk和vh)与人恒定轻链和重链区组合以便产生主要地具有人结构域的抗体的重组方式制备。这种嵌合抗体的产生是本领域熟知的,并且可以通过标准方式实现(如,例如在美国专利号5,624,659中描述的,通过引用完全并入本文)。
[0336]
适用于非人(例如啮齿动物或灵长类动物)抗体的术语“人源化”是杂合免疫球蛋白、免疫球蛋白链或其片段,其含有源自非人免疫球蛋白的最少序列。在大多数情况下,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体的互补决定区(cdr)的残基被来自具有所需特异性、亲和力和能力的非人类物种(供体抗体)比如小鼠、大鼠、兔子或灵长类动物的cdr的残基取代。在一些实施方式中,人免疫球蛋白的fv框架区(fr)残基被相应的非人残基取代。此外,人源化抗体可包括既不在受体抗体中也不在输入的cdr或框架序列中发现的残基。进行这些修饰进一步改进和优化抗体性能并且最小化当引入人体时的免疫原性。在一些示例中,人源化抗体将包括基本上所有的至少一个,并且通常两个可变区,其中所有或基本上所有的cdr区对应于非人免疫球蛋白的那些并且所有或基本上所有的fr区是人免疫球蛋白序列的那些。人源化抗体还可包括免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白的那些。
[0337]
可以工程化人源化抗体以含有人样免疫球蛋白结构域,并且仅并入动物源性抗体的互补决定区。这可以通过仔细检查单克隆抗原结合单位或单克隆抗体的可变区的高变环的序列,并且将它们与人抗原结合单位或人抗体链的结构相匹配来完成。参见,例如,美国专利号6,187,287,通过引用完全并入本文。
[0338]
用于人源化非人抗体的方法是本领域熟知的。“人源化”抗体是其中至少部分序列已经从其初始形式改变以使其更像人免疫球蛋白的抗体。在一些版本中,重(h)链和轻(l)链恒定(c)区用人序列取代。这可以是包括可变(v)区和异源免疫球蛋白c区的融合多肽。在一些版本中,互补决定区(cdr)包括非人抗体序列,而v框架区也已转化为人序列。参见,例如,ep 0329400。在一些版本中,v区通过设计人和小鼠v区的共有序列并且转换共有序列之间不同的cdr之外的残基来人源化。
[0339]
原则上,来自人源化抗体的框架序列可用作cdr移植的模板;然而,已经表明直接将cdr取代入这种框架中会导致对抗原的结合亲和力的显著丧失。glaser等(1992)j.immunol.149:2606;tempest等(1992)biotechnology 9:266和shalaby等(1992)j.exp.med.17:217。人抗体(huab)与原始鼠抗体(muab)的同源性越高,人框架将更不可能将可降低亲和力的畸变(distortions)引入鼠cdr。基于针对抗体序列数据库的序列同源性搜索,huab ic4为mum4ts.22提供了良好的框架同源性,尽管其他高度同源的huab也将适用,尤其是来自人亚组i的κl链或来自人亚组iii的h链。kabat等(1987)。各种计算机程序比如encad(levitt等(1983)j.mol.biol.168:595)可以用来预测v区的理想序列。本发明因此涵盖具有不同可变(v)区的huab。确定合适的v区序列并且优化这些序列在本领域技术人员的技能内。获得具有降低的免疫原性的抗体的方法也在美国专利号5,270,202和ep 699,755中描述。
[0340]
人源化抗体可以通过使用亲本和人源化序列的三维模型分析亲本序列和各种概念性人源化产物的过程来制备。三维免疫球蛋白模型是本领域技术人员熟悉的。可获得的计算机程序来阐释和显示选定的候选免疫球蛋白序列的可能的三维构象结构。检查这些显示允许分析残基在候选免疫球蛋白序列的功能中的可能作用,即,分析残基影响候选免疫球蛋白结合其抗原的能力。这样,可以从共有序列和输入序列中选择和组合fr残基,从而实现期望的抗体特征,比如对靶抗原的亲和力增加。
[0341]
用于人源化受试者抗原结合单元的过程可以如下。基于用于移植的人抗体种系的同源性、规范结构和物理性质选择最适合的种系受体重链和轻链可变区。进行mvh/vl与移植hvh/vl的计算机建模,并且生成原型人源化抗体序列。如果建模指示需要框架回复突变,则生成具有指示的fw改变的第二变体。合成编码选定种系框架和鼠cdr的dna片段。合成的dna片段被亚克隆至igg表达载体中,并且通过dna测序确认序列。人源化抗体在细胞,比如293f中表达,并且测试蛋白质,例如在mdm吞噬测定和抗原结合测定中。将人源化抗原结合单位与亲本抗原结合单位的抗原结合亲和力比较,例如,通过对表达靶抗原的细胞进行facs。如果亲和力比亲本抗原结合单位低2倍以上,则可以如上所述生成和测试第二轮人源化变体。
[0342]
如上所述,抗gal3抗体可以是“单价”或“多价”。前者每个抗原结合单位具有一个结合位点,而后者含有能够结合不止一种相同或不同种类的抗原的多个结合位点。取决于结合位点的数量,抗原结合单元可以是二价的(具有两个抗原结合位点)、三价的(具有三个抗原结合位点)、四价的(具有四个抗原结合位点)等。
[0343]
多价抗gal3抗体可基于它们结合特异性进一步分类。“单特异性”抗gal3抗体是能够结合至相同种类的一种或多种抗原的分子。“多特异性”抗gal3抗体是对至少两种不同抗原具有结合特异性的分子。虽然这种分子通常仅将结合两种不同的抗原(即双特异性抗
‑
gal3抗体),但在本文中使用时,具有另外特异性的抗体比如三特异性抗体也被该表达涵盖。本公开进一步提供了多特异性抗gal3抗体。多特异性抗gal3抗体是能够结合至少两种不同抗原的多价分子,例如,分别展示出对两种和三种不同抗原的结合特异性的双特异性和三特异性分子。
[0344]
单克隆抗体可以通过以下获得:用包括抗原,例如gal3或其表位的组合物注入小鼠,去除脾以获得b
‑
淋巴细胞,将b
‑
淋巴细胞与骨髓瘤细胞融合以产生杂交瘤,克隆杂交瘤,选择产生对抗原的抗体的阳性克隆,培养产生对抗原的抗体的克隆并且从杂交瘤培养物分离抗体。
[0345]
产生的单克隆抗体可以通过各种成熟的技术从杂交瘤培养物中分离和纯化。这种分离技术包括具有蛋白质
‑
a琼脂糖的亲和性层析、尺寸排阻层析和离子交换层析。参见,例如,coligan,在第2.7.1
‑
2.7.12页和第2.9.1
‑
2.9.3页。还参见baines等,“purification of immunoglobulin g(igg)”,在methods in molecular biology,第10卷,第79
‑
104页(the humana press,inc.1992)。在最初产生针对靶蛋白的抗体后,可以测序抗体并且随后通过重组技术制备。鼠抗体和抗体片段的人源化和嵌合化是本领域技术人员熟知的。参见,例如,leung等,hybridoma 13:469(1994);us20140099254a1,其中每篇通过引用以其整体明确地并入本文。
[0346]
人抗体可以使用转基因小鼠产生,所述转基因小鼠已经被基因工程化以产生特定
的人抗体,以响应使用靶蛋白的抗原挑战。参见green等,nature genet.7:13(1994),lonberg等,nature 368:856(1994)。针对靶蛋白的人抗体也可以通过遗传或染色体转染方法、噬菌体展示技术或体外激活b细胞构建。参见例如,mccafferty等,1990,nature 348:552
‑
553;美国专利号5,567,610和5,229,275,其每篇通过参考以其整体明确地并入本文。
[0347]
在一些实施方式中,gal3
‑
tim
‑
3相互作用可被减少至小于70%、小于60%、小于59%、小于50%、小于40%、小于34%、小于30%、小于20%、小于14%、小于10%、小于7%、小于5%、小于4%或小于1%。
[0348]
多核苷酸和载体
[0349]
在一些实施方式中,本公开提供了编码本文公开的任何抗gal3抗体的分离的核酸。在一些实施方式中,本公开提供了包括编码本文公开的任何抗gal3抗体的核酸序列的载体。在一些实施方式中,本发明提供了编码本文公开的抗gal3抗体的轻链cdr和重链cdr的分离的核酸。
[0350]
受试者抗gal3抗体可以通过重组dna技术、合成化学技术或其组合来制备。例如,使用本领域已知的标准分子技术,通常将编码抗gal3抗体的所需组分,包括轻链cdr和重链cdr的序列组装克隆至表达载体中。这些序列可以从编码所需蛋白质序列的其他载体、从使用各自的模板核酸的pcr生成的片段或通过编码所需序列的合成寡核苷酸的组装来组装。表达系统可以通过用包括感兴趣的抗gal3抗体的表达载体转染合适的细胞来创建。
[0351]
使用常规技术包括但不限于杂交、pcr和dna测序,可以容易地获得和测序对应于现有抗体的轻链或重链的各种区域的核苷酸序列。产生单克隆抗体的杂交瘤细胞用作抗体核苷酸序列的优选的来源。大量产生一系列单克隆抗体的杂交瘤细胞可以从公共或私人储存库中获得。最大的保藏机构是美国模式培养物保藏所(atcc.org),其提供了多样化的特征明确的杂交瘤细胞系的收集。可替选地,抗体核苷酸可以从免疫或未免疫的啮齿动物或人获得,并且形成器官比如脾和外周血液淋巴细胞。适用于提取和合成抗体核苷酸的具体技术在orlandi等(1989)proc.natl.acad.sci.u.s.a 86:3833
‑
3837;larrick等(1989)biochem.biophys.res.commun.160:1250
‑
1255;sastry等(1989)proc.natl.acad.sci.,u.s.a.86:5728
‑
5732和美国专利号5,969,108中描述。
[0352]
编码抗gal3抗体的多核苷酸也可以被修饰,例如,通过人重链和轻链恒定区的编码序列代替同源非人序列来置换。在这种方式中,制备了保留原始抗gal3抗体的结合特异性的嵌合抗体。
[0353]
用于抗体产生的宿主细胞
[0354]
在一些实施方式中,本公开提供了表达本文公开的任何一种抗gal3抗体的宿主细胞。受试者宿主细胞通常包括编码本文公开的任何一种抗gal3抗体的核酸。在一些实施方式中,宿主细胞是中国仓鼠卵巢(cho)细胞。在一些实施方式中,宿主细胞是ns0细胞。
[0355]
本发明提供了用以上所述的多核苷酸、载体或载体文库转染的宿主细胞。可以通过许多适当的方式的任意一种,包括电穿孔、微弹轰击;脂质转染、感染(其中载体与致病原偶联)、采用氯化钙、氯化铷、磷酸钙、deae
‑
葡聚糖或其他物质的转染,将载体引入合适的原核或真核细胞。引入载体的方法的选择通常将取决于宿主细胞的特征。
[0356]
对于大多数动物细胞,任何以上提到的方法都适合于载体递送。优选的动物细胞是脊椎动物细胞,优选地哺乳动物细胞,其能够大量,例如,以毫克水平表达外源引入的基
因产物。优选的细胞的非限制性示例是nih3t3细胞、cos、hela和cho细胞。
[0357]
一旦引入至合适的宿主细胞,抗gal3抗体的表达可以使用本领域已知的任何核酸或蛋白质测定来确定。例如,轻链cdr或重链cdr或抗gal3抗体的转录mrna的存在可以通过常规杂交测定(例如northern印迹分析)、扩增程序(例如rt
‑
pcr)、sage(美国专利号5,695,937)和基于阵列的技术(参见例如美国专利号5,405,783、5,412,087和5,445,934),使用与编码抗gal3抗体的多核苷酸的任何区域互补的探针来检测和/或量化。
[0358]
载体的表达还可以通过检查表达的抗gal3抗体来确定。本领域可获得用于蛋白质分析的各种技术。它们包括但不限于放射免疫测定、elisa(酶联免疫放射测定)、“夹心”免疫测定、免疫放射测定、原位免疫测定(使用例如,胶体金、酶或放射性同位素标记)、蛋白质印迹分析、免疫沉淀测定、免疫荧光测定和sds
‑
page。
[0359]
载荷(payload)
[0360]
在一些实施方式中,抗gal3抗体进一步包括载荷。在一些情况下,载荷包括小分子、蛋白质或其功能片段、肽或核酸聚合物。
[0361]
在一些情况下,与抗gal3抗体缀合的载荷的数量(例如,药物与抗体比例或dar)是约1:1,一种载荷对一种抗gal3抗体。在一些情况下,载荷与抗gal3抗体的比例是约2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1。在一些情况下,载荷与抗gal3抗体的比例是约2:1。在一些情况下,载荷与抗gal3抗体的比例是约3:1。在一些情况下,载荷与抗gal3抗体的比例是约4:1。在一些情况下,载荷与抗gal3抗体的比例是约6:1。在一些情况下,载荷与抗gal3抗体的比例是约8:1。在一些情况下,载荷与抗gal3抗体的比例是约12:1。
[0362]
在一些实施方式中,载荷是小分子。在一些实施方式中,小分子是细胞毒素载荷。示例性细胞毒素载荷包括但不限于微管破坏剂、dna修饰剂或akt抑制剂。
[0363]
在一些实施方式中,载荷包括微管破坏剂。示例性微管破坏试剂包括但不限于2
‑
甲氧基雌二醇、澳瑞他汀(auristatin)、查尔酮、秋水仙碱、考布他汀、念珠藻素(cryptophycin)、dictyostatin、盘皮海绵内酯、dolastain、软珊瑚醇、埃博霉素、软海绵素、莱利霉素(laulimalide)、美登素、noscapaxin、紫杉醇、peloruside、拟茎点霉毒素(phomopsin)、鬼臼毒素、根瘤素、海绵抑制素、紫杉烷、tubulysin、长春花生物碱、长春瑞滨或其衍生物或类似物。
[0364]
在一些实施方式中,美登素是美登木素生物碱。在一些实施方式中,美登木素生物碱是dm1、dm4或安丝菌素。在一些实施方式中,美登木素生物碱是dm1。在一些实施方式中,美登木素生物碱是dm4。在一些实施方式中,美登木素生物碱是安丝菌素。在一些实施方式中,美登木素生物碱是美登木素生物碱衍生物或类似物,比如描述在美国专利号5208020、5416064、7276497和6716821或美国公开号2013029900和us20130323268中的。
[0365]
在一些实施方式中,载荷是海兔毒素,或其衍生物或类似物。在一些实施方式中,海兔毒素是海兔毒素10或海兔毒素15,其或衍生物或类似物。在一些实施方式中,海兔毒素10类似物是澳瑞他汀、soblidotin、symplostatin 1或symplostatin 3。在一些实施方式中,海兔毒素15类似物是西马多丁或他西多丁。
[0366]
在一些实施方式中,海兔毒素10类似物是澳瑞他汀或澳瑞他汀衍生物。在一些实施方式中,澳瑞他汀或澳瑞他汀衍生物是澳瑞他汀e(ae)、澳瑞他汀f(af)、澳瑞他汀e5
‑
苯
甲酰基戊酸酯(aevb)、一甲基澳瑞他汀e(mmae)、一甲基澳瑞他汀f(mmaf)或一甲基澳瑞他汀d(mmad)、澳瑞他汀pe或澳瑞他汀pye。在一些实施方式中,澳瑞他汀衍生物是一甲基澳瑞他汀e(mmae)。在一些实施方式中,澳瑞他汀衍生物是一甲基澳瑞他汀f(mmaf)。在一些实施方式中,澳瑞他汀是澳瑞他汀衍生物或类似物,比如在美国专利号6884869、7659241、7498298、7964566、7750116、8288352、8703714和8871720中描述的。
[0367]
在一些实施方式中,载荷包括dna修饰剂。在一些实施方式中,dna修饰剂包括dna切割剂、dna嵌入剂、dna转录抑制剂或dna交联剂。在一些实施方式中,dna切割剂包括博来霉素a2、加利车霉素或其衍生物或类似物。在一些实施方式中,dna嵌入剂包括多柔比星、表柔比星、pnu
‑
159682、多米卡新、吡咯并苯二氮卓、寡霉素c、柔红霉素、戊柔比星、拓扑替康或其衍生物或类似物。在一些实施方式中,dna转录抑制剂包括更生霉素。在一些实施方式中,dna交联剂包括丝裂霉素c。
[0368]
在一些实施方式中,dna修饰剂包括安吖啶、蒽环霉素、喜树碱、多柔比星、多米卡新、烯二炔、依托泊苷、吲哚并苯二氮卓、纺锤菌素、替尼泊苷或其衍生物或类似物。
[0369]
在一些实施方式中,蒽环霉素是多柔比星、柔红霉素、表柔比星、伊达比星、丝裂霉素
‑
c、更生霉素、光辉霉素、奈莫柔比星、匹蒽醌、沙巴比星或戊柔比星。
[0370]
在一些实施方式中,喜树碱的类似物是拓扑替康、依立替康、西拉替康、科西替康、依沙替康、勒托替康、吉马替康、贝洛替康、鲁比替康或sn
‑
38。
[0371]
在一些实施方式中,多米卡新是多米卡新a、多米卡新b1、多米卡新b2、多米卡新c1、多米卡新c2、多米卡新d、多米卡新sa或cc
‑
1065。在一些实施方式中,烯二炔是加利车霉素、埃斯帕霉素或达内霉素a。
[0372]
在一些实施方式中,吡咯并苯二氮卓是蒽霉素、赤霉素、契卡霉素、dc
‑
81、甲基氨茴霉素(mazethramycin)、新茴霉素(neothramycins)a、新茴霉素b、porothramycin、prothracarcin、sibanomicin(dc
‑
102)、西伯霉素或茅屋霉素。在一些实施方式中,吡咯并苯二氮卓是茅屋霉素衍生物,比如在美国专利号8404678和8163736中描述的。在一些实施方式中,吡咯并苯二氮卓是比如在美国专利号8426402、8802667、8809320、6562806、6608192、7704924、7067511、us7612062、7244724、7528126、7049311、8633185、8501934和8697688和美国公开号us20140294868中描述的。
[0373]
在一些实施方式中,吡咯并苯二氮卓是吡咯并苯二氮卓二聚体。在一些实施方式中,pbd二聚体是对称的二聚体。对称的pbd二聚体的示例包括但不限于sjg
‑
136(sg
‑
2000)、zc
‑
423(sg2285)、sjg
‑
720,sjg
‑
738、zc
‑
207(sg2202)和dsb
‑
120。在一些实施方式中,pbd二聚体是非对称的二聚体。非对称的pbd二聚体的示例包括但不限于sjg
‑
136衍生物,比如在美国专利号8697688和9242013和美国公开号20140286970中描述的。
[0374]
在一些实施方式中,载荷包括akt抑制剂。在一些情况下,akt抑制剂包括ipatasertib(gdc
‑
0068)或其衍生物。
[0375]
在一些实施方式中,载荷包括聚合酶抑制剂,包括但不限于聚合酶ii抑制剂比如a
‑
鹅膏菌素和聚(adp
‑
核糖)聚合酶(parp)抑制剂。示例性parp抑制剂包括但不限于iniparib(bsi 201)、他拉唑帕尼(bmn
‑
673)、奥拉帕尼(azd
‑
2281)、奥拉帕尼、鲁卡帕尼(ag014699、pf
‑
01367338)、维利帕尼(abt
‑
888)、cep 9722、mk 4827、bgb
‑
290或3
‑
氨基苯甲酰胺。
[0376]
在一些实施方式中,载荷包括可检测的部分。示例性可检测的部分包括荧光染料;酶;,基底;化学发光部分;特异性结合部分比如链霉抗生物素、抗生物素蛋白或生物素;或放射性同位素。
[0377]
在一些实施方式中,载荷包括免疫调节剂。有用的免疫调节剂包括阻断激素对肿瘤作用的抗激素和抑制细胞因子产生、下调自身抗原表达或掩盖mhc抗原的免疫抑制剂。代表性的抗激素包括抗雌激素,包括例如它莫西芬、雷洛昔芬、抑制4(5)
‑
咪唑的芳香酶、4
‑
羟基他莫昔芬、曲沃昔芬、雷洛西芬、ly 117018、奥那司酮(onapnstone)和托瑞米芬;和抗雄激素比如氟他胺、尼鲁米特、比卡鲁胺、亮丙瑞林、戈舍瑞林;和抗肾上腺剂。阐释性免疫抑制剂包括但不限于2
‑
氨基
‑6‑
芳基
‑5‑
取代的嘧啶、硫唑硫嘌呤、环磷酰胺、溴隐亭、达那唑、氨苯砜、戊二醛、针对mhc抗原和mhc片段的抗独特型抗体、环孢菌素a、类固醇比如糖皮质激素、链激酶或雷帕霉素。
[0378]
在一些实施方式中,载荷包括免疫调节剂。示例性免疫调节剂包括但不限于gancyclovier、依那西普、他克莫司、西罗莫司、伏环孢素、环孢菌素、雷帕霉素、环磷酰胺、咪唑硫嘌呤、mycophenolgate mofetil、甲氨蝶呤、糖皮质激素及其类似物、黄嘌呤、干细胞生长因子、淋巴毒素、造血因子、肿瘤坏死因子(tnf)(例如tnfα)、白细胞介素(例如,白细胞介素
‑
1(il
‑
1)、il
‑
2、il
‑
3、il
‑
6、il
‑
10、il
‑
12、il
‑
18和il
‑
21)、集落刺激因子(例如,粒细胞集落刺激因子(g
‑
csf)和粒细胞巨噬细胞集落刺激因子(gm
‑
csf))、干扰素(例如干扰素
‑
α、干扰素
‑
β、干扰素
‑
γ)、被称为“s1因子”的干细胞生长因子、促红细胞生成素和血小板生成素或其组合。
[0379]
在一些实施方式中,载荷包括免疫毒素。免疫毒素包括但不限于蓖麻毒蛋白、放射性核素、商陆抗病毒蛋白、假单胞菌外毒素a、白喉毒素、蓖麻蛋白a链、真菌毒素比如限制性蛋白和磷脂酶。一般而言,参见“chimeric toxins”,olsnes和pihl,pharmac.ther.15:355
‑
381(1981)和“monoclonal antibodies for cancer detection and therapy,”eds.baldwin和byers,第159
‑
179、224
‑
266页,academic press(1985)。
[0380]
在一些实施方式中,载荷包括核酸聚合物。在一些实施方式中,核酸聚合物包括短干扰核酸(sina)、短干扰rna(sirna)、双链rna(dsrna)、微rna(mirna)、短发夹rna(shrna)、反义寡核苷酸。在一些实施方式中,核酸聚合物包括编码,例如细胞毒素蛋白或肽或细胞凋亡触发蛋白或肽的mrna。示例性细胞毒素蛋白或肽包括细菌细胞毒素比如α
‑
孔形成毒素(例如,来自大肠杆菌的溶细胞素a),β
‑
孔形成毒素(例如,α
‑
溶血素、pvl
‑
杀白细胞毒素、气溶素、梭菌ε
‑
毒素、产气荚膜梭菌肠毒素)、二元毒素(炭疽热毒素、水肿毒素、肉毒梭菌c2毒素、螺状梭菌毒素、产气荚膜梭菌(c.perfringens iota)毒素、艰难梭菌致死毒素(a和b))、朊病毒、副孢菌素、胆固醇依赖性溶细胞素(例如,肺炎球菌溶血素)、小孔形成毒素(例如,短杆菌肽a)、蓝藻毒素(例如,微囊藻毒素、节球藻素)、血液毒素、神经毒素(例如,肉毒杆菌神经毒素)、细胞毒素、霍乱毒素、白喉毒素、假单胞菌外毒素a、破伤风毒素或免疫毒素(伊达比星、蓖麻蛋白a、crm9、商陆抗病毒蛋白、dt)。示例性凋亡触发蛋白或肽包括凋亡蛋白酶激活因子
‑
1(apaf
‑
1)、细胞色素
‑
c、半胱天冬酶起始蛋白(casp2、casp8、casp9、casp10)、凋亡诱导因子(aif)、p53、p73、p63、bcl
‑
2、,bax、颗粒酶b、聚adp核糖聚合酶(parp)和p 21
‑
活化激酶2(pak2)。在一些实施方式中,核酸聚合物包括核酸诱饵。在一些实施方式中,核酸诱饵是蛋白质结合核酸的模拟物,比如基于rna的蛋白质结合模拟物。示例性核酸诱饵包括反
式激活区(tar)诱饵和rev响应元件(rre)诱饵。
[0381]
在一些情况下,载荷是适配体。适配体是结合至特定靶分子的小寡核苷酸或肽分子。示例性核酸适配体包括dna适配体、rna适配体或xna适配体,其是包括一种或多种非天然核苷酸的rna和/或dna适配体。示例性核酸适配体包括arc19499(archemix corp.)、reg1(regado biosciences)和arc1905(ophthotech)。
[0382]
按照本文所述的一些实施方式的核酸任选地包括天然存在的核酸,或一种或多种核苷酸类似物或具有与天然存在的核酸不同的结构。例如,2
’‑
修饰包括卤基(halo)、烷氧基和烯丙基氧基。在一些实施方式中,2
’‑
oh基团被选自h、or、r、卤基、sh、sr、nh2、nhr、nr2或cn的基团取代,其中r是c1‑
c6烷基、烯基或炔基,并且卤基是f、cl、br或i。修饰的连接的示例包括硫代磷酸酯和5
’‑
n
‑
亚磷酰胺连接。
[0383]
按照本文所述的一些实施方式利用具有各种不同核苷酸类似物、修饰的骨架或非天然存在的核苷间连接的核酸。在一些情况下,核酸包括天然核苷(即腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷)或修饰的核苷。修饰的核苷酸的示例包括碱基修饰的核苷(例如,阿糖胞苷、肌苷、异鸟苷、水粉蕈素、假尿苷、2,6
‑
二氨基嘌呤、2
‑
氨基嘌呤、2
‑
硫胸苷、3
‑
脱氮
‑5‑
氮杂胞苷、2
’‑
脱氧尿苷、3
‑
硝基吡咯、4
‑
甲基吲哚、4
‑
硫尿苷、4
‑
硫胸苷、2
‑
氨基腺苷、2
‑
硫胸苷、2
‑
硫尿苷、5
‑
溴胞苷、5
‑
碘尿苷、肌苷、6
‑
氮杂尿苷、6
‑
氯嘌呤、7
‑
脱氮杂腺苷、7
‑
脱氮鸟苷、8
‑
氮杂腺苷、8
‑
叠氮腺苷、苯并咪唑、m1
‑
甲基腺苷、吡咯并嘧啶、2
‑
氨基
‑6‑
氯嘌呤、3
‑
甲基腺苷、5
‑
丙炔基胞苷、5
‑
丙炔基尿苷、5
‑
溴尿苷、5
‑
氟尿苷、5
‑
甲基胞苷、7
‑
脱氮腺苷、7
‑
脱氮鸟苷、8
‑
氧代腺苷、8
‑
氧代鸟苷、o(6)
‑
甲基鸟嘌呤和2
‑
硫胞苷)、化学或生物修饰的碱基(例如,甲基化碱基)、修饰的糖(例如,2
’‑
氟核糖、2
’‑
氨基核糖、2
’‑
叠氮核糖、2
’‑
o
‑
甲基核糖、l
‑
对映体核苷阿拉伯糖和己糖)、修饰的磷酸根基团(例如,硫代磷酸酯和5
’‑
n
‑
亚磷酰胺连接)及其组合。用于核酸化学合成的天然和修饰的核苷酸单体很容易获得。在一些情况下,包含这种修饰的核酸相对于仅由天然存在的核苷酸组成的核酸显示出改善的性质。在一些实施方式中,利用本文所述的核酸修饰以减少和/或防止核酸酶(例如核酸外切酶、核酸内切酶等)的消化。例如,可以通过在一条或两条链的3’端处包括核苷酸类似物以减少消化来稳定核酸的结构。
[0384]
不同的核苷酸修饰和/或骨架结构可能存在于核酸的不同位置。这种修饰包括吗啉、肽核酸(pna)、甲基膦酸核苷酸、硫醇膦酸核苷酸、2
’‑
氟n3p5
’‑
亚磷酰胺、1’,5
’‑
脱水己糖醇核酸(hna)或其组合。
[0385]
缀合化学
[0386]
在一些实施方式中,载荷通过天然连接缀合至本文所述的抗gal3抗体。在一些实施方式中,缀合是如在以下中描述的:dawson等“synthesis of proteins by native chemical ligation,”science 1994,266,776
‑
779;dawson等“modulation of reactivity in native chemical ligation through the use of thiol additives,”j.am.chem.soc.1997,119,4325
–
4329;hackeng等“protein synthesis by native chemical ligation:expanded scope by using straightforward methodology.,”proc.natl.acad.sci.usa 1999,96,10068
–
10073或wu等“building complex glycopeptides:development of acysteine
‑
free native chemical ligation protocol,”angew.chem.int.ed.2006,45,4116
–
4125。在一些实施方式中,缀合是如美国专
利号8,936,910中描述的。
[0387]
在一些实施方式中,通过利用“无痕”偶联技术(philochem)的定向位点方法将载荷缀合至本文所述的抗gal3抗体。在一些实施方式中,“无痕”偶联技术利用结合部分上的n
‑
端1,2
‑
氨基硫醇基团,然后将其缀合至含有醛基的聚核酸分子。(参见casi等,“site
‑
specific traceless coupling of potent cytotoxic drugs to recombinant antibodies for pharmacodelivery,”jacs134(13):5887
‑
5892(2012))。
[0388]
在一些实施方式中,通过利用并入结合部分的非天然氨基酸的定向位点方法将载荷缀合至本文所述的抗gal3抗体。在一些实施方式中,非天然氨基酸包括对乙酰苯丙氨酸(pacphe)。在一些实施方式中,pacphe的酮基选择性地偶联至烷氧基
‑
胺衍生的缀合部分以形成肟键。(参见axup等,“synthesis of site
‑
specific antibody
‑
drug conjugates using unnatural amino acids,”pnas 109(40):16101
‑
16106(2012))。
[0389]
在一些实施方式中,通过利用酶催化过程的定向位点方法将载荷缀合至本文所述的抗gal3抗体。在一些实施方式中,定向位点方法利用smartag
tm
技术(redwood)。在一些实施方式中,smartag
tm
技术包括在醛标签存在下通过甲酰甘氨酸生成酶(fge)通过氧化过程从半胱氨酸生成甲酰甘氨酸(fgly)残基,随后将fgly经肼基
‑
pictet
‑
spengler(hips)连接缀合至alkylhydrain官能化的聚核酸分子。(参见wu等,“site
‑
specific chemical modification of recombinant proteins produced in mammalian cells by using the genetically encoded aldehyde tag,”pnas 106(9):3000
‑
3005(2009);agarwal等,“a pictet
‑
spengler ligation for protein chemical modification,”pnas 110(1):46
‑
51(2013))。
[0390]
在一些实施方式中,酶催化的工艺包括微生物转谷氨酰胺酶(mtg)。在一些情况下,利用微生物转谷氨酰胺酶催化的工艺将载荷缀合至抗gal3抗体。在一些实施方式中,mtg催化识别序列内谷氨酰胺的酰胺侧链与官能化聚核酸分子的伯胺之间形成的共价键的形成。在一些实施方式中,mtg是从莫巴链霉菌(streptomyces mobarensis)产生的。(参见strop等,“location matters:site of conjugation modulates stability and pharmacokinetics of antibody drug conjugates,”chemistry and biology 20(2)161
‑
167(2013))。
[0391]
在一些实施方式中,载荷通过如pct公开号wo2014/140317中描述的方法缀合至抗gal3抗体,该方法利用序列特异性转肽酶。
[0392]
在一些实施方式中,载荷通过如美国专利公开号2015/0105539和2015/0105540中描述的方法缀合至本文所述的抗gal3抗体。
[0393]
连接体
[0394]
在一些实施方式中,以上描述的连接体包括天然或合成的聚合物,其由支链或非支链单体的长链和/或二维或三维的单体交联网络组成。在一些实施方式中,连接体包括多糖、木质素、橡胶或聚烷撑氧化物(polyalkylen oxide)(例如,聚乙二醇)。
[0395]
在一些实施方式中,连接体包括但不限于α
‑
、ω
‑
二羟基聚乙二醇、可生物降解的内酯基聚合物,例如聚丙烯酸、聚乳酸(pla)、聚(乙醇酸)(pga)、聚丙烯、聚苯乙烯、聚烯烃、聚酰胺、聚氰基丙烯酸酯、聚酰亚胺、聚乙烯对苯二甲酸酯(polyethylenterephthalat)(pet、petg)、聚对苯二甲酸乙二醇酯(聚polyethylene terephthalate)(pete)、聚四亚甲
基二醇(ptg)或聚氨酯以及其混合物。如本文使用的,混合物指在相同化合物中使用不同聚合物以及指嵌段共聚物。在一些情况下,嵌段共聚物是聚合物,其中聚合物的至少一个部分由另一聚合物的单体构成。在一些实施方式中,连接体包括聚环氧烷。在一些实施方式中,连接体包括peg。在一些实施方式中,连接体包括聚乙烯酰亚胺(pei)或羟乙基淀粉(hes)。
[0396]
在一些情况下,聚环氧烷(例如,peg)是多分散或单分散化合物。在一些实施方式中,多分散材料包括不同分子量的材料的分散分布,其特征在于平均重量(重量平均)大小和分散度。在一些实施方式中,单分散peg包括一种大小的分子。在一些实施方式中,连接体是多分散或单分散聚环氧烷(例如,peg)并且指示的分子量代表聚环氧烷,例如,peg分子的平均分子量。
[0397]
在一些实施例中,连接体包含聚环氧烷(例如,peg)并且聚环氧烷(例如,peg)的分子量是约200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1450、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3250、3350、3500、3750、4000、4250、4500、4600、4750、5000、5500、6000、6500、7000、7500、8000、10,000、12,000、20,000、35,000、40,000、50,000、60,000或100,000da。
[0398]
在一些实施方式中,聚环氧烷(例如,peg)是离散的peg,其中离散的peg是包括不只一个重复环氧乙烷单元的聚合的peg。在一些实施方式中,离散的peg(dpeg)包括2至60、2至50或2至48个重复环氧乙烷单元。在一些实施方式中,dpeg包括约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、22、24、26、28、30、35、40、42、48、50或更多个重复环氧乙烷单元。在一些实施方式中,dpeg包括约2或更多个重复环氧乙烷单元。在一些情况下,dpeg是由纯的(例如,约95%、98%、99%或99.5%)起始材料以逐步方式合成为单分子量化合物。在一些情况下,dpeg具有特定的分子量,而不是平均分子量。在一些情况下,本文所述的dpeg是来自quanta biodesign,lmd的dpeg。
[0399]
在一些实施方式中,连接体是离散的peg,任选地包括2至60、2至50或2至48个重复环氧乙烷单元。在一些情况下,连接体包括包含约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、22、24、26、28、30、35、40、42、48、50或更多个重复环氧乙烷单元的dpeg。在一些情况下,连接体是来自quanta biodesign,lmd的dpeg。
[0400]
在一些实施方式中,连接体是多肽连接体。在一些实施方式中,多肽连接体包括至少2、3、4、5、6、7、8、10、15、20、25、30、35、40、45、50、60、70、80、90、100或更多个氨基酸残基。在一些实施方式中,多肽连接体包括至少2、3、4、5、6、7、8或更多个氨基酸残基。在一些实施方式中,多肽连接体包括至多2、3、4、5、6、7、8或更少个氨基酸残基。在一些情况下,多肽连接体是可切割的多肽连接体(例如,酶促地或化学地)。在一些情况下,多肽连接体是非可切割的多肽连接体。在一些实施方式中,多肽连接体包括val
‑
cit(缬氨酸
‑
瓜氨酸)、gly
‑
gly
‑
phe
‑
gly、phe
‑
lys、val
‑
lys、gly
‑
phe
‑
lys、phe
‑
phe
‑
lys、ala
‑
lys、val
‑
arg、phe
‑
cit、phe
‑
arg、leu
‑
cit、ile
‑
cit、trp
‑
cit、phe
‑
ala、ala
‑
leu
‑
ala
‑
leu或gly
‑
phe
‑
leu
‑
gly。在一些实施方式中,多肽连接体包括肽比如:val
‑
cit(缬氨酸
‑
瓜氨酸)、gly
‑
gly
‑
phe
‑
gly、phe
‑
lys、val
‑
lys、gly
‑
phe
‑
lys、phe
‑
phe
‑
lys、ala
‑
lys、val
‑
arg、phe
‑
cit、phe
‑
arg、leu
‑
cit、ile
‑
cit、trp
‑
cit、phe
‑
ala、ala
‑
leu
‑
ala
‑
leu或gly
‑
phe
‑
leu
‑
gly。在一些情况下,多肽连接体包括l
‑
氨基酸、d
‑
氨基酸或l
‑
和d
‑
氨基酸二者的混合物。
[0401]
在一些实施方式中,连接体包括同基双功能连接体。示例性同基双功能连接体包
括但不限于lomant试剂二硫代双(琥珀酰亚胺基丙酸酯)dsp、3
’3’‑
二硫代双(磺基琥珀酰亚胺基丙酸酯(dtssp)、双琥珀酰亚胺基辛二酸酯(dss)、双(磺基琥珀酰亚胺基)辛二酸酯(bs)、双琥珀酰亚胺基酒石酸酯(dst)、双磺基琥珀酰亚胺基酒石酸酯(磺基dst)、乙二醇双(琥珀酰亚胺基琥珀酸酯)(egs)、双琥珀酰亚胺基戊二酸酯(dsg)、n,n
’‑
双琥珀酰亚胺基碳酸酯(dsc)、己二酰亚胺二甲酯(dma)、庚二酰亚胺二甲酯(dmp)、二甲基新二亚酰(dms)、二甲基
‑
3,3
’‑
二硫代双丙酰亚胺酯(dtbp)、1,4
‑
二
‑3’‑
(2’'
‑
吡啶基二硫基)丙酰胺基)丁烷(dpdpb)、双马来酰亚胺己烷(bmh)、含芳基卤化物的化合物(dfdnb),比如例如1,5
‑
二氟
‑
2,4
‑
二硝基苯或1,3
‑
二氟
‑
4,6
‑
二硝基苯、4,4
’‑
二氟
‑
3,3
’‑
二硝基苯砜(dfdnps)、双
‑
[β
‑
(4
‑
叠氮基水杨酰胺)乙基]二硫化物(based)、甲醛、戊二醛、1,4
‑
丁二醇缩水甘油醚、己二酸二酰肼、碳酰肼、邻甲苯胺、3,3
’‑
二甲基联苯胺、联苯胺、α,α
’‑
对二氨基二苯、二碘
‑
对二甲苯磺酸、n,n'
‑
亚乙基
‑
双(碘乙酰胺)或n,n
’‑
六亚甲基
‑
双(碘乙酰胺)。
[0402]
在一些实施方式中,连接体包括异基双功能连接体。示例性异基双功能连接体包括但不限于胺反应性和巯基交联剂,比如n
‑
琥珀酰亚胺基3
‑
(2
‑
吡啶基二硫)丙酸酯(spdp)、长链n
‑
琥珀酰亚胺基3
‑
(2
‑
吡啶基二硫)丙酸酯(lc
‑
spdp)、水溶性长链n
‑
琥珀酰亚胺基3
‑
(2
‑
吡啶基二硫)丙酸酯(磺基
‑
lc
‑
spdp)、琥珀酰亚胺基氧羰基
‑
α
‑
甲基
‑
α
‑
(2
‑
吡啶基二硫)甲苯(smpt)、磺基琥珀酰亚胺基
‑6‑
[α
‑
甲基
‑
α
‑
(2
‑
吡啶基二硫)甲苯胺]己酸酯(磺基
‑
lc
‑
smpt)、琥珀酰亚胺基
‑4‑
(n
‑
马来酰亚胺甲基)环己烷
‑1‑
羧酸酯(smcc)、磺基琥珀酰亚胺基
‑4‑
(n
‑
马来酰亚胺甲基)环己烷
‑1‑
羧酸酯(磺基
‑
smcc)、间马来酰亚胺苯甲酰基
‑
n
‑
羟基琥珀酰亚胺酯(mbs)、间马来酰亚胺苯甲酰基
‑
n
‑
羟基磺基琥珀酰亚胺酯(磺基
‑
mbs)、n
‑
琥珀酰亚胺基(4
‑
碘乙酰基)氨基苯甲酸酯(siab)、磺基琥珀酰亚胺基(4
‑
碘乙酰基)氨基苯甲酸酯(磺基
‑
siab)、琥珀酰亚胺基
‑4‑
(对马来酰亚胺苯基)丁酸酯(smpb)、磺基琥珀酰亚胺基
‑4‑
(对马来酰亚胺苯基)丁酸酯(磺基
‑
smpb)、n
‑
(γ
‑
马来酰亚胺丁酰氧基)琥珀酸酰亚胺酯(gmb)、n
‑
(γ
‑
马来酰亚胺丁氧基)磺基琥珀酰亚胺酯(磺基
‑
gmb)、琥珀酰亚胺基6
‑
((碘乙酰基)氨基)己酸酯(siax)、琥珀酰亚胺基6
‑
[6
‑
(((碘乙酰基)氨基)己酰基)氨基]己酸酯(siaxx)、琥珀酰亚胺基4
‑
(((碘乙酰)氨基)甲基)环己烷
‑1‑
羧酸酯(siac)、琥珀酰亚胺基6
‑
(((((4
‑
碘乙酰)氨基)甲基)环己烷
‑1‑
羰基)氨基)己酸酯(siacx)、对硝基苯基碘乙酸酯(npia)、羰基反应性和巯基反应性交联剂,比如4
‑
(4
‑
n
‑
马来酰亚胺苯基)丁酸酰肼(mpbh)、4
‑
(n
‑
马来酰亚胺甲基)环己烷
‑1‑
羧基
‑
酰肼
‑
8(m2c2h),3
‑
(2
‑
吡啶基二硫)丙酰基酰肼(pdph),胺反应性和光反应性交联剂,比如n
‑
羟基琥珀酰亚胺基
‑4‑
叠氮基水杨酸(nhs
‑
asa)、n
‑
羟基磺基琥珀酰亚胺基
‑4‑
叠氮基水杨酸(磺基
‑
nhs
‑
asa)、磺基琥珀酰亚胺基
‑
(4
‑
叠氮基水杨酰胺基)己酸酯(磺基
‑
nhs
‑
lc
‑
asa)、磺基琥珀酰亚胺基
‑2‑
(对
‑
叠氮基水杨酰胺基)乙基
‑
1,3
’‑
二硫代丙酸酯(sasd)、n
‑
羟基琥珀酰亚胺基
‑4‑
叠氮苯甲酸酯(hsab)、n
‑
羟基磺基琥珀酰亚胺基
‑4‑
叠氮基苯甲酸酯(磺基
‑
hsab)、n
‑
琥珀酰亚胺基
‑6‑
(4
’‑
叠氮基
‑2’‑
硝基苯氨基)己酸酯(sanpah)、磺基琥珀酰亚胺基
‑6‑
(4
’‑
叠氮基
‑2’‑
硝基苯氨基)己酸酯(磺基
‑
sanpah)、n
‑5‑
叠氮基
‑2‑
硝基苯甲酰氧基琥珀酰亚胺(anb
‑
nos)、磺基琥珀酰亚胺基
‑2‑
(间叠氮基
‑
邻硝基苯甲酰胺)
‑
乙基
‑
1,3
’‑
二硫丙酸酯(sand)、n
‑
琥珀酰亚胺基
‑
4(4
‑
叠氮苯基)1,3
’‑
二硫丙酸酯(sadp)、n
‑
磺基琥珀酰亚胺基(4
‑
叠氮苯基)
‑
1,3
’‑
二硫丙酸酯(磺基
‑
sadp)、磺基琥珀酰亚胺基4
‑
(对叠氮苯基)丁酸酯(磺基
‑
sapb)、磺基琥珀酰亚胺基2
‑
(7
‑
叠氮基
‑4‑
甲基香豆素
‑3‑
乙酰胺)乙基
‑
1,3
’‑
二硫丙酸酯(saed)、磺基
琥珀酰亚胺基7
‑
叠氮基
‑4‑
甲基香豆素
‑3‑
乙酸酯(磺基
‑
samca)、对硝基苯基重氮丙酮酸酯(ρnpdp)、对硝基苯基
‑2‑
重氮
‑
3,3,3
‑
三氟丙酸酯(pnp
‑
dtp)、巯基反应性和光反应性交联剂,比如1
‑
(对叠氮水杨酰胺)
‑4‑
(碘乙酰胺)丁烷(asib)、n
‑
[4
‑
(对叠氮水杨酰胺)丁基]
‑3’‑
(2
’‑
吡啶基二硫)丙酰胺(apdp)、二苯酮
‑4‑
碘乙酰胺、二苯酮
‑4‑
马来酰亚胺羰基反应性和光反应性交联剂,比如对叠氮苯甲酰肼(abh)、羧酸酯反应性和光反应性交联剂,比如4
‑
(对叠氮基水杨酰胺)丁胺(asba)和精氨酸
‑
反应性和光反应性交联剂,比如对叠氮苯基乙二醛(apg)。
[0403]
在一些实施方式中,连接体包括苯甲酸基团或其衍生物。在一些实施方式中,苯甲酸基团或其衍生物包括对氨基苯甲酸(paba)。在一些实施方式中,苯甲酸基团或其衍生物包括γ
‑
氨基丁酸(gaba)。
[0404]
在一些实施方式中,连接体包括马来酰亚胺基团、肽部分和/或苯甲酸基团中的一种或多种,以任何组合。在一些实施方式中,连接体包括马来酰亚胺基团、肽部分和/或苯甲酸基团的组合。在一些实施方式中,马来酰亚胺基团是马来酰亚胺己酰基(mc)。在一些实施方式中,肽基团是val
‑
cit。在一些实施方式中,苯甲酸基团是paba。在一些实施方式中,连接体包括mc
‑
val
‑
cit基团。在一些情况下,连接体包括val
‑
cit
‑
paba基团。在其他情况下,连接体包括mc
‑
val
‑
cit
‑
paba基团。
[0405]
在一些实施方式中,连接体是自毁连接体(self
‑
immolative linker)或自消除连接体。在一些情况下,连接体是自毁连接体。在其他情况下,连接体是自消除连接体(例如,环化自消除连接体)。在一些实施方式中,连接体包括在美国专利号9,089,614或pct公开号wo2015038426中描述的连接体。
[0406]
在一些实施方式中,连接体为树突型连接体。在一些实施方式中,树突型连接体包括分支的,多功能连接体部分。在一些实施方式中,树突型连接体包括pamam树枝状高分子。
[0407]
在一些实施方式中,连接体是无痕连接体或其中切割后不留下与抗体或载荷的连接体部分(例如,原子或连接体基团)的连接体。示例性无痕连接体包括但不限于锗连接体、硅连接体、硫连接体、硒连接体、氮连接体、磷连接体、硼连接体、铬连接体或苯酰肼连接体。在一些情况下,连接体是如hejesen等,“a traceless aryl
‑
triazene linker for dna
‑
directed chemistry,”org biomol chem 11(15):2493
‑
2497(2013)中描述的无痕芳基
‑
三氮烯连接体。在一些实施方式中,连接体是blaney等,“traceless solid
‑
phase organic synthesis,”chem.rev.102:2607
‑
2024(2002)中描述的无痕连接体。在一些实施方式中,连接体是如美国专利号6,821,783中描述的无痕连接体。
[0408]
药物组合物
[0409]
在一些实施方式中,用于减少组织纤维化的药物制剂可包括上文描述的抗gal3抗体。抗gal3抗体可被配制用于全身施用。可替选地,抗gal3抗体可被配制用于肠胃外施用。
[0410]
在一些实施方式中,抗gal3抗体进一步配制成药物组合物。在一些实施方式中,药物组合物被配制用于通过多种施用途径向受试者施用,包括但不限于肠胃外(例如,静脉内、皮下、肌内、动脉内、皮内、腹膜内、玻璃体内、脑内或脑室内)、口服、鼻内、口腔、直肠或经皮施用途径。在一些实施方式中,本文所述的药物组合物被配制用于肠胃外(例如,静脉内、皮下、肌肉内、动脉内、皮内、腹膜内、玻璃体内、脑内或脑室内)施用。在一些实施方式中,本文所述的药物组合物被配制用于口服施用。在其他实施方式中,本文所述的药物组合
物被配制用于鼻内施用。
[0411]
在一些实施方式中,药物制剂包括但不限于水性液体分散体、自乳化分散体、固溶体、脂质体分散体、气溶胶、固体剂型、粉末、速释制剂、控释制剂、速溶制剂、片剂、胶囊、丸剂、缓释制剂、延长释放制剂、脉冲释放制剂、多颗粒制剂(例如,纳米颗粒制剂)以及混合的速释和控释制剂。
[0412]
在一些实施方式中,药物组合物进一步包括ph调节剂或缓冲剂,其包括酸,比如乙酸、硼酸、柠檬酸、乳酸、磷酸和盐酸;碱,比如氢氧化钠、磷酸钠、硼酸钠、柠檬酸钠、乙酸钠、乳酸钠、三羟甲基氨基甲烷;和缓冲液,比如柠檬酸盐/右旋糖、碳酸氢钠和氯化铵。这种酸、碱和缓冲液以使组合物的ph保持在可接受范围内所需的量被包括。
[0413]
在一些实施方式中,药物组合物包括使组合物的渗透压为可接受范围所需的量的一种或多种盐。这种盐包括具有钠、钾或铵阳离子和氯化物、柠檬酸盐、抗坏血酸盐、硼酸盐、磷酸盐、碳酸氢盐、硫酸盐、硫代硫酸盐或亚硫酸氢盐阴离子的盐;合适的盐包括氯化钠、氯化钾、硫代硫酸钠、亚硫酸氢钠和硫酸铵。
[0414]
在一些实施方式中,药物组合物进一步包括用于稳定化合物的稀释剂,因为它们可以提供更稳定的环境。溶解在缓冲溶液中的盐(其也可以提供ph控制或维持)在本领域中用作稀释剂,包括但不限于磷酸盐缓冲盐水溶液。在某些实施方式中,稀释剂增加组合物的体积以促进压缩或产生足够的体积以用于胶囊填充的均质共混物。这种化合物包括例如,乳糖、淀粉、甘露醇、山梨糖醇、右旋糖、微晶纤维素比如磷酸氢钙,磷酸二钙二水合物;磷酸三钙、磷酸钙;无水乳糖、喷雾干燥乳糖;预糊化淀粉、可压缩糖,比如(amstar);甘露醇、羟丙基甲基纤维素、醋酸硬脂酸羟丙基甲基纤维素、蔗糖基稀释剂、糖果糖;一水一碱式硫酸钙、二水硫酸钙;三水乳酸钙,葡萄糖结合剂;水解谷物固体,直链淀粉;粉状纤维素、碳酸钙;甘氨酸、高岭土;甘露醇、氯化钠;肌醇、膨润土等。
[0415]
在一些实施方式中,药物制剂还可包括另外治疗剂。另外治疗剂可以具有抗纤维化作用。另外治疗剂可以是配体,比如生长因子、细胞因子和基质金属蛋白酶(mmp)的抑制剂。另外治疗剂可以是tgf
‑
β、alk5、bmp
‑
7、pdgf、血小板衍生生长因子、vegf、tnf、hgf、il
‑
13、趋化因子(c
‑
c基序)配体2;ccr5、mmp和timp的抑制剂。另外治疗剂可以是shp
‑
627(ft011)、羟尼酮(f351)、pxs
‑
25、disitertide(p
‑
144)、非苏木单抗(gc
‑
1008)、ly2382770、stx
‑
100、cwhm
‑
12、sb
‑
431542、thr
‑
184、pf
‑
06473871、rxi
‑
109、fg
‑
3019、伊马替尼、bot
‑
191、尼罗替尼(amn
‑
107)、达沙替尼、尼达尼布(bibf
‑
1120)、索拉非尼(bay 43
‑
9006)、沙利度胺、泊马度胺、依那西普、贝利木单抗、refanalin(bb
‑
3)、德屈库单抗(qax
‑
576)、曲罗芦单抗(tralokinumab)、阿那白滞素、利纳西普(rilonacept)、sar156597、卡鲁单抗(cnto
‑
888)、剂宾达利(bindarit)、马拉维诺、rs
‑
504393、actimmune、α口服干扰素、巴马司他(batimastat)(bb
‑
49)、马马司他marimastat、macitentan、波生坦、安贝生坦、sparsentan(re
‑
021)、阿曲生坦、氯沙坦、bms
‑
986020、sar
‑
100842、par1拮抗剂、姜黄素、水飞蓟素、β
‑
石竹烯、贝前列素、曲伏前列腺素、阿肽地尔、西维来司钠、uk
‑
396082、serelaxin、prm
‑
151或薯蓣皂甙,ntu281。
[0416]
治疗性方案
[0417]
在一些实施方式中,本文公开的抗gal3抗体被施用用于治疗应用。在一些实施方式中,抗gal3抗体每天一次、每天两次、每天三次或更多次施用。抗gal3抗体日常、每天、每
隔一天、每周五天、每周一次、每隔一周、每月两周、每月三周、每月一次、每月两次、每月三次或更多施用。抗gal3抗体施用至少1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、18个月、2年、3年或更长。
[0418]
在患者状态确实改善的情况下,根据医生的判断,继续给予抗gal3抗体的施用;可替选地,正在施用的抗gal3抗体的剂量被暂时减少或暂时暂停一段时间长度(即“休药期”)。在一些实施方式中,休药期的长度在2天和1年之间变化,包括仅作为示例,2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天、35天、50天、70天、100天、120天、150天、180天、200天、250天、280天、300天、320天、350天或365天。在休药期期间的剂量减少为10%
‑
100%,包括,仅通过示例,10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。
[0419]
一旦患者的病症出现改善,必要时施用维持剂量。随后,由于症状的作用,将施用的剂量或频率或两者降低至维持改善的疾病、障碍或病症的水平。
[0420]
在一些实施方式中,对应于这种量的给定试剂的量取决于比如具体化合物、疾病的严重程度、需要治疗的受试者或宿主的特征(例如,体重)的因素,但是然而,根据围绕病例的具体情况以本领域已知的方式常规地确定,包括例如正施用的特定药剂、施用途径和正被治疗的受试者或宿主。在一些实施方式中,所需剂量方便地以单一剂量或作为同时(或在短时间内)或以适当间隔,例如作为每天两个、三个、四个或更多个子剂量(sub
‑
dose)施用的分开剂量提供。
[0421]
前述范围仅是建议性的,因为关于个体治疗方案的变量数量很大,并且与这些推荐值的相当大的偏移并不少见。这种剂量取决于许多变量而改变,不限于使用的化合物的活性、待治疗的疾病或病症、施用方式、个体受试者的要求、正治疗的疾病或病症的严重性,以及从业者的判断。
[0422]
在一些实施方式中,这种治疗方案的毒性和治疗功效通过细胞培养或实验动物中的标准药物程序确定,包括但不限于ld50(对50%群体致死的剂量)和ed50(在50%的群体中治疗有效的剂量)。毒性作用与治疗作用之间的剂量比是治疗指数,并且用ld50和ed50之间的比表达。优选展示出高治疗指数的化合物。从细胞培养试验和动物研究中获得的数据用于制定一系列用于人的剂量。这种化合物的剂量优选地位于以最小毒性包括ed50的循环浓度范围内。剂量在该范围内变化,这取决于所采用的剂型和所利用的施用途径。
[0423]
试剂盒/制品
[0424]
在一些实施方式中,本文公开了与本文所述的一种或多种组合物和方法使用的试剂盒和制品。这种试剂盒包括载体、包装或容器,其被隔开以容纳一个或多个容器,例如小瓶、管等,每个容器包括用于本文所述的方法的单独元件之一。合适的容器包括,例如瓶子、小瓶、注射器和试管。在一些实施方式中,容器由各种材料比如玻璃或塑料形成。
[0425]
本文提供的制品含有包装材料。药物包装材料的示例包括但不限于泡罩包装、瓶子、管、袋、容器、瓶子和任何适用于选定制剂和预期施用和治疗模式的包装材料。
[0426]
例如,容器包括本文公开的抗gal3抗体、用于产生本文所述的一种或多种抗体的宿主细胞和/或包括编码本文所述抗体的核酸分子的载体。这种试剂盒任选地包括与其在本文所述的方法中的使用相关的识别说明或标签或指令。
[0427]
试剂盒通常包括列出内容和/或使用说明的标签,以及具有使用说明的包装说插
页。通常还将包括一组说明。
[0428]
在一些实施方式中,标签在容器上或与容器相关。在一些实施方式中,当形成标签的字母、数字或其他字符被附着、模制或蚀刻到容器本身中时,标签位于容器上;当标签存在于也容纳容器的贮器或载体中时,标签与容器相关,例如作为包装插页。在一些实施方式中,标签用于指示内容物将用于特定治疗应用。标签还指示比如在本文所述的方法中使用内容物的指导。
[0429]
在一些实施方式中,药物组合物存在于包含一种或多种含有本文提供的化合物的单位剂型的包装或分配器装置中。例如,包装含有金属或塑料箔,例如泡罩包装。在一些实施方式中,包装或分配器装置附有施用说明。在一些实施方式中,包装或分配器还附有与容器相关的通知,该通知以管理药物制剂的制造、使用或销售的政府机构规定的形式,该通知反映了该机构对用于人或兽医施用的药物形式的批准。例如,这种通知是美国食品和药物管理局批准的处方药物标签或批准的产品插页。在一些实施方式中,还制备含有在相容的药物载体中配制的本文提供的化合物的组合物,将其置于合适的容器中,并且标记用于治疗指定病症。
[0430]
纤维化生物标志物
[0431]
在一些实施方式中,纤维化的特征在于一种或多种生物标志物,比如胶原蛋白、细胞外基质(ecm)分子和酶、细胞因子、蛋白质组学标志物或遗传标志物。在一些情况下,纤维化生物标志物包括但不限于胶原蛋白(i、iii和iv)、前胶原n
‑
末端肽、纤连蛋白、弹性蛋白、层粘连蛋白、α
‑
平滑肌肌动蛋白(α
‑
sma)、透明质酸(ha)、蛋白聚糖、ykl
‑
40、timp
‑
1、timp
‑
2、mmp
‑
2、mmp
‑
9、tgfβ、tnfα、血管紧张素
‑
ii、微原纤维相关蛋白4(mfap
‑
4)、原肌球蛋白、azin1的snp、tlr4、trpm5、aqp2或stxbp5l。某些生物标志物的表达或缺失与一种或多种纤维化疾病相关。当用抗
‑
gal3抗体治疗时,这种生物标志物的增加或减少可指示组织纤维化的减少。
[0432]
在一些实施方式中,纤维化生物标志物是α
‑
平滑肌肌动蛋白(α
‑
sma)。α
‑
sma是在血管平滑肌细胞中占主导地位并且参与纤维发生的42kda肌动蛋白同种型。肌成纤维细胞是已经部分地分化为平滑肌表型的成纤维细胞的形式。特别地,肌成纤维细胞可以通过使用包括α
‑
sma的细胞骨架蛋白收缩。在几种纤维化疾病中,已经观察到肌成纤维细胞的积累,导致细胞外基质的扩张。因此,α
‑
sma的表达改变(例如,表达升高)与肌成纤维细胞的激活相关,并且在其他情况下,可用作纤维化生物标志物。
[0433]
在一些实施方式中,纤维化生物标志物是纤连蛋白。纤连蛋白是细胞外基质内的高分子量(~440kda)糖蛋白,并且进一步结合至整联蛋白、胶原、纤维蛋白和硫酸乙酰肝素蛋白聚糖。纤连蛋白在细胞粘附、生长、迁移和分化中起主要作用,并且在众多功能之中进一步参与伤口愈合。纤连蛋白可以是可溶性血浆纤连蛋白或不溶性细胞纤连蛋白,并且可以是i型、ii型或iii型。纤连蛋白的表达改变(例如,表达降低)与纤维化相关。
[0434]
在一些实施方式中,纤维化生物标志物是转化生长因子(tgf)
‑
β1。tgf
‑
β1是细胞因子的tgf
‑
β超家族的多肽成员,tgf
‑
β1参与细胞生长、细胞增殖、细胞分化和细胞凋亡。此外,胶原产生细胞,例如成纤维细胞,被纤维发生细胞因子比如tgf
‑
β1激活。在纤维化背景下,tgf
‑
β1被认为是ecm合成的主要调节剂和有效诱导剂。而且,tgf
‑
β1由各种细胞比如巨噬细胞、嗜中性粒细胞、活化的肺泡上皮细胞、内皮细胞、成纤维细胞和肌成纤维细胞产生。
tgf
‑
β1的激活导致促炎症性反应和纤维发生细胞因子比如tnf
‑
α、pdgf、il
‑
1β和/或il
‑
13的表达增强,进一步增强和维持纤维化反应。
[0435]
在一些实施方式中,向感兴趣的组织位点施用抗gal3抗体调节一种或多种纤维化生物标志物的存在和/或表达。在一些实施方式中,抗gal3抗体改变选自胶原(i、iii和iv)、前胶原n
‑
末端肽、纤连蛋白、弹性蛋白、层粘连蛋白、α
‑
平滑肌肌动蛋白(α
‑
sma)、透明质酸(ha)、蛋白聚糖、ykl
‑
40、timp
‑
1、timp
‑
2、mmp
‑
2、mmp
‑
9、tgfβ、tnfα、血管紧张素
‑
ii、微原纤维相关蛋白4(mfap
‑
4)、原肌球蛋白、azin1的snp、tlr4、trpm5、aqp2和stxbp5l的一种或多种纤维化生物标志物的存在或不存在或表达。在一些实施方式中,抗gal3抗体改变α
‑
sma、纤连蛋白、tgf
‑
β1或其组合的存在或不存在或表达。在一些实施方式中,在感兴趣的组织位点施用抗gal3抗体导致α
‑
sma表达的降低。在一些实施方式中,在感兴趣的组织位点施用抗gal3抗体导致纤连蛋白表达的增加。在一些实施方式中,在感兴趣的组织位点施用抗gal3抗体导致tgf
‑
β1表达降低。
[0436]
在一些实施方式中,利用一种或多种纤维化生物标志物来监测纤维化的存在或不存在,或纤维化的进展。
[0437]
在一些情况下,本文公开的纤维化生物标志物的表达降低可指示组织纤维化的降低。
[0438]
在一些情况下,用抗gal3抗体治疗的组织中至少一种纤维化生物标志物的表达不同于用对照抗体治疗的对照组织中的至少一种纤维化生物标志物的表达。在一些情况下,对照抗体是不结合以上所述的一个或多个表位和/或不破坏gal3和tim
‑
3之间相互作用的抗gal3抗体。在一些情况下,对照抗体是igg2b抗体,例如鼠igg2b(migg2b)抗体。在一些情况下,用抗gal3抗体治疗的组织中至少一种纤维化生物标志物的表达低于用migg2b抗体治疗的对照组织中至少一种纤维化生物标志物的表达。
[0439]
纤维化疾病
[0440]
在一些实施方式中,抗gal3抗体可以被施用以治疗一种或多种纤维化疾病。纤维化疾病可以是肝纤维化。纤维化疾病可以是肺纤维化。纤维化疾病可以是囊性纤维化、特发性肺纤维化、骨髓纤维化、间质性肺病、肝纤维化、进行性大量纤维化、肝硬化、肾纤维化、心脏纤维化、肺炎、肺纤维化、胰腺纤维化、骨髓纤维化、肠道纤维化、关节纤维化、视网膜纤维化、丙型肝炎相关纤维化或肾原性全身性纤维化。
[0441]
在一些情况下,抗gal3抗体可以被施用至与α
‑
sma或纤连蛋白的表达相关的纤维化疾病。与增加的α
‑
sma相关的纤维化疾病可以是肾纤维化、肝纤维化、肝硬化、丙型肝炎相关纤维化、心脏纤维化、肺纤维化、间质性肺病、特发性肺纤维化、肺炎、骨髓纤维化、关节纤维化、视网膜纤维化或肾原性全身性纤维化。与纤连蛋白表达相关的纤维化疾病可以是囊性纤维化、肺纤维化、特发性肺纤维化、骨髓纤维化、间质性肺病、肝纤维化、进行性大量纤维化、肝硬化、肾纤维化、心脏纤维化、肺炎、肺纤维化、胰腺纤维化、骨髓纤维化、肠道纤维化、关节纤维化、视网膜纤连蛋白、丙型肝炎相关纤维化或肾原性全身性纤维化。
[0442]
治疗的受试者可被诊断具有纤维化疾病。在一些实施方式中,治疗的受试者可以是人、大鼠、小鼠或其他动物。在一些实施方式中,治疗的受试者可以是哺乳动物。在一些实施方式中,哺乳动物可以是人。哺乳动物可以是灵长类动物。灵长类动物可以是黑猩猩或大猩猩。
[0443]
在一些实施方式中,抗gal3抗体结合至gal3蛋白质内特定表位。在一些情况下,抗gal3抗体可结合至对应于seq id no:1(hgal3)的残基2
‑
21的gal3区域内至少1、2、3、4、5、6、10、15或20个氨基酸残基。在一些实施方式中,抗gal3可结合至对应于seq id no:1的残基42
‑
71的至少1、2、3、4、5、6、10、15或20个氨基酸残基。在其他实施方式中,抗gal3可结合至对应于seq id no:1的残基42
‑
91的至少1、2、3、4、5、6、10、15、20、30、40或50个氨基酸残基。可替选地,抗gal3抗体可结合至对应于seq id no:1的残基72
‑
91的至少1、2、3、4、5、6、10、15或20个氨基酸残基。在一些情况下,抗gal3抗体可结合至对应于残基2
‑
21和42
‑
71;42
‑
91;2
‑
21和72
‑
91或2
‑
21和42
‑
91的一个或多个残基处的gal3。gal3和tim
‑
3序列是表1中列出的。
[0444]
[0445][0446]
在一些实施方式中,抗gal3抗体可结合至表2中阐释的(和图11a中显示的)肽内至少1、2、3、4、5、6、10、15或20个氨基酸残基。
[0447][0448]
在一些实施方式中,抗gal3抗体可结合至肽_1(seq id no:3)、肽_5(seq id no:4)、肽_6(seq id no:5)或肽_8(seq id no:6)内的至少1、2、3、4、5、6、10、15或20个氨基酸残基。在一些实施方式中,抗gal3抗体可结合至肽_1(seq id no:3)内的至少1、2、3、4、5、6、10、15或20个氨基酸残基。在一些实施方式中,抗gal3抗体可结合至肽_5(seq id no:4)内的至少1、2、3、4、5、6、10、15或20个氨基酸残基。在一些实施方式中,抗gal3抗体可结合至肽_6(seq id no:5)内的至少1、2、3、4、5、6、10、15或20个氨基酸残基。在一些实施方式中,抗gal3抗体可结合至肽_8(seq id no:6)内的至少1、2、3、4、5、6、10、15或20个氨基酸残基。
[0449]
在一些实施方式中,抗gal3抗体进一步破坏gal3和tim
‑
3之间的相互作用。tim
‑
3是免疫细胞上,尤其t细胞上表达的分子并且可通过与gal3的相互作用抑制免疫应答,例如,t细胞信号传导。
[0450]
在一些实施方式中,基于其中gal3和tim
‑
3相互作用发生的界面设计gal3
‑
tim
‑
3抗体。gal3上的相互作用可发生在选自区域145
‑
168、149
‑
168、160
‑
177和/或165
‑
184的一个或多个残基处,其中区域对应于seq id no:1的位置145
‑
168、149
‑
168、160
‑
177和165
‑
184。在一些实施方式中,gal3上的相互作用可发生在区域145
‑
177内的一个或多个残基处,其中区域145
‑
177对应于seq id no:1的位置145
‑
177。相互作用可发生在区域160
‑
184内的
一个或多个残基处,其中区域160
‑
184对应于seq id no:1的位置160
‑
184。在一些实施方式中,相互作用可发生在区域145
‑
184内的一个或多个残基,其中区域145
‑
184对应于seq id no:1的位置145
‑
168。
[0451]
在一些实施方式中,gal3
‑
tim
‑
3抗体破坏gal3和tim
‑
3之间的相互作用,其中gal3上的相互作用涉及选自seq id no:1的区域145
‑
168、149
‑
168、160
‑
177和/或165
‑
184一个或多个残基。gal3上的相互作用可发生在seq id no:1的区域145
‑
177内的一个或多个残基处。相互作用可发生在seq id no:1的区域160
‑
184内的一个或多个残基处。相互作用可发生在seq id no:1的区域145
‑
184内的一个或多个残基处。
[0452]
在一些实施方式中,相互作用可发生在选自区域149
‑
156、152
‑
171、152
‑
169、152
‑
168、163
‑
169或163
‑
171的gal3的一个或多个残基处,其中区域对应于seq id no:1的位置149
‑
156、152
‑
171、152
‑
169、152
‑
168、163
‑
169和163
‑
171。在一些实施方式中,gal3
‑
tim
‑
3抗体破坏gal3和tim
‑
3之间的相互作用,其中gal3上的相互作用涉及选自区域149
‑
156、152
‑
171、152
‑
169、152
‑
168、163
‑
169或163
‑
171的一个或多个残基,其中区域对应于seq id no:1的位置149
‑
156、152
‑
171、152
‑
169、152
‑
168、163
‑
169和163
‑
171。相互作用可发生在选自区域149
‑
156的gal3的一个或多个残基处,其中区域对应于seq id no:1的位置149
‑
156。相互作用可发生在区域163
‑
169内gal3的一个或多个残基处,其中区域对应于seq id no:1的位置163
‑
169。相互作用可发生在区域163
‑
171内gal3的一个或多个残基处,其中区域对应于seq id no:1的163
‑
171。相互作用可发生在区域152
‑
169内gal3的一个或多个残基处,其中区域对应于seq id no:1是位置152
‑
169。相互作用可发生在区域152
‑
171内gal3的一个或多个残基处,其中区域对应于seq id no:1的位置152
‑
171。相互作用可发生在区域163
‑
171内gal3的一个或多个残基处,其中区域对应于seq id no:1的位置163
‑
171。
[0453]
在一些实施方式中,gal3
‑
tim
‑
3抗体破坏gal3和tim
‑
3之间的相互作用,其中gal3上的相互作用涉及选自seq id no:1的区域149
‑
156、152
‑
171、152
‑
169、152
‑
168、163
‑
169或163
‑
171的一个或多个残基。相互作用可发生在seq id no:1的区域149
‑
156内gal3的一个或多个残基处。相互作用可发生在seq id no:1的区域163
‑
169内gal3的一个或多个残基处。相互作用可发生seq id no:1的区域163
‑
171内gal3的一个或多个残基处。相互作用可发生在seq id no:1的区域152
‑
169内gal3的一个或多个残基处。相互作用可发生在seq id no:1的区域152
‑
171内gal3的一个或多个残基处。相互作用可发生在seq id no:1的区域163
‑
171内gal3的一个或多个残基处。
[0454]
gal3
‑
tim
‑
3抗体可与在本文所述的位置处与tim
‑
3面接的gal3区域内的至少1、2、3、4、5、6、10、15、20、30或40个氨基酸残基相互作用。
[0455]
tim
‑
3上的相互作用可发生在对应于位置72
‑
104和/或64
‑
93的一个或多个残基处,其中残基对应于seq id no:2的位置90
‑
122和82
‑
111。可替选地,tim
‑
3上的相互作用可发生在位置91
‑
111、107
‑
117、96
‑
102、100
‑
106和/或92
‑
119的一个或多个残基处,其中残基对应于seq id no:2的位置91
‑
111、107
‑
117、96
‑
102、100
‑
106和92
‑
119。tim
‑
3上的相互作用可发生在位置91
‑
117、91
‑
119、96
‑
117、100
‑
117或96
‑
106处的一个或多个残基处。gal3
‑
tim
‑
3破坏抗体可被设计与在本文所述的位置处与gal3面接的tim
‑
3区域内的至少1、2、3、4、5、6、10、15、20、30或40个氨基酸残基相互作用。
[0456]
在一些情况下,相互作用可发生在选自seq id no:1的区域149
‑
156、152
‑
168、
163
‑
169和/或163
‑
171的gal3的一个或多个残基处;并且一个或多个残基对应于seq id no:2的位置90
‑
122和/或82
‑
111。相互作用可发生在选自seq id no:1的区域149
‑
156、152
‑
168、163
‑
169和/或163
‑
171的gal3的一个或多个残基处;并且在seq id no:2的位置91
‑
111、107
‑
117、96
‑
102、100
‑
106和/或92
‑
119的一个或多个残基处。gal3上的相互作用可发生在选自seq id no:1的区域145
‑
168、160
‑
177和/或165
‑
184的一个或多个残基处;并且一个或多个残基对应于seq id no:2的位置90
‑
122和/或82
‑
111。gal3上的相互作用可发生在选自seq id no:1的区域145
‑
168、160
‑
177和/或165
‑
184的一个或多个残基处;并且在seq id no:2的位置91
‑
111、107
‑
117、96
‑
102、100
‑
106和/或92
‑
119的一个或多个残基处。gal3
‑
tim
‑
3破坏抗体可被设计与在本文所述的位置处彼此面接的gal3区域上和tim
‑
3上的至少1、2、3、4、5、6、10、15、20、30或40个氨基酸残基相互作用。
[0457]
对于本文提供的任何实施方式,使用的抗gal3抗体可用另一抗gal3抗体代替。该抗gal3抗体可选自由以下组成的组:2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8和mimt001(imt001)。该抗gal3抗体可以是2d10.2b2、3b11.2g2、4a11.2b5、4g2.2g6、6h6.2d6、7d8.2d8、12g5.d7、13a12.2e5、13g4.2f8、13h12.2f8、14h10.2c9、15f10.2d6、15g7.2a7、19b5.2e6、19d9.2e5、20d11.2c6、20h5.a3、23h9.2e4、24d12.2h9、846.1f5、846.2h3、846t.1h2、9h2.2h10、imt001
‑
4、imt006
‑
1、imt006
‑
5、imt006
‑
8或mimt001,或其任何组合。该抗gal3抗体可以是mimt001。该抗gal3抗体可以是除了mimt001之外的抗体。该抗gal3抗体可以是4a11.2b5。该抗gal3抗体可以是imt001
‑
4、imt006
‑
1、imt006
‑
5或imt006 8的一种或多种。该抗gal3抗体可以是4a11.2b5。该抗gal3抗体可以是一种imt001
‑
4。该抗gal3抗体可以是imt006
‑
1。该抗gal3抗体可以是imt006
‑
5。该抗gal3抗体可以是imt006
‑
8。在一些实施方式中,抗体包括任何一种或多种这些抗体的一个或多个cdrs、vh和/或vl。
实施例
[0458]
在以下实施例中更详细地公开了以上讨论的实施方式的一些方面,这些实施例不以任何方式旨在限制本公开的范围。本领域技术人员将理解,许多其他实施方式也落入本发明的范围内,如以上本文和权利要求中描述的。
[0459]
实施例1:gal3
‑
过度表达细胞系的生成
[0460]
a20,小鼠b淋巴瘤细胞系,获得自美国组织和细胞培养物保藏中心(atcc,manassas,va),用编码flag标记的人gal3蛋白质或flag标记的人pdl1蛋白质的核酸构建体转染。构建体另外含有抗生素抗性标志物。基于抗生素抗性选择转化的细胞以产生稳定表达flag标记的人gal3蛋白质的a20细胞(a20 gal3细胞)或稳定表达flag标记的人pdl1蛋白质的a20细胞(a20 hpdl1细胞)。
[0461]
实施例2:gal3特异性结合至tim
‑3[0462]
该实施例描述了为评估gal3和tim
‑
3之间的相互作用而进行的各种测定。
[0463]
结合测定
‑
免疫共沉淀
[0464]
进行免疫共沉淀实验以测试tim
‑
3是否与gal3特异性相互作用。293t细胞用编码
ha标记的tim
‑
3的质粒和编码flag标记的gal3、flag标记的gal9或flag标记的ceacam1的质粒共转染。按照制造商的方案使用lipofectamine 3000(waltham,ma)进行转染。使转染的细胞生长过夜,并且然后在1ml裂解缓冲液中洗涤和裂解。将裂解的细胞离心并且收集上清液(裂解物)。制备裂解物并在sds page上分离,并且分别用抗ha(图1a)和抗flag抗体(图1b)探测。抗flag和抗ha抗体都购买自sigma。图1a和图1b中的箭头指示各种蛋白质的存在。
[0465]
对于免疫沉淀,将抗flag琼脂糖珠子(abcam,cambridge,ma)添加至以上产生的上清液(裂解物)中。通过在4℃旋转过夜来孵育珠子和裂解物,以允许flag标记的蛋白质附着。然后用裂解缓冲液洗涤珠子3x并且与1x sds page样品缓冲液混合、煮沸并且在sds
‑
page上分离。将sds
‑
page凝胶转移至用ant
‑
ha抗体探测的膜上(图1c)。在图1a
‑
c中,泳道1
‑
3分别表示从用编码ha标记的tim
‑
3的质粒和编码flag标记的gal3的质粒共转染的细胞、用编码ha标记的tim
‑
3的质粒和编码flag标记的gal9的质粒共转染的细胞或用编码ha标记的tim
‑
3的质粒和编码flag标记的ceacam1的质粒共转染的细胞产生的裂解物的结果。
[0466]
结果,如图1a
‑
c中显示的,指示人gal3特异性地拉下人tim
‑
3,而人ceacam1不能拉下ha标记的人tim
‑
3。尽管似乎人gal9也拉下人tim
‑
3(图1c的泳道2),但由于gal9蛋白质聚集,这似乎是非特异性的
–
gal9的分子量似乎远大于其40kda的实际大小。gal9和tim
‑
3之间的相互作用本质上是非特异性的结论也由以下图5b中显示的证据支持。
[0467]
进行另外的免疫共沉淀实验以测试gal3是否与tim
‑
3特异性相互作用。flag
‑
人gal3质粒(origene,rockville,md)被转染入293t细胞中,其是以80%汇合度(confluency)。如以上所述,使用lipofectamine 3000在10cm板中进行转染。转染过夜后,在已经用人fc、人pd1
‑
fc或人tim
‑
3fc涂覆3小时的10cm板上替换细胞。细胞在1xpbs中洗涤一次,并且然后在1ml裂解缓冲液中裂解。收集并且离心细胞裂解物。将蛋白g珠子添加至离心后形成的上清液中,并且在4℃旋转孵育4小时。然后珠子用裂解缓冲液洗涤3x,随后添加1x sds page样品缓冲液。将含有珠子的样品煮沸并且在sds
‑
page上分离,转移至膜上。然后用ant
‑
flag抗体探测膜。如图2中显示的,人tim
‑
3特异地拉下flag标记的gal3。相反地,人fc和人pd1 fc都不能拉下tim
‑
3。这显示gal3不结合至fc或pd1 fc,并且gal3和tim
‑
3之间的结合是特异性的。
[0468]
结合测定
–
细胞粘附测定
[0469]
接下来,进行细胞粘附测定以确认gal3和tim
‑
3的结合。在本实验中,在4℃用人fc、人pd1
‑
fc、人vista
‑
fc、人tim
‑3‑
fc涂覆96孔板过夜,然后用pbs中的2%bsa在37℃阻断2小时。将a20、过表达人gal3的a20细胞(a20 gal3)或过表达人pdl细胞的a20细胞(a20 pdl1)接种入用以上描述的各种fc蛋白质涂覆的孔中。然后以720rpm离心板,然后停止。在37℃孵育板30分钟,并且然后浸入pbs中。将板缓慢翻转180度并且保持在翻转位置30分钟。将板翻转回来并且从pbs中取出后,取出来自每个孔中的200μl溶液并且丢弃,以及将剩余的溶液(体积约100μl)转移入96孔板中。通过流式细胞术分析计数细胞。
[0470]
结果(图3)显示,附着至人tim
‑
3fc涂覆的板的表达人gal3的a20(a20 gal3)细胞的数量显著大于附着至用人vista fc或人pd1 fc涂覆的板上的那些。如预期的,由于pdl1是pd1的已知配体,显示附着至hpd1fc的a20pdl1细胞的数量显著大于附着至用人vista fc或人tim
‑
3fc涂覆的板的那些。这些结果进一步确认了gal3和tim
‑
3之间的相互作用是特异性的。
[0471]
阻断测定—流式细胞术
[0472]
使用a20细胞进行流式细胞术分析以评估tim
‑
3和gal3之间的结合。a20 gal3细胞用含有或不含有小鼠tim
‑
3fc的10%fbs hbss溶液在冰上孵育20分钟。有五个实验组:在第1组中,a20 gal3细胞在没有mtim
‑
3fc蛋白质的情况下孵育,作为对照;在第2组中,a20 gal3细胞在有mtim
‑
3fc蛋白质的情况下孵育;在第3、4、5组中,除了mtim
‑
3fc蛋白质之外,也添加抗小鼠tim
‑
3多克隆抗体(r&d system,minneapolis,mn)(第3组)、单克隆抗体rmt3
‑
23(bio x cell,west lebanon,nh)(第4组)、单克隆抗体215015(r&d systems)(第5组)以测试这些抗体是否可以阻断gal3和tim
‑
3的结合。为了阻断,将细胞用含有提到的抗体的10%fbs hbss孵育,然后添加含有mtim
‑
3fc的10%fbs hbss 20分钟。将样品离心并且小球被添加含有apc缀合的抗hfc抗体(jackson immunoresearch,west grove,pa)的10%fbs hbss 20分钟。旋转后,活/死细胞用紫罗兰死细胞染色试剂盒(life technologies)染色。对染色的细胞进行流动分析。
[0473]
图4显示了mtim
‑
3能够结合至死细胞和活细胞上的gal 3蛋白质,并且gal3和死细胞结合tim
‑
3上的不同表位。图4a显示了通过流式细胞术分析活的a20细胞(左侧的峰)和死的a20细胞(右侧的峰)。在该测定中,tim
‑
3fc结合死细胞(图4c,第2行)和在活细胞上表达的gal3(图4b,第2行)。然而,mtim
‑
3单克隆抗体rmt3
‑
23阻断了tim
‑
3与死细胞的结合(图4c,第4行),但不阻断tim
‑
3与活细胞上表达的gal3的结合(图4b,第4行)。这显示了gal3和死细胞结合至tim
‑
3上的不同表位。作为对照,mtim
‑
3多克隆抗体和单克隆抗体215015(r&d system,minneapolis,mn)分别对tim
‑
3结合至gal3(图4b,第3行和第5行)或死细胞(图4c,第3行和第5行)不具有任何作用。
[0474]
阻断测定
–
elisa
[0475]
还进行了elisa测定以测试gal3和tim
‑
3之间的相互作用。将96孔elisa板(thermofisher scientific)用pbs中的小鼠gal3蛋白质(biolegend,san diego,ca)或pbs中的人gal9蛋白质(r&d systems)或乙醇中的磷脂酰丝氨酸(ps)(sigma)涂覆,并且在4℃孵育过夜。用tbst洗涤三次板,并且然后在室温用含有2%bsa的pbs缓冲液阻断1小时。在图5a中,不同抗gal3抗体,即mgal3多克隆抗体(r&d systems)、mab imt001(也在wo 2019/023247中描述的,特此通过引用以其整体明确地并入)、mab m3/38(thermofisher scientific)(图5a),被添加至已经用gal3涂覆的孔中。将抗体孵育10分钟,并且然后将小鼠tim
‑
3fc添加至板中,并且孵育另外一小时孵育。然后洗涤板三次,并且随后在室温与抗人
‑
igg
‑
hrp(jackson immunoresearch)一起孵育1h。用tbst洗涤三次后,用tmb消减(subtract)(genetex,irvine,ca)显现颜色,并且用1n hcl终止反应。在450nm处读取光密度(od)。结果表达为重复的平均od
±
sd。图5a中的结果显示,在所有测试的抗体中,小鼠gal3多克隆抗体和单克隆抗体imt001阻断了gal3和tim
‑
3之间的相互作用(图5a)。
[0476]
在图5b中,将pbs中的小鼠gal3蛋白质(biolegend)(第1组和第2组)或乙醇中的ps(sigma
‑
aldrich,st.louis,mo)(第3组和第4组)涂覆在板上,并且在4℃孵育过夜。将抗mtim
‑
3小鼠抗体,mab rmt3
‑
23(bio x cell)添加至涂覆板中,仅用于第2组和第4组。如以上所述添加第二抗人
‑
igg
‑
hrp抗体和底物以检测mtim
‑
3与mgal3或ps的结合。结果显示了与第3组相比,第4组中的信号显著降低,指示了rmt3
‑
23阻断ps与tim
‑
3的结合;同时,结果显示了与第1组相比,第2组的信号没有显著降低,指示了rmt3
‑
23没有阻断gal3与tim
‑
3的
结合。由于tim
‑
3通过其与外化且暴露在死细胞表面上的ps的相互作用结合至死细胞,这些实验证实了图4a
‑
图4c中的观察,gal3和ps结合至tim
‑
3上的不同表位。
[0477]
对于糖依赖性测定,用mgal3(第1组和第2组)或hgal9(第3组和第4组)涂覆elisa板。在室温将小鼠tim
‑
3fc蛋白质(r&d systems)添加至用(第2组和第4组)或不用(第1组和第3组)25mm的α
‑
乳糖(sigma
‑
aldrich)涂覆的elisa板1h。如以上所述添加第二抗人
‑
igg
‑
hrp抗体和底物以检测mtim
‑3‑
fc与mgal3或hgal9的结合。图5c显示了乳糖阻断了gal9与tim
‑
3的结合,如与第3组(不存在乳糖)相比,第4组(存在乳糖)中的信号显著降低10倍以上所显示的,指示gal9和tim
‑
3之间的糖依赖性结合。相反地,虽然乳糖对gal3与tim
‑
3的结合的阻断作用是最小的,但从第2组(存在乳糖)和第1组(不存在乳糖)之间tim
‑
3和gal3的结合产生的信号中没有显著性差异。这显示gal3和tim
‑
3之间的相互作用受糖的存在影响,即相互作用是糖不依赖的。
[0478]
实施例3:过度表达的gal3抑制t细胞激活
[0479]
本实施例描述了为评估a20细胞中gal3的过表达的功能性质而进行的实验。
[0480]
如以上所述产生稳定过表达hgal3的a20克隆#41、#31和#15。图6a显示了流式细胞术分析的结果,显示了这些克隆中的hgal3表达水平。a20或a20gal3克隆的细胞与小鼠do11.10 t细胞混合。将混合物放置于平坦的96孔板的每个孔中,并且然后将ova323
‑
339肽(invivogen,san diego,ca)添加至板中。孵育过夜后,上清液用于通过elisa(thermo fisher scientific)测量t细胞的il
‑
2产生。如图6b中显示的,与当t细胞与亲本a20细胞混合时相比,当与三种小鼠a20细胞克隆中的任何一种混合时,小鼠do11.10 t细胞产生的il
‑
2显著降低(图6b)。
[0481]
实施例4:在小鼠肺转移模型中抗gal3抗体显示抗肿瘤活性
[0482]
进行该实施例中的实验以评估体内gal3:tim
‑
3抑制剂的抗肿瘤功效。根据由分子医学研究所机构动物护理和使用委员会批准的方案进行动物实验。c57bl/6小鼠抵达后被放置在由实验动物护理评估和认证协会认可的设施中。将三十六只7周龄雌性小鼠随机分为三组(n=12)。在第0天,将b16f10细胞(在0.1ml pbs中2x105个)洗涤并且在pbs中再悬浮,然后使用具有27
‑
ga针头的注射器注射入小鼠的尾静脉中。注射b16f10细胞后,在第0、3、7和10天用10mg/kg的小鼠igg2b(bio x cell,west lebanon,nh),在第0、3、7天用10mg/kg的mpd1抗体(bio x cell,west lebanon,nh)或在第0、3、7、10和15天用10mg/kg的gal3抗体imt001向动物腹膜内施用。该实验中使用的gal3抗体克隆imt001识别对应于gal3上的肽_5(pgaypgqappgaypgqappg,seq id no:7)的表位。在第21天,人道处死动物,并且取出肺组织且固定在10%缓冲的甲醛溶液中。计数肺中的左叶的一个表面上黑色转移集落数(图7b)。结果表示为均值
±
sem。使用单向anova与igg对照组比较进行统计分析。
[0483]
图7a显示了用抗
‑
mgal3抗体染色的b16f10细胞的平均荧光强度(mfi)比用同种型对照抗体染色的细胞高近十倍。详细地,将b16f10细胞用含有对照大鼠igg pe或大鼠抗小鼠gal3pe抗体(thermo fisher scientific,waltham,ma)的10%fbs hbss溶液在冰上孵育20分钟。旋转后,活/死细胞用紫罗兰死细胞染色试剂盒(thermo fisher scientific,waltham,ma)染色。对染色的细胞进行流动分析。图7b显示了来自三个治疗组的整个肺的代表性图像。图7c显示了左肺叶表面上转移集落数(均值
±
sem)。图7d和图7e显示了不同治疗组的肺重和体重(均值
±
sem)。与同种型对照组相比,gal3抗体治疗组显示了肿瘤数量显著
(约46%)减少(p<0.01),如黑色转移集落数指示的。然而,与同种型对照组相比,抗小鼠pd1抗体29f在该肺转移模型中没有显示出显著的抗肿瘤作用(p>0.05)。
[0484]
实施例5:在4t1原位肿瘤诱导的肺转移模型中抗gal3抗体显示出抗肿瘤活性
[0485]
动物实验遵循分子医学研究所机构动物护理和使用委员会批准的方案。7周龄的雌性balb/c小鼠抵达后被放置在由实验动物护理评估和认证协会认可的设施中。在肿瘤植入当天,收集4t1细胞、洗涤并且再悬浮在pbs中。通过吸入麻醉剂(医用级空气中3%至5%异氟烷)麻醉小鼠。通过使用具有25
‑
ga针头的注射器将0.1ml pbs中的2x105个细胞皮下注入乳腺中。小鼠被随机分为两组(n=10)。注射4t1细胞后,在第0、3和7天用10mg/kg的小鼠igg2b(bio x细胞)或在第0、3、7、10和14天用10mg/kg的gal3抗体imt001向小鼠腹膜内注射。每周两次监测肿瘤体积和体重。在第30天,小鼠被人道处死,并且肺组织用30%蔗糖膨胀,取出并且固定在bouin溶液(sigma
‑
aldrich)中。计数肺左叶一个表面上的转移集落数。结果表示为均值
±
sem。使用非配对t检验与igg对照组比较进行统计分析。
[0486]
图8a显示了来自治疗组的整个肺的代表性图像。图8b显示了不同治疗组的体重(均值
±
sem)。图8c显示了左肺叶一个表面上的转移集落数(均值
±
sem)。与用同种型对照抗体治疗的小鼠相比,用单克隆抗人gal3抗体治疗的动物显示肺转移数的显著减少(p<0.05)。
[0487]
实施例6:在原发性小鼠renca肾肿瘤模型中抗gal3抗体显示出抗肿瘤活性
[0488]
进行实验以评估gal3:tim
‑
3抑制剂在原发性肿瘤模型中的抗肿瘤功效(图9)。动物实验是根据由分子医学研究所机构动物护理和使用委员会批准的方案进行的。balb/c小鼠抵达后被放置在由实验动物护理评估和认证协会认可的设施中。七周龄的雌性小鼠被随机分为三组(n=15)。在肿瘤植入当天,通过吸入麻醉剂(医用级空气中的3%至5%异氟烷)麻醉小鼠。洗涤renca细胞并且再悬浮在pbs中,然后使用具有25
‑
ga针头的注射器皮下注入0.1ml pbs中的2x105个细胞。注射renca细胞后,在第0、3和7天用10mg/kg的小鼠igg2b(bio x cell)或mpd1抗体(bioxcell)或在第0、3、7、10和14天用gal3抗体imt001抗体向小鼠腹腔内注射。当对照组中的肿瘤体积达到2000
‑
2500mm3之间时,动物被人道处死。结果表示为均值
±
sem。使用未配对t检验与igg2b对照组比较进行统计分析。
[0489]
结果显示了在肾癌模型中gal3抗体(imt001)的抗肿瘤活性。与同种型对照组相比,抗gal3抗体治疗组显示出肿瘤生长的显著(约35%)减少(p<0.05),而抗pd
‑
1抗体没有作用(图9)。
[0490]
实施例7:在原发性小鼠mc38 colon肿瘤模型中抗gal3抗体显示出抗肿瘤活性
[0491]
动物实验遵循分子医学研究所机构动物护理和使用委员会批准的方案。7周龄的雌性c57bl/6小鼠抵达后被放置在由实验动物护理评估和认证协会认可的设施中。在肿瘤植入当天,收集mc38鼠结肠腺癌细胞、洗涤并且再悬浮在pbs中。通过吸入麻醉剂(医用级空气中的3%至5%异氟烷)麻醉小鼠。使用具有25
‑
ga针头的注射器将0.1ml pbs中的5x105个细胞皮下注入小鼠的右侧。在第7天,测量肿瘤体积并且将小鼠随机分为两组(n=8)。在第7、10、14、17和22天用10mg/kg小鼠igg2b(bioxcell)或gal3抗体imt001向小鼠腹膜内施用。每周两次监测肿瘤体积和体重。当肿瘤体积达到3000mm3时,人道处死动物。结果表示为均值
±
sem。使用非配对t检验与igg对照组比较进行统计分析。
[0492]
图10中的结果显示在mc38结肠癌模型中imt001抗体具有抗肿瘤活性。与用同种型
对照抗体治疗的小鼠相比,imt001抗体治疗的小鼠在第24天显示了肿瘤负荷的显著降低(约33%)(p<0.05)。
[0493]
实施例8:gal3抗体克隆imt001的表位结合
[0494]
合成了由10个氨基酸重叠并且覆盖整个人gal3蛋白质序列的含有2420氨基酸肽的肽阵列(genscript,piscataway,nj)(图11a)。将20μg的每种肽斑点印迹到膜上。用pbs中的5%的奶阻断后,将膜与1ug/ml imt001抗体在4℃孵育过夜。洗涤三次后,将膜与1:8000稀释的抗migg hrp抗体(southern biotech,birmingham,al)孵育一小时。洗涤三次后,将膜与western ecl印迹基质(bio
‑
rad,hercules,ca)孵育并且显影(图11b)。肽5(seq id no:7)和6(seq id no:8)显示了良好信号,指示imt001结合的hgal3上的表位是pgaypgqappgaypgqappgaypgapgayp。
[0495]
为了进一步限定以上肽上imt001的结合表位,合成了8个由其衍生的较短肽(genscript,piscataway,nj)(图11c),并且通过elisa确定它们与imt001的结合(图11d)。用pbs缓冲液中的这些肽涂覆96孔elisa板(thermo scientific)并且在4℃孵育过夜。用tbst洗涤板三次,随后在室温用含有2%bsa的pbst缓冲液阻断1h。在室温将以10μg/ml的imt001在涂覆的elisa板中孵育1h。洗涤板三次,随后在室温用1:8000稀释的抗小鼠
‑
igg
‑
hrp孵育1小时。用tbst洗涤三次并且用50μl的1n hcl终止后,用100μl的tmb消减(genetex)显现颜色。在450nm读取光学密度(od)。结果表示为重复的平均od
±
sd。pep
‑
2显示良好信号,指示人gal3上imt001的结合表位是gqappgaypg。
[0496]
实施例9:b16f10肺转移小鼠肿瘤中的免疫特性
[0497]
用1百万b16f10细胞静脉注射植入小鼠。然后在第0、1、3和7天用imt001或同种型对照(10mg/kg i.p.)治疗小鼠,并且在第8天处死,用于肺免疫细胞分离和表型分析。从肺中分离细胞,并且然后用针对淋巴细胞标志物cd3、cd4、cd8、cd19、dx5的荧光标记的抗体染色,并且通过流式细胞术进行分析。图12中的结果显示,与同种型对照抗体治疗相比,抗gal3抗体imt001治疗增加了容纳肿瘤的肺中各种免疫效应细胞,包括cd3 t淋巴细胞、cd4 t辅助细胞、cd8细胞毒性t细胞、cd19 b细胞和dx5天然杀伤细胞的数量。这指示抗gal3抗体能够激活免疫细胞。
[0498]
实施例10:人肺癌相关的巨噬细胞上检测的gal3表达
[0499]
进行免疫组织化学(ihc)实验以检测人肺癌中的gal3表达。在室温将人肺癌(us biomax inc.)的冷冻组织切片在10%中性缓冲福尔马林(fisher scientific)中固定10min,并且在pbs中洗涤两次进行5分钟。通过在室温在3%h2o2中浸渍切片10min来阻断内源过氧化物酶。在pbs中洗涤两次进行5min后,在室温将切片在链霉抗生物素试剂(molecular probes)中孵育15min,随后用pbs彻底冲洗,在生物素试剂(molecular probes)中孵育15min,并且在pbs中再次冲洗以阻断内源生物素背景。将切片用10%fbs、200μg/ml migg和200μg/ml higg阻断1小h,在4℃与第一抗体imt001
‑
生物素(5μg/ml)孵育过夜,洗涤三次,然后与第二抗体hrp抗生物素蛋白(biolegend)以1:100孵育1h并且洗涤三次。染色通过与dab底物(vector laboratories)孵育显现染色,并且通过在蒸馏水中浸渍切片停止染色。人肺癌切片最终在苏木精qs(vector laboratories)中复染,在蒸馏水中洗涤,在分级的一系列的乙醇和二甲苯溶液中脱水,并且在vectamount
tm
封固剂(mounting medium)(vector laboratories)中封固。
[0500]
图13a
‑
b中的结果显示,那些人肺癌切片(鳞状细胞癌和腺癌)中的冠层状肿瘤相关的巨噬细胞表达gal3,这由它们被imt001的阳性染色所证明。
[0501]
实施例11:人m2巨噬细胞上的gal3表达
[0502]
首先用cd14细胞阳性选择试剂盒(miltenyi,auburn,ca)从外周血单核细胞(pbmc)中分离人cd14单核细胞,并且在gm
‑
csf加il
‑
4,或gm
‑
csf,或m
‑
csf(rocky hill,nj)存在的情况下分别分化成树突细胞(dc),或m1巨噬细胞,或m2巨噬细胞。然后进行流式细胞术分析以检测人树突细胞(dc)、m1和m2巨噬细胞上的gal3表达。详细地,在冰上将100,000个dc、m1或m2细胞与含有以10μg/ml的对照migg
‑
生物素(biolegend)或imt001
‑
生物素的100μl 10%fbs hbss溶液孵育20分钟。然后洗涤细胞并且在冰上与pe
‑
链霉抗生物素(biolegend)以1:1000孵育20分钟。旋转后,活/死细胞用紫罗兰死细胞染色试剂盒(life technologies)染色。对染色的细胞进行流动分析。图14c中的结果显示用imt001染色的m2细胞的平均荧光强度(mfi)远高于用同种型对照抗体染色的细胞,指示imt001与m2细胞特异性结合,而树突细胞(图14a)和m1巨噬细胞(图14b)可能没被染色。
[0503]
实施例12:抗gal3抗体在巨噬细胞/t细胞反应中增强小鼠t细胞活性
[0504]
通过ihc和流式细胞术分析检测小鼠巨噬细胞上gal3的表达。在ihc的细节中,每孔100,000个细胞接种过夜。在第二天,用pbs洗涤细胞一次,在室温用3%甲醛固定10min,然后用pbs洗涤两次并且在室温在含有10%fbs和200μg/ml的pbs中阻断1h。阻断后,在4℃将细胞与10μg/ml的第一抗体migg
‑
生物素(biolegend)或imt001
‑
生物素孵育过夜,用pbst洗涤三次,在室温用抗生物素蛋白
‑
hrp(1:1000)染色1h,并且然后用pbst再洗涤三次。使用过氧化物酶底物使染色显色并且用苏木精qs(vector laboratories)复染。结果显示,与migg对照(图15a)相比,imt001清楚地检测到巨噬细胞上的gal3表达(图15b)。
[0505]
在流式细胞术的实验中,在冰上用10%fbs加200μg/ml higg阻断100,000个raw细胞20min,并且然后在冰上与含有以10μg/ml的对照migg(bd biosciences)或imt001的100μl 10%fbs hbss溶液孵育20分钟。然后洗涤细胞并且在冰上与apc缀合的抗mfc抗体(jackson immunoresearch)以1:100孵育20min。旋转后,活/死细胞用紫罗兰死细胞染色试剂盒(life technologies)染色。对染色的细胞进行流动分析。图15c显示,与用同种型对照抗体染色的细胞的那些相比,用imt001染色的raw细胞的平均荧光强度(mfi)高出10倍以上。
[0506]
imt001激活t细胞的能力通过混合淋巴细胞反应(mlr)试验证明。raw小鼠巨噬细胞与do11小鼠t细胞以1:1比例混合,用ova肽处理,并且在以10μg/ml的migg(bd biosciences)、抗mpd1抗体29f(bioxcell)或imt001存在的情况下,在37℃培养过夜。取出50μl的培养基用于mil
‑
2测量。根据来自ebioscience的商业试剂盒小鼠il
‑
2elisa ready
‑
set
‑
go测量mil
‑
2产生。
[0507]
图15d显示,与migg或mpd1抗体治疗的细胞相比,imt001抗体而不是小鼠pd
‑
1抗体29f增强了il
‑
2的产生,指示巨噬细胞诱导的t细胞失活的逆转。
[0508]
实施例13:鉴定抗体阻断gal3
‑
tim
‑
3相互作用
[0509]
为了鉴定具有阻断gal3和tim
‑
3相互作用能力的gal3靶向抗体,在存在(或不存在)各种gal3靶向抗体或对照抗体或不存在抗体的情况下孵育纯化的gal3和tim
‑
3蛋白质,并且通过elisa评估蛋白质相互作用。
[0510]
将人gal3蛋白质(acro biosystems,ga3
‑
h5129)在磷酸盐缓冲液(pbs)(corning)中稀释至0.5μg/ml的浓度,并且将100ul的稀释的hgal3添加至96孔elisa板(thermo fisher,44
‑
2404
‑
21)的每个孔中。在4℃孵育板过夜后,每孔用300μl的具有0.05%tween(vwr)(pbst)的pbs洗涤板三次。然后在室温轻轻振荡每孔用200μl的pbst中的2%牛血清白蛋白(bsa)(sigma)阻断板一小时。其后,除去pbst中的2%bsa,并且将50ul的pbst中的2%bsa中的20ug/ml的抗gal3抗体添加至孔中以在室温轻轻振荡孵育10分钟。实验中使用抗体mab1、mab2、mab3、mab4、mab5、mab6和mab7。使用的抗体在表3中列出。
[0511]
然后,将50ul的pbst中的2%bsa中的1ug/ml的人tim
‑
3细胞外结构域蛋白质(acro biosystems,tm3
‑
h5229)添加至孔中。在室温轻轻振荡孵育板一小时。然后用每孔300μl的pbst洗涤板三次,并且将100ul的pbst中的2%bsa中0.3ug/ml的抗人tim
‑
3生物素化的抗体(r&dsystems,baf2365)添加至每孔中。轻轻振荡孵育板一小时,并且然后每孔用300μl的pbst洗涤三次。然后将100ul的抗生物素蛋白
‑
hrp(1:1000)(jackson immunoresearch)添加至每个孔中,并且在室温轻轻振荡孵育板30分钟。随后每孔用300μl的pbst洗涤板三次,并且将100ul的tmb底物(fisher scientific,34029)添加至每个孔中。每孔用50ul的1m hcl(vwr)终止反应。使用酶标仪(molecular devices)在450nm的吸光度处读取板。gal3
‑
tim
‑
3相互作用的阻断百分比被计算为在没有抗体的情况下获得的信号减去背景信号的分数。
[0512]
如图16中显示的,抗gal3抗体展示出不同的阻断gal3和tim
‑
3的相互作用的能力。抗体mab1、mab2、mab4和imt001中的每一种破坏了gal3
‑
tim
‑
3结合,导致gal3
‑
tim
‑
3结合分别降低至未阻断的对照(无抗体)的14%、4%、10%和7%。抗体mab3和mab5适度地破坏gal3
‑
tim
‑
3结合,相互作用分别降低至未阻断对照的34%和59%。最后,mab6和mab7不影响gal3
‑
tim
‑
3结合。结果显示抗体mab1、mab2、mab3、mab4、mab5和imt001均在一定程度上阻断了gal3
‑
tim
‑
3的相互作用。它还表明单独的gal3结合不足以破坏gal3和tim
‑
3的相互作用,并且这种破坏活性需要特定的性质。
[0513][0514][0515]
实施例14:鉴定结合至gal3的不同表位的抗体
[0516]
为了确定与gal3
‑
tim
‑
3抗体阻断位点相关的gal3上的表位,通过将具有和不具有gal3
‑
tim
‑
3阻断活性的抗gal3抗体应用于gal3肽来进行elisa测定。
[0517]
产生了20个氨基酸肽的文库,每个氨基酸肽代表hgal3(seq id no:1)的某些区域。50ul的pbs中至少2ug/ml的产生的hgal3肽:肽1(seq id no:3)、5(seq id no:7)、6(seq id no:8)、8(seq id no:10)或23(seq id no:25)添加至96孔elisa板(thermo fisher,44
‑
2404
‑
21)的孔中。作为阳性对照,将100ul的pbs中的0.1ug/ml全长人半乳糖凝集素
‑
3蛋白质(acro biosystems,ga3
‑
h5129)添加至elisa板的孔中。在4℃孵育板过夜后,用每孔300ul的pbst洗涤板三次。然后在室温轻轻震荡用每孔200ul的pbst中的2%bsa阻断板一小时。其后,除去pbst中的2%bsa并且将100ul的pbst中2%bsa中的0.1ug/ml抗体添加至孔中(图17a
‑
b)。至于阴性对照组,在没有hgal3肽或hgal3蛋白质的情况下应用抗体。
[0518]
在室温轻轻振荡孵育板一小时,并且然后用每孔300μl的pbst洗涤三次。随后,将hrp缀合的第二抗体添加至孔中,并且在室温轻轻振荡孵育30分钟。用每孔300μl的pbst洗涤板三次后,然后将100ul的tmb底物(fisher scientific,34029)添加至每孔中。用每孔50ul的1m hcl(vwr)终止反应,并且使用酶标仪(molecular devices)在450nm的吸光度读取板。
[0519]
具有已知gal3
‑
tim
‑
3阻断活性的抗gal3抗体mab1、mab3、mab4和imt001以不同程度结合至hgal3肽5(seq id no:7)、6(seq id no:8)和8(seq id no:10)(图17a),提示这些gal3
‑
tim
‑
3阻断抗体在gal3上共享一些共同的表位。抗体mab5,具有部分gal3
‑
tim
‑
3阻断活性的抗体,也结合该区域。抗体mab2,具有强gal3
‑
tim
‑
3阻断活性的抗体,结合至不同gal3肽、肽1(seq id no:3)(图17b)。相反,不具有gal3
‑
tim
‑
3阻断活性的抗gal3抗体mab7展示出对肽10(seq id no:12)和23(seq id no:25)的结合活性,而mab6未能显示出实质性结合至任何肽,但确实显示出结合至hgal3hgal3蛋白质,暗示对该抗体的非线性结合表位。为清楚的目的,未显示未能结合至任何gal3抗体的肽。总体上,这些观察鉴定了由肽1(seq id no:3)、5(seq id no:7)、6(seq id no:8)和8(seq id no:10)表示的序列,作为预测gal3
‑
tim
‑
3阻断活性的特征。这些肽对应于gal3的前2
‑
21个n
‑
末端氨基酸和hgal3(seq id no:1)的残基52
‑
71和72
‑
91。
[0520]
实施例15:抗gal3抗体的结合结构域
[0521]
为了评估具有gal3
‑
tim
‑
3阻断活性的抗gal3抗体是否结合至gal3分子的相同或重叠区域,进行了表位竞争测定(epitope binning assay)以评估抗体同时结合至gal3的能力。
[0522]
将100ul的0.1ug/ml的hgal3(acro biosystems,ga3
‑
h5129)添加至96孔elisa板(thermo fisher,44
‑
2404
‑
21)的每个孔中,除了对照组,“无涂覆”的那些,在4℃孵育板过夜后,用每孔300ul的pbst洗涤板三次。在室温轻轻震荡用每孔200ul的pbst中的2%bsa阻断板一小时,并且去除pbst中的2%bsa。将50ul的pbst中的2%bsa中抗hgal3抗体:mab1、mab4或mab5(4.2ug/ml)添加至孔中,以在室温轻轻振荡预孵育10分钟。没有抗体添至到第二对照组“无抗体”的孔中进行预孵育。
[0523]
在具有或不具有抗gal3抗体的情况下预孵育后,将50ul的pbst中2%bsa中的生物素化的抗gal3抗体:mab1、mab4和mab5(0.2ug/ml)一起添加至孔中,并且在室温轻轻振荡孵育一小时。未将抗体添加至第三对照组“空白”的孔中来孵育。其后,用每孔300μl的pbst洗涤板三次,然后将100ul的抗生物素蛋白
‑
hrp(1:1000)(jackson immunoresearch)添加至每孔中。再次在室温轻轻振荡孵育板30分钟,并且然后用每孔300μl的pbst洗涤三次。然后
将100ul的tmb底物(fisher scientific,34029)添加至每个孔中。用每孔50ul的1m hcl(vwr)终止反应,并且使用酶标仪(molecular devices)在450nm的吸光度读取板。
[0524]
如图18中显示的,抗体结合绘制为未阻断的对照的百分比。表明与用同种型对照预孵育相比,用mab1预孵育降低了mab1、mab4和mab5与hgal3的结合,指示这些抗体共享一些重叠的结合结构域。类似地,mab4预孵育大大减少了后来的mab1、mab4和mab5的结合。虽然mab5预孵育降低了mab5的结合,其仅最低限度地影响mab1和mab4的结合,指示竞争是不对称的,这通常是低亲和力抗体的结果。
[0525]
实施例16:gal3
‑
tim
‑
3阻断抗体显示出不同生物物理特征
[0526]
为了确定gal3结合抗体的生物物理特征,使用纯化的gal3蛋白质和各种抗体进行了生物层干扰仪评估。使用gator(probe life,east palo alto,ca)将纯化的抗体以10ug/ml加载到抗人fc探针上180秒。在测定缓冲液中平衡30秒后,负载的探针以1:2的连续稀释浸入人gal
‑
3中用于缔合,从500nm开始。观察缔合300秒直到平衡。然后将探针浸入测定缓冲液中300秒用于解离。
[0527]
gal3结合抗体缔合和解离的实时图描绘在图19a
‑
c中。抗体mab4显示出具有1.2nm的k
d
的最强亲和力,具有1.05e 6m
‑
1sec
‑1的k
结合
和具有1.32e
‑
3sec
‑1的k
解离
(图19b)。抗体mab1展示出13.5nm的k
d
的第二强亲和力,具有1.7e 6m
‑
1sec
‑1的k
结合
和2.29e
‑
2sec
‑1的k
解离
。抗体mab5展示出32.3nm的k
d
的最弱亲和力,具有1.41e 6m
‑
1sec
‑1的k
结合
和4.57sec
‑1的k
解离
。这些结合亲和力与来自实施例15中抗体竞争研究的预测相对亲和力定性上一致。
[0528]
实施例17:具有gal3
‑
tim
‑
3阻断活性的gal3靶向抗体激活抗原介导的t细胞应答
[0529]
为了评估具有gal3
‑
tim
‑
3阻断活性的gal3靶向抗体增强t细胞介导的应答的能力,使用了cmv抗原回忆试验。人外周血单核细胞(pbmc)(astarte,供体id 230)在37℃水浴中快速解冻,在20ml的具有10%fbs的rpmi培养基中再悬浮,并且以1500rpm离心5min。培养基被丢弃,小球再悬浮于20ml的培养基中且通过h&e排除(exclusion)计数,并且在无血清培养基(lonza)中稀释至4百万/ml的最终浓度。将50ul的培养基加细胞(200,000个细胞/孔)添加至96孔圆底板的60个内孔中,并且在37℃孵育30min。将抗体添加至无血清培养基中,使其储备浓度为4x最终浓度(40ug/ml)。将50ul的4x浓度的抗体直接添加至pbmcs中并且在37℃孵育30min。pbmc与抗体孵育30min后,将100ul的2x浓度(1ug/ml)的cmv(astarte biologics,cat.#1004)直接添加至细胞中并且在37℃孵育4天。在第4天,收集10ul的细胞上清液以经人ifn
‑
γelis试剂盒(invitrogen)通过elisa测量人ifnγ浓度。
[0530]
如图20中显示的,用不具有tim
‑3‑
gal3阻断活性的gal3靶向抗体mab6和mab7处理的样品与同种型对照处理的样品一样诱导相似水平的干扰素
‑
g分泌。相反,具有tim
‑3‑
gal3阻断活性的gal3靶向抗体mab1、mab2、mab4和人源化抗体imt001展示出明显增加水平的干扰素
‑
γ分泌。值得注意的是,mab5,具有部分gal3
‑
tim
‑
3阻断活性但对gal3是相对低的亲和力的抗体未能诱导显著的干扰素
‑
γ分泌,指示gal3靶向抗体的免疫激活性质需要亲和力阈值。类似地,mab3,具有部分gal3
‑
tim
‑
3阻断活性的抗体在该t细胞激活测定中产生了模棱两可的结果。总的来说,这些数据表明gal3靶向抗体可以增强抗原特异性t细胞激活,并且只有那些具有阻断tim
‑3‑
gal3相互作用的抗体才拥有该活性。
[0531]
实施例18:gal3
‑
tim
‑
3结合表面
[0532]
为了鉴定介导gal3和tim
‑
3之间相互作用的氨基酸残基,进行了交联质谱法。5ul
纯化的gal3(4.62um)和tim
‑
3(3.74um)用k200 maldi ms分析试剂盒(covalx)交联。向9μl交联混合物中添加入1μl的k200稳定剂试剂(2mg/ml),并且在室温孵育3小时。在结晶后立即通过高质量maldi分析来分析孵育的样品。对于分析,应用了以下参数:质谱仪:线性和正模式,离子源1:20kv,离子源2:17kv,透镜:12kv,脉冲离子提取:400ns hm4,增益电压:3.14kv,加速电压:20kv。交联的gal3
‑
tim
‑
3产物被鉴定具有mh =26.886kda和mh =34.397kda。用胰蛋白酶、胰凝乳蛋白酶、aspn
‑
n、弹性蛋白酶或嗜热菌蛋白酶消化交联的蛋白质以形成单独的交联肽(图21a)。确定了连接位点处交联肽的序列(图21a
‑
c)。由于该区域固有的非结构化特征,gal3的gal3
‑
tim
‑
3阻断表位不包括在gal3的晶体结构模型中。注意,图21a中描绘的氨基酸编号反映了信号肽加工后成熟蛋白质中的氨基酸编号。参见表4,表4显示了对应于seq id no:2的氨基酸编号。
[0533]
发现位置73
‑
101处tim
‑
3氨基酸附近的氨基酸残基与145
‑
184处gal3氨基酸附近的残基交联(图21a
‑
c)。这些氨基酸位于每个分子的暴露区域,提示这些区域参与了gal3和tim
‑
3的蛋白质
‑
蛋白质相互作用。重要地,抗gal3抗体mab1、mab2、mab3、mab4和mab5似乎结合如肽结合测定中所鉴定的不同表位,对应于如实施例14中描述的hgal3(seq id no:1)的前2
‑
21个n
‑
末端氨基酸和残基52
‑
71和72
‑
91,提示二级或三级结构可能与gal3的n
‑
末端区域相关,其中该区域介导gal
‑
tim
‑
3界面且结合至gal3
‑
tim
‑
3阻断抗体。
[0534]
表4显示了来自图21a和seq id no:2的代表性氨基酸编码。
[0535]
表4
[0536][0537]
实施例19:用抗gal3抗体减少鼠肾纤维化
[0538]
为了评估gal3抑制对肾纤维化的影响,将imt001施用至鼠肾纤维化疾病模型。由于imt001还展示出gal3
‑
tim
‑
3阻断活性,研究显示gal3
‑
tim
‑
3破坏对肾纤维化也有影响。
[0539]
使用8周龄的雄性c57bl/6小鼠创建单侧的尿道梗阻(uuo)小鼠模型。动物被随机分为三组(n=5);假(sham)、小鼠igg2b对照和imt001。所有动物研究均按照分子医学研究所机构动物护理和使用委员会批准的方案进行。在第0天,进行手术以结扎每只动物的左侧输尿管。手术后,在第1、5和10天向动物腹膜内施用10mg/kg的migg2b(bioxcell)或imt001。假组中的动物不进行治疗。在第4、8和15天,动物被人道处死,并且左肾组织被手术去除并且快速冷冻用于蛋白质印迹分析。
[0540]
将来自14天治疗uuo组的30mg快速冷冻肾组织在500μl的ripa缓冲液(thermo scientific)中均质化。将匀浆置于冰上10分钟,并且然后在1.5ml eppendorf管中在4℃以12000rpm离心10min。收集含有蛋白质的上清液并且用nanodrop(thermofisher)通过a280
吸光度进行定量。蛋白质样品在含有β
‑
巯基乙醇(bio
‑
rad)的4x样品缓冲液中煮沸10min。将等量的蛋白质裂解物(20μl/孔;10μg/μl)加载到预制的sds
‑
page凝胶(bio
‑
rad)上并且进行电泳分离。将分离的蛋白质转移至聚偏二氟乙烯膜上,随后用具有0.5%tween(pbst)的磷酸盐缓冲液(fisher scientific mt21030cm)中的5%脱脂奶粉进行阻断。在4℃将膜与靶向α
‑
平滑肌肌动蛋白(sma)(1:2000稀释)(sigma a5228)和纤连蛋白fn
‑
eiiia(1:1000稀释)(abcam ab6328)的初始抗体孵育过夜。蛋白质印迹数据标准化为gapdh(1:5000稀释)(abcam ab181602)。用pbst洗涤三次后,在室温将膜与以1:5000稀释的缀合至辣根过氧化物酶的相应第二抗体孵育两小时。用pbst洗涤膜三次,并且使用制造商(bio
‑
rad)推荐和开发的标准ecl检测方法通过增强的化学发光检测蛋白质条带。gapdh用作负载对照参考。
[0541]
如图22中阐释的,与用假手术治疗的动物相比,进行输尿管结扎且用非特异性同种型对照抗体migg2b治疗的动物展示出纤维化标志物平滑肌肌动蛋白(a
‑
sma)和纤连蛋白的诱导(泳道1
‑
3与泳道7
‑
9)。相反地,相对于igg2b对照(泳道7
‑
9),进行输尿管结扎且用imt001治疗的动物展示出两种纤维化标志物(泳道4
‑
6)的表达降低,看起来与假治疗的动物更相似。这些观察提示阻断gal3和破坏gal3
‑
tim
‑
3相互作用可以减少肾纤维化。
[0542]
实施例20:用抗gal3抗体减少鼠肝纤维化
[0543]
gal3
‑
tim
‑
3阻断抗体imt001用于纤维化的非肥胖糖尿病和炎症(n
‑
if)小鼠遗传模型,以研究gal3抑制对肝纤维化的影响。
[0544]
n
‑
if小鼠是通过将24αβnod小鼠和nod.rag2
‑
/
‑
小鼠品系杂交而产生的。n
‑
if小鼠与b6.rag2
‑
/
‑
小鼠品系回交10代。将小鼠(雄性和雌性)分成两组:imt001抗体治疗组和migg2b抗体对照组。以10mg/kg体重每四天向动物施用抗体,持续40天,随后处死动物。进行所有的努力都是为了尽量减少痛苦。收集肝和肾组织并且在液氮中迅速冷冻,用于蛋白质印迹分析。如实施例19中进行组织处理和蛋白质印迹分析。gapdh用作负载对照参考。
[0545]
相对于用migg2b同种型对照治疗的动物,用gal3
‑
tim
‑
3阻断抗体imt001治疗的动物在纤维化标志物a
‑
sma和纤连蛋白的表达中显著降低(图23)。这些数据提示通过imt001的gal3
‑
tim
‑
3阻断减少了n
‑
if模型中的肝纤维化。
[0546]
实施例21:具有/不具有gal3
‑
tim
‑
3破坏性质的抗gal3抗体对纤维化的影响
[0547]
为了评估具有和不具有gal3
‑
tim
‑
3阻断活性的抗gal3抗体对纤维化的影响,进行了基于体外细胞培养的研究。
[0548]
正常大鼠肾成纤维细胞(nrk
‑
49f)在含有10%胎牛血清和青霉素/链霉素抗生素的rpmi培养基中生长至80%汇合度。培养基被去除并且用具有青霉素/链霉素但不具有胎牛血清的rpmi取代以诱导血清饥饿24小时,然后用对照migg2b(10mg/ml)、tgf
‑
β1(1ng/ml)或半乳糖凝集素
‑
3抗imt001(10mg/ml)处理静息细胞,并且在蛋白质提取缓冲液中裂解。使用gapdh作为负载对照参考,通过蛋白质印迹分析裂解物诱导纤维化疾病的成纤维细胞到成肌细胞标志物,包括α
‑
sma和纤连蛋白。类似地,在5%co2下在37℃的加湿培养箱中,在角质细胞培养基中生长正常人肾近端肾小管细胞(hk
‑
2)(atcc;rockville,md)。培养的细胞用migg2b(10mg/ml)、tgf
‑
β1(1ng/ml)或imt001(10mg/ml)处理,并且通过蛋白质印迹进行评估。
[0549]
实施例22:具有纤维化疾病的患者的治疗
[0550]
展现黄疸和液体潴留的患者去看医生。医生诊断出患者具有肝纤维化并且开具包
括抗gal3抗体的疗法。该疗法以约10mg/kg患者体重每天口服施用至患者,持续一个月。在一些情况下,抗gal3抗体还具有gal3
‑
tim
‑
3阻断性质。
[0551]
实施例23:使用抗gal3抗体诱导人受试者中的免疫系统激活
[0552]
根据标准比如免疫系统不规则、自身免疫性疾病、免疫缺陷、免疫抑制、癌症或纤维化,任选地选择人受试者或患者。抗gal3抗体通过肠胃外、静脉内、肌内、小动脉内、皮内、皮下、腹膜内、心室内或颅内途全身地施用。监测受试者对免疫系统不规则、自身免疫性疾病、免疫缺陷、免疫抑制、癌症或纤维化的影响。还通过使用本领域已知的方法,例如气相色谱分析、液相色谱、质谱或酶联免疫吸附测定(elisa)测量细胞因子比如ifnγ、tgf
‑
β、tgf
‑
β1、il
‑
1β、il
‑
2、tnf
‑
α或gm
‑
csf的血液、血浆或血清水平来监测受试者。
[0553]
可替选地,使用本领域已知的技术,比如离心和荧光激活细胞分选,从受试者中分离白细胞或富含tim
‑
3的白细胞。分离的白细胞或富含tim
‑
3的白细胞与抗gal3抗体接触以影响至少一种细胞因子的产生并诱导免疫激活。接触的白细胞或富含tim
‑
3的白细胞可以自体返回受试者以治疗免疫有关的疾病比如癌症或纤维化。在1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24小时,或1、2、3、4、5、6、7天,或1、2、3、4周,或1、2、3、4、5、6、7、8、9、10、11、12个月,或1、2、3、4、5、6、7、8、9、10年内可看见治疗的效果。
[0554]
在一些实施方式中,向受试者施用抗gal3抗体或将白细胞或富含tim
‑
3的白细胞与抗gal3抗体接触可以将gal3和tim
‑
3之间的相互作用降低至小于99%、小于95%、小于90%、小于80%、小于78%、小于70%、小于66%、小于60%、小于56%、小于52%、小于50%、小于40%、小于30%、小于29%、小于27%、小于20%、小于19%、小于17%、小于10%、小于5%、小于4%、小于3%、小于2%或小于1%的正常的。
[0555]
抗gal3抗体可以在无菌条件下和在规定或控制的程序下产生和制备。在该过程中,抗gal3抗体用于制造药物或组合物。制备的抗gal3抗体用于治疗免疫有关的疾病比如癌症或纤维化。
[0556]
保持和确保无菌的方法可以遵守良好生产规范(gmp)、良好组织规范(gtp)、良好实验室规范(glp)和良好分销规范(gdp)标准。保持和确保无菌的方法包括但不限于高效微粒空气(hepa)过滤、湿热或干热,辐射例如x射线、γ射线或uv光,杀菌剂或熏蒸剂比如环氧乙烷、二氧化氮、臭氧、戊二醛、甲醛、过乙酸、二氧化氯或过氧化氢,无菌容器的防腐剂填充,塑料膜或包装袋包装或真空密封。
[0557]
实施例24:具有gal3
‑
tim3阻断活性的抗体的发现
[0558]
为了扩展用原始组的抗体进行观察,开展了抗体发现活动,以鉴定具有阻断gal3和tim3组装能力的其他gal3结合抗体。balb/c、fvb和cd
‑
1f小鼠以7天间隔接种50ug的融合至连接体间隔的6
‑
组氨酸标签,gal3
‑
ecd
‑
his(acro ga3
‑
h5129;批号819
‑
43ps1
‑
5e.)的gal3蛋白质与tlr激动剂佐剂混合物(50μg mpl l、20μg cpg、10μg poly(i:c)和10μgr848)组合,重复3次,随后接种50μg的gal3
‑
his,其单独皮下施用至腹股沟、颈后和尾部部位基础以及飞节和腹膜内位点。按照iacuc方案处死动物,并且收获脾、股骨和淋巴结(腋窝、副腋窝、纵隔、腹股沟浅层、髂骨、骶骨和腘窝)。在具有15ml dmem的组织培养皿中使用2个无菌磨砂载玻片获得免疫淋巴结(ln)、脾和骨髓细胞的单细胞悬浮液。用装有18号针头的5ml注射器经端盖洗涤从股骨中提取骨髓。来自3只动物的细胞以1200rpm离心5分钟使形成小球,再悬浮于10ml的dmem(gibco 10564
‑
011)中,并且通过血细胞计数器计数来计数
(enumerate)有核细胞。将细胞以1200rpm使形成小球并且再悬浮于sc缓冲液(pbs、2%fbs和1mm edta)中,并且用制造商推荐的方案,用easysep
tm
mouse cd138 positive selection kit(stemcell technologies)分离浆细胞。富集的cd138阳性细胞以1200rpm离心5分钟使形成小球,再悬浮于50ml电融合缓冲液(eppendorf 940
‑
00
‑
220
‑
6)中并且被计数。另外,将sp2/0
‑
mil6骨髓瘤细胞(atcc crl2016)以1200rpm离心5分钟使形成小球,再悬浮于50ml电融合缓冲液中并且被计数。骨髓瘤细胞和cd138阳性浆细胞以1:1比例混合,用电融合缓冲液将体积扩大至50ml,细胞以1200rpm离心5分钟使形成小球,并且丢弃上清液。在电融合缓冲液中反复洗涤和使形成小球的步骤后,将细胞再悬浮于电融合缓冲液中至10x10^6个细胞/ml的浓度,将至多9ml的细胞悬浮液添加至btx电融合腔室中,并且将细胞以800v电融合方案融合。融合的细胞静置5分钟,转移至含有40ml培养基mm(dmem、15%fbs、1%glutamax和1%pen/strep)的组织培养皿中,在37℃、8%co2孵育1小时,用移液管再悬浮,以1200rpm离心5分钟形成小球,再悬浮于clonacell hy liquid hatselection medium(stemcell technologies)中,并且铺板于96孔组织培养平底板。10天后,对上清液取样并且通过elisa评估与分离的gal3的结合。将50ul的再悬浮于稀释剂(具有0.5%bsa的pbs)中的0.1ug/ml gal3
‑
ecd
‑
his(acro ga3
‑
h5129;批号819
‑
43ps1
‑
5e)添加至每孔中45分钟,丢弃上清液并且用具有0.05%tween20的磷酸盐缓冲液(pbs)洗涤板。将50ul的在稀释剂中1:5稀释的杂交瘤上清液添加至每个孔中1小时,随后用pbs/0.05%tween20连续5次300ul洗涤,然后50ul的稀释剂中1:3000稀释的缀合至辣根过氧化物酶(novex a16090)的山羊抗小鼠fc
‑
特异性抗体添加至每个孔中1小时,随后用pbs/0.05%tween20连续5次300ul洗涤。洗涤后,将50ul的abts(novex#00
‑
202
‑
4)添加至每个孔中20
‑
30分钟,然后在分光光度计(molecular devices)上以405nm的吸光度读数。
[0559]
通过spr评估gal3结合抗体的结合亲和力。动力学实验在25℃在biacoret200上以高性能模式进行。配体蛋白质,纯化抗体被捕获到与抗人fc或抗小鼠fc抗体偶联的cm5芯片上,一次将三种抗体分别捕获到流动池#2、3和4上,而流动池#1用作参考。将hbs
‑
ep缓冲液中的分析物半乳糖凝集素
‑
3以100、50、25、12.5、6.25、3.125和0nm的浓度以30μl/min的流速注射到所有四个流动池中。允许复合物分别缔合和解离240秒和300秒。用30秒注射10mm甘氨酸ph 1.7(流速30μl/min)再生表面。使用biacoret200评估软件v2.0内获得的全局数据分析选项,将数据拟合到简单的1:1交互模型。确认,gal3单克隆抗体的亲和力对所有研究的抗体都大于30nm(表24.1)。选择具有亲和力小于2e
‑
7的抗体进行进一步表征。
[0560]
表24.1
[0561]
[0562][0563]
评估了阳性评分孔阻断gal3和tim3缔合的能力。为了鉴定具有阻断gal3和tim3相互作用能力的gal3靶向抗体,将纯化的gal3和tim3蛋白质在以上描述的gal3免疫杂交瘤上清液的存在下孵育,或在没有抗体的情况下孵育,并且通过elisa评估蛋白质相互作用。将人半乳糖凝集素
‑
3蛋白质(acro biosystems,ga3
‑
h5129)在pbs(corning,21
‑
030
‑
cm)中稀释至3μg/ml的浓度,并且添加至96孔elisa板(thermo fisher,44
‑
2404
‑
21)的孔中。在4℃将板孵育过夜后,将用pbst(具有0.05%tween 20[vwr,0777]的pbs)洗涤板三次。然后在室温轻轻振荡用pbst中的2%bsa(emd millipore,126609)阻断板一小时。其后,丢弃pbst中的2%bsa,并且将pbst中2%bsa中的抗体或抑制剂(从20μg/ml、60μg/ml或180μm开始3倍稀释)添加至孔中。然后,以1:1比例将pbst中2%bsa中的2μg/ml的人tim3(aero biosystems,
tm3
‑
h5229)添加至孔中的抗体或抑制剂中。在室温轻轻振荡孵育板一小时。其后,用pbst洗涤板三次,并且将pbst中2%bsa中的0.3μg/ml的人tim3生物素化抗体(r&dsystems,baf2365)添加至孔中。轻轻振荡孵育板一小时,并且然后用pbst洗涤三次。然后将抗生物素蛋白
‑
hrp(1:2000)添加至孔中。在室温轻轻振荡孵育板一小时,并且然后用pbst洗涤三次。然后将tmb底物(thermo scientific,34029)添加至每个孔中。用1m hcl(jt baker,5620
‑
02)终止反应并且使用酶标仪(molecular devices)在450nm的吸光度读数。
[0564]
如图24中描绘的,gal3结合抗体展示出阻断gal3和tim3缔合的可变能力。一些抗体能够阻断gal3和tim3的组装至小于gal3靶向抗体包括846.2h3不存在的情况下观察的水平的5%。其他gal3结合抗体阻断gal3和tim3的组装至gal3靶向抗体,包括mimt001、846.1f5、2d10.2b2、6h6.2d6、20h5.a3和846t.1h2不存在的情况下观察的水平的5
‑
20%。其他gal3结合抗体阻断gal3和tim3的组装至gal3靶向抗体,包括19b5.2e6、13h12.2f8和23h9.2e4不存在的情况下观察的水平的20
‑
50%。其他gal3结合抗体阻断gal3和tim3的组装至gal3靶向抗体,包括15g7.2a7、4g2.2g6、4a11.2b5、14h10.2c9、20d11.2c6、19d9.2e5、13a12.2e5和3b11.2g2不存在的情况下观察的水平的50
‑
75%。其他gal3结合抗体显示出对gal3和tim3的组装最小的阻断活性,在gal3靶向抗体,包括12g5.d7、7d8.2d8、9h2.2h1、13g4.2f8和24d12.2h9不存在的情况下将tim3和gal3的结合降低25%或更少。
[0565]
实施例25:具有和不具有gal3
‑
tim3阻断活性的gal3
‑
靶向抗体结合gal3的不同表位
[0566]
为了鉴定具有和不具有gal3
‑
tim3阻断活性的gal3抗体所结合的表位,产生了表示gal3部分的20种氨基酸肽的文库,总结在表24.1中,并且通过elisa评估结合gal3抗体的能力。
[0567]
50μl的pbs中至少2μg/ml的hgal3肽或0.1μg/ml全长人gal3蛋白质(genscript)和人半乳糖凝集素
‑
3蛋白质(acro biosystems,ga3
‑
h5129)在pbs(corning,21
‑
030
‑
cm)中分别稀释至至少2μg/ml或0.1μg/ml的浓度,并且添加至96孔elisa板(thermo fisher,44
‑
2404
‑
21)的孔中。在4℃孵育板过夜后,用pbst(具有0.05%tween 20[vwr,0777]的pbs)洗涤板三次。然后在室温轻轻振荡用pbst中的2%bsa(emd millipore,126609)阻断板一小时。其后,丢弃pbst中的2%bsa,并且将人半乳糖凝集素
‑
3杂交瘤上清液或抗体在pbst中的2%bsa中稀释至至少0.1μg/ml的浓度,并且添加至孔中。在室温轻轻振荡孵育板一小时,并且然后用pbst洗涤三次。然后,将pbst中2%bsa中稀释的(1:4000)山羊抗小鼠igg
‑
hrp(jackson immunoresearch,115
‑
036
‑
1461)或山羊抗大鼠igg hrp(abcam,ab205720)添加至孔中。在室温轻轻振荡孵育板30分钟至1小时,并且然后用pbst洗涤三次。然后将tmb底物(thermo scientific,34029)添加至每个孔中。用1m hcl(jt baker,5620
‑
02)终止反应并且使用酶标仪(molecular devices)在450nm的吸光度读数。
[0568]
在多个位置观察gal3结合抗体与肽阵列的结合,大多数结合在肽1
‑
8中观察到,总结在表25.1中。显著地,所有具有强tim3
‑
gal3阻断活性的gal3结合抗体都展示出与肽4、5、6或7结合的能力,对应于gal的n
‑
末端结构域中的肽序列。具体地,六种单独的具有gal3
‑
tim3阻断活性的gal3结合抗体(6h6.2d6、20h5.a3、20d11.2c6、19b5.2e6、15g7.2a7、23h9.2e4)都结合了gal3的肽1,对应于gal3的氨基酸1
‑
20,adnfslhdalsgsgnpnpqg(seq id no:3)。相反地,没有观察到具有差gal3
‑
tim3阻断活性的gal3靶向抗体结合肽1。综上所述,
这些数据指示结合至gal3肽1是阻断gal3与tim3相互作用的能力的预测。类似地,具有gal3
‑
tim3阻断活性的三种单独的gal3结合抗体(4g2.2g6、3b11.2g2和13a12.2e5)结合gal3的肽4,对应于gal3的氨基酸31
‑
50,gaggypgasypgaypgqapp(seq id no:6)。相反地,没有观察到具有差gal3
‑
tim3阻断活性的gal3靶向抗体结合肽4。综上所述,这些数据指示结合至gal3肽4是阻断gal3与tim3相互作用的能力的预测。进一步,十三种具有gal3
‑
tim3阻断活性的gal3结合抗体(mimt001、846t.1h2、13h12.2f8、19d9.2e5、14h10.2c9、2d10.2b2、4a11.2b5、846、1b.32d.3b5和13a12.2e5)都结合gal3的肽6,对应于gal3的氨基酸51
‑
70,gaypgqappgaypgapgayp(seq id no:8)。相反地,没有观察到具有差gal3
‑
tim3阻断活性的gal3靶向抗体结合肽6。综上所述,这些数据指示结合至gal3肽6是阻断gal3与tim3相互作用的能力的预测。另外,十一种具有gal3
‑
tim3阻断活性的gal3结合抗体(6h6.2d6、20h5.a3、20d11.2c6、13h12.2f8、19b5.2e6、23h9.2e4、15g7.2a7、19d9.2c10、2 7d8.2d8、15f10.2d6和846.14a2)都结合gal3的肽7,对应于gal3的氨基酸61
‑
80,aypgapgaypgaappgvypg(seq id no:9)。相反地,没有观察到具有差gal3
‑
tim3阻断活性的gal3靶向抗体结合肽7。综上所述,这些数据指示结合至gal3肽7是阻断gal3与tim3相互作用的能力的预测。总之,这些数据指示抗gal3抗体与gal3肽1、4、5、6和7的结合作为阻断gal3与tim3相互作用的能力的预测。
[0569]
如图25中阐释的,肽4、5、6和7共享包括脯氨酸
‑
甘氨酸(pg)和酪氨酸
‑
脯氨酸
‑
甘氨酸(ypg)的重复氨基酸序列,指示可以解释gal3靶向抗体结合多种gal3肽的能力的共同特征。进一步,氨基酸序列甘氨酸
‑
x
‑
酪氨酸
‑
脯氨酸
‑
甘氨酸(gxypg),其中x可以是氨基酸丙氨酸(a)、甘氨酸(g)或缬氨酸(v),被共享于肽4、6和7中,每个都拥有由3个氨基酸隔开的两个这种序列。相应地,紧密并列的两个gxypg序列的存在可能是结合具有阻断gal3和tim3的能力的gal3靶向抗体的能力的预测。另外,丙氨酸、甘氨酸和缬氨酸的grantham距离是ala
‑
val:64、ala
‑
gly:60、val
‑
gly:109,从而预测具有类似低grantham距离的氨基酸可能类似地能够在可变区置换,包括脯氨酸和苏氨酸。
[0570]
表25.2.半乳糖凝集素
‑
3肽序列
[0571]
[0572][0573]
实施例26:具有阻断活性的gal3
‑
tim3抗体竞争结合至gal3
[0574]
为了确定具有gal3
‑
tim3阻断活性的gal3结合抗体是否结合至gal3分子的相同或重叠区域,进行了抗体竞争测定以评估抗体同时结合gal3的能力。将胺反应探针负载到gator生物传感器(probe life,palo alto,ca)上,在dh20中平衡60秒,浸入100μl edc 0.2m/nhs 0.05m激活缓冲液中30秒,然后浸入10mm naoac缓冲液中的20μg/μl人gal3
‑
his溶液中,ph 5直到结合饱和,并且在1m乙醇胺ph 8.5中淬灭300秒。gal3
‑
hi加载后,将吸头浸入20μg/ml饱和抗体中,然后依次浸入5μg/ml竞争抗体中。如图26中显示的,具有竞争结合特征的抗体被分配bin,并且进行与阻断活性的关联。在初始bin分配后,随后的竞争实验是用来自如描述的bin建立的代表性物种进行的,以鉴定bin 1和3的其他成员。
[0575]
建立了12种独立的针对gal3的竞争抗体结合模式。显著地,观察到bin和阻断
gal3
‑
tim3阻断活性之间的强关联。来自bin的1、2、3、4、5和6的所有抗体显著抑制gal3结合至tim3,总结在表25.1中。相反地,bin 7和bin 8中的抗体是对tim3的gal3阻断的稍弱的阻断剂,尽管对gal3具有强亲和力。bin 10、11和12中的抗体均不具有显著抑制gal3和tim3缔合的能力。因此,1、2、3、4、5和6的竞争结合bin能够鉴定gal3结合抗体阻断gal3和tim3组装的能力。
[0576]
实施例27:人源化gal3
‑
tim3阻断抗体阻断gal3
‑
tim3结合
[0577]
gal3
‑
tim3阻断抗体的人源化变体类似地展示出阻断纯化的gal3和tim3相互作用的能力,如通过elisa评估的,如图27中阐释的。imt001
‑
4、imt006
‑
1、imt006
‑
5和imt006
‑
8分别展示出5.6nm、26.5nm、4.1nm和2.8nm的ic50。
[0578]
实施例28:gal3
‑
tim3阻断抗体展示出与抗pd1或抗pd
‑
l1抗体的组合抗肿瘤活性
[0579]
为了评估gal3
‑
tim3阻断抗体影响肿瘤生物学的潜力,与其他靶向免疫调节检查点分子pd
‑
1和pd
‑
l1的抗体组合,在携带mbt
‑
2膀胱肿瘤异种移植物的小鼠中进行了研究。简言之,7周龄的雌性c3h/hej小鼠(jackson laboratory)通过吸入麻醉剂(医用级空气中的3%至5%异氟烷)麻醉,并且通过使用具有25
‑
ga针头的注射器将0.1ml pbs中的1x106mbt
‑
2细胞(sekisui xenotech,llc)皮下注射入右侧。肿瘤植入后7天,将小鼠随机分为六组(n=9
‑
10)。用同种型对照migg2b(bioxcell)、抗gal3(mimt001)、抗pd1(rmp1
‑
14,bioxcell)加migg2b、抗pd1(rmp1
‑
14)加mimt001、抗pdl1(10f.9g2,bioxcell)加migg2b和抗pdl1(10f.9g2)加mimt001腹膜内施用给小鼠。同种型对照和抗gal3抗体在第7、9、12、14和16天以20mg/kg给药;抗pd1(rmp1
‑
14 10mg/kg)或抗pdl1(10f.9g2,5mg/kg)在第8、12和15天给药。每周两次监测肿瘤体积和体重。当肿瘤体积或动物健康达到iacuc定义的终点时,动物被人道处死。结果表示为均值
±
sem,通过双向anova进行统计分析。
[0580]
用mimt001或huigg治疗的动物没有展示出任何显著的肿瘤体积减少(数据未显示)。相反地,如图28中描述的,3/10用抗pd
‑
l1抗体治疗的动物展示出强烈的抗肿瘤应答,如通过在治疗后肿瘤体积的减少反映的(图28a
‑
b)。显著地,5/10用mimt001和抗pd
‑
l1抗体组合治疗的动物展示出强烈的抗肿瘤应答,表示相对于单独用抗pd
‑
l1抗体治疗的动物应答率的66%增加。这些数据指示阻断gal3和tim3的抗体与抗pd
‑
l1抗体的组合与单独的抗pd
‑
l1抗体所具有的抗肿瘤活性相比具有显著增加的抗肿瘤活性。
[0581]
进行了单独的研究,以评估用皮下mbt
‑
2肿瘤移植的小鼠中mimt001与抗pd
‑
1抗体的组合的活性。如在pd
‑
1研究中,用同型对照或单独的mimt001的治疗不减少肿瘤体积(数据未显示)。相反地,用抗pd
‑
1抗体的治疗导致3/10动物的抗肿瘤应答,如由肿瘤体积的显著减少展示的(图28c
‑
d)。显著地,6/10用mimt001和抗pd
‑
1抗体组合治疗的动物展示出强烈的抗肿瘤应答,表示相对于用单独的抗pd
‑
1抗体治疗的动物应答率100%增加。这些数据指示阻断gal3
‑
tim3的抗体与抗pd
‑
1抗体的组合比单独的抗pd
‑
1抗体具有显著增加的抗肿瘤活性。与pd
‑
l1组合研究一起考虑,这些数据指示可以阻断gal3
‑
tim3相互作用的gal3
‑
靶向抗体具有更广泛地加强由pd
‑1‑
pd
‑
l1检查点中断诱导的抗肿瘤活性的能力。
[0582]
实施例29:gal3
‑
tim3阻断抗体在hcc中展示出单试剂抗肿瘤活性
[0583]
在stam
‑
cdaa小鼠中诱导的自发肝细胞癌(hcc)模型的设置中评估了评估gal3
‑
tim3阻断抗体活性的进一步研究。简言之,两天龄的雄性c57bl/6小鼠通过单次皮下注射200ug的链脲佐菌素引起胰岛破坏,并且然后从4周龄开始喂食cdaa高脂肪饮食(研究饮食#
a06071302)并且继续在每项研究的整个持续时间。在8周龄时,将小鼠分成两组(每组七只小鼠)。通过腹膜内每周两次注射人抗migg4同种型对照(higg4,10mg/kg)或人抗gal3抗体(imt001
‑
4,10mg/kg)治疗小鼠,持续4周。所有动物护理和程序均由immutics iacuc批准。
[0584]
如图29a
‑
b中描述的,而在保持正常饮食的动物中未观察到肿瘤,用同种型对照抗体治疗的stam
‑
cdaa动物展示出多灶性肿瘤生成的迹象,如肉眼观察所证实的,在4/7动物中注意到严重(每个肝>5个肿瘤)形成和在2/7动物中注意到中等形成(每个肝3
‑
5个肿瘤),而只有1/7被注意到肉眼可见没有肿瘤。相反地,在用imt001
‑
4治疗的动物中,肿瘤形成显著减少,只有1/7动物展示出严重肿瘤形成,表示严重肿瘤形成减少了75%,并且1/7动物展示出中等肿瘤形成,表示中等肿瘤形成减少50%。相应地,imt001
‑
4治疗的动物在5/7动物中没有展示出肉眼可见的肿瘤形成迹象,表示明显无肿瘤的动物增加了400%。
[0585]
进行用苏木精和伊红染色的肿瘤样品的显微镜检查以评估观察到的肿瘤的组织学。简言之,在4%多聚甲醛(electron microscopy sciences,cat#15710s)中固定肝24小时,转移至70%etoh中72小时,并且随后将样品嵌入石蜡中。将5mm样品切割并且固定在apex高级粘合剂切片(leica,cat#3800080)上,随后脱蜡,在连续乙醇浴中再水化,在苏木精(cat#hhs32
‑
1l,milliporesigma)中5min,define(leica,cat#3803590)中1分钟,返蓝缓冲液(leica,cat#3802916)中1分钟并且酒精伊红y515(leica,cat#3801616)中30秒染色,然后脱水、清除和上盖玻片(sakura finetek,cat#6500)。在revolve显微镜(discover echo,inc.)下获取明场图像。
[0586]
与在来自同种型对照治疗的动物的肝中肉眼观察到的肿瘤一致,组织切片显示被脂肪肝的脂肪变性区域包围的发育不良的肝细胞的大的多灶性区域(图29c)。预期脂肪变性为施用的饮食的结果。来自imt001
‑
4治疗的动物的肝切片展示出显著较少的发育不良的肝细胞斑块区域,图29c中描绘了罕见的代表性区域。注意到,除了肿瘤斑块的稀有性增加外,imt001
‑
4治疗的动物的肿瘤区域大小也显著小于对照治疗的动物。
[0587]
为了更系统地评估stam
‑
cdaa小鼠中hcc的丰度,在同种型和imt001
‑
4治疗的动物中评估了α
‑
胎蛋白(afp)(hcc出现的人临床生物标志物)的血清水平。根据制造商的指导,通过elisa(r&d systems#mafp00)测定血清afp。
[0588]
正常小鼠展示低水平的血清中的afp,但是,在用同种型对照治疗的stam
‑
cdaa小鼠中,afp显著升高,3/6动物展示出>2000ng afp/ml,并且6/6动物展示出>1000ng afp/ml(图29d)。相反地,imt001
‑
4治疗的动物相对于同种型治疗的动物展示出显著降低的afp水平,只有1/6动物展示出>2000ng afp/ml,表示66%减少,并且2/6动物展示出>1000ng afp/ml,也表示66%减少。这些数据与如图29a中肉眼观察所指示的观察到的肿瘤形成频率和严重程度一致。
[0589]
综上所述,这些数据表明人源化gal3
‑
tim3阻断抗体可以显著降低hcc肿瘤负荷,并且这些抗体可以作为单试剂具有抗肿瘤活性。
[0590]
实施例30:imt001减少了nash纤维化的蛋氨酸/胆碱缺乏模型中脂肪变性、气球样变和炎症
[0591]
为了进一步研究gal3
‑
tim3阻断抗体影响肝纤维化的能力,采用了肝纤维化的蛋氨酸
‑
胆碱缺乏(mcd)小鼠模型。简言之,六周龄的雄性c57bl/6小鼠(jackson laboratory)被喂食正常饮食(envigo,#2020x;n=5只小鼠);或mcd饮食(fisher scientific,#
mp296043910,n=25),持续8周,并且通过研究的其余部分持续进行。将小鼠分为三组(每组7只小鼠)并且根据alt评分随机分组。第1组和第2组每周两次ip注射小鼠抗migg2alala同种型对照(miso,10mg/kg)或小鼠抗gal3抗体(mimt001,10mg/kg)持续4周治疗,此时处死动物并且收集肝样品,在4%多聚甲醛(electron microscopy sciences,cat#15710s)中固定24小时,转移至70%etoh中72小时,随后将样品嵌入石蜡中。将5mm样品切割并且固定在apex高级粘合剂切片(leica,cat#3800080)上,随后脱蜡,在连续乙醇浴中再水化,在苏木精(cat#hhs32
‑
1l,milliporesigma)中5min,define(leica,cat#3803590)中1分钟,返蓝缓冲液(leica,cat#3802916)中1分钟,酒精伊红y515(leica,cat#3801616)中30秒染色,然后它们脱水、清除和盖上盖玻片(sakura finetek,cat#650))。在revolve显微镜(discover echo,inc.)下获取明场图像。
[0592]
用同种型对照抗体治疗的mcd小鼠展示出该模型典型的肝损伤迹象,包括脂肪变性,通过苏木精和伊红(h&e)染色的肝样品中存在的大面积白色区域所证明的;肝细胞气球样变,通过泡状凋亡细胞证明的;以及存在浸润的免疫细胞,如具有很少细胞质的大量核细胞簇证明的(图30a)。来自mimt001治疗的mcd小鼠的肝样品在这些损伤测量中的每一个都展示出显著减少。为了量化差异,进行了基于图像的量化,揭示了脂肪变性从对照处理的样品中的1.17适度、但是统计学上显著减少至mimt001处理的样品中的1,减少了15%(图30b)。另外,凋亡气球样细胞的存在从对照处理的样品中的1.34减少至mimt001处理样品中的0.98,减少了27%。进一步,浸润性小叶免疫细胞的存在从对照处理的样品中的1.78减少至mimt001处理的样品中的0.73,减少了59%。这些测量产生了综合的nas分数,并且mimt001治疗的动物相对于4.29的同种型对照治疗分数展示出明显减少的2.72的nas评分,降低了43%。t检验揭示,这些观察无论作为个体观察还是作为综合nas分数都具有统计学显著性。
[0593]
为了评估这些样品中的纤维化,通过天狼猩红染色评估组织切片的纤维胶原沉积物的沉积。简言之,脱蜡后,来自同种型对照或imt001治疗的mcd小鼠的肝样品在连续乙醇浴中再水化,在室温将切片在饱和苦味水溶液中的0.01%固绿fcf溶液(cat#1.04022.0025milliporesigma)中染色15分钟,随后在室温在0.04%固绿fcf/0.1%天狼星红饱和苦味水溶液中孵育1小时,然后它们脱水、澄清和固定。使用imagej软件(rasband,w.s.,imagej,u.s.national institutes of health,bethesda,maryland,usa,world wide web.imagej.nih.gov/ij/)对图像进行定量。
[0594]
如图30b中显示的,在用同种型对照治疗的mcd小鼠的肝切片中证明了显著的纤维化,如这些样品中存在丰富的天狼猩红阳性胶原网络所指示的。相反地,用mimt001治疗的mcd小鼠的肝切片展示出降低水平的天狼猩红染色的胶原蛋白沉积物。天狼猩红切片的基于图像的量化揭示染色从同种型对照治疗动物区域的样品中组织面积的4.3%减少至mimt001治疗的样品中面积的1.25%,减少了71%(图30d)。
[0595]
这些数据指示gal3
‑
tim3阻断抗体可以减少肝纤维化的鼠mcd模型中的肝纤维化。
[0596]
实施例31:imt001
‑
4减少了cdaa
‑
hfd stam小鼠中的肝纤维化
[0597]
为了确认mcd小鼠模型中观察到的肝纤维化减少不是这种情况所独有的,在肝纤维化的stam hfd
‑
cdaa小鼠模型中探索了mimt001的活性。简言之,两天龄的雄性c57bl/6小鼠通过单次皮下注射200ug的链脲佐菌素引起胰岛破坏,并且然后从4周龄开始喂食cdaa高
脂肪饮食(research diet#a06071302)并且继续在每项研究的整个持续时间。在8周龄时,基于alt评分将小鼠分为两组(每组7只小鼠)。通过每周两次腹膜内注射人抗migg4同种型对照(higg4,10mg/kg)或人抗gal3抗体(imt001
‑
4,10mg/kg)处理小鼠,持续4周。所有动物护理和程序均由immutics iacuc批准。
[0598]
用同种型对照抗体处理的stam cdaa
‑
hfd小鼠展示出该模型典型的肝损伤迹象,如天狼猩红染色的肝切片中所证明的,其展示出显著的脂肪变性和丰富的纤维化胶原沉积物的存在(图31a)。与那些对照处理的动物相比,来自imt001
‑
4处理动物的肝样品展示出相似水平的脂肪变性,但天狼猩红阳性纤维化胶原沉积物的水平实质上降低。天狼猩红染色的图像定量分析揭示,虽然用同种型对照抗体处理的stam cdaa
‑
hfd展示出5.1%面积天狼猩红染色,但在来自imt001处理的动物的样品中,这降低至1.66%,降低了67%(图31b)。这些数据指示gal3
‑
tim3阻断抗体可以减少肝纤维化的鼠stam cdaa
‑
hfd模型中的肝纤维化,并且与来自肝纤维化mcd模型的类似观察一起考虑,强烈表明具有tim3
‑
gal3阻断活性的抗gal3抗体在人纤维化疾病中具有治疗潜力。
[0599]
实施例32:人源化抗gal3抗体抑制uuo小鼠模型中的肾纤维化
[0600]
为了进一步评估具有阻断tim3
‑
gal3组装能力的gal3靶向抗体影响纤维化的能力,我们评估了人源化imt001
‑
4和imt006
‑
1在肾纤维化的小鼠单侧输尿管梗阻(uuo)模型中的影响。简言之,将8周龄的c57bl/6j雄性小鼠分为假(sham)、具有huigg4
‑
的uuo、和具有huimt001
‑
4的uuo、huimt006
‑
1和用二甲双胍处理的uuo。huigg4、huimt001
‑
4和huimt006
‑
1分别以10mg/kg q2dx3通过腹膜内途径施用,而二甲双胍(500mg/kg/天)溶解于饮用水中施用至小鼠。在一些情况下,治疗性抗体或二甲双胍在uuo前1天施用,而在其他实验中,治疗性抗体或二甲双胍在uuo后1天施用。uuo手术7天后,处死小鼠,收获左肾并且用4%多聚甲醛固定,用于免疫组织化学(ihc),并且将血液收集在肝素
‑
edta管中,用于血液生物化学分析。根据制造商提供的方案使用商业elisa试剂盒(catalog#mkm100;r&d systems,minneapolis,mn)测量血浆小鼠tim
‑
1/kim
‑
1/havcr的水平。根据制造商提供的方案使用商业elisa试剂盒(catalog#dy1857;r&d systems,minneapolis,mn)测量血浆小鼠脂钙蛋白
‑
2/ngal的水平。产生和加工5um固定的肾样品切片,用于天狼猩红染色,如对以上肝样品描述的。
[0601]
在初始uuo实验中,在uuo前一天用同种型对照抗体、imt001
‑
4、imt006
‑
1或用二甲双胍(临床上证明的肾纤维化调节剂)处理动物。对与肾纤维化相关的肾损伤标志物kim
‑
1的评估显示,相对于假手术处理的动物,用同种型对照抗体处理的uuo样品中kim
‑
1的强烈上调,而用imt001
‑
4或imt006
‑
1处理的动物,kim
‑
1水平相对于对照显著降低(图32a)。二甲双胍也降低了kim
‑
1的水平,然而,由于该组内的动物间变异性,降低没有统计学显著性。血清ngal(另一种全身性肾损伤标志物)的评估证实了类似的模式,其中同种型对照处理的uuo动物相对于假处理的动物展示出显著升高的水平,而imt001
‑
4和imt006
‑
1处理的uuo动物相对于同种型处理的uuo动物展示出血清ngal水平显著降低。在这种情况下,二甲双胍证明显著影响ngal水平。
[0602]
为了直接评估uuo模型中的肾纤维化,通过天狼猩红染色评估来自如上处理的动物的肾的纤维化沉积物。用同种型抗体处理的uuo动物展示出天狼猩红染色的特征模式(图32b)。相反地,来自用imt001
‑
4、imt001
‑
6或二甲双胍处理的uuo小鼠的肾样品显示,天狼猩
红染色实质上减少。切片的图像量化揭示,来自用同种型处理的uuo样品展示出2.65%的天狼猩红染色,而来自imt001
‑
4、imt006
‑
1和二甲双胍处理动物的样品展示出显著降低的天狼猩红染色,分别为1.75%、1.26%和1.83%(图32c)。
[0603]
综上所述,这些观察结果指示具有gal3
‑
tim3阻断活性的人源化抗体在肾纤维化中具有抗纤维化活性,将gal3
‑
tim3阻断抗体的抗纤维化活性范围扩展到肝纤维化以外。
[0604]
为了评估tim3
‑
gal3阻断抗体在减少肾纤维化方面的稳健性,评估了当在uuo手术后一天施用时,mimt001抑制纤维化的能力。在uuo手术和用同种型或对照抗体处理后,收获肾样品并且通过ihc染色胶原蛋白1a1(col1a1),这是肾纤维化的标志物。如图33a中显示的,用mimt001处理的动物比来自用同种型对照处理的动物的样品展示出col1a1染色水平降低。图像量化揭示,与假对照相比,col1a1染色在同种型对照处理的uuo肾样品中显著升高,列举的前者为5.48个强度单位,后者为17.75。相反地,观察到来自mimt001处理的动物的肾样品显著降低至9.17个强度单位,表示该纤维化标志物的总体降低了48%(图33b)。
[0605]
相应地,在肾纤维化中gal3
‑
tim3阻断抗体不仅提供预防益处,而且提供治疗益处。
[0606]
实施例33:抗gal3抗体抑制小鼠博莱霉素
‑
诱导的损伤模型中的肺纤维化
[0607]
肺纤维化是另一种重要形式的纤维化疾病,具有人的重大健康影响。为了评估gal3
‑
tim3阻断的抗纤维化作用是否扩展到肺纤维化的背景,评估了小鼠博莱霉素诱导的肺纤维化模型对mimt001的敏感性。简言之,用50ul的pbs中重构的30ug的博莱霉素硫酸(mp biomedicals,cat#190306)气管内注射c57blck/6雄性小鼠。在第18、20、22和24天用migg2b同种型对照,通过尾静脉注射的抗gal3抗体(mimt001)(10mg/kg)或通过气管内注射的50ul的captisol(med chem express,cat#hy
‑
17031)中10um的小分子td139(med chem express,cat#hy
‑
19940)处理小鼠。在第27天处死小鼠,并且手术解剖肺并且在4%多聚甲醛中固定24小时,交换成70%乙醇,并且嵌入石蜡中。通过来自electron microscopy sciences(hatfield,pa)的masson三色染色试剂盒(26367)评估固定样品中的肺纤维化。将5um肺切片固定在载玻片上。脱蜡后,在连续乙醇浴中再水化。通过在56度在bouin固定液中孵育染色1h,用briebrich scarlet/酸性品红、磷钼酸
‑
磷钨酸和苯胺蓝染色,然后在乙酸中分化,然后它们脱水、澄清和固定。
[0608]
来自同种型对照处理的小鼠的博来霉素损伤的肺在该模型中展示出典型的肺损伤形态,具有大量的肺纤维化和肺泡瘢痕迹象(图34a)。相反地,尽管用mimt001处理的博来霉素损伤动物的肺中存在损伤的证据,但是与同种型对照相比纤维化显著减少。肺损伤通过ashcroft评分进行量化,显示与来自mimt001处理的动物的样品的4.09相比,来自同种型对照处理的动物样品的肺的平均评分5.74,统计学显著降低表示纤维化损伤减少了29%(图34b)。这些数据指示,gal3
‑
靶向gal3
‑
tim3阻断抗体可改善肺纤维化中的纤维化疾病,扩展了在肾和肝纤维化中进行的类似的先前观察。
[0609]
实施例34:抗gal3抗体的序列
[0610]
确定了本文公开的抗gal3的互补决定区(cdr)序列。使用imgt(world wide web.ebi.ac.uk/ipd/imgt/hla/align.html)提供cdr。图35a中提供了重链cdr(vh)并且图35b中提供了轻链cdr(vl)。图36a中提供了完整的vh序列,并且图36b中提供了完整的vh序列。图37中提供了恒定区的序列。
[0611]
来自不同bin的gal3结合抗体的互补决定区使用clustal omega比对(图38)。bin 1抗体在vh cdr1和cdr2以及在vl cdr1和cdr3区域中共享显著的同源性。bin 2抗体在所有检查的cdr中共享显著的同源性,观察到相对保守的a/s、v/t、h/d和l/f置换。bin 3抗体在某种程度上更加多样化,在cdr1中具有显著的序列同源性,但在其他cdr区域中相对不同。bin 4抗体在所有检查的cdr中共享显著的同源性,观察到相对保守的a/t、i/v、d/g、s/n、qk和v/l置换。bin 5抗体在所有cdr中也共享显著的同源性,除了较不保守的t/i、n/y置换之外,还观察到相对保守的y/f、n/k置换。最后,观察到bin 7抗体cdr几乎相同,vl cdr2中的单个v/l置换将3b11.2g2与13a12.2e5区分。与图35a
‑
b、36a
‑
b、37或38中提供的任何其他序列比对可以用本领域已知的技术完成。
[0612]
在至少一些先前描述的实施方式中,实施方式中使用的一个或多个元素可以互换地用于另一实施方式中,除非这种替换在技术上不可行。本领域技术人员将理解,在不脱离要求保护的主题的范围的情况下,可以对以上描述的方法和结构进行各种其他省略、添加和修改。所有这些修改和变化都旨在落入由所附权利要求定义的主题范围内。
[0613]
关于本文中基本上任何复数和/或单数术语的使用,本领域技术人员可以作为适合于上下文和/或应用从复数转换为单数和/或从单数转换为复数。为了清楚起见,本文可以明确地陈述各种单数/复数排列。
[0614]
本领域技术人员将理解,一般而言,本文使用的术语,尤其是所附权利要求书(例如,所附权利要求书的主体)中的,旨在作为“开放”术语(例如,术语“包括”(“including”)应解释为“包括但不限于”,术语“具有”应解释为“至少具有”,术语“包括”(“includes”)应解释为“包括但不限于”等)。本领域技术人员将进一步理解,如果打算引入特定数量的权利要求阐述,则将在权利要求中明确地阐述这种意图,并且在没有这种阐述的情况下不存在这种意图。例如,为了帮助理解,以下所附权利要求可能含有使用介绍性短语“至少一个/一种”和“一个或多个/一种或多种”来介绍权利要求的叙述。然而,这种短语的使用不应被解释为暗示通过不定冠词“一个/一种”(“a”)或“一个/一种”(“an”)引入权利要求阐述将含有这种引入的权利要求阐述的任何特定权利要求限制为仅含有一个这种阐述的实施方式,即使当相同权利要求包括介绍性短语“一个或多个/一种或多种”或“至少一个/一种”和不定冠词,比如“一个/一种”(“a”)或“一个/一种”(“an”)(例如,“一个/一种”(“a”)或“一个/一种”(“an”)应解释为“至少一个/一种”或“一个或多个/一种或多种”);这同样适用于使用定冠词来介绍权利要求。另外,即使明确阐述了引入的权利要求引用的具体编号,本领域技术人员将认识到,这种阐述应该被解释为意味着至少表示引用的编号(例如,“两次引用”的裸引用,而不是其他修饰语,意味着至少两次引用,或两次或更两次引用)。此外,在那些类似于“a、b和c等中的至少一个/一种”的约定的情况下被使用,一般而言,这种构造旨在在本领域技术人员将理解约定的意义上(例如,“具有a、b和c中的至少一个/一种系统”将包括但不限于以下系统:单独的a、单独的b、单独的c、a和b一起、a和c一起、b和c一起和/或a、b和c一起等)。在那些类似于“a、b或c等的至少一个/一种”的约定的情况下被使用,一般而言,这种构造旨在在本领域技术人员将理解约定的意义上(例如,“具有a、b或c中的至少一个/一种的系统”将包括但不限于以下系统:单独的a、单独的b、单独的c、a和b一起、a和c一起、b和c一起和/或a、b和c一起等)。本领域技术人员将进一步理解,实际上任何呈现两个或多个可选的术语的分离词和/或短语,无论是在说明书、权利要求或附图中,都应被理解为考虑包
括术语之一的可能性,其中一个术语,或两个术语。例如,短语“a或b”将被理解为包括“a”或“b”或“a和b”的可能性。
[0615]
另外,在根据马库什组描述本公开的特征或方面的情况下,本领域技术人员将认识到,因此也根据马库什组的任何个体成员或成员子组来描述本公开。
[0616]
如本领域技术人员将理解的,对于任何和所有目的,比如根据提供书面描述,本文公开的所有范围还涵盖任何和所有可能的子范围及其子范围的组合。任何列出的范围都可以很容易地被识别为足够描述并且能够将相同的范围分解为至少相等的一半、三分之一、四分之一、五分之一、十分之一等。作为非限制性实施例,本文讨论的每个范围都可以很容易地分解分为下三分之一、中三分之一和上三分之一等。如本领域技术人员还将理解的所有语言,比如“高达”、“至少”、“大于”、“小于”等和如包括所列举的数字,并且指可以随后分解为子范围的范围,如以上所讨论。最后,如本领域技术人员将理解的,范围包括每个单独的成员。因此,例如,具有1
‑
3个主题的组是指具有1、2或3个主题的组。类似地,具有1
‑
5个主题的组是指具有1、2、3、4或5个主题等的组。
[0617]
虽然本文已经公开了各种方面和实施方式,但其他方面和实施方式对于本领域技术人员来说将是显而易见的。本文公开的各种方面和实施方式是为了阐述的目的而不旨在限制性的,真实范围和精神是由以下权利要求指示的。
[0618]
在本公开中引用的所有文章、专利、专利申请和其他出版物这里均通过引用以每个它们整体并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。