用于调节dux4的表达的化合物、方法和医药组合物
技术领域
1.本发明涉及用于减少动物的dux4 mrna和蛋白质的表达的化合物、使用该化合物的方法和含有该化合物的医药组合物。本发明的方法对于治疗、预防或减轻dux4相关疾病,例如面肩肱型肌营养不良(facioscapulohumeral muscular dystrophy:fshd)。
背景技术:
2.面肩肱型肌营养不良(fshd)是在全世界以20000分之一、在欧洲以7500分之一的概算频率发病的肌营养不良,在肌营养不良中,是次于杜氏肌营养不良(duchenne muscular dystrophy)、强直性肌营养不良的第3多的疾病。初发症状为面部或上肢、肩胛部、上肢带的肌力下降,随着疾病进行,下肢带、下肢也产生障碍,在约20%的病例中,在40岁之前在轮椅上生活(即使成为壮年期,也有仅轻度的面部肌无力的情况)。也多并发有疼痛、神经性耳聋和视网膜病。约9成的患者在20岁前发病。在重症患者(约4%)中,从婴儿期起显示肌力下降。
3.根据原因基因,fshd被分类为fshd1和fshd2这2个类型。fshd1型占fshd患者整体的约95%。在fshd1型患者中,4q35的d4z4重复区域会遗传性地缩短(1~10个的d4z4重复),由此引起被d4z4重复区域所编码的dux4的异常表达(在健康人中,dux4不表达)。fshd2型占fshd患者整体的约5%,因smchd1(dna甲基化酶)变异而引起dux4的异常表达。dux4具备类转录因子的功能,使下游所编码的引起肌肉细胞的细胞凋亡或肌肉萎缩的基因组表达。dux4的异常表达是由于保有4qa与4qb这2个等位基因中被称为4qa的等位基因而导致的。4qa中存在的聚腺苷酸化位点对于dux4 mrna的稳定化是必需的(非专利文献1、非专利文献2、非专利文献3)。
4.反义技术作为用于调节某些基因产物的表达的有效手段而逐渐为人所知,因此,有判明在用于调节dux4的几个治疗、诊断和研究应用中非常有用的可能性。
5.报告了使用编码dux4 mirna的腺伴随病毒来抑制dux4基因的表达的方法(专利文献1),但制备该腺伴随病毒繁杂,并且难以送达至需要的全身肌肉。
6.报告了使用编码dux4 shrna的慢病毒来抑制dux4基因的表达的方法(非专利文献2),但制备该慢病毒繁杂,并且难以送达至需要的全身肌肉。进而,在四头肌或斜方肌细胞的体外(invitro)的基因抑制作用有21%、44%的残留活性,不能说是充分的效果。
7.报告了连接有多个针对dux4的反义寡核苷酸的化合物(专利文献2),但并不是修饰寡核苷酸,并且其抑制效果不能说充分。
8.报告了结合于dux4 mrna的剪接部位的反义寡核苷酸化合物(专利文献3),但这些化合物由于为包含内含子的前mrna选择性,因此对成熟mrna的抑制效果弱,另外,由于基于脂质体转染法的敲减而难以对生物体给药。
9.作为目前进行的fshd治疗方法,是作为对症疗法的复健(伸展、运动)、nsaids的给药、呼吸护理等,但效果不充分,患者的负担大。因此,本说明书中的目的是提供用于处置fshd的化合物、组合物和方法。
10.现有技术文献
11.专利文献
12.专利文献1:国际公开第2013/016352号
13.专利文献2:国际公开第2017/007886号
14.专利文献3:美国公开第2012/0225034号
15.非专利文献
16.非专利文献1:snider et al.,plos 2010,vol.6(10)p1
17.非专利文献2:ferreboeuf et al.,humanmolecular genetics 2013,vol.23(1),p171
18.非专利文献3:sacconi et al.,biochim.biophys.acta 2015,p607
技术实现要素:
19.本发明的课题在于提供用于抑制dux4的表达的、以及用于处置、即治疗、预防、延迟或改善dux4相关疾病和/或其症状的化合物、方法和医药组合物。本说明书中公开的化合物和医药组合物也抑制snp等变异型dux4或dux4的剪接变体。
20.某种实施方式提供一种方法,是在动物(包含人类)中减少dux4的表达的方法,包括将本说明书中记载的含有以dux4为靶的修饰寡核苷酸的化合物或含有该化合物的医药组合物对动物进行给药。
21.某种实施方式提供一种方法,将含有以dux4为靶的修饰寡核苷酸的化合物或医药组合物对动物进行给药,进行核内核糖核酸酶(rnase h等)介导的敲减。另外,提供一种方法,其给药含有该修饰寡核苷酸的化合物来抑制dux4 mrna的转录或dux4蛋白质的翻译。修饰寡核苷酸优选分布于肌肉中,特别优选分布于骨骼肌中。
22.某种实施方式提供一种处置具有fshd的动物的方法。某种实施方式中,本发明的方法进一步包括将包含本说明书中记载的以dux4为靶的修饰寡核苷酸的治疗有效量的化合物或医药组合物对动物进行给药。某种实施方式中,本发明的方法包括确定具有fshd1和/或fshd2的动物。
23.某种实施方式提供处置、即治疗、预防、延迟或改善肌肉萎缩、肌力下降的方法。缓和面颊部、肩、上臂部的肌力下降导致的缺乏表情/睁眼睡觉/上肢举起困难/翼状肩胛,或者延迟恶化。另外,优选防止腰带、下肢的肌力下降,进一步优选防止神经性耳聋和视网膜病的并发。
24.某种实施方式中,dux4 mrna具有genbank登录号nm_001293798.2记载的序列(作为序列表的序列号1并入本说明书中)。序列表的序列号1的dux4 mrna的剪接变体也称为dux4
‑
fl1或dux4的成熟mrna。某种实施方式中,dux4 mrna具有genbank登录号nm_001306068.2记载的序列(作为序列表的序列号5并入本说明书中)。序列表的序列号5的dux4 mrna的剪接变体也称为dux4
‑
fl2。某种实施方式中,dux4具有genbank登录号nm_001363820.1记载的序列(作为序列表的序列号6并入本说明书中)。序列表的序列号6的dux4 mrna的剪接变体也称为dux4
‑
s。某种实施方式中,dux4称为上述剪接变体的snp。
25.本发明涉及以下项[1]~[27]中记载的非限定性的带编号的实施方式,但并不限定于这些。
[0026]
项[1]一种修饰寡核苷酸,由12~30个残基构成,
[0027]
包含至少8个连续的核酸碱基序列,该核酸碱基序列与序列号1的dux4的成熟mrna的核酸碱基序列的从5’末端起第126~147位、232~248位、1306~1325位或1480~1495位的其等长部分互补,
[0028]
上述修饰寡核苷酸的核酸碱基序列与序列号1的dux4的成熟mrna的核酸碱基序列的其等长部分具有至少90%的互补性,
[0029]
在上述至少8个连续的核酸碱基序列包含与序列号1的核酸碱基序列的从5’末端起第1480~1495位的其等长部分互补的核酸碱基序列的情况下,上述修饰寡核苷酸由在3’末端具有序列号1的核酸碱基的从5’末端起第1480位的碱基的互补碱基的核酸碱基序列构成。
[0030]
项[2]根据项[1]所述的修饰寡核苷酸,其中,上述修饰寡核苷酸中的1个以上的修饰核苷酸包含修饰糖。
[0031]
项[3]根据项[2]所述的修饰寡核苷酸,其中,上述修饰糖选自双环糖、由2
’‑
o
‑
甲氧基乙基修饰的糖和由2
’‑
o
‑
甲基修饰的糖。
[0032]
项[4]根据项[3]所述的修饰寡核苷酸,其中,上述双环糖选自lna、guna、alna[ms]、alna[mu]、alna[ipu]、alna[oxz]和alna[trz]。
[0033]
项[5]一种修饰寡核苷酸,由12~30个残基构成,
[0034]
包含至少8个连续的核酸碱基序列,该核酸碱基序列与序列号1的dux4的成熟mrna的核酸碱基序列的从5’末端起第1472~1495位的其等长部分互补,
[0035]
上述修饰寡核苷酸的核酸碱基序列与序列号1的dux4的成熟mrna的核酸碱基序列的其等长部分具有至少90%的互补性,
[0036]
上述修饰寡核苷酸含有至少1个包含选自guna、alna[ms]、alna[mu]、alna[ipu]、alna[oxz]和alna[trz]中的修饰糖的核苷。
[0037]
项[6]根据项[5]所述的修饰寡核苷酸,其中,上述修饰寡核苷酸进一步包含由2
’‑
o
‑
甲氧基乙基修饰的糖和/或由2
’‑
o
‑
甲基修饰的糖。
[0038]
项[7]根据项[1]~[6]中任一项所述的修饰寡核苷酸,其中,上述修饰寡核苷酸中的至少1个修饰核苷酸包含修饰核酸碱基。
[0039]
项[8]根据项[7]所述的修饰寡核苷酸,其中,上述修饰核酸碱基为5
‑
甲基胞嘧啶。
[0040]
项[9]根据项[1]~[8]中任一项所述的修饰寡核苷酸,其中,至少1个核苷间键为修饰核苷间键。
[0041]
项[10]根据项[9]所述的修饰寡核苷酸,其中,上述修饰核苷间键为硫代磷酸酯核苷间键。
[0042]
项[11]根据项[1]~[10]中任一项所述的修饰寡核苷酸,其中,上述修饰寡核苷酸包含:
[0043]
1)间隙片段,
[0044]
2)5’侧翼片段,以及
[0045]
3)3’侧翼片段;
[0046]
上述间隙片段位于上述5’侧翼片段与上述3’侧翼片段之间,
[0047]
上述5’侧翼片段和3’侧翼片段的核苷均包含至少1个修饰糖,
[0048]
上述间隙片段的核苷仅为不含修饰糖的核苷,或者为包含1或2个包含修饰糖的核苷且除此以外不含修饰糖的核苷。
[0049]
项[12]根据项[1]~[11]中任一项所述的修饰寡核苷酸,其中,上述修饰寡核苷酸由与序列号1的dux4的成熟mrna的核酸碱基序列的从5’末端起第128~143位的核酸碱基序列、从5’末端起第232~247位的核酸碱基序列、从5’末端起第233~248位的核酸碱基序列、从5’末端起第1309~1323位的核酸碱基序列或从5’末端起第1480~1495位的核酸碱基序列互补的核酸碱基序列构成。
[0050]
项[13]根据项[1]~[12]中任一项所述的修饰寡核苷酸,其中,上述修饰寡核苷酸由gtggcgatgc ccgggt(序列号75)、gagattcccg cnggtg(序列号78:n表示5
‑
甲基胞嘧啶)、ngagattcccgccggt(序列号2:n表示5
‑
甲基胞嘧啶)、gnagttctccgcggt(序列号3:n表示5
‑
甲基胞嘧啶)或gnntagacagcgtngg(序列号4:n表示5
‑
甲基胞嘧啶)的碱基序列构成。
[0051]
项[14]根据项[13]所述的修饰寡核苷酸,由下式表示:
[0052]
glsmlsmlstdsadsgdsadscdsadsgdscdsgdstdsmlsglsgl。
[0053]
式中,
[0054]
各核酸碱基按照下述记号来表示:
[0055]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、m=5
‑
甲基胞嘧啶,
[0056]
各糖部分按照下述记号来表示:
[0057]
l=lna、d=2
’‑
脱氧核糖,
[0058]
各核苷间键按照下述记号来表示:
[0059]
s=硫代磷酸酯。
[0060]
项[15]根据项[13]所述的修饰寡核苷酸,由下式表示:
[0061]
gmsmmsmmstdsadsgdsadscdsadsgdscdsgdstdsmmsgmsgm。
[0062]
式中,
[0063]
各核酸碱基按照下述记号来表示:
[0064]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、m=5
‑
甲基胞嘧啶,
[0065]
各糖部分按照下述记号来表示:
[0066]
m=alna[ms]、d=2
’‑
脱氧核糖,
[0067]
各核苷间键按照下述记号来表示:
[0068]
s=硫代磷酸酯。
[0069]
项[16]根据项[13]所述的修饰寡核苷酸,由下式表示:
[0070]
gmsmmsamsgdstdstdscdstdscdscdsgdscdsgmsgmstm。
[0071]
式中,
[0072]
各核酸碱基按照下述记号来表示:
[0073]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、m=5
‑
甲基胞嘧啶,
[0074]
各糖部分按照下述记号来表示:
[0075]
m=alna[ms]、d=2
’‑
脱氧核糖,
[0076]
各核苷间键按照下述记号来表示:
[0077]
s=硫代磷酸酯。
[0078]
项[17]根据项[13]所述的修饰寡核苷酸,由下式表示:
[0079]
mlsglsalsgdsadstdstdscdscdscdsgdscdscdsglsglstl。
[0080]
式中,
[0081]
各核酸碱基按照下述记号来表示:
[0082]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、m=5
‑
甲基胞嘧啶;
[0083]
各糖部分按照下述记号来表示:
[0084]
l=lna、d=2
’‑
脱氧核糖,
[0085]
各核苷间键按照下述记号来表示:
[0086]
s=硫代磷酸酯。
[0087]
项[18]根据项[14]所述的修饰寡核苷酸或其盐,由下式表示:
[0088][0089]
项[19]根据项[15]所述的修饰寡核苷酸或其盐,由下式表示:
[0090][0091]
项[20]根据项[16]所述的修饰寡核苷酸或其盐,由下式表示:
[0092][0093]
项[21]根据项[17]所述的修饰寡核苷酸或其盐,由下式表示:
[0094][0095]
项[22]一种医药组合物,包含项[1]~[21]中任一项所述的修饰寡核苷酸或其医药上可允许的盐、以及药学上可允许的载体。
[0096]
项[23]根据项[22]所述的医药组合物,用于dux4相关疾病的治疗、预防或延迟其进展。
[0097]
项[24]根据项[23]所述的医药组合物,其中,上述dux4相关疾病为面肩肱型肌营养不良。
[0098]
项[25]一种用于受试者的dux4相关疾病的治疗、预防或延迟其进展的方法,其特征在于,将项[1]~[21]中任一项所述的修饰寡核苷酸的有效量对需要其的受试者进行给药。
[0099]
项[26]一种制造用于dux4相关疾病的治疗、预防或延迟其进展的医药品的项[1]~[21]中任一项所述的修饰寡核苷酸的应用。
[0100]
项[27]一种用于dux4相关疾病的治疗、预防或延迟其进展的项[1]~[21]中任一项所述的修饰寡核苷酸的应用。
[0101]
根据本发明,能够提供对由dux4基因的异常表达引起的面肩肱型肌营养不良等疾病的处置有效的修饰寡核苷酸。
附图说明
[0102]
图1是表示通过给药各种dux4修饰寡核苷酸所带来的dux4基因表达的抑制效果的附图。
[0103]
图2是表示通过给药各种dux4修饰寡核苷酸所带来的dux4基因表达的抑制效果的
附图。
[0104]
图3是表示通过给药dux4修饰寡核苷酸所带来的用量依赖性的dux4基因表达的抑制效果的附图。
[0105]
图4是表示通过给药各种dux4修饰寡核苷酸所带来的dux4基因表达的抑制效果的附图。
[0106]
图5是表示通过给药dux4修饰寡核苷酸(化合物编号3)所带来的dux4 tg小鼠中的肌酸激酶和dux4 mrna的抑制效果的附图。
[0107]
图6是表示通过给药dux4修饰寡核苷酸(化合物编号123、化合物编号247和化合物编号113)所带来的dux4 tg小鼠的肌酸激酶和dux4 mrna的抑制效果的附图。
具体实施方式
[0108]
上述的概要和以下的详细说明两者均仅是例示性和说明性的,应理解为并非限制所请求的本发明。本说明书中,只要没有特别记载,单数形的使用包含复数形。本说明书中,只要没有特别记载,“或”的使用是指“和/或”。进而,用语“包括(including)”以及其它形态,例如“包含(includes)”和“所包含(included)”的使用均不是限定性的。进而,只要没有特别记载,“要素”等用语包含含有1个单元的要素和含有超过1个亚单元的要素。
[0109]
本说明书使用的章节的标题只是出于构成上的目的,不应解释为限定所记载的主题。对于包含但不限定于专利、专利申请、文章、书籍和论文的本技术所引用的全部文件或文件的一部分,关于本说明书中所论述的文件的一部分和其整体,通过参照而明确地并入本说明书中。
[0110]
(定义)
[0111]
只要未给出具体的定义,则本说明书中记载的与分析化学、有机合成化学、以及医学化学和药物化学相关联而被利用的命名法和它们的顺序和做法在本技术领域中是公知的,是通常使用的。在本说明书中使用的化学合成和化学分析中可以使用标准的做法。在被允许的情况下,对于贯穿本说明书的公开整体而提及的所有专利、申请、公开申请和其它刊物、可通过国立生物技术信息中心(ncbi)等的数据库而获得的genbank登录号和相关序列信息以及其它数据,关于本说明书中所论述的文件的一部分和其整体,通过参照而明确地并入本说明书中。
[0112]
另外,本说明书与电子格式的序列表一起申请,该电子格式中记载的序列表的信息通过参照而将其整体并入本说明书中。
[0113]
只要没有特别指示,则以下的用语具有以下的含义。
[0114]“核酸”是指由单体的核苷酸构成的分子。作为核酸的例子,可举出核糖核酸(rna)、脱氧核糖核酸(dna)、单链核酸、双链核酸、小分子干扰核糖核酸(sirna)和微rna(mirna),但并不限定于这些。核酸也可以在单一分子中包含这些要素的组合。
[0115]“核酸碱基”是指能够与另一核酸的碱基配对的杂环部分。核酸碱基有“修饰核酸碱基”和“非修饰核酸碱基”。
[0116]“核酸碱基序列”是指任意的与糖键或核酸碱基修饰没有关系的连续的核酸碱基的顺序。
[0117]“核苷”是指连接于糖的核酸碱基。某种实施方式中,核苷连接于磷酸基。
[0118]“核苷酸”是指具有与核苷的糖部分共价键合的磷酸基等的核苷。天然存在的核苷酸的糖部分为核糖或脱氧核糖,介由磷酸基,通过磷酸二酯键进行共价键合。
[0119]“低聚物化合物”或“低聚物”是指能够与核酸分子的至少一个区域杂交的连接单体亚单元的聚合物。
[0120]“寡核苷酸”是指各核苷和各核苷间键相互独立地可以被修饰也可以不被修饰的连接的核苷的聚合物。
[0121]“非修饰核苷酸”是指由天然存在的核酸碱基、糖部分和核苷间键构成的核苷酸。某种实施方式中,非修饰核苷酸为rna核苷酸(即β
‑
d
‑
核糖核苷)或dna核苷酸(即β
‑
d
‑
脱氧核糖核苷),但并不限定于这些。
[0122]“修饰核苷酸”是指独立地具有修饰糖部分、修饰核苷间键或修饰核酸碱基的核苷酸。“修饰核苷”是指独立地具有修饰糖部分或修饰核酸碱基的核苷。
[0123]“核苷间键”是指核苷间的化学键。
[0124]“连接的核苷”是指通过核苷间键来键合或连接的邻接核苷。
[0125]“天然存在的核苷间键”是指3
’‑5’
磷酸二酯键。
[0126]“修饰核苷间键”是指从天然存在的核苷间键(即磷酸二酯核苷间键)的取代或任意变化。例如有硫代磷酸酯核苷间键,但并不限定于此。
[0127]“硫代磷酸酯核苷间键”是指通过将1个非交联氧原子用硫原子取代而对磷酸二酯键进行修饰的核苷间的键。硫代磷酸酯键是该修饰核苷间键的1个例子。
[0128]“修饰核酸碱基”是指除腺嘌呤、胞嘧啶、鸟嘌呤、胸腺嘧啶或尿嘧啶以外的任意核酸碱基。例如有5
‑
甲基胞嘧啶,但并不限定于此。“非修饰核酸碱基”是指嘌呤碱基的腺嘌呤(a)和鸟嘌呤(g)、以及嘧啶碱基的胸腺嘧啶(t)、胞嘧啶(c)和尿嘧啶(u)。
[0129]“修饰寡核苷酸”是指包含至少1个该修饰核苷和/或该修饰核苷间键的寡核苷酸。
[0130]“盐”是将酸所包含的1个以上的可解离的氢离子用金属离子或铵离子等阳离子取代而得的化合物的总称,作为修饰寡核苷酸的盐,可举出在硫代磷酸酯键的硫(s)基或修饰核酸碱基内的官能团(例如氨基)上,与无机物离子(例如钠离子、镁离子)所形成的盐(例如钠盐、镁盐),但并不限定于此。
[0131]“糖”或“糖部分”是指天然糖部分或修饰糖部分。
[0132]“天然糖部分”是指dna(2
’‑
h)或rna(2
’‑
oh)中可见的糖。
[0133]“修饰糖”是指从天然糖部分的取代或变化。作为修饰糖,例如可举出取代糖部分和代用糖部分。
[0134]“取代糖部分”是指除rna或dna的天然糖以外的呋喃糖基。
[0135]“2
’‑
o
‑
甲氧基乙基”(2
’‑
moe和2
’‑
o(ch2)2‑
och3也同样)是指呋喃糖基环的2’位的o
‑
甲氧基
‑
乙基修饰。经2
’‑
o
‑
甲氧基乙基修饰的糖为修饰糖。
[0136]“2
’‑
o
‑
甲氧基乙基核苷酸”是指包含经2
’‑
o
‑
甲氧基乙基修饰的糖部分的核苷酸。
[0137]“2
’‑
o
‑
甲基”(2
’‑
ome和2
’‑
och3也同样)是指呋喃糖基环的2’位的o
‑
甲基修饰。经2
’‑
o
‑
甲基修饰的糖为修饰糖。
[0138]“2
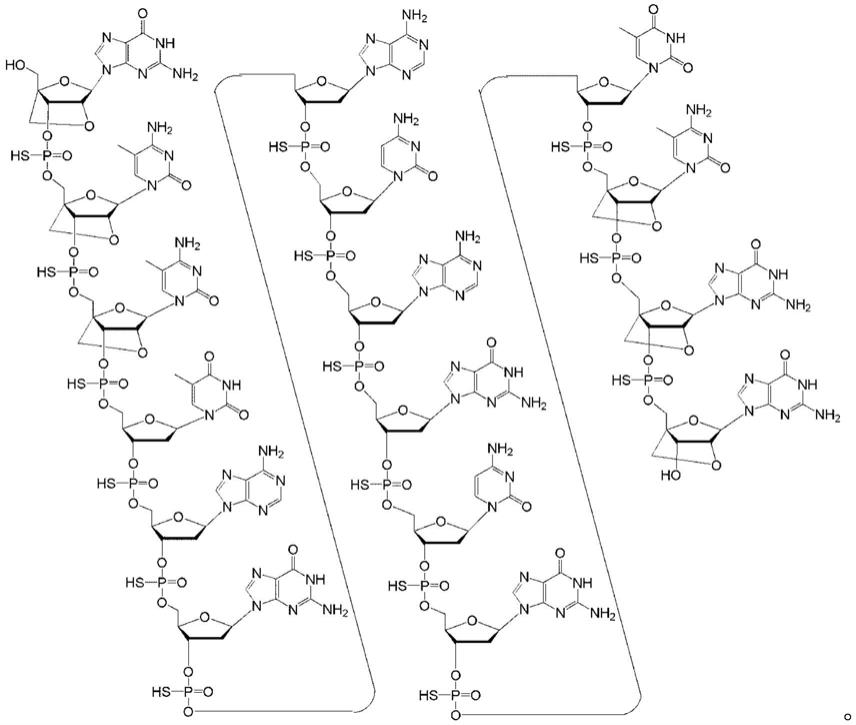
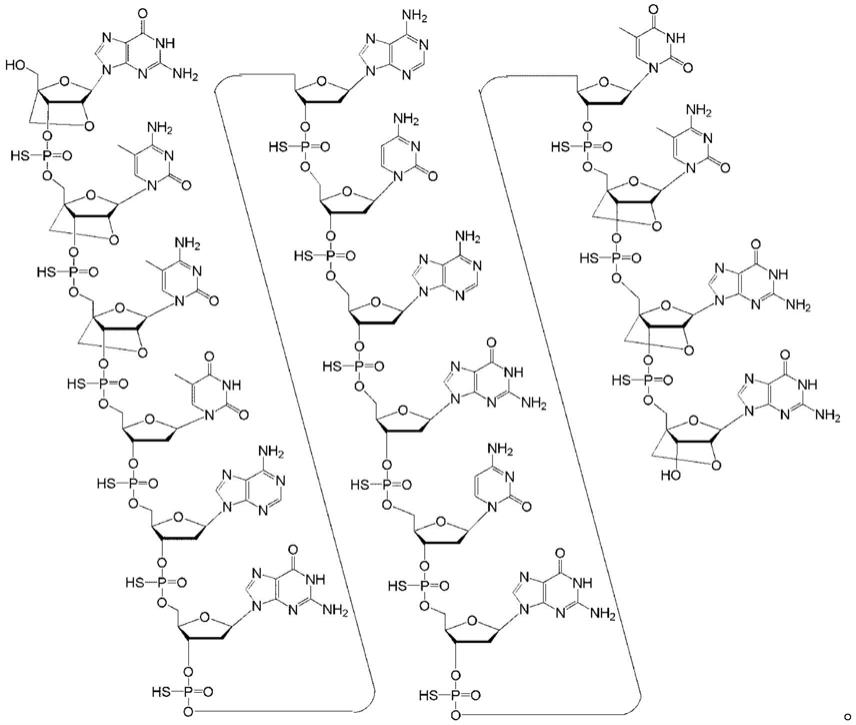
’‑
o
‑
甲基核苷酸”是指包含经2
’‑
o
‑
甲基修饰的糖部分的核苷酸。
[0139]
用于“代用糖部分”的“糖代用物”是指仅糖单元(呋喃糖环)的取代。糖代用物可以取代核苷的天然存在的糖部分,其结果,得到的核苷亚单元可以相互连接和/或与其它核苷
连接,形成能够与互补的低聚物化合物杂交的低聚物化合物。这样的结构体包含:含有与呋喃糖基不同数量的原子的环(例如4、6或7元环);呋喃糖基的氧与非氧原子(例如碳、硫或氮)的取代;或原子数的变化和氧的取代这两者。这样的结构体也可包含对应于取代糖部分所记载的内容的取代(例如,任意地包含进一步的取代基的6元的碳环式双环糖代用物)。糖代用物也包含更复杂的糖的取代(例如非环系的肽核酸)。作为糖代用物,可举出吗啉代、环己烯基和环己六醇,但不限定于此。
[0140]“双环糖”是指通过存在于同一环上的2个不同的碳原子的交联而修饰的呋喃糖基环。优选“双环糖”是指呋喃糖基环的2’位与4’位通过交联而被修饰的修饰糖。“双环核酸”是指核苷或核苷酸的呋喃糖部分包含“双环糖”的核苷或核苷酸。
[0141]“lna”是指通常被成为2’,4
’‑
锁核酸(locked nucleic acid)的核苷或核苷酸,例如,可举出通式:
[0142][0143]
[式中,
[0144]
b为核酸碱基,
[0145]
x和y各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等]
[0146]
表示的核苷或核苷酸(参照wo98/39352)。典型的具体例可举出下述式:
[0147][0148]
表示的核苷或核苷酸。
[0149]“guna”为下述式:
[0150][0151]
[式中,b为核酸碱基,r3、r4、r5、r6各自独立地为氢原子或可以被1个以上的取代基取代的c1‑6烷基,r7、r8各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等,而且r9、r
10
、r
11
各自独立地为氢原子、可以被1个以上的取代基取代的c1‑6烷基、或者氨基的保护基团]
[0152]
表示的核苷或核苷酸。(例如参照国际公开第2014/046212号、国际公开第2017/047816号)。
[0153]“alna[mu]”为下述通式(i):
[0154][0155]
[式中,
[0156]
b为核酸碱基;
[0157]
r1、r2、r3和r4各自独立地为氢原子、或可以被1个以上的取代基取代的c1‑6烷基,
[0158]
r5和r6各自独立地为氢原子、羟基的保护基团、或可以被取代的磷酸基、对磷部分或支承体的共价键等,
[0159]
m为1或2;
[0160]
x为下述式(ii
‑
1):
[0161][0162]
表示的基团,
[0163]
式(ii
‑
1)中记载的记号:
[0164][0165]
表示与2
’‑
氨基的键合点,
[0166]
r7和r8中的一者为氢原子,另一者为可以被1个以上的取代基取代的甲基]
[0167]
表示的核苷或核苷酸(例如参照日本特愿2018
‑
212424)。典型的具体例是r7和r8中的一者为氢原子,另一者为无取代的甲基的核苷或核苷酸。
[0168]“alna[ipu]”为上述的“alna[mu]”中所定义的通式(i)表示的核苷或核苷酸,该式中,
[0169]
x为下述式(ii
‑
1):
[0170][0171]
表示的基团,
[0172]
r7和r8中的一者为氢原子,另一者为可以被1个以上的取代基取代的异丙基(例如参照日本特愿2018
‑
212424)。典型的具体例是r7和r8中的一者为氢原子,另一者为无取代的异丙基的核苷或核苷酸。
[0173]“alna[trz]”为上述的“alna[mu]”中所定义的通式(i)表示的核苷或核苷酸,该式中,
[0174]
x为下述式(ii
‑
2):
[0175][0176]
表示的基团,
[0177]
a为可以被1个以上的取代基取代的三唑基(例如参照日本特愿2018
‑
212424)。典型的具体例是a为可以具有1或多个甲基的三唑基,更具体而言为1,5
‑
二甲基
‑
1,2,4
‑
三唑
‑3‑
基的核苷或核苷酸。
[0178]“alna[oxz]”为上述的“alna[mu]”中所定义的通式(i)表示的核苷或核苷酸,该式
中,
[0179]
x为下述式(ii
‑
2):
[0180][0181]
表示的基团,
[0182]
a为可以被1个以上的取代基取代的二唑基(例如参照日本特愿2018
‑
212424)。典型的具体例是a为可以具有1个或多个甲基的二唑基、更具体而言为5
‑
甲基
‑
1,2,4
‑
二唑
‑3‑
基的核苷或核苷酸。
[0183]“alna[ms]”为上述的“alna[mu]”中所定义的通式(i)表示的核苷或核苷酸,该式中,
[0184]
x为下述式(ii
‑
3):
[0185][0186]
表示的基团,
[0187]
m为可以被甲基取代的磺酰基,该甲基可以被1个以上的取代基取代(例如参照日本特愿2018
‑
212424)。典型的具体例是m为被无取代的甲基取代的磺酰基的核苷或核苷酸。
[0188]“5
‑
甲基胞嘧啶”是指被键合于5位的甲基修饰的胞嘧啶。5
‑
甲基胞嘧啶为修饰核酸碱基。
[0189]“单链寡核苷酸”是指未与互补链杂交的寡核苷酸。
[0190]“dux4”是指也被称为双同源框4(double homeobox4)的转录因子的核酸或蛋白质。dux4例如可举出由dux4基因所转录的各种剪接变体、或其单碱基取代物(snp),也可以为该变异体和/或snp。
[0191]
对于dux4 mrna,报告了大量的剪接变体。人dux4
‑
s(序列表的序列号6)根据外显子1内的非典型的剪接供体位点(splicing donor site),由短的外显子1(外显子1s)、外显子2、外显子3构成,编码没有毒性的短的dux4蛋白质。人dux4
‑
fl由外显子1、外显子2、外显子3构成,编码全长的dux4蛋白质。dux4
‑
fl有作为不含内含子1的成熟mrna的dux4
‑
fl1(序列表的序列号1)和包含内含子1的dux4
‑
fl2(序列表的序列号5),均编码全长的dux4蛋白质,在肌肉中表达时认为是fshd的原因(参照上述非专利文献2)。
[0192]
dux4 mrna也在正常的睾丸中表达,除dux4
‑
fl以外,还表达外显子1、外显子2、外显子6、外显子7的剪接变体和/或外显子1、外显子2、外显子4、外显子5、外显子6、外显子7的剪接变体(参照上述非专利文献1)。
[0193]
dux4蛋白质作为转录因子发挥作用,作为通过dux4来调节转录的基因,例如可举
出mbd3l2、zscan4、trim43、defb103、znf217等(参照上述非专利文献2)。
[0194]
本发明的修饰寡核苷酸的靶dux4 mrna例如优选人dux4,更优选dux4
‑
fl、进一步优选序列表的序列号1中记载的dux4
‑
fl1。另外,作为本发明的修饰寡核苷酸对dux4的靶部位,优选外显子1、内含子1、外显子2、内含子2、外显子3。
[0195]
已知dux4基因因易位等染色体异常而与其它基因融合而表达。作为其它基因,例如报告有igh(yasuda等,nature genetics 48(5),569(2016))、cic(yoshimoto等,cancer research 77,2927(2017))、ewsr1(sirvent等,cancer genetics and cytogenetics 195,12(2009)),分别被认为是b细胞性急性淋巴性白血病、分化圆细胞肉瘤、胚胎型横纹肌肉瘤等的原因基因。本发明的修饰寡核苷酸也包含以它们的融合基因为靶的化合物。
[0196]“dux4的表达”是指由编码dux4的基因所转录的mrna的水平,或者由该mrna所翻译的蛋白质的水平。dux4的表达可以通过northern印迹法或western印记法、pcr等本技术领域中已知的方法来决定。
[0197]“dux4核酸”是指编码dux4的任意核酸。例如,某种实施方式中,dux4核酸包含编码dux4的dna序列、由编码(包含含有内含子和外显子的基因组dna的)dux4的dna所转录的rna序列、以及编码dux4的mrna前体或经剪接的成熟mrna。另外,某种实施方式中,包含通过dux4基因与其它基因的融合而产生的基因的dna序列、rna序列。
[0198]“dux4 mrna”是指编码dux4蛋白质的mrna。
[0199]“连续性的核酸碱基”、“连续的核酸碱基”是指相互直接邻接的核酸碱基。
[0200]“互补的”是指对于第一核酸与第二核酸的核酸碱基间进行配对的能力。
[0201]“完全互补的(也称为互补性)”或“100%互补的(也称为互补性)”是指第一核酸的核酸碱基序列的各核酸碱基全部在第二核酸的第二核酸碱基序列中具有互补的核酸碱基。某种实施方式中,第一核酸为修饰寡核苷酸,靶核酸为第二核酸。
[0202]“杂交(hybridization)”是指互补的核酸分子的粘接(annealing)。某种实施方式中,作为互补的核酸分子,可举出修饰寡核苷酸和靶核酸。
[0203]“可特异性地杂交”是指在修饰寡核苷酸与靶核酸之间具有足以诱导期望的效果的互补度,另一方面,特异性键合在所期望的条件、即体内分析(invivo assay)和治疗性处置的情况下的生理条件下,对非靶核酸仅呈现最少的效果或完全不显示效果的修饰寡核苷酸。
[0204]“错配”或“非互补性的核酸碱基”是指第一核酸的核酸碱基无法与第二核酸或靶核酸的对应的核酸碱基配对的情况。
[0205]“靶向(targeting)”或“靶”是指与靶核酸特异性杂交且诱导期望的效果的修饰寡核苷酸的设计和选择的过程。
[0206]“靶核酸”、“靶rna”和“靶rna转录产物”均是指修饰寡核苷酸可作为靶的核酸。某种实施方式中,靶核酸包含dux4核酸的区域。
[0207]“靶片段”是指修饰寡核苷酸作为靶的靶核酸的核苷酸序列。“5’靶部位”是指靶片段的最5’侧的核苷酸。“3’靶部位”是指靶片段的最3’侧的核苷酸。
[0208]“活性靶区域”或“靶区域”是指1种或多种活性的修饰寡核苷酸为靶的区域。“活性的修饰寡核苷酸”是指减少靶核酸水平或蛋白质水平的修饰寡核苷酸。
[0209]“反义抑制”是指与不存在修饰寡核苷酸下的靶核酸水平或靶蛋白质水平相比,存
在与靶核酸互补的修饰寡核苷酸下的靶核酸水平或靶蛋白质水平减少。
[0210]“sirna”是指具有能够对靶核酸的对应的区域或片段杂交的核酸碱基序列的双链rna寡核苷酸。
[0211]“shrna”是指具有能够对靶核酸的对应的区域或片段杂交的核酸碱基序列的发夹型的单链rna寡核苷酸。
[0212]“snorna”是指存在于核仁的非编码rna,具有能够对靶rna核酸的对应的区域或片段杂交的核酸碱基序列,引导靶rna核酸的甲基化或假尿苷化的化学修饰的单链寡核苷酸。
[0213]“mirna”是指调节其它基因的表达的非编码rna,具有能够对靶核酸的对应的区域或片段杂交的核酸碱基序列的单链或双链rna寡核苷酸。
[0214]“帽(cap)结构”或“末端帽部分”是指编入到修饰寡核苷酸的任一末端的化学修饰。
[0215]“化学异质性区域”是指与相同修饰寡核苷酸内的其它区域在某点上化学性质不同的修饰寡核苷酸内的区域。例如,具有2
’‑
o
‑
甲氧基乙基核苷酸的区域与具有未被2
’‑
o
‑
甲氧基乙基修饰的核苷酸的区域的化学性质不同。
[0216]“嵌合体修饰寡核苷酸”是指具有至少2个的化学异质性区域的修饰寡核苷酸。
[0217]“基元(motif)”是指修饰寡核苷酸中的化学异质性区域的样式(pattern)。
[0218]“间隙体(gapmer)”是指具有支持利用rnase h的切断的多个核苷的内部区域位于具有1个或多个核苷的外部区域之间,且构成内部区域的核苷与构成外部区域的核苷(可以是多个)在化学上不同的修饰寡核苷酸。内部区域可称为“间隙片段(gap segment),”外部区域可称为“侧翼片段(wing segment)”。可以将存在于比间隙片段更靠5’的位置的侧翼片段称为“5’侧翼片段,”可以将存在于比间隙片段更靠3’的位置的侧翼片段称为“3’侧翼片段”。
[0219]“直接邻接”是指在直接邻接的要素之间没有介入的要素。
[0220]“核内核糖核酸酶”是指在核内可见的核糖核酸酶。作为核内核糖核酸酶,可举出包含rnase h1和rnase h2的rnase h、双链rnase drosha以及其它双链rnase,但并不限定于这些。
[0221]
某种实施方式中,间隙体是指如下的修饰寡核苷酸:具有5’侧翼片段和3’侧翼片段以及间隙片段;5’侧翼片段和3’侧翼片段的核苷的数量分别为1个至8个;间隙片段位于两个侧翼片段之间,且与它们直接邻接,核苷数量为6个以上,并且该间隙片段为仅含有不含修饰糖的核苷,或者包含含有修饰糖的1或2个核苷且除此以外为不含修饰糖的核苷。
[0222]“药剂”是指对动物进行给药时,能够赋予治疗利益的活性物质。“第一药剂”是指本发明的治疗用化合物。例如,第一药剂也可以是靶向dux4的修饰寡核苷酸。“第二药剂”是指本发明的第二治疗用化合物(例如靶向dux4的第二修饰寡核苷酸)和/或不靶向dux4的治疗用化合物。
[0223]“医药上可允许的盐”是指修饰寡核苷酸的生理学和医药上可允许的盐,即保持修饰寡核苷酸所期望的生物活性且不对其赋予不期望的毒性效果的盐。
[0224]“稀释剂”是指虽然欠缺药理学活性,但在医药上是必要或期望的组合物中的成分。例如,所注射的组合物中的稀释剂可以为液体,例如生理盐水。
[0225]“dux4相关疾病”是指由dux4 mrna或dux4蛋白质、或者因dux4基因的易位所致的
融合基因的mrna或蛋白质的异常表达引起的疾病。可举出面肩肱型肌营养不良、b细胞性急性淋巴性白血病、分化圆细胞肉瘤、胚胎型横纹肌肉瘤等,但并不限定于这些。
[0226]“面肩肱型肌营养不良”或“fshd”是指由于面部、肩胛、肱肌的肌力下降而发病的肌营养不良。对人而言,认为主要是伴随处于第4号染色体的端粒(染色体末端)附近的基因组重复序列(d4z4)的缩短,其结果造成基因组结构发生变化,原本在肌肉(前体)细胞中不表达的dux4基因异位表达,引起细胞死亡(fshd1)。另外,在一部分的fshd患者中,在抑制基因表达的基因组结构控制因子之一的smchd1中发现基因变异(fshd2)。
[0227]
fshd为与进行性肌肉衰弱和肌纤维消失相关联的肌营养不良的一种。与主要侵害下半身的杜氏肌营养不良和贝克型肌营养不良不同,fshd是在上半身,主要在面部肌、肩胛肌和肱肌发病。但是,也有在骨盆、腰、下肢发病的情况。fshd的症状多出现在10岁~26岁,但在之后很久才发病的也不稀有。根据情况,也有完全不发病的情况。症状的通例为轻度,恶化速度也非常缓慢。通常为面部肌衰弱,可能有眼睑下垂、无法吹口哨、脸部表情变化减少、忧郁或愤怒的脸部表情、语言发音困难、肩胛肌肉衰弱(是肩胛骨突出(翼状肩胛)和斜肩等变形的原因)、下肢衰弱、听力损失和心脏病的顾虑等。
[0228]“活性医药剂”是指对动物进行给药时提供治疗利益的医药组合物中的物质(可以是多个)。例如,某种实施方式中,以dux4为靶的修饰寡核苷酸为活性医药剂。
[0229]“同时给药”是指由两个药剂引起的药理学效果同时在患者中显现的任意样式的2个药剂的共同给药。同时给药不需要两个药剂在单一医药组合物中,在相同剂型中,或者通过相同给药路径进行给药。由两个药剂引起的药理学效果不需要同时显现。该药理学效果仅需要在某一定期间内重复,不需要具有相同广度。
[0230]“给药”是指对动物给药药剂,可举出医疗专家给药和自我给药,但并不限定于这些。
[0231]“改善”是指减少相关的疾病、障碍或状态的至少1个指标、症候或症状。指标的严重度可通过本领域技术人员已知的主观或客观的尺度来决定。
[0232]“动物”是指人类,或者包含小鼠、大鼠、兔子、狗、猫、猪在内的非人动物,但不限定于这些,以及包含猴子和黑猩猩在内的非人灵长类,但并不限定于这些。
[0233]“共给药”是指对个体给药2种以上的药剂。2种以上的药剂可存在于单一的医药组合物中,也可存在于各自的医药组合物中。2种以上的药剂可以分别介由相同或不同的给药路径进行给药。共给药包含并行或逐次给药。
[0234]“用量”是指以单次给药或特定期间内给药的医药剂的特定的定量。某种实施方式中,用量可通过1、2次或其以上的推注、片剂或注射来给药。例如,在期望皮下给药的某种实施方式中,期望的用量需要为单次的注射所不易容纳的容量,因此,为了实现期望的用量,可以使用2次以上的注射。某种实施方式中,医药剂通过注入而长期或持续性地进行给药。用量可作为每小时、天、周或月的医药剂的量而记载。
[0235]“有效量”或“治疗有效量”是指在需要药剂的个体中足以实现期望的生理结果的活性医药剂的量。有效量可根据所处置的个体的健康和身体状态、所处置的个体的分类组、组合物的制剂、个体的医学状态的评价以及其它相关联的因子而在个体间变动。
[0236]“确定具有面肩肱型肌营养不良(fshd)的动物”是指确定诊断为fshd的障碍或状态的动物,或确定容易成为fshd的障碍或状态的动物。例如,有家族史的个体有可能容易成
为fshd的障碍或状态。
[0237]
这样的确定可通过包含调查个体的病历和标准的临床检査或评价的任意方法来实现。应予说明,fshd虽然根据发病机制已知有fshd1和fshd2,但fshd包含这两者。
[0238]“个体”是指针对处置或疗法所选择的人或非人动物。
[0239]“肌肉强直症”是指随意收缩或电刺激后的异常缓慢的肌肉弛缓。
[0240]“非口服给药”是指介由注射或注入的给药。作为非口服给药,可举出皮下给药、静脉内给药、肌肉内给药、动脉内给药、腹腔内给药或颅内给药,例如髓腔内或脑室内给药。给药可以是持续的或长期的,也可以是短期的或间断的。
[0241]“医药组合物”是指适于对个体给药的物质的混合物。例如,医药组合物可包含1种或多种活性药剂和灭菌水溶液。
[0242]“预防”是指在几分钟至无期限的期间,使疾病、障碍或不理想的健康状态、或与该疾病、障碍或不理想的健康状态相关联的1个以上的症状的发病或产生延迟或防范于未然。预防也指减少产生疾病、障碍或不理想的健康状态的危险性。
[0243]“治疗”是指减轻或排除疾病、障碍或不理想的健康状态、或与该疾病、障碍或不理想的健康状态相关联的1个以上的症状,或者部分解除或根绝该疾病、障碍或不理想的健康状态本身的1个或其以上的原因。
[0244]“处置”是指包含上述预防或治疗。例如,也包括为了使该疾病、障碍或不理想的健康状态变化或改善而给药本发明的医药组合物。
[0245]“前药”是指以非活性型制备的治疗剂,该非活性型通过内源性酶或其它化学物质或条件的作用而在体内或其细胞内转换为活性型。
[0246]“副作用”是指除期望的效果以外的可能由处置引起的生理反应。某种实施方式中,作为副作用,可举出注射部位反应、肝功能检査的异常、肾功能异常、肝毒性、肾毒性、中枢神经系统异常、肌病和倦怠。例如,血液中的丙氨酸氨基转移酶(alt)、天冬氨酸氨基转移酶(ast)或γ
‑
谷氨酰转肽酶(γ
‑
gtp)水平的上升可表示肝毒性或肝功能异常。例如,胆红素的上升可表示肝毒性或肝功能异常。另外,尿蛋白的上升、血液中的肌酸酐、尿素氮(un)的上升可表示肾毒性或肾功能异常。
[0247]“皮下给药”是指在皮肤正下方的给药。
[0248]“治疗有效量”是指对个体赋予治疗利益的药剂量。
[0249]
(具体的实施方式)
[0250]
实施方式
[0251]
下述所示的某种具体的实施方式将提供用于抑制dux4表达的化合物、使用该化合物的方法和含有该化合物的医药组合物,但并不限定于这些。
[0252]
某种实施方式将提供一种在动物中减少dux4表达的方法,包括对动物给药含有靶向dux4的修饰寡核苷酸的化合物。
[0253]
某种实施方式将提供一种方法,其为了通过抑制dux4基因的转录、或抑制dux4 mrna的翻译、或引导dux4 mrna的切断来妨碍具有病原性的dux4转录因子的累积,给予修饰寡核苷酸。
[0254]
某种实施方式提供一种具有面肩肱型肌营养不良的动物的处置方法,包括以下工序:a)确定具有面肩肱型肌营养不良的上述动物,以及b)对上述动物给药治疗有效量的含
有以dux4为靶的修饰寡核苷酸的化合物。
[0255]
某种实施方式提供一种在需要的对象中减轻肌肉强直症的方法。该方法包括对对象给药与dux4 mrna互补的修饰寡核苷酸,修饰寡核苷酸键合于dux4 mrna时,使核糖核酸酶或核内核糖核酸酶活化,由此减轻肌肉强直症。某种实施方式中,对象具有或疑似具有面肩肱型肌营养不良,或者高表达dux4 mrna或处于人第4号染色体的d4z4的重复数减少,或者具有或疑似具有smchd1(dna甲基化酶)变异。
[0256]
某种实施方式中,本发明的方法中使用的修饰寡核苷酸为嵌合体。某种实施方式中,本发明中使用的方法的修饰寡核苷酸为间隙体。
[0257]
本说明书中记载的本发明的方法的某种实施方式中,给药为皮下给药。某种实施方式中,给药为静脉内或肌肉内给药。
[0258]
某种实施方式中,本发明的方法中使用的修饰寡核苷酸以dux4 mrna的dux4蛋白质编码区域、内含子、5’utr或3’utr为靶。某种实施方式中,本发明的方法中使用的修饰寡核苷酸以dux4 mrna的外显子1、外显子2、外显子3、内含子1、内含子2为靶。
[0259]
本说明书中记载的本发明的方法的某种实施方式中,dux4 mrna被核内核糖核酸酶的rnase h1切断。
[0260]
本发明的方法的某种实施方式中,dux4 mrna在肌肉组织中减少。某种实施方式中,作为剪接变体的dux4
‑
fl1(序列表的序列号1)、dux4
‑
fl2(序列表的序列号5)优先被减少。
[0261]
某种实施方式中,dux4 mrna具有genbank登录号nm_001293798.2中记载的序列(作为序列表的序列号1并入本说明书中)。序列表的序列号1的剪接变体也称为dux4
‑
fl1或dux4的成熟mrna。某种实施方式中,dux4 mrna具有genbank登录号nm_001306068.2中记载的序列(作为序列表的序列号5并入本说明书中)。序列表的序列号5的剪接变体也称为dux4
‑
fl2。某种实施方式中,dux4具有genbank登录号nm_001363820.1中记载的序列(作为序列表的序列号6并入本说明书中)。序列表的序列号6的剪接变体也称为dux4
‑
s。某种实施方式中,dux4 mrna具有上述剪接变体的snp。
[0262]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,且具有包含修饰寡核苷酸的核酸碱基序列,该修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位、232~248位、1306~1325位或1472~1495位的等长部分互补的至少8个连续的核酸碱基序列的核酸碱基序列。某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,且具有包含修饰寡核苷酸的核酸碱基序列,该修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位、232~248位、1306~1325位或1472~1495位的等长部分互补的至少9个、10个、11个或12个连续的核酸碱基序列的核酸碱基序列。
[0263]
修饰寡核苷酸可以由与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位、232~248位、1306~1325位或1472~1495位的等长部分互补的至少8个连续的核酸碱基序列,除该核酸碱基序列以外,在5’末端侧和/或3’末端侧也可以具有附加序列。
[0264]
某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位的等长部分互补的至少8个、9个、10个、11个、12个、13
个、14个、15个、16个、17个、18个、19个、20个、21个或22个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0265]
某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第232~248位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个、16个或17个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0266]
某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1306~1325位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0267]
某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1472~1495位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个或24个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0268]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。
[0269]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第232~248位的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个
残基的上述修饰寡核苷酸。
[0270]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1306~1325位的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。
[0271]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1472~1495位的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为由12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基构成的上述修饰寡核苷酸。
[0272]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,且具有包含修饰寡核苷酸的核酸碱基序列,该修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第128~143位、233~248位、1309~1323位或1480~1495位的等长部分互补的至少8个连续的核酸碱基序列的核酸碱基序列。某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,且具有包含修饰寡核苷酸的核酸碱基序列,该修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第128~143位、233~248位、1309~1323位或1480~1495位的等长部分互补的至少9个、10个、11个、12个连续的核酸碱基序列的核酸碱基序列。
[0273]
某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第128~143位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个或16个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0274]
某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第233~248位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个或16个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0275]
某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1309~1323位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个或15个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0276]
某种实施方式中,修饰寡核苷酸是与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1480~1495位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个或16个连续的核酸碱基序列,且是由在3’末端具有序列号1的核酸碱基的从5’末端起第1480位的碱基的互补碱基的核酸碱基序列的30个残基以内的修饰寡核苷酸。
[0277]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第128~143位的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。
[0278]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第233~248位的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。
[0279]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1309~1323位的等长部
分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。
[0280]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,是与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1480~1495位的等长部分互补的核酸碱基序列,并且是由在3’末端具有序列号1的核酸碱基的从5’末端起第1480位的碱基的互补碱基的核酸碱基序列构成,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的核酸碱基序列。另外,某种实施方式中,为由12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基构成的上述修饰寡核苷酸。
[0281]
某种实施方式中,本说明书所提供的修饰寡核苷酸以序列表的序列号1的以下区域中的任1者为靶:从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位。某种实施方式中,本说明书所提供的修饰寡核苷酸以序列表的序列号1的以下区域中的任1者为靶:从5’末端起第128~143、232~247、233~248、1309~1323和1480~1495位。
[0282]
某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少8个连续的核酸碱基的互补区域。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补
的至少8个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位为靶。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少8个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第128~143、232~247、233~248、1309~1323或1480~1495位为靶。
[0283]
某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少10个连续的核酸碱基的互补区域。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少10个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位为靶。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少10个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第128~143、232~247、233~248、1309~1323或1480~1495位为靶。
[0284]
某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少12个连续的核酸碱基的互补区域。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少12个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位为靶。某种实施方式中,本说明
书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少12个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第128~143、232~247、233~248、1309~1323或1480~1495位为靶。
[0285]
某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少14个连续的核酸碱基的互补区域。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少14个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位为靶。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少14个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第128~143、232~247、233~248、1309~1323或1480~1495位为靶。
[0286]
某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位的等长部分互补的核酸碱基序列的修饰寡核苷酸。另外,某种实施方式中,修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第128~143、232~247、233~248、1309~1323、1480~1495位的等长部分互补的核酸碱基序列。
[0287]
某种实施方式中,修饰寡核苷酸是包含序列表的序列号2~4、7~64、69~97、102~112中的任1者所记载的核酸碱基序列的修饰寡核苷酸。另外,某种实施方式中,修饰寡核苷酸是包含序列表的序列号2~4、75、78中的任1者所记载的核酸碱基序列的修饰寡核苷酸。
[0288]
某种实施方式中,修饰寡核苷酸是由序列表的序列号2~4、7~64、69~97、102~112中的任1者所记载的核酸碱基序列构成的修饰寡核苷酸。另外,某种实施方式中,修饰寡核苷酸是由序列表的序列号2~4、75、78中的任1者所记载的核酸碱基序列构成的修饰寡核苷酸。
[0289]
某种实施方式中,修饰寡核苷酸具有包含序列表的序列号2、3、4、75、或78中的任1
者所记载的核酸碱基序列的至少8个连续的核酸碱基的核酸碱基序列。
[0290]
某种实施方式中,修饰寡核苷酸具有包含序列表的序列号2、3、4、75、或78中的任1者所记载的核酸碱基序列的至少10个连续的核酸碱基的核酸碱基序列。
[0291]
某种实施方式中,修饰寡核苷酸具有包含序列表的序列号2、3、4、75、或78中的任1者所记载的核酸碱基序列的至少12个连续的核酸碱基的核酸碱基序列。
[0292]
某种实施方式中,修饰寡核苷酸具有包含序列表的序列号2、3、4、75、或78中的任1者所记载的核酸碱基序列的至少14个连续的核酸碱基的核酸碱基序列。
[0293]
某种实施方式中,修饰寡核苷酸具有包含由序列表的序列号2、3、4、75、或78中的任1者所记载的核酸碱基序列构成的核酸碱基的核酸碱基序列。
[0294]
某种实施方式中,修饰寡核苷酸具有由序列表的序列号2、3、4、75、或78中的任1者所记载的核酸碱基序列构成的核酸碱基序列。
[0295]
某种实施方式中,动物为人。
[0296]
某种实施方式中,给药包含非口服给药。
[0297]
某种实施方式中,化合物为单链的修饰寡核苷酸。
[0298]
某种实施方式中,在测定上述修饰寡核苷酸整体的情况下,修饰寡核苷酸的核酸碱基序列与序列表的序列号1的上述任1个区域的等长部分至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补。某种实施方式中,在测定上述修饰寡核苷酸整体的情况下,修饰寡核苷酸的核酸碱基序列与序列表的序列号1的上述任1个区域的等长部分100%互补。
[0299]
某种实施方式中,上述修饰寡核苷酸的至少1个核苷间键为修饰核苷间键。某种实施方式中,各核苷间键为硫代磷酸酯核苷间键。
[0300]
某种实施方式中,上述修饰寡核苷酸的至少1个核苷包含修饰糖。某种实施方式中,至少1个修饰糖为双环糖。某种实施方式中,至少1个修饰糖包含2
’‑
o
‑
甲氧基乙基、2
’‑
o
‑
甲基和/或4
’‑
(ch2)
n
‑
o
‑2’
交联(式中,n为1或2)。
[0301]
某种实施方式中,上述修饰寡核苷酸的糖部分包含至少1个作为双环糖的修饰糖。某种实施方式中,至少1个修饰糖为lna、guna、alna[ms]、alna[mu]、alna[ipu]、alna[oxz]和/或alna[trz]。
[0302]
某种实施方式中,上述修饰寡核苷酸的至少1个核苷包含修饰核酸碱基。某种实施方式中,修饰核酸碱基为5
‑
甲基胞嘧啶。
[0303]
某种实施方式中,修饰寡核苷酸为间隙体,且包含以下片段:a)由连接的脱氧核苷构成的间隙片段,b)由连接的核苷构成的5’侧翼片段,以及c)由连接的核苷构成的3’侧翼片段。间隙片段位于5’侧翼片段与3’侧翼片段之间,且各侧翼片段的各核苷包含2
’‑
o
‑
甲基修饰糖、2
’‑
o
‑
甲氧基乙基修饰糖或双环糖等修饰糖。
[0304]
某种实施方式中,修饰寡核苷酸为间隙体,且包含以下片段:a)包含含有1或2个的2
’‑
o
‑
甲基修饰糖或2
’‑
o
‑
甲氧基乙基修饰糖等修饰糖的核苷且除此以外为不含修饰糖的核苷的间隙片段,b)包含连接的核苷的5’侧翼片段,以及c)包含连接的核苷的3’侧翼片段。间隙片段位于5’侧翼片段与3’侧翼片段之间,且各侧翼片段的各核苷包含2
’‑
o
‑
甲基修饰糖、2
’‑
o
‑
甲氧基乙基糖或双环糖等修饰糖。
[0305]
某种实施方式中,修饰寡核苷酸为间隙体,且包含以下片段:a)核苷数为6、7、8、9、
10、11、12、13、14、15或16个的间隙片段,并且上述核苷仅为不含修饰糖的核苷,或者包含1或2个包含2
’‑
o
‑
甲基修饰糖或2
’‑
o
‑
甲氧基乙基修饰糖等修饰糖的核苷且除此以外为不含修饰糖的核苷的间隙片段,b)核苷数为2、3、4、5、6或7个的5’侧翼片段,以及c)核苷数为2、3、4、5、6、7或8个的3’侧翼片段。
[0306]
这里,间隙片段位于5’侧翼片段与3’侧翼片段之间,各侧翼片段的各核苷包含2
’‑
o
‑
甲基修饰糖、2
’‑
o
‑
甲氧基乙基糖或双环糖,上述修饰寡核苷酸的各核苷间键包含硫代磷酸酯键,上述修饰寡核苷酸中的胞嘧啶的一部分或全部可以为5
’‑
甲基胞嘧啶。
[0307]
某种实施方式中,修饰寡核苷酸为间隙体,构成间隙体的核苷数为12个、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个。
[0308]
某种实施方式中,修饰寡核苷酸为间隙体,核苷的糖部分中包含2
’‑
o
‑
甲基、2
’‑
o
‑
甲氧基乙基和/或4
’‑
(ch2)
n
‑
o
‑2’
交联(式中,n为1或2)。
[0309]
某种实施方式中,修饰寡核苷酸为间隙体,且核苷的糖部分中包含lna、guna、alna[ms]、alna[mu]、alna[ipu]、alna[oxz]和/或alna[trz]。
[0310]
某种实施方式中,修饰寡核苷酸为间隙体,其是包含12~30个残基的修饰寡核苷酸,且具有包含修饰寡核苷酸的核酸碱基序列,该修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位、232~248位、1306~1325位或1472~1495位的等长部分互补的至少8个连续的核酸碱基序列的核酸碱基序列。某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸,且具有包含修饰寡核苷酸的核酸碱基序列,该修饰寡核苷酸是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位、232~248位、1306~1325位或1472~1495位的等长部分互补的至少9个、10个、11个或12个连续的核酸碱基序列的核酸碱基序列。
[0311]
某种实施方式中,修饰寡核苷酸为间隙体,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个或22个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0312]
某种实施方式中,修饰寡核苷酸为间隙体,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第232~248位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个、16个或17个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0313]
某种实施方式中,修饰寡核苷酸为间隙体,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1306~1325位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0314]
某种实施方式中,修饰寡核苷酸为间隙体,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1472~1495位的等长部分互补的至少8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个或24个连续的核酸碱基序列的核酸碱基序列,是30个残基以内的修饰寡核苷酸。
[0315]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸的间隙体,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~147位
的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。
[0316]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸的间隙体,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第233~248位的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。
[0317]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸的间隙体,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1309~1323位的等长部分所互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸的间隙体,是包含与序列表的序。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。
[0318]
某种实施方式中,修饰寡核苷酸是由12~30个残基构成的修饰寡核苷酸的间隙
体,是包含与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1472~1495位的等长部分互补的核酸碱基序列,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基的上述修饰寡核苷酸。此时,5’侧翼片段和/或3’侧翼片段中所包含的寡核苷酸包含至少1个核苷,该核苷包含至少1个选自guna、alna[ms]、alna[mu]、alna[ipu]、alna[oxz]和alna[trz]中的修饰糖,进而,也可以包含由2
’‑
o
‑
甲氧基乙基修饰的糖和/或由2
’‑
o
‑
甲基修饰的糖。
[0319]
某种实施方式中,修饰寡核苷酸是包含12~30个残基的修饰寡核苷酸的间隙体,是与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第1480~1495位的等长部分互补的核酸碱基序列,并且是由在3’末端具有序列号1的核酸碱基的从5’末端起第1480位的碱基的互补碱基的核酸碱基序列构成,且在等长部分中与序列表的序列号1至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补的修饰寡核苷酸。另外,某种实施方式中,为由12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基构成的上述修饰寡核苷酸。
[0320]
某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,以序列表的序列号1的以下区域中的任1者为靶:从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位。某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,以序列表的序列号
1的以下区域中的任1者为靶:从5’末端起第128~143、232~247、233~248、1309~1323和1480~1495位。
[0321]
某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少8个连续的核酸碱基的互补区域。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少8个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位为靶。某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少8个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第128~143、232~247、233~248、1309~1323或1480~1495位为靶。
[0322]
某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少10个连续的核酸碱基的互补区域。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少10个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位为靶。某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少10个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第128~143、232~247、233~248、1309~1323或1480~1495位为靶。
[0323]
某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少12个连续的核酸碱基的互补区域。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少12个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、
1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位为靶。某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少12个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第128~143、232~247、233~248、1309~1323或1480~1495位为靶。
[0324]
某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少14个连续的核酸碱基的互补区域。某种实施方式中,本说明书所提供的修饰寡核苷酸具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少14个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位为靶。某种实施方式中,本说明书所提供的修饰寡核苷酸为间隙体,具有核酸碱基序列,该核酸碱基序列包含含有对靶区域互补的至少14个连续的核酸碱基的互补区域,且靶区域以序列表的序列号1的从5’末端起第128~143、232~247、233~248、1309~1323或1480~1495位为靶。
[0325]
某种实施方式中,修饰寡核苷酸为间隙体,是由与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第126~141、126~143、127~142、127~143、127~144、127~146、128~143、128~144、128~147、232~245、232~247、233~246、233~247、233~248、234~247、234~248、1304~1323、1306~1321、1306~1324、1307~1323、1307~1324、1307~1325、1307~1326、1308~1323、1308~1324、1308~1322、1308~1325、1309~1323、1309~1324、1309~1325、1309~1322、1310~1323、1310~1324、1472~1485、1472~1486、1472~1487、1472~1488、1473~1487、1473~1488、1473~1489、1474~1488、1474~1489、1475~1490、1476~1490、1476~1491、1476~1495、1477~1495、1478~1496、1479~1495、1479~1496、1479~1498、1480~1494、1480~1495、1480~1496、1480~1497或1480~1499位的等长部分互补的核酸碱基序列构成的修饰寡核苷酸。另外,某种实施方式中,修饰寡核苷酸为间隙体,是由与序列表的序列号1的dux4的成熟mrna的核酸碱基的从5’末端起第128~143、232~247、233~248、1309~1323、1480~1495位的等长部分互补的核酸碱基序列构成的修饰寡核苷酸。
[0326]
某种实施方式中,修饰寡核苷酸为间隙体,是由序列表的序列号2~4、7~64、69~97、102~112中的任1者所记载的核酸碱基序列构成的修饰寡核苷酸。某种实施方式中,修饰寡核苷酸为间隙体,是由序列表的序列号2~4、75、78中的任1者所记载的核酸碱基序列
构成。
[0327]
某种实施方式中,修饰寡核苷酸为间隙体,是化合物编号1~112、114~132、137~246中的任1者所记载的修饰寡核苷酸。另外,某种实施方式中,修饰寡核苷酸为间隙体,是化合物编号1~3、123、157、204、221、231中的任1者所记载的修饰寡核苷酸。
[0328]
本说明书中,表示核苷酸的“gls”等记号中,左侧位置所示的缩写是指核酸碱基部分,中央位置所示的缩写是指糖部分,而且右侧位置所示的缩写是指核苷间键的样式。
[0329]
某种实施方式中,修饰寡核苷酸为间隙体,是下式:
[0330]
glsmlsmlstdsadsgdsadscdsadsgdscdsgdstdsmlsglsgl
[0331]
表示的修饰寡核苷酸,
[0332]
式中,
[0333]
各核酸碱基按照下述记号来表示:
[0334]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、m=5
‑
甲基胞嘧啶,
[0335]
各糖部分按照下述记号来表示:
[0336]
l=lna、d=2
’‑
脱氧核糖,
[0337]
各核苷间键按照下述记号来表示:
[0338]
s=硫代磷酸酯。
[0339]
某种实施方式中,修饰寡核苷酸为间隙体,
[0340]
是下式:
[0341]
gmsmmsmmstdsadsgdsadscdsadsgdscdsgdstdsmmsgmsgm
[0342]
表示的修饰寡核苷酸,
[0343]
式中,
[0344]
各核酸碱基按照下述记号来表示:
[0345]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、m=5
‑
甲基胞嘧啶,
[0346]
各糖部分按照下述记号来表示:
[0347]
m=alna[ms]、d=2
’‑
脱氧核糖,
[0348]
各核苷间键按照下述记号来表示:
[0349]
s=硫代磷酸酯。
[0350]
某种实施方式中,修饰寡核苷酸为间隙体,是下式:
[0351]
gmsmmsamsgdstdstdscdstdscdscdsgdscdsgmsgmstm
[0352]
表示的修饰寡核苷酸,
[0353]
式中,
[0354]
各核酸碱基按照下述记号来表示:
[0355]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、m=5
‑
甲基胞嘧啶,
[0356]
各糖部分按照下述记号来表示:
[0357]
m=alna[ms]、d=2
’‑
脱氧核糖,
[0358]
各核苷间键按照下述记号来表示:
[0359]
s=硫代磷酸酯。
[0360]
某种实施方式中,修饰寡核苷酸为间隙体,是下式:
[0361]
mlsglsalsgdsadstdstdscdscdscdsgdscdscdsglsglstl
[0362]
表示的修饰寡核苷酸,
[0363]
式中,
[0364]
各核酸碱基按照下述记号来表示:
[0365]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、m=5
‑
甲基胞嘧啶,
[0366]
各糖部分按照下述记号来表示:
[0367]
l=lna、d=2
’‑
脱氧核糖,
[0368]
各核苷间键按照下述记号来表示:
[0369]
s=硫代磷酸酯。
[0370]
某种实施方式提供一种在dux4相关疾病的动物中减少dux4 mrna和/或dux4蛋白质的水平(例如肌肉内水平)的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。
[0371]
某种实施方式提供一种在fshd的动物中减少dux4 mrna和/或dux4蛋白质的水平(例如肌肉内水平)的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。另外,某种实施方式提供一种在fshd的动物中减少肌肉障碍和/或改善运动功能的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。
[0372]
另外,某种实施方式提供一种fshd的处置、即治疗、预防、改善、减轻的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。
[0373]
某种实施方式提供一种fshd的各种症状(例如面部肌衰弱、眼睑下垂、无法吹口哨、脸部表情变化减少、忧郁或愤怒的脸部表情、语言发音困难、肩胛肌肉衰弱(翼状肩胛、斜肩等变形)、下肢衰弱、听力损失和心脏病)的预防、改善、减轻的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。
[0374]
某种实施方式提供一种在b细胞性急性淋巴性白血病等的动物中减少通过dux4基因与igh基因融合而产生的mrna和/或蛋白质的水平(例如血中的b细胞内水平)的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。另外,某种实施方式提供一种b细胞性急性淋巴性白血病等的处置、即治疗、预防、改善、减轻的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。
[0375]
某种实施方式提供一种在分化圆细胞肉瘤等的动物中减少通过dux4基因与cic基因融合而产生的mrna和/或蛋白质的水平(例如肉瘤内水平)的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。另外,某种实施方式提供一种分化圆细胞肉瘤等的处置、即治疗、预防、改善、减轻的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。
[0376]
某种实施方式提供一种在胚胎型横纹肌肉瘤等动物中减少通过dux4基因与ewsr1基因融合而产生的mrna和/或蛋白质的水平(例如肉瘤内水平)的方法,包括对动物给药针对dux4的修饰寡核苷酸。另外,某种实施方式提供一种胚胎型横纹肌肉瘤等的处置、即治疗、预防、改善、减轻的方法,包括对动物给药针对dux4的修饰寡核苷酸的有效量。
[0377]
某种实施方式提供一种副作用少的dux4相关疾病的治疗、预防、改善、减轻的方法,该方法包含对动物给药针对dux4的修饰寡核苷酸。某种实施方式中,作为副作用,可举出注射部位反应、肝功能检査的异常、肾功能异常、肝毒性(病理组织学上的异常发现:肝细胞的变性坏死、肝细胞肥大等)、肾毒性(病理组织学上的异常发现等)、中枢神经系统异常、肌病和倦怠。例如血液中的alt、ast、γ
‑
gtp、gldh、alp(碱性磷酸酶)或tba(total bile acids)水平的上升可表示肝毒性或肝功能异常。例如,胆红素的上升可表示肝毒性或肝功
能异常。另外,尿蛋白的上升、血液中的肌酸酐或un的上升可表示肾毒性或肾功能异常。
[0378]
某种实施方式提供一种制造用于使用在本说明书记载的治疗方法中的任一者中的医药品的本说明书所记载的任意化合物或含有该化合物的医药组合物的应用。例如,某种实施方式提供一种制造用于处置、即治疗、预防、延迟或改善fshd的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于抑制dux4表达、以及用于处置、即治疗、预防、延迟或改善dux4相关疾病和/或其症状的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于在动物中用于减少dux4的表达的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于在动物中优先减少dux4
‑
fl mrna的水平(例如肌肉内水平)、减轻肌肉强直症的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于处置具有fshd的动物的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于处置包含肌肉僵直、肌肉强直症、面部肌衰弱、眼睑下垂、无法吹口哨、脸部表情变化减少、忧郁或愤怒的脸部表情、语言发音困难、肩胛肌肉衰弱(翼状肩胛、斜肩等变形)、下肢衰弱、听力损失和心脏病的与fshd产生有关的1个以上的症状和结果的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于通过引导dux4基因的转录、dux4 mrna的翻译、dux4 mrna的切断来妨碍dux4蛋白质表达的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。
[0379]
某种实施方式提供一种试剂盒,是如本说明书记载那样处置、即治疗、预防或改善fshd的试剂盒,包含a)本说明书中记载的化合物以及任意的b)本说明书中记载的进一步的药剂或疗法。试剂盒可进一步包含用于出于处置、即治疗、预防或改善fshd的目的而使用试剂盒的说明书或标签。
[0380]
某种实施方式提供一种制造用于在本说明中记载的治疗方法的任一者中使用的医药品的本说明书所记载的任意化合物或含有该化合物的医药组合物的应用。例如,某种实施方式提供一种制造用于处置、即治疗、改善或预防fshd的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于抑制dux4表达、以及处置、即治疗、预防、延迟或改善dux4相关疾病和/或其症状的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于在动物中减少dux4的表达的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于在动物中优先减少dux4
‑
fl mrna的水平(例如肌肉内水平)、减轻肌肉强直症的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种制造用于处置具有fshd的动物的医药品的本说明书中记载的化合物或含有该化合物的医药组合物的应用。某种实施方式提供一种用于处置包含肌肉僵直、肌肉强直症、面部肌衰弱、眼睑下垂、无法吹口哨、脸部表情变化减少、忧郁或愤怒的脸部表情、语言发音困难、肩胛肌肉衰弱(翼状肩胛、斜肩等变形)、下肢衰弱、听力损失和心脏病的与fshd的产生有关的1个以上的症状和结果的本说明书中记载的化合物或含有该化合物的医药组合物。某种实施方式提供一种具有由序列表的序列号2~4、7~64、69~97或102~112的核酸碱基序列构成的核酸碱基序列的修饰寡核苷酸,或者化合物编号1~112、114~132或137~246的化合物。
[0381]
某种实施方式中,在按照5’至3’的方向进行记载的情况下,修饰寡核苷酸具有包含其所靶向的靶核酸的靶片段的反向互补链的核酸碱基序列。某种这样的实施方式中,在按照5’至3’的方向进行记载的情况下,修饰寡核苷酸具有包含其所靶向的靶核酸的靶片段的反向互补链的核酸碱基序列。
[0382]
某种实施方式中,以dux4为靶的本说明书的修饰寡核苷酸为12~30个核苷酸的长度。换言之,一些实施方式中,修饰寡核苷酸为12~30个残基连接而成的核酸碱基。其它实施方式中,修饰寡核苷酸包含由12~29个残基、12~28个残基、12~27个残基、12~26个残基、12~25个残基、12~24个残基、12~23个残基、12~22个残基、12~21个残基、12~20个残基、12~19个残基、12~18个残基、12~17个残基、12~16个残基、12~15个残基、12~14个残基、13~29个残基、13~28个残基、13~27个残基、13~26个残基、13~25个残基、13~24个残基、13~23个残基、13~22个残基、13~21个残基、13~20个残基、13~19个残基、13~18个残基、13~17个残基、13~16个残基、13~15个残基、13~14个残基、14~29个残基、14~28个残基、14~27个残基、14~26个残基、14~25个残基、14~24个残基、14~23个残基、14~22个残基、14~21个残基、14~20个残基、14~19个残基、14~18个残基、14~17个残基、14~16个残基、14~15个残基连接而成的核酸碱基构成的修饰寡核苷酸。某些这样的实施方式中,修饰寡核苷酸包含12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个残基连接而成的核酸碱基的长度,或者由通过任意2个的上述值所确定的范围构成的修饰寡核苷酸。某种实施方式中,这些长度的任一修饰寡核苷酸包含本说明书中记载的例示修饰寡核苷酸中的任一核酸碱基序列的至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18或至少19个残基的连续的核酸碱基(例如序列表的序列号2~4、7~64、69~97或102~112)中的任1者所记载的核酸碱基序列的至少8个连续的核酸碱基。
[0383]
可以在不使活性消失的情况下增加或减少反义寡核苷酸等反义化合物的长度和/或导入错配碱基。例如,根据woolfetal.(proc.natl.acad.sci.usa89:7305
‑
7309,1992),对13~25个核酸碱基长的一系列反义寡核苷酸在卵母细胞注射模式中它们诱导靶rna切断的能力,报告了在反义寡核苷酸的末端附近具有8或11个错配碱基的25个核酸碱基长的反义寡核苷酸虽然比不含错配的反义寡核苷酸的程度少,但能够引导靶mrna的特异性切断。同样地报告了可使用包含具有1或3个错配的反义寡核苷酸在内的13个核酸碱基的反义寡核苷酸实现靶特异性切断。
[0384]
根据gautschi et al.(j.natl.cancer inst.93:463
‑
471,march 2001),报告了对bcl
‑
2mrna具有100%的互补性且对bcl
‑
xl mrna具有3个错配的寡核苷酸在体外和体内显示减少bcl
‑
2和bcl
‑
xl这两者表达的能力。进而,报告了该寡核苷酸在体内显示强力的抗肿瘤活性。
[0385]
靶核酸、靶区域和核苷酸序列
[0386]
作为编码dux4的核苷酸序列,没有限定,可举出以下的序列。
[0387]
·
genbank登录号nm_001293798.2中记载的序列(作为序列表的序列号1并入本说明书中)。序列表的序列号1的剪接变体也称为dux4
‑
fl1或dux4的成熟mrna。
[0388]
·
genbank登录号nm_001306068.2中记载的序列(作为序列表的序列号5并入本说明书中)。序列表的序列号5的剪接变体也称为dux4
‑
fl2。
[0389]
·
genbank登录号nm_001363820.1中记载的序列(作为序列表的序列号6并入本说明书中)。序列表的序列号6的剪接变体也称为dux4
‑
s。
[0390]
·
上述各剪接变体的snp。
[0391]
本说明书中所包含的实施例的序列表的各序列号中记载的序列与对糖部分、核苷间键或核酸碱基的任何修饰均没有关系。因此,序列表的序列号所规定的修饰寡核苷酸可独立地包含对糖部分、核苷间键或核酸碱基的1个或多个修饰。化合物编号中记载的修饰寡核苷酸表示核酸碱基序列与基元的组合。
[0392]
某种实施方式中,靶区域为靶核酸的结构上确定的区域。例如,靶区域可包含3’utr、5’utr、外显子、内含子、外显子/内含子接合部、编码区域、翻译起始区域、翻译终止区域或其它确定的核酸区域中的1个以上。对于dux4的结构上确定的区域可以由ncbi等序列数据库通过登录号而得到,这样的信息作为参照并入本说明书中。某种实施方式中,靶区域可包含靶区域内的某靶片段的5’靶部位起至靶区域内的其它靶片段的3’靶部位为止的序列。
[0393]
靶向(targeting)包含修饰寡核苷酸进行杂交,其结果产生期望的效果的至少1个靶片段的决定。某种实施方式中,期望的效果为mrna靶核酸水平的减少。某种实施方式中,期望的效果为靶核酸所编码的蛋白质水平的减少或与靶核酸有关系的表型的变化。
[0394]
靶区域可包含1个或多个靶片段。靶区域内的多个靶片段可以重复。或者它们也可以不重复。某种实施方式中,靶区域内的靶片段由约300个以下的核苷酸而分离。某种实施方式中,靶区域内的靶片段由靶核酸的250、200、150、100、90、80、70、60、50、40、30、20或10个核苷酸,或大约这些数量的核苷酸,或者,这些数量以下的核苷酸,或由任意2个上述值确定的范围的多个核苷酸分离。某种实施方式中,靶区域内的靶片段由靶核酸的5个以下或约5个以下的核苷酸分离。某种实施方式中,靶片段是连续的。其意图为由具有本说明书所举出的5’靶部位或3’靶部位中任一者的起始核酸的范围所确定的靶区域。
[0395]
适当的靶片段可在5’utr、编码区域、3’utr、内含子、外显子或外显子/内含子接合部内发现。包含起始密码子或终止密码子的靶片段也是适当的靶片段。适当的靶片段能够特异性排除起始密码子或终止密码子等某种结构上确定的区域。
[0396]
适当的靶片段的决定可包含遍及基因组整体的与其它序列的靶核酸的序列的比较。例如,可使用blast算法来确定不同核酸间的类似区域。该比较能够防止选择可与所选择的靶核酸以外的序列(即,非靶序列或脱靶序列)以非特异性样式杂交的修饰寡核苷酸序列。
[0397]
可具有活性靶区域内的修饰寡核苷酸的(例如,以靶核酸水平的减少百分比所确定的)活性变动。某种实施方式中,dux4 mrna的水平减少成为dux4蛋白质表达抑制的指标。dux4蛋白质的水平减少也成为靶mrna表达抑制的指标。进而,表型的变化、例如减轻肌肉强直症或减少肌肉障碍可成为dux4 mrna和/或蛋白质的表达抑制的指标。
[0398]
杂交
[0399]
一些实施方式中,杂交在本说明书所公开的修饰寡核苷酸与dux4核酸之间产生。杂交的最一般的机制伴随核酸分子的互补的核酸碱基间的氢键(例如watson
‑
crick、hoogsteen或反hoogsteen型氢键)。杂交的强度能够由熔化温度tm表示。tm是指杂交的双链核酸的50%解离为单链核酸的温度,虽然根据溶液的盐条件、核酸的长度或碱基序列等而
不同,但tm值越高则杂交越强。
[0400]
杂交在各种条件下产生。严苛条件为序列依赖性,根据杂交的核酸分子的性质和组成而决定。
[0401]
决定序列是否能够与靶核酸特异性杂交的方法是本技术领域中周知的(sambrooke and russell,molecular cloning:a laboratory manual,3rded.,2001)。某种实施方式中,本说明书所提供的修饰寡核苷酸可以与dux4核酸特异性地杂交。
[0402]
互补性
[0403]
在修饰寡核苷酸的足够数量的核酸碱基能够与靶核酸的对应的核酸碱基形成氢键以产生期望的效果(例如dux4核酸等靶核酸的反义抑制)的情况下,修饰寡核苷酸和靶核酸彼相互补。
[0404]
修饰寡核苷酸可以以其中间存在或邻接的片段不参与杂交现象的方式(例如环结构、错配或发夹结构)遍及dux4核酸的1个或多个片段进行杂交。
[0405]
某种实施方式中,本说明书所提供的修饰寡核苷酸或其特定部分对dux4核酸、靶区域、靶片段或它们的特定部分90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%互补。某种实施方式中,修饰寡核苷酸与dux4核酸、靶区域、靶片段或它们的确定部分至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%互补,包含本说明书所记载的例示修饰寡核苷酸中任一核酸碱基序列的至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18或至少19个连续的核酸碱基(例如,序列表的序列号2、3、4、7~64、69~97或102~112中的任1者所记载的核酸碱基序列的至少8个连续的核酸碱基)。修饰寡核苷酸与靶核酸的互补性百分比可使用惯例的方法来决定,可以遍及修饰寡核苷酸整体进行测定。
[0406]
例如,修饰寡核苷酸的20个的核酸碱基中的18个对靶区域互补,因此,认为进行特异性杂交的修饰寡核苷酸相当于90%的互补性。该例子中,剩余的非互补性的核酸碱基可以丛集,也可以夹着互补核酸碱基,不需要相互连续或与互补核酸碱基连续。修饰寡核苷酸与靶核酸区域的互补性百分比可使用本技术领域中已知的blast程序(basiclocal alignmentsearchtools)和powerblast程序(altschulet al.,j.mol.biol.,1990,215,403410;zhang and madden,genome res.,1997,7,649656)来惯例地决定。同源性百分比、序列同一性或互补性例如可通过gap程序(wisconsinsequenceanalysis package,version 8for unix,genetics computer group,university research park,madison wis.),使用利用了smith and waterman(adv.appl.math.,1981,2,482 489)的算法的默认设定来决定。
[0407]
非互补性核酸碱基的部位可以是修饰寡核苷酸的5’末端,也可以是3’末端。或者,非互补性核酸碱基(可以是多个)也可以是修饰寡核苷酸内部的位置。存在2个以上非互补性核酸碱基时,它们可以是连续的(即连接的),也可以是非连续的。一个实施方式中,非互补性核酸碱基位于间隙体修饰寡核苷酸的侧翼片段中。
[0408]
某种实施方式中,12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核酸碱基长或者至多这些核酸碱基长的修饰寡核苷酸包含对靶核酸、例如dux4核酸或其特定部分的3个以下、2个以下或1个以下的非互补性核酸碱基(可以是多个)。
[0409]
本说明书所提供的修饰寡核苷酸也包含与靶核酸的一部分互补的修核酸碱基。本
说明书中使用时,“部分”是指靶核酸的区域或者片段内的确定数量的连续的(即连接的)核酸碱基。“部分”也可指修饰寡核苷酸的确定数量的连续的核酸碱基。某种实施方式中,修饰寡核苷酸与靶片段的至少8个核酸碱基部分互补。某种实施方式中,修饰寡核苷酸与靶片段的至少10个核酸碱基部分互补。某种实施方式中,修饰寡核苷酸与靶片段的至少15个核酸碱基部分互补。也是指与靶片段的至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20个或其以上的核酸碱基部分、或者由这些值中的任意2个所确定的范围互补的修饰寡核苷酸。
[0410]
同一性
[0411]
本说明书所提供的修饰寡核苷酸也可对特定的核苷酸序列、序列表的序列号或特定的化合物编号表示的化合物或它们的部分具有确定的同一性百分比。在本说明书中使用时,在修饰寡核苷酸具有相同的核酸碱基配对能力的情况下,其与本说明书所公开的序列相同。例如,包含尿嘧啶代替所公开的dna序列的胸腺嘧啶的rna中,由于尿嘧啶与胸腺嘧啶这两者均与腺嘌呤配对,因此,认为与该dna序列相同。也是指本说明书的修饰寡核苷酸的缩短和延长形式以及对本说明书所提供的修饰寡核苷酸具有不相同的碱基的化合物。不相同的碱基可以相互邻接,也可以遍及修饰寡核苷酸整体而分散。修饰寡核苷酸的同一性百分比是按照对所比较的序列具有相同的碱基配对的碱基数量来计算的。
[0412]
某种实施方式中,修饰寡核苷酸或其部分与本说明书所公开的例示修饰寡核苷酸或序列表的序列号或这些部分的1个或多个至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%相同。
[0413]
修饰
[0414]
核苷为碱基
‑
糖的组合物。核苷的核酸碱基(也已知为碱基)部分通常为杂环碱基部分。核苷酸是进一步包含与核苷的糖部分共价键合的磷酸基的核苷。对于包含戊呋喃糖基糖的核苷,磷酸基可连接在糖的2’、3’或5’羟基部分。寡核苷酸介由邻接核苷彼此进行共价键合而形成,形成直链状的聚合物寡核苷酸。在寡核苷酸结构内,磷酸基通常被认为形成寡核苷酸的核苷间键。
[0415]
修饰寡核苷酸中的修饰包含对核苷间键、糖部分或核酸碱基的取代或变化。出于例如细胞摄入的增强、对核酸靶的亲和性的增强、在核酸酶存在下的稳定性增大或抑制活性的增大等期望特性的理由,修饰修饰寡核苷酸多比天然型优选。
[0416]
修饰核苷间键
[0417]
rna和dna的天然存在的核苷间键为3
’‑5’
磷酸二酯键。出于例如细胞摄入的增强、对靶核酸的亲和性的增强和在核酸酶存在下的稳定性增大等期望特性的理由,与具有天然存在的核苷间键的修饰寡核苷酸相比,多选择具有1个或多个经修饰的即天然不存在的核苷间键的修饰寡核苷酸。
[0418]
具有修饰核苷间键的寡核苷酸包含保持磷原子的核苷间键和不具有磷原子的核苷间键。作为代表性的含磷的核苷间键,可举出磷酸二酯、磷酸三酯、膦酸甲酯、氨基磷酸酯和硫代磷酸酯中的1种以上,但并不限定这些。含磷和非含磷键的制备方法是周知的。
[0419]
某种实施方式中,以dux4核酸为靶的修饰寡核苷酸包含1个或多个修饰核苷间键。某种实施方式中,修饰核苷间键为硫代磷酸酯键。某种实施方式中,修饰寡核苷酸的各核苷间键为硫代磷酸酯核苷间键。
[0420]
修饰糖部分
[0421]
本发明的修饰寡核苷酸优选使用构成其的至少1个核苷包含修饰糖的修饰寡核苷酸。本发明中,修饰糖是指糖部分被修饰的糖,包含1个以上该修饰糖的修饰寡核苷酸具有核酸酶稳定性的增强、键合亲和性的增大等有利的特征。修饰糖中的至少一个优选具有双环糖或取代糖部分。
[0422]
作为具有修饰糖的核苷的例子,可举出包含5
’‑
乙烯基、5
’‑
甲基(r或s)、4
’‑
s、2
’‑
f、2
’‑
och3、2
’‑
och2ch3、2
’‑
och2ch2f和2
’‑
o(ch2)2och3取代基的核苷,但并不限定于这些。2’位的取代基也可以从烯丙基、氨基、叠氮基、硫基、o
‑
烯丙基、o
‑
c1~c
10
烷基、ocf3、och2f、o(ch2)2sch3、o(ch2)2‑
o
‑
n(r
m
)(r
n
)、o
‑
ch2‑
c(=o)
‑
n(r
m
)(r
n
)和o
‑
ch2‑
c(=o)
‑
n(r
l
)
‑
(ch2)2‑
n(r
m
)(r
n
)(式中,各r
l
、r
m
和r
n
独立地为h或者取代或无取代的c1~c
10
烷基)中选择。
[0423]
作为具有双环糖的核苷的例子,可举出包含4’与2’的核糖基环原子的间的交联的核苷,但并不限定于这些。某种实施方式中,本说明书所提供的寡核苷酸含有交联包含下式中的1个的具有1个或多个双环糖的核苷:4
’‑
(ch2)
‑
o
‑2’
(lna);4
’‑
(ch2)
‑
s
‑2’
;4
’‑
(ch2)2‑
o
‑2’
(ena);4
’‑
ch(ch3)
‑
o
‑2’
和4
’‑
ch(ch2och3)
‑
o
‑2’
(和它们的类似物。参照美国专利7399845号);4
’‑
c(ch3)(ch3)
‑
o
‑2’
(和它们的类似物。参照wo2009/006478号);4
’‑
ch2‑
n(och3)
‑2’
(和它们的类似物。参照wo2008/150729号);4
’‑
ch2‑
o
‑
n(ch3)
‑2’
(和它们的类似物。参照us2004
‑
0171570号);4
’‑
ch2‑
n(r)
‑
o
‑2’
(式中,r为h、c1~c
12
烷基或保护基团)(参照美国专利7427672号);4
’‑
ch2‑
c(h)(ch3)
‑2’
(和它们的类似物。参照chattopadhyayaet al.,j.org.chem.,2009,74,118
‑
134);以及4
’‑
ch2‑
c(=ch2)
‑2’
(和它们的类似物。参照wo2008/154401号)。
[0424]
具有进一步的双环糖的核苷已在发表文献中报告(参照例如srivastavaet al.,j.am.chem.soc.,2007,129(26)8362
‑
8379;friedenet al.,nucleicacids research,2003,21,6365
‑
6372;elayadiet al.,curr.opinioninvens.drugs,2001,2,558
‑
561;braasch et al.,chem.biol.,2001,8,1
‑
7;orum et al.,curr.opinion mol.ther.,2001,3,239
‑
243;wahlestedt etal.,proc.natl.acad.sci.u.s.a.,2000,97,5633
‑
5638;singhet al.,chem.commun.,1998,4,455
‑
456;koshkinetal.,tetrahedron,1998,54,3607
‑
3630;kumaret al.,bioorg.med.chem.lett.,1998,8,2219
‑
2222;singhet al.,;美国专利us7,399,845号;6,770,748号;6,525,191号;6,268,490号;美国us2008
‑
0039618号;us2007
‑
0287831号;us2004
‑
0171570号;us2009
‑
0012281号;wo2010/036698;wo 2009/067647号;wo2009/067647号;wo2007/134181号;wo2005/021570号;wo2004/106356号;wo94/14226号;wo 2009/006478号;wo2008/154401号;和wo2008/150729号)。具有上述的双环糖的核苷分别可以具有例如包含α
‑
l
‑
核呋喃糖和β
‑
d
‑
核呋喃糖中的1个或多个立体化学糖构型而制备。
[0425]
具有双环糖的核苷的guna已作为具有胍交联的人工核苷被报告(参照wo2014/046212号、wo2017/047816号)。双环核苷的alna[ms]、alna[mu]、alna[ipu]、alna[trz]和alna[oxz]已作为交联型人工核酸氨基lna(alna)被报告(参照日本专利申请日本特愿2018
‑
212424号)。
[0426]
某种实施方式中,具有双环糖的核苷,在戊呋喃糖基糖部分的4’与2’的碳原子之间包含交联,包含含有从
‑
[c(r
a
)(r
b
)]
n
‑
、
‑
c(r
a
)=c(r
b
)
‑
、
‑
c(r
a
)=n
‑
、
‑
c(=nr
a
)
‑
、
‑
c(=
o)
‑
、
‑
c(=s)
‑
、
‑
n(r
a
)
‑
、
‑
o
‑
、
‑
si(r
a
)2‑
和
‑
s(=o)
x
‑
中独立地选择的1个或1个至4个连接基团的交联,但并不限定于这些,式中,x为0、1或2;n为1、2、3或4;各r
a
和r
b
独立地为h、保护基团、羟基、c1~c
12
烷基、取代c1~c
12
烷基、c2~c
12
烯基、取代c2~c
12
烯基、c2~c
12
炔基、取代c2~c
12
炔基、芳香环基、取代芳香环基、杂环基、取代杂环基、c5~c7脂环基、取代c5~c7脂环基、卤素、oj1、nj1j2、sj1、n3、cooj1、酰基(c(=o)
‑
h)、取代酰基、cn、磺酰基(s(=o)2‑
j1)或亚磺酰基(s(=o)
‑
j1),
[0427]
各j1和j2独立地为h、c1~c
12
烷基、取代c1~c
12
烷基、c2~c
12
烯基、取代c2~c
12
烯基、c2~c
12
炔基、取代c2~c
12
炔基、芳香环基、取代芳香环基、酰基(c(=o)
‑
h)、取代酰基、杂环基、取代杂环基、c1~c
12
氨基烷基、取代c1~c
12
氨基烷基或保护基团。
[0428]
某种实施方式中,双环糖部分的交联为
‑
[c(r
a
)(r
b
)]
n
‑
、
‑
[c(r
a
)(r
b
)]
n
‑
o
‑
、
‑
c(r
a
r
b
)
‑
n(r)
‑
o
‑
或
‑
c(r
a
r
b
)
‑
o
‑
n(r)。某种实施方式中,交联为4
’‑
ch2‑2’
、4
’‑
(ch2)2‑2’
、4
’‑
(ch2)3‑2’
、4
’‑
ch2‑
o
‑2’
(此时的具有双环糖的核苷也称为lna)、4
’‑
(ch2)2‑
o
‑2’
、4
’‑
ch2‑
o
‑
n(r)
‑2’
和4
’‑
ch2‑
n(r)
‑
o
‑2’‑
,式中,各r独立地为h、保护基团或c1~c
12
烷基。
[0429]
某种实施方式中,双环糖部分的交联为4
’‑
ch2‑
o
‑2’‑
(lna)或
‑
ch2‑
n(r)
‑
,式中,各r独立地为
‑
so2‑
ch3(alna[ms])、
‑
co
‑
nh
‑
ch3(alna[mu])、1,5
‑
二甲基
‑
1,2,4
‑
三唑
‑3‑
基(alna[trz])、
‑
co
‑
nh
‑
ch(ch3)2(alna[ipu])、5
‑
甲基
‑
1,2,4
‑
二唑
‑3‑
基(alna[oxz])(日本专利申请日本特愿2018
‑
212424号)。
[0430]
某种实施方式中,具有双环糖的核苷由异构体空间构型进一步定义。例如,包含4
’‑
(ch2)
‑
o
‑2’
交联的核苷可以以α
‑
l
‑
空间构型存在、也可以β
‑
d
‑
空间构型存在。
[0431]
某种实施方式中,具有双环糖的核苷包含具有4
’‑2’
交联的核苷,作为这样的交联,可举出α
‑
l
‑4’‑
(ch2)
‑
o
‑2’
、β
‑
d
‑4’‑
ch2‑
o
‑2’
、4
’‑
(ch2)2‑
o
‑2’
、4
’‑
ch2‑
o
‑
n(r)
‑2’
、4
’‑
ch2‑
n(r)
‑
o
‑2’
、4
’‑
ch(ch3)
‑
o
‑2’
、4
’‑
ch2‑
s
‑2’
、4
’‑
ch2‑
ch(ch3)
‑2’
和4
’‑
(ch2)3‑2’
(式中,r为h、保护基团、c1~c
12
烷基,或者可以被c1~c
12
烷基取代的尿素或胍),但并不限定于这些。
[0432]
某种实施方式中,具有双环糖的核苷具有下式:
[0433][0434]
式中,
[0435]
bx为杂环碱基部分,
[0436]
t
a
和t
b
各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等,
[0437]
z
a
为c1~c6烷基、c2~c6烯基、c2~c6炔基、取代c1~c6烷基、取代c2~c6烯基、取代c2~c6炔基、酰基、取代酰基、取代酰胺、硫醇或取代硫醇。
[0438]
某种实施方式中,取代基各自独立地被从卤素、氧代基、羟基、oj
c
、nj
c
j
d
、sj
c
、n3、oc(=x)j
c
和nj
e
c(=x)nj
c
j
d
(式中,各j
c
、j
d
和j
e
独立地为h、c1~c6烷基或取代c1~c6烷基,x为o
或nj
c
)中独立选择的取代基进行单取代或多取代。
[0439]
某种实施方式中,具有双环糖的核苷具有下式:
[0440][0441]
式中,
[0442]
bx为杂环碱基部分,
[0443]
t
a
和t
b
各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等,
[0444]
z
b
为c1~c6烷基、c2~c6烯基、c2~c6炔基、取代c1~c6烷基、取代c2~c6烯基、取代c2~c6炔基或取代酰基(c(=o)
‑
)。
[0445]
某种实施方式中,具有双环糖的核苷具有下式:
[0446][0447]
式中,
[0448]
bx为杂环碱基部分,
[0449]
t
a
和t
b
各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等,
[0450]
r
d
为c1~c6烷基、取代c1~c6烷基、c2~c6烯基、取代c2~c6烯基、c2~c6炔基或取代c2~c6炔基,
[0451]
各q
a
、q
b
、q
c
和q
d
独立地为h、卤素、c1~c6烷基、取代c1~c6烷基、c2~c6烯基、取代c2~c6烯基、c2~c6炔基或取代c2~c6炔基、c1~c6烷氧基、取代c1~c6烷氧基、酰基、取代酰基、c1~c6氨基烷基或取代c1~c6氨基烷基。
[0452]
某种实施方式中,具有双环糖的核苷具有下式:
[0453]
[0454]
式中,
[0455]
bx为杂环碱基部分;
[0456]
t
a
和t
b
各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等,
[0457]
q
a
、q
b
、q
e
和q
f
各自独立地为氢、卤素、c1~c
12
烷基、取代c1~c
12
烷基、c2~c
12
烯基、取代c2~c
12
烯基、c2~c
12
炔基、取代c2~c
12
炔基、c1~c
12
烷氧基、取代c1~c
12
烷氧基、oj
j
、sj
j
、soj
j
、so2j
j
、nj
j
j
k
、n3、cn、c(=o)ojj、c(=o)nj
j
j
k
、c(=o)j
j
、o
‑
c(=o)nj
j
j
k
、n(h)c(=nh)nj
j
j
k
、n(h)c(=o)
‑
nj
j
j
k
或n(h)c(=s)nj
j
j
k
,
[0458]
或者,q
e
和q
f
均为=c(q
g
)(q
h
),
[0459]
q
g
和q
h
各自独立地为h、卤素、c1~c
12
烷基或取代c1~c
12
烷基。
[0460]
具有4
’‑
ch2‑
o
‑2’
交联的腺嘌呤、胞嘧啶、鸟嘌呤、5
‑
甲基
‑
胞嘧啶、胸腺嘧啶和尿嘧啶双环核苷(也称为lna)的合成和制备与它们的低聚物化和核酸识别特性一并记载(koshkinet al.,tetrahedron,1998,54,3607
‑
3630)。具有双环糖的核苷的合成也记载于wo98/39352和wo99/14226。
[0461]
具有4
’‑
ch2‑
o
‑2’
(此时的双环核苷也称为lna)和4
’‑
ch2‑
s
‑2’
等4
’‑2’
交联基团的各种双环核苷的类似物也已被制备(kumaret al.,bioorg.med.chem.lett.,1998,8,2219
‑
2222)。还记载了用于作为核酸聚合酶的底物使用的包含双环核苷的寡脱氧核糖核苷酸双链的制备(wengelet al.,wo99/14226)。进而,2
’‑
氨基
‑
bna(此时的双环核苷也称为alna)、即立体结构上受限的高亲和性寡核苷酸类似物的合成已经在本技术领域中记载(singhet al.,j.org.chem.,1998,63,10035
‑
10039)。进而,已制备了2
’‑
氨基
‑
和2
’‑
甲基氨基
‑
bna,以前已报告了与互补的rna链和dna链的双链的热稳定性。
[0462]
某种实施方式中,具有双环糖的核苷具有下式:
[0463][0464]
式中,
[0465]
bx为杂环碱基部分,
[0466]
t
a
和t
b
各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等,
[0467]
各q
i
、q
j
、q
k
和q
l
独立地为h、卤素、c1~c
12
烷基、取代c1~c
12
烷基、c2~c
12
烯基、取代c2~c
12
烯基、c2~c
12
炔基、取代c2~c
12
炔基、c1~c
12
烷氧基、取代c1~c
12
烷氧基、oj
j
、sj
j
、
soj
j
、so2j
j
、nj
j
j
k
、n3、cn、c(=o)oj
j
、c(=o)nj
j
j
k
、c(=o)j
j
、o
‑
c(=o)nj
j
j
k
、n(h)c(=nh)nj
j
j
k
、n(h)c(=o)nj
j
j
k
或n(h)c(=s)nj
j
j
k
,
[0468]
q
i
和q
j
或q
l
和q
k
均为=c(q
g
)(q
h
),式中,q
g
和q
h
各自独立地为h、卤素、c1~c
12
烷基或取代c1~c
12
烷基。
[0469]
具有4
’‑
(ch2)3
‑2’
交联和烯基类似物交联4
’‑
ch=ch
‑
ch2‑2’
的1个碳环式双环核苷已被记载(frier et al.,nucleicacids research,1997,25(22),4429
‑
4443和albaeket al.,j.org.chem.,2006,71,7731
‑
7740)。碳环式双环核苷的合成和制备也与其低聚物化和生化研究一起被记载(srivastavaet al.,j.am.chem.soc.2007,129(26),8362
‑
8379)。
[0470]
某种实施方式中,作为具有双环糖的核苷,可举出如下所示的
[0471]
(a)α
‑
l
‑
亚甲氧基(4
’‑
ch2‑
o
‑2’
)bna,
[0472]
(b)β
‑
d
‑
亚甲氧基(4
’‑
ch2‑
o
‑2’
)bna,
[0473]
(c)亚乙氧基(4
’‑
(ch2)2‑
o
‑2’
)bna,
[0474]
(d)氨基氧基(4
’‑
ch2‑
o
‑
n(r)
‑2’
)bna,
[0475]
(e)氧基氨基(4
’‑
ch2‑
n(r)
‑
o
‑2’
)bna,
[0476]
(f)甲基(亚甲氧基)(4
’‑
ch(ch3)
‑
o
‑2’
)bna(也称为约束乙基或cet),
[0477]
(g)亚甲基
‑
硫基(4
’‑
ch2‑
s
‑2’
)bna,
[0478]
(h)亚甲基
‑
氨基(4
’‑
ch2‑
n(r)
‑2’
)bna,
[0479]
(i)甲基碳环(4
’‑
ch2‑
ch(ch3)
‑2’
)bna,
[0480]
(j)亚丙基碳环(4
’‑
(ch2)3‑2’
)bna,和
[0481]
(k)乙烯基bna,但并不限定于这些。
[0482][0483]
式中,bx为碱基部分,r独立地为保护基团、c1~c6烷基或c1~c6烷氧基。
[0484]
某种实施方式(lna)中,具有双环糖的核苷可举出以下的通式:
[0485][0486]
[式中,
[0487]
b为核酸碱基,
[0488]
x和y各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等]表示的核苷(参照wo98/39352)。典型的具体例可举出下述式:
[0489][0490]
表示的核苷酸。
[0491]
某种实施方式(guna)中,包含双环糖的核苷为下述通式:
[0492][0493]
[式中,b为核酸碱基,r3、r4、r5、r6各自独立地为氢原子、或可以被1个以上的取代基取代的c1‑6烷基,r7、r8各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或支承体的共价键等,r9、r
10
、r
11
各自独立地为氢原子、可以被1个以上的取代基取代的c1‑6烷基,或氨基的保护基团]
[0494]
表示的核苷(例如参照国际公开第2014/046212号、国际公开第2017/047816号)。
[0495]
某种实施方式(alna[mu])中,包含双环糖的核苷为下述通式(i):
[0496][0497]
[式中,
[0498]
b为核酸碱基,
[0499]
r1、r2、r3和r4各自独立地为氢原子、或可以被1个以上的取代基取代的c1‑6烷基,
[0500]
r5和r6各自独立地为氢原子、羟基的保护基团、可以被取代的磷酸基、对磷部分或
支承体的共价键等,
[0501]
m为1或2,
[0502]
x为下述式(ii
‑
1):
[0503][0504]
表示的基团,
[0505]
式(ii
‑
1)中记载的记号:
[0506][0507]
表示与2
’‑
氨基的键合点,
[0508]
r7和r8中的一者为氢原子,另一者为可以被1个以上的取代基取代的甲基]
[0509]
表示的核苷(例如参照日本特愿2018
‑
212424)。典型的具体例是r7和r8中的一者为氢原子,另一者为无取代的甲基的核苷。
[0510]
某种实施方式(alna[ipu])中,包含双环糖的核苷为具有上述的alna[mu]中定义的通式(i)的核苷,该式中,
[0511]
x为下述式(ii
‑
1):
[0512][0513]
表示的基团,
[0514]
r7和r8中的一者为氢原子,另一者为可以被1个以上的取代基取代的异丙基(例如参照日本特愿2018
‑
212424)。典型的具体例是r7和r8中的一者为氢原子,另一者为无取代的异丙基的核苷。
[0515]
某种实施方式(alna[trz])中,包含双环糖的核苷为具有上述通式(i)的核苷,该式中,x为下述式(ii
‑
2):
[0516][0517]
表示的基团,
[0518]
a为可以被1个以上的取代基取代的三唑基(例如参照日本特愿2018
‑
212424)。alna[trz]的典型的具体例是a为可以具有1或多个甲基的三唑基,更具体而言为1,5
‑
二甲
基
‑
1,2,4
‑
三唑
‑3‑
基的核苷。
[0519]
某种实施方式(alna[oxz])是具有上述alna[mu]中定义的通式(i)的核苷,该式中,
[0520]
x为下述式(ii
‑
2):
[0521][0522]
表示的基团,
[0523]
a为可以被1个以上的取代基取代的二唑基(例如参照日本特愿2018
‑
212424)。典型的具体例是a为可以具有1或多个甲基的二唑基、更具体而言为5
‑
甲基
‑
1,2,4
‑
二唑
‑3‑
基的核苷或核苷酸。
[0524]
某种实施方式(alna[ms])中,包含双环糖的核苷为具有上述通式(i)的核苷,该式中,x为下述通式(ii
‑
3):
[0525][0526]
表示的基团,
[0527]
m为可以被甲基取代的磺酰基,该甲基可以被1个以上的取代基取代(例如参照日本特愿2018
‑
212424)。alna[ms]的典型的具体例是m为被无取代的甲基取代的磺酰基的核苷。
[0528]
某种实施方式中,核苷通过核糖基环与糖代用物的取代而被修饰。作为这样的修饰,可举出核糖基环与代用环系(也称为dna类似物)、例如吗啉代环、环己烯基环、环己基环或四氢吡喃基环、例如具有下式中的1个的环的取代,但并不限定于这些。
[0529][0530]
某种实施方式中,选择具有下式的糖代用物:
[0531][0532]
式中,
[0533]
bx为杂环碱基部分,
[0534]
t3和t4各自独立地为将四氢吡喃核苷类似物连接于低聚物化合物而得的核苷间连接基团,或者t3和t4中的一者为将四氢吡喃核苷类似物连接于低聚物化合物或寡核苷酸而得的核苷间连接基团,且t3和t4中的另一者为h、羟基保护基团、连接共轭基团或5’或3
’‑
末端基团,
[0535]
q1、q2、q3、q4、q5、q6和q7各自独立地为h、c1~c6烷基、取代c1~c6烷基、c2~c6烯基、取代c2~c6烯基、c2~c6炔基或取代c2~c6炔基,
[0536]
r1和r2中的一者为氢,另一者从卤素、取代或无取代的烷氧基、nj1j2、sj1、n3、oc(=x)j1、oc(=x)nj1j2、nj3c(=x)nj1j2和cn(式中,x为o、s或nj1,各j1、j2和j3独立地为h或c1~c6烷基)中选择。
[0537]
某种实施方式中,q1、q2、q3、q4、q5、q6和q7分别为h。某种实施方式中,q1、q2、q3、q4、q5、q6和q7中的至少1个不为h。某种实施方式中,q1、q2、q3、q4、q5、q6和q7中的至少1个为甲基。某种实施方式中,可以提供r1和r2中的一者为f的thp核苷。某种实施方式中,r1为氟,且r2为h;r1为甲氧基,且r2为h;以及,r1为甲氧基乙氧基,且r2为h。
[0538]
作为这样的糖代用物,可举出在本技术领域被称为己糖醇核酸(hna)、阿卓糖醇核酸(ana)和甘露糖醇核酸(mna)的糖代用物(参照leumann,c.j.,bioorg.&med.chem.,2002,10,841
‑
854),但并不限定于这些。
[0539]
某种实施方式中,糖代用物包含具有超过5个原子和超过1个杂原子的环。例如,报告了包含吗啉代糖部分的核苷和其在低聚物化合物中的使用(例如参照braaschet al.,biochemistry,2002,41,4503
‑
4510;以及美国专利5698685;5166315;5185444;和5034506)。
[0540]
在本说明书中使用时,用语“吗啉代”是指具有以下结构的糖代用物:
[0541]
某种实施方式中,例如,可以通过从上述吗啉代结构附加或改变各种取代基,从而修饰吗啉代基。这样的糖代用物在本说明书中称为“修饰吗啉代基”。
[0542]
某种实施方式中,寡核苷酸包含1个或多个修饰环己烯基核苷,其是具有6元环己烯基代替天然存在的核苷的戊呋喃糖基残基的核苷。作为修饰环己烯基核苷,可举出本技术领域中记载的修饰环己烯基核苷(参照例如共有的2010年4月10日公开的wo2010/036696、robeynset al.,j.am.chem.soc.,2008,130(6),1979
‑
1984;horvathet al.,tetrahedronletters,2007,48,3621
‑
3623;nauwelaerts et al.,j.am.chem.soc.,2007,129(30),9340
‑
9348;guet al.,nucleosides,nucleotides&nucleic acids,2005,24(5
‑
7),993
‑
998;nauwelaerts etal.,nucleic acidsresearch,2005,33(8),2452
‑
2463;robeyns et al.,acta crystallographica,section f:structuralbiology and crystallization communications,2005,f61(6),585
‑
586;guet al.,tetrahedron,2004,60(9),2111
‑
2123;guet al.,oligonucleotides,2003,13(6),479
‑
489;wanget al.,
applications,crc press,boca raton,1993,pp.276
‑
278)。
[0554]
作为进一步的修饰核酸碱基,可举出5
‑
羟基甲基胞嘧啶、黄嘌呤、次黄嘌呤、2
‑
氨基腺嘌呤、腺嘌呤和鸟嘌呤的6
‑
甲基和其它烷基衍生物、腺嘌呤和鸟嘌呤的2
‑
丙基和其它烷基衍生物、2
‑
硫代尿嘧啶、2
‑
硫代胸腺嘧啶和2
‑
硫代胞嘧啶、5
‑
卤代尿嘧啶和胞嘧啶、5
‑
丙炔基(
‑
c≡c
‑
ch3)尿嘧啶和胞嘧啶以及嘧啶碱基的其它炔基衍生物、6
‑
偶氮尿嘧啶、胞嘧啶和胸腺嘧啶、5
‑
尿嘧啶(假尿嘧啶)、4
‑
硫代尿嘧啶、8
‑
卤代、8
‑
氨基、8
‑
硫醇、8
‑
硫代烷基、8
‑
羟基和其它8
‑
取代腺嘌呤和鸟嘌呤、5
‑
卤代、特别是5
‑
溴、5
‑
三氟甲基和其它5
‑
取代尿嘧啶和胞嘧啶、7
‑
甲基鸟嘌呤和7
‑
甲基腺嘌呤、2
‑
f
‑
腺嘌呤、2
‑
氨基
‑
腺嘌呤、8
‑
氮杂鸟嘌呤和8
‑
氮杂腺嘌呤、7
‑
脱氮杂鸟嘌呤和7
‑
脱氮杂腺嘌呤、3
‑
脱氮杂鸟嘌呤和3
‑
脱氮杂腺嘌呤。
[0555]
杂环碱基部分也可以包含嘌呤或嘧啶碱基被其它杂环、例如7
‑
脱氮杂
‑
腺嘌呤、7
‑
脱氮杂鸟苷、2
‑
氨基吡啶和2
‑
吡啶酮取代的杂环碱基部分。作为对增大修饰寡核苷酸的键合亲和性特别有用的核酸碱基,可举出5
‑
取代嘧啶、6
‑
氮杂嘧啶和n
‑
2、n
‑
6和o
‑
6取代嘌呤(包含2
‑
氨基丙基腺嘌呤、5
‑
丙炔基尿嘧啶和5
‑
丙炔基胞嘧啶)。
[0556]
某种实施方式中,以dux4核酸为靶的修饰寡核苷酸包含1个或多个修饰核酸碱基。某种实施方式中,以dux4核酸为靶的修饰寡核苷酸包含1个或多个修饰核酸碱基。某种实施方式中,修饰核酸碱基为5
‑
甲基胞嘧啶。某种实施方式中,各胞嘧啶为5
‑
甲基胞嘧啶。
[0557]
某种修饰寡核苷酸基元
[0558]
某种实施方式中,为了对修饰寡核苷酸赋予抑制活性的增强、对靶核酸的键合亲和性的增大或对体内核酸酶所致的分解的抵抗性等特性,以dux4核酸为靶的修饰寡核苷酸具有配置在样式或基元的化学修饰亚单元。
[0559]
为了赋予对核酸酶所致分解的抵抗性的增大、细胞摄入的增大、对靶核酸的键合亲和性的增大和/或抑制活性的增大,嵌合体修饰寡核苷酸典型而言包含至少1个修饰区域。嵌合体修饰寡核苷酸的第二区域可作为对切断rna:dna双链的rna链的细胞内核酸内切酶rnase h底底物而任意地发挥作用。
[0560]
具有间隙体基元的修饰寡核苷酸为嵌合体修饰寡核苷酸。间隙体中,具有支持rnase h切断的多个核苷酸的内部区域位于外部区域间,该外部区域具有与内部区域的核苷化学性质不同的多个核苷酸。在具有间隙体基元的修饰寡核苷酸的情况下,间隙片段一般是作为以核酸内切酶进行切断的底物而发挥作用,但侧翼片段包含修饰核苷。某种实施方式中,间隙体区域可通过各自包含不同的区域的糖部分的类型而区别。一些实施方式中,用于区别间隙体区域的糖部分的类型可包含β
‑
d
‑
核糖核苷、β
‑
d
‑
脱氧核糖核苷、2
’‑
修饰核苷(对于这样的2
’‑
修饰核苷,其中可包含2
’‑
moe和2
’‑
o
‑
ch3)以及双环糖修饰核苷(这样的双环糖修饰核苷可包含具有lna、guna、alna[ms]、alna[mu]、alna[ipu]、alna[trz]和/或alna[oxz]的双环糖修饰核苷)。侧翼
‑
间隙
‑
侧翼基元常记为“x
‑
y
‑
z,”“x”表示5’侧翼区域的长度,“y”表示间隙区域的长度,“z”表示3’侧翼区域的长度。在本说明书中使用时,记载为“x
‑
y
‑
z”的间隙体具有如下空间构型:间隙片段位于分别直接邻接在5’侧翼片段和3’侧翼片段的位置。因此,在5’侧翼片段与间隙片段之间、或者间隙片段与3’侧翼片段之间不存在中间性核苷酸。本说明书的修饰寡核苷酸中的任一者可具有间隙体基元。一些实施方式中,x与z相同,其它实施方式中,它们不同。优选的实施方式中,y为8至16个核苷酸。x、y或z可以为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30个或其以上的核
苷酸中的任一者。因此,作为间隙体,例如可举出2
‑
10
‑
3、2
‑
14
‑
2、2
‑
15
‑
2、2
‑
16
‑
2、3
‑6‑
7、3
‑7‑
5、3
‑8‑
3、3
‑8‑
4、3
‑8‑
5、3
‑9‑
2、3
‑9‑
3、3
‑9‑
4、3
‑9‑
5、3
‑9‑
8、3
‑
10
‑
2、3
‑
10
‑
3、3
‑
10
‑
4、3
‑
11
‑
3、3
‑
12
‑
3、3
‑
14
‑
3、4
‑7‑
4、4
‑7‑
5、4
‑8‑
3、4
‑8‑
4、4
‑9‑
3、4
‑
10
‑
3、5
‑6‑
4、5
‑6‑
5、5
‑7‑
3、5
‑7‑
4、5
‑8‑
3、5
‑8‑
4或7
‑6‑
3,但并不限定于这些。
[0561]
某种实施方式中,以dux4核酸为靶的修饰寡核苷酸具有3
‑
10
‑
3间隙体基元。某种实施方式中,以dux4核酸为靶的修饰寡核苷酸具备3
‑9‑
3间隙体基元。某种实施方式中,以dux4核酸为靶的修饰寡核苷酸具备3
‑9‑
4间隙体基元。某种实施方式中,以dux4核酸为靶的修饰寡核苷酸具备3
‑8‑
5间隙体基元。
[0562]
某种实施方式中,这些间隙体的修饰寡核苷酸包含本说明书中记载的例示修饰寡核苷酸中的任一核酸碱基序列的至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27、至少28、至少29或至少30个连续的核酸碱基(例如序列表的序列号2、3、4、7~64、69~97或102~112中的任1者所记载的核酸碱基序列的至少8个连续的核酸碱基)。
[0563]
某种实施方式中,本发明提供包含寡核苷酸的低聚物化合物。某种实施方式中,这样的寡核苷酸包含1个或多个化学修饰。某种实施方式中,化学修饰寡核苷酸包含1个或多个修饰糖。某种实施方式中,化学修饰寡核苷酸包含1个或多个修饰核酸碱基。某种实施方式中,化学修饰寡核苷酸包含1个或多个修饰核苷间键。某种实施方式中,化学修饰(糖修饰、核酸碱基修饰和/或键合修饰)决定样式或基元。某种实施方式中,糖部分、核苷间键和核酸碱基的化学修饰的图案各自互为无关系。因此,寡核苷酸可通过其糖修饰基元、核苷间键合基元和/或核酸碱基修饰基元进行说明(在本说明书中使用时,核酸碱基修饰基元与核酸碱基的序列没有关系,说明对核酸碱基的化学修饰)。
[0564]
某种糖基元
[0565]
某种实施方式中,寡核苷酸包含在确定的图案或糖修饰基元中沿着寡核苷酸或其区域配置的1个或多个类型的修饰糖部分和/或天然存在的糖部分。这样的基元可包含本说明书中论述的糖修饰和/或其它已知的糖修饰中的任一者。
[0566]
某种实施方式中,寡核苷酸包含具有间隙体糖修饰基元的区域,或者由该区域构成,该区域包含2个外部区域即“侧翼片段”和1个内部区域即“间隙片段”。间隙体基元的3区域(5’侧翼片段、间隙片段和3’侧翼片段)形成核苷的连续的序列,这里,各侧翼片段的核苷的糖部分中的至少几个与间隙片段的核苷的糖部分的至少几个不同。特别是至少距间隙片段最近的各侧翼片段的核苷(5’侧翼片段的最3’侧的核苷和3’侧翼片段的最5’侧的核苷)的糖部分与邻接的间隙片段的核苷的糖部分不同,因此决定侧翼片段与间隙片段之间的边界部位。某种实施方式中,间隙片段内的糖部分相互相同。某种实施方式中,间隙片段包含具有与间隙片段的1个或多个其它核苷的糖部分不同的糖部分的1个或多个核苷。某种实施方式中,2个侧翼片段的糖修饰基元相互相同(对称的间隙体)。某种实施方式中,5’侧翼片段的糖修饰基元与3’侧翼片段的糖修饰基元不同(非对称的间隙体)。
[0567]
某种5’侧翼片段
[0568]
某种实施方式中,间隙体的5’侧翼片段由1个至5个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由2个至5个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由3个至5个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由4个或5个连接
的核苷构成。某种实施方式中,间隙体的5’侧翼片段由1个至4个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由1个至3个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由1个或2个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由2个至4个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由2个或3个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由3个或4个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由1个核苷构成。某种实施方式中,间隙体的5’侧翼片段由2个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由3个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由4个连接的核苷构成。某种实施方式中,间隙体的5’侧翼片段由5个连接的核苷构成。
[0569]
某种实施方式中,间隙体的5’侧翼片段包含至少1个双环核苷。某种实施方式中,间隙体的5’侧翼片段包含至少2个双环核苷。某种实施方式中,间隙体的5’侧翼片段包含至少3个双环核苷。某种实施方式中,间隙体的5’侧翼片段包含至少4个双环核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个约束乙基核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷。某种实施方式中,间隙体的5’侧翼片段的各核苷为双环核苷。某种实施方式中,间隙体的5’侧翼片段的各核苷为约束乙基核苷。某种实施方式中,间隙体的5’侧翼片段的各核苷为含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷。
[0570]
某种实施方式中,间隙体的5’侧翼片段包含至少1个非双环修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个2
’‑
取代核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个、例如3个、4个或5个2
’‑
moe核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个2
’‑
ome核苷。某种实施方式中,间隙体的5’侧翼片段的各核苷为非双环修饰核苷。某种实施方式中,间隙体的5’侧翼片段的各核苷为2
’‑
取代核苷。某种实施方式中,间隙体的5’侧翼片段的各核苷为2
’‑
moe核苷。某种实施方式中,间隙体的5’侧翼片段的各核苷为2
’‑
ome核苷。
[0571]
某种实施方式中,间隙体的5’侧翼片段包含至少1个双环核苷和至少1个非双环修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个双环核苷和至少1个2
’‑
取代核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个双环核苷和至少1个2
’‑
moe核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个双环核苷和至少1个2
’‑
ome核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个双环核苷和至少1个2
’‑
脱氧核苷。
[0572]
某种实施方式中,间隙体的5’侧翼片段包含至少1个约束乙基核苷和至少1个非双环修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个约束乙基核苷和至少1个2
’‑
取代核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个约束乙基核苷和至少1个2
’‑
moe核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个约束乙基核苷和至少1个2
’‑
ome核苷。某种实施方式中,间隙体的5’侧翼片段包含至少1个约束乙基核苷和至少1个2
’‑
脱氧核苷。
[0573]
某种实施方式中,间隙体的5’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核
苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少1个修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少2个修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少3个修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少4个修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少5个修饰核苷。
[0574]
某种实施方式中,间隙体的5’侧翼片段包含2个含有lna的核苷。某种实施方式中,间隙体的5’侧翼片段包含3个含有lna的核苷。某种实施方式中,间隙体的5’侧翼片段包含4个含有lna的核苷。某种实施方式中,间隙体的5’侧翼片段包含3个含有alna[ms]的核苷。某种实施方式中,间隙体的5’侧翼片段包含2个含有guna的核苷。某种实施方式中,间隙体的5’侧翼片段包含3个含有guna的核苷。某种实施方式中,间隙体的5’侧翼片段包含3个含有alna[mu]的核苷。某种实施方式中,间隙体的5’侧翼片段包含3个含有alna[ipu]的核苷。某种实施方式中,间隙体的5’侧翼片段包含2个含有lna的核苷与1个含有guna的核苷。某种实施方式中,间隙体的5’侧翼片段包含3个含有alna[trz]的核苷。某种实施方式中,间隙体的5’侧翼片段包含3个含有alna[ms]的核苷与1个2
’‑
ome核苷。某种实施方式中,间隙体的5’侧翼片段包含3个含有alna[ms]的核苷与2个2
’‑
ome核苷。
[0575]
某种实施方式中,间隙体的5’侧翼片段包含3个约束乙基核苷。某种实施方式中,间隙体的5’侧翼片段包含2个双环核苷和2个非双环修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含2个约束乙基核苷和2个2
’‑
ome核苷。某种实施方式中,间隙体的5’侧翼片段包含2个双环核苷和2个非双环修饰核苷。某种实施方式中,间隙体的5’侧翼片段包含2个约束乙基核苷和2个2
’‑
ome核苷。某种实施方式中,间隙体的5’侧翼片段包含2个约束乙基核苷和3个2
’‑
ome核苷。
[0576]
某种实施方式中,间隙体的5’侧翼片段由1个含有alna[ms]的核苷构成。某种实施方式中,间隙体的5’侧翼片段由2个连接的含有alna[ms]的核苷构成。某种实施方式中,间隙体的5’侧翼片段由3个连接的含有alna[ms]的核苷构成。某种实施方式中,间隙体的5’侧翼片段由4个连接的含有alna[ms]的核苷构成。某种实施方式中,间隙体的5’侧翼片段由5个连接的含有alna[ms]的核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1个2
’‑
ome核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和2个2
’‑
ome核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和3个2
’‑
ome核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的3个含有alna[ms]的核苷与1个2
’‑
moe核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的2个含有alna[ms]的核苷与2个2
’‑
moe核苷构成。某种
实施方式中,间隙体的5’侧翼片段由连接的3个含有lna的核苷与2个2
’‑
moe核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的2个含有lna的核苷与2个2
’‑
moe核苷构成。
[0577]
某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含1个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含2个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含3个5
‑
甲基胞嘧啶。
[0578]
某种3’侧翼片段
[0579]
某种实施方式中,间隙体的3’侧翼片段由1个至8个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由2个至5个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由3个至5个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由4个或5个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由1个至4个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由1个至3个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由1个或2个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由2个至4个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由2个或3个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由3个或4个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由1个核苷构成。某种实施方式中,间隙体的3’侧翼片段由2个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由3个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由4个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由5个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由6个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由7个连接的核苷构成。某种实施方式中,间隙体的3’侧翼片段由8个连接的核苷构成。
[0580]
某种实施方式中,间隙体的3’侧翼片段包含至少1个双环核苷。某种实施方式中,间隙体的3’侧翼片段包含至少2个双环核苷。某种实施方式中,间隙体的3’侧翼片段包含至少3个双环核苷。某种实施方式中,间隙体的3’侧翼片段包含至少4个双环核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个约束乙基核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷。某种实施方式中,间隙体的3’侧翼片段的各核苷为双环核苷。某种实施方式中,间隙体的3’侧翼片段的各核苷为约束乙基核苷。某种实施方式中,间隙体的3’侧翼片段的各核苷为含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷。
[0581]
某种实施方式中,间隙体的3’侧翼片段包含至少1个非双环修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个2
’‑
取代核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个2
’‑
ome核苷。某种实施方式中,间隙体的3’侧翼片段的各核苷为非双环修饰核苷。某种实施方式中,间隙体的3’侧翼片段的各核苷为2
’‑
取代核苷。某种实施方式中,间隙体的3’侧翼片段的各核苷为2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段的各核苷为2
’‑
ome核苷。
[0582]
某种实施方式中,间隙体的3’侧翼片段包含至少1个双环核苷和至少1个非双环修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个双环核苷和至少1个2
’‑
取代核
苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个双环核苷和至少1个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个双环核苷和至少1个2
’‑
ome核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个双环核苷和至少1个2
’‑
脱氧核苷。
[0583]
某种实施方式中,间隙体的3’侧翼片段包含至少1个约束乙基核苷和至少1个非双环修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个约束乙基核苷和至少1个2
’‑
取代核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个约束乙基核苷和至少1个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个约束乙基核苷和至少1个2
’‑
ome核苷。某种实施方式中,间隙体的3’侧翼片段包含至少1个约束乙基核苷和至少1个2
’‑
脱氧核苷。
[0584]
某种实施方式中,间隙体的3’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少1个修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少2个修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少3个修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少4个修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少5个修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少6个修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少7个修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含从2
’‑
moe核苷、2
’‑
ome核苷、含有lna的核苷、含有guna的核苷、含有alna[ms]的核苷、含有alna[mu]的核苷、含有alna[ipu]的核苷、含有alna[trz]的核苷和/或含有alna[oxz]的核苷中选择的至少8个修饰核苷。
[0585]
某种实施方式中,间隙体的3’侧翼片段包含2个含有lna的核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有lna的核苷。某种实施方式中,间隙体的3’侧翼片段包含4个含有lna的核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有alna[ms]的核苷。某种实施方式中,间隙体的3’侧翼片段包含2个含有guna的核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有guna的核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有alna[mu]的核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有alna[ipu]的核苷。某种实施方式中,间隙体的3’侧翼包含2个含有lna的核苷与1个含有guna的核苷。某种实施方
式中,间隙体的3’侧翼片段包含3个含有alna[trz]的核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有alna[ms]的核苷与1个2
’‑
ome核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有alna[ms]的核苷与2个含有2
’‑
ome的核苷。某种实施方式中,间隙体的3’侧翼片段包含3个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含4个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含5个2
’‑
moe。某种实施方式中,间隙体的3’侧翼片段包含3个含有alna[ms]的核苷与1个含有2
’‑
moe的核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有alna[ms]的核苷与2个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含2个含有alna[ms]的核苷与2个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含2个含有alna[ms]的核苷与3个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含3个含有alna[ms]的核苷与5个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含1个含有alna[ms]的核苷与3个2
’‑
moe核苷。某种实施方式中,间隙体的3’侧翼片段包含2个含有lna的核苷与2个2
’‑
moe核苷。
[0586]
某种实施方式中,间隙体的3’侧翼片段包含3个约束乙基核苷。某种实施方式中,间隙体的3’侧翼片段包含2个双环核苷和2个非双环修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含2个约束乙基核苷和2个2
’‑
ome核苷。某种实施方式中,间隙体的3’侧翼片段包含2个双环核苷和2个非双环修饰核苷。某种实施方式中,间隙体的3’侧翼片段包含2个约束乙基核苷和2个2
’‑
ome核苷。某种实施方式中,间隙体的3’侧翼片段包含2个约束乙基核苷和3个2
’‑
ome核苷。
[0587]
某种实施方式中,间隙体的3’侧翼片段由1个含有alna[ms]的核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的2个含有alna[ms]的核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的3个含有alna[ms]的核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的4个含有alna[ms]的核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的5个含有alna[ms]的核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的3、4或5个2
’‑
moe核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1个2
’‑
ome核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和2个2
’‑
ome核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和3个2
’‑
ome核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1个2
’‑
moe核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和2个2
’‑
moe核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和3个2
’‑
moe核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和5个2
’‑
moe核苷构成。某种实施方式中,间隙体的3’侧翼片段由连接的2个含有lna的核苷和2个2
’‑
moe核苷构成。
[0588]
某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含1个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含2个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含3个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的3’侧翼片段由连接的1、2、3、4或5个2
’‑
moe核苷构成,且包含1个5
‑
甲基胞嘧啶。
[0589]
某种实施方式中,间隙体的5’侧翼片段由1个含有alna[ms]的核苷构成,且3’侧翼
片段由1个含有alna[ms]的核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的2个含有alna[ms]的核苷构成,且3’侧翼片段由连接的2个含有alna[ms]的核苷构成。某种实施方式中的片段,间隙体的5’侧翼片段由连接的3个含有alna[ms]的核苷构成,且3’侧翼片段由连接的3个含有alna[ms]的核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的4个含有alna[ms]的核苷构成,且3’侧翼片段由连接的4个含有alna[ms]的核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的5个含有alna[ms]的核苷构成,且3’侧翼片段由连接的5个含有alna[ms]的核苷构成。
[0590]
某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1个2
’‑
ome核苷构成,且3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1个2
’‑
ome核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和2个2
’‑
ome核苷构成,且3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和连接的2个2
’‑
ome核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和3个2
’‑
ome核苷构成,且3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和3个2
’‑
ome核苷构成。
[0591]
某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1或2个2
’‑
moe核苷构成,且3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1或2个2’moe核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1、2或3个2
’‑
moe核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且3’侧翼片段由连接的1、2、3、4或5个2
’‑
moe核苷构成。某种实施方式中,间隙体的5’侧翼片段由连接的1、2、3、4或5个2
’‑
moe核苷构成,且3’侧翼片段由连接的1、2或3个alna[ms]构成。
[0592]
某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含1个5
‑
甲基胞嘧啶,进而,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含1个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含2个5
‑
甲基胞嘧啶,进而,间隙体的3’侧翼由连接的1、2或3个含有alna[ms]的核苷构成,且包含1个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含2个5
‑
甲基胞嘧啶,进而,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含2个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含3个5
‑
甲基胞嘧啶,进而,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含3个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,且包含1个5
‑
甲基胞嘧啶,进而,间隙体的3’侧翼片段由连接的1、2、3、4或5个2
’‑
moe核苷构成,且包含1个5
‑
甲基胞嘧啶。某种实施方式中,间隙体的5’侧翼片段由连接的1、2或3个含有alna[ms]的核苷构成,进而,间隙体的3’侧翼片段由连接的1、2或3个含有alna[ms]的核苷和1、2或3个2
’‑
moe核苷构成,且包含1个5
‑
甲基胞嘧啶。
[0593]
某种实施方式中,间隙体的间隙片段包含10个连续的核苷,在第1、2、3、4、5、6、7、8、9或10个的任一核苷中包含2
’‑
ome核苷,且剩余的核苷为脱氧核苷。
[0594]
用于将医药组合物制剂化的组合物和方法
[0595]
为了制备医药组合物或制剂,可以将修饰寡核苷酸与1个以上的医药上可允许的活性或非活性的物质混合。用于医药组合物的制剂化的组合物和方法根据包含给药路径、疾病程度或所给药的用量在内的一些判断基准来决定,但并不限定于这些。
[0596]
通过将适当的医药上可允许的稀释剂或载体与修饰寡核苷酸组合,可以将以dux4核酸为靶的修饰寡核苷酸在医药组合物中利用。作为医药上可允许的稀释剂,可举出磷酸盐缓冲盐水(pbs)。pbs是适于在非口服递送的组合物中使用的稀释剂。因此,在一个实施方式中,包含以dux4核酸为靶的修饰寡核苷酸和医药上可允许的稀释剂的医药组合物可在本说明书所记载的方法中使用。某种实施方式中,医药上可允许的稀释剂为pbs。
[0597]
在对包含人的动物给药时,包含修饰寡核苷酸的医药组合物包含可(直接或间接地)提供在生物学上有活性的代谢物或其残留物的任意的医药上可允许的盐、酯或这样的酯的盐或任意的其它寡核苷酸。因此,例如,本公开也涉及修饰寡核苷酸的医药上可允许的盐、前药、这样的前药的医药上可允许的盐和其它生物学上的同等物。作为适当的医药上可允许的盐,可举出钠盐和钾盐,但并不限定于这些。
[0598]
为了形成具有活性的修饰寡核苷酸,前药可包含在修饰寡核苷酸的一端或两端编入附加的核苷,该修饰寡核苷酸在体内被内源性核酸酶切断。
[0599]
共轭修饰寡核苷酸
[0600]
可以将修饰寡核苷酸与增强所得到的修饰寡核苷酸的活性、细胞分布或细胞摄入的1个或多个部分或共轭物进行共价键合。作为典型的共轭基团,可举出胆固醇部分和脂质部分。作为进一步的的共轭基团,可举出碳水化合物、磷脂、生物素、吩嗪、叶酸、菲啶、蒽醌、吖啶、荧光素、罗丹明、香豆素和色素。
[0601]
例如,为了增强核酸酶稳定性等特性,也可以以具有一般键合于修饰寡核苷酸的一个末端或两个末端的1个或多个稳定化基团的方式对修饰寡核苷酸进行修饰。稳定化基团包含帽结构。这些末端修饰保护具有末端核酸的修饰寡核苷酸免受核酸外切酶分解,可有助于细胞内的递送和/或定位。帽可以存在于5’末端(5’帽)或3’末端(3’帽),也可以存在于两个末端。帽结构在本技术领域中是周知的,例如,可举出反转脱氧无碱基帽。作为可用于将修饰寡核苷酸的一端或两端加上帽以赋予核酸酶稳定性的进一步的3’和5’稳定化基团,可举出wo03/004602公开的稳定化基团。
[0602]
细胞培养和修饰寡核苷酸处理
[0603]
修饰寡核苷酸对dux4核酸的水平、活性或表达的效果可以在各种细胞类型中在体外进行试验。这样的解析中使用的细胞类型可以从商业供应商(例如美国培养细胞系统保存机关、manassus、va;zen
‑
bio,inc.、research triangle park、nc;clonetics corporation、walkersville、md)获得,细胞使用市售的试剂(例如invitrogenlife technologies、carlsbad、ca),按照供应商的说明书来培养。作为例示的细胞类型,可举出c2c12细胞、hepg2细胞、hep3b细胞、原代肝细胞、a549细胞、gm04281成纤维细胞和llc
‑
mk2细胞,但并不限定于这些。这些细胞可转染表达人dux4 mrna的载体来使用。作为载体,优选作为与荧光酶或gfp等报告基因的融合蛋白质来表达,例如可举出psicheck
‑
2vector(promega)。
[0604]
修饰寡核苷酸的体外试验
[0605]
用修饰寡核苷酸对细胞进行的方法记载在本说明书中,这可以根据修饰寡核苷酸
的种类而适当地改变。
[0606]
通常,在培养中细胞到达约60~80%汇合度时,用修饰寡核苷酸处理细胞。
[0607]
修饰寡核苷酸例如通过脂质转染法导入到细胞中的。
[0608]
作为通常用于将修饰寡核苷酸导入培养细胞的一种试剂,可举出阳离子性脂质转染试剂的lipofectin(注册商标)(invitrogen、carlsbad、ca)。在opti
‑
mem(注册商标)1(invitrogen、carlsbad、ca)中,将修饰寡核苷酸与lipofectin(注册商标)混合,得到修饰寡核苷酸的期望的最终浓度以及典型而言相对于每100nm修饰寡核苷酸达2~12μg/ml的lipofectin(注册商标)浓度。
[0609]
作为用于将修饰寡核苷酸导入培养细胞的其它试剂,可举出lipofectamine2000(注册商标)(invitrogen、carlsbad、ca)。在opti
‑
mem(注册商标)1血清减少培养基(invitrogen、carlsbad、ca)中,将修饰寡核苷酸与lipofectamine2000(注册商标)混合,得到修饰寡核苷酸的期望的浓度以及典型而言相对于每100nm修饰寡核苷酸达2~12μg/ml的lipofectin(注册商标)浓度。
[0610]
作为用于将修饰寡核苷酸导入培养细胞的其它试剂,可举出cytofectin(注册商标)(invitrogen、carlsbad、ca)。在opti
‑
mem(注册商标)1血清减少培养基(invitrogen、carlsbad、ca)中,将修饰寡核苷酸与cytofectin(注册商标)混合,得到修饰寡核苷酸的所期望的浓度以及典型而言相对于每100nm修饰寡核苷酸达2~12μg/ml的cytofectin(注册商标)浓度。
[0611]
作为用于将修饰寡核苷酸导入培养细胞的其它做法,可举出电穿孔法。
[0612]
修饰寡核苷酸即使不使用lipofectin等,也可导入细胞中。将此时的修饰寡核苷酸的靶基因的表达抑制方法称为gymnosis法。
[0613]
通过惯例的方法,用修饰寡核苷酸对细胞进行处理。典型而言,在修饰寡核苷酸处理起16~48小时后收集细胞,在该时刻,通过本技术领域中已知以及本说明书中记载的方法来测定靶核酸的rna或蛋白质水平。通常,在多次反复实施处理时,显示作为反复处理的平均值的数据。
[0614]
所使用的修饰寡核苷酸的浓度根据细胞系统而不同。决定对特定细胞系统最适的修饰寡核苷酸浓度的方法在本技术领域中是周知的。使用lipofectamine2000(注册商标)、lipofectin或cytofectin进行转染时,典型而言,以达1nm~300nm的浓度使用修饰寡核苷酸。使用电穿孔进行转染时,以达625~20000nm的较高浓度使用修饰寡核苷酸。可由各浓度的基因表达的抑制率算出抑制50%的基因表达的修饰寡核苷酸浓度ic50。
[0615]
rna分离
[0616]
rna解析可对总细胞rna或聚(a) mrna来实施。rna分离的方法在本技术领域中是周知的。对于rna而言,使用本领域公知的方法,例如按照制造业者推荐的方案,使用trizol(注册商标)试剂(invitrogen、carlsbad、ca)来制备。
[0617]
关于靶水平或表达的抑制的解析
[0618]
dux4核酸水平或表达的抑制可通过本技术领域中已知的各种方法进行分析。例如,靶核酸水平例如可通过northern印迹解析、竞争性聚合酶链反应(pcr)或定量实时pcr来定量化。rna解析可对总细胞rna或聚(a) mrna来实施。rna分离的方法在本技术领域中是周知的。northern印迹解析在本技术领域中也是惯例的。定量实时pcr可使用依照可由pe
‑
applied biosystems、foster city、ca获得的制造者的说明书使用的市售的abi prism(注册商标)7600、7700或7900序列检测系统便利地实现。
[0619]
靶rna水平的定量实时pcr解析
[0620]
靶rna水平的定量化可依照制造者的说明书,使用abi prism(注册商标)7600、7700或7900序列检测系统(pe
‑
applied biosystems、foster city、ca),通过定量实时pcr而实现。定量实时pcr的方法在本技术领域中是周知的。
[0621]
在实时pcr之前,将所分离的rna进行逆转录酶(rt)反应,由此,生成之后作为实时pcr扩增的底物而使用的互补dna(cdna)。在相同试样孔中逐次实施rt和实时pcr的反应。rt和实时pcr的试剂可由invitrogen(carlsbad、ca)得到。rt、实时pcr反应通过本领域技术人员周知的方法进行。
[0622]
通过实时pcr而得的基因(或rna)靶的量通过使用亲环素a等的表达恒定的基因的表达水平,或者使用ribogreen(注册商标)(invitrogen、inc.carlsbad、ca)对总rna进行定量化来进行标准化。亲环素a的表达通过实时pcr与靶同时地多重地或个别地实施而定量化。总rna是使用ribogreen(注册商标)rna定量化试剂(invitrogen、inc.eugene、or)来定量化。使用ribogreen(注册商标)的rna的定量化方法在jones,l.j.,etal,(analytical biochemistry,1998,265,368
‑
374)中有教导。使用cytofluor(注册商标)4000设备(peapplied biosystems)测定ribogreen(注册商标)荧光。
[0623]
以与dux4核酸杂交的方式设计探针和引物。实时pcr的探针和引物的设计方法在本技术领域中是周知的,可包含primer express(注册商标)软件(applied biosystems、fostercity、ca)等软件的使用。
[0624]
蛋白质水平的解析
[0625]
通过测定dux4蛋白质的水平来评价dux4核酸的反义抑制。dux4蛋白质的水平,可通过本领域中公知的各种方法,例如免疫沉降法、western印记解析(免疫印记法)、酶联免疫吸附测定法(elisa)、定量蛋白质分析、蛋白质活性分析(例如卡斯蛋白酶活性分析)、免疫组织化学法、免疫细胞化学法或荧光活化细胞分选(facs)进行调查或定量化。针对靶的抗体可由各种供给源、例如抗体的msrs目录(aeriecorporation、birmingham、mi)确定和获得,或者可通过本技术领域周知的以往的单克隆或多克隆抗体产生方法来制备。
[0626]
基因表达的解析
[0627]
也可以利用荧光酶等报告基因测定dux4基因表达的水平。例如,使用psicheck
‑
2vector(promega)时,dux4基因的表达可通过作为与dux4的融合蛋白的renilla荧光酶的发光量来测定,通过以同样载体上存在的萤火虫荧光素酶的发光量进行校正,能够排除非特异性的细胞死亡等影响。
[0628]
修饰寡核苷酸的体内试验
[0629]
为了评价修饰寡核苷酸抑制dux4表达和使表型变化的能力,在动物中进行试验。试验可在正常动物或实验用的疾病模型、例如dux4的基因转基因小鼠模型(jones,t.et al.plos one.2018;13(2)、article numbere0192657)、使用基因重组aav病毒的dux4基因表达小鼠(wallace,lm et al.mol ther.2012;20(7):1417、wallace,lm et al.ann neurol.2011;69(3):540)中实施。
[0630]
为了对动物进行给药,在医药上可允许的稀释剂、例如磷酸缓冲盐水中将修饰寡
核苷酸制剂化。给药包含非口服给药路径。在利用修饰寡核苷酸的处置期间后,将rna从组织分离,测定dux4核酸表达的变化。也测定dux4蛋白质的水平的变化。
[0631]
某种反义机制
[0632]
fshd是由肌肉中的dux4基因(特别是dux4
‑
fl的剪接变体)的异常表达而引起的。另一方面,dux4在健康人中、例如睾丸等中也表达。在睾丸等中表达的某种dux4的剪接变体中,除dux4
‑
fl以外,还表达外显子1、外显子2、外显子6、外显子7的剪接变体、外显子1、外显子2、外显子4、外显子5、外显子6、外显子7的剪接变体(上述非专利文献1)。
[0633]
某种生物标志物
[0634]
至少部分地通过dux4蛋白质的累积水平来调节例如mbd3l2、zscan4、trim43、defb103、znf217等基因表达(上述非专利文献2)。另外,可以测定血中肌酸激酶作为肌肉障碍的标志物。
[0635]
某种适应症
[0636]
某种实施方式中,本说明书提供处置个体的方法,包括给药本说明书中记载的1个或多个医药组合物。某种实施方式中,个体具有fshd。
[0637]
因此,本说明书提供在需要改善与fshd有关的症状的对象中改善与fshd有关的症状的方法。某种实施方式中,提供减少与fshd有关的1个以上的症状的发病率的方法。某种实施方式中,提供降低与fshd有关的症状的严重程度的方法。某种实施方式中,作为与fshd有关的症状,可举出肌肉僵直、肌肉强直症、面部肌衰弱、眼睑下垂、无法吹口哨、脸部表情变化减少、忧郁或愤怒的脸部表情、语言发音困难、肩胛肌肉衰弱(翼状肩胛、斜肩等变形)、下肢衰弱、听力损失和心脏病。
[0638]
某种实施方式中,本发明的方法包括将治疗有效量的以dux4核酸为靶的化合物对需要其的个体进行给药。
[0639]
某种实施方式中,以dux4核酸为靶的修饰寡核苷酸的给药带来至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约99%或由任意2个这些值确定的范围的dux4的表达的减少。
[0640]
某种实施方式中,包含以dux4为靶的修饰寡核苷酸的医药组合物可用于制备一种医药,该医药用于处置患有或容易患fshd等dux4相关疾病的患者。
[0641]
某种实施方式中,本说明书中记载的方法包括给药一种化合物,该化合物包含序列表的序列号2、3、4、7~64、69~97或102~112中记载的序列的具有本说明书所记载的连续的核酸碱基部分的修饰寡核苷酸。
[0642]
给药
[0643]
某种实施方式中,本说明书中记载的化合物和医药组合物非口服地给药。
[0644]
某种实施方式中,非口服给药通过注入来进行。注入可以是持续的或长期的,也可以是短期的或间断的。某种实施方式中,所注入的医药剂利用泵来递送。某种实施方式中,非口服给药通过注射(例如推注注射)来进行。注射剂可利用注射器来递送。
[0645]
作为非口服给药,例如可举出皮下给药、静脉内给药、肌肉内给药、动脉内给药、腹腔内给药或颅内给药、例如髓腔内或脑室内给药。给药可以是持续的或长期的,也可以是短期的或间断的。
[0646]
某种实施方式中,本说明书中记载的医药组合物的化合物的递送带来靶mrna和/或靶蛋白质的水平的至少70%的下调(down regulation)。某种实施方式中,本说明书中记载的化合物或组合物的递送持续至少1天、至少3天、至少5天、至少7天、至少10天、至少14天、至少20天、至少21天、至少28天、至少30天、至少35天、至少40天、至少45天、至少50天、至少55天、至少60天、至少65天、至少70天、至少75天、至少76天、至少77天、至少78天、至少79天、至少80天、至少85天、至少90天、至少95天、至少100天、至少105天、至少110天、至少115天、至少120天、至少1年带来靶mrna和/或标的蛋白质的水平的10%、20%、30%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的下调。
[0647]
某种实施方式中,修饰寡核苷酸以每天1次、3天1次、每周1次、隔周1次、3周1次、每月1次、2个月1次、3个月1次、6个月1次、一年2次或一年1次,通过注射或注入来递送。
[0648]
某些并用疗法
[0649]
某种实施方式中,包含本发明的修饰寡核苷酸的第一药剂与1种或多种第二药剂共给药。某种实施方式中,这样的第二药剂被设计为处置与本说明书中记载的第一药剂相同的fshd。某种实施方式中,这样的第二药剂被设计为处置与本说明书中记载的第一药剂不同的疾病、障碍或状态。某种实施方式中,这样的第二药剂被设计为处置本说明书中记载的1个或多个医药组合物的不期望的副作用。某种实施方式中,第二药剂为了处置第一药剂的不期望的作用而与第一药剂共给药。某种实施方式中,第二药剂为了带来并用效果而与第一药剂共给药。某种实施方式中,第二药剂为了带来协同效果而与第一药剂共给药。
[0650]
某种实施方式中,第一药剂和1种或多种第二药剂同时给药。某种实施方式中,第一药剂和1种或多种第二药剂在不同的时间给药。某种实施方式中,第一药剂和1种或多种第二药剂在单一的医药制剂中一起制备。某种实施方式中,第一药剂和1种或多种第二药剂分别进行制备。
[0651]
某些化合物
[0652]
某种实施方式中,本说明书中公开的化合物可使用市售的dna
·
rna合成用亚酰胺(amidite)(也包含lna),通过亚磷酰胺法来合成低聚物。人工核酸guna可通过wo2014/046212号、wo2017/047816号中记载的方法来合成低聚物。人工核酸alna[ms]、alna[mu]、alna[ipu]、alna[trz]和alna[oxz]可通过日本特愿2018
‑
212424号中记载的方法而合成低聚物。
[0653]
某种实施方式中,本说明书中公开的化合物与适当的比较化合物相比,享受到提高1个或多个体外和/或体内特性的利益。
[0654]
某种实施方式中中,是具有(5’至3’)ngagattcccgccggt(n为5
‑
甲基胞嘧啶,作为序列号2并入本说明书中)的序列的化合物编号1的化合物,即,5’侧翼、3’侧翼由各3个含有lna的核苷构成的间隙体,并且各核苷间键为硫代磷酸酯键的化合物。
[0655]
某种实施方式中,是具有(5’至3’)gnagttctccgcggt(n为5
‑
甲基胞嘧啶,作为序列表的序列号3并入本说明书中)的序列的化合物编号2的化合物,即,5’侧翼、3’侧翼由各3个含有alna[ms]的核苷构成的间隙体,并且各核苷间键为硫代磷酸酯键的化合物。
[0656]
某种实施方式中,是具有(5’至3’)gnntagacagcgtngg(n为5
‑
甲基胞嘧啶,作为序列表的序列号4并入本说明书中)的序列的化合物编号3的化合物,即,5’侧翼、3’侧翼由各3个含有lna的核苷构成的间隙体,并且各核苷间键为硫代磷酸酯键的化合物。
[0657]
某种实施方式中,是具有(5’至3’)gnntagacagcgtngg(n为5
‑
甲基胞嘧啶,作为序列表的序列号4并入本说明书中)的序列的化合物编号123的化合物,即,5’侧翼、3’侧翼由各3个含有alna[ms]的核苷构成的间隙体,并且各核苷间键为硫代磷酸酯键的化合物。
[0658]
非限定性公开以及通过参照的并入
[0659]
本说明书中记载的某种化合物、组合物和方法依照某种实施方式而特异性地进行了记载,但以下的实施例仅起到例示本说明书中记载的化合物的作用,并未打算限定本发明。本技术中记载的参考文献、genbank登录号等分别通过参照将其整体并入本说明书中。
[0660]
本技术所附的序列表根据需要以“rna”或“dna”中的任一者的形式特定各序列,但实际上这些序列可通过化学修饰的任意组合进行修饰。本领域技术人员可以容易地理解,用于说明修饰寡核苷酸的“rna”或“dna”这样的指定根据情况是随意的。例如,包含含有2
’‑
oh糖部分和胸腺嘧啶碱基的核苷的寡核苷酸可作为具有修饰糖(相对于dna的天然2
’‑
h而言为2
’‑
oh)的dna,或具有修饰碱基(相对于rna的天然尿嘧啶而言为胸腺嘧啶(甲基化尿嘧啶))的rna进行说明。
[0661]
因此,包含序列表中的核酸序列在内的本说明书所提供的核酸序列并不限定于这些,意图为包括含有包含具有修饰核酸碱基这样的核酸在内的天然或修饰rna和/或dna的任意组合的核酸,但并不限定于这些。虽然没有限定,但作为进一步的例子,具有核酸碱基序列“atcgatcg”的低聚物化合物可以进行修饰、也可以不进行修饰,包含具有这样的核酸碱基序列的任意低聚物化合物,其中包含含有rna碱基的这样的化合物,例如具有序列“aucgaucg”的化合物,以及“aucgatcg”等具有一些dna碱基和一些rna碱基的化合物,以及“atmecgaucg”(这里,mec表示5位包含甲基的胞嘧啶碱基)等具有其它经修饰或天然存在的碱基的低聚物化合物,但并不限定于这些。
[0662]
实施例
[0663]
非限定性公开以及通过参照的并入
[0664]
本说明书中记载的某种化合物、组合物和方法依照某种实施方式而特异性地进行了记载,但以下的实施例仅起到例示本说明书中记载的化合物的作用,并未打算限定本发明。本技术中记载的参考文献分别通过参照将其整体并入本说明书中。
[0665]
将本说明书中使用的各人工核酸的结构与各自的缩写一并示于下述结构式。
[0666]
各人工核酸的结构与简称
[0667][0668]
实施例1
[0669]
体外评价用修饰寡核苷酸化合物的合成和纯化
[0670]
使用各种亚酰胺(lna亚酰胺是由chem genes和hongene biotechnology limited购入,2
’‑
ome亚酰胺由sigma
‑
aldrich购入,guna通过wo2014/046212号、wo2017/047816号中记载的方法合成,alna[ms]、alna[mu]、alna[ipu]、alna[trz]和alna[oxz]通过日本特愿2018
‑
212424号中记载的方法合成),通过dna/rna寡核苷酸自动合成机ns
‑
8ii(gene design株式会社制)以0.2或1.0μmol规模使用cpg或聚苯乙烯载体合成修饰寡核苷酸化合物。亚酰胺全部调整为0.1m的乙腈溶液,非天然型核苷中的偶联时间以10分钟进行,除此之外的工序以ns
‑
8ii的标准条件进行。活化剂使用activator42(sigma
‑
aldrich)、硫化使用sulfurizing reagentii(gren research corporation)。合成的寡核苷酸加入28%氨水溶液并在60
‑
65℃反应8小时,从而进行从载体的切出和碱基部的脱保护。将氨浓缩馏去后,进行反相hplc纯化。
[0671]
实施例2
[0672]
体内评价用修饰寡核苷酸化合物的合成和纯化
[0673]
使用各种亚酰胺,利用dna/rna寡核苷酸自动合成机akta oligopilot plus 10(ge healthcare japan株式会社制),以20~50μmol规模使用聚苯乙烯载体合成修饰寡核苷酸化合物。dna亚酰胺调整为0.1m、非天然型亚酰胺调整为0.05~0.1m的乙腈溶液,非天然型核苷中的偶联再循环时间以20分钟进行,对通用载体(universal carrier)导入第1碱基时,各自连续2次实施偶联、硫化、加帽工序。除此以外的工序以aktaoligopilot plus10的标准条件进行。活化剂使用activator42(sigma
‑
aldrich),硫化使用sulfurizing reagentii(gren research corporation)。合成的寡核苷酸使用20%二乙基胺/乙腈或50%三乙基胺/乙腈在固相上进行脱氰基乙基处理,加入28%氨水溶液并在60
‑
65℃反应8~24小时,由此进行从载体的切出和碱基部的脱保护。将氨浓缩馏去后,利用阴离子交换柱
进行纯化。利用脱盐柱除去阴离子交换后所含的剩余盐去除。
[0674]
实施例3
[0675]
修饰寡核苷酸化合物的纯度确认
[0676]
所合成的修饰寡核苷酸化合物的纯化和纯度确认通过反相hplc,按以下的条件进行。任一化合物的纯度均为85%以上。
[0677]
反相hplc(纯化)
[0678]
流动相:
[0679]
a液:400mm六氟异丙醇、15mm三乙基胺
[0680]
b液:甲醇
[0681]
梯度:a:b=85:15
→
70:30(10min)
[0682]
使用柱:
[0683]
分配waters xbridge@oligonucleotide beh c18 obdtm prep column,2.5μm,10mm*50mm
[0684]
流速:
[0685]
分配5ml/min
[0686]
柱温:60℃。
[0687]
检测:uv(260nm)
[0688]
反相hplc(纯度确认)
[0689]
流动相:
[0690]
a液:400mm六氟异丙醇、15mm三乙基胺水溶液
[0691]
b液:甲醇
[0692]
梯度:a:b=80:20
→
70:30(6.5min)
[0693]
使用柱:
[0694]
分析waters acquity uplc@oligonucleotide beh c18 column,1.7μm,2.1mm*50mm
[0695]
流速:0.2ml/min
[0696]
柱温:60℃。
[0697]
检测:uv(260nm)
[0698]
阴离子交换纯化
[0699]
流动相:
[0700]
a液:1mm naoh 20%乙腈水溶液
[0701]
b液:1mm naoh,1.5m nacl/20%乙腈水溶液
[0702]
使用柱:tskgel superq
‑
5pw(13)*15mm
[0703]
流速:7ml/min
[0704]
柱温:室温
[0705]
检测:uv(260nm)
[0706]
脱盐柱
[0707]
流动相:
[0708]
a液:20%乙腈水溶液
[0709]
b液:20%乙腈水溶液
[0710]
使用柱:
[0711]
ge hiprep 26/10desalting*4根串联
[0712]
流速:12ml/min
[0713]
柱温:室温
[0714]
实施例4
[0715]
修饰寡核苷酸化合物分子量测定
[0716]
合成的修饰寡核苷酸化合物的分子量使用waters zq按以下条件进行。
[0717]
流动相:
[0718]
a液:400mm六氟异丙醇、15mm三乙基胺水溶液
[0719]
b液:甲醇
[0720]
梯度:a:b=80:20
→
70:30(6.5min)
[0721]
使用柱:
[0722]
waters acquity uplc@oligonucleotide beh c18 column,1.7μm,2.1mm*50mm
[0723]
流速:0.2ml/min
[0724]
柱温:60℃。
[0725]
检测:uv(260nm)
[0726]
实施例5
[0727]
合成的修饰寡核苷酸化合物的分子量
[0728]
将合成的修饰寡核苷酸化合物示于以下表1。化合物的表述将各核苷酸以3个字母表示。其中,3’末端的核苷酸没有核苷间键,因此以2个字母表示。
[0729]
1)第1个字母以大写表示,表示下述核酸碱基:
[0730]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、u=尿嘧啶、m=5
‑
甲基胞嘧啶,
[0731]
2)第2个字母表示下述各糖部分:
[0732]
l=lna、g=guna、m=alna[ms]、u=alna[mu]、p=alna[ipu]、t=alna[trz]、e=2
’‑
moe、o=2
’‑
ome、d=2
’‑
脱氧核糖,
[0733]
3)第3个字母表示下述核苷间键:
[0734]
s=硫代磷酸酯、p=磷酸二酯。
[0735]
作为靶位置,示出修饰寡核苷酸的dux4成熟mrna的5’靶部位(对应于修饰寡核苷酸的3’末端的序列表的序列号1的位置)。
[0736]
[表1
‑
1]
[0737][0738]
[表1
‑
2]
[0739]
(续表1)
[0740][0741]
[表1
‑
3]
[0742]
(续表1)
[0743][0744]
[表1
‑
4]
[0745]
(续表1)
[0746][0747]
[表1
‑
5]
[0748]
(续表1)
[0749][0750]
[表1
‑
6]
[0751]
(续表1)
[0752][0753]
实施例6
[0754]
体外dux4敲减活性试验(脂质转染法)
[0755]
在混合有dux4修饰寡核苷酸和脂质转染胺rnai试剂的转染试剂上,以1.25
×
104cells/cm2接种c2c12细胞,在co2孵育箱培养一晩。第二天,使用脂质转染胺2000试剂,将使dux4序列克隆在psicheck
‑
2 vector(promega)的多克隆位点的报告质粒对细胞转染,在co2孵育箱培养24小时左右。然后,使用dual
‑
glo luciferase assay system,以酶标仪检
测细胞内的萤火虫荧光素酶和海肾萤光素酶发光值。为了由海肾荧光酶活性所产生的发光值校正转染效率、细胞数的影响,算出与萤火虫荧光酶活性所产生的发光值的比。由添加修饰寡核苷酸时的海肾/荧光虫的减少率,以100分率算出抑制率,由50%前后2点的浓度和此时的抑制率算出ic
50
值(表2)。与dux4成熟mrna的第232~248位、1306~1325位或1472~1495位所互补的化合物(化合物编号1~132)相比,可知化合物编号133(与序列表的序列号1的第214~227位互补)、134(与序列表的序列号1的第1323~1336位互补)、135(与序列表的序列号1的第1458~1471位互补)、136(与序列表的序列号1的第1495~1508位互补)的抑制率明显弱。
[0756]
实施例7
[0757]
体外dux4敲减活性试验(gymnosis法)
[0758]
在dux4修饰寡核苷酸溶液中,以6
×
103cells/cm2接种c2c12细胞,在co2孵育箱培养2晩。2天后,从细胞除去含有dux4修饰寡核苷酸溶液的培养基,用新的培养基进行清洗。然后,使用脂质转染胺2000试剂,将使dux4序列克隆于psicheck
‑
2vector(promega)的多克隆位点的报告质粒对细胞转染,在co2孵育箱培养24小时左右。然后,使用dual
‑
glo luciferase assay system,以酶标仪检测细胞内的萤火虫荧光素酶和海肾萤光素酶发光值。为了由海肾荧光酶活性所产生的发光值来校正转染效率、细胞数的影响,算出与萤火虫荧光酶活性所产生的发光值的比。由添加修饰寡核苷酸时的海肾/萤火虫的减少率,以100分率算出抑制率,由50%前后2点的浓度和此时的抑制率算出ic
50
值。将结果示于下述表2。与包含与dux4成熟mrna的第232~248位、1306~1325位或1472~1495位的区域内的等长部分互补的核酸碱基序列的化合物(化合物编号1~132)相比,可知化合物编号133(与序列表的序列号1的第214~227位互补)、134(与序列表的序列号1的第1323~1336位互补)、135(与序列表的序列号1的第1458~1471位互补)、136(与序列表的序列号1的第1495~1508位互补)的抑制率明显弱。
[0759]
[表2
‑
1]
[0760][0761]
[表2
‑
2]
[0762]
(续表2)
[0763]
350.0090.105360.0060.390370.0030.133
380.0050.125390.0060.143400.0020.051410.0070.184420.0080.166430.0080.148440.0090.174450.0230.699460.0030.109470.0050.181480.0050.166490.0090.261500.0030.206510.0050.419520.0060.414530.0160.164540.0100.402550.0060.05256<0.030.577570.0120.435580.0020.058590.0020.052600.0050.100610.0020.048620.0030.038630.0040.090640.0190.426650.0020.128660.0020.066670.0030.188680.0130.850690.0020.083700.0050.111
[0764]
[表2
‑
3]
[0765]
(续表2)
[0766]
710.0020.037720.0020.072730.0050.292740.0020.079
750.0050.237760.0030.073770.0040.091780.0100.132790.0100.099800.0090.373810.0030.115820.0110.529830.0030.113840.0070.207850.0170.400860.0050.106870.0050.097880.0070.154890.0190.434900.0080.077910.0090.148920.0150.763930.0070.13594<0.030.793950.0210.496960.0360.306970.0090.546980.0100.363990.0080.6241000.0140.6691010.0290.4431020.0140.6571030.0110.3071040.0070.2551050.0050.1221060.0060.291
[0767]
[表2
‑
4]
[0768]
(续表2)
[0769]
1070.0040.3211080.0760.8771090.0750.7301100.0200.2661110.0170.223
1120.0500.6161130.0160.5691140.0130.2591150.0110.5311160.0030.1121170.0030.0921180.0150.4611190.0040.4671200.0040.4561210.0080.2391220.0060.2891230.0130.1541240.0030.3381250.0100.2721260.0040.1591270.0030.0931280.0060.2561290.0080.0881300.0030.0791310.0050.2451320.0060.294133>0.3>3134>0.3>31350.140>3136>0.3>3
[0770]
实施例8
[0771]
修饰寡核苷酸化合物的合成和体外dux4敲减活性试验(gymnosis法)
[0772]
表3示出新合成的修饰寡核苷酸化合物和对该化合物的与实施例7同样地进行的体外dux4敲减活性试验的结果。
[0773]
应予说明,表3中的化合物的表述将各核苷酸以3个字母表示。其中,3’末端的核苷酸没有核苷间键,因此以2个字母表示。
[0774]
1)第1个字母以大写表示,表示下述核酸碱基:
[0775]
a=腺嘌呤、t=胸腺嘧啶、g=鸟嘌呤、c=胞嘧啶、u=尿嘧啶、m=5
‑
甲基胞嘧啶,
[0776]
2)第2个字母表示下述各糖部分:
[0777]
l=lna、m=alna[ms]、e=2
’‑
moe、o=2
’‑
ome、d=2
’‑
脱氧核糖,
[0778]
3)第3个字母表示下述核苷间键:
[0779]
s=硫代磷酸酯、p=磷酸二酯。
[0780]
作为靶位置,示出修饰寡核苷酸的dux4成熟mrna的5’靶部位(对应于修饰寡核苷酸的3’末端的序列表的序列号1的位置)。
[0781]
与包含与dux4成熟mrna的第126~147位、232~248位、1306~1325位或1472~1495位的区域内的等长部分互补的核酸碱基序列的化合物(化合物编号137~247)相比,可知化合物编号248(与序列表的序列号1的第112~127位互补)、249(与序列表的序列号1的第162~177位互补)、250(与序列表的序列号1的第264~279位互补)、251(与序列表的序列号1的第1273~1288位互补)的抑制率明显弱。
[0782]
[表3]
[0783]
[表3
‑
1]
[0784][0785]
续表3
[0786]
[表3
‑
2]
[0787][0788]
实施例9
[0789]
体内dux4敲减活性试验
[0790]
制作编入有序列表的序列号1的dux4成熟mrna的腺伴随病毒载体aav
‑
dux4(signagen laboratories,cat.#sl100862)。在异氟醚(pfizer株式会社)麻醉下,对8周龄的c57bl/6j小鼠(雄性、日本charlesriver)的胫骨前肌以1e 10vg/50μl肌肉内给药aav
‑
dux4。3天后,以成为1、3、10和50mg/5ml/kg的方式利用生理盐水制备以dux4为靶的修饰寡核苷酸,对8周龄的c57bl/6j小鼠(雄性、日本charlesriver)进行尾静脉内给药。72小时后
在颈椎脱臼或异氟醚(pfizer株式会社)麻醉下,从腹部大静脉进行全采血,并使其致死。致死后,采取胫骨前肌,浸渍在rnalater soln.(invitrogen)中后,在
‑
80℃冷冻。对组织加入maxwell rsc simplyrna tissue kit(promega)的均质化缓冲液,使用多珠振荡器进行破碎,依照试剂盒记载的方案将rna纯化。将rna 400ng逆转录,使用所得到的cdna进行定量pcr。修饰寡核苷酸的敲减活性是以相对于载体(vehicle)组的相对值来表示相对于dux4的18s rrna的量比。将1、3、10和50mg/5ml/kg时的结果示于图1~4。化合物编号1(与dux4成熟mrna的第233位~248位互补的序列)、化合物编号2(与dux4成熟mrna的第1309位~1323位互补的序列)、化合物编号3(与dux4成熟mrna的第1480位~1495位互补的序列)、化合物编号13(与dux4成熟mrna的第234位~247位互补的序列)、化合物编号41(与dux4成熟mrna的第1308位~1323位互补的序列)、化合物编号54(与dux4成熟mrna的第1309位~1323位互补的序列)、化合物编号57(与dux4成熟mrna的第1309位~1323位互补的序列)、化合物编号68(与dux4成熟mrna的第1309位~1323位互补的序列)、化合物编号78(与dux4成熟mrna的第1309位~1324位互补的序列)、化合物编号88(与dux4成熟mrna的第1310位~1323位互补的序列)、化合物编号104(与dux4成熟mrna的第1473位~1488位互补的序列)、化合物编号122(与dux4成熟mrna的第1480位~1495位互补的序列)即使对生物体给药,也能够抑制肌肉内的dux4基因表达。
[0791]
实施例10
[0792]
修饰寡核苷酸的安全性
[0793]
以最大100mg/kg的给药量将化合物编号3、42、123对6周龄的icr小鼠(雄性,日本charlesriver)进行静脉内给药,结果未观察到肝毒性(血液中的alt、ast的上升和病理组织学上的异常发现)、肾毒性(血液中的un、肌酸酐的上升和病理组织学上的异常发现)、一般症状变化、死亡等现象。
[0794]
实施例11
[0795]
体内tg小鼠dux4敲减活性试验
[0796]
使用9周龄的雄性flexdux4
‑
heteto/hsa
‑
mcm
‑
hetero:tg(dux4
‑
tg)和flexdux4
‑
wild/hsa
‑
mcm
‑
hetero:tg(mcm,control)(雄性,由the jackson laboratory对日本charlesriver株式会社导入)。以各用量的给药液成为5ml/kg的方式利用生理盐水制备以dux4为靶的修饰寡核苷酸,每周1次进行尾静脉内给药。在4周给药结束1周后,在异氟醚深度麻醉下从腹部大静脉进行全采血,并使其安乐死。以edta分离血浆,进行肌酸激酶(ck)测定。采取下肢的肌肉,测定湿重量,进行基因表达解析。
[0797]
如图5和图6所示,化合物编号3和化合物编号123抑制了dux4的mrna表达。另外,降低了作为肌肉障碍标志物的ck的血中水平。另一方面,化合物编号113和化合物编号247未确认到明确的对dux4mrna表达和血中ck水平的作用。
[0798]
实施例12
[0799]
小鼠连续给药毒性试验
[0800]
使用生理盐水,以成为100mg/5ml/kg的方式制备以dux4为靶的修饰寡核苷酸,对6周龄的icr小鼠(雄性,日本charlesriver)连续4天进行尾静脉内给药。在最终给药72小时后,在异氟醚麻醉下从后大静脉进行采血,实施临床生化检査。另外,在放血致死后进行剖检,实施肝脏和肾脏的病理组织学检査。在化合物编号123中,在给药后没有确认到死亡和
一般状态、摄食量和体重的变化,没有观察到肝毒性(血清中的alt、ast的上升和病理组织学上的异常发现)、肾毒性(血清中的un、肌酸酐的上升和病理组织学上的异常发现)。另一方面,对于化合物编号113和化合物编号247,虽然在给药后没有确认到死亡和一般状态、摄食量和体重的变化,但均确认到到明确的肝毒性(血清中的alt、ast、gldh、alp、胆红素、胆汁酸的上升、病理组织学上的异常发现:肝细胞的变性坏死、肝细胞肥大)和肾毒性(血清中的肌酸酐的上升)。另外,该试验条件下的化合物编号123的肝脏和肾脏中浓度分别为323和251μg/g,与化合物编号247的肝脏和肾脏中浓度111和185μg/g、化合物编号113的肝脏和肾脏中浓度39.3和235μg/g相比,尽管是同等以上的组织中浓度,但没有确认到肝和肾毒性。
[0801]
[表4]
[0802]
表4.小鼠连续给药试验血液生化检查
[0803]
检查项目对照组化合物编号123对照组化合物编号247化合物编号113ast(u/l)53.860.238.01187.01355.8alt(u/l)30.438.617.62300.21282.8gldh(u/l)16.036.07.0813.2768.8alp(u/l)340.2345.2204.21063.8640.6t
‑
bil(mg/dl)0.0860.0520.1061.2080.298d
‑
bil(mg/dl)0.0240.0120.0441.0860.238i
‑
bil(mg/dl)0.0620.0400.0620.1220.060tba(μmol/l)0.801.600.9028.0263.32un(mg/dl)20.3418.6218.3223.0223.20cre(mg/dl)0.0560.0540.0620.1260.152
[0804]
[表5]
[0805]
表5.小鼠连续给药试验病理发现
[0806]
病理发现对照组化合物编号123对照组化合物编号247化合物编号113肝细胞的变性坏死0/50/50/53/54/5肝细胞肥大0/50/50/54/55/5
[0807]
参考例
[0808]
将含有alna[ms]的核苷酸、含有alna[mu]的核苷酸、含有alna[ipu]的核苷酸、含有alna[trz]的核苷酸、含有alna[oxz]的核苷酸的合成法的路线示于以下。应予说明,起始化合物1a、1d、1g可通过国际公开第2017/047816号中记载的方法来合成。
[0809]
alna[ms]
‑
t的合成
[0810][0811]
alna[ms]
‑
mc的合成
[0812][0813]
alna[ms]
‑
g的合成
[0814][0815]
alna[ms]
‑
a的合成
[0816][0817]
alna[mu]
‑
t的合成
[0818][0819]
alna[mu]
‑
mc的合成
[0820][0821]
alna[mu]
‑
g的合成
[0822][0823]
alna[mu]
‑
a的合成
[0824][0825]
alna[ipu]
‑
t的合成
[0826][0827]
alna[ipu]
‑
mc的合成
[0828][0829]
alna[ipu]
‑
g的合成
[0830][0831]
alna[ipu]
‑
a的合成
[0832][0833]
alna[trz]
‑
t的合成
[0834][0835]
alna[trz]
‑
mc的合成
[0836][0837]
alna[trz]
‑
g的合成
[0838][0839]
alna[trz]
‑
a的合成
[0840][0841]
alna[oxz]
‑
t的合成
[0842][0843]
alna[oxz]
‑
mc的合成
[0844][0845]
产业上的可利用性
[0846]
本发明的修饰寡核苷酸能够用作对dux4相关疾病的治疗、预防或延迟其进展有用的化合物。
[0847]
[序列表自由文本]
[0848]
序列表的序列号1表示dux4成熟mrna的碱基序列。
[0849]
序列表的序列号2~4和7~112表示修饰寡核苷酸的碱基序列。
[0850]
序列表的序列号5~6表示作为序列号1的剪接变体的dux4
‑
fl2和dux4
‑
s各自的碱基序列。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。