用于生物剂治疗或载体化基因治疗中的左心室去负荷的系统和方法
相关申请的交叉引用
1.本技术要求于2019年3月29日提交的美国临时申请号62/826,444和2020年1月10日提交的美国临时申请号62/959,333的优先权,两者均通过引用并入本文。
背景技术:
2.心血管疾病是全世界发病、死亡和保健负担的主要原因。已经为心血管疾病开发了多种治疗方式,范围从药物到机械装置和最终移植。临时心脏支持装置,如心室辅助装置,提供血液动力学支持和促进心脏恢复。一些心室辅助装置被经皮插入到心脏中,并可以与天然心脏平行运作以补充心输出量,如装置家族(abiomed,inc.,danvers ma)。
3.通过将基因转移到靶标进行的遗传操纵可用于治疗细胞或器官,如心脏。见例如julie a.wolfram,phd等人,gene therapy to treat cardiovascular disease,jahavol 2,issue 4(2013)(“wolfram”),其整体通过引用并入本文。基因治疗方法包括使用一种或多种基因治疗载体,病毒的或非病毒的。对于病毒载体,可以对病毒的基因组进行编程,并将病毒作为基因治疗载体注射到患者体内,其中预期病毒基因组将在患者体内表达。病毒载体的至少一个实例包括腺相关病毒(aav)。载体的给予可以通过在不同位置注射或灌注来完成。例如,冠状动脉灌注可用于递送载体基因组全局地跨越心肌。总体上需要高基因表达以实现治疗效果。在冠状动脉中给予病毒载体的至少一个缺点是该技术的相对低效,因为载体基因组被心脏迅速递送到体循环中。由于心脏泵送,载体基因组通过心脏的清除速率可过高而不能实现期望的基因表达。病毒相对快速地穿过心脏,其中相对极少时间附着到心肌并转导足够的心肌。对心脏给予生物剂治疗会出现同样的问题。使心脏停歇以降低载体基因组或生物剂的清除速率并增加在心脏中的停留的技术导致心脏不稳定和/或缺血。
4.因此,期望有能够降低载体基因组或生物剂在心脏中的清除速率而不具有与使心脏停止或减慢相关的不利方面的系统和方法。
技术实现要素:
5.本文所述的方法、系统和装置能够通过以下将生物剂治疗如但不限于基因治疗载体有效地递送到心肌:(i)暂时阻断至心肌的血流,以增加心肌中的生物剂治疗(例如基因治疗载体)摄取和减少生物剂治疗(例如基因治疗载体)通过心脏的清除,(ii)与注射生物剂治疗(例如载体基因治疗)同时,在心脏中操作机械循环支持装置,以维持心脏功能和体循环,而没有对患者的不利影响。这些方法、系统和装置的至少一个优点是能够增加生物剂治疗(例如基因治疗载体)在心肌内的沉积。通过在至少一个冠状动脉(即围绕和供应心脏的动脉和血管)中部署血管成形术球囊以暂时停止血流,和在所部署的球囊远侧注射诸如基因治疗载体病毒的生物剂治疗,使病毒介质在冠状动脉中积聚,为诸如病毒载体的治疗
提供显著更多的时间以转导心肌。在注射生物剂治疗时操作机械循环支持装置维持了生命所需的心输出量并且使患者免受膨胀的血管成形术球囊导致的潜在缺血事件——机械循环支持装置充当临时心脏旁路。机械支持装置可以是血泵,如impella装置。在一些实施方式中,生物剂治疗如基因治疗载体可以靶向特定心脏组织,如成纤维细胞或内皮细胞。在一些实施方式中,可以采用一种或多种基因治疗载体来优先靶向肌细胞、成纤维细胞、内皮细胞或其他靶标组织。
6.在第一示例性实施方式中,治疗心脏的方法包括操作机械循环支持装置以支持心脏。在一些实施方式中,机械循环支持装置在患者体外操作,并且在其他实施方式中,机械循环支持装置被插入患者。方法进一步包括操作机械循环支持装置以支持时段,并在支持时段期间向心脏给予生物剂治疗,如基因治疗载体。在一个实例中,基因治疗载体在心脏的血管内被给予。在另一实例中,方法进一步包括将血管成形术球囊插入血管中和使球囊膨胀以暂时封堵血管。在一个实例中,基因治疗载体在血管成形术球囊远侧的位置处被给予至心脏。例如,基因治疗载体在膨胀球囊下游的冠状动脉内被给予。在一些实例中,基因治疗载体可以经几个时段的过程被给予。例如,在第一给予时段期间向心脏给予第一剂的基因治疗载体,然后在第二给予时段期间向心脏给予第二剂的基因治疗载体,其中两个给予时段间隔休息时段。在一个实例中,休息时段长于第一给予时段。在一个实例中,膨胀的血管成形术球囊暂时封堵血管以少于约三分钟,优选地一分钟。在一个实例中,支持时段——在此期间使用机械循环支持装置,例如微型轴向跨瓣泵(microaxial transvalvular pump)——长于10分钟。支持装置在不同的给予时段和休息时段期间运行。在一个实例中,向心脏给予基因治疗载体被配置以增加载体dna在心脏组织中的表达。基因治疗载体可以被靶向心脏内的组织,包括心肌、成纤维细胞、内皮细胞、或其他心脏组织。
7.在第二示例性实施方式中,支持患者心脏的方法包括将血泵经皮插入到心脏中和将血泵横跨心脏的主动脉瓣定位。方法进一步包括操作血泵以使心脏的左心室去负荷(unload),且同时操作血泵和将基因治疗载体注射到以本文所述方式封堵的心脏的冠状动脉中。
8.在第三示例性实施方式中,上调患者心肌中的基因表达的方法包括将球囊置于患者的冠状动脉中,和使球囊膨胀以第一时段以在第一时段期间暂时阻断冠状动脉内的血流。方法进一步包括将血泵布置到患者的心脏中,和在第二时段期间操作患者心脏中的血泵之前将泵横跨心脏的主动脉瓣定位。方法包括在第一时段期间在冠状动脉内在膨胀球囊远侧位置处注射基因治疗载体,和在第一时段后使球囊瘪缩以恢复冠状动脉内的血流。在此示例性实施方式中,第一时段发生在第二时段期间,并且第一时段具有不导致心肌细胞中永久性局部缺血的持续时间。在一个实例中,方法包括在第二时段期间在冠状动脉内在膨胀球囊远侧位置处注射生物剂治疗,如基因治疗载体。在另一个实例中,方法包括在少于或等于第二时段的第三时段期间,在冠状动脉内在膨胀球囊远侧位置处注射基因治疗载体。第一时段的持续时间可以少于三分钟,优选地少于一分钟。
9.在第四示例性实施方式中,支持患者心脏的方法包括在心脏内给予生物剂治疗如基因治疗载体。方法进一步包括降低生物剂治疗如基因治疗载体通过心脏的清除速率。在生物剂治疗是基因治疗载体的那些实施方式中,降低的清除速率导致基因治疗载体在心脏中表达,导致用基因治疗载体转导心脏,或这些的任何组合。在一个实例中,方法将机械循
环支持装置和球囊导管部署到心脏。
10.在第五示例性实施方式中,用于支持已经经历心源性休克或心肌梗塞的患者心脏的心脏保护系统部署机械循环支持装置和球囊导管,该机械循环支持装置被配置以被在患者体内插入和操作,该球囊导管具有带有近端和远端的可膨胀球囊。球囊导管包括与球囊的近端流体连接的膨胀导管,并且球囊被配置以被插入患者的冠状动脉中以与机械循环支持装置同时使用。系统进一步部署递送导管以在体内递送基因载体治疗,该递送导管具有带有入口开口的近端,该入口开口被配置以接收含有基因治疗载体的溶液;带有出口开口的远端;以及在递送导管的近端和远端之间延伸的管。球囊被配置以在膨胀时封堵至少部分地通过冠状动脉的血流。在一个实例中,机械循环支持装置是基于导管的血管内血泵。在另一个实例中,出口开口被配置以在球囊膨胀时被定位在球囊远端的远侧。在再另一实例中,在递送导管的近端和远端之间延伸的管具有比球囊更长的纵向长度。在另一个实例中,球囊导管被配置使得在球囊膨胀后,球囊导管出口开口不被球囊阻碍。在给予基因治疗载体的那些实施方式中,载体可以包括编码在体内表达时具有心脏保护功能的肽的非天然核酸材料,基因治疗载体被配置以被心肌细胞吸收。
11.在第六示例性实施方式中,治疗心脏的方法包括操作机械循环支持装置以支持心脏。方法进一步包括操作机械循环支持装置以支持时段,封堵至少一个心脏血管和对封堵的心脏血管给予生物剂治疗。生物剂治疗可被设置以优先靶向肌细胞、成纤维细胞、内皮细胞或其他靶标组织。
附图说明
12.结合附图考虑以下详细描述后,上述和其他目标和优点将变得显而易见,其中同样的附图标记始终指代同样的部分,并且其中:
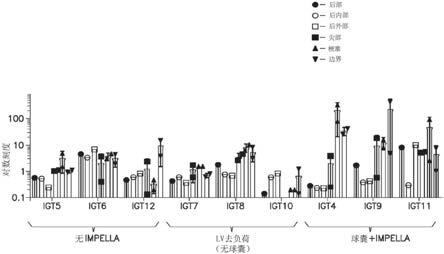
13.图1示例了已经经历利用病毒基因治疗载体进行的生物剂治疗的三组猪的不同心脏组织中的基因表达水平,(i)不具有impella支持(猪igt5、igt6、igt12),(ii)具有impella支持但不具有血管成形术球囊(猪igt7、igt8、igt10),和(iii)具有impella支持与血管成形术球囊的组合(猪igt4、igt9、igt11);
14.图2示例了图1的三组猪的左心房组织中的基因表达水平——该猪已经经历利用病毒基因治疗载体进行的生物剂治疗,(i)不具有impella支持(猪igt5、igt6、igt12),(ii)具有impella支持但不具有血管成形术球囊(猪igt7、igt8、igt10),和(iii)具有impella支持与血管成形术球囊的组合(猪igt4、igt9、igt11);
15.图3示例了图1的三组猪的肝组织中的基因表达水平——该猪已经经历利用病毒基因治疗载体进行的生物剂治疗,(i)不具有impella支持(猪igt5、igt6、igt12),(ii)具有impella支持但不具有血管成形术球囊(猪igt7、igt8、igt10),和(iii)具有impella支持与血管成形术球囊的组合(猪igt4、igt9、igt11);
16.图4示例了已经经历在具有impella支持和血管成形术球囊的情况下利用病毒基因治疗载体进行的生物剂治疗的一头猪(猪igt11)的载体基因组表达,利用pcr来计数载体基因组和猪基因组;
17.图5示例了已经经历在具有impella支持和血管成形术球囊的情况下利用病毒基因治疗载体进行的生物剂治疗的一头猪(猪igt11)的载体基因组表达,假设每个猪细胞中
一定重量的dna;以及
18.图6示例了不同组织样本的、已经经历在具有impella支持和血管成形术球囊的情况下利用基因治疗载体的生物剂治疗的一头猪(猪igt11)的荧光素酶活性和载体基因组表达之间的相关性。
具体实施方式
19.为了提供对本文所述系统和方法的整体理解,将描述某些示例性实施方式。尽管本文描述的实施方式和特征被具体描述为与循环和再灌注治疗系统结合使用,但是将理解,下面概述的所有部件和其他特征可以以任何合适的方式彼此组合并且可以被设置和应用于其他类型的循环治疗和再灌注治疗装置。
20.如上所述,在一个实施方式中,将基因治疗载体引入被机械支持的心脏的封堵血管中。图1
‑
6示例了在对猪进行的基因治疗载体研究中获得的结果。对于第一对照组猪。研究中的猪被编号——猪5被称为igt5,猪6被称为igt6,等等。考虑了三组猪。在第一对照组猪(“第1组”)中,将带有荧光素酶(产生生物发光的酶)的腺相关病毒6型载体(aav6)注射到冠状动脉中——未使用血管成形术球囊或机械循环系统装置。在第二组猪(“第2组”)中,用机械循环系统装置(impella泵)使左心室去负荷,同时将基因治疗载体注射到冠状动脉中——未使用血管成形术球囊。在第三组猪(“第3组”)中,在冠状动脉中部署血管成形术球囊,将基因治疗载体注射到球囊远侧的冠状动脉中,以及与注射同时地使用机械循环系统装置(impella泵)。作为研究方案的一部分,分阶段进行基因治疗载体注射——其中第一注射阶段后接无注射时段,然后第二注射阶段后接无注射时段,最后是第三注射阶段后接无注射时段。
21.图1示例了在三组猪的猪研究期间获得的结果。y轴测量组织活检中的荧光素酶水平,其中荧光素酶水平与肌细胞中表达的多个基因相关。如果荧光素酶被表达,则测定发光,并且发光强度与组织中的载体基因组表达量相关。y轴采用对数标度,其中值为1表示标准基因组表达。各种数据点(后部、后内部(post endo)、后外部(post epi)、尖部、梗塞、边界)对应于其中进行活检的心肌不同区域。如图1中所示,与第1组(无impella)和第2组(impella但无球囊)相比,第3组(球囊且impella)中的猪显示载体基因组表达水平对数高于第1组或第2组的载体基因组表达水平。同时使用血管成形术球囊和机械循环支持装置的至少一个优点是能够延长基因治疗载体介质在心肌中积聚的时间,同时维持心脏稳定性。血管成形术球囊的部署是相对短的,例如少于一(1)分钟——冠状动脉的封堵可能导致一定的心肌顿抑(短暂时间的组织局部缺血),但心肌顿抑的影响是可逆的。
22.图2以类似于图1的形式示例了载体基因组表达水平,但是是左心房组织活检的。如图2中所示,在第3组中,一头猪——猪11(igt11)——的荧光素酶活性增加了3000倍,表明基因表达水平极高。
23.图3以类似于图1的形式示例了载体基因组表达水平,但是是肝组织活检的。当采用部署病毒载体的生物剂治疗时,最小化病毒在靶标器官外的存在是可期望的。优选地,患者体循环中的病毒水平应该是低的。意图清除体循环的器官如肝脏表明病毒在到达肝脏之前从系统(system)中排除的程度。如图3中所示,对于第3组猪,肝脏中的表达水平低于预期表达值1。这表明大部分载体病毒在注射位点附近被输出——即进入心肌,其中仅期望地少
量的载体病毒到达肝脏。
24.图4示例了相同猪研究的猪11的载体基因组表达水平,但形式不同于图1
‑
3。图4显示了利用pcr测试——聚合酶链反应测试——的部署基因治疗载体的生物剂治疗的结果。利用pcr的猪11(第3组的一部分:使用impella和血管成形术球囊)的部署基因治疗载体的治疗结果与图1
‑
3中所示的结果一致:猪11(和第3组的猪)呈现某些心脏组织中的载体基因表达水平显著高于其系统其余部分。在左手侧图中,y
‑
轴测量经由pcr得到的基因表达,并且x
‑
轴对应于来自不同组织区域的不同活检。心脏对应的组织区域(尖部、梗塞、边界、后外部、后内部、中隔、基前部(base
‑
ante)、基侧部(base
‑
lat)、基后部(base
‑
post)、基中隔部、冠状动脉和左心房)的pcr水平远高于与其他组织区域(rv、ra、肝、skm、肺、肾皮质、脾、脑、cm、非cm)。这确认了绝大多数基因治疗载体在心脏组织中被表达,并且其他器官具有非常低的表达。类似地,在右手侧图中,猪11的通过猪基因组标准化的载体基因组的比例在冠状动脉和左心房组织活检中(igt11)显著高于在任何其他组织活检(脑、cm、肾、肝、肺、非cm、rv、ski、脾)中。
25.图5显示了用于猪研究的基因治疗载体表达的另一个指标。假设有6pgdna/猪细胞,将治疗载体基因组通过猪细胞中的dna量而标准化。同样,治疗载体基因组与猪基因组的比例在左心房和冠状动脉组织活检中是最高的,表明左心房和冠状动脉是基因治疗载体最有效的位置。
26.图6示例了图1
‑
3(荧光素酶)和图4
‑
5(pcr)中考虑的两种类型的基因治疗载体指标之间的相关性。图6在y
‑
轴上绘制荧光素酶活性,且在x
‑
轴上绘制载体基因组/猪基因组的比例。图6确认,荧光素酶活性与病毒基因组(vg)表达直接相关。载体基因组与猪基因组的比例越高,荧光素酶(luc)活性越高。
27.上文关于基因治疗载体描述的相同技术可用于增加其他生物剂的摄取,包括干细胞、rna、mrna、反义寡核苷酸治疗、多肽、或用于心脏中摄取的任何其他生物剂。例如,方法可以与干扰心脏中的基因产生的寡核苷酸或与具有类似功能的任何其他分子联用。在另一个实例中,可以将靶向管控或抑制心脏组织的炎性响应的生物剂可被注射到心脏中,如前蛋白转化酶枯草杆菌蛋白酶kexin 9型(pcsk9)、肿瘤坏死因子(tnf)抑制剂、或rna干扰生物剂。通过向心肌或任何其他靶标组织类型如成纤维细胞或内皮细胞进行冠状动脉内注射各种生物剂,可以改善心脏病和心脏症状的治疗。生物剂治疗可被设置以优先地靶向肌细胞、成纤维细胞、内皮细胞或其他靶标组织。
28.生物剂治疗在心脏中的血管内被给予,并且可以与在血管中使用血管成形术球囊以暂时封堵血管结合给予。生物剂治疗可以在心脏中在血管成形术球囊远侧的位置处被给予,例如在冠状动脉中在血管成形术球囊远侧。在一些实例中,生物剂治疗经几个时段的过程被给予,穿插有休息时段,在休息时段期间不给予生物剂治疗。休息时段可以长于生物剂治疗的给予时段。
29.按照心脏症状指示,生物剂可以彼此组合或与基因载体治疗组合而被注射到心脏中。为了向心肌或任何其他被靶向组织类型如成纤维细胞或内皮细胞递送任何生物剂,血管内的血流被暂时阻断,以增加生物剂在心脏组织中的摄取和减少生物剂通过心脏的清除,同时在心脏中操作机械循环支持装置以维持心脏功能和体循环,而没有对患者的不利影响。通过在生物剂给予期间阻断血流,生物剂有更多时间与心脏组织接触以转导期望的
组织目标。
30.在本说明书中,词语“包含”应以其“开放”意义理解,即“包括”的意义,且因此不限于其“封闭”意义,即“仅由
……
组成”的意义。对应的含义应归结于出现时的对应词语“包含”(“comprise”、“comprised”、和“comprises”)。
31.虽然已经描述了本技术的具体实施方式,但是对于本领域技术人员来说显而易见的是,本技术可以在不脱离其本质特征的情况下以其他具体形式实施。因此,当前实施方式和实例在所有方面都被认为是示例性的而非限制性的。例如,虽然本公开已经描述了诸如基于手/臂的手势和翻转的移动的检测,但相同的原理适用于其他大规模运动,如用户在床上躺姿和坐姿之间移动(反之亦然),到达特定目标(台灯、或呼吸设备)等。
32.进一步将理解,除非出现相反的指示,本文对本领域已知主题的任何提及不构成对这种主题属于本技术相关领域的技术人员公知的承认。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。