产气荚膜梭菌
β
1毒素抗体的间接elisa方法
技术领域
1.本发明属于病原微生物检测技术领域,具体是指一种产气荚膜梭菌β1毒素抗体间接elisa检测方法。
背景技术:
2.产气荚膜梭菌(c.perfringens)又称魏氏梭菌(c.welchii),是一种正常情况下人和动物胃肠道中寄生的条件致病菌。产气荚膜梭菌根据其分泌的四种主要外毒素(α、β、ε、ι)分为a、b、c、d、e五个亚型。
3.产气荚膜梭菌(clostridium perfringens)是重要的人畜共患致病菌,可引起人和多种动物的肠毒血症、气性坏疽、坏死性肠炎甚至死亡,该病发病凶险,感染病畜在短时期内迅速发病,若不能及时诊断和治疗,常常会引起休克乃至死亡,患病的幼畜即使存活,也往往由于生长状况不佳被淘汰,严重影响牛羊养殖业健康发展。β1毒素由b型和c型产气荚膜梭菌产生,可导致人和动物致死性的出血性黏膜溃疡和小肠黏膜坏疽甚至是肠毒血症,b型和c型产气荚膜梭菌是家畜中常见的致病株型。该毒素是经典的β型成孔蛋白,可破坏细胞内外的离子平衡,并诱导机体产生il
‑
1β等炎性因子。
4.目前,对该毒素的检测尚缺乏相关的检测产品,临床上亟需一种操作方便,敏感性高,特异性好,稳定可靠的方法进行养殖场动物中产气荚膜梭菌的流行病学调查和抗体水平的检测,因此,建立一种针对产气荚膜梭β1毒素单克隆抗体的间接elisa检测方法非常有必要。
技术实现要素:
5.针对上述情况,为克服现有技术的缺陷,本发明提供了一种动物血清中产气荚膜梭菌β1毒素抗体的水平的检测方法和材料,适用于产气荚膜梭菌β1 毒素所引起的临床血清流行病学调查和疫苗免疫效果评价,具体是一种特异性强、灵敏度高、稳定性良好、可快速检测产气荚膜梭菌β1毒素抗体间接 elisa检测方法。
6.本发明采取的技术方案如下:本发明一种产气荚膜梭菌β1毒素抗体间接 elisa检测方法,包括以下步骤:
7.步骤一、产气荚膜梭菌β1毒素抗体的间接elisa方法的建立:
8.(1)以包被液稀释包被抗原至10μg/ml,96孔酶标板中以100μl/孔进行包被,4℃过夜,所述包被抗原为可溶性重组产气荚膜梭菌β1毒素蛋白;
9.该步骤中所使用的抗原为重组产气荚膜梭菌β1毒素蛋白,其制备方法包括以下步骤:
10.s1:取重组表达菌株bl21(de3)ptig
‑
cpb1甘油冻存菌株,在含100μg/ ml氨苄青霉素的lb固体平板上划线,次日挑取单菌落接入10ml含100μg/ ml氨苄青霉素的lb液体培养基中培养至菌液od
600
达1.0以上;
11.s2:再以1%的接种量接种于200ml含100μg/ml氨苄青霉素的lb液体培养基中培养
3小时,之后加入0.5mm iptg在20℃条件下诱导表达16 h,离心收获菌体;
12.(2)pbst溶液洗板3次,每次5分钟,加入封闭液,以200μl/孔进行封闭,37℃保温2小时;
13.所述pbst溶液为1l的pbs溶液中加入2
‰
tween
‑
20混匀制得;
14.所述步骤(2)中封闭液为5%脱脂奶粉,所述5%脱脂奶粉的制备方法为称取脱脂奶粉5g,,加pbs溶液定容至100ml;
15.(3)pbst溶液洗板3次,每次5分钟,加入待检血清样品,以阳性对照为产气荚膜梭菌β1毒素单克隆抗体1k19,阴性对照为产气荚膜梭菌β2毒素单克隆抗体,100μl/孔,37℃保温1小时;
16.所述阳性对照为产气荚膜梭菌β1毒素单克隆抗体1k19,其制备方法为:将冻存于液氮罐中的1k19杂交瘤细胞复苏,进行细胞传代培养,待细胞状态良好后按1:100的比例将细胞分传于75cm2的培养瓶中,并置于co2培养箱中直至细胞过度生长以富积抗体,约5天后,待培养液变黄色后,将细胞培养液转移到50ml的离心管中,室温下1500g离心10min,收集1k19培养上清,用0.22μm的滤器进行过滤除菌,采用akta纯化系统使用protein g纯化,获得mcab1k19;对纯化样品进行sds
‑
page、鉴定后并经bca定量后用加入甘油保存于﹣80℃冰箱中备用;
17.该步骤中所使用的阴性对照为β2毒素单克隆抗体。
18.(4)pbst溶液洗板3次,每次5分钟,阳性对照孔和阴性对照孔加入 hrp
‑
山羊抗小鼠igg为二抗,待测血清样品孔加入相应的hrp标记二抗, 100μl/孔,室温1小时;
19.所述步骤(4)中hrp
‑
山羊抗小鼠igg二抗为hrp
‑
山羊抗小鼠igg稀释 2000倍,所述hrp标记相应二抗为hrp标记的山羊抗待检动物igg二抗稀释 2000倍;
20.(5)pbst溶液洗板3次,每次5分钟,加入底物显色液100μl/孔,室温下避光10分钟,加入终止液h2so4溶液终止反应,测定od450nm数值检测吸光度值;
21.步骤二、结果判定标准的确定:
22.当样品od450nm值>x 3sd时,判定为阳性;od450nm值<x 2sd时,判定为阴性;介于二者之间时,判为可疑;
23.通过统计学分析,其中阴性对照总体平均值为0.086,标准差sd为0.028,故阳性临界值为0.17,阴性临界值为0.142。
24.进一步地,所述步骤(1)中包被液为0.85m碳酸盐缓冲液,ph值为 9.6,所述0.85m碳酸盐缓冲液的包被液制备方法为称取nahco
3 2.93g以及 na2co
3 1.59g,加蒸馏水定容至1l。
25.进一步地,所述步骤(3)中阳性对照为产气荚膜梭菌β1毒素单克隆抗体 1k19,以pbs稀释28倍(0.25μg/μl)。
26.进一步地,所述步骤(5)中底物显色液为5%邻苯二胺溶液,所述5%邻苯二胺溶液的制备方法包括称取opd(邻苯二胺)5mg,量取10ml底物缓冲液进行溶解,加入3%h2o20.15ml,现配现用,其中,所述底物缓冲液为柠檬酸缓冲液,ph值为5.0,所述柠檬酸缓冲液的制备方法包括称取柠檬酸 1.92g,na2hpo4称取2.84g,并加蒸馏水定容至100ml。
27.进一步地,所述步骤(5)中终止液为2mol/l的h2so4,所述终止液的制备方法包括量取蒸馏水178.3ml,逐滴加入浓度为98%的浓硫酸21.7ml。
28.进一步地,所述可溶性重组产气荚膜梭菌β1毒素蛋白的包被抗原表达菌株的构建方法为:根据文献报道的产气荚膜梭菌β1毒素基因序列,设计引物:
29.forward(5`
‑
3`)cggaattccatatggatataggcaaaactactactat
30.reverse(5`
‑
3`)gaatgcggccgcaatagctgttactttatg
31.从产气荚膜梭菌c型标准株中扩增cpb1基因,构建至ptig
‑
trx载体,转化至bl21(de3)菌株中,标记为bl21(de3)ptig
‑
cpb1。
32.进一步地,所述包被抗原为重组产气荚膜梭菌β1毒素蛋白,所述可溶性重组蛋白的制备方法包括以下步骤:
33.步骤a:离心收集800ml诱导后重组表达菌体,用pbs清洗一次,菌体沉淀加入20mm tris
‑
hcl(ph8.0)缓冲液重悬10ml,加入100μg/ml溶菌酶,1
‰
tritonx
‑
100,0.01mm pmsf,超声破碎10min;
34.步骤b:10000rmp离心10min,取沉淀使用10ml含0.2m尿素的20mm tris
‑
hcl(ph 8.0)缓冲液清洗沉淀一次;10000rmp离心10min,离心沉淀加入10ml含2m尿素的20mm tris
‑
hcl(ph 8.0)变性缓冲液,37℃孵育2h 使沉淀完全溶解变性;
35.步骤c:将溶解变性后蛋白液转移到透析袋中,并向其透析袋外部的液体依次加入150ml含尿素浓度梯度分别为1.5m、1m、0.5m、0m的20mmtris
‑
hcl(ph 8.0)复性缓冲液,每个浓度梯度处理6h。
36.进一步地,所述阳性对照为产气荚膜梭菌β1毒素单克隆抗体1k19,为根据ncbi所提供的β1毒素氨基酸序列,对蛋白序列进行分析和抗原预测,去除可能发生交叉识别的大肠杆菌和产气荚膜梭菌β2毒素、α毒素,ε毒素的位点,从目标蛋白中挑选出抗原表位指数最高的一段具有14个氨基酸的肽段,以此作为抗原注射至balb/c小鼠,三次免疫后,取小鼠脾脏与骨髓瘤细胞进行融合,经限制性梯度稀释后获得阳性克隆细胞株,并经过筛选获得。
37.进一步地,所述mcab1k19纯化所用结合缓冲液为20mm磷酸钠,ph 7.0,洗脱缓冲液为0.1m甘氨酸
‑
盐酸缓冲液,ph 2.7,中和缓冲液为1m tris
‑ꢀ
cl,ph 9.0。
38.进一步地,所述完全培养基含有体积含量为10%的胎牛血清的rpmimedium 1640,所述完全培养基含有体积含量为1%的青链霉素以及1%的谷氨酰胺。
39.进一步地,所述阴性对照为产气荚膜梭菌β2毒素单克隆抗体。
40.采用上述结构本发明取得的有益效果如下:本方案一种产气荚膜梭菌β1 毒素抗体间接elisa检测方法,具有以下优点:
41.1、特异性强,利用本方法对实验室保留的产气荚膜梭菌阳性血清和采集的健康牛血清进行检测,结果显示,只有产气荚膜梭菌阳性血清为阳性,而健康牛血清均为阴性,表明所建立的检测体系具有良好的特异性;
42.2、灵敏度高,将mcab1k19按照倍比稀释,对建立并优化好的间接 elisa检测方法进行敏感性测试,实验结果显示在mcab 1k19稀释到2ng/μ l时od450nm为0.2235,仍在阳性临界值0.17以上,说明建立并优化好的间接elisa检测方法敏感性较高;
43.3、稳定性良好,利用建立好的间接elisa检测方法,对产气荚膜梭菌β1毒素阳性抗体(mcab1k19)、阴性抗体进行批次和批间检测,计算变异系数,验证该方法的稳定性,试验结果显示4次批内检测变异系数为3.654%
‑ꢀ
7.934%,4次批间检测变异系数为3.725%
‑
6.759%,批间和批内重复的变异系数均小于10%,表明建立的该方法具有良好的稳定性。
附图说明
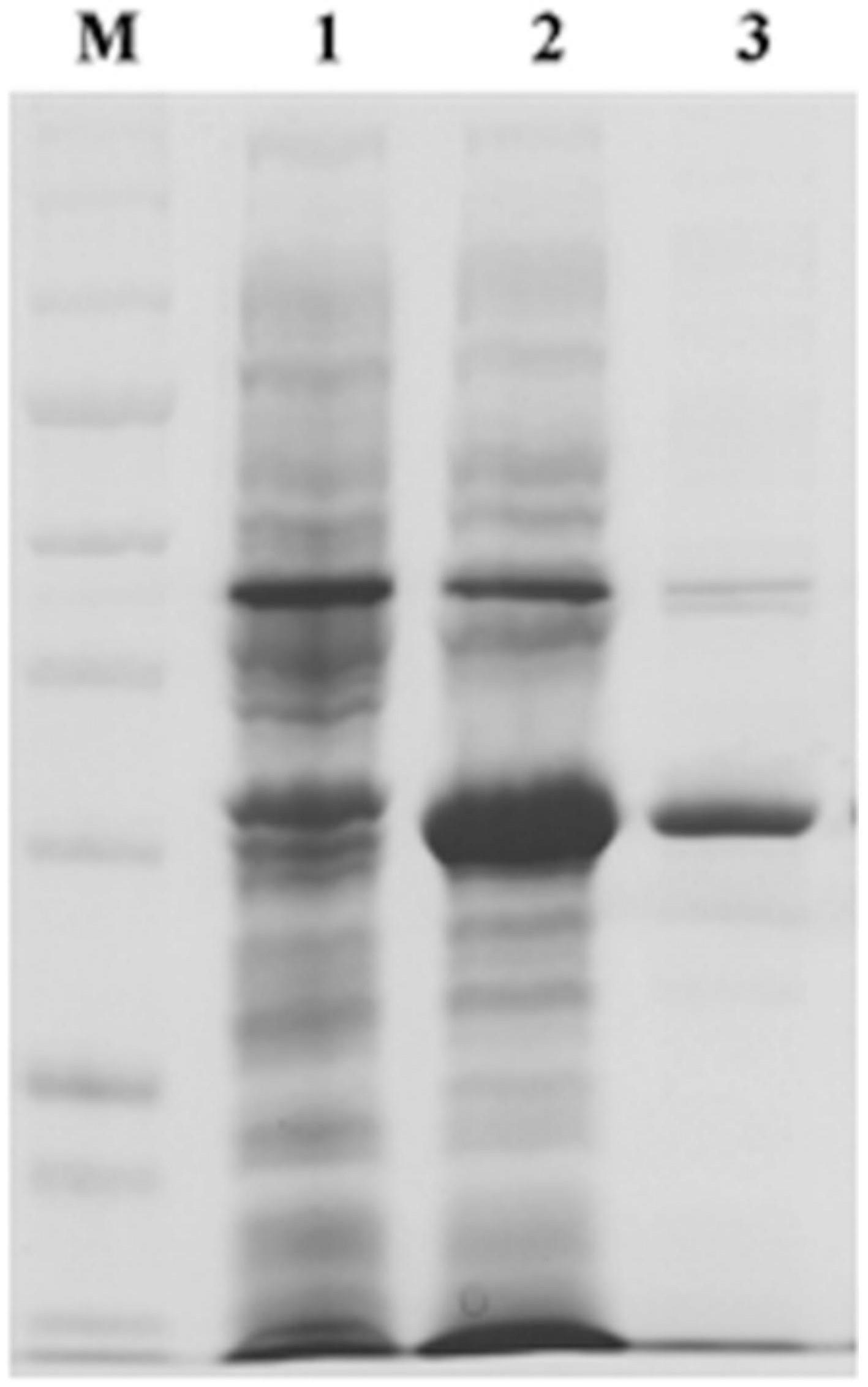
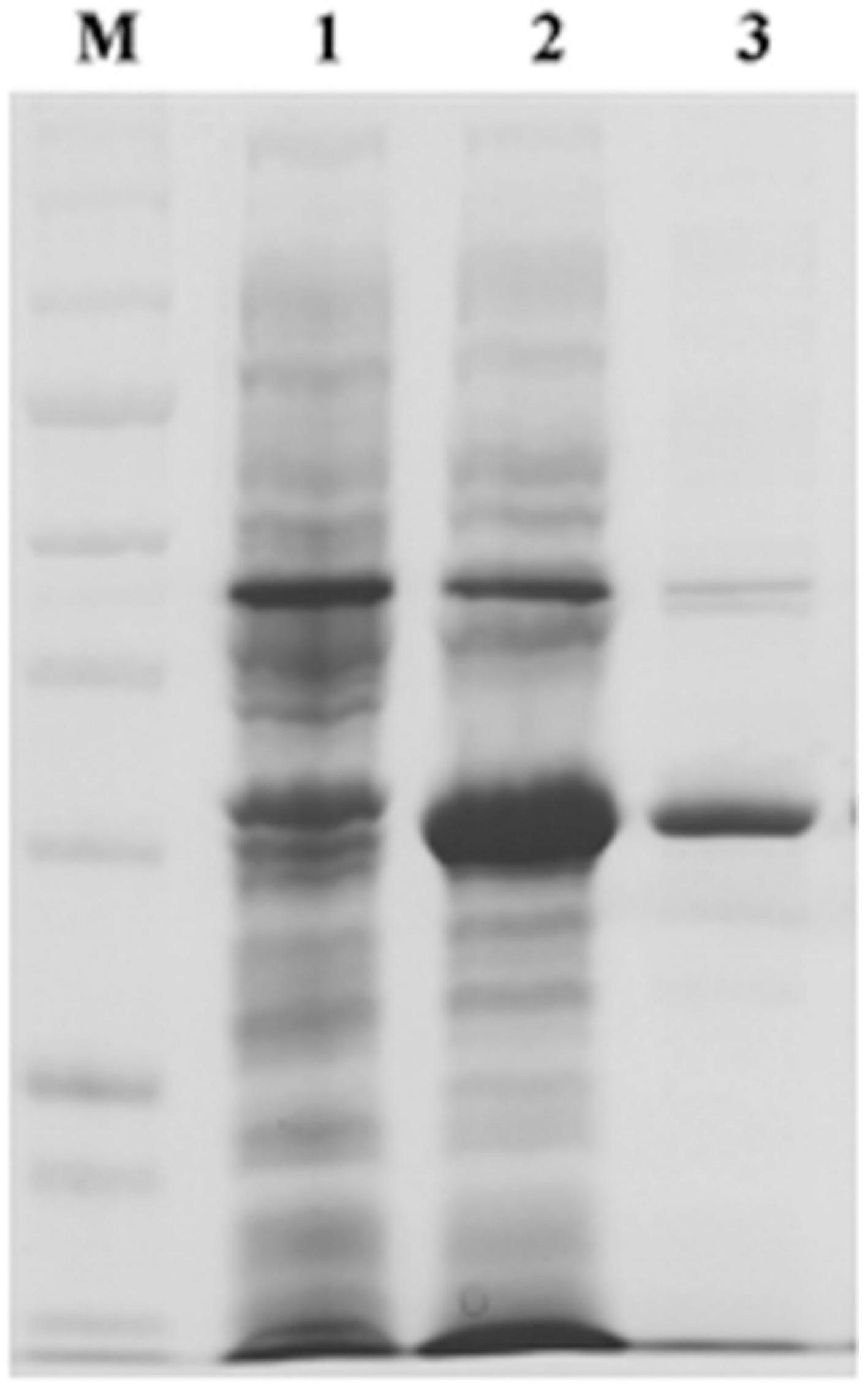
44.图1为本发明一种产气荚膜梭菌β1毒素抗体间接elisa检测方法的β1 毒素重组蛋白的表达、纯化蛋白电泳图;
45.图2为本发明一种产气荚膜梭菌β1毒素抗体间接elisa检测方法的最佳抗原包被浓度优化结果图;
46.图3为本发明一种产气荚膜梭菌β1毒素抗体间接elisa检测方法的 mcab1k19最佳稀释倍数优化结果图;
47.图4为本发明一种产气荚膜梭菌β1毒素抗体间接elisa检测方法的临界值的测定图。
48.图1中,m表示marker(cst14208 80kda(红),57k da,46kda,32kda,25kda(绿),22kda,17kda,11kkda,17kda,10kda);1表示bl21(de3)ptig诱导后菌体蛋白;2表示bl21(de3)ptig
‑
cpb1诱导后菌体;3 表示bl21(de3)ptig
‑
cpb1包涵体经0.2m尿素洗涤并复性。
49.附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。
具体实施方式
50.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
51.如图1
‑
4所示,本发明一种产气荚膜梭菌β1毒素抗体间接elisa检测方法,包括:
52.实施例1:可溶性重组产气荚膜梭菌β1毒素蛋白的表达:
53.根据文献报道的的产气荚膜梭菌β1毒素基因序列,设计引物
54.forward(5`
‑
3`)cggaattccatatggatataggcaaaactactactat
55.reverse(5`
‑
3`)gaatgcggccgcaatagctgttactttatg
56.从产气荚膜梭菌c型标准株中扩增cpb1基因,构建至ptig
‑
trx载体,转化至bl21(de3)菌株中,标记为bl21(de3)ptig
‑
cpb1。
57.取bl21(de3)ptig
‑
cpb1甘油冻存菌株,在含100μg/ml氨苄青霉素的 lb固体平板上划线,次日挑取单菌落接入10ml含100μg/ml氨苄青霉素的 lb液体培养基中培养至菌液od600达1.0以上,再以1%的接种量接种于 200ml含100μg/ml氨苄青霉素的lb液体培养基中培养3小时,之后在20 ℃、0.5mm iptg条件下诱导表达16h,收获菌液。
58.实施例2:可溶性重组产气荚膜梭菌β1毒素蛋白的纯化:
59.离心收集800ml诱导后重组表达菌体,用pbs清洗一次,菌体沉淀加入 20mm tris
‑
hcl(ph 8.0)缓冲液重悬10ml,加入100μg/ml溶菌酶,1
‰ꢀ
tritonx
‑
100,0.01mm pmsf,超声破碎10min;10,000rmp离心10min,取沉淀使用10ml含0.2m尿素的20mm tris
‑
hcl(ph 8.0)缓冲液清洗沉淀一次;10,000rmp离心10min,离心沉淀加入10ml含2m尿素的20mm tris
‑ꢀ
hcl(ph 8.0)变性缓冲液,37℃孵育2h使沉淀完全溶解变性;将溶解变性后蛋白液转移到透析袋中,并向其透析袋外部的液体依次加入150ml含尿素浓度梯度分别为1.5m、1m、0.5m、0m的20mm tris
‑
hcl(ph 8.0)复性缓冲液,每个浓度梯度处理6h。
60.实施例3:可溶性产气荚膜梭菌β1毒素蛋白抗原包被条件的确定:
61.采用方阵滴定法,以β1毒素重组蛋白为包被抗原,将β1毒素重组蛋白用包被缓冲液作稀释,按每孔浓度分别为2μg/ml、5μg/ml、8μg/ml、10μ g/ml稀释,酶标板每孔加100μl,4℃包被过夜;以5%脱脂奶粉,以纯化的 mcab1k19为一抗,hrp
‑
山羊抗小鼠igg为二抗,opd为显色液,2m h2so4溶液为终止液,测定od450nm数值检测吸光度值。
62.实施例4:封闭条件的确定:
63.采用方阵滴定法,以10μg/ml的β1毒素重组蛋白为包被抗原;以5% bsa或5%脱脂奶粉分别孵育30min、60min、90min和120min为封闭液,纯化的mcab1k19为一抗,hrp
‑
山羊抗小鼠igg为二抗,opd为显色液,2m h2so4溶液为终止液,测定od450nm数值检测吸光度值。
64.实施例5:产气荚膜梭菌β1毒素单克隆抗体1k19的制备;
65.根据ncbi所提供的β1毒素氨基酸序列,对蛋白序列进行分析和抗原预测,去除可能发生交叉识别的大肠杆菌和产气荚膜梭菌β2毒素、α毒素,ε毒素的位点,从目标蛋白中挑选出抗原表位指数最高的一段具有14个氨基酸的肽段,以此作为抗原注射至balb/c小鼠,三次免疫后,取小鼠脾脏与骨髓瘤细胞进行融合,经限制性梯度稀释后获得阳性克隆细胞株,并经过筛选获得。
66.实施例6:产气荚膜梭菌β1毒素单克隆抗体1k19的纯化:
67.将冻存于液氮罐中的1k19杂交瘤细胞复苏,接种至含有体积含量为1%的青链霉素、1%的谷氨酰胺以及10%的胎牛血清的rpmi medium 1640中进行细胞传代培养,待细胞状态良好后按1:100的比例将细胞分传于75cm2的培养瓶中,并置于co2培养箱中直至细胞过度生长以富积抗体,约5天后,待培养液变黄色后,收集1k19培养上清,用0.22μm的滤器进行过滤除菌,采用 akta纯化系统使用protein g纯化,纯化所用结合缓冲液为20mm磷酸钠, ph 7.0,洗脱缓冲液为0.1m甘氨酸
‑
盐酸缓冲液,ph 2.7,中和缓冲液为1m tris
‑
cl,ph 9.0,收获蛋白洗脱峰获得纯化的mcab1k19。
68.实施例7:单克隆抗体1k19的稀释比的确定:
69.采用方阵滴定法,以10μg/ml的β1毒素重组蛋白为包被抗原;以5%脱脂奶粉孵育120min为封闭条件,纯化的mcab1k19为一抗,分别作1:256、 1:512、1:1024、1:2048、1:4096、1:8192、1:16384稀释,设pbs为空白对照,hrp
‑
山羊抗小鼠igg为二抗,opd为显色液,2m h2so4溶液为终止液,测定od450nm数值检测吸光度值。
70.实施例8:hrp
‑
山羊抗小鼠igg稀释度的确定:
71.采用方阵滴定法,以10μg/ml的β1毒素重组蛋白为包被抗原,以5%脱脂奶粉孵育120min为封闭条件,纯化的mcab1k19稀释28倍为一抗,hrp
‑
山羊抗小鼠igg按照1:1000、1:2000、1:4000、1:8000梯度进行稀释为二抗, opd为显色液,2m h2so4溶液为终止液,测定od450nm数值检测吸光度值。
72.实施例9:间接elisa检测方法临界值的确定:
73.利用建立好的间接elisa检测方法,对30份阴性抗体进行了elisa测定,并计算这些样品的平均od450nm值(x)和标准方差(sd)。当样品 od450nm值>x 3sd时,判定为阳性;od450nm值<x 2sd时,判定为阴性;介于二者之间时,判为疑似。
74.通过统计学分析,其中阴性对照总体平均值为0.086,标准差sd为 0.028,故阳性临界值为0.17,阴性临界值为0.142。
75.需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
76.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
77.以上对本发明及其实施方式进行了描述,这种描述没有限制性,附图中所示的也只是本发明的实施方式之一,实际的结构并不局限于此。总而言之如果本领域的普通技术人员受其启示,在不脱离本发明创造宗旨的情况下,不经创造性的设计出与该技术方案相似的结构方式及实施例,均应属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。