1.本发明涉及一种胰岛素凝胶组合物,属医药制剂技术领域。
背景技术:
2.囊泡又称脂质体,是以两亲性的磷脂为材料,形成的具有封闭双分子层结构和内水腔的球形或椭球型的微粒。囊泡壁是由脂质分子组成的双层结构,亲水性药物可被包载入内部水腔,而两亲性药物、亲脂性药物及带电亲水性药物能通过疏水或静电相互作用与囊泡双分子层结合(critical issues related to transfersomes novel vesicular system.actasci.pol.technol.aliment.2012,11(1):67-82)。柔性囊泡作为一种柔性微粒,1992年由cevc和blume首次提出(lipid vesicles penetrate into intact skin owing to the transdermal osmotic gradients and hydration force.biochimica et biophysica acta.1992,1104(1):226-232),通过在囊泡的磷脂双分子层中加入边缘激活剂,破坏磷脂双层结构的平衡,使其具有弹性和高度变形性,从而够通过挤压变形,穿过比其自身尺寸小得多的生物膜屏障,进而显著增强非注射给药途径中药物的吸收。但是由于在柔性囊泡制备过程中加入的边缘活化剂在使其具备了弹性和变形性的同时,也增加了双分子层的不稳定性,导致在储存过程中,柔性囊泡的药物包封率显著下降,且囊泡极易发生聚集和融合,影响到药物效力的发挥并产生副作用,因此,柔性囊泡具有比普通囊泡更加严重的物理和化学不稳定性。
3.凝胶具有较好的生物相容性,对药物释放具有缓释、控释作用,制备工艺简单且形状美观,易于涂布使用,局部给药后易吸收,稳定性较好。将微粒包封在凝胶体系中不仅可以修饰药物的释放曲线,此外,对于不稳定的囊泡载药系统,形成凝胶还可以提高它的稳定性(c.peptu,a.a.indrei,m.popa,new tendencies in controlled drug release-liposomes entrapped in polymer matrices,rev.med.chir.soc.med.nat.iasi.113(2009)164.)。
4.众所周知,胰岛素作为一种大分子蛋白质,体内生物利用度低,前期研究以胰岛素/磷脂复合物为中间载体,通过加入具有边缘活化作用的离子型表面活化剂,制备了一种胰岛素柔性微粒(专利申请号201910392799.6)。体内外研究均显示,胰岛素柔性微粒尽管大大提高了口腔黏膜透过性,其口腔黏膜给药药理相对生物利用度高,具有良好的发展前景,但由于液体的流动性,胰岛素柔性微粒溶液难以长时间停留在给药部位。因此,我们将凝胶基质加入到胰岛素柔性微粒溶液中,通过增加制剂的生物粘附性来增加药物停留时间。据文献报道,凝胶的释药机制取决于凝胶骨架的溶蚀性以及药物在凝胶层中的扩散速度(dimensional changes,gel layer evolution and drug release studies in hydrophilic matrices loaded with drugs of different solubility[j].int j pharm,2007,339(1-2):66-75.),不同的药物由于它们自身的溶解性、分子量,亲脂性均不相同,其在凝胶层中的实际扩散情况也不相同。此外,柔性微粒作为一种药物储库,将药物胰岛素包封在柔性微粒中,不同的凝胶基质材料也会对胰岛素在柔性微粒中的释药速度造
成影响。
[0005]
我们在研究中发现,当采用凝胶基质制备胰岛素凝胶组合物,使其具有一定的生物粘附性时,该凝胶组合物很难同时满足药效和储存稳定性需求:液体凝胶组合物在使用过程中能够快速释放药物,具有良好的体内药效,但多数稳定性较差,例如4℃冰箱储存1个月就可见明显胰岛素沉淀;半固体凝胶组合物在储存条件下稳定性好,但在使用过程中却难以使药物从凝胶中释放出来,导致体内药理相对生物利用度显著降低。
技术实现要素:
[0006]
本发明解决的技术问题是提供一种胰岛素凝胶组合物,该凝胶组合物可在体温条件下迅速溶解或融化,从凝胶中快速释放药物,维持体内药效,并且稳定性好。为解决本发明的技术问题,本发明提供了如下技术方案:
[0007]
本发明技术方案的第一方面是提供了一种胰岛素凝胶组合物,其特征在于,所述凝胶组合物含有胰岛素、磷脂、离子型表面活性剂和凝胶基质,所述凝胶组合物在32℃以上为液体状态或者在1小时内溶解或融化为液体状态。其中,本发明所述的“液体状态”是本领域技术人员所知晓的含义,具体而言,“液体状态”是指没有确定的形状,处于流动状态,它的体积在压力及温度不变的环境下,是固定不变的。举例而言,本发明所述“溶解”是指一种物质(溶质)分散于另一种物质(溶剂)中成为溶液的过程,例如,本发明中“溶解”可以是胰岛素凝胶剂分散于水(或动物体液)中成为溶液的过程。本发明的“融化”是指物质由固态变为液态的过程。本发明所述储存的条件或温度优选30℃以下,可选地,25℃以下,进一步可选地,4℃以下。本发明中的“半固体”状态是指一种介于固体和液体之间的状态,在保持自身形状,支持自身重量方面类似于固体,而压力可以改变形状,低压下可以流动的性质则类似于液体。本发明中的“常温”是指10℃至30℃之间的任意温度或温度范围。本领域技术人员知晓,本发明中的温度,如储存温度、动物或人的体温,基于所列出的数值上下浮动
±
1℃。本发明的胰岛素凝胶组合物可有效维持药物体内药效,并提高药物稳定性,使其在储存过程中的性状不发生改变。
[0008]
本发明的胰岛素凝胶组合物中凝胶基质的质量百分含量高于等于0.2%,低于50%。所述凝胶基质选自卡波姆、纤维素衍生物、透明质酸、海藻酸盐、泊洛沙姆、聚乙烯醇、聚乙二醇、聚乙烯吡咯烷酮、明胶、西黄耆胶、黄原胶、聚n-丙烯酰甘氨酰胺中的一种或多种。其中,所述纤维素衍生物优选为羧甲基纤维素钠(cmc-na)、羟丙甲纤维素(hpmc)、壳聚糖、甲基纤维素中的一种或多种。
[0009]
优选地,所述凝胶基质为卡波姆,百分含量高于等于0.2%,低于2.5%,优选0.6-2.2%,更优选0.7-2%,进一步优选0.8-1.8%。
[0010]
优选地,所述凝胶基质选自明胶和/或透明质酸,百分含量为1-5%,优选1-3%。
[0011]
优选地,所述凝胶基质为纤维素衍生物,百分含量为2-6%,优选2.2-5.5%。
[0012]
优选地,所述凝胶基质为泊洛沙姆,百分含量为高于15,低于50%,优选20-45%。
[0013]
本发明的胰岛素凝胶组合物中胰岛素的质量分数大于0.06%,优选大于0.15%。
[0014]
所述胰岛素选自动物胰岛素、人胰岛素及胰岛素类似物中的至少一种。
[0015]
所述磷脂选自天然磷脂、合成磷脂中的至少一种。所述离子型表面活性剂选自胆酸盐类、高级脂肪酸盐类、硫酸化物、磺酸化物、十六烷基三甲基胺溴化物、甘草酸盐类中的
至少一种。
[0016]
所述胰岛素以柔性微粒的形式存在于所述凝胶组合物中。进一步地,所述柔性微粒含有胰岛素/磷脂复合物和离子型表面活性剂。
[0017]
进一步地,所述柔性微粒中,胰岛素:磷脂:离子型表面活性剂三者的质量比为1:3~50:0.1~20,优选1:5~15:0.5~15,更优选1:7~12:1~5。
[0018]
可选地,所述柔性微粒还含有游离磷脂、非离子型表面活性剂和胆固醇中的一种或几种。
[0019]
进一步地,所述非离子表面活性剂选自吐温类、司盘类、泊洛沙姆、脂肪酸甘油酯、卖泽、苄泽中的至少一种。
[0020]
优选地,所述非离子型表面活性剂与胰岛素的质量比为0.1:1~20:1,优选2:1~15:1;
[0021]
优选地,所述游离磷脂与胰岛素的质量比为0:1~50:1,优选0:1~20:1;
[0022]
优选地,所述胆固醇与胰岛素的质量比为0:1~10:1,优选0:1~1:1。
[0023]
本发明所公开的温度或含量范围以上限和下限形式表示,可以分别为一个或多个下限,或一个或多个上限;给定范围通过选定一个下限和一个上限进行限定的,选定的下限和上限限定了特别范围的边界,所有可以这种方式进行限定的范围是包含和可组合的,即任何下限可与任何上限组合形成一个范围;例如,针对特定参数列出1-40和0.6-50的范围,理解为0.6-40和1-50的范围也是预料到的;此外,如果列出最小范围值1和0.5,和如果列出最大范围值50,40和30,则以下范围可全部预料到:1-30、1-40、1-50、0.5-30、0.5-40、0.5-50。
[0024]
如果没有其他说明,本发明涉及的质量百分含量基于组合物的总质量。
[0025]
本发明技术方案的第二方面是提供了制备第一方面所述胰岛素凝胶组合物的制备方法,所述方法包括以下步骤:
[0026]
(一)制备胰岛素柔性微粒
[0027]
1)制备胰岛素/磷脂复合物
[0028]
将胰岛素溶于含适量酸的有机溶剂中,将磷脂溶于适量有机溶剂中;将以上两种溶液混合,在一定温度下水浴减压旋蒸,旋蒸过程中分次加入适量有机溶剂,继续旋转蒸发挥除溶剂,干燥得胰岛素/磷脂复合物。
[0029]
2)再制备胰岛素柔性微粒的“柔性微粒溶液”,可为以下方法中的任意一种:
[0030]
方法(a):
[0031]
·
薄膜:将胰岛素/磷脂复合物和离子型表面活性剂,一同溶解于有机溶剂中,挥除溶剂,干燥得薄膜;
[0032]
·
薄膜水化:取水性介质适量,加入到干燥后的薄膜中,在一定温度下,水化一定时间,经匀化制备得到“囊泡溶液”,即得。
[0033]
方法(b):
[0034]
·
薄膜:将胰岛素/磷脂复合物,溶解于有机溶剂中,挥除溶剂,干燥得薄膜;
[0035]
·
薄膜水化:将离子型表面活性剂溶解于适量的水性介质中,加入到干燥后的薄膜中,在一定温度下,水化一定时间,经匀化得到“囊泡溶液”,即得。
[0036]
方法(c):
[0037]
·
取胰岛素磷脂复合物及离子型表面活性剂,一同溶解于有机溶剂中,然后加入水性介质,超声处理使之成乳,减压旋蒸除去有机溶剂,得“囊泡溶液”,即得。
[0038]
方法(d):
[0039]
·
取胰岛素磷脂复合物溶解于有机溶剂中,然后将离子型表面活性剂溶解于水性介质中,两者混合匀化处理使之成乳,减压旋蒸除去有机溶剂得“囊泡溶液”,即得。
[0040]
(二)制备胰岛素凝胶组合物
[0041]
取凝胶基质,在一定温度下进行溶胀,将溶胀完全的凝胶基质,在一定温度下与步骤2)的胰岛素柔性微粒混合均匀,冷却,即得。
[0042]
在本发明的一种实施方式中,所述凝胶组合物的制备方法包括以下步骤:
[0043]
1)制备胰岛素/磷脂复合物
[0044]
将胰岛素溶于含适量酸的有机溶剂中,将磷脂溶于适量有机溶剂中;将以上两种溶液混合,在一定温度下水浴减压旋蒸,旋蒸过程中分次加入适量有机溶剂,继续旋转蒸发挥除溶剂,干燥得胰岛素/磷脂复合物。
[0045]
2)再制备胰岛素柔性微粒的“柔性微粒溶液”,可为以下方法中的任意一种:方法(a):
[0046]
·
薄膜:将胰岛素/磷脂复合物和离子型表面活性剂,一同溶解于有机溶剂中,
[0047]
挥除溶剂,干燥得薄膜;
[0048]
·
薄膜水化:取凝胶基质和水性介质,加入到干燥后的薄膜中,在一定温度下,水化并溶胀一定时间,经匀化制备得到胰岛素凝胶组合物,即得。
[0049]
方法(b):
[0050]
·
薄膜:将胰岛素/磷脂复合物,溶解于有机溶剂中,挥除溶剂,干燥得薄膜;
[0051]
·
薄膜水化:将离子型表面活性剂溶解于适量的水性介质中,取凝胶基质,将含离子型表面活性剂的水性介质和凝胶基质一起加入到干燥后的薄膜中,在一定温度下,水化并溶胀一定时间,经匀化得到胰岛素凝胶组合物,即得。
[0052]
方法(c):
[0053]
·
取胰岛素磷脂复合物及离子型表面活性剂,一同溶解于有机溶剂中,取凝胶基质,加入到水性介质中,将上述两种溶液混合,超声处理使之成乳,减压旋蒸除去有机溶剂,得胰岛素凝胶组合物,即得。
[0054]
方法(d):
[0055]
·
取胰岛素磷脂复合物溶解于有机溶剂中,然后将离子型表面活性剂和凝胶基质加入到水性介质中,两者混合匀化处理使之成乳,减压旋蒸除去有机溶剂得胰岛素凝胶组合物,即得。
[0056]
在一种实施方式中,本发明所述胰岛素凝胶组合物的制备方法包括以下步骤:
[0057]
1)制备胰岛素柔性微粒:采用薄膜分散法制得,包含胰岛素、磷脂、表面活性剂和水性介质;
[0058]
2)制备胰岛素凝胶组合物:
[0059]
取凝胶基质,在一定温度下进行溶胀,将溶胀完全的凝胶基质与步骤1)的胰岛素柔性微粒混合均匀,冷却,即得;
[0060]
在另一种实施方式中,本发明所述胰岛素凝胶组合物的制备方法包括以下步骤:
[0061]
采用薄膜分散法制得,包含胰岛素、磷脂、表面活性剂和含凝胶基质的水性介质。
[0062]
有益技术效果:本发明的胰岛素凝胶组合物具有以下优点:
[0063]
1)制备工艺简单、方便;
[0064]
2)稳定性好;
[0065]
3)在体温条件下,1小时内药物释放量达50%以上,口腔黏膜给药药理相对生物利用度高。
附图说明
[0066]
图1为本发明制得的胰岛素液体凝胶组合物的体内降糖曲线图;
[0067]
图2为本发明制得的胰岛素难溶(融)性半固体凝胶组合物的体内降糖曲线图。
具体实施方式
[0068]
下面通过附图和实施例对本发明进一步详细说明。通过这些示例性说明,本发明的特点和优点将变得更为清楚明确。这里作为示例性所说明的任何实施例不必解释为优于或好于其它实施例。此外,下面所描述的本发明不同实施方式中涉及的技术特征只要彼此之间未构成冲突就可以相互结合。
[0069]
本发明中,溶解或融化时间及释放量测定方法:取胰岛素柔性微粒凝胶组合物1g,置100ml烧杯中,铺匀底部,加入50ml水,于37℃下恒温振荡,转速120rpm。观察溶解或融化时间。30min后移取适量溶液作为释放度测定供试品溶液。另精密称取胰岛素对照品适量,以0.1%三氟乙酸-水溶液溶解并稀释至浓度为100μg/ml的溶液,作为对照品溶液。精密量取供试品溶液和对照品溶液各注入液相色谱仪进行分离分析,色谱柱为300sb-c18(4.6
×
250mm,5μm,agilent),流动相为0.2mol/l硫酸盐缓冲液-乙腈(74-26),流速为1.0ml/min,检测波长为214nm,柱温为40℃,进样量为20μl。记录色谱图,根据峰面积按照外标法计算胰岛素释放量。
[0070]
实施例1:以胰岛素-磷脂复合物为中间载体,制备载有胰岛素的柔性微粒。
[0071]
根据发明专利申请201180002259.4所述的方法取胰岛素60mg,将胰岛素和磷脂按质量比例1:10投料,按如下方法制备:取胰岛素60mg溶于6ml含0.1%三氟醋酸的甲醇溶液中;取大豆卵磷脂600mg溶于54ml二氯甲烷中,将上述2种溶液进行混合,形成澄清的溶液。将此溶液于37℃条件下进行减压旋转蒸发至溶剂挥干,将其置于真空干燥箱中,干燥后刮取至密闭容器中,得到胰岛素/磷脂复合物。取胰岛素/磷脂复合物660mg,与游离磷脂600mg和tween 20 400mg一同溶于20ml二氯甲烷中,形成澄清的溶液。将此溶液37℃条件下进行减压旋转蒸发至溶剂挥干,得干燥薄膜。取脱氧胆酸钠100mg溶于20ml磷酸缓冲液(0.02mol/l)中,得到脱氧胆酸钠的磷酸缓冲液。用该脱氧胆酸钠的磷酸缓冲液对所形成的薄膜进行水化30min,水化完成后经探头超声分散(150w,1min/次,共4次)、过膜(0.22μm),得到以胰岛素/磷脂复合物为中间载体的柔性微粒,粒径为81nm。
[0072]
实施例2:取溶胀完全的凝胶基质(取0.5g卡波姆(质量百分含量为0.5%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶在冰箱冷藏(4℃)和常温(20-25℃)储存时为液体状
态,37℃条件下,30min内可溶解或融化,30min内释放量为83%,复溶后粒径为106nm。
[0073]
实施例3:取溶胀完全的凝胶基质(取2.5g卡波姆(质量百分含量为2.5%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,1h内不能溶解或融化,30min内释放量为12%,复溶后粒径为132nm。
[0074]
实施例4:取溶胀完全的凝胶基质(取4g羧甲基纤维素钠(质量百分含量为4%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,30min内可溶解或融化,30min内释放量为95%,复溶后粒径为316nm。
[0075]
实施例5:取溶胀完全的凝胶基质(取4g羟丙甲纤维素(质量百分含量为4%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,1h内可溶解或融化,30min内释放量为67%,复溶后粒径为94nm。
[0076]
实施例6:取溶胀完全的凝胶基质(取2g透明质酸(质量百分含量为2%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶在冰箱冷藏(4℃)、常温(20-25℃)、30℃储存时均为半固体状态,37℃条件下,30min内可溶解或融化,30min内释放量为90%,复溶后粒径为127nm。
[0077]
实施例7:取溶胀完全的凝胶基质(取明胶80mg(质量百分含量为2%),加水2ml,加热至溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶常温(20-25℃)储存时为液体状态,置冰箱冷藏(4℃)储存时为半固体状态,37℃条件下,30min内可溶解或融化,30min内释放量为92%,复溶后粒径为84nm。
[0078]
实施例8:取溶胀完全的凝胶基质(取0.1g卡波姆(质量百分含量为0.1%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶在冰箱冷藏(4℃)和常温(20-25℃)储存时为液体状态,37℃条件下,30min内可溶解或融化。
[0079]
实施例9:取溶胀完全的凝胶基质(取0.2g卡波姆(质量百分含量为0.2%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶在冰箱冷藏(4℃)和常温(20-25℃)储存时为液体状态,37℃条件下,30min内可溶解或融化。
[0080]
实施例10:取溶胀完全的凝胶基质(取2.2g卡波姆(质量百分含量为2.2%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获
得胰岛素柔性微粒凝胶组合物。该凝胶在冰箱冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,1h内可溶解或融化。
[0081]
实施例11:取溶胀完全的凝胶基质(取1g卡波姆(质量百分含量为1%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,1h内可以溶解或融化。
[0082]
实施例12:取溶胀完全的凝胶基质(取2.5g壳聚糖(质量百分含量为2.5%)于50ml水中,加冰醋酸适量,使壳聚糖溶解,再加入适量甘油磷酸钠,于4℃下溶胀完全),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶冰箱冷藏(4℃)保存时为液体状态,常温(20-25℃)储存时为半固体状态,37℃条件下,30min内可溶解或融化。
[0083]
实施例13:取溶胀完全的凝胶基质(取15g泊洛沙姆(质量百分含量为15%)于50ml水中,于4℃下溶胀完全),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶冰箱冷藏(4℃)保存时为液体状态,常温(20-25℃)储存时为液体状态。
[0084]
实施例14:取溶胀完全的凝胶基质(取30g泊洛沙姆(质量百分含量为30%)于50ml水中,于4℃下溶胀完全),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶冰箱冷藏(4℃)保存时为液体状态,常温(20-25℃)储存时为半固体状态,37℃条件下,1h内可溶解或融化。
[0085]
实施例15:取溶胀完全的凝胶基质(取50g泊洛沙姆(质量百分含量为50%)于50ml水中,于4℃下溶胀完全),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。该凝胶冰箱冷藏(4℃)保存时为液体状态,常温(20-25℃)储存时为半固体状态,37℃条件下,1h内不能溶解或融化。
[0086]
实施例16:取溶胀完全的凝胶基质(取琼脂糖80mg(质量百分含量为2%),加水2ml,加热溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶在冰箱(4℃)或常温(20-25℃)储存时为半固体状态,37℃条件下,1h内不能溶解或融化。
[0087]
实施例17:取溶胀完全的凝胶基质(取卡拉胶120mg(质量百分含量为3%),加水2ml,加热溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶在冰箱(4℃)或常温(20-25℃)储存时为半固体状态,37℃条件下,1h内不能溶解或融化。
[0088]
实施例18:取溶胀完全的凝胶基质(取卡拉胶40mg(质量百分含量为1%),加水2ml,加热溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶在冰箱(4℃)或常温(20-25℃)储存时为半固体状态,37℃条件下,1h内不能溶解或融化。
[0089]
实施例19:取溶胀完全的凝胶基质(取卡拉胶10mg(质量百分含量为0.25%),加水
2ml,加热溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为液体状态。
[0090]
实施例20:取明胶80mg(质量百分含量为2%),至2ml实施例1中的磷酸缓冲液中,水化30min,混合均匀,获得胰岛素凝胶组合物。该凝胶常温(20-25℃)储存时为液体状态,置冰箱冷藏(4℃)储存时为半固体状态,37℃条件下,30min内可溶解或融化。
[0091]
实施例21:取溶胀完全的凝胶基质(取明胶40mg,透明质酸80mg,加水2ml,加热至溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,30min内可溶解或融化。
[0092]
实施例22:取溶胀完全的凝胶基质(取明胶:60mg,透明质酸60mg,加水2ml,加热至溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,30min内可溶解或融化。
[0093]
实施例23:取溶胀完全的凝胶基质(取明胶:80mg,透明质酸40mg,加水2ml,加热至溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,30min内可溶解或融化。
[0094]
实施例24:取溶胀完全的凝胶基质(取明胶96mg,透明质酸24mg,加水2ml,加热至溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶在冷藏(4℃)和常温(20-25℃)储存时为半固体状态,37℃条件下,30min内可溶解或融化。
[0095]
实施例25:取溶胀完全的凝胶基质(取0.6g卡波姆(质量百分含量为0.6%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0096]
实施例26:取溶胀完全的凝胶基质(取0.7g卡波姆(质量百分含量为0.7%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0097]
实施例27:取溶胀完全的凝胶基质(取0.8g卡波姆(质量百分含量为0.8%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0098]
实施例28:取溶胀完全的凝胶基质(取2g卡波姆(质量百分含量为2%)于50ml水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0099]
实施例29:取溶胀完全的凝胶基质(取1.8g卡波姆(质量百分含量为1.8%)于50ml
水中,待其溶胀完全后,加入乙醇胺调节ph至6.5-7.5之间即可),取适量与同重量实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0100]
实施例30:取溶胀完全的凝胶基质(取1g透明质酸(质量百分含量为1%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0101]
实施例31:取溶胀完全的凝胶基质(取3g透明质酸(质量百分含量为3%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0102]
实施例32:取溶胀完全的凝胶基质(取5g透明质酸(质量百分含量为5%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0103]
实施例33:取溶胀完全的凝胶基质(取明胶40mg(质量百分含量为1%),加水2ml,加热至溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶常温(20-25℃)储存为液体状态,冰箱冷藏(4℃)时为半固体状态,37℃条件下,30min内可溶解或融化。
[0104]
实施例34:取溶胀完全的凝胶基质(取明胶120mg(质量百分含量为3%),加水2ml,加热至溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶常温(20-25℃)储存和冰箱冷藏(4℃)时为半固体状态,37℃条件下,30min内可溶解或融化。
[0105]
实施例35:取溶胀完全的凝胶基质(取明胶200mg(质量百分含量为5%),加水2ml,加热至溶解后静置至37℃左右即可),与同重量的实施例1中的胰岛素柔性微粒混合均匀,静置至室温,获得胰岛素柔性微粒凝胶组合物。该凝胶常温(20-25℃)储存和冰箱冷藏(4℃)时为半固体状态,37℃条件下,1h内可溶解或融化。
[0106]
实施例36:取溶胀完全的凝胶基质(取2g羧甲基纤维素钠(质量百分含量为2%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0107]
实施例37:取溶胀完全的凝胶基质(取2.2g羧甲基纤维素钠(质量百分含量为2.2%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0108]
实施例38:取溶胀完全的凝胶基质(取5.5g羧甲基纤维素钠(质量百分含量为5.5%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0109]
实施例39:取溶胀完全的凝胶基质(取6g羧甲基纤维素钠(质量百分含量为6%)于50ml水中,静置溶胀),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0110]
实施例40:取溶胀完全的凝胶基质(取20g泊洛沙姆(质量百分含量为20%)于50ml水中,于4℃下溶胀完全),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0111]
实施例41:取溶胀完全的凝胶基质(取45g泊洛沙姆(质量百分含量为45%)于50ml水中,于4℃下溶胀完全),取适量与同重量的实施例1中的胰岛素柔性微粒充分混合,涡旋30秒,将制备的凝胶3000rpm离心20min,充分脱气,获得胰岛素柔性微粒凝胶组合物。
[0112]
实施例42:制备不同胰岛素柔性微粒的凝胶组合物
[0113]
(1)制备胰岛素/磷脂复合物
[0114]
取胰岛素60mg,将胰岛素:磷脂的质量比例按1:3、1:5、1:10、1:20、1:50投料,按如下方法制备,取胰岛素60mg溶于6ml含0.1%三氟醋酸的甲醇溶液中;分别取大豆卵磷脂180mg、300mg、600mg、1200mg和3000mg溶于54ml二氯甲烷中,将上述2种溶液进行混合,形成澄清的溶液。将此溶液于37℃条件下进行减压旋转蒸发至溶剂挥干,将其置于真空干燥箱中,干燥后刮取至密闭容器中,得到系列的胰岛素磷脂复合物,标记为复合物ⅰ、ⅱ、ⅲ、ⅳ、
ⅴ
。
[0115]
(2)按照如下方法制备胰岛素柔性微粒
[0116]
方法1
[0117]
薄膜:将(1)所制备的胰岛素/磷脂复合物iii、吐温20、脱氧胆酸钠、游离磷脂,一同溶解于氯仿:甲醇(3:1)中,挥除溶剂,干燥得薄膜;
[0118]
薄膜水化:取磷酸缓冲液(0.02mol/l)适量,加入到干燥后的薄膜中,水化30min,水化完成后经探头超声分散(150w,1min/次,共4次)、过膜(0.22μm)),得到胰岛素柔性微粒。
[0119]
方法2
[0120]
薄膜:将(1)所制备的胰岛素/磷脂复合物iii、吐温20、游离磷脂、胆固醇,一同溶解于二氯甲烷中,挥除溶剂,干燥得薄膜;
[0121]
薄膜水化:取脱氧胆酸钠加入到磷酸缓冲液(0.02mol/l)后,加入到干燥后的薄膜中,水化30min,水化完成后经探头超声分散(150w,1min/次,共4次)、过膜(0.22μm)),得到胰岛素柔性微粒。
[0122]
方法3
[0123]
薄膜:将(1)所制备的胰岛素/磷脂复合物iii和游离磷脂,溶解于二氯甲烷中,挥除溶剂,干燥得薄膜;
[0124]
薄膜水化:取tween20和脱氧胆酸钠溶于20ml磷酸缓冲液(0.02mol/l)中,得到表面活性剂的磷酸缓冲液,加入到薄膜中,水化30min,水化完成后经探头超声分散(150w,1min/次,共4次)、过膜(0.22μm)),得到胰岛素柔性微粒。
[0125]
方法4
[0126]
将(1)所制备的胰岛素/磷脂复合物iii、游离磷脂、吐温20和脱氧胆酸钠一同溶解于氯仿:甲醇(3:1)中,加入磷酸缓冲液(0.02mol/l)20ml,超声处理使之成乳,减压旋蒸除去有机溶剂得柔性微粒。
[0127]
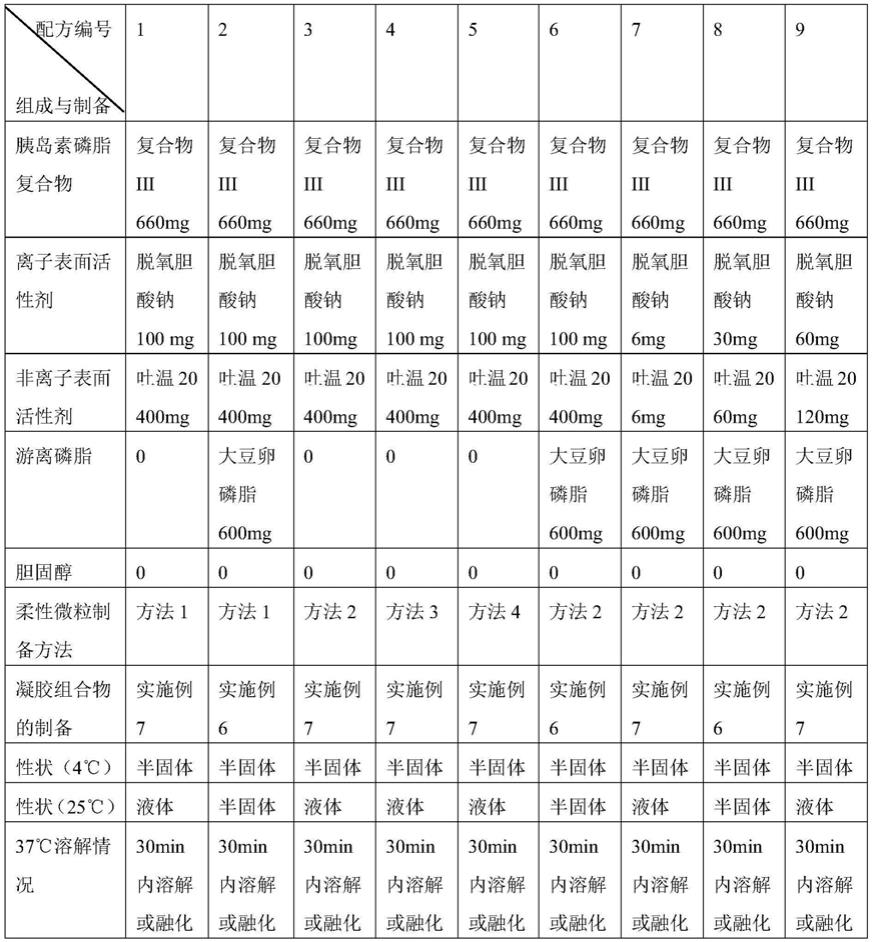
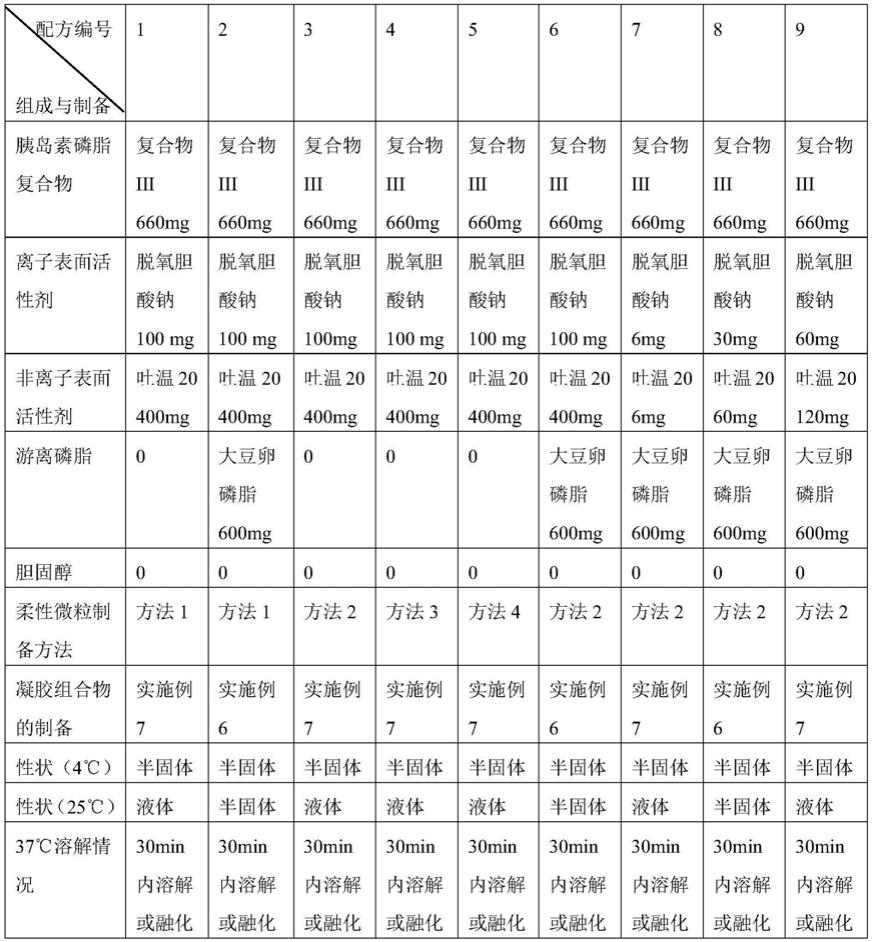
根据上述方法制备胰岛素柔性微粒并按照实施例的方法制备胰岛素凝胶组合物,具体见下表:
[0128]
表1不同胰岛素凝胶组合物的组成与制备
[0129]
[0130][0131]
用任一胰岛素/磷脂复合物进行替换,可得到类似结果。
[0132]
实施例43:以胰岛素为中间载体,制备胰岛素柔性微粒凝胶组合物
[0133]
取游离磷脂1.2g和tween20 400mg一同溶于20ml二氯甲烷中,挥干,得干燥薄膜。取胰岛素60mg和脱氧胆酸钠100mg溶于20ml磷酸缓冲液(0.02mol/l)中,加入到薄膜中,水化30min,水化完成后经探头超声分散(150w,1min/次,共4次)、过膜(0.22μm)),得到胰岛素柔性微粒。采用实施例7的方法制备胰岛素柔性微粒凝胶组合物。该凝胶常温(20-25℃)储存时为液体状态,置冰箱冷藏(4℃)储存时为半固体状态,37℃条件下,30min内溶解或融化。
[0134]
试验例
[0135]
试验例1:对胰岛素柔性微粒液体凝胶和胰岛素柔性微粒难溶(融)性半固体凝胶进行实验
[0136]
取实施例2、3制备的胰岛素柔性微粒液体凝胶和胰岛素柔性微粒难溶(融)性半固体凝胶,考察其性状、粒径、溶解或融化时间及30min内释放量。
[0137]
溶解或融化时间及释放量测定方法:取胰岛素柔性微粒凝胶组合物1g,置100ml烧杯中,铺匀底部,加入50ml水,于37℃下恒温振荡,转速120rpm。观察溶解或融化时间。30min
后移取适量溶液作为释放度测定供试品溶液。另精密称取胰岛素对照品适量,以0.1%三氟乙酸-水溶液溶解并稀释至浓度为100μg/ml的溶液,作为对照品溶液。精密量取供试品溶液和对照品溶液各注入液相色谱仪进行分离分析,色谱柱为300sb-c18(4.6
×
250mm,5μm,agilent),流动相为0.2mol/l硫酸盐缓冲液-乙腈(74-26),流速为1.0ml/min,检测波长为214nm,柱温为40℃,进样量为20μl。记录色谱图,根据峰面积按照外标法计算胰岛素释放量。
[0138]
表2两种胰岛素柔性微粒凝胶的体外释放
[0139][0140]
试验结果表明,与胰岛素柔性微粒液体凝胶相比,胰岛素柔性微粒难溶(融)性半固体凝胶,在37℃下,难以在1h内快速溶解或融化,30min药物释放量仅12%,而胰岛素柔性微粒液体凝胶,可以在30min内快速溶解或融化,其30min释放量高达83%。由此可知,溶解或融化时间与30min释放量具有正相关性,溶解或融化越快,30min释放量越高。
[0141]
试验例2:对胰岛素柔性微粒液体凝胶的体内降血糖实验
[0142]
1)试验药物
[0143]
胰岛素溶液:胰岛素溶液(87iu/ml);
[0144]
胰岛素柔性微粒:按实施例1制备的胰岛素柔性微粒(87iu/ml);
[0145]
胰岛素柔性微粒液体凝胶:按实施例2中制备的胰岛素柔性微粒凝胶组合物(43.5iu/g)。
[0146]
2)试验动物及家兔食管结扎模型
[0147]
取健康日本大耳白兔,体重2.0
±
0.5kg,雄性。禁食2小时(不禁水)后使用强生稳豪型血糖仪测定初始血糖值,选取初始血糖值在6.0~10.0之间的动物耳缘静脉注射2%戊巴比妥钠麻醉后对其进行食管结扎,待血糖值稳定10min后给药。给药后半小时,解除食管结扎,缝合伤口。
[0148]
3)给药方式及剂量
[0149]
取已进行食管结扎的日本大耳白兔12只,随机分成4组,每组3只,按照下述给药方式和剂量进行给药;
[0150]
胰岛素溶液组:舌下及颊黏膜(38.70~39.54℃)给药,10iu/kg,将全部剂量的药液平均分成4份,各取一份量均匀滴加至两侧颊黏膜,取两份量均匀滴于舌下;
[0151]
皮下注射组:取胰岛素溶液,以1iu/kg皮下注射;
[0152]
胰岛素柔性微粒组:给药方式同胰岛素溶液组;
[0153]
胰岛素柔性微粒液体凝胶组:舌下及颊黏膜给药,10iu/kg,将全部剂量的凝胶平均分成4份,各取一份量均匀涂布至两侧颊黏膜,取两份量均匀涂布舌下。
[0154]
4)血糖测定
[0155]
分别于给药后第0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、6h于耳缘静脉取血,使用血糖仪测定血糖值并记录,计算每组血糖降低百分比的平均值,绘制单次给药之后的血糖降
低曲线。
[0156]
5)试验结果
[0157]
试验结果(图1)表明,对进行食管结扎的日本大耳白兔进行口腔黏膜给胰岛素柔性微粒液体凝胶,与初始血糖值相比,其血糖下降幅度可达70%;与胰岛素柔性微粒具有相同程度的降血糖效果,药理相对生物利用度15.40%;显著优于以相同剂量相同方式给药的胰岛素溶液组,具有良好的口腔黏膜吸收效果;与以1iu/kg剂量皮下注射胰岛素溶液相比,其降糖幅度更大且药效维持时间更长。
[0158]
由试验例1和试验例2可知,能够快速溶解或融化的胰岛素柔性微粒凝胶,一方面30min释放量高,另一方面由于粘附性的增加延长了柔性微粒在给药部位的给药时间,进而能够维持柔性微粒良好的药效。
[0159]
试验例3:对胰岛素柔性微粒液体凝胶稳定性的实验
[0160]
取按实施例2、8、9中制备的胰岛素柔性微粒组液体凝胶,进行4℃稳定性实验。
[0161]
表3胰岛素柔性微粒液体凝胶4℃稳定性
[0162][0163]
试验结果表明,以0.1%卡波姆制备的胰岛素柔性微粒凝胶一个月即发生胰岛素析出,以0.2%、0.5%卡波姆制备的胰岛素柔性微粒凝胶分别在一个月内稳定和两个月内稳定。
[0164]
试验例4:对胰岛素柔性微粒难溶(融)性半固体凝胶的体内降血糖实验
[0165]
1)试验药物
[0166]
胰岛素溶液:胰岛素溶液(87iu/ml);
[0167]
胰岛素柔性微粒:按实施例1制备的胰岛素柔性微粒(87iu/ml);
[0168]
胰岛素柔性微粒难溶(融)性半固体凝胶:按实施例3中制备的胰岛素柔性微粒凝胶组合物(43.5iu/g)。
[0169]
2)试验动物及家兔食管结扎模型同试验例1
[0170]
3)给药方式及剂量
[0171]
取已进行食管结扎的日本大耳白兔12只,随机分成4组,每组3只,按照下述给药方式和剂量进行给药;
[0172]
胰岛素溶液组:舌下及颊黏膜给药,10iu/kg,将全部剂量的药液平均分成4份,各取一份量均匀滴加至两侧颊黏膜,取两份量均匀滴于舌下;
[0173]
皮下注射组:取胰岛素溶液,以1iu/kg皮下注射;
[0174]
胰岛素柔性微粒组:给药方式同胰岛素溶液组;
[0175]
胰岛素柔性微粒难溶(融)性凝胶组:舌下及颊黏膜给药,10iu/kg,将全部剂量的凝胶平均分成4份,各取一份量均匀涂布于两侧颊黏膜,取两份量均匀涂布于舌下。
[0176]
血糖测定同试验例1。
[0177]
4)试验结果
[0178]
试验结果(图2)表明,当提高卡波姆浓度获得胰岛素柔性微粒难溶(融)性半固体凝胶后,体内降血糖效果显著降低,药理相对生物利用度为2.94%。由此可知,胰岛素柔性微粒难溶(融)性半固体凝胶难以在1h内快速溶解或融化,其30分钟释放量仅12%,进而降低了体内药效。
[0179]
试验例5:对不同凝胶基质进行实验
[0180]
取实施例1制备的胰岛素柔性微粒和凝胶基质,采用不同凝胶基质常用的用量,按实施例4、5、6、7制备胰岛素柔性微粒凝胶组合物,考察其性状、粒径、溶解或融化时间及30min内释放量。
[0181]
表4不同凝胶基质对胰岛素柔性微粒凝胶组合物的质量影响
[0182][0183]
结果表明,羧甲基纤维素钠、羟丙基纤维素、透明质酸、明胶制备的胰岛素柔性微粒凝胶组合物在4℃或/和20-25℃下均为半固体状态,粒径在400nm以下,可在1h内溶解或融化,且37℃下药物释放量在50%以上,溶解或融化时间以及30min释放量均与实施例2中制备的胰岛素柔性微粒液体凝胶相当,该结果进一步验证了溶解或融化速度与30min释放量的正相关性。
[0184]
基于以上结果可以得知,若胰岛素凝胶组合物可以在1小时内溶解或融化,则其30min释放量可达50%以上。因此,我们对实施例中凝胶组合物的溶解或融化时间进行测定,同时以此考察其释放量的高低。
[0185]
试验例6:对明胶与透明质酸的混合凝胶基质的比例进行实验
[0186]
取实施例1制备的胰岛素柔性微粒和凝胶基质,按实施例21、22、23、24的制备方法制备胰岛素凝胶组合物,考察其性状、溶解或融化时间。
[0187]
表5混合凝胶基质对胰岛素凝胶组合物的质量影响
[0188][0189]
结果表明,明胶和透明质酸以不同比例制备的胰岛素柔性微粒凝胶组合物在4℃或/和常温20-25℃下均为半固体状态,37℃条件下,均可在30min内溶解或融化。
[0190]
试验例7:对不同制备方法进行实验
[0191]
取实施例1制备的胰岛素柔性微粒和凝胶基质,按实施例7、20的制备方法制备胰岛素凝胶组合物,考察其性状、溶解或融化时间。
[0192]
表6不同制备方法对胰岛素凝胶组合物的质量影响
[0193][0194]
结果表明,两种制备方法没有明显差异。
[0195]
试验例8:对半固体状态胰岛素柔性微粒凝胶组合物的稳定性实验
[0196]
取实施例7、11制备的胰岛素柔性微粒凝胶组合物,进行4℃稳定性实验。
[0197]
表7胰岛素柔性微粒凝胶组合物的4℃稳定性
[0198][0199]
结果表明,半固体状态的胰岛素柔性微粒凝胶组合物在4℃下3个月内稳定。
[0200]
以上结合了优选的实施方式对本发明进行了说明,不过这些实施方式仅是范例性的,仅起到说明性的作用。在此基础上,可以对本发明进行多种替换和改进,这些均落入本发明的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。