用于使用微针的协同免疫化学治疗的透皮系统及其治疗方法
1.本技术要求2020年5月22日提交的申请号为63/028,850的美国临时申请的优先权,并通过引用将其全部内容并入。
技术领域
2.本文提供了一种透皮系统,其用于通过微针直接局部共同递送免疫检查点抑制剂和化学治疗剂以用于协同的免疫化学治疗。本文提供了脂质包覆的纳米颗粒及其促进药物释放和肿瘤靶向的用途。本文还提供了一种使用所述系统治疗癌症和其他障碍的方法。
背景技术:
3.癌症是仅次于心血管疾病的第二大死亡原因。尽管化学治疗仍然是癌症治疗的主要策略,但是最近免疫检查点抑制剂已导致了癌症治疗的范式转变。t细胞上表达的程序性细胞死亡蛋白
‑
1(pd
‑
1)与其肿瘤细胞上的受体程序性细胞死亡配体
‑
1(pd
‑
l1)结合,导致t细胞免疫应答失活并有助于肿瘤免疫逃避1。免疫检查点抑制剂抗pd
‑
1(apd
‑
1)可以阻断pd
‑
1与pd
‑
l1 的结合,从而激活对肿瘤细胞的t细胞免疫应答2。用于各种癌症的免疫检查点抑制剂的应用已经迅速增加,并已经显示出令人鼓舞的治疗结果3。但是,免疫检查点抑制剂的局限性阻碍了其进一步的临床应用。据报道,对 apd
‑
1的总体客观响应率在晚期黑色素瘤中约为33%4,在头颈癌中仅为 20%5。在治疗过程中,高百比的患者表现出原发性耐药或产生的适应性耐药
6,7,8
。此外,由apd
‑
1激活的免疫反应通常不持久
2,9
。提高响应率和克服耐药性仍然是免疫治疗中的主要挑战。
4.肿瘤微环境中的免疫分析(immune profiling)在化学治疗和免疫治疗中起着至关重要的作用。临床研究表明,肿瘤微环境中的基质成纤维细胞赋予顺式
‑
二氨铂(ii)的化学耐药性,而cd8 t细胞则通过cd8 t细胞来源的干扰素(ifn)
‑
γ(cd8 t细胞的主要效应细胞因子)消除了癌症相关的成纤维细胞介导的化学耐药性,这揭示了化学治疗和免疫治疗之间的相互作用
10
‑
12
。肿瘤微环境中t细胞的克隆扩增与对化学治疗的更好的响应相关
13
;因此,化学治疗的有效性依赖于持久的抗癌免疫反应的诱导
14,15
。肿瘤微环境中预先存在的cd8 t细胞也预示了apd
‑
1治疗的功效。这代表了一种新的治疗策略,其中可以通过改变肿瘤微环境来改善化学治疗和免疫治疗的结果。据报道,由于肿瘤通过多种途径逃避免疫反应,因此组合治疗在对抗耐药性方面具有潜在的协同作用,并且比单药疗法更有效
1,16
。
5.使用免疫检查点抑制剂抗pd
‑
1(apd
‑
1)的免疫治疗已经彻底改变了癌症治疗。但是,免疫检查点抑制剂的局限性阻碍了其进一步的临床应用。发现对apd
‑
1的总体客观响应率在晚期黑色素瘤中约为33%,而在hnc中仅为20%。在治疗过程中,高百分比的患者表现出原发性耐药或产生的适应性耐药。此外,由apd
‑
1激活的免疫反应通常不持久。提高响应率和克服耐药性仍然是免疫治疗中的主要挑战。
技术实现要素:
6.在一个实施方案中,本文提供了一种新的构思,其用于通过微针直接局部共同递
送免疫检查点抑制剂和顺铂(cddp,一种化学治疗剂),用于协同的免疫化学治疗。这是一种提高威胁生命的癌症的治疗结果的新治疗策略。在一个实施方案中,所述治疗针对对一种或多种癌症治疗耐受的受试者。在一个实施方案中,微针递送apd
‑
1和cddp。在一个实施方案中,本文提供了通过微针直接局部共同递送免疫检查点抑制剂和化学治疗剂,其用于协同的免疫化学治疗。
7.在一个实施方案中,由mn激活的稳健的t细胞应答可以增强apd
‑
1 和cddp两者的功效。协同的抗癌机制通过微针诱导的稳健的t细胞应答, apd
‑
1对t细胞中的pd
‑
1的阻断以及肿瘤细胞中的cddp的直接细胞毒性激活。该方法协同增强了抗癌作用。穿过富含免疫细胞的表皮的mn通过激活t细胞而激发了稳健的免疫应答。通过由mn激活的稳健的t细胞应答, apd
‑
1对t细胞中的pd
‑
1的阻断以及肿瘤细胞中的cddp的直接细胞毒性维持协同的免疫化学治疗作用。mn介导的宿主免疫应答增强了apd
‑
1激活的t细胞免疫,其增强了cddp对癌细胞的直接杀伤。
8.在一个实施方案中,本文提供的方法是抗体依赖性细胞介导的细胞毒性或“adcc”,其是指细胞毒性的一种形式,其中分泌的免疫球蛋白结合到某些细胞毒性细胞(例如,自然杀伤(nk)细胞、嗜中性粒细胞和巨噬细胞) 上存在的fc受体(fcr)上,使这些细胞毒性效应细胞特异性结合于带有抗原的靶细胞,并随后用细胞毒素杀死靶细胞。针对靶细胞表面的特异性高亲和力igg抗体“武装”了细胞毒性细胞,并且绝对是这样的杀伤所必需的。靶细胞的裂解是在细胞外,需要直接的细胞间接触,并且不涉及补体。可以想到,除了抗体之外,具有与携带抗原的靶细胞特异性结合的能力的其他包含fc区的蛋白,特别是fc融合蛋白将能够实现细胞介导的细胞毒性。为简单起见,由fc融合蛋白的活性引起的细胞介导的细胞毒性在本文中也称为 adcc活性。
9.本文提供了一种包含微针的透皮药物递送系统,所述微针包含纳米颗粒,所述纳米颗粒包含抗pd
‑1‑
顺铂。
10.在一个实施方案中,纳米颗粒是ph响应性的。
11.在一个实施方案中,纳米颗粒包含脂质和聚乙烯吡咯烷酮(pvp)。
12.在一个实施方案中,微针是水溶性的。
13.本文提供了一种治疗有其需要的受试者的癌症的方法,所述方法包括给予所述受试者一种透皮药物递送系统,所述系统包含微针,并且其中所述微针包含治疗有效剂量的抗pd
‑1‑
顺铂
‑
纳米颗粒。
14.在一个实施方案中,与给予抗pd
‑
1或顺铂(cddp)相比,所述治疗具有协同作用。
15.在一个实施方案中,所述癌症是黑色素瘤、头颈癌或鳞状细胞癌。
16.在一个实施方案中,所述方法还包括给予另外的治疗。
17.在一个实施方案中,在治疗之前,所述受试者表现出原发性耐药性、产生的适应性耐药和/或对化学治疗无响应。
18.在一个实施方案中,与全身注射抗pd
‑
1相比,所述治疗加强免疫应答和/或使肿瘤体积减小至少8倍。
19.在一个实施方案中,所述治疗抑制细胞增殖和/或增强t细胞浸润。
20.在某些实施方案中,本文提供了一种微针,其由包含纳米颗粒的生物相容性共聚物形成,所述纳米颗粒包含一种或多种治疗剂。当包含一种或多种水溶性或疏水性药物的
纳米颗粒被携带在微针中时,微针可以递送所述纳米颗粒。特别地,由于脂溶性药物在被结构溶解时形成的胶束型自组装纳米颗粒携带的同时被递送,因此可以大大提高在水溶液中的溶解度。因此,吸收差的现有药物可以穿过人体皮肤递送。在一个实施方案中,纳米颗粒包含形成双层的1,2
‑
二油酰基
‑
sn
‑
甘油
‑3‑
磷酸酯(dopa),以实现与其他脂质的连接,所述其他脂质例如1,2
‑
二油酰基
‑3‑
三甲基铵丙烷(dotap)、1,2
‑
二硬脂酰基
‑
sn
‑
甘油
‑3‑
磷酸乙醇胺
‑
n
‑
[氨基(聚乙二醇)
‑
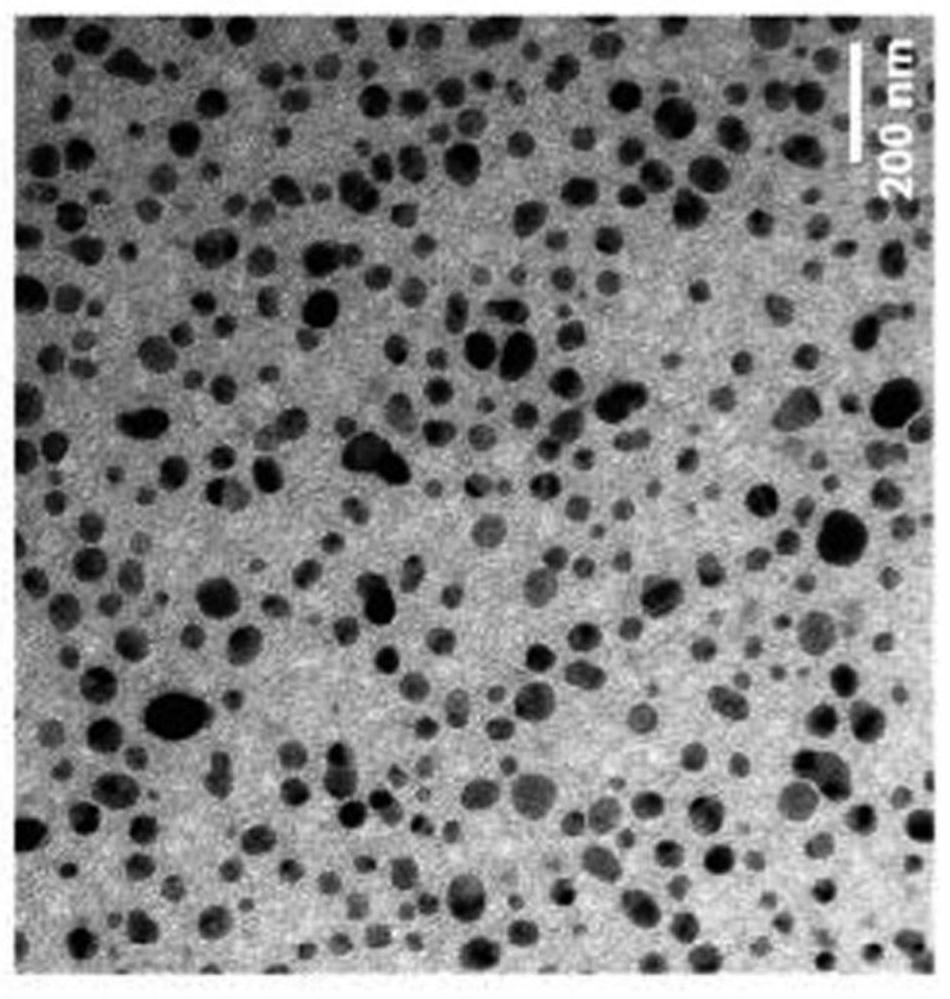
2000](铵盐) (dspe
‑
peg
‑
aa)和胆固醇。
[0021]
在一个实施方案中,递送系统是透皮药物递送系统。在某些实施方案中,透皮药物递送系统包含微针,所述微针包含纳米颗粒,所述纳米颗粒包含抗 pd
‑
1和顺铂。
[0022]
在某些实施方案中,抗pd
‑
1是抗体或其pd
‑
1抗原结合片段。
[0023]
术语“抗体”是指通过免疫球蛋白分子的可变区内的至少一个抗原识别位点识别并特异性结合于靶点的免疫球蛋白分子,所述靶点诸如蛋白质、多肽、肽、碳水化合物、多核苷酸、脂质或前述的组合。如本文所使用,术语“抗体”包括完整的多克隆抗体,完整的单克隆抗体,抗体片段(例如fab、fab'、f(ab')2和fv片段),单链fv(scfv)突变体,多特异性抗体,例如由至少两种完整抗体产生的双特异性抗体,嵌合抗体,人源化抗体,人抗体,包含抗体的抗原决定部分的融合蛋白,和任何其他包含抗原识别位点的修饰的免疫球蛋白分子,只要这些抗体表现出期望的生物活性。
[0024]
根据免疫球蛋白的分别称为α、δ、ε、γ和μ的重链恒定结构域的特性,抗体可以属于免疫球蛋白的五种主要类别中的任何一种:iga、igd、ige、 igg和igm,或其子类(同种型)(例如igg1、igg2、igg3、igg4、iga1和 iga2)。不同种类的免疫球蛋白具有不同的且众所周知的亚基结构和三维构型。抗体可以是裸露的或与其他分子,例如毒素、放射性同位素等缀合以形成adc。
[0025]
抗pd
‑
1抗体是选择性结合pd
‑
1多肽的抗体或其抗原结合片段。示例性的抗pd
‑
1抗体包括例如派姆单抗keytruda.rtm.、兰洛利珠单抗、 mk
‑
3475)、纳武单抗(opdiva.rtm.、bms
‑
936558、mdx
‑
1106、ono
‑
4538) 或amp
‑
224。
[0026]
术语“抗原结合片段”是指包含完整抗体的一部分的分子,并且特别是指包含完整抗体的抗原决定可变区的分子。本领域已知,抗体的抗原结合功能可以通过全长抗体的片段来实现。抗体片段的实例包括但不限于fab、 fab'、f(ab')2和fv片段,线性抗体、单链抗体和由抗体片段形成的多特异性抗体。
[0027]
在某些实施方案中,抗原结合片段是fv、fab、f(ab')2、fab'、dsfv、scfv 或sc(fv)2。
[0028]
在某些实施方案中,抗体或其抗原结合片段缀合于至少一种不同的药剂,包括例如抗癌剂。
[0029]
在某些实施方案中,纳米颗粒是ph响应性的。在一个实施方案中,纳米颗粒是自组装的。
[0030]
在某些实施方案中,纳米颗粒有效地减少副作用,增强活性肿瘤聚焦,改善细胞摄取以及化学治疗和免疫治疗的核/细胞质靶向。
[0031]
在某些实施方案中,纳米颗粒包含脂质和聚乙烯吡咯烷酮(pvp)。
[0032]
本文提供了一种制备抗pd
‑1‑
cddp纳米颗粒的方法。
[0033]
在某些实施方案中,微针是水溶性的并且可以溶解在组织中。
[0034]
在某些实施方案中,微针包括9
×
9根针,所述针的高度为800μm,底部直径为约400μm。
[0035]
本文提供了一种试剂盒,其包括用于治疗癌症或增生性障碍的透皮系统。所述试剂盒包括透皮系统和使用该系统的说明书。所述试剂盒包括透皮系统,所述透皮系统包含微针,所述微针还包含抗pd
‑1‑
cddp纳米颗粒。
[0036]
本文提供了一种抑制细胞生长的方法,所述方法包括给予受试者一种透皮药物递送系统,所述系统包含微针,并且其中所述微针包含有效剂量的抗 pd
‑1‑
cddp
‑
纳米颗粒。
[0037]
本文提供了一种抑制受试者的肿瘤生长的方法,所述方法包括给予有其需要的受试者有效剂量的抗pd
‑1‑
cddp纳米颗粒。
[0038]
本文提供了一种增加受试者的抗肿瘤免疫应答的方法,所述方法包括给予有其需要的受试者有效剂量的抗pd
‑1‑
cddp
‑
纳米颗粒。
[0039]
本文提供了一种治疗有其需要的受试者的癌症的方法,所述方法包括给予所述受试者一种透皮药物递送系统,所述系统包含微针,并且其中所述微针包含治疗有效剂量的抗pd
‑1‑
cddp
‑
纳米颗粒。
[0040]
诸如“治疗(treating)”或“治疗(treatment)”或“治疗(to treat)”或“减轻(alleviating)”或“减轻(to alleviate)”的术语是指治愈、减缓、减轻所诊断的病理病症或障碍的症状和/或中止其进展的治疗措施。在某些方面,如果患者显示出例如某种类型的癌症的全部、部分或短暂缓解,则根据本发明的方法成功地“治疗”了受试者的癌症。
[0041]
关于所述目的,可以凭经验并以常规方式确定“有效量”。
[0042]
在某些实施方案中,与给予抗pd
‑
1或顺铂(cddp)相比,所述治疗具有协同作用。
[0043]
术语“癌症”、“肿瘤”、“癌性”和“恶性”是指或描述哺乳动物的通常以不受调节的细胞生长为特征的生理状况。癌症的实例包括但不限于癌,包括腺癌、淋巴瘤、母细胞瘤、黑色素瘤、肉瘤和白血病。这样的癌症的更具体的实例包括鳞状细胞癌、小细胞肺癌、非小细胞肺癌、胃肠道癌、霍奇金淋巴瘤和非霍奇金淋巴瘤、胰腺癌、成胶质细胞瘤、神经胶质瘤、宫颈癌、卵巢癌、肝癌如肝细胞癌和肝细胞瘤、膀胱癌、乳腺癌(包括激素介导的乳腺癌)、结肠癌、结肠直肠癌、子宫内膜癌、骨髓瘤(如多发性骨髓瘤)、唾液腺癌、肾癌如肾细胞癌和威尔姆斯肿瘤、基底细胞癌、黑色素瘤、前列腺癌、外阴癌、甲状腺癌、睾丸癌、食道癌、各种类型的头颈癌和粘液性来源的癌例如粘液性卵巢癌、胆管癌(肝)和肾乳头状癌。在某些实施方案中,所述癌症选自结肠癌、乳腺癌、淋巴瘤和非小细胞癌。
[0044]
在某些实施方案中,所述癌症选自结直肠癌、胰腺癌、膀胱癌、白血病、淋巴瘤、神经胶质瘤、成胶质细胞瘤、黑色素瘤、卵巢癌、甲状腺癌、食道癌、前列腺癌和乳腺癌。
[0045]
在某些实施方案中,癌症具有转移前表型,包括黑色素瘤或乳腺癌。
[0046]
在某些实施方案中,癌症是转移性癌症。在某些实施方案中,本文公开的纳米颗粒可以触发适应性抗肿瘤活性和/或抑制转移。
[0047]
在某些实施方案中,受试者是人,但不限于人、非人灵长类动物、啮齿动物、农场动物、犬和猫,它们将成为特定治疗的接受者。
[0048]
在某些实施方案中,所述方法还包括给予另外的治疗。在某些实施方案中,所述方法包括将抗pd
‑1‑
cddp纳米颗粒与治疗有效量的第二药剂组合给予,所述第二药剂是除第一药剂以外的抗癌剂。
[0049]
在某些实施方案中,在治疗之前,受试者表现出原发性耐药、产生的适应性耐药和/或对化学治疗无响应。
[0050]
在某些实施方案中,与全身注射抗pd
‑
1相比,所述治疗加强免疫应答和/或使肿瘤体积减小至少8倍。在某些实施方案中,所述治疗是单独给予抗 pd
‑
1或顺铂的至少8倍。在某些实施方案中,治疗是8
‑
10倍、10
‑
12倍、12
‑
15 倍、15
‑
20倍。
[0051]
在某些实施方案中,抗pd
‑1‑
顺铂的有效剂量为100μm
‑
150μm、150 μm
‑
200μm、200μm
‑
250μm、250μm
‑
300μm、300μm
‑
350μm、350μm
‑
400 μm、400μm
‑
450μm、450μm
‑
500μm、500μm
‑
550μm、550μm
‑
600μm 或600μm
‑
650μm。
[0052]
在某些实施方案中,治疗抑制细胞增殖和/或增强t细胞浸润。
附图说明
[0053]
图1a
‑
f.在np和mn中的apd
‑
1/cddp的表征。(a)在np中的 apd
‑
1/cddp表现出具有均匀分布的球形形态,如tem图像所示。(b)通过dls检测的粒度。(c)来自np的apd
‑
1在不同ph值的pbs中的释放曲线。(d)溶解性mn的sem图像。(e)mn尖端的更高放大倍率。(f) mn的荧光显微镜图像。使用liss rhod pe脂质标记np。误差条是样品的标准偏差(sd)(n=3)。
[0054]
图2a
‑
d.体外抗肿瘤谱和pd
‑
l1表达的图示。(a)用三种药物(cddp、在np中的cddp和在np中的apd1/cddp)处理的三种细胞系(fadu、 cal 27和scc
‑
vii)的ic50。(b)在24孔板中用100μm的pt浓度处理4 小时后细胞系的细胞摄取。(c)用pt浓度为100μm的游离cddp或 apd
‑1‑
cddp
‑
np处理细胞4小时。使用apo
‑
brdu
tm tunel分析试剂盒确定细胞凋亡和细胞周期,并通过流式细胞术对其都进行评价。(d)基于pi 的荧光强度评价细胞周期。使用或不使用lps处理scc vii细胞系和raw264.7细胞系两者。误差条代表三次独立实验的sd,通过单向anova计算统计学显著性。p值:***p<0.01;****p<0.0001。
[0055]
图3a
‑
c.体内抗肿瘤功效。(a)经过各种治疗的小鼠的代表性生物发光图像:在不同时间点(t1:第一次治疗后3天,t2:第二次治疗后3天,和t3:第3次治疗后3天)的(i)用pbs治疗的对照组(表示为pbs);(ii) 腹膜内(i.p.)注射cddp(表示为cddp);(iii)i.p.注射apd
‑
1(表示为apd
‑
1); (iv)i.p.注射apd1和cddp(表示为apd
‑
1 cddp);(v)i.p.注射 apd
‑1‑
cddp
‑
np(表示为apd1
‑
cddp
‑
np);(vi)cddp np负载的mn贴剂(表示为cddp
‑
np mn);(vii)apd
‑
1负载的mn贴剂(表示为apd
‑
1mn); (viii)apd
‑1‑
cddp
‑
np负载的mn贴剂(表示为apd
‑1‑
cddp
‑
np mn)。基于处死后的(b)肿瘤体积和(c)肿瘤重量评价抗肿瘤效率。一旦肿瘤体积达到10mm3,每组[(i)pbs;(ii)apd
‑
1;(iii)apd1 cddp;(iv) 在np中的apd
‑
1/cddp;(v)apd
‑
1mn;(vi)在np中的apd
‑
1/cddp mn] 就开始治疗。每组给予三次治疗,并持续三个周期。误差条代表每个组的 sd(n=7)。使用mann
‑
whitney u检验进行统计分析。p值:*p<0.05,***p <0.001。
[0056]
图4a
‑
d.肿瘤特异性细胞增殖和诱导的细胞凋亡。(a)各组肿瘤组织中的代表性ki
‑
67 ihc。(b)肿瘤组织中的tunel图像。(c)统计分析结果。ki
‑
67密度表示为阳性面积/总面积。(d)将细胞凋亡指数计算为绿色细胞数/总细胞数。每个条代表平均值
±
sd,n=7。使用mann
‑
whitney u检验进行统计分析。p值:*p<0.05,**p<0.01。
[0057]
图5a
‑
e.t细胞应答和免疫谱。(a)使用流式细胞术检测到的肿瘤组织中cd4 t细胞和cd8 t细胞浸润的代表性图像。(b)使用elisa在血清中检测到的ifn
‑
γ。(c)肿瘤细胞中
cd8 t细胞的定量分析。(d)肿瘤细胞中cd4 t细胞的定量分析。(e)总cd4 til中的cd4 foxp3 treg 的百分比。每个条代表平均值
±
sd,n=7。使用mann
‑
whitney u检验进行统计分析。p值:*p<0.05,**p<0.01。
[0058]
图6a
‑
d.每组中的全身作用。(a)整个实验期间的体重。血清中的(b) bun值和(c)总igg值。误差条基于7只小鼠的sd。(d)六组(对照组、 apd
‑
1、apd
‑
1 cddp、在np中的apd
‑
1/cddp、apd
‑
1mn和在np中的 apd
‑
1/cddp mn)的主要器官(肝、肺、肾和脾)的h&e染色。cddp组表现出严重的副作用,可以通过纳米封装和mn介导的递送来减轻。每个条代表七只小鼠的平均值
±
sd。使用mann
‑
whitney u检验进行统计分析。p 值:*p<0.05,***p<0.001。
[0059]
图7.由微针递送的免疫化学治疗的协同作用的示意图。将apd
‑
1和 cddp封装在np中,用于化学治疗和免疫治疗的组合。然后将np嵌入到 mn中用于透皮递送。apd
‑
1可以竞争性地阻断pd
‑
l1与pd
‑
1的结合,导致t细胞激活。同时,cddp的细胞内释放可以诱导对肿瘤细胞的直接细胞毒性。
[0060]
图8(a)
‑
(c).(a)通过蛋白质印迹测定的pd
‑
l1蛋白表达。(b) 使用taqman qpcr探针评价的mrna表达。(c)通过在肿瘤切片上的ihc 检测到的pd
‑
l1表达的代表性显微照片。阴性pd
‑
l1表达(部分或全部细胞膜染色小于1%);低pd
‑
l1表达(大约50%的膜被染色);高pd
‑
l1表达 (超过50%的细胞膜被染色)。
[0061]
图9.体内抗肿瘤功效。在不同时间点(t1:第一次治疗后3天,t2:第二次治疗后3天,和t3:第三次治疗后3天)用cddp和在np中的cddpmn进行不同治疗的小鼠的代表性生物发光图像。
[0062]
图10.全身作用。采用cddp和在np中的cddp mn的主要器官(肝、肺、肾和脾)的h&e染色。
具体实施方式
[0063]
1.透皮系统
[0064]
本发明提供了一种透皮递送装置,其包括用于递送包含免疫治疗剂和化学治疗剂的纳米颗粒的微针。
[0065]
透皮递送装置可以是可包含各种特征的贴剂形式。例如,所述装置可包括可以储存药剂并提供用于递送的药剂的储器,例如容器、多孔基质等。所述装置可以在装置本身内包括储器。例如,所述装置可包括可以携带一种或多种用于递送的药剂的空洞或多个孔。
[0066]
治疗剂可以通过部分或整个装置的降解或通过药剂从装置扩散而从装置释放。包含一种或多种药剂的制剂可以保留在储器内。适合用作不可渗透的背衬层的材料可以包括诸如聚酯、聚乙烯、聚丙烯和其他合成聚合物的材料。所述材料通常是可热密封或以其他方式可密封到背衬层上,以提供对储器内容物横向流动的屏障。
[0067]
2.微针
[0068]
微针(mn)被用于广泛的医学和科学应用。微针是一种可以穿透皮肤的角质层或粘膜用于透皮递送的微创装置。皮肤是高度活跃的免疫器官,包含大量的驻留抗原呈递细胞。刺穿富含免疫细胞的表皮的mn可以通过激活 t细胞来激发稳健的免疫应答。
[0069]
在一个实施方案中,微针由玻璃、金属、塑料或聚合材料形成,但不限于此。玻璃的类型包括但不限于具有或不具有内部细丝的硼硅酸盐玻璃、铝硅酸盐玻璃和石英。硼硅酸
盐通常用于包括微注射、膜片钳、微针抽吸等的应用中。在一些情况下,铝硅酸盐玻璃可优选用于微注射,因为它比硼硅酸盐玻璃更坚硬并且能够承受与微注射相关的力。然而,铝硅酸盐玻璃在比硼硅酸盐更高的温度下可延展,并且在较窄的温度范围内可工作。因此,由铝硅酸盐制成的微针尖端通常具有带有短锥形的细尖端的形状。与其他类型的玻璃相比,石英由于其纯度而具有优异的机械、电和光学质量性质,但可能更昂贵。任何上述类型的玻璃均适合用于本文提供的技术。其他类型的玻璃包括但不限于钠钙玻璃、中性玻璃、硅酸铝玻璃、铅玻璃、uv玻璃、x射线玻璃、密封玻璃等。也可以使用其他材料,例如金属形成微管/微针。金属包括但不限于不锈钢、钛合金、铜、铝、铬、形状记忆合金、镍钛合金、铂或镍。在这些实施方案中,金属可以被阳极氧化。在这种情况下,用于非粘附和颜色标记的合适试剂应该能够结合到金属尖端的表面或被修饰为能够结合到金属尖端的表面。塑料类型包括但不限于模制塑料和/或由以下生成的塑料:高密度聚乙烯(hdpe)、聚氯乙烯(pvc)、低密度聚乙烯(ldpe)、聚丙烯(pp)、聚苯乙烯或泡沫聚苯乙烯(ps)和其他塑料(包括聚碳酸酯、聚丙交酯、丙烯酸、丙烯腈丁二烯、苯乙烯、玻璃纤维和尼龙)。
[0070]
聚合材料也可用于增材制造并形成微针。聚合材料可以包括但不限于聚乙醇酸(pga)或聚醇酸(polycolic acid,pca)、聚乳酸或聚丙交酯(pla)、丙烯酸酯或适合用于3d制造或微打印技术或增材制造技术的任何其他类型的材料。pla是一种可生物降解的生物活性热塑性脂族聚酯,由于作为降解产物的乳酸在代谢上无害,与人具有高度的生物相容性,因此通常用于可植入医疗装置。pga也是一种可生物降解的热塑性线性脂族聚酯,可用于形成本文所述的微针,并通常用于生物医学和组织工程应用。任何适合用于3d 打印应用的材料,例如丙烯酸酯基团类材料,均可与用于本文提供的装置和技术。
[0071]
在某些实施方案中,可以使用3d打印来形成微针,并且一旦形成,微针就可以用色彩/颜色和非粘性涂层涂覆。在某些实施方案中,可以在制造过程中将色彩/颜色与液体聚合物混合并掺入打印的微针中。在某些实施方案中,微针可以由不同的材料形成,使得材料中的一种被着色,例如在多材料 dlw或其他增材制造技术中。通常,材料是生物相容的。
[0072]
在某些实施方案中,微针可包括任何合适的形状。例如,微针的尖端可以是有斜面的、尖的、钝的、圆形的、弯曲的或其他形状。在某些情况下,微针尖端侧面可以存在开口。在某些实施方案中,在用拉针器(pipette puller) 牵拉之前,毛细管的外径范围为0.5mm至2.00mm。如根据实验应用定制的,由毛细管形成的微针的内径范围可以为0.2μm至1.56mm,或两者之间的任何直径。在某些实施方案中,微针的外径可以为65
‑
180μm,而内径可以为 5
‑
30μm。许多形状和尺寸是可能的,并且所有这样的形状和尺寸都落入本文提供的实施方案的范围内。
[0073]
在某些实施方案中,微针的尺寸可以基于其形成材料、通过微针尖端待注射或转移的材料和/或微针插入到其中的材料来确定。因此,微针可以具有任何合适的长度和任何合适的直径。微针内壁可包括微结构或抗粘附材料/ 涂层,以防止将被注入对象的细胞或其他材料粘附到微针的内壁。微针外壁可包括抗堵塞材料/涂层,以防止当微针处于生物对象内部时在注射过程中微针尖端被细胞质或其他组分堵塞。
[0074]
在某些实施方案中,由生物相容性两亲嵌段共聚物组成的释放纳米颗粒的可溶性微针结构包含水溶性或脂溶性药物以便于其递送。在一个实施方案中,生物相容性两亲嵌段共聚物可以是在亲水结构域中的聚合物和在疏水结构域中的聚合物的二嵌段、三嵌段或
多嵌段共聚物。在某些实施方案中,在亲水结构域中的聚合物可以是选自以下的一种或多种:聚丙烯酸(paa)、聚乙二醇(peg)、聚丙烯腈(pan)、聚环氧乙烷(peo)、聚乙酸乙烯酯 (pvac)、聚乙烯醇(pva)和聚甲基丙烯酸甲酯(pmma)。
[0075]
在某些实施方案中,在疏水结构域中的聚合物可以是选自以下的一种或多种:聚环氧丙烷(ppo)、聚己内酯(pcl)、聚乳酸(pla)、聚乙醇酸(pga)、聚(乳酸
‑
共
‑
乙醇酸)(plga)、聚酸酐、聚原酸酯、聚酯、聚酯酰胺、聚苯乙烯、聚二烯、聚异丁烯、聚异丙基丙烯酰胺、聚硅氧烷、聚(2
‑
乙烯基萘)、聚(乙烯基吡啶和n
‑
甲基乙烯基吡啶鎓碘化物)和聚(乙烯基吡咯烷酮)。
[0076]
在某些实施方案中,生物相容性两亲嵌段共聚物优选为选自以下的一种或多种:泊洛沙姆(聚环氧乙烷
‑
聚环氧丙烷
‑
聚环氧乙烷)(peo
‑
ppo
‑
peo) 三嵌段共聚物、泊洛沙姆(聚环氧丙烷
‑
聚环氧乙烷
‑
聚环氧丙烷) (ppo
‑
peo
‑
ppo)三嵌段共聚物、聚环氧乙烷
‑
聚乳酸
‑
聚环氧乙烷 (peo
‑
pla
‑
peo)三嵌段共聚物、聚乳酸
‑
聚环氧乙烷
‑
聚乳酸 (pla
‑
peo
‑
pla)三嵌段共聚物、聚环氧乙烷
‑
聚乙醇酸
‑
聚环氧乙烷 (peo
‑
pga
‑
peo)三嵌段共聚物、聚乙醇酸
‑
聚环氧乙烷
‑
聚乙醇酸 (pga
‑
peo
‑
pga)三嵌段共聚物、聚环氧乙烷
‑
聚(乳酸
‑
共
‑
乙醇酸)
‑
聚环氧乙烷(peo
‑
plga
‑
peo)三嵌段共聚物、聚(乳酸
‑
共
‑
乙醇酸)
‑
聚环氧乙烷
‑ꢀ
聚(乳酸
‑
共
‑
乙醇酸)(plga
‑
peo
‑
plga)三嵌段共聚物、聚环氧乙烷
‑
聚己内酯
‑
聚环氧乙烷(peo
‑
pcl
‑
peo)三嵌段共聚物、聚己内酯
‑
聚环氧乙烷
‑ꢀ
聚己内酯(pcl
‑
peo
‑
pcl)三嵌段共聚物、聚环氧乙烷
‑
聚乳酸(peo
‑
pla) 二嵌段共聚物、聚环氧乙烷
‑
聚乙醇酸(peo
‑
pga)二嵌段共聚物、聚环氧乙烷
‑
聚(乳酸
‑
共
‑
乙醇酸)(peo
‑
plga)二嵌段共聚物和聚环氧乙烷
‑
聚己内酯(peo
‑
pcl)二嵌段共聚物。
[0077]
在某些实施方案中,生物相容性两亲嵌段共聚物更优选是泊洛沙姆(聚环氧乙烷
‑
聚环氧丙烷
‑
聚环氧乙烷)(peo
‑
ppo
‑
peo)三嵌段共聚物。
[0078]
在某些实施方案中,微针包含纳米颗粒,所述纳米颗粒包含一种或多种治疗剂。对所包含的药物没有特别限制,并且可以使用水溶性或脂溶性药物。可用的药物的实例可以包括选自以下的任一种:化学物质、佐剂、疫苗、蛋白质药物、肽药物、用于基因治疗的核酸分子、用于化妆品的活性物质和用于医疗用途的抗体,或其两种或多种的混合物。
[0079]
在某些实施方案中,基于干燥后微针的总重量,药物可以为0.0001至 50重量%,并且优选为0.01至20重量%。药物的含量可以根据药物的最小有效浓度和微针的类型不同而确定。
[0080]
在某些实施方案中,微针还可以包含增强结构中的药物稳定性和针强度的添加剂。添加剂可以选自以下的任一种:透明质酸、壳聚糖、聚乙烯醇、羧乙烯基聚合物、丙烯酰基乙烯基聚合物、葡聚糖、羧甲基纤维素、羟乙基纤维素、黄原胶、刺槐豆胶、乙烯
‑
乙酸乙烯酯聚合物、乙酸纤维素、丙烯酰基取代的乙酸纤维素、聚氨酯、聚己内酯、聚(乳酸
‑
共
‑
乙醇酸)(plga)、聚乳酸(pla)、聚乙醇酸(pga)、聚酸酐、聚苯乙烯、聚乙酸乙烯酯、聚氯乙烯(pvc)、聚氟乙烯(pvf)、聚乙烯基咪唑、氯磺酸聚烯烃、聚环氧乙烷、聚乙烯吡咯烷酮(pvp)、聚乙二醇(peg)、聚甲基丙烯酸酯、羟丙基甲基纤维素(hpmc)、乙基纤维素(ec)、羟丙基纤维素(hpc)、羧甲基纤维素和环糊精,或其两种或多种的混合物。
[0081]
在某些实施方案中,包含纳米颗粒的微针可以在插入体内上皮时溶解。
[0082]
在某些实施方案中,微针在水溶液中保持稳定的结构并且纳米颗粒溶解在水溶液
中,并且在疏水性药物递送期间容易地递送治疗剂以及增加药物在水溶液中的溶解度,从而促进疏水性药物的递送或一种或多种治疗剂的同时透皮递送。
[0083]
3.包含治疗剂的纳米颗粒
[0084]
本文提供了包含两种或更多种治疗剂的纳米颗粒。本文提供了脂质体纳米颗粒及其制备和使用方法。在某些实施方案中,纳米颗粒包含一种或多种脂质。在某些实施方案中,脂质是peg缀合的脂质,和任选的一种或多种在物理上和/或在化学上稳定所述颗粒的另外的材料。在某些实施方案中,脂质的浓度为约8摩尔%至约30摩尔%。脂质体可以通过本领域已知的任何方法来制备。在某些实施方案中,纳米颗粒的平均直径为约100nm至约300nm,优选为约100nm至约250nm,更优选为约100nm至约200nm。脂质体包含一种或多种待递送到表面的治疗剂、预防剂和/或诊断剂。在某些实施方案中,所述表面是粘膜表面,包括覆盖女性生殖道、胃肠道、肺、气道、鼻、结肠和眼睛的那些。为了有效地穿过粘膜表面递送治疗剂,药物或基因载体必须能够穿透粘液屏障,以避免粘液诱导的聚集和快速清除。
[0085]
纳米颗粒可以与一种或多种药学上可接受的赋形剂组合以制备药物制剂。纳米颗粒可以通过各种给药途径给予,例如肠内或肠胃外,以及局部或经肺。在一个实施方案中,纳米颗粒通过微针分配。在一个实施方案中,纳米颗粒通过透皮系统中的微针分配。在一个实施方案中,透皮系统是贴剂。
[0086]
在一个实施方案中,纳米颗粒通过反相微乳液制备。
[0087]
在某些实施方案中,纳米颗粒包含1,2
‑
二油酰基
‑
sn
‑
甘油
‑3‑
磷酸酯 (dopa)形成的双层,以实现与其他脂质的连接,所述其他脂质例如1,2
‑ꢀ
二油酰基
‑3‑
三甲基铵丙烷(dotap)、1,2
‑
二硬脂酰基
‑
sn
‑
甘油
‑3‑
磷酸乙醇胺
ꢀ‑
n
‑
[氨基(聚乙二醇)
‑
2000](铵盐)(dspe
‑
peg
‑
aa)和胆固醇。
[0088]
在某些实施方案中,纳米颗粒的直径为10至2000nm,优选为50至 1000nm。
[0089]
纳米颗粒还可以包含一种或多种稳定剂。稳定剂是纳米颗粒中的组分或另外的组分,其减少或防止囊泡去稳定化和/或调理作用以及伴随的包封的药剂或药物的释放。例如,稳定剂,例如胆固醇和其他材料,增强脂质双层的机械强度。其他材料包括脂质中的一种或多种。(多种)稳定剂的浓度为至少约5摩尔%,优选至少约10摩尔%,更优选至少约20摩尔%,最优选至少约30摩尔%。在一些实施方案中,稳定剂的浓度为约5摩尔%至约50摩尔%。在某些实施方案中,稳定剂的浓度为约25、50或70摩尔%。在一个实施方案中,稳定剂的浓度为约25摩尔%。在某些实施方案中,稳定剂是胆固醇,并且以如上所述的浓度存在。其他合适的稳定剂包括神经节苷脂。在其他实施方案中,稳定剂可以是peg缀合的脂质,因此不需要另外的一种或多种稳定剂。
[0090]
在某些实施方案中,纳米颗粒是物理上和化学上稳定的。如本文所使用的“物理上稳定的”是指粒度和/或多分散性在延长的时间段内保持恒定。在某些实施方案中,“物理上稳定的”是指颗粒的平均直径的变化在2、4、6、 8、12、16、20、24、30、36或48小时内小于10、9、8、7、6、5、4、3、 2或1%。在某些实施方案中,颗粒的平均直径的变化在48小时后小于10、 9、8、7、6、5、4、3或2%。在某些实施方案中,“物理上稳定的”是指颗粒的多分散性的变化在2、4、6、8、12、16、20、24、30、36或48小时内小于10、9、8、7、6、5、4、3、2或1%。在某些实施方案中,颗粒的多分散性的变化在48小时后小于10、9、8、7、6、5、4、3、2或1%。在某些实施方案中,纳米颗粒显示几乎没有或没有聚集,当引入粘液时保持良好的分散。
[0091]
4.治疗方法
[0092]
在一个实施方案中,本发明提供了一种将治疗剂递送到受试者的方法,所述方法包括:用微针穿透受试者的角质层,所述微针具有与包含一种或多种治疗剂的纳米颗粒流体连通的通道。在一个实施方案中,治疗剂以高生物利用度被递送穿过受试者的皮肤屏障。在一个实施方案中,所述方法用于将治疗剂透皮递送到受试者的血流。在一个实施方案中,治疗剂被递送到受试者的肿瘤。
[0093]
可以将纳米颗粒全身性引入待治疗的受试者中。如本文所使用的术语“全身性引入”是指整体上属于或影响受试者的纳米颗粒的任何引入,例如将纳米颗粒引入受试者的循环血液中。如前所述,纳米颗粒在靶区域中累积的机制可以是通过被动机制、主动机制或其组合。在被动机制中,纳米颗粒可以被注射或输注到血流中,并通过增强的通透性和滞留(“epr”)效应而积聚在靶区域或肿瘤部位。通过这种机制,被动靶向的颗粒在破坏的血管附近区域中的肿瘤中积聚。在一个实施方案中,将纳米颗粒通过透皮系统引入受试者中。在一个实施方案中,透皮系统是贴剂。在一个实施方案中,贴剂包含微针。
[0094]
通过这种机制,被动靶向的颗粒在破坏的血管附近区域中的肿瘤中积聚。在某些实施方案中,纳米颗粒通过增强的通透性和滞留(epr)效应优先积聚在肿瘤中,其中包含宽的内皮间连接、丰富的跨内皮通道、不完整或不存在的基底膜以及功能失调的淋巴管泄漏的肿瘤脉管系统有助于全身性注射的大分子和纳米颗粒被动外渗进入肿瘤。
[0095]
靶向肿瘤部位的主动机制包括纳米颗粒,所述纳米颗粒包含针对优先由靶细胞表达的细胞表面分子的抗体。这些颗粒可被插入血液中,使其选择性地积聚在靶区域中,并选择性地结合至靶区域中的细胞,所述细胞在其细胞表面上存在这样的分子。另外,血管靶向剂可用于主动靶向靶位点。类似地,主动靶向肿瘤内皮细胞的颗粒将积聚在内皮表面。
[0096]
当给予受试者时,本文所述的纳米颗粒表现出增强的转运。在一个实施方案中,纳米颗粒通过透皮系统上的微针给予。在一些实施方案中,纳米颗粒以一定的绝对扩散率移动穿过受试者身体的表面。在某些实施方案中,该表面邻近或接近诸如肿瘤或癌症的治疗区域。在某些实施方案中,颗粒可以在1s的时间标度下以至少1x104、2x104、5x104、1x103、2x103、5x103、 1x102、2x102、4x102、5x102、6x102、8x102、1x10、2x10、5x10、2、1、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μm2/s的扩散率传播。相反,非穿透性颗粒具有至少约1x104μm2/s的扩散率。
[0097]
纳米颗粒扩散通过受试者身体表面的能力也可以通过目测进行定性评价。在一些实施方案中,脂质的浓度为约10摩尔%,并且至少50、60、70、 80或90%的纳米颗粒在2小时时可移动,并且至少30、40、50、60或70%的纳米颗粒在15小时时可移动。在一个实施方案中,纳米颗粒显示几乎没有或没有聚集。在其他实施方案中,脂质的浓度为约20%,并且至少约75、 80、85、90、95、96、96、98或99%的纳米颗粒在2小时时可移动,并且至少约80、85、86、87、88、89、90、91、92、93、94、95、96、97、98 或99%的纳米颗粒在15小时时可移动。纳米颗粒分散良好,几乎没有聚集或没有聚集。
[0098]
通过利用本文所述的透皮递送方法,与皮下递送途径相比的比较生物利用度可以大于约20%、大于约30%或大于约35%。
[0099]
就高生物利用度而言,从循环中丢失的生物活性剂的浓度,例如,隔绝在人体器官,特别是与防御机制相关的器官中的生物活性剂的浓度低。在某些实施方案中,在递送药
剂后,例如在递送后约72小时,在淋巴结中发现的治疗剂的浓度可以小于约50纳克每克组织(ng/g),小于约40ng/g,小于约20ng/g,小于约10ng/g,小于约1ng/g或小于约0.6ng/g。在某些实施方案中,治疗的肿瘤或靶器官内的治疗剂的浓度大于约40
‑
50ng/g,大于约 25
‑
40ng/g或大于约15
‑
25ng/g。
[0100]
癌细胞不像正常组织细胞,因为缺少常规的细胞机制和行为,因此使得治疗的选择和产生的功效难以预测。特别地,受试者可以表现出耐药、产生的适应性耐药和/或对治疗无响应。耐药性是个问题并且因为一些癌细胞对癌症药物耐药,因此可能在化学治疗和免疫治疗中存活下来。癌症药物耐药性可能是由于癌细胞的癌症药物代谢增加,或者是由癌症药物膜转运蛋白将癌症药物转运出癌细胞的速率增加导致,使得细胞内癌症药物的浓度保持对癌细胞具有亚毒性。
[0101]
在一个实施方案中,本文提供的方法包括给予纳米颗粒以增强免疫治疗和化学治疗诱导的癌细胞死亡并降低与免疫治疗和化学治疗相关的毒性。在一个实施方案中,与单独给予免疫治疗剂和化学治疗剂时相比,给予包含含有免疫治疗剂和化学治疗剂的纳米颗粒的微针提供了协同作用。在一个实施方案中,纳米颗粒包含抗体和顺铂二者,其提供协同作用或协同效应,即当活性成分一起使用时所实现的作用大于分别使用化合物所产生的作用之和。可以给予另外的组合治疗,其可以提供进一步的协同作用。
[0102]
在某些实施方案中,本文提供的方法用于促进对于癌症的阳性治疗响应。关于癌症治疗的术语“阳性治疗响应”是指与所公开的包含例如抗体或其抗原结合片段、变体或衍生物的纳米颗粒的活性相关的疾病的改善和/或与疾病有关的症状的改善。因此,例如,疾病的改善可以表征为完全响应。“完全响应”是指在任何先前的测试结果标准化的情况下,不存在临床可检测的疾病。供选择地,疾病的改善可以归类为部分响应。“阳性治疗响应”包括减少或抑制癌症的进展和/或持续时间,减少或改善癌症的严重程度,和/或改善由给予所公开的纳米颗粒而导致的其一种或多种症状。
[0103]
在某些实施方案中,在给予本文公开的纳米颗粒之后,所述治疗提供一种、两种或三种或更多种结果:(1)稳定、减少或消除癌细胞群;(2)稳定或减少癌症生长;(3)破坏癌症形成;(4)根除、去除或控制原发性、区域性和/或转移性癌症;(5)降低死亡率;(6)无疾病、无复发、无进展和/或总体生存、持续时间或比率增加;(7)响应率增加、响应持续时间或响应或缓解的患者人数增加;(8)住院率降低,(9)住院时间减少,(10)保持癌症的大小,并且不增加或增加小于10%,优选小于5%,优选小于4%,优选小于2%,和(12)缓解的患者数量增加。
[0104]
可以使用诸如磁共振成像(mri)扫描、x射线放射成像、计算机断层扫描(ct)扫描、流式细胞术或荧光激活细胞分选仪(facs)分析、组织学、肉眼病理学和血液化学筛查技术来评估临床响应,包括但不限于通过 elisa、ria或色谱法可检测到的变化。
[0105]
本文还提供了一种组合治疗,其包括给予包含免疫治疗剂和化学治疗剂的纳米颗粒以及进一步给予另外的治疗。本文公开的方法包括使用分开的制剂或单一药物制剂的共同给药,以及以任一顺序连续给药。在某些实施方案中,纳米颗粒与其他药物组合给药,其中抗体或其抗原结合片段、变体或衍生物和(多种)治疗剂可以依次、以任何顺序或同时(即同时或在同一时间范围内)给药。
[0106]
5.治疗剂
[0107]
抗癌剂包括用于治疗恶性肿瘤例如癌性生长的药物。药物治疗可以单独使用,或与其他治疗(例如手术或放射治疗)组合使用。根据所涉及器官的性质,几种类型的药物可用于癌症治疗。例如,乳腺癌通常由雌激素刺激,并且可以用使性激素失活的药物治疗。同样,可以使用使雄激素(雄性激素) 失活的药物治疗前列腺癌。用于本发明的某些方法的抗癌剂尤其包括抗体 (例如,结合igf
‑
1r的抗体、结合egfr的抗体、结合her2的抗体或结合 cmet的抗体)、靶向igf1r的小分子、靶向egfr的小分子、靶向her2的小分子、抗代谢物、烷化剂、拓扑异构酶抑制剂、微管靶向剂、激酶抑制剂、蛋白质合成抑制剂、免疫治疗剂、激素治疗、糖皮质激素、芳香酶抑制剂、 mtor抑制剂、化学治疗剂、蛋白激酶b抑制剂、磷脂酰肌醇3
‑
激酶(pi3k) 抑制剂、细胞周期蛋白依赖性激酶(cdk)抑制剂、rlr9、cd289、酶抑制剂、抗trail、mek抑制剂等。
[0108]
在某些实施方案中,本文公开的纳米颗粒包含针对pd
‑
1(程序性死亡1 蛋白)、其两个配体pd
‑
l1(程序性死亡配体1)和/或pd
‑
l2,或ctla
‑
4 (细胞毒性t淋巴细胞抗原4蛋白)的抗体或其抗原结合片段。在某些实施方案中,抗pd
‑
1抗体是派姆单抗(keytruda.rtm.,以前是兰洛利珠单抗,也称为mk
‑
3475)或其抗原结合片段。在某些实施方案中,抗pd
‑
1抗体是纳武单抗(bms
‑
936558、mdx
‑
1106、ono
‑
4538,opdiva.rtm.)或其抗原结合片段。在某些实施方案中,抗pd
‑
l1抗体是bms
‑
936559或其抗原结合片段。在某些实施方案中,抗pd
‑
l1抗体是mpdl3280a。在某些实施方案中,抗pd
‑
1抗体是amp
‑
224(抗pd
‑
1fc融合蛋白)或其抗原结合片段。在某些实施方案中,抗pd
‑
l1抗体是medi4736或其抗原结合片段。
[0109]
在一个实施方案中,化学治疗剂选自索拉非尼(sorafenb)、瑞戈非尼、伊马替尼、艾瑞布林、吉西他滨、卡培他滨、美法仑、拉帕替尼、达拉非尼、苹果酸舒尼替尼(sutinib malate)、克唑替尼、依维莫司、tori西罗莫司 (torisirolimus)、西罗莫司、阿昔替尼、吉非替尼、阿那曲唑(anastrole)、比卡鲁胺、氟维司群、雷替曲塞(ralitrexed)、培美曲塞、醋酸戈舍瑞林、厄洛替尼、维罗非尼、维莫得吉(visiodegib)、柠檬酸他莫昔芬、紫杉醇、多西他赛、卡巴他赛、奥沙利铂、阿柏西普、贝伐单抗、曲妥珠单抗、帕妥珠单抗、美法仑22b、紫杉烷、博来霉素、美法仑、白花丹素、伊立替康、丝裂霉素
‑
c、米托蒽醌、smancs、多柔比星、聚乙二醇化多柔比星、folfori、5
‑
氟尿嘧啶、替莫唑胺、帕瑞肽、替加氟、吉美嘧啶、奥替拉西(oteraci)、伊曲康唑、硼替佐米、来那度胺、伊立替康(irintotecan)、表柔比星和罗米地辛。在某些实施方案中,化学治疗剂是顺铂、卡铂、氟尿嘧啶、长春花碱、吉西他滨、环磷酰胺、多柔比星、氨甲喋呤、紫杉醇、拓扑替康、依托泊苷、氨甲喋呤、索拉非尼、伊立替康、特罗凯或其组合。
[0110]
6.给药方式
[0111]
制备和向有其需要的受试者给予包含抗体或其抗原结合片段、变体或衍生物和顺铂的纳米颗粒的方法是本领域技术人员众所周知的或容易确定的。在某些实施方案中,以包含纳米颗粒和药物载体的组合物的形式提供纳米颗粒。在某些实施方案中,所述组合物是包含纳米颗粒、表面活性剂、油和水的局部组合物。在某些实施方案中,纳米颗粒组合物是微乳液。给药途径可以是例如口服、肠胃外、通过吸入或局部给药。本文所用的术语“肠胃外”包括例如静脉内、动脉内、腹膜内、肌内、皮下、直肠或阴道给药。然而,在与本文的教导相容的其他方法中,纳米颗粒可以直接递送至不良细胞群的部位,从而增加患病组织对治疗剂的暴露。在一个实施方案中,纳米颗粒经微针递送。
[0112]
其组合的给药途径可以是例如口服、肠胃外、通过吸入或局部给药。本文所使用的术语“肠胃外”包括例如静脉内、动脉内、腹膜内、肌内、皮下、直肠或阴道给药。然而,在与本文的教导相容的其他方法中,本发明的组合可以直接递送至不良细胞群的部位,从而增加患病组织对治疗剂的暴露。
[0113]
7.药物组合物
[0114]
在本发明中使用的药物组合物可以包含药学上可接受的载体,包括例如水、离子交换剂、蛋白质、缓冲物质和盐。防腐剂和其他添加剂也可以存在。载体可以是溶剂或分散介质。remington’s pharmaceutical sciences(mackpublishing co.)第16版(1980)中描述了用于本文公开的治疗方法的适合的制剂。在任何情况下,无菌注射溶液均可通过在适当的溶剂中以所需的量向本发明的治疗性组合中掺入活性化合物(例如,抗体或其抗原结合片段,变体或其具有化学治疗药物的衍生物,与其他活性剂组合),然后过滤灭菌来制备。此外,制剂可以以试剂盒的形式包装并出售。这样的制品可以具有标签或包装说明书,显示相关的组合物用于治疗患有疾病或障碍或易患疾病或障碍的受试者。
[0115]
肠胃外制剂可以是单次推注剂量、输注或负荷推注剂量,然后是维持剂量。这些组合物可以以特定的固定间隔或可变间隔给药,例如每天一次,或在“根据需要”的基础上给药。所述组合物可以作为单剂量、多剂量或在确定时间段内以输注给药。还可以调整剂量方案以提供最佳的期望反应(例如,治疗或预防反应)。
[0116]
用于治疗障碍,例如某些类型的癌症,包括例如结肠癌、黑色素瘤、乳腺癌、淋巴瘤、非小细胞肺癌、霍奇金淋巴瘤、非霍奇金淋巴瘤和伯基特淋巴瘤、卵巢癌、乳腺癌、头颈癌和胰腺癌的本发明的组合物的治疗有效剂量根据许多不同因素变化,包括给药方式、靶部位、患者的生理状态、患者是人还是动物、给予的其他药物,以及治疗是预防性还是治疗性的。通常,患者是人,但是也可以治疗包括转基因哺乳动物在内的非人哺乳动物。可以使用本领域技术人员已知的常规方法来滴定测量治疗剂量以优化安全性和功效。
[0117]
8.剂量
[0118]
在某些实施方案中,纳米颗粒以约1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg或约20mg/kg的浓度给药。在某些实施方案中,抗体或其抗原结合片段和顺铂以约1:1、1:2、1:3、 1:4、1:5、1:10、10:1、5:1、4:1、3:1、2:1或1:1的比例给药。在某些实施方案中,与未经治疗的受试者或采用单药疗法治疗的受试者相比,给予本文公开的治疗可以使存活率提高约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。在某些实施方案中,与未经治疗的受试者或采用单药疗法治疗的受试者相比,给予本文公开的纳米颗粒可以使存活率提高约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约 8倍、约9倍或约10倍。
[0119]
在某些实施方案中,纳米颗粒的有效剂量为每公斤患者体重约1纳克至每公斤患者体重约50毫克;或每公斤患者体重约1纳克至每公斤患者体重约5毫克;或每公斤患者体重约1纳克至每公斤患者体重约0.5毫克;或每公斤患者体重约10纳克至每公斤患者体重约0.5毫克;或每公斤患者体重约 20纳克至每公斤患者体重约100微克;或每公斤患者体重约10纳克至每公斤患者体重约10微克。在某些实施方案中,给药后患者血浆中的纳米颗粒为约5纳摩尔至约200微摩尔;或约10纳摩尔至约100微摩尔;或约20纳摩尔至约10微摩尔。
[0120]
实施例
[0121]
在一个实施方案中,本文公开了在治疗免疫治疗无响应的癌症中通过微针递送的apd
‑
1。还提供了负载有apd
‑1‑
cddp
‑
np的新型微针(图7),以促进协同的免疫化学治疗。我们使用具有免疫能力的鼠肿瘤同种移植模型证明了由微针激活的稳健的t细胞应答可以增强apd
‑
1和cddp两者的功效。通过微针激活的稳健的t细胞应答,apd
‑
1对t细胞中的pd
‑
1的阻断以及肿瘤细胞中cddp的直接细胞毒性,维持协同的免疫化学治疗作用。微针介导的宿主免疫反应可以增强apd
‑
1激活的t细胞免疫,进而将增强cddp 对癌细胞的直接杀伤作用。
[0122]
1.1apd
‑1‑
cddp
‑
np的表征
[0123]
通过反相微乳液合成了apd
‑1‑
cddp
‑
np。准备好的cddp前体,顺式
ꢀ‑
[pt(nh3)2(h2o)2]2(no3)2用于增加溶解度并进一步促进cddp的包封。1,2
‑ꢀ
二油酰基
‑
sn
‑
甘油
‑3‑
磷酸酯(dopa)形成双层以实现与其他脂质的连接,所述其他脂质例如1,2
‑
二油酰基
‑3‑
三甲基铵
‑
丙烷(dotap)、1,2
‑
二硬脂酰基
‑
sn
‑
甘油
‑3‑
磷酸乙醇胺
‑
n
‑
[氨基(聚乙二醇)
‑
2000](铵盐)(dspe
‑
peg
‑
aa) 和胆固醇。这些脂质提供肿瘤靶向性和选择性的优势
21,22
。此外,由于疏水和静电非特异性相互作用,apd
‑
1被负载到np的外层。使用酶联免疫吸附分析(elisa)试剂盒测定的apd
‑
1的包封效率为50%。在4℃下储存一个月内未检测到明显的抗体释放。如透射电子显微镜(tem)图像所示的, np表现出直径约为57.6nm的球形形态(图1a),其与动态光散射(dls) 的结果(图1b)一致。通过dls检测的平均直径为55.5nm。为了评价apd
‑
1 的释放,在37℃下在具有不同ph值的pbs中孵育np。在24小时内,在酸性环境中较高比例的apd
‑
1从np解离,而np内层中的pt有望持续释放 72h(图1c)。apd
‑1‑
cddp
‑
np促进了化学治疗剂和免疫治疗剂的协同递送。
[0124]
1.2apd1
‑
cddp
‑
np的体外抗肿瘤活性
[0125]
为了评估apd1
‑
cddp
‑
np的抗肿瘤功效,在fadu、cal 27和scc vii 细胞系中检测了细胞毒性、细胞摄取和细胞凋亡。单独的apd1不能诱导任何细胞毒性,即使将其添加到cddp中也未增强其体外抗癌功效。基于合成 cddp
‑
np的程序合成了apd
‑1‑
cddp
‑
np,其被赋予相同的优势。对于三种细胞系,np的半数最大抑制浓度(ic50)值均显著低于游离cddp的半数最大抑制浓度(图2a),并且在用100μm的药物处理细胞系4小时后检测到更多的pt(图2b)。总之,更多的药物被细胞吸收,经过脂质涂覆和纳米包封后,它们发挥了更高的药物功效。np增加了cddp的溶解度和其从内体的逃逸,并由于dotap的包封更多地避免了溶酶体降解,进一步增加了细胞系的药物摄取量。apd
‑
1主要用于抑制免疫检查点阻断(icb)和引起t 细胞活性。鉴于apd
‑
1在体外无效,与cddp
‑
np相比,apd
‑1‑
cddp
‑
np 在ic50和细胞摄取方面均未表现出显著差异。综上所述,apd
‑1‑
cddp
‑
np 对癌细胞系的体外细胞毒性与cddp
‑
np相同。
[0126]
此外,分别用游离cddp或apd
‑1‑
cddp
‑
np处理细胞系,然后使用 apo
‑
brdu试剂盒通过流式细胞术进行分析。dna链断裂时出现大量3’羟基末端,使用tunel技术用brdutp和末端脱氧核苷酸转移酶(tdt)对其进行标记。dna掺入后,可以通过抗brdu抗体检测到brdu。如图2c 所示,apd
‑1‑
cddp
‑
np诱导24.5%的细胞凋亡,而游离cddp仅诱导2.79%的细胞凋亡。该结果表明np触发了细胞系中可辨别的凋亡。此外,根据细胞周期分析,g2期的百分比显著降低,表明在apd
‑1‑
cddp
‑
np组中较低的细胞生长(图2d)。
[0127]
总之,np已经实现了较低的ic50值和较高的细胞摄取,并且它们可以通过减少g2
期的细胞数量来诱导更多的细胞凋亡。所有数据表明,np可以显著增强抗肿瘤功效,但是添加apd
‑
1未使医学作用内化。
[0128]
1.3溶解性mn的表征
[0129]
为了通过透皮递送靶向皮肤上的免疫区域,将药物进一步包封到溶解性 mn中。溶解性mn是按照模塑方法制造的。选择聚乙烯吡咯烷酮(pvp) 作为结构材料,是因为它提供生物相容性、强机械性质和高水溶性的优点。如扫描电子显微镜(sem)图像中所示的(图1d和1e),mn由9
×
9根针组成,针的高度为800μm,底部直径为约400μm。应用liss rhod pe脂质以标记np。mn的荧光图像进一步证实了治疗剂在mn尖端上的适当分布 (图1f)。所获得的mn可以在5分钟内完全溶解在水中,并且它们可以在 20分钟内溶解到小鼠皮肤中。将mn阵列以适当的强度压在小鼠皮肤上20 分钟后,可以观察到明显的针孔,并且尖端可以在此过程中溶解。此外,具有针孔的皮肤区域可以在不到一天的时间内恢复,而不引起任何皮肤溃疡。此外,在4℃下储存一个月后,负载的apd
‑
1和np的生物活性不降低。总之,结果表明这种类型的pvp结构化的mn可以介导药物递送,具有在皮肤中的均匀分布和高溶解度以及高机械强度。
[0130]
1.4体内和体外pd
‑
l1表达
[0131]
pd
‑
l1是apd
‑
1和apd
‑
l1治疗的逻辑生物标志物
23,24
。scc vii细胞系是自发出现在c3h小鼠腹壁的鼠鳞状细胞癌细胞系。我们分别通过蛋白质印迹和qpcr确定pd
‑
l1蛋白和mrna是否在scc vii细胞系中表达。 lps刺激后,raw 264.7表现出更高的pd
‑
l1表达;然而,在scc vii细胞中未观察到表达。使用免疫组织化学(ihc)进一步检测了pd
‑
l1是否在具有免疫能力的鼠肿瘤同种移植模型中表达。小于1%的部分或完全膜染色被认为是pd
‑
l1的阴性表达。另外,将1%到49%的染色率定义为低pd
‑
l1表达,而高pd
‑
l1表达代表染色率大于50%的那些
25
。根据上述标准,85%的肿瘤阳性表达pd
‑
l1,其中50%表现出高pd
‑
l1表达。
[0132]
1.5体内抗肿瘤功效
[0133]
我们进一步研究了对具有免疫功能的小鼠肿瘤同种移植模型的肿瘤抑制。将scc vii细胞系皮下接种到c3h/hej小鼠的右侧腹以获得浅表肿瘤。将小鼠分为8组,包括(i)用pbs治疗的对照组(表示为pbs);(ii)腹膜内(i.p.)注射cddp(表示为cddp);(iii)i.p.注射apd
‑
1(表示为apd
‑
1); (iv)i.p.注射apd1和cddp二者(表示为apd
‑
1 cddp);(v)i.p.注射 apd
‑1‑
cddp
‑
np(表示为apd1
‑
cddp
‑
np);(vi)cddp np负载的mn贴剂(表示为cddp
‑
np mn);(vii)apd
‑
1负载的mn贴剂(表示为apd
‑
1mn); (viii)apd
‑1‑
cddp
‑
np负载的mn贴剂(表示为apd
‑1‑
cddp
‑
np mn)。在治疗前和每次治疗后3天使用游标卡尺监测肿瘤体积。此外,使用生物发光图像再次证实了肿瘤生长(图3a)。用pbs治疗的小鼠显示出自然的肿瘤生长。与对照组相比,用cddp治疗的小鼠表现出有限的治疗功效,肿瘤重量显著降低,但肿瘤体积无差异。尽管85%的肿瘤阳性表达了pd
‑
l1,但 apd
‑
1全身治疗引起的抑制作用微不足道。apd
‑
1是一种可以阻断 pd
‑
1/pd
‑
l1轴以更新细胞毒性t细胞的免疫药物。但是,apd
‑
1的无效治疗作用可能是由于以下原因。首先,更新的t细胞可能过于消耗,使它们显示受损的效应子功能,增殖潜力有限
26
。第二,癌症抗原可能被“掩盖”;因此,它们不能被t细胞识别
27
。第三,肿瘤微环境可能包含多种抑制性免疫细胞,例如肿瘤相关的巨噬细胞,其迫使t细胞具有不良作用
28
。尽管确切原因不清楚,该研究中的动物模型对全身性apd
‑
1免疫治疗无响应。
[0134]
然而,由mn贴剂递送的apd
‑
1显示出显著的抗癌作用。apd
‑
1mn组的肿瘤体积(418
±
66mm3)比apd
‑
1全身注射组的肿瘤体积(90.252
±
39.343 mm3)显著减小,p值小于0.05。与apd
‑
1全身注射组的肿瘤重量(0.443
±
0.083 g)相比,apd
‑
1mn组的肿瘤重量(0.05
±
0.017g)降低了8倍(p<0.001)。皮肤是高度活跃的免疫器官,其包含大量的驻留抗原呈递细胞。已经报道, mn通过使抗原递送靶向皮肤而被应用于增加疫苗的免疫原性
29
,并且mn 可以通过激活t细胞来诱导免疫反应
30
。我们的结果表明,mn递送的apd
‑
1 可以在对apd
‑
1全身治疗无响应的动物模型中实现有效的抗肿瘤作用。这代表了用于免疫治疗无响应的癌症的有前途的治疗策略。
[0135]
本文公开的是,apd
‑
1 cddp组比apd
‑
1或cddp组表现出更大的肿瘤消退作用(p<0.05,图3)。值得注意的是,apd
‑1‑
cddp
‑
np可以向小鼠协同递送化学治疗药物和免疫治疗药物两者,并且与在apd
‑
1 cddp组中相比,对肿瘤生长的抑制更显著(p<0.01,图3)。apd
‑1‑
cddp
‑
np组的肿瘤重量为0.099
±
0.03g,而在apd
‑
1 cddp组中其为0.219
±
0.061g(p <0.01)。在apd
‑
1 cddp组中的肿瘤体积为192.799
±
79.824mm3,而在 apd
‑1‑
cddp
‑
np组中其仅为93.246
±
36.017mm3(p<0.05)。mn递送的 cddp
‑
np比apd
‑1‑
cddp
‑
np表现出更高的抗肿瘤功效,这证实了mn的有前景的抗肿瘤功效。此外,与任何其他组相比,apd
‑1‑
cddp
‑
np mn组显示出最显著的肿瘤消退作用。与apd
‑1‑
cddp
‑
np组相比,在apd
‑1‑
cddp
‑
npmn组中的肿瘤体积(18.312
±
8.286mm3)和肿瘤重量(0.012
±
0.005g) 两者均显著降低(分别为p<0.05和p<0.001)。这些结果证明,mn为化学治疗和免疫治疗药物的透皮共同递送提供了非常有前景的工具。
[0136]
通过在福尔马林固定的石蜡包埋的肿瘤组织切片中的ihc进一步证实了细胞增殖。用cddp治疗的小鼠实现了延迟的肿瘤生长,其中25%的细胞继续增殖,然而用apd
‑
1治疗的小鼠仍然表现出大约70%的充足的细胞增殖。肿瘤浸润淋巴细胞(til)如cd4 细胞和cd8 浸润肿瘤组织,并在apd
‑
1 治疗后开始增殖。我们从图4a和4c中得出结论,cddp可以抑制细胞增殖,并且apd
‑
1可以增强t细胞浸润。通过mn贴剂递送的apd
‑
1可以放大结果。til攻击肿瘤组织并随后杀死肿瘤细胞。通过流式细胞术进一步证实了这些增殖的细胞是t细胞还是肿瘤细胞。另外,通过原位tunel分析评估肿瘤细胞凋亡(图4b和4d)。apd
‑
1mn和apd
‑1‑
cddp
‑
np mn组中的细胞凋亡指数分别为61.4%
±
12.1%和73.2%
±
11.6%,显著高于在cddp 组(14.4%
±
5.3%,p<0.01)和apd
‑
1组(5.4%
±
2.7%,p<0.01)中的细胞凋亡指数。这些数据进一步证实了我们的假设,即mn可以激发t细胞活性,然后通过t细胞诱导细胞凋亡。这些结果表明,肿瘤抑制是通过肿瘤细胞凋亡介导的。总之,apd
‑1‑
cddp
‑
np mn不仅可以增加活化t细胞的数量,而且可以杀死肿瘤细胞。
[0137]
1.6t细胞应答和免疫谱
[0138]
为了评价t细胞应答和免疫谱,处死后收集肿瘤组织和血液。作为icb 的apd
‑
1可以是til的正调节剂。通过流式细胞术评估cd4 t细胞和cd8 t细胞向肿瘤细胞的浸润。如图5d所示,分别在对照组和cddp组中仅检测到4.92%和4.478%的cd8 t细胞。相比之下,与对照组中的t细胞浸润相比,用apd
‑
1或apd
‑
1 cddp组治疗的小鼠表现出4倍的t细胞浸润。此外,在apd
‑1‑
cddp
‑
np(cd8 为45.95%,cd 4 为24.31%)和apd
‑
1mn 组(cd8 为47.98%,cd 4 为37.50%)中均检测到活化的cd8 t细胞和 cd4 t细胞显著增加,而在apd
‑
1组中仅检测到12.13%的cd8 t细胞和 15.0%的cd4 t细胞,表明在纳米包封或透皮递送后t细胞显著浸润了肿瘤细胞。更重要的是,与其他组相比,mn介导的apd
‑1‑
cddp
‑
np表现出最高的t
细胞浸润(肿瘤细胞中75.95%的cd8 t细胞)。这些结果与ihc 检测的ki
‑
67一致。效应t细胞的增加与肿瘤消退功效相关,表明活化的t 细胞正在攻击肿瘤细胞。为了揭示体内细胞机制,使用elisa试剂盒确定了小鼠血清中ifn
‑
γ和tnf
‑
α的产生。未检测到tnf
‑
α水平的显著差异;然而,ifn
‑
γ表现出与cd8 t细胞正相关(图5b)。pbs和cddp处理的小鼠显示ifn
‑
γ水平低于其他五组。纳米包封后,apd
‑
1导致更多的ifn
‑
γ产生。值得注意的是,mn介导的递送系统可以对ifn
‑
γ表达做出更多贡献;在apd
‑1‑
cddp
‑
np组中,mn组显示最高的ifn
‑
γ表达。此外,分析了 cd4 foxp3 t细胞的浸润,并且三个mn组显示出调节性t细胞的显著减少(图5e)。
[0139]
综上所述,由mn激活的细胞毒性t细胞应答增加可以解释为什么负载有apd
‑
1或apd
‑1‑
cddp
‑
np的mn在对apd
‑
1全身治疗无响应的动物模型中显示出强大的抗癌作用。通过mn贴剂递送的apd
‑1‑
cddp
‑
np可以使更多的t细胞稳健,然后浸润到肿瘤部位,以及向肿瘤部位释放化学治疗药物,产生协同抗癌功效。
[0140]
1.7全身毒性和副作用
[0141]
化学治疗剂的副作用严重限制了其临床应用,并进一步导致了不理想的结果。为了评估这些治疗的全身毒性和副作用,我们记录了体重,并分别使用尿素氮检测试剂盒和总igg elisa试剂盒测定了血清中的血液尿素氮 (bun)值和总免疫球蛋白g(igg)值。无论是否添加apd1,用cddp 治疗的小鼠均表现出严重的体重减轻。由于癌症恶病质,注射pbs或cddp 的小鼠在最后一次注射后表现出体重减轻,而用mn治疗的小鼠在整个实验过程中没有体重减轻(图6a)。bun值的正常范围是12mg ml
‑1至33mgml
‑1。如图6b中所示,用cddp或cddp和apd
‑
1治疗的小鼠的bun值超出正常范围。纳米包封后,apd
‑1‑
cddp
‑
np组中的某些小鼠的bun值在正常范围内,而与apd
‑
1加cddp组相比没有统计学意义。值得注意的是,在所有mn贴剂组中以及在对照组中的bun值均在正常范围内,表明mn 可以是一种安全的递送系统,不引起肾毒性。此外,cddp导致igg严重降低,而向cddp添加apd
‑
1可以在一定程度上恢复下降趋势。值得注意的是,与其他组相比,mn组显示出显著增加的igg值(p<0.001)(图6c)。
[0142]
处死后收集每组的肝、肺、肾和脾脏进行苏木精和曙红(h&e)染色,以分析药物是否诱导对这些器官的毒性(图6c)。光学显微镜分析显示,在小鼠肝脏切片中,在cddp和apd1加cddp组中肝实质中发现了一些改变。显微镜视野显示一些坏死性肝细胞的区域、炎性细胞浸润、胆管增生和肝细胞肿胀。另外,在这两个组中的充血比在对照组中稍微更明显,并且肝小叶的结构也混淆了。相比之下,apd
‑1‑
cddp
‑
np组一般表现出正常的结构,肝索轻微解体,肝小叶的结构也不完全清楚。在apd
‑
1、apd
‑
1mn和 apd
‑1‑
cddp
‑
np mn组中,肝实质与对照组中的肝实质非常相当。对于肺切片,与对照组相比,在cddp、apd
‑
1加cddp和apd
‑1‑
cddp
‑
np组中都观察到肺泡弥漫性损伤和严重的炎症浸润。其他组显示正常的微观肺结构。关于肾毒性,cddp组和apd
‑
1加cddp组中小鼠的肾脏的显微镜检查显示出严重的毒性肾小管坏死。该发现的特征是肾小球塌陷和系膜细胞与周围的肾小管融合,加上鲍氏囊塌陷、肾小囊腔消失和分散的淋巴细胞浸润。相比之下,在用apd
‑
1、apd
‑
1mn和apd
‑1‑
cddp
‑
np mn治疗的小鼠中没有肾损伤的迹象。肾脏的形态学特征与对照组的形态学特征相似。至于cddp组中的脾脏,白髓明显减少,动脉周围淋巴鞘消失,并伴有更多的嗜中性粒细胞浸润,红髓和白髓的边界不清楚。在apd
‑
1 cddp和apd
‑1‑
cddp
‑
np 组中,白髓面积减少,动脉周围淋巴
spectro arcos,kleve,德国)监测的铂(pt)浓度调节至200mm;因此获得顺式
‑
[pt(nh3)2(h2o)2]2(no3)2前体;将800mm kcl水溶液和200mm顺式
‑
[pt(nh3)2(h2o)2]2(no3)2分别添加到由环己烷/co
‑
520(71%:29%, v:v)和环己烷/triton
tm x
‑
100/己醇(75%:15%:10%,v:v:v)(3:1)组成的微乳液中。随后,将20mm dopa添加到前体溶液中,并搅拌20分钟,然后将两种溶液混合。30分钟后,将乙醇加入溶液中,并以12000g离心15 分钟以上。用乙醇洗涤至少三遍后,将颗粒重新分散到氯仿中,并将脂质(如 dotap、dspe
‑
peg
‑
aa和胆固醇)添加到溶液中。随后,蒸发氯仿,并将颗粒分散在di水中。最终,将100μg apd
‑
1添加到在4℃下搅拌过夜的1.0 ml np中,以获得apd
‑1‑
cddp
‑
np。通过离心收集np,然后重悬于di水中。
[0151]
2.4apd
‑1‑
cddp
‑
np的表征
[0152]
使用透射电子显微镜(tem,cm100,philips electron optics,eindhoven,荷兰)观察apd
‑1‑
cddp
‑
np的形态。通过动态光散射粒度分析仪(nanotracwave ii,microtrac,montgomeryville,pa,美国)检测粒度。基于pt含量确定cddp的负载能力,并通过icp
‑
oes监测pt含量。另外,使用大鼠总 igg elisa试剂盒(thermo fisher scientific,美国)检测apd
‑
1的负载能力。为了测量体外apd
‑
1释放曲线,在37℃下将np添加到各种ph值为4.1和 7.4的磷酸盐缓冲的盐水(pbs)中。此外,收集10μl培养基进行测试,并在预定时间点添加10μl新培养基。使用大鼠总igg elisa试剂盒(thermofisher scientific,美国)确定apd
‑
1的量。
[0153]
2.5apd
‑1‑
cddp
‑
np的体外抗肿瘤活性
[0154]
2.5.1细胞毒性
[0155]
将fadu、cal 27和scc vii细胞系以每孔1
×
104个细胞的密度接种到96孔板中,并培养24小时。然后将细胞用各种浓度的cddp、apd
‑
1、 cddp
‑
np或apd
‑1‑
cddp
‑
np再处理24小时。使用细胞计数试剂盒
‑
8 (cck
‑
8,dojindo,tokyo,日本)确定处理过的细胞的细胞活力,并使用 spss软件(v.24.0,ibm spss,chicago,il,美国)计算ic50。
[0156]
2.5.2细胞摄取
[0157]
为了检测细胞摄取,将fadu和scc vii细胞系以每孔5
×
105个细胞的密度接种到24孔板中以检测细胞摄取。在37℃下用浓度为100μm pt的 cddp、cddp
‑
np或apd
‑1‑
cddp
‑
np处理细胞4小时。随后,将细胞用磷酸盐缓冲溶液(pbs)洗涤两次,并使用69%hno3裂解。将水添加到消化的溶液中,将hno3稀释至2%,然后通过icp
‑
oes测定pt的含量。
[0158]
2.6细胞凋亡与细胞周期
[0159]
将细胞放置在6厘米的培养皿中,并用cddp和apd
‑1‑
cddp
‑
np处理, pt浓度为100μm。使用apo
‑
brdu
tm
转移酶dutp缺口末端标记(tunel) 分析试剂盒(thermo fisher scientific,美国),用流式细胞术检测细胞凋亡,并使用碘化丙啶(pi,thermo fisher scientific,美国)遵循制造商的方案确定细胞周期的阶段。染色前将细胞用1%多聚甲醛(pfa)或乙醇固定,染色后立即通过流式细胞术(bd facsverse
tm
,bd,franklin lake,nj,美国)进行分析。使用flowjo(7.6.1,bd,美国)分析所有数据。
[0160]
2.7溶解性mn的制造
[0161]
使用注塑方法,用聚二甲基硅氧烷(pdms,sylgard 184,dow corning, mi,美国)制备mn模具。将pdms及其搭配的固化剂以10:1的重量比共混,然后均匀搅拌。pdms混合物溶液中的气泡必须通过以7000rmp离心 10分钟来去除。在没有气泡的情况下将su
‑
8母版放置
在pdms溶液的中间底部,针的尖端朝上。在约70℃的温度下,将放入pdms溶液中的su
‑
8 母版干燥24小时,以形成pdms模具。然后将pdms模具与su
‑
8母模具分离,并准备用作制备mn的模具。之后,将1.5g聚乙烯吡咯烷酮(pvp, mw~360k,sigma
‑
aldrich,美国)溶解在10ml di水中。将指定重量的apd
‑
1 或apd
‑1‑
cddp np粉末添加到15%(w/w)pvp溶液中,并将0.1ml混合的pvp溶液放入mn模具中,然后以4000rpm离心5分钟以确保混合的溶液填充空腔。将mn贴剂在带有恒温空气循环系统的烤箱中于40℃下干燥 24小时。然后将干燥的mn贴剂准备从模具上剥离下来,用于进一步使用。
[0162]
2.8pd
‑
l1的体外和体内表达
[0163]
通过蛋白质印迹和定量聚合酶链式反应(qpcr)检测scc vii细胞系的体外pd
‑
l1表达。选择脂多糖(lps,大肠杆菌lps,sigma,美国)刺激的raw 264.7细胞作为阳性对照。将scc vii和raw 264.7细胞用10μg ml
‑1lps处理4h。随后,使用具有halt蛋白酶和磷酸抑制剂的ripa裂解缓冲液(thermo fisher scientific,美国)裂解细胞。使用pierce
tm bca蛋白质分析试剂盒(thermo fisher scientific,美国)测定蛋白质含量。将总共 30μg蛋白质负载到sds
‑
page上并转移到pvdf膜上。在用5%在含有0.1% tween 20的tris缓冲的盐水(tbs)中的脱脂牛奶封闭后,将膜与一抗(抗 pd
‑
l1和抗β
‑
肌动蛋白,abcam,美国)在4℃下一起孵育过夜。然后将膜用tbs/tween 20洗涤三遍,然后在室温下在hrp缀合的二抗(cell signalingtechnology,danvers,ma,美国)中孵育2h。最后,在与pierce
tm ecl 蛋白质印迹底物(thermo fisher scientific,美国)一起孵育后,使用chemidocxrs系统(biorad,hercules,ca,美国)观察膜。使用rneasy mini试剂盒(qiagen,hilden,德国)分离细胞裂解液中的总rna。按照制造商的方案,使用superscript
tm iii逆转录酶(thermo fisher scientific,美国)从 rna逆转录cdna。然后通过fast advanced master mix(thermofisher scientific,美国)将cdna应用于定量合成pcr产物。使用 steponeplus
tm
实时pcr系统(applied biosystems,foster city,ca,美国) 进行pcr扩增。检测pd
‑
l1的基因表达,并应用β
‑
肌动蛋白以归一化靶基因的拷贝数。
[0164]
对于pd
‑
l1表达的体内检测,处死后收集一部分肿瘤组织,并固定在 4%pfa中。然后将组织包埋在石蜡中,切成5μm的厚度。去石蜡和复水后进行ihc。抗原修复后,将切片与一抗兔抗pd
‑
l1(abcam,美国)在4℃下一起孵育过夜。然后应用兔特异性hrp/dab检测ihc试剂盒(abcam,美国)检测pd
‑
l1的表达。苏木精用于复染。最终,使用光学显微镜和照相术(eclipse lv100pol,nikon,tokyo,日本)使切片可视化,并使用imagej软件(nih,bethesda,md,美国)分析图像。
[0165]
2.9mn的体内抗肿瘤活性
[0166]
2.9.1小鼠和体内肿瘤模型
[0167]
雄性和雌性c3h/hej小鼠购自the jackson laboratory(bar harbor,me,美国),并在香港大学的实验动物单元饲养。所有动物程序均按照活体动物教学与研究应用委员会(the committee on the use of live animals in teachingand research,culatr,hku)批准的方案进行。通过将悬浮在100μl hanks 平衡盐溶液(hbss,gibco,美国)中的1
×
106scc vii
‑
luc细胞注射到小鼠右侧腹,建立具有免疫能力的鼠肿瘤同种移植模型。64只小鼠随机分为8 组,包括:(i)对照组,其用pbs治疗;(ii)腹膜内注射cddp(表示为 cddp);(iii)腹膜内注射apd
‑
1(表示为apd
‑
1);(iv)一侧注射cddp,另一侧注射apd
‑
1(表示为apd
‑
1 cddp);(v)apd
‑1‑
cddp
‑
np注射(表示为np);(vi)通过mn递送lcc np(表示为lcc np mn);(vii)apd
‑
1 负载的mn(表示为apd
‑
1mn);(viii)apd
‑1‑
cddp
‑
np负载的mn(表示为np mn)。一旦肿瘤体积达到10mm3,就给予治疗,并且每3天给予每次治疗并持续3个周期。通过体内成像系统
–
spectrum(perkin elmer,waltham, ma,美国)收集生物发光图像。每三天通过生物发光信号和游标卡尺二者监测肿瘤大小。肿瘤体积计算为0.5
×
长径
×
短径2。处死后也测量肿瘤体积和肿瘤湿重。根据ihc方案,使用抗ki67(abcam,美国)在切片的肿瘤组织中测定肿瘤增殖。
[0168]
2.10全身免疫作用
[0169]
2.10.1血液
[0170]
从小鼠收集血液并保存在抗凝管(血液收集管,k3ek3edta,greiner bio
‑
one international,澳大利亚)中。将血液在4℃下以 1500g离心10分钟,然后将血浆转移到新的eppendorf管中。在4℃下以 2000g离心15分钟后,收集上清液以获得小鼠血清。分别使用小鼠ifn
‑
γ elisa试剂盒(thermo fisher scientific,美国)和小鼠tnf
‑
αelisa试剂盒(thermo fisher scientific,美国)检测血清中的ifn
‑
γ和tnf
‑
α。
[0171]
2.10.2肿瘤组织
[0172]
从每只小鼠收集一块肿瘤用于流式细胞术。完成后,将组织用pbs冲洗并保持在4℃的pbs中。将肿瘤组织切成非常小的块,并通过100μm细胞过滤器(bd falcon,美国)筛分。随后,使用注射器的柱塞端按压切片的组织。倒出上清液,将团粒重新悬浮在流式细胞仪染色缓冲液(pbs加10% fbs)中。将该溶液分到两个容量为300μl的eppendorf管中,然后将1μl 一抗单独加入两个管中的一个。使用的三种一抗是兔抗cd4(abcam,cambridge,ma,美国),大鼠抗cd8(abcam,美国)和小鼠抗foxp3(abcam,美国)。将二抗,即alexa488山羊抗兔igg(h&l)(美国abcam),山羊抗小鼠igg(h&l)
‑
pe和alexa647山羊抗大鼠igg(h&l) (abcam,美国),以1:400的比例稀释到流式细胞仪染色缓冲液中,并在加入到样品中之后在室温下避光孵育15分钟。
[0173]
2.11毒性和副作用研究
[0174]
处死后收集肝、肾、脾和肺,并固定在4%pfa中。在包埋到石蜡中后,将组织切成5μm切片,用于h&e染色。使用偏光显微镜(eclipselv100pol,日本)收集组织的图像。分别使用尿素氮检测试剂盒(thermofisher scientific,美国)和小鼠igg总elisa试剂盒(thermofisher scientific,美国)检测血清中的bun和总igg水平。
[0175]
2.12统计分析
[0176]
所有统计分析均使用ibm spss statistics 25.0进行,包括单向anova、多次t检验或曼
‑
惠特尼(mann
‑
whitney)u检验。定量数据表示为平均值
±
标准偏差(sd)。p值<0.05被认为是统计学上显著的。
[0177]
参考文献
[0178]
1.naiing,a.,immunotherapy.springer international publishing ag:2017.
[0179]
2.topalian,s.l.;drake,c.g.;pardoll,d.m.,immune checkpoint blockade:a common denominator approach to cancer therapy.cancer cell 2015,27(4),450
‑
61.
[0180]
3.ni,l.;dong,c.,new checkpoints in cancer immunotherapy. immunological reviews 2017,276(1),52
‑
65.
kalari,k.r.;suman,v.j.;weinshilboum,r.;wang,l.;boughey,j.c.;goetz, m.p.;nakamura,y.,clonal expansion of antitumor t cells in breast cancer correlates with response to neoadjuvant chemotherapy.international journal of oncology 2016,49(2),471
‑
8.
[0191]
14.fridman,w.h.;zitvogel,l.;sautes
‑
fridman,c.;kroemer,g.,the immune contexture in cancer prognosis and treatment.nature reviews clinical oncology 2017,14(12),717
‑
734.
[0192]
15.tao,z.;muzumdar,m.d.;detappe,a.;huang,x.;xu,e.s.;yu,y.; mouhieddine,
[0193]
16.t.h.;song,h.;jacks,t.;ghoroghchian,p.p.,differences in nanoparticle uptake in transplanted and autochthonous models of pancreatic cancer.nano letters 2018,18(4),2195
‑
2208.
[0194]
17.topalian,s.l.;weiner,g.j.;pardoll,d.m.,cancer immunotherapy comes of age.journal of clinical oncology 2011,29(36),4828
‑
36.
[0195]
18.ye,y.;wang,j.;hu,q.;hochu,g.m.;xin,h.;wang,c.;gu,z., synergistic transcutaneous immunotherapy enhances antitumor immune responses through delivery of checkpoint inhibitors.acs nano 2016,10(9), 8956
‑
8963.
[0196]
19.wang,c.;ye,y.;hochu,g.m.;sadeghifar,h.;gu,z.,enhanced cancer immunotherapy by microneedle patch
‑
assisted delivery of anti
‑
pd1 antibody.nano letters 2016,16(4),2334
‑
2340.
[0197]
20.xu,j.;xu,b.;tao,j.;yang,y.;hu,y.;huang,y., microneedle
‑
assisted,dc
‑
targeted codelivery of ptrp
‑
2 and adjuvant of paclitaxel for transcutaneous immunotherapy.small(weinheim an der bergstrasse,germany)2017,13(28),1
‑
13.
[0198]
21.lan,x.;she,j.;lin,d.
‑
a.;xu,y.;li,x.;yang,w.
‑
f.;lui,v.w.y.;jin, l.;xie,x.;su,y.
‑
x.,microneedle
‑
mediated delivery of lipid
‑
coated cisplatin nanoparticles for efficient and safe cancer therapy.acs applied materials& interfaces 2018,10(39),33060
‑
33069.
[0199]
22.zhang,c.;jugold,m.;woenne,e.c.;lammers,t.;morgenstern,b.; mueller,m.m.;zentgraf,h.;bock,m.;eisenhut,m.;semmler,w.;kiessling, f.,specific targeting of tumor angiogenesis by rgd
‑
conjugated ultrasmall superparamagnetic iron oxide particles using a clinical 1.5
‑
t magnetic resonance scanner.cancer research 2007,67(4),1555
‑
62.
[0200]
23.radwan,a.a.;alanazi,f.k.,targeting cancer using cholesterol conjugates.saudi pharmaceutical journal 2014,22(1),3
‑
16.
[0201]
24.gibney,g.t.;weiner,l.m.;atkins,m.b.,predictive biomarkers for checkpoint inhibitor
‑
based immunotherapy.the lancet.oncology 2016,17(12), e542
‑
e551.
[0202]
25.topalian,s.l.;taube,j.m.;anders,r.a.;pardoll,d.m., mechanism
‑
driven biomarkers to guide immune checkpoint blockade in cancer therapy.nature reviews cancer 2016,16(5),275
‑
87.
[0203]
26.herbst,r.s.;soria,j.
‑
c.;kowanetz,m.;fine,g.d.;hamid,o.; gordon,m.s.;sosman,j.a.;mcdermott,d.f.;powderly,j.d.;gettinger,s. n.;kohrt,h.e.k.;horn,l.;lawrence,d.p.;rost,s.;leabman,m.;xiao,y.; mokatrin,a.;koeppen,h.;hegde,p.s.;mellman,i.;chen,d.s.;hodi,f.s., predictive correlates of response to the anti
‑
pd
‑
l1 antibody mpdl3280a in cancer patients.nature 2014,515,563.
[0204]
27.lin,e.p.
‑
y.;yang,c.
‑
y.;lin,c.
‑
w.;huang,b.
‑
t.;lai,w.
‑
y.;tseng, y.
‑
t.;yang,p.
‑
c.,priming pd
‑
l1 expression by chemotherapeutic agents in non
‑
small cell lung cancers.journal of clinical oncology 2017,35(15_suppl), e20087
‑
e20087.
[0205]
28.pol,j.;vacchelli,e.;aranda,f.;castoldi,f.;eggermont,a.;cremer,i.; sautes
‑
fridman,c.;fucikova,j.;galon,j.;spisek,r.;tartour,e.;zitvogel,l.; kroemer,g.;galluzzi,l.,trial watch:immunogenic cell death inducers for anticancer chemotherapy.oncoimmunology 2015,4(4),e1008866.
[0206]
29.hugo,w.;zaretsky,j.m.;sun,l.;song,c.;moreno,b.h.; hu
‑
lieskovan,s.;berent
‑
maoz,b.;pang,j.;chmielowski,b.;cherry,g.;seja, e.;lomeli,s.;kong,x.;kelley,m.c.;sosman,j.a.;johnson,d.b.;ribas, a.;lo,r.s.,genomic and transcriptomic features of response to anti
‑
pd
‑
1 therapy in metastatic melanoma.cell 2016,165(1),35
‑
44.
[0207]
30.sullivan,s.p.;koutsonanos,d.g.;del pilar martin,m.;lee,j.w.; zarnitsyn,v.;choi,s.
‑
o.;murthy,n.;compans,r.w.;skountzou,i.;prausnitz,m.r.,dissolving polymer microneedle patches for influenza vaccination.nature medicine 2010,16,915.
[0208]
31.esser,e.s.;pulit
‑
penaloza,j.a.;kalluri,h.;mcallister,d.; vassilieva,e.v.;littauer,e.q.;lelutiu,n.;prausnitz,m.r.;compans,r.w.; skountzou,i.,microneedle patch delivery of influenza vaccine during pregnancy enhances maternal immune responses promoting survival and long
‑
lasting passive immunity to offspring.scientific reports 2017,7(1),5705
‑
5705.
[0209]
32.duarte,s.;loubat,a.;momier,d.;topi,m.;faneca,h.;pedroso de lima,m.c.;carle,g.f.;pierrefite
‑
carle,v.,isolation of head and neck squamous carcinoma cancer stem
‑
like cells in a syngeneic mouse model and analysis of hypoxia effect.oncology report 2012,28(3),1057
‑
62.
[0210]
具体实施方案的前述描述将如此充分地揭示本发明的一般性质,使得其他人可以在不过度实验的情况下,在不背离本发明的一般构思的情况下,通过应用相关领域技术范围内的知识(包括引用以及通过引用并入本文的文件的内容)来容易地修改和/或改变这样的具体实施方案以用于各种应用。因此,基于本文提出的教导和指导,这样的改变和修改旨在落入所公开的实施方案的等通方案的含义和范围内。应当理解,本文的措词或术语是出于描述而非限制的目的,使得本说明书的术语或措辞将由本领域技术人员根据本文提出的
教导和指导,结合相关领域技术人员的知识来解释。
[0211]
尽管上文已经描述了本发明的各种实施方案,但是应当理解,它们已经通过实例而非限制的方式给出。对于相关领域的技术人员显而易见的是,可以在不脱离本发明的精神和范围的情况下在形式和细节上在其中进行各种改变。因此,本发明不应被任何上述示例性实施方案限制,而应仅根据所附权利要求及其等同方案来限定。
[0212]
本文中引用的所有参考文献出于所有目的整体并入本文,其程度如同出于所有目的具体且单独地指出各出版物、专利或专利申请均通过引用整体并入。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。