组合物、脂质颗粒制造试剂盒、物质递送方法和检测方法
1.相关申请的交叉引用
2.本技术基于并要求于2020年3月19日提交的日本专利申请号2020
‑
049219的优先权,其全部内容通过引用并入本文。
3.领域
4.本文所述的实施方案大体涉及组合物、脂质颗粒制造试剂盒、物质递送方法和检测方法。
5.背景
6.t细胞恶性是一种恶性肿瘤疾病,包括t细胞白血病和t细胞淋巴瘤。为了治疗和诊断各种恶性肿瘤的目的,一直需要将治疗剂或诊断剂特异性地递送至恶性肿瘤细胞。例如,在递送中使用对预定恶性肿瘤细胞特异的抗原或受体。然而,t细胞恶性肿瘤细胞具有与正常t细胞几乎无法区分的表面抗原,使得使用抗原或受体进行治疗变得困难。
7.附图简述
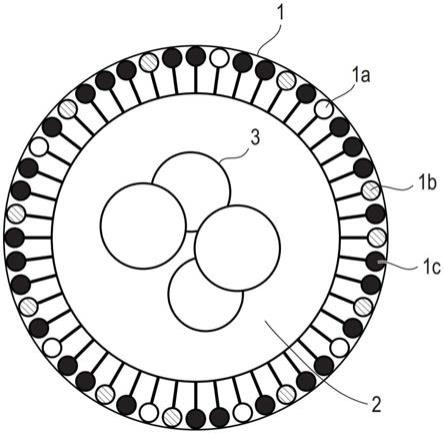
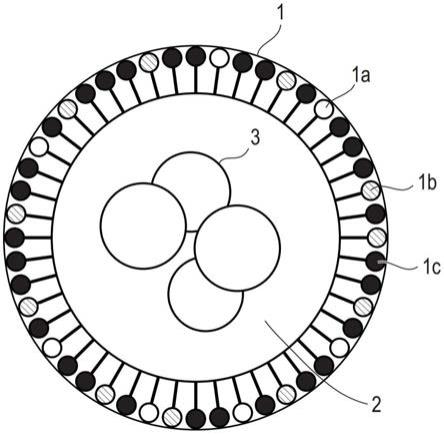
8.图1是显示第一实施方案的脂质颗粒示例的截面图。
9.图2是显示第二实施方案的物质递送载体示例的截面图。
10.图3是显示第二实施方案的物质递送方法示例的流程图。
11.图4是显示第二实施方案的物质递送方法示例的示意图。
12.图5是显示第三实施方案的物质递送载体示例的截面图。
13.图6是显示第三实施方案的检测方法示例的流程图。
14.图7是显示第三实施方案的检测方法示例的示意图。
15.图8是显示实施例1的实验结果的图。
16.图9是显示实施例1的实验结果的图。
17.图10是显示实施例1的实验结果的图。
18.图11是显示实施例2的实验结果的图。
19.图12是显示实施例2的实验结果的图。
20.图13是显示实施例3的实验结果的图。
21.图14是显示实施例4的实验结果的图。
22.发明详述
23.一般而言,根据一个实施方案,组合物用于将目标物质递送至t细胞恶性肿瘤细胞。所述组合物包含物质递送载体。所述物质递送载体具有脂质颗粒和包封在脂质颗粒中的目标物质。所述脂质颗粒包含至少由式(i)所代表的第一脂质和由式(ii)所代表的第二脂质作为其成分。
24.下面将结合附图描述实施方案。注意,在这些实施方案中,基本上相同的结构元件将由相同的附图标记表示,并且可部分省略对其的说明。此外,附图只是示意,因而每个元件的厚度与其平面尺寸之间的关系、元件之间的厚度比率等可能与实际情况不同。
25.(第一实施方案)
26.·
脂质颗粒
27.根据第一实施方案,提供了用于将目标物质引入t细胞恶性肿瘤细胞的脂质颗粒。如图1所示,脂质颗粒1是基本上球状的空心体,能够在其中心腔2中包封目标物质3。
28.目标物质3是打算递送至t细胞恶性肿瘤细胞的物质。目标物质3可以是任何物质,只要其可被包封在脂质颗粒1中,通常可以是用于t细胞恶性肿瘤的核酸、蛋白、肽、其他有机化合物、无机化合物、治疗剂或诊断剂等。
29.脂质颗粒1可由例如脂质膜组成,该脂质膜由作为源材料的多个脂质分子借助非共价键排列而形成。脂质颗粒1包含至少第一脂质1a和第二脂质1b作为其成分。第一脂质1a为以下式(i)所示的脂质化合物,同时第二脂质1b为以下式(ii)所示的脂质化合物:
[0030][0031][0032]
除了第一脂质1a和第二脂质1b之外,脂质颗粒1还可包含另外的脂质。在组成脂质颗粒1的脂质分子成分的组成中,由第一脂质1a和第二脂质1b组成的部分将在下文中被称为“第一部分”。另一方面,由除第一脂质1a和第二脂质1b以外的脂质分子成分组成的部分将在下文中被称为“第二部分”。在下文中,包含在第二部分中的脂质将被统称为“第三脂质1c”。
[0033]
术语“第一部分”和“第二部分”仅表示脂质颗粒1的成分组成,并不意味着其中所含脂质的物理位置。例如,第一部分和第二部分中的每一个的成分不一定独立地聚集在脂质颗粒1中,而是第一部分中包含的脂质和第二部分中包含的脂质可以混合方式存在。相对于组成脂质颗粒1的全部脂质成分,第一部分的配比优选为30%或更高且小于50%(摩尔比)。
[0034]
第一部分中的第二脂质1b的配比优选为40%或更高。在这种情况下,目标物质3的引入效率和对t细胞恶性肿瘤细胞的特异性可得到提高。通过将第一部分中的第二脂质1b的配比控制在50%或更高,可提高目标物质3引入活体的量,即目标物质3的体内引入可得到提高,这更加有益。第二脂质1b的配比更优选为60%或更高。第二脂质1b的配比上限可以是80%、90%、95%、96%、97%、98%或99%。
[0035]
根据第一部分中第一脂质1a和第二脂质1b的配比,可改变脂质颗粒1的尺寸和细胞透性。例如,第二脂质1b越多,脂质颗粒1的尺寸越大。脂质颗粒1的平均尺寸可根据意图的应用进行改变,并且通常可在约50nm至约300nm的范围内调整。例如,当打算体内应用时,平均尺寸可在约70nm至约100nm的范围内调整。
[0036]
脂质颗粒1可通过内吞作用并入t细胞恶性肿瘤细胞中,通常是通过使其与细胞接触。然后可将目标物质3释放到细胞中。其中含有第一脂质1a和第二脂质1b的脂质颗粒1具有更容易被t细胞恶性肿瘤细胞并入而不太容易被其他细胞如正常血细胞并入的性质。因此,目标物质3可有效地引入t细胞恶性肿瘤细胞中,仅通过简单地使预先包封在脂质颗粒1中的目标物质3与t细胞恶性肿瘤细胞接触(如,通过施用),而无需使用先前方法中使用过的抗原或受体。因而脂质颗粒1可用于需要将目标物质3选择性或特异性递送至t细胞恶性肿瘤细胞的各种应用。
[0037]
在此,t细胞恶性是由t细胞(t淋巴细胞)的恶性转化引起的疾病。t细胞恶性肿瘤细胞包含恶性t细胞,如t细胞衍生的白血病细胞、淋巴瘤细胞等。
[0038]
脂质颗粒1的第二部分中所含的第三脂质1c的类型没有特别限定,而且第二部分通常含有基础脂质。例如,作为生物膜的主要成分的脂质可用作基础脂质。基础脂质是磷脂或鞘脂中的任一种,例如二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、二氢鞘磷脂、脑磷脂、脑苷脂以及它们的组合。
[0039]
例如,基础脂质可优选为以下中的任一种:1,2
‑
二油酰基
‑
sn
‑
甘油
‑3‑
磷酸乙醇胺(dope)、1,2
‑
硬脂酰基
‑
sn
‑
甘油
‑3‑
磷酸乙醇胺(dspe)、1,2
‑
二棕榈酰基
‑
sn
‑
甘油
‑3‑
磷脂酰胆碱(dppc)、1
‑
棕榈酰
‑2‑
油酰基
‑
sn
‑
甘油
‑3‑
磷脂酰胆碱(popc)、1,2
‑
二
‑
o
‑
十八烷基
‑3‑
三甲基铵丙烷(dotma)、1,2
‑
二油酰基
‑3‑
二甲基铵丙烷(dodap)、1,2
‑
二肉豆蔻酰基
‑3‑
二甲基铵丙烷(14:0dap)、1,2
‑
二棕榈酰
‑3‑
二甲基铵丙烷(16:0dap)、1,2
‑
二硬脂酰基
‑3‑
二甲基铵丙烷(18:0dap)、n
‑
(4
‑
羧苄)
‑
n,n
‑
二甲基
‑
2,3
‑
双(油酰氧基)丙烷(dobaq)、1,2
‑
二油酰基
‑3‑
三甲基铵丙烷(dotap)、1,2
‑
二油酰
‑
sn
‑
甘油
‑3‑
磷酸胆碱(dopc)、1,2
‑
二亚油酰基
‑
sn
‑
甘油
‑3‑
磷酸胆碱(dlpc)、1,2
‑
二油酰基
‑
sn
‑
甘油
‑3‑
磷酸
‑
l
‑
丝氨酸(dops)、胆固醇和其任意组合。
[0040]
上述基础脂质中,特别优选的是诸如阳离子脂质和中性脂质的脂质,其含量可用于控制脂质颗粒1的酸解离常数。优选将dotap用作阳离子脂质,优选将dope用作中性脂质。
[0041]
第二部分还优选包含能够防止脂质颗粒1聚集的脂质。这种抗聚集脂质进一步优选包含peg(聚乙二醇)修饰的脂质,例如聚乙二醇(peg)二肉豆蔻酰甘油(dmg
‑
peg)、衍生自ω
‑
氨基(低聚乙二醇)链烷酸酯单体的聚酰胺低聚物(us 6,320,017 b)、单唾液酸神经节苷脂等。
[0042]
第二部分可另外包含任何脂质,包括用于控制毒性的相对较低毒性的脂质;具有官能团的脂质,配体通过该官能团与脂质颗粒1结合;以及用于防止包封物质渗漏的脂质,例如甾醇,更具体地胆固醇。特别优选含有胆固醇。
[0043]
考虑到意图的脂质颗粒1的酸解离常数(pka),脂质颗粒1的粒径1,目标物质3的类型,细胞内稳定性等,适当地选择用于第二部分的脂质的类型和组成。
[0044]
例如,当第二部分含有dope、dotap、胆固醇和dmg
‑
peg时,脂质颗粒1对目标物质3具有特别优异的递送效率,因此是优选的。
[0045]
除目标物质3之外,必要时可将额外的成分包封在脂质颗粒1中。额外的成分通常是ph调节剂、渗透调节剂、基因激活剂、用于t细胞恶性肿瘤细胞的任何其他治疗剂或诊断剂等。ph调节剂通常是有机酸如柠檬酸或其盐。渗透调节剂通常是糖或氨基酸。基因激活剂将在后面描述。
[0046]
通常通过用于包封小分子至脂质颗粒中的任何已知方法,例如bangham法、有机溶剂提取法、表面活性剂去除法和冷冻
‑
解冻法,可制造包封目标物质3和其他任选物质的脂质颗粒1。例如,通过将脂质颗粒1的材料按照所需比率加入有机溶剂如醇中获得脂质混合物,并制备包含待包封成分如目标物质3的水性缓冲液,然后将水性缓冲液倒入脂质混合物中。搅拌得到的混合物使其悬浮,从而形成包封目标物质3等的脂质颗粒1。
[0047]
通过改变脂质混合物中单个材料的混合比率,可容易地控制脂质颗粒1的成分的配比。例如,脂质颗粒1的成分的配比可几乎等于脂质混合物中单个材料的混合比率。通过改变水性缓冲液中物质的量的比率,可容易地控制脂质颗粒1中待包封的物质的量的比率。
[0048]
在下文中,包封目标物质3的脂质颗粒1又被称为“物质递送载体”。
[0049]
组合物
[0050]
物质递送载体可以液体组合物包含在合适载体中的形式提供。载体通常可以是水、氯化钠水溶液如盐水、甘氨酸水溶液、缓冲溶液等。物质递送载体可备选地以干粉状组合物的形式提供。粉状组合物通过由用户向其中加入适当的液体(如,任何上述载体)即可使用。
[0051]
除了物质递送载体之外,组合物还可包含提高储存稳定性的物质。提高储存稳定性的物质例如但不具体限于,白蛋白、脂蛋白、载脂蛋白、糖蛋白如球蛋白等;ph调节剂、缓冲剂、张力调节剂等;能够将组合物同化成生理状态的药学上可接受的参与者,例如乙酸钠、乳酸钠、氯化钠、氯化钾和氯化钙;亲脂性自由基猝灭剂,如α
‑
生育酚,能够抑制自由基引起的损伤;以及脂质保护剂,如以铁草胺(ferrioxamine)为代表的水溶性螯合剂,能够抑制脂质过氧化损伤,和能够提高储存稳定性。
[0052]
在物质递送载体打算向活体施用的情况下,该组合物优选具有药学上可接受的化学组成,并且通过任何已知方法进行灭菌。
[0053]
根据另一实施方案,提供了用于制造脂质颗粒1的脂质混合物。该脂质混合物包含至少第一脂质1a和第二脂质1b。该脂质混合物可含有按照上述任意所需混合比率混合的第一脂质1a和第二脂质1b,并且可含有属于第二部分的脂质。该脂质混合物可以用于制造脂质颗粒1的试剂盒的形式与期望的目标物质3一起提供。
[0054]
(第二实施方案)
[0055]
在第二实施方案中,将说明将脂质颗粒1用于减少或消灭t细胞恶性肿瘤细胞的示例性应用。在这种情况下,用于减少或消灭t细胞恶性肿瘤细胞的物质可用作目标物质3。参考图2说明包封这种目标物质3的示例性脂质颗粒1,即物质递送载体10。
[0056]
·
物质递送载体
[0057]
如图2所示,物质递送载体10具有脂质颗粒1和包封在脂质颗粒1中作为目标物质3的rna4。例如,rna4包封在脂质颗粒1内,同时用核酸缩合肽5缩合。
[0058]
在此可用的脂质颗粒1可以是第一实施方案中说明的任何脂质颗粒1。
[0059]
rna4通常是具有杀细胞基因的mrna(信使rna)序列的rna。
[0060]
本文所述的术语“杀细胞基因”是在包括癌细胞在内的人细胞中诱导例如杀细胞作用(主要是细胞凋亡)的一组基因的总称,又被称为“自杀基因”。
[0061]
杀细胞基因包括抑癌基因(p53、rb、arf等)、死亡配体受体基因(fas、肿瘤坏死因子受体(tnfr)、死亡受体(dr)4、dr5等)、促凋亡基因(bax、bak、bim、bid、bad、noxa、puma
等)、凋亡抑制因子拮抗基因(smac、diablo等)、半胱天冬酶基因(半胱天冬酶3、半胱天冬酶6、半胱天冬酶7、半胱天冬酶9、半胱天冬酶8、半胱天冬酶10、诱导型半胱天冬酶9(icaspase9)等)、病毒来源基因(hsv
‑
tk基因)等。
[0062]
抑癌基因的mrna可以是剪接前的pre
‑
mrna,也可以是剪接后的成熟mrna。或者,rna4可以是转录后修饰的杀细胞基因的mrna,其可在5'末端添加cap,并在3'末端聚腺苷酸化。
[0063]
除了杀细胞基因的mrna序列之外,rna4还可包含另外的序列。这类另外的序列是为了提高转录和表达的效率,例如与5'末端结合的球蛋白前导序列和/或与3'末端结合的poly(a)序列。
[0064]
rna4优选经修饰以具有分解抗性。此类修饰可以是使rna不易被rnase等分解的任何已知修饰,例如通过使用或向rna引入天然经修饰核苷酸或非天然核苷酸、使用或添加非天然序列、添加天然或非天然cap结构等。
[0065]
天然修饰核苷酸通过假尿苷、5
‑
甲基胞苷、1
‑
甲基腺苷等示例。非天然核苷酸通过bna(桥接核酸)、lna(锁核酸)、pna(肽核酸)等示例。
[0066]
非天然序列通常是人工合成的、非天然存在的碱基序列,例如随机碱基序列、以及天然或非天然氨基酸与核酸的杂合序列。非天然序列优选结合到如rna的末端。
[0067]
天然cap结构通过cap0(m7gpppn)、cap1(m7gpppnm)等示例。非天然cap结构通过arca(抗反向帽类似物)、lna
‑
鸟苷等示例。非天然cap结构优选结合到如rna的5'末端。
[0068]
脂质颗粒1中优选包含1至约1000个rna4分子。
[0069]
rna4可以完整形式或用核酸缩合肽5缩合后包封在脂质颗粒1中。使用核酸缩合肽5可将核酸缩合为紧凑的尺寸,使得可以在更小尺寸的脂质颗粒1中包封更大量的rna4。这也使得可以减少残留在脂质颗粒1外部的rna4的量,并防止物质递送载体10彼此聚集。因此可提高rna4的递送效率。
[0070]
核酸缩合肽5优选为含有阳离子氨基酸的肽,该阳离子氨基酸占整体的45%或更高。更优选的核酸缩合肽5在一端具有序列rrrrrr(第一氨基酸序列),并且在另一端具有序列rqrqr(第二氨基酸序列)。在第一氨基酸序列和第二氨基酸序列之间,不存在或存在一个或多个由rrrrrr或rqrqr组成的中间序列。在第一氨基酸序列、第二氨基酸序列和中间序列中的两个相邻序列之间,含有两个或更多个中性氨基酸。中性氨基酸通常是g或y。或者,另一端可以具有rrrrrr(第一氨基酸序列),代替第二氨基酸序列。
[0071]
核酸缩合肽5优选具有以下氨基酸序列:
[0072]
rqrqryyrqrqrggrrrrrr(seq id no:1)
[0073]
rqrqrggrrrrrr(seq id no:2)
[0074]
rrrrrryyrqrqrggrrrrrr(seq id no:3)。
[0075]
此外,具有以下氨基酸序列的核酸缩合肽5可与上述任何一种核酸缩合肽5组合使用。该肽可进一步缩合已与上述核酸缩合肽5缩合的核酸聚集体。
[0076]
gnqssnfgpmkggnfggrssgpyggggqyfakprnqggy(m9)(seq id no:4)
[0077]
在被脂质颗粒1包封之前,rna4可通过例如在搅拌下将rna4与核酸缩合肽5混合来浓缩。
[0078]
考虑到上述效果的证明,在目标物质3是核酸如rna4的情况下,优选使用核酸缩合
肽5,但取决于待使用的目标物质3的类型,不一定总是使用核酸缩合肽5。
[0079]
除了rna4,脂质颗粒1中还可包封任选的ph调节剂、渗透调节剂、基因激活剂、用于t细胞恶性肿瘤细胞的其他治疗剂等。
[0080]
基因激活剂是促进或诱导由rna4和/或表达因子的表达引起的杀细胞作用的试剂。例如,在rna4编码icaspase 9基因的情况下,优选将化学二聚化诱导剂(cid)作为基因激活剂与其一起包封。
[0081]
·
物质递送方法
[0082]
下面将说明使用第二实施方案的物质递送载体10的物质递送方法。物质递送方法包括,如图3所示,使该实施方案的物质递送载体10与t细胞恶性肿瘤细胞接触(接触步骤s1)。
[0083]
t细胞恶性肿瘤细胞通常存在于受试者体内。受试者优选为人,但可以是除人之外的任何动物。动物优选为哺乳动物。受试者可以是已被诊断患有t细胞恶性的受试者,或者可以是已患有或疑似患有t细胞恶性的受试者。
[0084]
在这种情况下,接触步骤s1通过向受试者施用包含物质递送载体10的组合物来进行。施用途径没有特别限制,因而进行全身施用,例如通过静脉内注射、皮下注射、肌内注射、动脉注射、硬膜外注射、脑脊髓腔注射、胸内注射、腹膜内注射、局部病灶内注射或滴注。施用时间表可以是仅在考虑例如目的;和受试者的性别、年龄、体重和病理状况时是可选择的。此外,可以是单次施用,也可以是重复或周期性多次施用。施用后,物质递送载体10通常由血液输送,并在体内与t细胞恶性肿瘤细胞6接触。
[0085]
在这种情况下,物质递送载体10的脂质颗粒1的组成优选确定为调整脂质颗粒的粒径为1至100μm或更小。第一部分中的第二脂质1b的配比优选为50%或更高。配比更优选为60%或更高。
[0086]
如图4部分(a)所示,与t细胞恶性肿瘤细胞6接触的物质递送载体10然后如通过内吞作用并入t细胞恶性肿瘤细胞6中。虽然图4部分(a)未显示,但是将rna4引入t细胞恶性肿瘤细胞6,然后rna4在t细胞恶性肿瘤细胞6内转录,从而表达杀细胞因子。然后杀细胞因子根据其类型进入级联机制或信号传输,以诱导t细胞恶性肿瘤细胞6的细胞死亡。或者,在某些情况下,取决于杀细胞基因的类型,可抑制t细胞恶性肿瘤细胞6进一步增殖。因此,可以减少或消灭受试者中的t细胞恶性肿瘤细胞6。
[0087]
另一方面,如图4部分(b)所示,物质递送载体10不太可能并入其他细胞7,如正常血细胞等,从而使其他细胞7存活(完整)并证明安全。
[0088]
考虑到以上,根据第二实施方案的物质递送载体和物质递送方法,可将rna4有效地递送至受试者的t细胞恶性肿瘤细胞6中,并且减少或消灭t细胞恶性肿瘤细胞。因此可以有效和安全的方式治疗t细胞恶性肿瘤。
[0089]
与以dna形式引入的情况相比,物质递送载体10以rna4的形式引入杀细胞基因能更快速和有效地表达杀细胞因子,因为省略了转录步骤。此外,与杀细胞因子以蛋白形式引入的情况相比,脂质颗粒1的尺寸可以减小,这提高了引入效率并且使制造更容易,因为不需要根据杀细胞因子的类型改变待包封至脂质颗粒1的试剂。
[0090]
然而,杀细胞基因并不限于mrna的形式,反而可以是dna或蛋白的形式。又或者,使用其他治疗剂代替杀细胞基因,脂质颗粒1可用于减少或消灭t细胞恶性肿瘤细胞6。
[0091]
在另一实施方案中,第二实施方案的物质递送载体10和物质递送方法也可用于减少或消灭体外t细胞恶性肿瘤细胞6。在这种情况下,t细胞恶性肿瘤细胞6通常可以是从活体中取出并培养的细胞,或作为细胞系建立的细胞。接触步骤s1在这种情况下通常可通过将含有脂质颗粒1的组合物滴到细胞上来进行。
[0092]
(第三实施方案)
[0093]
在第三实施方案中,将说明脂质颗粒1在检测t细胞恶性肿瘤细胞中的示例性应用。在这种情况下,可使用检测t细胞恶性肿瘤细胞的物质作为目标物质3。
[0094]
如图5所示,第三实施方案的物质递送载体20包含诊断剂15作为目标物质3,代替第二实施方案中的rna4。在此使用的脂质颗粒1可以是第一实施方案中说明的任何一种。
[0095]
例如,诊断剂15可以是能够产生可检测的第一信号的物质。诊断剂15可以是可被包封至脂质颗粒1中的物质。可产生光学第一信号的物质或含有核医疗诊断设备可检测的放射性同位素的物质可用作诊断剂15。当物质递送载体20用于体内施用时,优选选择药学上可接受的物质作为诊断剂15。
[0096]
除了诊断剂15之外,脂质颗粒1还可包封任选的ph调节剂、渗透调节剂、基因激活剂、针对t细胞恶性肿瘤细胞的其他诊断剂等。
[0097]
·
物质递送方法
[0098]
以下说明了使用第三实施方案的物质递送载体20,通过将诊断剂15递送至t细胞恶性肿瘤细胞来检测t细胞恶性肿瘤细胞的物质递送方法。如图6所示,第三实施方案的物质递送方法包括:使包封诊断剂15的脂质颗粒1(物质递送载体20)与样品细胞接触(接触步骤s11);检测第一信号(检测步骤s12);和基于检测结果确定样品细胞中是否存在t细胞恶性肿瘤细胞(确定步骤s13)。
[0099]
样品细胞是疑似或预测含有t细胞恶性肿瘤细胞6的细胞组。样品细胞典型地可以是已被诊断为t细胞恶性肿瘤的细胞,或可以是疑似受t细胞恶性肿瘤影响的受试者体内存在的细胞,或可以是从这些受试者的活体中取出的细胞组。或者,样品细胞也可以是通过人工分化或恶性转化获得的细胞组。
[0100]
在使用体内存在的样品细胞的情况下,接触步骤s11通过将包含物质递送载体20的组合物施用于受试者来进行。在使用体外存在的样品细胞的情况下,接触步骤s1典型地通过将包含物质递送载体20的组合物滴加到样品细胞来进行。
[0101]
如图7部分(a)所示,与t细胞恶性肿瘤细胞6接触的物质递送载体20接着被并入t细胞恶性肿瘤细胞6中。这样,将诊断剂15并入t细胞恶性肿瘤细胞6中。
[0102]
在检测步骤s12中,检测第一信号。使用适合于诊断剂15类型的适当装置检测第一信号9。在体内施用物质递送载体20的情况下,可使用任何已知的体内成像方法。在第一信号9为荧光的情况下,可使用荧光分子断层扫描术(fmt)等。在样品细胞为体外细胞的情况下,可通过显微镜、光学传感器等进行检测。对于诊断剂15为放射性同位素的示例性情况,可通过核医学诊断设备等进行检测。
[0103]
另一方面,如图7部分(b)所示,物质递送载体20不太可能被并入其他细胞7中,从而无法从这样的其他细胞7中获得第一信号9。
[0104]
接着,使用检测结果确定样品细胞中是否存在t细胞恶性肿瘤细胞(确定步骤s13)。例如,如果存在从中获得第一信号9的细胞,则可确定样品细胞具有t细胞恶性肿瘤细
胞。在样品细胞为源自受试者的细胞组的情况下,可利用确定步骤s13中获得的确定结果的信息来例如诊断受试者是否具有t细胞恶性肿瘤细胞。或者,可使用确定结果的信息来辅助这种诊断。
[0105]
在另一实施方案中,诊断剂15可以是包含报告基因mrna的rna。例如,报告基因是编码报告蛋白的基因。报告蛋白是产生可检测的第一信号的蛋白。报告蛋白优选具有较低的细胞毒性,并且其信号可从活细胞中检测到。
[0106]
报告蛋白优选选自例如荧光蛋白,如绿色荧光蛋白、红色荧光蛋白和蓝色荧光蛋白;发光酶蛋白,如萤火虫荧光素酶、海肾荧光素酶和nanoluc(注册商标)荧光素酶等;活性氧产生酶,如黄嘌呤氧化酶或一氧化氮合酶等;以及显色酶蛋白,如β
‑
半乳糖苷酶或氯霉素乙酰转移酶。
[0107]
与第二实施方案中的方式相同,除了报告基因的mrna之外,rna可进一步包含额外的序列,可以经修饰以具有分解抗性,或者可在用核酸缩合肽5缩合的同时包封在脂质颗粒1内。
[0108]
根据第三实施方案的脂质颗粒1可进一步包封基因激活剂,其有助于从报告基因的mrna表达报告蛋白和/或从报告蛋白产生第一信号。
[0109]
根据第三实施方案的上述物质递送载体和检测方法,现在可以将诊断剂15有效地递送至t细胞恶性肿瘤细胞,并且检测和诊断t细胞恶性肿瘤。
实施例
[0110]
以下将说明实施方案的物质输送载体的制造和使用的实施例。
[0111]
实施例1
[0112]
评估并入t细胞恶性、正常血细胞、乳腺癌细胞和脑肿瘤细胞的脂质颗粒的量
[0113]
·
脂质颗粒的制备
[0114]
制备含有绿色荧光蛋白(gfp)的mrna(来自jena bioscience gmbh)的溶液和在乙醇中的脂质溶液。乙醇中脂质溶液的组成总结在表1中。
[0115]
表1 乙醇中脂质溶液的组成(单位:mol)
[0116][0117][0118]
表1中,“fft
‑
10”代表式(i)所示的化合物,“fft
‑
20”代表式(ii)所示的化合物。
[0119][0120]
向表1中汇总的乙醇中的脂质溶液的每一种加入0.4mol罗丹明
‑
pe(注册商标,来自avanti polar lipid,inc.),向其中加入含有gfp mrna的溶液,并且通过移液使内容物完全悬浮。向溶液中加入7倍量的10mm hepes缓冲液(ph7.3),然后使用离心超滤装置(amicon
tm ultra
‑
0.5ml,ultracel
‑
50k,来自millipore)使溶液浓缩并替换为10mm hepes缓冲液(ph7.3),从而获得包封gfp mrna的脂质颗粒。使用rna定量系统quantifluor
tm rna(来自promega corporation)测量包封在脂质颗粒中的mrna的量。
[0121]
·
细胞的准备
[0122]
在此使用的t细胞恶性肿瘤细胞是人白血病细胞系:jurkat细胞(来自atcc(注册商标))。在此使用的正常血细胞是人外周血单核细胞:pbmc(来自lonza kk.)。在此使用的乳腺癌细胞是人乳腺肿瘤细胞系:mda
‑
mb
‑
231细胞(来自atcc(注册商标)),在此使用的脑肿瘤细胞为人胶质母细胞瘤细胞系:t98g细胞(来自atcc(注册商标))。
[0123]
·
使用脂质颗粒引入mrna
[0124]
jurkat和pbmc以5.0
×
105个细胞/500μl texmacs
tm
培养基(来自miltenyi biotec)接种于48孔培养板上。在48孔培养板上,mda
‑
md
‑
231使用dmem培养基(含10%fbs,gibco(注册商标))以1.0
×
105个细胞/250μl接种,而t98g使用rpmi1640培养基(含10%fbs,gibco(注册商标))以1.0
×
105个细胞/250μl接种。然后向jurkat和pbmc中添加1.0μg包封gfp mrna的脂质颗粒,并向mda
‑
md
‑
231和t98g中添加0.5μg。通过移液将各混合物完全混合,然后在具有37℃和5%co2条件气氛的培养箱中培养。
[0125]
将脂质颗粒加入细胞24小时后,收集细胞,并使用荧光激活细胞分选仪:facs(facsverse
tm
,来自bd biosciences)测量细胞的罗丹明荧光。使用细胞的罗丹明荧光作为指标,测量脂质颗粒并入细胞的量。
[0126]
·
结果
[0127]
图8显示t细胞恶性肿瘤细胞中罗丹明的荧光强度。荧光强度在使用fft
‑
10(仅有)的情况下约为200rfu,在使用fft
‑
20(仅有)的情况下约为1300rfu,对于使用fft
‑
10和fft
‑
20两者的情况约为1600rfu。
[0128]
图9显示在t细胞恶性肿瘤细胞和pbmc之间比较罗丹明的荧光强度。荧光强度在使
用fft
‑
10(仅有)的情况下,对于t细胞恶性肿瘤细胞(jurkat)约为200rfu,对于pbmc约为10rfu。荧光强度在使用fft
‑
20(仅有)的情况下,对于t细胞恶性肿瘤细胞约为1300rfu,对于pbmc约为25rfu。荧光强度在使用fft
‑
10和fft
‑
20两者的情况下,对于t细胞恶性肿瘤细胞约为1600rfu,对于pbmc约为100rfu。
[0129]
所有情况都表明,与pbmc相比,t细胞恶性肿瘤细胞中并入包封mrna的脂质体的量更多。在使用fft
‑
20(仅有)的情况下以及同时使用fft
‑
10和fft
‑
20两者的情况下,差异尤其明显。还发现使用fft
‑
10和fft
‑
20两者的情况下表明并入的包封mrna的脂质体的量最大。
[0130]
图10显示在t细胞恶性肿瘤细胞、乳腺癌细胞和脑肿瘤细胞之间的比较结果。罗丹明的荧光强度在使用fft
‑
10(仅有)的情况下,对于t细胞恶性肿瘤细胞(jurkat)约为200rfu,对于乳腺癌细胞(mda
‑
mb
‑
231)约为2300rfu,并且对于脑肿瘤细胞(t98g)约为600rfu。荧光强度在使用fft
‑
20(仅有)的情况下,对于t细胞恶性肿瘤细胞约为1300rfu,对于乳腺癌细胞约为100rfu,而对于脑肿瘤细胞约为1000rfu。荧光强度在使用fft
‑
10和fft
‑
20两者的情况下,对于t细胞恶性肿瘤细胞约为1600rfu,对于乳腺癌细胞约为500rfu,而对于脑肿瘤细胞约为1000rfu。
[0131]
使用fft
‑
20(仅有)以及fft
‑
10和fft
‑
20两者的情况表明,与乳腺癌细胞和脑肿瘤细胞相比,t细胞恶性肿瘤细胞中并入的包封mrna的脂质体的量更多。使用fft
‑
10(仅有),并入乳腺癌细胞中的量最大。
[0132]
图9和图10所示的结果表明,对于使用fft
‑
20(仅有)以及使用fft
‑
10和fft
‑
20两者的情况,更多量的mrna可并入t细胞恶性肿瘤细胞中。因此,在接下来的实验中,进一步评估了含有fft
‑
20(仅有)以及fft
‑
10和fft
‑
20两者的脂质颗粒。
[0133]
实施例2
[0134]
评估并入t细胞恶性肿瘤细胞和pbmc的脂质颗粒的量
[0135]
·
脂质颗粒的制备
[0136]
制备乙醇中的含有罗丹明
‑
pe(注册商标,来自avanti polar lipid,inc.)和脂质的脂质溶液。乙醇中脂质溶液的化学组成汇总在表2中。
[0137]
表2 脂质溶液的组成(单位:mol)
[0138][0139]
向表2中列出的每一种在乙醇中如此制备的脂质溶液中加入含有荧光素酶mrna(来自jena bioscience gmbh)的溶液,然后通过移液完全悬浮。向溶液中加入7倍量的10mm hepes缓冲液(ph7.3),然后溶液使用离心超滤装置(amicon
tm ultra
‑
0.5ml,ultracel
‑
50k,来自millipore)浓缩并替换为10mm hepes缓冲液(ph7.3),从而获得包封mrna的各脂质颗
粒。使用名为quantifluor
tm rna(来自promega corporation)的rna定量系统测量包封在脂质颗粒中的mrna的量。
[0140]
·
细胞的准备
[0141]
使用与实施例1所使用相同的t细胞恶性肿瘤细胞和pbmc。
[0142]
pbmc和jurkat以5.0
×
105个细胞/500μl texmacs
tm
培养基(来自miltenyi biotec)接种在48孔培养板上。接种后,加入2.0μg的包封荧光素酶mrna的各脂质颗粒,通过移液将内容物充分混合,然后在具有37℃和5%co2条件气氛的培养箱中培养。24小时后,取出培养板,收集细胞,检查脂质颗粒向细胞的并入和包封在脂质颗粒中的mrna的表达。
[0143]
使用细胞的罗丹明荧光作为指标,测量脂质颗粒并入细胞的量。使用荧光激活的细胞分选仪:facs(facsverse
tm
,来自bd biosciences)测量细胞的罗丹明荧光。使用细胞的荧光素酶发光强度作为指标,测量包封在脂质颗粒中的荧光素酶mrna的表达量。荧光素酶发光强度使用one
‑
glo
tm
荧光素酶测定系统(来自promega corporation)和光度计:infinite(注册商标)200pro(来自tecan)来测量。
[0144]
·
结果
[0145]
罗丹明荧光的量的测量结果示于图11。荧光强度在no.43(fft
‑
20(仅有))的情况下,对于t细胞恶性肿瘤细胞(jurkat)约为1300rfu,对于pbmc约为25rfu。荧光强度在no.78的情况下,对于t细胞恶性肿瘤细胞约为700rfu,对于pbmc约为20rfu。荧光强度在no.79的情况下,对于t细胞恶性肿瘤细胞约为500rfu,对于pbmc约为15rfu。荧光强度在no.80的情况下,对于t细胞恶性肿瘤细胞约为1500rfu,对于pbmc约为10rfu。
[0146]
相比pbmc,发现所有的脂质颗粒以更多的量并入t细胞恶性肿瘤细胞中。尤其是no.43和no.79在两种细胞类型之间容易并入的量差异很大,证明了它们的良好性能。
[0147]
荧光素酶发光量的测量结果示于图12。发光强度在no.43(fft
‑
20(仅有))的情况下,对于t细胞恶性肿瘤细胞约为40000rlu,对于pbmc约为300rlu。发光强度在no.78的情况下,对于t细胞恶性肿瘤细胞约为25000rlu,对于pbmc约为100rlu。发光强度在no.79的情况下,对于t细胞恶性肿瘤细胞约为27000rlu,对于pbmc约为65rlu。发光强度在no.80的情况下,对于t细胞恶性肿瘤细胞约为58000rlu,对于pbmc约为640rlu。
[0148]
相比pbmc,发现所有的脂质颗粒以更多的量并入t细胞恶性肿瘤细胞中。
[0149]
实施例3
[0150]
体外评估包封icaspase 9mrna的脂质颗粒
[0151]
·
脂质颗粒的制备
[0152]
含有编码nanoluc(注册商标)荧光素酶的基因(下文简称“nanoluc
tm
基因”)(表3,seq id no:5)的rna(表4,seq id no:6);以及含有icaspase 9基因编码序列(表5,seq id no:7)的rna(表6,seq id no:8),通过体外转录法合成,然后分别在5'末端和3末'端添加帽结构和poly(a)序列,由此合成mrna(rna合成系统,t7 mscript
tm
标准mrna产生系统,cellscript
tm
)。在这些mrna中,球蛋白前导序列结合至基因编码序列的5'末端,poly(a)序列结合至3'末端。
[0153]
[0154]
[0155]
[0156][0157]
使用先前在实施例2中使用的脂质颗粒no.43和no.79,以与实施例2中相同的方法制备包封icaspase 9mrna的脂质颗粒。
[0158]
在此使用的t细胞恶性肿瘤细胞是人白血病细胞系:jurkat(来自jrcb细胞库)和ccrf
‑
cem(来自jrcb细胞库)。通过将萤火虫荧光素酶基因导入上述jurkat细胞,制备萤火虫荧光素酶标记的jurkat细胞。在此使用的正常血细胞是人外周血单核细胞:pbmc(来自健康供体)。
[0159]
在48孔培养板上,将jurkat、ccrf
‑
cem和pbmc各以5
×
105个细胞/500μltexmacs
tm
培养基(来自miltenyi biotec)接种,向其中加入2μg包封icaspase 9mrna的脂质颗粒,通过移液将内容物充分混合,然后在具有37℃和5%co2条件气氛的培养箱中培养。24小时后,取出培养板,向孔中加入cid(二聚化化学诱导剂)(b/b homodimerizer,来自takara bio inc.)至调整终浓度为10nm进行诱导细胞死亡。
[0160]
加入cid后,于37℃、5%co2条件气氛的培养箱中继续培养,24小时后收集细胞,检查包封icaspase 9mrna的脂质颗粒和cid诱导的细胞死亡。通过流式细胞术测量细胞死亡。
[0161]
·
结果
[0162]
结果总结在图13部分(a)至部分(c)。在图13中,纵坐标示出培养的肿瘤细胞数量的比例,起始日肿瘤细胞数量为1。如图13部分(a)所示,t细胞恶性肿瘤细胞jurkat的数量在具有脂质颗粒no.43和施用cid的组以及具有脂质颗粒no.79和施用cid的组中明显减少,分别计数0.05倍和0.1倍。如图13部分(b)所示,t细胞白血病细胞ccrf
‑
cem的数量在具有脂质颗粒no.43和施用cid的组以及具有脂质颗粒no.79和施用cid的组中明显减少,分别计数0.3倍和0.1倍。如图13部分(c)所示,pbmc的数量在具有脂质颗粒no.43和施用cid的组中显示几乎没有减少(施用脂质颗粒no.79以及有和没有cid的组无数据)。此外,当mrna未被包封在脂质颗粒中时,所有类型的细胞都显示几乎没有减少肿瘤细胞数量。
[0163]
因此证明,通过使用包封icaspase 9mrna的脂质颗粒no.43和no.79连同cid可减少肿瘤细胞。
[0164]
实施例4
[0165]
包封icaspase 9mrna的脂质颗粒的体内评估
[0166]
·
脂质颗粒的制备
[0167]
包封实施例3所述nanoluc
tm mrna的脂质颗粒no.43(nluc
‑
43),包封实施例3所述icaspase 9mrna的脂质颗粒no.43(icas
‑
43),以及包封icaspase 9mrna的脂质颗粒no.79(icas
‑
79)以与实施例2相同的方法制备。
[0168]
·
向小鼠施用和测量肿瘤的量
[0169]
向免疫缺陷小鼠(nod.cg
‑
prkdc
scid
il2rg
tm1wjl
/szj nsg小鼠)通过尾静脉以3
×
106个细胞/动物施用ffluc标记的jurkat细胞,并在施用后4天、15天和29天,通过尾静脉施用实施例3所述的包封nanoluc
tm mrna的脂质颗粒no.43(nluc
‑
43)、包封icaspase 9mrna的脂质颗粒no.43(icas
‑
43)和包封icaspase9mrna的脂质颗粒no.79(icas
‑
79)。在施用包封mrna的脂质颗粒后1天、2天和3天,腹膜内施用50μg/动物的cid。通过向小鼠腹膜内施用荧光素底物,并在10分钟后,通过使用ivis(注册商标)成像系统测量发光强度,在体内以时间依赖性和定量的方式评估肿瘤的量。
[0170]
·
结果
[0171]
结果如图14所示。图14显示单个测量日的肿瘤的量的平均值。发现施用nluc
‑
43和icas
‑
no.43的小鼠第21天的肿瘤的量约为2600000(p/s/cm2/sr)(其中“p”代表光子,“s”代表秒,“sr”代表球面度)。另一方面,发现施用icas
‑
79的小鼠第21天的肿瘤的量约为500000(p/s/cm2/sr),被抑制成在no.43的情况下的五分之一左右。
[0172]
与体外不同,在体内给予时,脂质颗粒可通过体内各种组织诸如静脉与t细胞恶性肿瘤细胞接触,而t细胞恶性肿瘤细胞以外的细胞存在,no.79和no.43之间的不同粒径和渗透性使得测试结果如图14所示不同。
[0173]
实施例5
[0174]
·
粒径的评估
[0175]
使用zeta sizer(zetasizer nano zsp,来自malvern panalytical ltd.)测量包封mrna的脂质颗粒的粒径。在890l纯化水(来自otsuka pharmaceutical co.,ltd.)中混合
10μl包封mrna的脂质颗粒,使用zetasizer以粒径测量模式测量脂质颗粒的粒径。表7显示no.43和no.79的粒径测量结果。
[0176]
表7脂质颗粒的粒径
[0177][0178]
尽管已经描述了某些实施方案,但是这些实施方案仅通过示例的方式呈现,并且不旨在限制本发明的范围。实际上,本文描述的新的实施方案可以多种其他形式体现;此外,在不脱离本发明的精神的情况下,可对本文描述的实施方案的形式进行各种省略、替换和变化。所附权利要求及其等同物旨在覆盖落入本发明的范围和精神内的这类形式或修改。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。