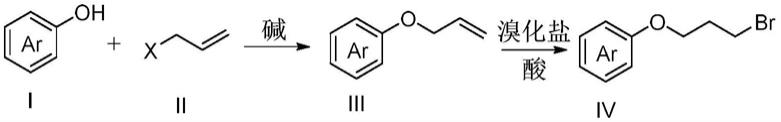
一种3
‑
苯氧基溴丙烷或其类似物的制备方法
技术领域
1.本发明属于药物合成技术领域,具体涉及一种3
‑
苯氧基溴丙烷或其类似物的制备方法。
背景技术:
[0002]3‑
苯氧基溴丙烷及其类似物作为一种常用的医药中间体,在抗肿瘤、抗菌等药物的研发中也有广泛的应用。以3
‑
苯氧基溴丙烷为例,目前主要的合成方法有两种。方法1是通过苯酚和1,3
‑
二溴丙烷直接进行亲核取代反应制得粗产品,粗产品通过减压精馏纯化。该方法转化率低,选择性差,副产物多,粗产品纯度低,且必需采用高温减压精馏纯化,过程之中不仅产物分解后引入更多副产物,而且副产物会与产物形成共沸而难于完全分离开。方法2是通过苯酚和3
‑
溴
‑1‑
丙醇经亲核取代和溴代反应制得产品。该路线中原料3
‑
溴
‑1‑
丙醇与1,3
‑ꢀ
二溴丙烷相比价格较高且稳定性差,导致产品成本升高且杂质多,而且溴代反应中使用三苯基膦、四溴化碳等毒性较大试剂,且必需无水反应条件和产生含磷废水,粗产品同样要用柱层析或者减压蒸馏的方法进行纯化。虽然,cn 111018678 a公开了一种该方法的改进方法,经过3
‑
苯氧基对甲苯磺酸丙酯中间体,通过重结晶精制后溴代,避免了柱层析和减压蒸馏纯化,但是该方法仍然必需价格较高且稳定性差的原料3
‑
溴
‑1‑
丙醇,而且合成步骤较多,并且使用了分子质量较大、不带入产物分子中的对甲苯磺酸基团,原子经济性较差不符合绿色化学,在很大程度上增加了成本。因此,上述合成方法中均不利于工业化生产。
[0003]
现今化学工业的发展主题和方向是绿色化学,在有机合成方向上应该寻找理想的原子经济性反应,实现无污染的零排放合成工艺。从设计与合成3
‑
苯氧基溴丙烷及其类似物这类末端溴代化合物来看,通过烯烃与溴化氢直接加成反应实现烯烃氢溴化获得产物是一条比较理想的合成方法。此方法从原子利用效能方面是原子经济性很好,从环境影响方面是低污染、零排放的符合当前绿色化学合成方向,从成本经济方面是由于烯烃的直接利用在很大程度上降低了成本。然而由于溴化氢为气态,实现这一反应难度很大,实际工艺操作较复杂,因此有必要寻求合适的工艺流程以简便的实现此工艺路线。
技术实现要素:
[0004]
本发明的目的是提供一种3
‑
苯氧基溴丙烷及其类似物的合成方法。
[0005]
实现本发明目的技术解决方案是:一种3
‑
苯氧基溴丙烷或其类似物的合成方法,其包括如下步骤:
[0006]
(1)搅拌条件下,向极性非质子性有机溶剂中依次加入苯酚或芳香酚和碱,升温达到目标反应温度后保温,缓慢滴加烯丙基化合物,滴加完毕后保温反应一定时间,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入萃取有机溶剂,用碱液洗、水洗至中性,干燥后减压浓缩得到丙烯基芳基醚;
[0007]
(2)搅拌条件下,向极性非质子性有机溶剂中依次加入丙烯基芳基醚,引发剂和溴
化盐,升温达到目标反应温度时,缓慢滴加酸,滴加完毕后保温反应一定时间,待反应完毕后降温至室温,然后有机层用碱液洗、水洗至中性,干燥后减压浓缩得到3
‑
苯氧基溴丙烷或其类似物。
[0008]
较佳的,步骤(1)中,芳香酚包括对甲基苯酚、对氯苯酚、对溴苯酚、3,4
‑
亚甲二氧基苯酚、1
‑
萘酚中的任一种;烯丙基化合物包括3
‑
氯代丙烯、3
‑
溴代丙烯、3
‑
碘代丙烯、烯丙胺、烯丙醇、甲酸烯丙酯、碳酸二烯丙酯、烯丙基醚、烯丙硫醇、烯丙基磷酸二乙酯中的任一种;碱包括碳酸钾、碳酸钠、碳酸铯、氢氧化钠、氢氧化钾中的任一种。
[0009]
较佳的,步骤(1)中,极性非质子性有机溶剂包括丙酮、丁酮、乙腈、n,n
‑
二甲基甲酰胺、二甲基亚砜中的任一种;萃取有机溶剂包括乙酸乙酯、二氯甲烷、三氯甲烷、1,2
‑
二氯乙烷、1,1
‑
二氯乙烷中的任一种;碱液包括碳酸钾、碳酸钠、氢氧化钠、氢氧化钾水溶液中的任一种。
[0010]
较佳的,步骤(1)中,苯酚或芳香酚与烯丙基化合物的摩尔比为1:1.0~1.5,苯酚或芳香酚与碱摩尔比为1:1.0~2.0;目标反应温度为60~100℃,时间为4~12h。
[0011]
较佳的,步骤(2)中,引发剂包括过氧化苯甲酰、过氧化乙酰、间氯过氧苯甲酸、双氧水、叔丁基过氧化氢、双(四丁铵)过氧二硫酸盐、过氧化苯甲酸叔丁酯、偶氮二异丁腈中的任一种;溴化盐包括溴化钠、溴化钾、溴化锂、溴化锌中的任一种;酸包括硫酸、磷酸中的任一种。
[0012]
较佳的,步骤(2)中,弱极性有机溶剂包括四氯化碳、环己烷、三氯甲烷、二氯甲烷、 1,2
‑
二氯乙烷、1,1
‑
二氯乙烷中的一种或多种;碱液包括碳酸钾、碳酸钠、氢氧化钠、氢氧化钾水溶液中的一种或多种。
[0013]
较佳的,步骤(2)中,丙烯基芳基醚与溴化盐的摩尔比为1:1.1~2.0,丙烯基芳基醚与酸摩尔比为1:1.0~2.0,引发剂用量为丙烯基芳基醚1mol%~2mol%;目标反应温度为 40~100℃;时间为1~5h。
[0014]
与现有技术相比,本发明的有益效果是:(1)本发明中以溴化盐和酸原位生成高浓度氢溴酸,代替气态溴化氢实现烯烃加成反应,避免了使用气体的诸多不便,所用工艺操作简便,试剂稳定性高,安全隐患较小,便于运输和储存,易于控制和工业化大规模使用。(2)本发明方法与现有方法相比具有原子经济性更好,从环境影响方面是低污染、零排放的符合当前的绿色化学合成方向,从成本经济方面是由于烯烃的直接利用在很大程度上降低了成本,原料廉价易得,工艺操作简单,条件易控制,同时催化效果好、收率较高、废液处理容易,便于工业化大规模生产。
具体实施方式
[0015]
以下通过实施例进一步说明本发明,但专利权利并不局限于这些实施例。
[0016]
本发明采用廉价且易得的式i苯酚或其类似物芳香酚和式ii烯丙基化合物为原料,经过亲核取代反应和加成反应得到式iv 3
‑
苯氧基溴丙烷及其类似物。另外,为避免使用气态溴化氢,本发明采用溴化盐和酸原位生成高浓度氢溴酸以实现加成反应。
[0017][0018]
包括如下步骤:
[0019]
(1)向反应釜中投入极性非质子性有机溶剂后开启搅拌,依次加入式i苯酚或其类似物芳香酚和碱,升温达到目标反应温度后保温,缓慢滴加式ii烯丙基化合物,滴加完毕后保温反应一定时间,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入萃取有机溶剂,然后用碱液洗、水洗至中性,干燥后减压浓缩得到式iii丙烯基芳基醚;
[0020]
(2)向反应釜中投入弱极性有机溶剂后开启搅拌,依次加入式iii丙烯基芳基醚,引发剂和溴化盐,升温达到目标反应温度时缓慢滴加酸,滴加完毕后保温反应一定时间,待反应完毕后降温至室温,然后有机层用碱液洗、水洗至中性,干燥后减压浓缩得到式iv 3
‑
苯氧基溴丙烷产品。
[0021]
实施例1
[0022]
丙烯基苯基醚的制备
[0023]
向反应釜中投入丙酮200ml后开启搅拌,依次加入苯酚18.8g,碳酸钾41.5g和3
‑
溴代丙烯26.6g,升温达到60℃保温反应8h,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入乙酸乙酯,然后用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到丙烯基苯基醚24.1g,产率90%。1h nmr(400m hz,cdcl3)δ7.38
‑
7.28(m,2h),7.00
‑
6.91(m,3h),6.09 (dd,j=17.5,10.5hz,1h),5.44(d,j=17.5hz,1h),5.31(d,j=10.5hz,1h),4.55(d,j=5.5hz, 2h);
13
c nmr(100m hz,cdcl3)δ158.7,133.5,129.6,120.9,117.7,114.8,68.8.。
[0024]
实施例2
[0025]
丙烯基苯基醚的制备
[0026]
向反应釜中投入n,n
‑
二甲基甲酰胺200ml后开启搅拌,依次加入苯酚18.8g,氢氧化钠16g和烯丙胺22.8g,升温达到100℃保温反应8h,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入二氯甲烷,然后用碳酸钾水溶液洗、水洗至中性,干燥后减压浓缩得到丙烯基苯基醚20.9g,产率78%。1h nmr(400m hz,cdcl3)δ7.38
‑
7.28(m,2h),7.00
‑
6.91(m, 3h),6.09(dd,j=17.5,10.5hz,1h),5.44(d,j=17.5hz,1h),5.31(d,j=10.5hz,1h),4.55(d,j =5.5hz,2h);
13
c nmr(100m hz,cdcl3)δ158.7,133.5,129.6,120.9,117.7,114.8,68.8.。
[0027]
实施例3
[0028]
丙烯基苯基醚的制备
[0029]
向反应釜中投入二甲基亚砜200ml后开启搅拌,依次加入苯酚18.8g,氢氧化钾22.4g 和烯丙醇23.2g,升温达到100℃保温反应8h,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入三氯甲烷,然后用氢氧化钠水溶液洗、水洗至中性,干燥后减压浓缩得到丙烯基苯基醚22.0g,产率82%。1h nmr(400m hz,cdcl3)δ7.38
‑
7.28(m,2h),7.00
‑
6.91(m,3h), 6.09(dd,j=17.5,10.5hz,1h),5.44(d,j=17.5hz,1h),5.31(d,j=10.5hz,1h),4.55(d,j= 5.5hz,2h);
13
c nmr(100m hz,cdcl3)δ158.7,133.5,129.6,120.9,117.7,114.8,68.8.。
[0030]
实施例4
[0031]
丙烯基苯基醚的制备
[0032]
向反应釜中投入丙酮200ml后开启搅拌,依次加入苯酚18.8g,碳酸钾41.5g和碳酸二烯丙酯31.2g,升温达到60℃保温反应12h,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入1,2
‑
二氯乙烷,然后用氢氧化钠水溶液洗、水洗至中性,干燥后减压浓缩得到丙烯基苯基醚20.1g,产率78%。1h nmr(400m hz,cdcl3)δ7.38
‑
7.28(m,2h),7.00
‑
6.91(m,3h), 6.09(dd,j=17.5,10.5hz,1h),5.44(d,j=17.5hz,1h),5.31(d,j=10.5hz,1h),4.55(d,j= 5.5hz,2h);
13
c nmr(100m hz,cdcl3)δ158.7,133.5,129.6,120.9,117.7,114.8,68.8.。
[0033]
实施例5
[0034]
丙烯基苯基醚的制备
[0035]
向反应釜中投入n,n
‑
二甲基甲酰胺200ml后开启搅拌,依次加入苯酚18.8g,氢氧化钠16g和烯丙基醚23.6g,升温达到100℃保温反应7h,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入1,1
‑
二氯乙烷,然后用氢氧化钠水溶液洗、水洗至中性,干燥后减压浓缩得到丙烯基苯基醚18.0g,产率70%。1h nmr(400m hz,cdcl3)δ7.38
‑
7.28(m,2h), 7.00
‑
6.91(m,3h),6.09(dd,j=17.5,10.5hz,1h),5.44(d,j=17.5hz,1h),5.31(d,j=10.5hz, 1h),4.55(d,j=5.5hz,2h);
13
c nmr(100m hz,cdcl3)δ158.7,133.5,129.6,120.9,117.7, 114.8,68.8.。
[0036]
实施例6
[0037]
丙烯基苯基醚的制备
[0038]
向反应釜中投入n,n
‑
二甲基甲酰胺200ml后开启搅拌,依次加入苯酚18.8g,氢氧化钠16g和烯丙硫醇29.6g,升温达到90℃保温反应10h,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入二氯乙烷,然后用氢氧化钠水溶液洗、水洗至中性,干燥后减压浓缩得到丙烯基苯基醚21.0g,产率80%。1h nmr(400m hz,cdcl3)δ7.38
‑
7.28(m,2h), 7.00
‑
6.91(m,3h),6.09(dd,j=17.5,10.5hz,1h),5.44(d,j=17.5hz,1h),5.31(d,j=10.5hz, 1h),4.55(d,j=5.5hz,2h);
13
c nmr(100m hz,cdcl3)δ158.7,133.5,129.6,120.9,117.7, 114.8,68.8.。
[0039]
实施例7
[0040]
丙烯基苯基醚的制备
[0041]
向反应釜中投入n,n
‑
二甲基甲酰胺200ml后开启搅拌,依次加入苯酚18.8g,氢氧化钾22.4g和烯丙基磷酸二乙酯71.2g,升温达到100℃保温反应5h,待反应完毕后降温至室温,过滤除去不溶物,浓缩滤液后加入三氯乙烷,然后用氢氧化钠水溶液洗、水洗至中性,干燥后减压浓缩得到丙烯基苯基醚20.1g,产率75%。1h nmr(400m hz,cdcl3)δ7.38
‑
7.28(m,2h), 7.00
‑
6.91(m,3h),6.09(dd,j=17.5,10.5hz,1h),5.44(d,j=17.5hz,1h),5.31(d,j=10.5hz, 1h),4.55(d,j=5.5hz,2h);
13
c nmr(100m hz,cdcl3)δ158.7,133.5,129.6,120.9,117.7, 114.8,68.8.。
[0042]
实施例8
[0043]
丙烯基(4
‑
甲基苯基)醚的制备
[0044]
向反应釜中投入乙腈200ml后开启搅拌,依次加入4
‑
甲基苯酚21.6g,碳酸钾55.3g
1h),8.11(d,j=8.4hz,1h),7.61
‑
7.55(m,3h),7.41
‑
7.38(m,1h),6.22
‑
6.18(m,1h),6.11(dd,j =17.5,10.5hz,1h),5.46(d,j=17.5hz,1h),5.35(d,j=10.5hz,1h),4.65(d,j=5.5hz,2h);
13
c nmr(100mhz,cdcl3)δ158.8,136.1,135.5,134.5,130.1,128.8,125.6,124.8,121.2,119.8, 118.5,105.9,70.9.。
[0057]
实施例13
[0058]3‑
苯氧基溴丙烷的制备
[0059]
向反应釜中投入四氯化碳200ml后开启搅拌,依次加入丙烯基苯基醚26.8g,过氧化苯甲酰1g和溴化钠30.6g,升温达到50℃时缓慢滴加硫酸18g,滴加完毕后保温反应1h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
苯氧基溴丙烷41.0g,产率95%。1h nmr(400m hz,cdcl3)δ7.28(t,j=8.0hz,2h),6.95(t,j= 7.6hz,1h),6.90(d,j=8.0hz,2h),4.09(t,j=6.0hz,2h),3.59(t,j=6.4hz,2h),2.33
‑
2.27(m, 2h);
13
c nmr(100mhz,cdcl3)δ158.8,129.6,121.0,114.6,65.3,32.5,30.2.。
[0060]
实施例14
[0061]3‑
苯氧基溴丙烷的制备
[0062]
向反应釜中投入环己烷200ml后开启搅拌,依次加入丙烯基苯基醚26.8g,过氧化乙酰 1g和溴化钾35.3g,升温达到60℃时缓慢滴加硫酸18g,滴加完毕后保温反应1.5h,待反应完毕后降温至室温,然后有机层用碳酸钾水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
苯氧基溴丙烷39.3g,产率91%。1h nmr(400m hz,cdcl3)δ7.28(t,j=8.0hz,2h),6.95(t,j= 7.6hz,1h),6.90(d,j=8.0hz,2h),4.09(t,j=6.0hz,2h),3.59(t,j=6.4hz,2h),2.33
‑
2.27(m, 2h);
13
c nmr(100mhz,cdcl3)δ158.8,129.6,121.0,114.6,65.3,32.5,30.2.。
[0063]
实施例15
[0064]3‑
苯氧基溴丙烷的制备
[0065]
向反应釜中投入1,2
‑
二氯乙烷200ml后开启搅拌,依次加入丙烯基苯基醚26.8g,间氯过氧苯甲酸1g和溴化锂30.3g,升温达到70℃时缓慢滴加磷酸18g,滴加完毕后保温反应2h,待反应完毕后降温至室温,然后有机层用氢氧化钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
苯氧基溴丙烷38.9g,产率90%。1h nmr(400m hz,cdcl3)δ7.28(t,j=8.0hz,2h), 6.95(t,j=7.6hz,1h),6.90(d,j=8.0hz,2h),4.09(t,j=6.0hz,2h),3.59(t,j=6.4hz,2h), 2.33
‑
2.27(m,2h);
13
c nmr(100mhz,cdcl3)δ158.8,129.6,121.0,114.6,65.3,32.5,30.2.。
[0066]
实施例16
[0067]3‑
苯氧基溴丙烷的制备
[0068]
向反应釜中投入1,1
‑
二氯乙烷200ml后开启搅拌,依次加入丙烯基苯基醚26.8g,双氧水 2g和溴化锌33.4g,升温达到80℃时缓慢滴加磷酸18g,滴加完毕后保温反应4h,待反应完毕后降温至室温,然后有机层用氢氧化钾水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
苯氧基溴丙烷34.6g,产率80%。1h nmr(400m hz,cdcl3)δ7.28(t,j=8.0hz,2h),6.95(t,j= 7.6hz,1h),6.90(d,j=8.0hz,2h),4.09(t,j=6.0hz,2h),3.59(t,j=6.4hz,2h),2.33
‑
2.27(m, 2h);
13
c nmr(100mhz,cdcl3)δ158.8,129.6,121.0,114.6,65.3,32.5,
30.2.。
[0069]
实施例17
[0070]3‑
苯氧基溴丙烷的制备
[0071]
向反应釜中投入三氯甲烷200ml后开启搅拌,依次加入丙烯基苯基醚26.8g,偶氮二异丁腈1g和溴化钠35.6g,升温达到80℃时缓慢滴加硫酸18g,滴加完毕后保温反应4h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
苯氧基溴丙烷36.7g,产率85%。1h nmr(400m hz,cdcl3)δ7.28(t,j=8.0hz,2h),6.95(t,j= 7.6hz,1h),6.90(d,j=8.0hz,2h),4.09(t,j=6.0hz,2h),3.59(t,j=6.4hz,2h),2.33
‑
2.27(m, 2h);
13
c nmr(100mhz,cdcl3)δ158.8,129.6,121.0,114.6,65.3,32.5,30.2.。
[0072]
实施例18
[0073]3‑
苯氧基溴丙烷的制备
[0074]
向反应釜中投入二氯甲烷200ml后开启搅拌,依次加入丙烯基苯基醚26.8g,双(四丁铵) 过氧二硫酸盐1g和溴化钠35.6g,升温达到60℃时缓慢滴加硫酸18g,滴加完毕后保温反应 5h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
苯氧基溴丙烷33.7g,产率78%。1h nmr(400m hz,cdcl3)δ7.28(t,j=8.0hz,2h), 6.95(t,j=7.6hz,1h),6.90(d,j=8.0hz,2h),4.09(t,j=6.0hz,2h),3.59(t,j=6.4hz,2h), 2.33
‑
2.27(m,2h);
13
c nmr(100mhz,cdcl3)δ158.8,129.6,121.0,114.6,65.3,32.5,30.2.。
[0075]
实施例19
[0076]3‑
苯氧基溴丙烷的制备
[0077]
向反应釜中投入四氯化碳200ml后开启搅拌,依次加入丙烯基苯基醚26.8g,过氧化苯甲酸叔丁酯1g和溴化钠35.6g,升温达到80℃时缓慢滴加硫酸18g,滴加完毕后保温反应5h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
苯氧基溴丙烷32.4g,产率75%。1h nmr(400m hz,cdcl3)δ7.28(t,j=8.0hz,2h),6.95 (t,j=7.6hz,1h),6.90(d,j=8.0hz,2h),4.09(t,j=6.0hz,2h),3.59(t,j=6.4hz,2h), 2.33
‑
2.27(m,2h);
13
c nmr(100mhz,cdcl3)δ158.8,129.6,121.0,114.6,65.3,32.5,30.2.。
[0078]
实施例20
[0079]3‑
(4
‑
甲基苯氧基)溴丙烷的制备
[0080]
向反应釜中投入四氯化碳200ml后开启搅拌,依次加入丙烯基(4
‑
甲基苯基)醚29.6g,过氧化苯甲酰1g和溴化钠30.6g,升温达到60℃时缓慢滴加硫酸18g,滴加完毕后保温反应 2h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
(4
‑
甲基苯氧基)溴丙烷43.1g,产率94%。1h nmr(400m hz,cdcl3)δ7.13(d,j= 8.0hz,2h),6.85(d,j=7.6hz,2h),4.07(t,j=6.0hz,2h),3.51(t,j=6.4hz,2h),2.33
‑
2.27 (m,2h),2.25(s,3h);
13
c nmr(100mhz,cdcl3)δ156.8,130.1,127.6,114.6,67.3,32.5,29.9, 21.3.。
[0081]
实施例21
[0082]3‑
(4
‑
氯苯氧基)溴丙烷的制备
[0083]
向反应釜中投入四氯化碳200ml后开启搅拌,依次加入丙烯基(4
‑
氯苯基)醚33.8g,过氧化苯甲酰1g和溴化钠30.6g,升温达到60℃时缓慢滴加硫酸18g,滴加完毕后保温反应3h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
(4
‑
氯苯氧基)溴丙烷44.4g,产率89%。1h nmr(400m hz,cdcl3)δ7.36(d,j=8.0hz, 2h),6.82(d,j=7.6hz,2h),4.06(t,j=6.0hz,2h),3.51(t,j=6.4hz,2h),2.31
‑
2.24(m,2h);
13
c nmr(100mhz,cdcl3)δ156.2,130.1,115.5,113.1,65.1,31.4,29.1.。
[0084]
实施例22
[0085]3‑
(4
‑
溴苯氧基)溴丙烷的制备
[0086]
向反应釜中投入四氯化碳200ml后开启搅拌,依次加入丙烯基(4
‑
溴苯基)醚42.6g,过氧化苯甲酰1g和溴化钠35.7g,升温达到70℃时缓慢滴加硫酸18g,滴加完毕后保温反应5h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
(4
‑
溴苯氧基)溴丙烷55.9,产率95%。1h nmr(400m hz,cdcl3)δ7.48(d,j=8.0hz, 2h),6.97(d,j=7.6hz,2h),4.08(t,j=6.0hz,2h),3.55(t,j=6.4hz,2h),2.33
‑
2.27(m,2h);
13
c nmr(100mhz,cdcl3)δ158.8,132.6,118.6,114.7,66.1,32.8,30.1.。
[0087]
实施例23
[0088]3‑
(3,4
‑
亚甲二氧基苯氧基)溴丙烷的制备
[0089]
向反应釜中投入四氯化碳200ml后开启搅拌,依次加入丙烯基(3,4
‑
亚甲二氧基苯基)醚35.6g,过氧化苯甲酰1g和溴化钠35.7g,升温达到50℃时缓慢滴加硫酸18g,滴加完毕后保温反应3h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
(3,4
‑
亚甲二氧基苯氧基)溴丙烷44.1g,产率85%。1h nmr(400m hz,cdcl3) δ2.14
‑
2.41(m,2h),3.59(t,j=6.4hz,2h),4.03(t,j=5.9hz,2h),5.91(2h,s),6.32(dd,j=8.4, 2.4hz,1h),6.50(d,j=2.4hz,1h),6.70(d,j=8.4hz,1h);
13
c nmr(100mhz,cdcl3)δ 152.8,149.4,145.4,109.7,107.1,100.3,101.8,67.1,32.8,29.9.。
[0090]
实施例24
[0091]3‑
(1
‑
萘氧基)溴丙烷的制备
[0092]
向反应釜中投入四氯化碳200ml后开启搅拌,依次加入丙烯基(1
‑
萘基)醚36.8g,过氧化苯甲酰1g和溴化钠35.7g,升温达到100℃时缓慢滴加硫酸18g,滴加完毕后保温反应5h,待反应完毕后降温至室温,然后有机层用碳酸钠水溶液洗、水洗至中性,干燥后减压浓缩得到3
‑
(1
‑
萘氧基)溴丙烷45.6g,产率86%。1h nmr(400m hz,cdcl3)δ8.24(d,j=7.0hz,1h), 7.81
‑
7.79(m,1h),7.50
‑
7.41(m,4h),6.81(d,j=7.5hz,1h),4.27
‑
4.25(m,2h),3.71
‑
3.68(m, 2h),2.45
‑
2.41(m,2h);
13
c nmr(100m hz,cdcl3)δ154.6,134.8,127.8,126.7,126.1,125.8, 125.5,122.1,120.7,105.0,65.7,32.8,30.5。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。