l
‑
fabp的免疫测定方法以及用于所述方法的测定试剂
1.本技术是国际申请号pct/jp2016/055576,国际申请日2016年2月25日,中国申请号201680023791.7,发明名称为“l
‑
fabp的免疫测定方法以及用于所述方法的测定试剂”的专利申请的分案申请。
技术领域
2.本发明涉及使用抗l
‑
fabp抗体的用于l
‑
fabp的免疫学测定方法以及该方法中使用的测定试剂。
背景技术:
3.脂肪酸结合蛋白(fabp)是存在于细胞溶胶中并具有约14千道尔顿的分子量和结合脂肪酸的能力的一组蛋白质,并且包括至少七种已知分子种类,如肝脏型(l
‑
fabp)、肠型(i
‑
fabp)、心型(h
‑
fabp)、脑型(b
‑
fabp)、皮肤型(c
‑
fabp/e
‑
fabp)、脂肪细胞型(ap2)和外周神经细胞型(髓磷脂p2),这些被认为是由共同的祖先基因进化来的家族。尽管每种类型的fabp显示出特定的组织分布,但是名称表明在其中首先发现该类型的组织,而不必然表示该类型仅存在于所述组织中。例如,至少两种类型的fabp,即肝脏型(l
‑
fabp)和心型(h
‑
fabp)在人肾脏组织中表达,其中l
‑
fabp分布在近端小管中,而h
‑
fabp主要分布在远端小管中(maatman等,biochemical journal,第288卷,第285
‑
290页,1992;maatman等,biochemical journal,第273卷,第759
‑
766页,1991)。
4.专利文献1公开了一种肾病检查方法,其特征在于关注l
‑
fabp在肾组织中的表达与肾病的预后之间的关系和检测试验样品中存在的来源于肾组织的脂肪酸结合蛋白。更具体地,在描述的实例中,使用由肾病患者收集的尿作为样品,通过使用抗小鼠l
‑
fabp多克隆抗体利用夹心elisa测定渗漏到尿中的l
‑
fabp的量。然而,没有描述详细的测定条件(样品处理和抗原
‑
抗体反应的条件)、检测灵敏度、测定值等。
5.在专利文献2中,公开了一种脓毒症或多器官功能衰竭的预测方法,其中,根据以下发现:通过用氧化还原剂如血红素(氯[3,7,12,17
‑
四甲基
‑
8,13
‑
二乙烯基卟啉
‑
2,18
‑
二丙酸(2
‑
)]铁(iii),也称为氯(卟啉)合铁(iii)络合物(chloro(porphyrinato)iron(iii)complex))处理尿来增强尿l
‑
fabp的免疫反应性,和当增强度(诱导倍数)越大时患有脓毒症或多器官功能衰竭的患者的预后越差,通过使用特定抗体的elisa检测l
‑
fabp,以比较用氧化还原剂处理之前和之后的收集尿样品中的检测值。
[0006]
另外,专利文献3公开了一种方法,其中将选自还原剂(谷胱甘肽、半胱氨酸、青霉胺等)、离液剂(尿素、胍等)和表面活性剂(正十二烷基苯磺酸钠等)中的一种或两种化合物作为变性剂添加到尿样品用于以这些化合物预处理尿样品从而改善免疫测定的灵敏度,即对作为分析物的尿蛋白的测定灵敏度,并且l
‑
fabp被描述为尿蛋白的实例。然而,作为测定尿蛋白的方法的一个具体实例,仅描述了用变性剂处理巨蛋白(megalin),以用于利用使用识别两个不同表位的抗人巨蛋白lbd1单克隆抗体的夹心elisa进行检测,而没有包括关于l
‑
fabp检测的具体描述。
[0007]
另一方面,专利文献4公开了一种肾病的检查方法及其检查试剂盒,其特征在于使用以量子点标记的探针和检测试验样品中存在的来源于肾组织的l
‑
fabp。该文献中描述的一个具体实例是使用以量子点标记的探针的免疫色谱,滴下并展开未进行如稀释的操作的尿样品用于免疫色谱,当施加激发光(波长:350nm)时,通过红色荧光裸眼观察l
‑
fabp与量子点标记的单克隆抗体之间的复合物的捕获量。
[0008]
引用列表
[0009]
专利文献
[0010]
专利文献1:日本已公开的专利公开第h11
‑
242026号
[0011]
专利文献2:日本已公开的专利公开第2011
‑
22000号
[0012]
专利文献3:日本已公开的专利公开第2014
‑
85208号
[0013]
专利文献4:wo 2009/081680
技术实现要素:
[0014]
技术问题
[0015]
本发明人尝试通过乳胶比浊免疫测定(latex turbidimetric immunoassay,以下有时称为ltia)检测l
‑
fabp,以开发更快和更简单的测定l
‑
fabp的方法。当利用具有包含作为第一试剂的缓冲液和作为第二试剂的含有固定化抗l
‑
fabp抗体的乳胶颗粒的缓冲液的一般构成的ltia试剂测定l
‑
fabp时,无法获得期望的灵敏度,并且在尿l
‑
fabp的测定中,在与基于elisa的体外诊断产品(renapro(注册商标)l
‑
fabp试验tmb(由cmic holdings制造))的相关性方面也无法获得期望性能。
[0016]
本发明要解决的问题是提供使用抗l
‑
fabp抗体的用于样品中的l
‑
fabp的免疫学测定方法,其检测灵敏度等于或大于现有的基于elisa的体外诊断产品的检测灵敏度,并且具有良好相关性。本发明要解决的另一问题是提供用于使用抗l
‑
fabp抗体的用于样品中的l
‑
fabp的免疫学测定方法的试剂和试剂盒。
[0017]
问题的解决方案
[0018]
[1]一种利用抗l
‑
fabp抗体检测样品中的l
‑
fabp(肝脏型脂肪酸结合蛋白)的方法,其包括使抗l
‑
fabp抗体以及分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与疑似包含l
‑
fabp的样品接触的步骤。
[0019]
[2]根据以上第[1]项所述的方法,其中所述分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物为选自式(1)表示的化合物或其盐或酯和式(2)表示的化合物或其盐中的一种或两种以上:
[0020]
式(1)的化合物或其盐或酯
[0021]
[化学式1]
[0022]
[0023]
[在式(1)中,r1为氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,r2至r6各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、羟基、羧基、氨基或
‑
sr7(r7表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r7时,r7可以是彼此相同的基团或彼此不同的基团)];和
[0024]
式(2)的化合物或其盐
[0025]
[化学式2]
[0026][0027]
[在式(2)中,r
11
至r
14
各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、氨基、可以经卤原子取代的苯基或
‑
sr
16
(r
16
表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r
16
时,r
16
可以是彼此相同的基团或彼此不同的基团),其中存在于同一分子中的r
11
和r12可以一起形成羰基,并且存在于同一分子中的r
13
和r
14
可以一起形成羰基,
[0028]
r
15
表示氢原子、卤原子、或可以带支链的具有1、2或3的碳数的烷基,
[0029]
x
11
为氮原子或硫原子,
[0030]
x
12
和x
13
各自独立地为碳原子或氮原子,
[0031]
l1、l2、m1、m2和n各自独立地为0或1,并且
[0032]
x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线各自独立地为单键或双键,其中
[0033]
l1、l2、m1、m2和n的值以及x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线的键指示根据x
11
至x
13
的化合价适当确定的值和化学键]。
[0034]
[3]根据以上第[2]项所述的方法,其中式(2)表示的化合物或其盐为选自以下化合物或其盐中的一种或两种以上:
[0035]
式(2)的化合物或其盐
[0036]
[化学式3]
[0037][0038]
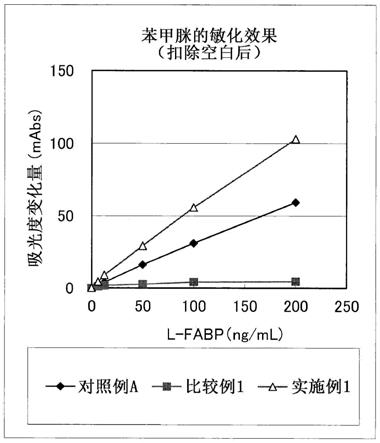
[在式(2)中,r
11
至r
14
各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、氨基、可以经卤原子取代的苯基或
‑
sr
16
(r
16
表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r
16
时,r
16
可以是彼此相同的基团或彼此不同的基团),其中存在于同一分子中的r
11
和r
12
可以一起形成羰基,并且存在于同一分子中的r
13
和r
14
可以一起形成羰基,
[0039]
r
15
表示氢原子、卤原子、或可以带支链的具有1、2或3的碳数的烷基],其中
[0040]
在x
11
至x
13
、l1 l2、m1 m2、n(l1、l2、m1、m2和n各自独立地表示0或1)和双虚线的组合中,
[0041]
(a)x
11
为硫原子,x
12
和x
13
为碳原子,l1 l2为2,m1 m2为2,n为0,x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线为单键,
[0042]
(b)x
11
为硫原子,x
12
和x
13
为碳原子,l1 l2为1,m1 m2为1,n为0,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键,
[0043]
(c)x
11
为氮原子,x
12
和x
13
为碳原子,l1 l2为2,m1 m2为2,n为1,x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线为单键,
[0044]
(d)x
11
为氮原子,x
12
和x
13
为碳原子,l1 l2为1,m1 m2为1,n为1,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键,
[0045]
(e)x
11
和x
12
为氮原子,x
13
为碳原子,l1 l2为1,m1 m2为1,n为0,x
11
和x
13
之间的双虚线为双键,x
12
和x
13
之间的双虚线为单键,或
[0046]
(f)x
11
、x
12
和x
13
为氮原子,l1 l2为0,m1 m2为0,n为1,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键。
[0047]
[4]根据以上第[1]项所述的方法,其中使抗l
‑
fabp抗体以及分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与疑似包含l
‑
fabp的样品接触的步骤按以下顺序进行:在使所述化合物与疑似包含l
‑
fabp的样品接触的步骤之后是使所述化合物与所述抗l
‑
fabp抗体接触的步骤。
[0048]
[5]根据以上第[1]至[4]项中任一项所述的方法,其中,在使抗l
‑
fabp抗体以及分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与疑似包含l
‑
fabp的样品接触的步骤中,所述化合物的浓度为300mmol/l至500mmol/l。
[0049]
[6]根据以上第[1]至[5]项中任一项所述的方法,其中所述抗l
‑
fabp抗体被固定在不溶载体上。
[0050]
[7]根据以上第[6]项所述的方法,其中所述不溶载体为乳胶颗粒、金属胶体颗粒、多孔膜或由合成高分子化合物制成的免疫平板。
[0051]
[8]根据以上第[7]项所述的方法,其中采用颗粒凝集测定法。
[0052]
[9]根据以上第[7]项所述的方法,其中采用侧流型或流过型免疫色谱。
[0053]
[10]根据以上第[1]至[9]项中任一项所述的方法,其中抗l
‑
fabp抗体为具有彼此不同的识别位点的两种以上单克隆抗体。
[0054]
[11]根据以上第[10]项所述的方法,其中将具有彼此不同的识别位点的两种以上单克隆抗体分别固定在乳胶颗粒上,其中通过乳胶比浊免疫测定检测l
‑
fabp。
[0055]
[12]根据以上第[10]项所述的方法,其中,用标记物质标记具有彼此不同的识别位点的两种以上单克隆抗体中的一种单克隆抗体,同时将另外的一种或多种单克隆抗体固定在一个或多个固相上,其中通过免疫色谱、elisa或化学发光检测法检测l
‑
fabp。
[0056]
[13]根据以上第[1]至[12]项中任一项所述的方法,其中所述样品为尿、全血、血清或血浆。
[0057]
[14]一种用于利用抗l
‑
fabp抗体检测样品中的l
‑
fabp的试剂,其包含抗l
‑
fabp抗体;以及分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物。
[0058]
[15]一种用于利用抗l
‑
fabp抗体检测样品中的l
‑
fabp的预处理方法,其包括使分
子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与疑似包含l
‑
fabp的样品接触的步骤。
[0059]
[16]一种用于利用抗l
‑
fabp抗体检测样品中的l
‑
fabp的预处理试剂,其包含分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物。
[0060]
[17]一种改善利用抗l
‑
fabp抗体检测样品中的l
‑
fabp(肝脏型脂肪酸结合蛋白)的方法的测定灵敏度的方法,其包括使抗l
‑
fabp抗体以及分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与疑似包含l
‑
fabp的样品接触的步骤。
[0061]
[18]根据以上第[17]项所述的方法,其中分子中具有nh2
‑
c=n
‑
局部结构和环状结构的化合物为选自式(1)表示的化合物或其盐或酯和式(2)表示的化合物或其盐中的一种或两种以上:
[0062]
式(1)的化合物或其盐或酯
[0063]
[化学式4]
[0064][0065]
[在式(1)中,r1为氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,r2至r6各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、羟基、羧基、氨基或
‑
sr7(r7表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r7时,r7可以是彼此相同的基团或彼此不同的基团)];和
[0066]
式(2)的化合物或其盐
[0067]
[化学式5]
[0068][0069]
[在式(2)中,r
11
至r
14
各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、氨基、可以经卤原子取代的苯基或
‑
sr
16
(r
16
表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r
16
时,r
16
可以是彼此相同的基团或彼此不同的基团),其中存在于同一分子中的r
11
和r
12
可以一起形成羰基,存在于同一分子中的r
13
和r
14
可以一起形成羰基,
[0070]
r
15
表示氢原子、卤原子、或可以带支链的具有1、2或3的碳数的烷基,
[0071]
x
11
为氮原子或硫原子,
[0072]
x
12
和x
13
各自独立地为碳原子或氮原子,
[0073]
l1、l2、m1、m2和n各自独立地为0或1,
[0074]
x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线各自独立地为单键或双键,其中
[0075]
l1、l2、m1、m2和n的值以及x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线的键指
示根据x
11
至x
13
的化合价适当确定的值和化学键]。
[0076]
[19]根据以上第[18]项所述的方法,其中式(2)表示的化合物或其盐为选自以下化合物或其盐中的一种或两种以上:
[0077]
式(2)的化合物或其盐
[0078]
[化学式6]
[0079][0080]
[在式(2)中,r
11
至r
14
各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、氨基、可以经卤原子取代的苯基或
‑
sr
16
(r
16
表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r
16
时,r
16
可以是彼此相同的基团或彼此不同的基团),其中存在于同一分子中的r
11
和r
12
可以一起形成羰基,存在于同一分子中的r
13
和r
14
可以一起形成羰基,
[0081]
r
15
表示氢原子、卤原子、或可以带支链的具有1、2或3的碳数的烷基],其中
[0082]
在x
11
至x
13
、l1 l2、m1 m2、n(l1、l2、m1、m2和n各自独立地表示0或1)和双虚线的组合中,
[0083]
(a)x
11
为硫原子,x
12
和x
13
为碳原子,l1 l2为2,m1 m2为2,n为0,x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线为单键,
[0084]
(b)x
11
为硫原子,x
12
和x
13
为碳原子,l1 l2为1,m1 m2为1,n为0,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键,
[0085]
(c)x
11
为氮原子,x
12
和x
13
为碳原子,l1 l2为2,m1 m2为2,n为1,x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线为单键,
[0086]
(d)x
11
为氮原子,x
12
和x
13
为碳原子,l1 l2为1,m1 m2为1,n为1,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键,
[0087]
(e)x
11
和x
12
为氮原子,x
13
为碳原子,l1 l2为1,m1 m2为1,n为0,x
11
和x
13
之间的双虚线为双键,x
12
和x
13
之间的双虚线为单键,或
[0088]
(f)x
11
、x
12
和x
13
为氮原子,l1 l2为0,m1 m2为0,n为1,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键。
[0089]
[20]根据以上第[17]项所述的方法,其中使抗l
‑
fabp抗体以及分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与疑似包含l
‑
fabp的样品接触的步骤按以下顺序进行:在使所述化合物与疑似包含l
‑
fabp的样品接触的步骤之后是使所述化合物与抗l
‑
fabp抗体接触的步骤。
[0090]
[21]根据以上第[17]至[20]项中任一项所述的方法,其中,在使抗l
‑
fabp抗体以及分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与疑似包含l
‑
fabp的样品接触的步骤中,所述化合物的浓度为300mmol/l至500mmol/l。
[0091]
[22]根据以上第[17]至[21]项中任一项所述的方法,其中所述抗l
‑
fabp抗体被固
定在不溶载体上。
[0092]
[23]根据以上第[22]项所述的方法,其中不溶载体为乳胶颗粒、金属胶体颗粒、多孔膜或由合成高分子化合物制成的免疫平板。
[0093]
[24]根据以上第[23]项所述的方法,其中采用颗粒凝集测定法。
[0094]
[25]根据以上第[23]项所述的方法,其中采用侧流型或流过型免疫色谱。
[0095]
[26]根据以上第[17]至[25]项中任一项所述的方法,其中抗l
‑
fabp抗体为具有彼此不同的识别位点的两种以上单克隆抗体。
[0096]
[27]根据以上第[26]项所述的方法,其中将具有彼此不同的识别位点的两种以上单克隆抗体分别固定在乳胶颗粒上,其中通过乳胶比浊免疫测定检测l
‑
fabp。
[0097]
[28]根据以上第[26]项所述的方法,其中,用标记物质标记具有彼此不同的识别位点的两种以上单克隆抗体中的一种单克隆抗体,同时将另外的一种或多种单克隆抗体固定在一个或多个固相上,其中通过免疫色谱、elisa或化学发光检测法检测l
‑
fabp。
[0098]
[29]根据以上第[17]至[28]项中任一项所述的方法,其中样品为尿、全血、血清或血浆。
[0099]
[30]一种用于改善用于利用抗l
‑
fabp抗体检测样品中的l
‑
fabp的试剂的测定灵敏度的试剂,其包含抗l
‑
fabp抗体;以及分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物。
[0100]
[31]一种用于改善用于利用抗l
‑
fabp抗体检测样品中的l
‑
fabp的方法的测定灵敏度的预处理方法,其包括使分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与疑似包含l
‑
fabp的样品接触的步骤。
[0101]
[32]一种用于改善用于利用抗l
‑
fabp抗体检测样品中的l
‑
fabp的试剂的测定灵敏度的预处理试剂,其包含分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物。
[0102]
发明的有益效果
[0103]
根据本发明,通过使分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与样品中的l
‑
fabp接触,可以用免疫学测定方法更快和更简单地检测样品中的l
‑
fabp。
附图说明
[0104]
[图1]图1为ltia中式(1)的化合物(苯甲脒盐酸盐)和基准方法的预处理液组分的效果的比较结果图。
具体实施方式
[0105]
(样品)
[0106]
本发明中使用的样品的实例包括尿、血液(全血、血浆或血清)、肾组织、来自肾组织的提取物等。其中,尿为特别优选的样品。任何样品都是可使用的,只要样品疑似包含l
‑
fabp即可,包括来源于健康受试者的样品、来源于患者的样品、来源于疑似患有疾病的人的样品等。
[0107]
(抗l
‑
fabp抗体)
[0108]
对于本发明中使用的抗l
‑
fabp抗体,可以将由器官、细胞、体液等纯化的天然l
‑
fabp制备为免疫原(抗原)。l
‑
fabp主要分布在肝或肾中,由此可以由这些器官等纯化和分
离。此外,已知l
‑
fabp在人、小鼠、猪、牛和大鼠中是高度同源的,在氨基酸水平上具有90%以上的同源性,因此例如可以使用小鼠l
‑
fabp作为抗原用于获得与人l
‑
fabp结合的抗体。
[0109]
可以根据kelvin等人的文献(j.biol.chem.,第263卷,第15762
‑
15768页,1988)中所述的方法等进行天然l
‑
fabp的纯化。具体地,在使切除的器官匀化后,通过凝胶过滤、阴离子交换层析等将通过超速离心获得的细胞质级分分为小部分,并通过使用分子量或脂肪酸结合活性作为指标选择包含l
‑
fabp的级分,并将其分离和纯化。对所选择的级分进行sds
‑
聚丙烯酰胺电泳以确认纯化的蛋白质形成单一条带,并且,如果需要的话进行进一步纯化。对于纯化的蛋白质,可以确定氨基酸组成和n端氨基酸序列,并将其与报道的组成和序列进行比较,以确认蛋白质为目标分子种类。
[0110]
用作抗原的l
‑
fabp可以是通过基因工程技术生成的重组蛋白。由于例如(veerkamp和maatman,prog.lipid res.,第34卷,第17
‑
52页,1995)已经报道了l
‑
fabp的氨基酸序列和基因序列,因此可以基于这些序列设计引物用于通过pcr(聚合酶链式反应)法由合适的cdna文库等克隆cdna。该cdna可以用于进行基因重组以制备重组l
‑
fabp。此外,l
‑
fabp的片段或具有其部分序列的合成肽等可以根据需要与载体大分子物质(bsa、血蓝蛋白等)结合,并用作抗原。
[0111]
特异性结合l
‑
fabp的抗体可以是抗血清、多克隆抗体、单克隆抗体等中的任一种。
[0112]
抗体优选具有高特异性,例如在抗l
‑
fabp抗体的情况下,理想地,抗体基本上不与h
‑
fabp交叉反应。为了获得具有较高特异性的抗体,有利地使用高度纯化的和高纯度的抗原。当制备抗体时,通过接种如上所述制备的纯化抗原使非人类温血动物免疫。用于免疫的非人类温血动物的实例包括哺乳动物(兔、绵羊、大鼠、小鼠、豚鼠、马、猪等)和鸟类(鸡、鸭、鹅等)。在兔的情况下,例如,在背部或后足掌部皮下接种在约1ml生理盐水和弗氏完全佐剂中乳化的约100μg至1mg抗原,从第二次开始,佐剂替换为弗氏不完全佐剂,以二至四周的间隔接种抗原三至八次用于免疫,抗体在最终接种后约7至12天产生,并被使用。在小鼠的情况下,通常以约两周的间隔皮下、腹膜内或静脉内接种10至30μg/动物的抗原三至八次用于免疫,以使用在最终接种后的约二至四天产生的抗体。
[0113]
多克隆抗体可以通过收集来自如上所述免疫的动物的血液、分离血清(抗血清)并由所获得的抗血清回收ig级分来制备。例如,多克隆igg可以通过凭借使用蛋白g柱的亲和层析等由抗血清回收igg级分来制备。
[0114]
单克隆抗体由通过使由免疫动物收集的抗体产生细胞与永生化细胞融合获得的杂交瘤产生。小鼠和大鼠优选用作用于单克隆抗体的免疫动物。可以根据如下的kohler和milstein(kohler和milstein,nature,第256卷,第495
‑
887页,1975)的方法产生杂交瘤。收集来自如上所述免疫的动物的抗体产生细胞(如脾细胞或淋巴结细胞),并使其与合适的永生化细胞融合。例如,骨髓瘤细胞的细胞系(nsi
‑
ag4/1、sp2/o
‑
agl4等)优选用作永生化细胞。骨髓瘤细胞优选为自身不产生抗体或者免疫球蛋白h或l链的非分泌者。骨髓瘤细胞优选具有选择标记物,使得可以在选择培养基中筛选未融合的骨髓瘤细胞和融合的杂交瘤。例如,对于选择标记物,通常使用具有8
‑
氮鸟嘌呤耐受性(次黄嘌呤
‑
鸟嘌呤
‑
磷酸核糖转移酶缺陷)、胸苷激酶缺陷等的细胞系。通过添加合适的融合促进剂如聚乙二醇来进行细胞融合。细胞融合优选以每个永生化细胞约10个抗体产生细胞的比例进行,并且可以优选地以约106个细胞/ml的抗体产生细胞的细胞密度进行。
[0115]
适当地稀释进行融合处理的细胞,然后在选择培养基中培养一周至两周。例如,当使用耐受8
‑
氮鸟嘌呤的骨髓瘤细胞时,在hat(次黄嘌呤、氨基喋呤、胸苷)培养基中培养的未融合的骨髓瘤细胞死亡,在hat(次黄嘌呤、氨基喋呤、胸苷)培养基中培养的未融合的抗体产生细胞由于有限的分裂周期也死亡;但是,仅融合细胞可以继续进行分裂并在选择培养基中生存。在选择培养基中培养后,例如,利用固定在固相上的抗原对上清液进行elisa,以检测目标抗体的存在/不存在,克隆可以通过有限稀释法进行以选择产生识别目标抗原的单克隆抗体的杂交瘤。选择产生具有期望性质(如抗体效价、抗体种类、亚类、对抗原的亲和性、特异性、表位等)的单克隆抗体的杂交瘤。igg通常优选作为单克隆抗体种类。
[0116]
将单克隆抗体产生杂交瘤腹膜内植入到与用于免疫的动物相同物种的动物中,经过一定时间后,可以由所述动物收集腹水,以分离目标单克隆抗体。或者,可以在合适的动物细胞培养基中培养杂交瘤,可以由培养液分离单克隆抗体。一旦获得目标杂交瘤,就可以由杂交瘤获得编码单克隆抗体的基因,以通过常用的基因重组技术在合适的宿主(例如蚕等)中表达和产生目标单克隆抗体。例如,可以根据需要按照组合硫酸铵沉淀、凝胶层析、离子交换层析、亲和层析等的通常纯化方法进行抗体的分离和纯化。
[0117]
本发明中使用的抗l
‑
fabp抗体可以是已知抗体或未来开发的抗体。尽管没有特别限制,但是可以使用的市售抗l
‑
fabp抗体包括圣克鲁斯生物技术(santa cruz biotechnology)的c
‑
4(目录号:sc
‑
374537)、f
‑
9(目录号:sc
‑
271591),r&d系统(r&d systems)的328607(目录号:mab2964),hycult biotech的l2b10(目录号:ha 2049
‑
ia),lifespan biosciences的2g4(目录号:ls
‑
b3001)等。这些抗体与来源于人类的l
‑
fabp蛋白的内部区域、n端区域等的多肽结合,即使当抗体与l
‑
fabp分子的内部区域结合时,也可以通过使用本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物以较高灵敏度和较高特异性检测l
‑
fabp。
[0118]
本发明中的“抗体”不仅包括完全的免疫球蛋白分子,还包括本领域中已知的具有抗原结合能力的抗体片段或抗体衍生物,如fab、fab’2、cdr、人源化抗体、多功能抗体和单链抗体(scfv)。
[0119]
(检测)
[0120]
本发明的使用抗l
‑
fabp抗体检测l
‑
fabp的方法为免疫学测定方法。更具体地,其实例包括但不限于颗粒免疫凝集测定法如乳胶比浊免疫测定(ltia)、elisa、化学发光检测法和免疫色谱(侧流型、流过型)。其中,更优选不包括用于b/f分离的步骤的免疫学测定方法(均相免疫测定法)。
[0121]
应注意,当在本说明书中描述ltia作为测定方法时,其检测方法可以通过使用本说明书中任何已知检测方法,如透射光(吸光度)变化的测定、散射光变化的测定和颗粒变化的测定来实现。
[0122]
此外,本领域技术人员可以容易地理解,本发明适用于免疫组织学染色法、电泳法(蛋白质印迹等)、斑点印迹法等,只要通过使用与本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物接触的样品进行使用抗l
‑
fabp抗体的免疫学测定即可。
[0123]
此外,术语“检测”或“测定”必须最广义地解释,包括l
‑
fabp的存在的证明和/或定量,而必须不被解释为限制。
[0124]
(不溶载体)
[0125]
本发明中使用的不溶载体可以是由聚合物基材如聚苯乙烯树脂、无机基材如玻璃、多糖基材如纤维素和琼脂糖等制成的不溶载体,并且在其形状方面没有特别限制,可以根据所采用的测定方法选择任何形状,包括小珠或颗粒状(例如乳胶颗粒、金属胶体颗粒)、平板或片状(例如多孔膜、免疫平板)、管状(例如试管)等。
[0126]
颗粒的实例包括在颗粒免疫凝集测定法中通常使用的主要由聚苯乙烯构成的乳胶颗粒,以及包含苯乙烯
‑
丁二烯共聚物、(甲基)丙烯酸酯聚合物等作为基材的颗粒。由金属胶体、明胶、脂质体、微囊、二氧化硅、氧化铝、炭黑、金属化合物、金属、陶瓷或磁性材料制成的颗粒也是可以使用的。对于本发明中使用的载体颗粒,可以使用同一种材料或两种以上材料。
[0127]
载体颗粒的粒径优选为0.15μm至0.45μm,更优选0.2μm至0.4μm。可以组合并使用平均粒径不同的两种以上的载体颗粒。
[0128]
多孔膜可以是已知的膜,并且可以由任何材料制成。多孔膜的材料的实例包括但不限于聚乙烯、聚对苯二甲酸乙二酯、尼龙、玻璃、多糖如纤维素和纤维素衍生物、陶瓷等。具体地,实例包括由密理博(millipore)、东洋滤纸(toyo roshi)、沃特曼(whatman)等销售的玻璃纤维滤纸、纤维素滤纸等。
[0129]
平板(免疫平板)可以是已知的平板,并且可以由任何材料制成。平板的材料的实例包括但不限于合成高分子化合物,如氯乙烯、聚乙烯、聚苯乙烯、聚丙烯和聚烯烃弹性体,以及玻璃等。
[0130]
(抗体固定在不溶载体上)
[0131]
用于将抗l
‑
fabp抗体固定在不溶载体上的方法没有特别限制,可以使用任何已知方法。
[0132]
当将抗l
‑
fabp抗体固定在颗粒上时,这通过使用例如利用混合颗粒和抗体造成的物理吸附的物理吸附法、或利用偶联剂如碳二亚胺使颗粒表面上的羧基或氨基与抗体分子化学结合的化学结合法来实现。抗体分子可以凭借间隔分子固定在颗粒上。此外,在通过使用化学结合法使抗体与另一蛋白质如白蛋白结合之后,蛋白质可以物理地或化学地固定在颗粒上。
[0133]
当将抗l
‑
fabp抗体固定在多孔膜上时,抗体可以通过例如将一定量的包含所述抗体的溶液以线、点、特定符号如 的形状涂布至多孔膜来固定化。
[0134]
在本说明书中,“不溶载体”被称为“固相”,使不溶载体能够物理地或化学地支撑抗原或抗体或者使不溶载体能够物理地或化学地支撑抗原或抗体的状态在一些情况下被称为“固定”、“固定化”、“固相化”、“敏化”或“吸附”。
[0135]
(标记的抗体)
[0136]
用于标记抗体的标记物质的实例包括例如酶、荧光物质、化学发光物质、生物素、抗生物素、放射性同位素、胶体金颗粒或着色乳胶颗粒。使标记物质和抗体结合的方法可以是本领域技术人员可用的方法,如戊二醛法、马来酰亚胺法、吡啶基二硫化物法或高碘酸法。标记物质和结合方法都不限于以上描述的那些,可以使用已知方法。
[0137]
对于标记的检测,例如,当使用酶如过氧化物酶或碱性磷酸酶作为标记物质时,可以通过使用酶的特定底物(例如,当酶为辣根过氧化物酶时,使用1,2
‑
苯二胺或3,3’,5,5
’‑
四甲基联苯胺,或在碱性磷酸酶的情况下使用磷酸对硝基苯酯)测定酶活性,当使用生物素
作为标记物质时,至少用与生物素不同的标记物质标记的抗生物素一般与其反应。
[0138]
(分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物)
[0139]
本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物为式(1)和式(2)表示的化合物(在本说明书中有时称为“式(1)的化合物”和“式(2)的化合物”)。
[0140]
式(1)的化合物为以下化合物或其盐或酯:
[0141]
[化学式7]
[0142][0143]
[在式(1)中,r1为氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,r2至r6各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、羟基、羧基、氨基或
‑
sr7(r7表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r7时,r7可以是彼此相同的基团或彼此不同的基团)]。
[0144]
式(2)的化合物为以下化合物或其盐:
[0145]
[化学式8]
[0146][0147]
[在式(2)中,r
11
至r
14
各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、氨基、可以经卤原子取代的苯基或
‑
sr
16
(r
16
表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r
16
时,r
16
可以是彼此相同的基团或彼此不同的基团),其中存在于同一分子中的r
11
和r
12
可以一起形成羰基,存在于同一分子中的r
13
和r
14
可以一起形成羰基,r
15
表示氢原子、卤原子、或可以带支链的具有1、2或3的碳数的烷基,
[0148]
x
11
为氮原子或硫原子,
[0149]
x
12
和x
13
各自独立地为碳原子或氮原子,
[0150]
l1、l2、m1、m2和n各自独立地为0或1,
[0151]
x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线各自独立地为单键或双键,其中
[0152]
l1、l2、m1、m2和n的值以及x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线的键指示根据x
11
至x
13
的化合价适当确定的值和化学键]。
[0153]
此外,式(2)的化合物为以下化合物或其盐:
[0154]
[化学式9]
[0155][0156]
[在式(2)中,r
11
至r
14
各自独立地表示氢原子、卤原子、可以带支链的具有1、2或3的碳数的烷基、氨基、可以经卤原子取代的苯基或
‑
sr
16
(r
16
表示氢原子、羟基或可以带支链的具有1、2或3的碳数的烷基,并且当存在多个r
16
时,r
16
可以是彼此相同的基团或彼此不同的基团),其中存在于同一分子中的r
11
和r
12
可以一起形成羰基,存在于同一分子中的r
13
和r
14
可以一起形成羰基,r
15
表示氢原子、卤原子、或可以带支链的具有1、2或3的碳数的烷基],其中
[0157]
在x
11
至x
13
、l1 l2、m1 m2、n(l1、l2、m1、m2和n各自独立地表示0或1)和双虚线的组合中,
[0158]
(a)x
11
为硫原子,x
12
和x
13
为碳原子,l1 l2为2,m1 m2为2,n为0,x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线为单键,
[0159]
(b)x
11
为硫原子,x
12
和x
13
为碳原子,l1 l2为1,m1 m2为1,n为0,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键,
[0160]
(c)x
11
为氮原子,x
12
和x
13
为碳原子,l1 l2为2,m1 m2为2,n为1,x
11
和x
13
之间的双虚线以及x
12
和x
13
之间的双虚线为单键,
[0161]
(d)x
11
为氮原子,x
12
和x
13
为碳原子,l1 l2为1,m1 m2为1,n为1,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键,
[0162]
(e)x
11
和x
12
为氮原子,x
13
为碳原子,l1 l2为1,m1 m2为1,n为0,x
11
和x
13
之间的双虚线为双键,x
12
和x
13
之间的双虚线为单键,或
[0163]
(f)x
11
、x
12
和x
13
为氮原子,l1 l2为0,m1 m2为0,n为1,x
11
和x
13
之间的双虚线为单键,x
12
和x
13
之间的双虚线为双键。
[0164]
式(1)表示的化合物的实例包括苯甲脒衍生物,式(2)表示的化合物的实例包括氨基噻唑衍生物、氨基三唑衍生物、氨基四唑衍生物和氨基咪唑衍生物。每分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物的盐可以根据需要地选自盐酸盐、硫酸盐、硝酸盐、氢溴酸盐、氢氟酸盐、氟硼酸盐、草酸盐、乳酸盐、已二酸盐、酒石酸盐、氢碘酸盐、甲苯磺酸盐、丙二酸盐、碳酸氢盐等,考虑本发明的效果以及处理的简易性、可用性等没有特别的限制。
[0165]
式(1)的化合物的更具体的实例包括苯甲脒盐酸盐(cas号:1670
‑
14
‑
0)、苯甲脒盐酸盐水合物(cas号:206752
‑
36
‑
5)、4
‑
氟苯甲酰胺肟(cas号:69113
‑
32
‑
2)和4
‑
氯苯甲脒盐酸盐(cas号:14401
‑
51
‑
5)。式(2)的化合物的更具体的实例包括氨基噻唑啉(cas号:1779
‑
81
‑
3)、2
‑
氨基
‑2‑
噻唑啉盐酸盐(cas号:3882
‑
98
‑
2)、假乙内酰硫脲(pseudothiohydantoin,cas号:556
‑
90
‑
1)、2
‑
氨基
‑5‑
溴噻唑氢溴酸盐(cas号:61296
‑
22
‑
8)、2
‑
氨基
‑
4,5
‑
二甲基噻唑氢溴酸盐(cas号:7170
‑
76
‑
5)、2,4
‑
二氨基
‑5‑
苯基噻唑单氢溴酸盐(cas号:6020
‑
54
‑
8)和肌酸酐(cas号:60
‑
27
‑
5)。其中,苯甲脒盐酸盐、2
‑
氨基
‑2‑
噻唑啉盐酸盐和肌酸酐为特别优选的。这些分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合
物可以单独使用,或者可以作为其两种以上的组合使用。
[0166]
本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物的添加浓度的优选范围可以是50mmol/l至1000mmol/l、50mmol/l至500mmol/l、50mmol/l至600mmol/l、100mmol/l至900mmol/l、200mmol/l至800mmol/l、300mmol/l至600mmol/l、300mmol/l至550mmol/l、300mmol/l至500mmol/l和350mmol/l至450mmol/l,优选为50mmol/l至500mmol/l,更优选300mmol/l至500mmol/l。所使用的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物中每一个的最佳浓度可以如本说明书中所述地实验获得。
[0167]
(使本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与样品中的l
‑
fabp接触的方法以及使抗l
‑
fabp抗体样品中的l
‑
fabp接触的方法)
[0168]
使本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与样品中的l
‑
fabp接触的方法可以例如是将包含本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物的液体试剂与样品混合的方法。另一方法可以是将样品供应至用本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物浸润的不溶载体(如多孔膜)使得接触发生的方法。
[0169]
此外,在与本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物接触之后或者同时,通过已知的合适方法,使样品中的l
‑
fabp与固定在不溶载体上的抗l
‑
fabp抗体接触。
[0170]
使本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物与样品接触的方法的实例包括其中使所述化合物作为样品的稀释剂与样品的提取液或样品的保存液、展开液等接触的方法。实例还包括以下方法,其中,在样品收集(如尿收集和血液收集)时,在用于样品收集的容器(如尿收集杯和血液收集管)中,使化合物与样品连同根据需要的酶活性抑制剂、抗凝剂等接触的方法。
[0171]
(测定试剂盒)
[0172]
根据本发明提供的测定试剂盒中除本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物之外的组分没有特别限制,只要可以免疫学测定l
‑
fabp即可。以下会通过以夹心elisa、免疫色谱和ltia作为实例来描述测定试剂盒。
[0173]
<夹心elisa>
[0174]
在夹心elisa的情况下,测定试剂盒包括至少(a)具有固定在其上的本发明的抗l
‑
fabp抗体的不溶载体和(b)用标记物质标记且具有与l
‑
fabp反应的性质的抗体。在该情况下,不溶载体优选为平板(免疫平板),并且可以适当地选择和使用标记物质。
[0175]
固定在不溶载体上的抗体捕获样品中的l
‑
fabp,并在不溶载体上形成复合物。用标记物质标记的抗体与捕获的l
‑
fabp结合,并与上述复合物形成夹心结构。可以通过用与标记物质对应的方法测定标记物质的量来测定样品中的l
‑
fabp。可以通过使用本领域技术人员已知的方法来实现具体方法,如将抗体固定在不溶载体上的方法和使抗体与标记物质结合的方法,而没有特别限制。尽管在该构成的情况下可以设置均相测定法或异相测定法,但是均相测定法是更优选的。
[0176]
本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物可以被添加至例如样品稀释剂或用于抗原
‑
抗体反应的溶液中,由此可以使其与样品中的l
‑
fabp接触。
[0177]
<免疫色谱>
[0178]
通过使用测试条来设置典型的免疫色谱,所述测试条沿包含样品的溶液在片状不溶载体(如多孔膜)上展开的方向按顺序配制有“1.样品供应部位”、“2.保持标记抗体的部位(标记抗体保持部位)”和“3.使用于捕获由标记抗体和l
‑
fabp抗体形成的复合物的抗体固定的部位(捕获抗体部位)”,使得样品溶液由于毛细管作用持续移动。在免疫色谱的情况下,测定试剂盒至少包括如上所述的测试条。
[0179]
具体地,当将预定量的包含l
‑
fabp的样品添加至样品供应部位时,样品由于毛细管作用进入标记保持部位,l
‑
fabp和标记抗体结合到一起形成复合物。当通过膜展开的复合物进入捕获抗体部位时,复合物被固定在膜上的抗体(捕获抗体)捕获以形成[捕获抗体]
‑
[l
‑
fabp]
‑
[标记抗体]的三元复合物。可以通过任意方法(例如,在可以可视化的标记如胶体金颗粒的情况下的凝集图像,或在酶的情况下由于添加底物的显色反应)检测标记,从而检测l
‑
fabp的存在。
[0180]
例如,本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物可以初步被添加至样品稀释剂等中,或可以初步被包含在样品供应部位或标记保持部位中,由此可以使其与样品中的l
‑
fabp接触。例如,专利文献4中所述的免疫色谱为能够应用本发明的方法。
[0181]
<乳胶比浊免疫测定>
[0182]
在乳胶比浊免疫测定的情况下,测定试剂盒至少包括具有固定于其上的抗体的乳胶颗粒。对于乳胶比浊免疫测定中使用的抗体,可以使用“具有不同抗原识别位点的两种单克隆抗体”、“多克隆抗体”或“单克隆抗体和多克隆抗体”的任意组合。在该情况下,乳胶颗粒为同时具有固定于其上的抗体和标记物质的不溶载体。
[0183]
可以按照粒径和材料适当地选择用于这些测定试剂的乳胶颗粒,以获得期望的性能,如改善的灵敏度。乳胶颗粒可以是适合于支撑抗体的任何颗粒。例如,颗粒可以包含聚苯乙烯、苯乙烯
‑
磺酸(盐)共聚物、苯乙烯
‑
甲基丙烯酸共聚物、丙烯腈
‑
丁二烯
‑
苯乙烯共聚物、氯乙烯
‑
丙烯酸酯共聚物、乙酸乙烯酯
‑
丙烯酸酯共聚物等作为基材。尽管乳胶颗粒的形状没有特别限制,但是优选地,平均粒径足够大,足以使得可以用裸眼或者光学地检测由于乳胶颗粒表面上的抗体与l
‑
fabp之间的凝集反应而产生的聚集体。可以使用由诸如金属胶体、明胶、脂质体、微囊、二氧化硅、氧化铝、炭黑、金属化合物、金属、陶瓷或磁性材料的材料制成的颗粒代替乳胶颗粒。
[0184]
在临床检查中使用的用于ltia的典型测定试剂盒通常以第一试剂和第二试剂的形式提供。上述具有固定于其上的抗体的乳胶颗粒可以被包含在第一试剂或第二试剂中。尽管通常优选在第二试剂中包含具有固定于其上的抗体的乳胶颗粒,但是可以在第一试剂或者在第一和第二试剂两者中包含该颗粒。
[0185]
优选在第一试剂中包含本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物。通过将包含本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物的第一试剂与样品混合,样品中的l
‑
fabp与本发明的分子中具有nh2‑
c=n
‑
局部结构和环状结构的化合物接触。
[0186]
除了上述那些之外,本发明的试剂盒适当地包括缓冲组分(缓冲液)。例如,可用于本发明的缓冲液可以是任何常用缓冲液,包括tris
‑
盐酸、硼酸、磷酸、乙酸、柠檬酸、琥珀酸、邻苯二甲酸、戊二酸、马来酸、甘氨酸及其盐,以及good’s缓冲剂,如mes、bis
‑
tris、ada、
pipes、aces、mopso、bes、mops、tes和hepes。
[0187]
为了改善测定灵敏度和抑制非特异性反应,本发明的试剂盒根据需要还包括糖类、蛋白质等。其实例包括促进抗原
‑
抗体反应的组分(高分子化合物,如聚乙二醇、聚乙烯吡咯烷酮、磷脂聚合物等)、蛋白质和肽(白蛋白、酪蛋白等)、氨基酸、糖类(蔗糖、环糊精等)和防腐剂(叠氮化钠、proclin 300等)。
[0188]
尽管来源于组织(如肝和肾)的天然l
‑
fabp可以在样品测定中用作标准物质(l
‑
fabp标准物质),但是标准物质可以是通过基因工程技术产生的重组蛋白。由于例如(veerkamp和maatman,prog.lipid res.,第34卷,第17
‑
52页,1995)已经报道了l
‑
fabp的氨基酸序列和基因序列,因此可以基于这些序列设计引物用于通过pcr(聚合酶链式反应)法由合适的cdna文库等克隆cdna。这可以用于通过基因重组技术来制备重组l
‑
fabp。对于标准物质,更优选使用具有稳定结构的重组蛋白。
[0189]
实施例
[0190]
以下会描述本发明的实施例,以更具体地描述本发明;然而,本发明不限于此,并且可以在不脱离本发明的技术思想的范围内不同地应用。
[0191]
对于实施例1至4,通过在以下条件下使用以下材料来进行测定。
[0192]
(固定抗l
‑
fabp抗体的乳胶颗粒混悬液)
[0193]
(1)固定克隆l抗体的乳胶颗粒混悬液的制备
[0194]
向13ml包含0.36mg/ml抗l
‑
fabp抗体克隆l(由cmic holdings co.,ltd.制造)的20mmol/l tris缓冲液(ph8.5)中,添加13ml的平均粒径为0.27μm的1%乳胶颗粒(由积水化学工业株式会社(sekisui chemical co.,ltd.)制造)混悬液,并在4℃搅拌两小时。在这之后,添加13ml包含0.5%bsa的20mmol/l tris缓冲液(ph8.5),并在4℃搅拌一小时。然后,进行利用5mmol/l mops缓冲液(ph 7.0)的透析以获得固定克隆l抗体的乳胶颗粒混悬液。
[0195]
(2)固定克隆2抗体的乳胶颗粒混悬液的制备
[0196]
向8ml包含0.54mg/ml抗l
‑
fabp抗体克隆2(由cmic holdings co.,ltd.制造)的20mmol/l甘氨酸缓冲液(ph 9.5)中,添加8ml的平均粒径为0.25μm的1%乳胶颗粒(由积水化学工业株式会社(sekisui chemical co.,ltd.)制造)混悬液,并在4℃搅拌两小时。在这之后,添加8ml包含0.5%bsa的20mmol/l甘氨酸缓冲液(ph 9.5),并在4℃搅拌一小时。然后,进行利用5mmol/l mops缓冲液(ph 7.0)的透析以获得固定克隆2抗体的乳胶颗粒混悬液。
[0197]
(l
‑
fabp标准物质)
[0198]
通过专利文献1中所述的基因重组来获得l
‑
fabp标准物质。
[0199]
(l
‑
fabp基准测定法:基准方法)
[0200]
用于通过elisa体外诊断的药品(renapro(注册商标)l
‑
fabp试验tmb)用于基准方法。
[0201]
(对照第一试剂:也用作标准物质稀释剂)
[0202]
100mmol/l磷酸盐缓冲液(ph7.0)
[0203]
300mmol/l nacl
[0204]
0.2%bsa
[0205]
0.4%lipidure
‑
bl 103
[0206]
(第二试剂)
[0207]
5mmol/l mops缓冲液(ph 7.0)
[0208]
2.5abs/ml固定克隆l抗体的乳胶颗粒混悬液
(*)
[0209]
2.5abs/ml固定克隆2抗体的乳胶颗粒混悬液
(*)
[0210]
(*)abs表示在280nm的吸光度。
[0211]
(标准溶液)
[0212]
通过使用标准物质稀释剂将l
‑
fabp标准物质调整至期望浓度,并用作标准溶液。
[0213]
(冷冻解冻的尿)
[0214]
收集后在
‑
30℃冷冻保存的部分尿仅解冻一次并用于测定。
[0215]
(健康血清)
[0216]
通过从没有引起对体内l
‑
fabp变化的关注的既往史且实际具有在参考范围内的尿l
‑
fabp浓度的50位志愿者采集血液来获得血清,并汇集血清作为健康血清。在血液采集和汇集的当天使用健康血清。作为参比,通过使用基准方法测定的健康血清中的l
‑
fabp的浓度低于3ng/ml。
[0217]
(ltia的测定条件)
[0218]
(1)分析装置:日立7170自动分析仪(hitachi 7170automatic analyzer,由日立高新技术公司(hitachi high
‑
technologies corporation)制造)
[0219]
(2)样品量和试剂量:3μl样品,150μl第一试剂,50μl第二试剂
[0220]
(3)反应时间(反应温度):第一试剂5分钟(37℃),第二试剂5分钟(37℃)
[0221]
(4)测光点和测光对象:刚添加第二试剂后与添加后5分钟之间的吸光度变化
[0222]
[实施例1]确认基准方法的预处理液和本发明的化合物对ltia的效果
[0223]
比较根据常规技术的ltia(对照例a)、使用基准方法的预处理液的ltia(比较例1)和使用式(1)的化合物(苯甲脒盐酸盐)的ltia(实施例1)。
[0224]
1.操作
[0225]
(1)实施例1
[0226]
通过使用包含500mmol/l式(1)的化合物(苯甲脒盐酸盐)的对照第一试剂和第二试剂测定作为样品的标准溶液中的l
‑
fabp。
[0227]
(2)对照例a
[0228]
通过使用对照第一试剂和第二试剂测定作为样品的标准溶液中的l
‑
fabp。
[0229]
(3)比较例1
[0230]
通过使用以1体积比1体积的比例混合基准方法的预处理液和两倍浓缩的标准物质稀释剂得到的溶液,将标准物质稀释调整至期望的浓度,并将其用作用于比较例1的样品。通过使用对照第一试剂和第二试剂测定用于比较例1的样品中的l
‑
fabp。
[0231]
2.结果
[0232]
从实施例1、对照例a和比较例1的各试验中测定的样品的吸光度减去各试验中测定的0ng/ml l
‑
fabp样品的吸光度(空白吸光度)以计算净吸光度。图1示出x轴上是l
‑
fabp浓度和y轴上是净吸光度的校正曲线。
[0233]
当测定包含基准方法的预处理液组分的用于比较例1(
‑■‑
)的样品时,在任何l
‑
fabp浓度下净吸光度值都低于对照例a(
‑◆‑
)的净吸光度,此外根本没有观察到与l
‑
fabp
浓度相关的吸光度增加。因此,确认了基准方法的预处理液中的组分对ltia的测定干扰效果。基准方法的包装说明书中记载了预处理液包含表面活性剂,认为表面活性剂可能参与对ltia测定的干扰。
[0234]
另一方面,当在使用包含式(1)的化合物(苯甲脒盐酸盐)的对照第一试剂的实施例1(
‑
δ
‑
)的条件下测定时,在任何l
‑
fabp浓度下净吸光度都超过对照例a(
‑◆‑
)的净吸光度,并且观察到净吸光度的浓度依赖性的增加。因此,确认了式(1)的化合物(苯甲脒盐酸盐)对ltia的敏化效果。
[0235]
[实施例2]确认在冷冻解冻尿的测定的情况下本发明的化合物对ltia的效果
[0236]
通过使用具有式(1)的化合物(苯甲脒盐酸盐)和式(2)的化合物(2
‑
氨基
‑2‑
噻唑啉盐酸盐)共有的局部结构(nh2
‑
c=n
‑
)但是没有环状结构的化合物作为参考例的化合物来确认对ltia的效果。
[0237]
1.操作
[0238]
(1)实施例2a,实施例2b
[0239]
采用二十一份冷冻解冻尿试样(l
‑
fabp浓度:6ng/ml至365ng/ml)作为样品,通过使用包含500mmol/l苯甲脒盐酸盐的对照第一试剂(实施例2a)或包含500mmol/l 2
‑
氨基
‑2‑
噻唑啉盐酸盐的对照第一试剂(实施例2b)和第二试剂测定样品中的l
‑
fabp。
[0240]
(2)对照例b
[0241]
采用上述冷冻解冻尿作为样品,通过使用对照第一试剂和第二试剂测定样品中的l
‑
fabp。
[0242]
(3)参考例2a
[0243]
采用上述冷冻解冻尿作为样品,通过使用包含500mmol/l盐酸胍的对照第一试剂和第二试剂测定样品中的l
‑
fabp。
[0244]
(4)参考例2b
[0245]
采用上述冷冻解冻尿作为样品,通过使用包含500mmol/l氨基磺酸胍的对照第一试剂和第二试剂测定样品中的l
‑
fabp。
[0246]
(5)参考例2c
[0247]
采用上述冷冻解冻尿作为样品,通过使用包含500mmol/l盐酸氨基胍的对照第一试剂和第二试剂测定样品中的l
‑
fabp。
[0248]
2.结果
[0249]
通过使用以标准溶液为样品建立的校正曲线将实施例2a、实施例2b、对照例b和参考例2a至2c的各试验中测定的样品的净吸光度转换为l
‑
fabp浓度。通过以使用基准方法获得的样品的l
‑
fabp浓度(基准测定值)为x轴,以由各试验获得的l
‑
fabp浓度(试验测定值)为y轴绘图,通过最小二乘法研究试验测定值与基准测定值之间的相关性,并将其示于表1中。
[0250]
[表1]
[0251] r2回归方程实施例2a0.968y=1.516x 1.44实施例2b0.917y=0.972x
‑
1749对照例b0.458y=0.128x
‑
0.03
参考例2a0.837y=0.665x 4.59参考例2b0.772y=0.582x
‑
3.25参考例2c0.787y=0.566x
‑
1.10
[0252]
对照例b中的测定值与基准测定值之间的r2低至0.458,确认对照例b的条件不适用于其中使用作为临床检查试样的尿作为样品的测定。另一方面,实施例2a中的测定值与基准测定值之间的相关性是优选的。实施例2b中的测定值与基准测定值之间的相关性也是优选的。因此,确认式(1)的化合物和式(2)的化合物可以产生敏化效果,而不破坏与基准测定值的相关性,并且还可以使尿l
‑
fabp和标准物质的免疫反应性相当。
[0253]
参考例2a至2c中的测定值与基准测定值之间的相关性虽然超过对照例b中的测定值与基准测定值之间的相关性,但是低于实施例2a和实施例2b中的测定值与基准测定值之间的相关性。这表示以下可能性:除了与参考例的化合物共有的局部结构(nh2‑
c=n
‑
)之外,式(1)和(2)的化合物具有的环状结构参与式(1)的化合物和式(2)的化合物的效果。
[0254]
[实施例3]确认本发明的化合物在ltia中的优选浓度,第1部分
[0255]
研究了式(1)的化合物(苯甲脒盐酸盐:ba)的优选浓度。
[0256]
1.操作
[0257]
(1)实施例3
[0258]
采用十二份冷冻解冻尿试样(l
‑
fabp浓度:6ng/ml至130ng/ml)作为样品,通过使用包含表2中所示浓度的式(1)的化合物(苯甲脒盐酸盐:bah)的对照第一试剂和第二试剂测定样品中的l
‑
fabp。
[0259]
2.结果
[0260]
通过使用以标准溶液为样品建立的校正曲线将实施例3中测定的样品的净吸光度转换为l
‑
fabp浓度。通过以使用基准方法获得的样品的l
‑
fabp浓度(基准测定值)为x轴,以由各试验获得的l
‑
fabp浓度(试验测定值)为y轴绘图,通过最小二乘法研究试验测定值与基准测定值之间的相关性,并将其示于表2中。
[0261]
[表2]
[0262][0263]
当使用式(1)的化合物时,确认在任何浓度都有良好的相关性。根据回归方程中的变化,认为可以通过控制式(1)的化合物的使用浓度来调整灵敏度同时保持相关性。
[0264]
[实施例4]血清中l
‑
fabp的添加和回收试验
[0265]
1.操作
[0266]
通过用两倍浓缩的标准物质稀释剂和用健康血清稀释l
‑
fabp标准物质来制备添加和回收试验样品,使得获得表3中所示的添加的l
‑
fabp浓度。样品中健康血清的最终浓度为初始浓度的1/2。
[0267]
通过使用包含500mmol/l苯甲脒盐酸盐的对照第一试剂和第二试剂测定样品的l
‑
fabp。由获得的测定值得到回收率。
[0268]
2.结果
[0269]
每一l
‑
fabp浓度的回收率示于表3中。
[0270]
[表3]
[0271][0272]
在添加的l
‑
fabp的试验浓度范围中获得良好的回收率。确认本发明的方法不限于样品为尿的情况,甚至在使用血清作为样品时也可以获得期望的效果。由于在与尿相比包含更大量的各种共存蛋白质的血清中也获得与使用尿作为样品的情况相同的效果,因此认为本发明的化合物的效果与对共存蛋白质的作用相比对l
‑
fabp具有选择性。
[0273]
对于实施例5和6,通过在以下条件下使用以下材料来进行测定。
[0274]
(固定抗l
‑
fabp抗体的乳胶颗粒混悬液)
[0275]
(1)固定克隆l抗体的乳胶颗粒混悬液的制备
[0276]
向13ml包含0.36mg/ml抗l
‑
fabp抗体克隆l(由cmic holdings co.,ltd.制造)的20mmol/l tris缓冲液(ph 8.5)中,添加13ml的平均粒径为0.27μm的1%乳胶颗粒(由积水化学工业株式会社(sekisui chemical co.,ltd.)制造)混悬液,并在4℃搅拌两小时。在这之后,添加13ml包含0.5%bsa的20mmol/l tris缓冲液(ph 8.5),并在4℃搅拌一小时。然后,进行利用5mmol/l mops缓冲液(ph 7.0)的透析以获得固定克隆l抗体的乳胶颗粒混悬液。
[0277]
(2)固定克隆1抗体的乳胶颗粒混悬液的制备
[0278]
向8ml包含0.54mg/ml抗l
‑
fabp抗体克隆1(由cmic holdings co.,ltd.制造)的5mmol/l tris缓冲液(ph 7.5)中,添加8ml的平均粒径为0.25μm的1%乳胶颗粒(由积水化学工业株式会社(sekisui chemical co.,ltd.)制造)混悬液,并在4℃搅拌两小时。在这之后,添加8ml包含0.5%bsa的5mmol/l tris缓冲液(ph 7.5),并在4℃搅拌一小时。然后,进行利用5mmol/l mops缓冲液(ph 7.0)的透析以获得固定克隆1抗体的乳胶颗粒混悬液。
[0279]
(l
‑
fabp标准物质)
[0280]
通过专利文献1中所述的基因重组来获得l
‑
fabp标准物质。
[0281]
(l
‑
fabp基准测定法:基准方法)
[0282]
用于通过elisa体外诊断的药品(renapro(注册商标)l
‑
fabp试验tmb)用于基准方法。
[0283]
(对照第一试剂)
[0284]
300mmol/l kcl
[0285]
0.2%bpf(由东洋纺(toyobo)制造,目录号:bpf
‑
301)
[0286]
0.32%至0.68%lipidure
‑
bl403se
[0287]
(第二试剂)
[0288]
5mmol/l mops缓冲液(ph 7.0)
[0289]
3.75abs/ml固定克隆l抗体的乳胶颗粒混悬液
(*)
[0290]
1.25abs/ml固定克隆1抗体的乳胶颗粒混悬液
(*)
[0291]
(*)abs表示在280nm的吸光度。
[0292]
(标准物质稀释剂)
[0293]
磷酸盐缓冲液(ph 7.0)
[0294]
0.1%bpf(由东洋纺(toyobo)制造,目录号:bpf
‑
301)
[0295]
(标准溶液)
[0296]
通过使用标准物质稀释剂将l
‑
fabp标准物质调整至期望浓度,并用作标准溶液。
[0297]
(冷冻解冻的尿)
[0298]
收集后在
‑
30℃冷冻保存的部分尿仅解冻一次并用于测定。
[0299]
(ltia的测定条件)
[0300]
(1)分析装置:日立7170自动分析仪(hitachi7170automatic analyzer,由日立高新技术公司(hitachi high
‑
technologies corporation)制造)
[0301]
(2)样品量和试剂量:3μl样品,150μl第一试剂,50μl第二试剂
[0302]
(3)反应时间(反应温度):第一试剂5分钟(37℃),第二试剂5分钟(37℃)
[0303]
(4)测光点和测光对象:刚添加第二试剂后与添加后5分钟之间的吸光度变化
[0304]
(5)测定波长570nm/800nm
[0305]
[实施例5]确认本发明的化合物在ltia中的优选浓度,第2部分
[0306]
通过使用式(1)的化合物(苯甲脒盐酸盐)和式(2)的化合物(2
‑
氨基
‑2‑
噻唑啉盐酸盐和肌酸酐)确认了对ltia的效果。
[0307]
1.操作
[0308]
(1)实施例5a、5b和5c
[0309]
采用三十四份冷冻解冻尿试样(l
‑
fabp浓度:0.6ng/ml至123.0ng/ml)作为样品,通过使用包含表4中所示浓度的苯甲脒盐酸盐(结构式:表5中的5a,实施例5a)、2
‑
氨基
‑2‑
噻唑啉盐酸盐(结构式:表5中的5b,实施例5b)或肌酸酐(结构式:表5中的5c,实施例5c)的对照第一试剂和第二试剂测定样品中的l
‑
fabp。
[0310]
2.结果
[0311]
通过使用以标准溶液为样品建立的校正曲线将实施例5a、5b、5c的各试验中测定的样品的净吸光度转换为l
‑
fabp浓度。通过以使用基准方法获得的样品的l
‑
fabp浓度(基准测定值)为x轴,以由各试验获得的l
‑
fabp浓度(试验测定值)为y轴制图,通过最小二乘法研究试验测定值与基准测定值之间的相关性,并将其示于表4中。
[0312]
[表4]
[0313][0314]
[表5]
[0315][0316]
实施例5a、5b、5c中的测定值与基准测定值之间的相关性在任何浓度都是优选的。此外,确认可以使尿l
‑
fabp和标准物质的免疫反应性相当。
[0317]
[实施例6]确认本发明的化合物对样品保存条件的效果
[0318]
基准方法renapro(注册商标)l
‑
fabp试验tmb的包装说明书中记载了当在收集尿作为样品后保存样品时,样品应冷藏或冷冻(
‑
20℃至
‑
80℃)。
[0319]
在临床环境中,在一些情况下不能在收集样品后立即进行测定。样品的不适当保存可能导致不期望的测定值变化。通过使用本发明的试剂测定室温保存24小时的样品(尿)。
[0320]
1.操作
[0321]
(1)实施例6,比较例2
[0322]
采用二十三份冷冻解冻尿试样(l
‑
fabp浓度:0.3ng/ml至111.9ng/ml)作为样品,通过使用包含表6中所示浓度的式(1)的化合物(苯甲脒盐酸盐:bah)的对照第一试剂(实施例6,比较例2)和第二试剂测定样品中的l
‑
fabp。对于参考例,通过对在基准方法的包装说明书中记载的条件(冷藏保存24小时)下保存的样品使用相同的试剂也测定l
‑
fabp。
[0323]
2.结果
[0324]
通过使用以标准溶液为样品建立的校正曲线将实施例6、比较例2和参考例的各试验中测定的样品的净吸光度转换为l
‑
fabp浓度。通过以使用保存零小时的样品获得的样品的l
‑
fabp浓度(零小时测定值)为x轴,以由各试验获得的l
‑
fabp浓度(试验测定值)为y轴绘图,通过最小二乘法研究试验测定值与零小时测定值之间的相关性,并将其示于表6中。
[0325]
[表6]
[0326][0327]
当利用其中添加了250mmol/l苯甲脒盐酸盐的试剂测定室温保存24小时的样品时,与零小时保存的相关性是良好的;然而,回归方程的斜率较大。这表明室温保存24小时的样品的测定值高于零小时保存的测定值。另一方面,当利用其中添加了500mmol/l苯甲脒盐酸盐的试剂测定样品时,与零小时保存的相关性是良好的,并且回归方程的斜率变化在15%内。甚至在作为基准方法的包装说明书中未记载的条件的室温保存24小时的样品的情况下,也可以通过使用本发明的试剂以与新鲜样品或在良好保存条件中的样品相同的方式测定样品中的l
‑
fabp。
[0328]
还表明本发明的化合物可以用作用于样品的保存液。
[0329]
工业实用性
[0330]
根据本发明,通过使分子中具有nh2
‑
c=n
‑
局部结构和环状结构的化合物与样品中的l
‑
fabp接触,可以用免疫学测定方法更快和更简单地检测样品中的l
‑
fabp。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。