1.本发明涉及含有6
‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺或其药学上可接受的盐的药物组合物。
背景技术:
[0002]6‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺或6
‑
乙基
‑3‑
({3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲氧基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯基}氨基)
‑5‑
(四氢
‑
2h
‑
吡喃
‑4‑
基氨基)吡嗪
‑2‑
甲酰胺(以下,有时也称为国际通用名(inn)的吉瑞替尼)为式(i)的化学结构式所示的化合物。据报道,吉瑞替尼或其药学上可接受的盐例如具有抑制eml4(echinoderm microtubule associated protein like
‑
4,棘皮动物微管结合蛋白
‑
4)
‑
alk(anaplastic lymphoma kinase,间变淋巴瘤激酶)融合蛋白的激酶活性的活性,作为癌症治疗用药物组合物的有效成分是有用的(专利文献1:wo2010/128659,专利文献2:wo2017/006855)。另外,例如以吉瑞替尼换算含有吉瑞替尼富马酸盐40mg的适加坦(xospata)(注册商标)片40mg已经作为急性髓系白血病治疗药上市(非专利文献1:适加坦片40mg说明书(日本),或者pmda、fda或ema的网站)。需要说明的是,吉瑞替尼富马酸盐是由相对于吉瑞替尼2分子而言富马酸为1分子的比例构成的盐化合物的通用名,本说明书中也称为吉瑞替尼半富马酸盐。
[0003]
式(i)
[0004][0005]
为了实现癌症的药物治疗,需要用于发挥适当性能的制剂化,重要的是制成患者的服药依从性良好的制剂。在患者为婴儿、幼儿的情况下,应当考虑的点较多,可列举例如剂型、重量、味道、药品添加物等。从容易吞服的观点出发,婴儿、幼儿所希望的剂型大多为液剂、散剂、颗粒剂、糖浆剂等。但是,药物大多在水溶液中不稳定,因此难以选择液剂、糖浆剂。另外,还产生了为了服用准确量而适当地进行计量这一麻烦事。就散剂、颗粒剂而言,在用分包片材包装的情况下,由于要撕破袋取出药剂,因此存在幼儿难以开封、或者由于一部分洒出而不能服用适当量的课题。而且,在苦味重的药物的情况下,在液剂、散剂、颗粒剂的开发中需要研究用于降低苦味的技术或药品添加物。
[0006]
作为近年备受关注的剂型,有直径为1~4mm左右的小的片剂(以下有时也称为迷你片,有时仅记作片剂)。据报道,对于不能吞咽通常大小的片剂的年龄的幼儿而言,也得到了能够服用迷你片的结果(非专利文献2:takae et al.,pharmacology,japanese society of pharmaceutical sciences,2015,vol.75,p.32
‑
37)。另外,由于每1片的有效成分量比通常大小的片剂少,因此幼儿制剂所需的用量调节也容易通过片剂数进行改变。
[0007]
考虑到连小的片剂也不能吞服的患者,有使必要用量的片剂溶解、分散或悬浮于少量的适当溶剂中的方法。但是,例如将片剂用少量的水悬浮时,药物溶解、降低苦味的效果消失,因此有进一步改善的余地。
[0008]
现有技术文献
[0009]
专利文献
[0010]
专利文献1:国际公开第2010/128659号
[0011]
专利文献2:国际公开第2017/006855号
[0012]
非专利文献
[0013]
非专利文献1:适加坦片40mg说明书(日本)或者pmda、fda或ema的网站
[0014]
非专利文献2:高江誓词等、“药剂学”、日本药剂学会、2015、vol.75、p.32
‑
37
技术实现要素:
[0015]
发明所要解决的问题
[0016]
本发明的课题在于,提供含有吉瑞替尼或其药学上可接受的盐和降低苦味的甜味剂以及用于赋予粘合能力的添加剂、溶出稳定性优良的药物组合物。详细而言,本发明的课题在于,提供溶出稳定性优良的药物组合物,其含有吉瑞替尼或其药学上可接受的盐、降低苦味的甜味剂、以及用于赋予粘合能力的添加剂,抑制经时的热和/或湿度等应激所导致的吉瑞替尼的溶出稳定性下降。
[0017]
用于解决问题的方法
[0018]
本发明人为了降低将含有吉瑞替尼或其药学上可接受的盐的药物组合物用少量的水悬浮时感觉到的苦味,对降低吉瑞替尼或其药学上可接受的盐的苦味的药品添加物进行了深入研究,结果发现了特定的降低苦味的甜味剂。进而,本发明人着眼于吉瑞替尼的溶出稳定性进行了深入研究,结果发现,通过使用特定的用于赋予粘合能力的添加剂,能够提供溶出稳定性优良的含有吉瑞替尼或其药学上可接受的盐的药物组合物等,从而完成了本发明。
[0019]
即,本发明涉及:
[0020]
[1]一种药物组合物,其含有6
‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺或其药学上可接受的盐、甜味剂、以及两种以上糖类和/或糖醇类。
[0021]
[2]根据[1]所述的药物组合物,其中,甜味剂为选自由糖精、安赛蜜、阿斯巴甜和三氯蔗糖、以及它们的混合物组成的组中的一种或两种以上。
[0022]
[3]根据[1]或[2]所述的药物组合物,其中,甜味剂为三氯蔗糖。
[0023]
[4]根据[1]~[3]中任一项所述的药物组合物,其中,糖类为二糖类,糖醇类具有6个或12个碳原子。
[0024]
[5]根据[1]~[4]中任一项所述的药物组合物,其中,两种以上糖类和/或糖醇类选自由甘露糖醇、异麦芽酮糖醇水合物、麦芽糖醇、山梨糖醇、乳糖、蔗糖和海藻糖、以及它们的混合物组成的组。
[0025]
[6]根据[1]~[5]中任一项所述的药物组合物,其中,两种以上糖类和/或糖醇类中的一种为甘露糖醇。
[0026]
[7]根据[1]~[5]中任一项所述的药物组合物,其中,两种以上糖类和/或糖醇类中的一种选自由异麦芽酮糖醇水合物、麦芽糖醇、山梨糖醇、蔗糖和海藻糖组成的组。
[0027]
[8]根据[1]~[5]中任一项所述的药物组合物,其中,两种以上糖类和/或糖醇类中的一种为异麦芽酮糖醇水合物。
[0028]
[9]根据[7]或[8]所述的药物组合物,其中,[7]或[8]所述的异麦芽酮糖醇水合物、麦芽糖醇、山梨糖醇、蔗糖或海藻糖的配合量是相对于药物组合物的重量为1~20重量%。
[0029]
[10]根据[7]或[8]所述的药物组合物,其中,[7]或[8]所述的异麦芽酮糖醇水合物、麦芽糖醇、山梨糖醇、蔗糖或海藻糖作为粘合剂使用。
[0030]
[11]根据[1]~[10]中任一项所述的药物组合物,其中,其药学上可接受的盐为半富马酸盐。
[0031]
[12]根据[1]~[11]中任一项所述的药物组合物,其中,药物组合物为固体状。
[0032]
[13]根据[1]~[12]中任一项所述的药物组合物,其还含有崩解剂。
[0033]
[14]根据[12]或[13]所述的药物组合物,其中,药物组合物为片剂。
[0034]
[15]根据[1]~[14]中任一项所述的药物组合物,其中,将[1]~[14]中任一项所述的药物组合物在40℃且相对湿度75%的条件下保管1个月后,在第十七次修订日本药典溶出试验法0.1mol/l盐酸900ml的桨法中,在溶出试验开始起15分钟后6
‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺溶出85%以上,或者将[1]~[14]中任一项所述的药物组合物在40℃且相对湿度75%的条件下保管2个月和/或3个月后,在第十七次修订日本药典溶出试验法0.1mol/l盐酸900ml的桨法中,在溶出试验开始起15分钟后6
‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺溶出80%以上。
[0035]
[16]根据[1]~[15]中任一项所述的药物组合物,其中,药物组合物溶解或分散于适当的溶剂中而为溶液、悬浮液、糊状或凝胶状。
[0036]
[17]一种药物组合物,其含有6
‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺半富马酸盐、甘露糖醇、三氯蔗糖和异麦芽酮糖醇水合物。
[0037]
[18]根据[1]~[17]中任一项所述的药物组合物,其通过包括下述工序的制造方法制造:
[0038]
(1)通过使至少一种糖类和/或糖醇类分散或溶解于溶剂中而制造粘合液的工序;
[0039]
(2)将6
‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺或其药学上可接受的盐、甜味剂、以及至少一种糖类和/或糖醇类混合而得到混合物的工序;以及
[0040]
(3)将工序(1)中得到的粘合液喷雾或添加到工序(2)中得到的混合物中并进行造粒的工序。
[0041]
[19]一种药物组合物的制造方法,其是含有6
‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺或其药学上可接受的盐、以及两种以上糖类和/或糖醇类的药物组合物的制造方法,所述制造方法包括下述工
序:
[0042]
(1)通过使至少一种糖类和/或糖醇类分散或溶解于溶剂中而制造粘合液的工序;
[0043]
(2)将6
‑
乙基
‑3‑
{3
‑
甲氧基
‑4‑
[4
‑
(4
‑
甲基哌嗪
‑1‑
基)哌啶
‑1‑
基]苯胺基}
‑5‑
[(烷
‑4‑
基)氨基]吡嗪
‑2‑
甲酰胺或其药学上可接受的盐、甜味剂、以及至少一种糖类和/或糖醇类混合而得到混合物的工序;以及
[0044]
(3)将工序(1)中得到的粘合液喷雾或添加到工序(2)中得到的混合物中并进行造粒的工序。
[0045]
发明效果
[0046]
根据本发明,能够提供含有吉瑞替尼或其药学上可接受的盐、降低苦味的甜味剂、以及两种以上糖类和/或糖醇类的溶出稳定性优良的药物组合物,详细而言,能够提供抑制热和/或湿度等应激所导致的吉瑞替尼的溶出性下降的、溶出稳定性优良的药物组合物。
[0047]
另外,根据本发明,使含有吉瑞替尼或其药学上可接受的盐、降低苦味的甜味剂、以及两种以上糖类和/或糖醇类的药物组合物溶解或分散于适当的溶剂中,能够提供溶液、悬浮液、糊状或凝胶状的液体的药物组合物。
[0048]
另外,根据本发明,能够利用下述制造方法提供含有吉瑞替尼或其药学上可接受的盐、降低苦味的甜味剂、以及两种以上糖类和/或糖醇类的药物组合物、详细而言抑制热和/或湿度等应激所导致的吉瑞替尼的溶出性下降的、溶出稳定性优良的药物组合物,所述制造方法包括下述工序:通过使至少一种糖类和/或糖醇类分散或溶解于溶剂中而制造粘合液的工序;将吉瑞替尼或其药学上可接受的盐、降低苦味的甜味剂、以及至少一种糖类和/或糖醇类混合而得到混合物的工序;以及将前工序中得到的粘合液喷雾或添加到前工序中得到的混合物中并进行造粒的工序。
[0049]
另外,根据本发明,能够提供含有吉瑞替尼或其药学上可接受的盐、甘露糖醇、三氯蔗糖、以及异麦芽酮糖醇水合物的药物组合物,详细而言,能够提供抑制热和/或湿度等应激所导致的吉瑞替尼的溶出性下降的、溶出稳定性优良的药物组合物。
[0050]
进而,根据本发明,能够提供含有吉瑞替尼或其药学上可接受的盐、甜味剂、以及两种以上糖类和/或糖醇类的药物组合物的制造方法,详细而言,能够提供包括下述工序的制造方法:通过使至少一种糖类和/或糖醇类分散或溶解于溶剂中而制造粘合液的工序;将吉瑞替尼或其药学上可接受的盐、降低苦味的甜味剂、以及至少一种糖类和/或糖醇类混合而得到混合物的工序;以及将前工序中得到的粘合液喷雾或添加到前工序中得到的混合物中并进行造粒的工序。
具体实施方式
[0051]
本发明涉及含有吉瑞替尼或其药学上可接受的盐、甜味剂、以及两种以上糖类和/或糖醇类的药物组合物。另外,本发明涉及含有吉瑞替尼半富马酸盐、甘露糖醇、三氯蔗糖和异麦芽酮糖醇水合物的药物组合物。
[0052]
本发明中,“甜味剂”是指用于给药物组合物带来甜味的添加剂。另外,作为甜味剂,可列举例如:糖精或糖精钠、甘草酸、阿斯巴甜、甜菊糖、索马甜、安赛蜜、环己基氨基磺酸钠、爱德万甜、甜菊醇糖苷、新橙皮苷二氢查尔酮、纽甜、奇异果甜蛋白等甜的蛋白质、欧亚水龙骨甜素或甘草甜等皂苷及三氯蔗糖、或它们的混合物等。另外,本说明书中,“降低苦
味”是指:对于作为本来具有强烈苦味的物质的吉瑞替尼或其药学上可接受的盐,将苦味抑制到能够服用的程度。用于降低将吉瑞替尼或其药学上可接受的盐用少量的水等悬浮等时感觉到的苦味而优选的甜味剂为糖精、安赛蜜、阿斯巴甜、三氯蔗糖或它们的混合物,更优选为阿斯巴甜或三氯蔗糖,进一步优选为三氯蔗糖。
[0053]
本发明中,“糖精”的别名为邻磺酰苯甲酰亚胺
‑
邻苯甲酰磺酰亚胺
‑2‑
磺基苯甲酰亚胺,为通常以水溶性的钠盐(糖精酸钠)形式使用的甜味剂。
[0054]
另外,本发明中,“安赛蜜”为人工的甜味料。
[0055]
另外,本发明中,“阿斯巴甜”是形成了下述结构的甜味剂:l
‑
苯丙氨酸与甲醇脱水缩合而形成酯,所形成的苯丙氨酸甲酯的氨基与l
‑
天冬氨酸的羧基进行脱水缩合而形成肽键。
[0056]
另外,本发明中,“三氯蔗糖”是4,1’,6
’‑
三氯半乳蔗糖的注册商标名,化学名为1,6
‑
二氯
‑
1,6
‑
双脱氧
‑
β
‑
d
‑
呋喃果糖
‑4‑
氯
‑4‑
脱氧
‑
α
‑
d
‑
半乳糖吡喃糖苷,是将蔗糖的3个羟基选择性地置换为氯原子而得到的甜味剂。
[0057]
用于降低将吉瑞替尼或其药学上可接受的盐用少量的水等溶剂悬浮等时感觉到的苦味所需要的甜味剂的比例例如可通过使用通常被称为味觉传感器的仪器的体外方法、或聘用试验评价小组的感官试验等体内方法来确定。作为感官试验的评价方法,可列举例如下述方法:使以10mg/ml的浓度溶解有化合物a的液体或者类似于化合物a或其药学上可接受的盐的具有苦味的物质中含有适量的甜味剂,将所得试验液含于口中后立即吐出,对刚吐出后~30分钟后的苦味进行评分,但是不限于此。根据甜味剂的种类,适当的甜味剂的配合比例有所不同,相对于药物组合物的重量,典型地为0.001~70.0重量%,优选为0.01~60.0重量%,更优选为0.1~50.0重量%,进一步优选为1.0~40.0重量%,进一步优选为5.0~35.0重量%,进一步优选为5.5~33.3重量%,进一步优选为10.0~30.0重量%,进一步优选为15.0~30.0重量%,进一步优选为20.0~25.0重量%。需要说明的是,上述的上限和下限可以根据期望任意地组合,0.001~40.0重量%等。
[0058]
本发明的药物组合物含有两种以上糖类和/或糖醇类。因此,药物组合物可含有至少两种糖类、至少一种糖类及至少一种糖醇类、或者至少两种糖醇类。
[0059]“糖类”包括例如:葡萄糖、半乳糖等单糖;以及蔗糖、乳糖、海藻糖、麦芽糖等二糖,但是不限于此。优选为二糖类。
[0060]
另外,“糖醇”为醛糖、酮糖的羰基被还原而生成的糖的一种。通过糖的氢化而生成,为甘露糖醇、木糖醇、山梨糖醇、肌醇、麦芽糖醇、乳糖醇等具有通式hoch2(choh)
n
ch2oh的化合物的混合物。需要说明的是,n为4或10、即具有6或12个碳原子的糖醇可列举例如甘露糖醇、异麦芽酮糖醇水合物、麦芽糖醇及山梨糖醇糖,但是不限于此。
[0061]
本发明中使用的“糖类和/或糖醇类”中,作为糖类,优选乳糖、蔗糖、海藻糖、麦芽糖、乳糖、葡萄糖、果糖,更优选可从乳糖、蔗糖或海藻糖中选择。作为糖醇类,优选甘露糖醇、异麦芽酮糖醇水合物、麦芽糖醇、山梨糖醇、木糖醇、乳糖醇、赤藓糖醇,更优选甘露糖醇、异麦芽酮糖醇水合物、麦芽糖醇或山梨糖醇,进一步优选可从甘露糖醇或异麦芽酮糖醇水合物中选择。作为糖类和/或糖醇类,优选乳糖、甘露糖醇、异麦芽酮糖醇水合物、麦芽糖醇、山梨糖醇、蔗糖或海藻糖,更优选甘露糖醇、异麦芽酮糖醇水合物、麦芽糖醇或山梨糖醇,进一步优选甘露糖醇、异麦芽酮糖醇水合物或山梨糖醇,进一步优选可从甘露糖醇或异
麦芽酮糖醇水合物中选择。
[0062]
作为更优选的方式,本发明的药物组合物中含有的两种以上糖类和/或糖醇类中的一种为甘露糖醇,例如作为赋形剂使用。本发明的药物组合物中含有的两种以上糖类和/或糖醇类中的一种为甘露糖醇的药物组合物中,另外的至少一种糖类和/或糖醇类中的一种糖类和/或糖醇类例如作为用于赋予粘合能力的添加剂使用。优选异麦芽酮糖醇水合物、麦芽糖醇、山梨糖醇、蔗糖或海藻糖,更优选异麦芽酮糖醇水合物、麦芽糖醇或山梨糖醇,进一步优选可从异麦芽酮糖醇水合物或山梨糖醇中选择。
[0063]
作为进一步优选的方式,本发明的药物组合物中含有的两种以上糖类和/或糖醇类为甘露糖醇和异麦芽酮糖醇水合物。
[0064]
需要说明的是,异麦芽酮糖醇水合物是指6
‑
o
‑
α
‑
d
‑
吡喃葡糖基
‑
d
‑
山梨糖醇及1
‑
o
‑
α
‑
d
‑
吡喃葡糖基
‑
d
‑
甘露糖醇的混合物,水合形态没有限定。
[0065]
作为本发明的药物组合物中含有的两种以上糖类和/或糖醇类的配合比例,相对于药物组合物的重量,典型地为1~90重量%,优选为5~70重量%,更优选为10~60重量%,进一步优选为15~50重量%,进一步优选为25~45重量%,进一步优选为30~45重量%,进一步优选为35~42重量%,进一步优选为36~42重量%。
[0066]
本发明的药物组合物中含有的两种以上糖类和/或糖醇类中的一种为甘露糖醇的药物组合物中,作为另外的至少一种糖类和/或糖醇类中的一种糖类和/或糖醇类的配合比例,相对于药物组合物的重量,典型地为1~20重量%,优选为3~15重量%,更优选为5~15重量%,进一步优选为7~12%,进一步优选为9~11重量%。需要说明的是,含有甘露糖醇的本发明的药物组合物中,作为甘露糖醇的配合比例,相对于药物组合物的重量,典型地为1~40重量%,优选为10~40重量%,更优选为20~40重量%,进一步优选为25~35重量%,进一步优选为27~33重量%。
[0067]
需要说明的是,上述的上限和下限可以根据期望任意地组合。
[0068]
本说明书中,“溶出稳定性”是指:在热和/或湿度下暴露一定时间后的、吉瑞替尼的溶出性。另外,本说明书中,“溶出稳定性优良”或“抑制经时的溶出稳定性下降”典型地是指:将药物组合物(例如剂型为片剂)在70℃下保存9天、优选在40℃且相对湿度75%(以下也有时将相对湿度x%简单记作x%rh)的条件下保存1个月、2个月、3个月或6个月后,在第十七次修订日本药典溶出试验法的桨法中使用0.1mol/l盐酸900ml、且桨转速为50转/分钟的条件下对上述药物组合物实施溶出试验时,试验开始15分钟后或30分钟后吉瑞替尼的溶出率高。实施该溶出试验时试验开始15分钟后吉瑞替尼的溶出率高典型地为80%以上,优选为85%以上。作为另一方式,是指实施该溶出试验时试验开始30分钟后吉瑞替尼的溶出率典型地为90%以上。作为另一方式是指,将药物组合物在40℃且相对湿度75%的条件下保管1个月后,在第十七次修订日本药典溶出试验法0.1mol/l盐酸900ml的桨法中,在溶出试验开始起15分钟后吉瑞替尼溶出85%以上,或者将药物组合物在40℃且相对湿度75%的条件下保管2个月和/或3个月后,在第十七次修订日本药典溶出试验法0.1mol/l盐酸900ml的桨法中,在溶出试验开始起15分钟后吉瑞替尼溶出80%以上。
[0069]
本发明中使用的吉瑞替尼或其药学上可接受的盐例如可通过专利文献1(国际公开第2010/128659号)记载的方法或基于其进行制造而容易地获得。
[0070]
吉瑞替尼除了不形成盐的游离体的形态以外,还能够与酸形成药学上可接受的
盐。作为所述盐,可列举例如:与盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸等无机酸的酸加成盐;与甲酸、乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、半富马酸、马来酸、乳酸、苹果酸、柠檬酸、酒石酸、碳酸、苦味酸、甲磺酸、乙磺酸、谷氨酸等有机酸的酸加成盐。这些盐可以按照常规方法制造。可优选列举半富马酸。
[0071]
本发明中使用的吉瑞替尼或其药学上可接受的盐晶体的比例只要是在保存中稳定的范围就没有特别限制。在药物组合物为固体的情况下,晶体的比例例如可利用差示扫描量热分析(dsc分析)法、粉末x射线衍射法、固体nmr法、近红外分光(nir)法等进行计算。例如,作为计算吉瑞替尼半富马酸盐中的吉瑞替尼半富马酸盐晶体的比例的方法,例如作为近红外分光法测定,可以利用傅里叶变换近红外光谱仪(mpa、
ブルカー
·
オプティクス
)测定光谱(测定范围;12500cm
‑1~5800cm
‑1、分辨率;8cm
‑1、扫描次数;32次),对得到的光谱进行二阶微分(savitzky
‑
golay卷积法),使用近红外光谱分析软件(例如opus、
ブルカー
·
オプティクス
公司)进行分析。将药物组合物使用研钵和研棒制成粉末状,测定光谱。在药物组合物的光谱测定前,偏最小二乘法对以各种比例混合有吉瑞替尼半富马酸盐晶体的制备品的光谱进行回归分析并制作校正曲线,将由药物组合物得到的光谱内插到该校正曲线中,可以计算吉瑞替尼半富马酸盐晶体的比例。
[0072]
作为晶体的比例,例如相对于吉瑞替尼或其药学上可接受的盐的总量,典型地为60%以上,优选为60~100%,更优选为70~100%,进一步优选为80~100%,进一步优选为90~100%。另外,作为晶体的比例,例如相对于吉瑞替尼或其药学上可接受的盐的总量优选为60%以上且小于100%,更优选为70%以上且小于100%,进一步优选为80%以上且小于100%,进一步优选为90%以上且小于100%。需要说明的是,所使用的数值通常解释为实验误差内(例如,相对于平均值的95%置信区间内)或显示值的
±
10%内的任一较大变量的值及全部变量的值。
[0073]
关于吉瑞替尼或其药学上可接受的盐的给药量,可考虑患者的状态、年龄、性别等并根据各自的情况适宜决定,关于每天的给药量,例如对于成人可以是:以吉瑞替尼计,典型地为5~300mg,优选为10~200mg,更优选为20~180mg,进一步优选为40~160mg,进一步优选为80~140mg,进一步优选为110~130mg。可以将其1次给药或分2~4次给药。需要说明的是,上述的上限和下限可以根据期望任意地组合。
[0074]
关于吉瑞替尼或其药学上可接受的盐的配合比例,例如相对于药物组合物的重量为1~90重量%,优选为5~50重量%,更优选为10~40重量%,进一步优选为25~35重量%。作为吉瑞替尼或其药学上可接受的盐的含量,在制剂整体中为5~300mg,优选为10~200mg,更优选为10~50mg,进一步优选为10~40mg。需要说明的是,上述的上限和下限可以根据期望任意地组合。
[0075]
本发明的药物组合物可以制成各种制剂。可列举例如片剂、胶囊剂、散剂、颗粒剂、细粒剂、干糖浆剂等,但是不限于此。片剂包括:未进行薄膜包衣的片剂、即素片;进行了薄膜包衣的片剂、即薄膜衣片;口腔内崩解片;溶解片剂和迷你片,但是不限于此。优选为片剂或胶囊剂,更优选为片剂。
[0076]
本发明的液体制剂包括溶液、悬浮液、糖浆等,但是不限于此。本发明的液体制剂可通过将含有吉瑞替尼或其药学上可接受的盐、甜味剂以及两种以上糖类/糖醇类的药物组合物在溶剂中溶解、分散、悬浮等来制备。需要说明的是,作为溶剂,可列举例如水、果汁、
牛奶等,但是不限于此。
[0077]
本发明的药物组合物的重量只要患者能服用就没有特别限制。药物组合物的重量典型地为5~600mg,优选为270~600mg,更优选为10~500mg,进一步优选为15~300mg,进一步优选为30~270mg,进一步优选为35~180mg,进一步优选为100~140mg,进一步优选为30~50mg。需要说明的是,上述的上限和下限可以根据期望任意地组合。
[0078]
本发明的药物组合物中,可以在能够实现本发明的效果的范围内根据期望适宜地使用各种药品添加物,例如粘合剂、矫味剂、发泡剂、香料、缓冲剂、抗氧化剂、表面活性剂、助悬剂、薄膜包衣剂、崩解剂、润滑剂等。本发明中,药品添加物可以以一种或两种以上的组合适宜适量地添加。
[0079]
本发明中使用的“粘合剂”是指:为了作用于粒子间而使它们形成并维持集合体而使用的物质。作为粘合剂,包括例如糖类、糖醇类、羟丙基纤维素(hpc)等纤维素衍生物、可溶性聚合物,但是不限于此。优选的是,本发明的药物组合物中含有的糖类和/或糖醇类能够作为粘合剂起作用。需要说明的是,可以以能够实现本发明的效果的范围根据期望添加追加的粘合剂,但是本发明的药物组合物实质上不含hpc。
[0080]
作为矫味剂,可列举例如柠檬酸、酒石酸、苹果酸等,但是不限于此。
[0081]
作为发泡剂,可列举例如碳酸氢钠等,但是不限于此。
[0082]
作为香料,可列举例如柠檬、橙子、樱桃、树莓、薄荷等,但是不限于此。
[0083]
作为缓冲剂,可列举例如:柠檬酸、琥珀酸、富马酸、酒石酸或抗坏血酸、或者它们的盐类;谷氨酸、谷氨酰胺、甘氨酸、天冬氨酸、丙氨酸或精氨酸、或者它们的盐类;氧化镁、氧化锌、氢氧化镁、磷酸或硼酸、或者它们的盐类等,但是不限于此。
[0084]
作为抗氧化剂,可列举例如柠檬酸、亚硝酸钠、抗坏血酸、依地酸钠、大豆卵磷脂、天然维生素e、焦亚硫酸钠、二丁基羟基甲苯等,但是不限于此。
[0085]
作为表面活性剂,可列举例如聚山梨酯80、月桂基硫酸钠、聚氧乙烯氢化蓖麻油等,但是不限于此。
[0086]
作为助悬剂,可列举例如结晶纤维素、羧甲基纤维素钠、黄原胶、琼脂等,但是不限于此。
[0087]
本发明的药物组合物可以还含有薄膜包衣剂。薄膜包衣剂只要能够提供溶出稳定性优良的药物组合物就没有特别限制。可列举例如:聚乙烯醇、羟丙基甲基纤维素(hpmc)、羟丙基纤维素、乙基纤维素(ec)、聚乙烯醇(pva)、聚乙烯醇
·
聚乙二醇
·
接枝共聚物等药学上可接受的聚合物;丙二醇、聚乙二醇(peg)、甘油、三乙酸甘油酯(甘油三乙酸酯)、柠檬酸三乙酯(tec)等药学上可接受的增塑剂;矿物油、植物油等油;滑石、蜡、巴西棕榈蜡等药学上可接受的润滑剂或光泽剂;氧化钛、三氧化二铁等药学上可接受的着色剂;甜味剂;薄荷、浆果、香草等香料;聚葡萄糖、淀粉、阿拉伯胶、黄原胶等粘度调节剂等,但是不限于此。优选含有pva、hpmc或聚乙烯醇
·
聚乙二醇
·
接枝共聚物作为聚合物、含有peg作为增塑剂、含有滑石作为润滑剂、含有三氧化二铁作为着色剂的opadry(注册商标)(日本
カラコン
制)等市售的速释性包衣剂,更优选含有hpmc作为聚合物、含有peg作为增塑剂、含有滑石作为润滑剂、含有三氧化二铁作为着色剂的提供速释性的opadry(注册商标)(日本
カラコン
制)等市售的速释性包衣剂。
[0088]
本发明的药物组合物可以还含有崩解剂。崩解剂只要是能够提供溶出稳定性优良
的药物组合物者就没有特别限制。可列举例如羧甲基纤维素、羧甲基纤维素钙、交联羧甲基纤维素钠、低取代度羟丙基纤维素、玉米淀粉、马铃薯淀粉、大米淀粉、部分α化淀粉、α化淀粉、交联聚维酮,但是不限于此。优选为低取代度羟丙基纤维素。崩解剂可以为崩解剂
‑
赋形剂混合物、例如甘露糖醇/淀粉为8:2(由roquette制造的pearlitol flash)的一部分。本发明中使用的药物组合物中的崩解剂可以添加一种或两种以上的组合。
[0089]
作为本发明中使用的崩解剂的配合量,相对于药物组合物的重量,典型地为1~20重量%,优选为2~15重量%,更优选为3~10重量%,进一步优选为4~6重量%。需要说明的是,上述的上限和下限可以根据期望任意地组合。
[0090]
本发明的药物组合物可以还含有润滑剂。润滑剂可以抑制制剂化工序中(特别是成型工序)中例如药物组合物向臼、杵等的附着、用于从压片装置中的臼中取出片剂的力(后文有时也称为上推压力)的过度增大等,只要能够提供溶出稳定性优良的药物组合物则没有特别限制。可列举例如硬脂酸镁(以下有时也称为mg
‑
st)、硬脂酸钙、硬脂富马酸钠、滑石,但是不限于此。优选为硬脂酸镁。本发明中使用的药物组合物中的润滑剂可以添加一种或两种以上的组合。
[0091]
作为本发明中使用的润滑剂的配合量,相对于药物组合物的重量,典型地为0.5~5重量%,优选为1~3重量%,更优选为1.5~2重量%。需要说明的是,上述的上限和下限可以根据期望任意地组合。
[0092]
本发明还涉及含有吉瑞替尼或其药学上可接受的盐、以及糖类和/或糖醇类的药物组合物的制造方法,其包括下述工序:(1)通过使至少一种糖类和/或糖醇类分散或溶解于溶剂中而制造粘合液的工序;(2)将吉瑞替尼或其药学上可接受的盐、甜味剂、以及至少一种糖类和/或糖醇类混合而得到混合物的工序;以及(3)将工序(1)中得到的粘合液喷雾或添加到工序(2)中得到的混合物中并进行造粒的工序。
[0093]
本发明中使用的“粘合剂”是指:为了作用于粒子间而使它们形成并维持集合体而使用的物质。另外,本发明中使用的“粘合液”是指:通过使粘合剂分散或溶解于溶剂中而得到的液体。作为溶剂,可列举例如水、丙酮、甲醇、乙醇,但是不限于此。
[0094]
关于本发明的制造方法中使用的“甜味剂”、“糖类和/或糖醇类”等,可以直接适用本发明的药物组合物中的该说明。
[0095]
关于本发明的制造方法中的各成分的配合量、配合方法等,可以直接适用本发明的药物组合物中的该说明。
[0096]
以下对本发明的药物组合物的制造方法进行说明,但是,也包括例如包含粉碎、混合、造粒、干燥、过筛、整粒、成型(压片)、薄膜包衣、结晶化等工序的公知方法。
[0097]
粉碎、混合工序
[0098]
粉碎工序中,只要是能够将吉瑞替尼或其药学上可接受的盐及适当的药品添加物按照一般制药学方式粉碎的方法,则装置、手段均没有特别限制。作为粉碎装置,可列举例如锤磨机、球磨机、喷射磨机、胶体磨等,但是不限于此。粉碎条件适宜选择即可,没有特别限制。
[0099]
在与粉碎工序相连的各成分的混合工序中,只要是能够按照一般制药学方式将各成分混合均匀的方法,则装置、手段均没有特别限制。
[0100]
造粒工序
[0101]
造粒工序中,只要是能够将吉瑞替尼或其药学上可接受的盐及适当的药品添加物按照一般制药学方式造粒的方法,则装置、手段均没有特别限制。作为使用水等溶剂或使适量的粘合剂分散或溶解于水等而成的粘合液进行造粒的湿式造粒中所使用的造粒方法、装置,可列举例如高速搅拌造粒法、破碎(粉碎)造粒法、流化床造粒法、挤出造粒法、滚动造粒法、喷雾造粒法或根据这些方法使用的装置等,但是不限于此。作为造粒方法,例如将通过使异麦芽酮糖醇水合物分散或溶解于水等溶剂中而得的粘合液喷雾或添加到包含吉瑞替尼或其药学上可接受的盐及甜味剂的混合物中并进行造粒,由此可以得到造粒物。作为造粒中不使用水的方法,还可以选择使用非水溶剂的湿式造粒法、不使用溶剂的干式造粒法。
[0102]
干燥工序
[0103]
干燥工序中,只要是能够按照一般制药学方式进行干燥的方法,则装置、手段均没有特别限制。作为装置,可列举例如通风干燥机、减压干燥机、真空干燥机、流化床造粒干燥机等,但是不限于此。
[0104]
过筛、整粒工序
[0105]
过筛、整粒工序中,只要是能够按照一般制药学方式进行过筛或整粒的方法,则装置、手段均没有特别限制。作为装置,可列举例如筛、comil、powermill等,但是不限于此。
[0106]
成型(压片)工序
[0107]
成型工序中,只要是将本发明的药物组合物成型的方法,则装置、手段均没有特别限制。可列举例如:不进行造粒、干燥工序,将吉瑞替尼或其药学上可接受的盐及适当的药品添加物混合后,直接进行压缩成型而制造药物组合物的方法;进行造粒并干燥后进行压缩成型而制造药物组合物的方法;进行造粒,进一步混合润滑剂后进行压缩成型而制造药物组合物(例如素片)的方法等,但是不限于此。
[0108]
作为压片装置,可列举例如旋转式压片机、油压机等,但是不限于此。作为压片压力等压片条件,只要是能够压缩成型的压片压力就没有特别限制。例如,利用旋转式压片机(ex
‑
10、畑铁工所制)进行压缩成型时的压片压力(主压)可列举0.5~20.0kn,优选为1.0~10.0kn,更优选为1.5~4.5kn。需要说明的是,上述的上限和下限可以根据期望任意地组合。
[0109]
素片的硬度只要是制造工序至流通过程中不破损的程度的硬度则没有特别限制。例如,利用旋转式压片机(ht
‑
cvx
‑
typeiii20、畑铁工所制)测定压片品的硬度时的硬度可列举30n以上,优选为42n以上,更优选为64n以上,进一步优选为80n以上。需要说明的是,硬度的上限为400n以下。例如在使用旋转式压片机、油压机等作为压片装置的情况下,由于吉瑞替尼或其药学上可接受的盐具有金属附着性强的性质,因此,若进行连续压片则粘附于杵、压缩成型而成的片剂难以从臼中取出、或者上推压力增大。若发生粘附、上推压力增大,不仅会对片剂的外观造成影响,而且还会给臼杵、压片装置带来负担,因此应予以改善。作为改善方法,可列举例如对臼杵进行硬质铬处理或氮化铬处理等,但是不限于此。
[0110]
薄膜包衣工序
[0111]
压片后可以对药物组合物(例如素片)表面实施薄膜包衣。薄膜包衣工序中,只要是按照一般制药学方式进行包衣的方法则没有特别限制。可列举例如锅包衣、流涂、浸涂等,但是不限于此。
[0112]
结晶化工序
[0113]
在吉瑞替尼或其药学上可接受的盐晶体的比例降低的情况下,可以采用促进结晶化的工序。可列举例如微波照射处理、超声波照射处理、低频波照射处理、热电子照射处理等,但是不限于此。
[0114]
作为微波照射处理,可列举例如照射10mhz~25ghz的波长,但是不限于此。处理时间也依赖初始的晶体比例的程度、药品添加物的成分,但是可列举例如进行10秒~60分钟。照射本身可以连续或间断地进行,另外可以在任何时机进行。
[0115]
作为超声波照射处理,可列举例如照射频率为10khz~600khz的声波,但是不限于此。处理时间也依赖于晶体比例的程度、药品添加物的成分,但是可列举例如进行10秒~24小时。照射本身可以连续或间断地进行,另外可以在任何时机进行。
[0116]
实施例
[0117]
本实施例等中记载的吉瑞替尼的半富马酸盐使用了利用专利文献1(国际公开第2010/128659号)记载的方法或基于此的方法制造的物质。
[0118]
本实施例等中记载的甘露糖醇使用了pearlitol(注册商标)50c(roquette制),三氯蔗糖使用了三氯蔗糖(注册商标)(p)(三荣源ffi制),阿斯巴甜使用了味之素kk阿斯巴甜(味之素制),羟丙基纤维素使用了hpc l(日本曹达制)(后文有时也称为hpc),异麦芽酮糖醇水合物使用了galeniq 721(beneo
‑
palatinit制),麦芽糖醇使用了sweet peral(注册商标)p200(roquette制),山梨糖醇使用了neosorb(注册商标)xtab 290(roquette制),蔗糖使用了精制白糖(ue
‑
e)(关东化学制),海藻糖使用了海藻糖(p)(旭化成制),低取代度羟丙基纤维素使用了l
‑
hpc(注册商标)lh
‑
21(信越化学工业制),mg
‑
st使用了parteck(注册商标)lub mst(merck kgaa制),薄膜包衣剂使用了opadry(注册商标)(日本
カラコン
制)或opadry(注册商标)qx(日本
カラコン
制)。
[0119]
《试验例》
[0120]
向将吉瑞替尼半富马酸盐以11.05mg/ml的浓度溶解于水而成的液体中添加多种甜味剂,制备试验液。对制备的试验液实施感官试验,结果获知三氯蔗糖尤其降低吉瑞替尼半富马酸盐的苦味。
[0121]
《参考例、比较例1、实施例1和实施例2的配方》
[0122]
将作为不含两种以上糖类和/或糖醇类的配方的参考例、作为将参考例的一部分甘露糖醇替换为作为甜味剂的三氯蔗糖的配方的比较例1、将比较例1的hpc替换为异麦芽酮糖醇水合物的实施例1和组成比与实施例1若干不同的实施例2的配方示于表1。需要说明的是,本说明书中,参考例表示实质上不含甜味剂的例子,实施例表示含有甜味剂且溶出稳定性优良的例子,比较例表示含有甜味剂且溶出稳定性差的例子。
[0123]
[表1]
[0124]
成分参考例比较例1实施例1实施例2吉瑞替尼半富马酸盐11.0511.0511.0511.05甘露糖醇20.62512.62510.6112.41三氯蔗糖
‑
8.08.48.4hpc1.051.05
‑‑
异麦芽酮糖醇水合物
‑‑
3.63.48l
‑
hpc1.751.751.81.8
mg
‑
st0.5250.5250.720.54素片35.035.036.1837.68opadry(注册商标)1.051.05
‑‑
opadry(注册商标)qx
‑‑
1.081.13薄膜衣片36.0536.0537.2638.81
[0125]
单位:mg
[0126]
《参考例的片剂的制造》
[0127]
按照表1中记载的配方将吉瑞替尼半富马酸盐2223.0g及甘露糖醇4112.0g用流化床造粒机(gpcg
‑
pro
‑
5、
パウレック
制)混合后,喷雾作为粘合液的hpc水溶液3008g(固体成分:7重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,向得到的造粒品6111.9g中加入l
‑
hpc326.8g及mg
‑
st98.05g,用混合机(
コンテナミキサー
pm200(60l容器)、广岛
メタル
&
マシナリー
制)进行混合,得到混合品。将得到的混合品用旋转式压片机(ht
‑
cvx
‑
typeiii20、畑铁工所制)进行压片,得到素片。将得到的素片5158.8g加入到薄膜包衣机(prc
‑
20/60(20l容器)、
パウレック
制)中,用以纯化水分散或溶解opadry(注册商标)而成的液体进行薄膜包衣,得到参考例的薄膜衣片。
[0128]
《比较例1的片剂的制造》
[0129]
按照表1中记载的配方将吉瑞替尼半富马酸盐165.8g、甘露糖醇189.4g及三氯蔗糖120.0g用流化床造粒机(flo
‑
1、
フロイント
产业制)混合后,喷雾作为粘合液的hpc水溶液225g(固体成分:7重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品473.4g中称取196.3g,加入l
‑
hpc10.5g及mg
‑
st3.15g,用聚乙烯袋进行手动混合,得到混合品。将得到的混合品用旋转式压片机(ex
‑
10、畑铁工所制)进行压片,得到素片。将得到的素片35.0g添加到薄膜包衣机(
フローコーターミニ
、
フロイント
产业制)中,用以纯化水分散或溶解opadry(注册商标)而成的液体进行薄膜包衣,得到比较例1的薄膜衣片。
[0130]
《实施例1的片剂的制造》
[0131]
按照表1中记载的配方将吉瑞替尼半富马酸盐2.21kg、甘露糖醇2122.0g及三氯蔗糖1680.0g用流化床造粒机(gpcg
‑
pro
‑
5、
パウレック
制)混合后,喷雾作为粘合液的异麦芽酮糖醇水合物水溶液3602g(固体成分:20重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品6377.5g中称取5385.6g,加入l
‑
hpc288.0g及mg
‑
st115.2g,用混合机(
コンテナミキサー
pm200(60l容器)、广岛
メタル
&
マシナリー
制)进行混合,得到混合品。将得到的混合品用旋转式压片机(ht
‑
cvx
‑
typeiii20、畑铁工所制)进行压片,得到素片。将得到的素片900.6g加入到薄膜包衣机(hct
‑
30、
フロイント
产业制)中,用以纯化水分散或溶解opadry(注册商标)qx而成的液体进行薄膜包衣,得到实施例1的薄膜衣片。
[0132]
《实施例2的片剂的制造》
[0133]
按照表1中记载的配方将吉瑞替尼半富马酸盐165.75g、甘露糖醇186.15g及三氯蔗糖126.0g用流化床造粒机(gpcg
‑
1、
パウレック
制)(以下称为gpcg
‑
1)进行混合后,喷雾作为粘合液的异麦芽酮糖醇水合物水溶液475g(固体成分:10重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品401.9g中称取212.08g,加入l
‑
hpc10.84g及mg
‑
st3.23g,用聚乙烯袋进行手动混合,得到混合品。将得到的混合品用旋转式压片机(ex
‑
10、畑铁工所制)进行压片,得到素片。将得到的素片37.69g加入到薄膜包衣机(mini coater/drier
‑
2、caleva制)中,用以纯化水分散或溶解opadry(注册商标)qx而成的液体进行薄膜包衣,得到实施例2的薄膜衣片。
[0134]
《试验例2》
[0135]
将参考例、比较例1、实施例1及实施例2中制造的各薄膜衣片分别填充到高密度聚乙烯制的瓶中,在40℃、75%rh的条件下保管1个月、2个月或3个月,或者在70℃下保管9天,由此得到各保管样品。需要说明的是,密封条件为将瓶口部通过感应密封进行密封并盖上盖子,开放条件为不盖瓶盖。对于各保管样品,使用溶出试验器(ntr
‑
6100系列、ntr
‑
6200系列或ntr
‑
6400系列、富山产业制),在第十七次修订日本药典溶出试验法的桨法、溶出试验液为0.1mol/l盐酸900ml、桨转速为50转/分钟的条件下实施溶出试验。在试验开始15分钟后及30分钟后,使用紫外可见分光光度法(uv法)或高效液相色谱法(hplc法)测定溶出试验液的吉瑞替尼的峰面积,由得到的峰面积计算吉瑞替尼的浓度,由此计算出溶出率。uv法的情况下,使用紫外可见分光光度计(uv
‑
1800、岛津制作所制)进行测定(波长:313nm)。hplc法的情况下,使用alliance hplc(注册商标)系统(日本沃特斯制)进行测定(波长:314nm)。hplc法中使用的柱为capcellpak c18aq、内径4.6mm、长度150mm、粒径3μm(osakasoda制)或其同等品,维持在40℃而使用,流动相使用高氯酸溶液(ph2.2)/乙腈混合液=65/35。将未保管及各保管样品的吉瑞替尼的溶出率示于表2。
[0136]
[表2]
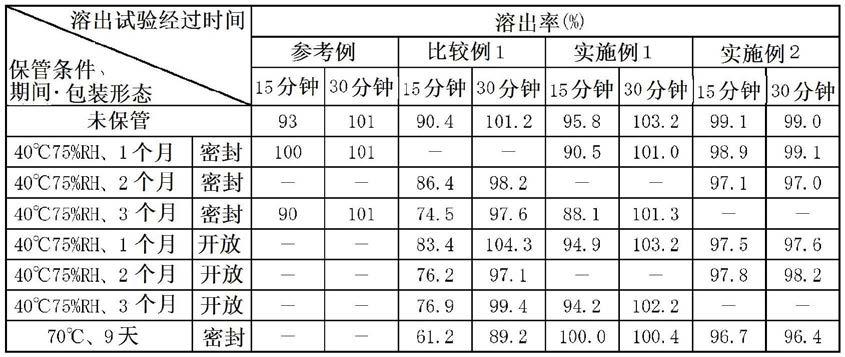
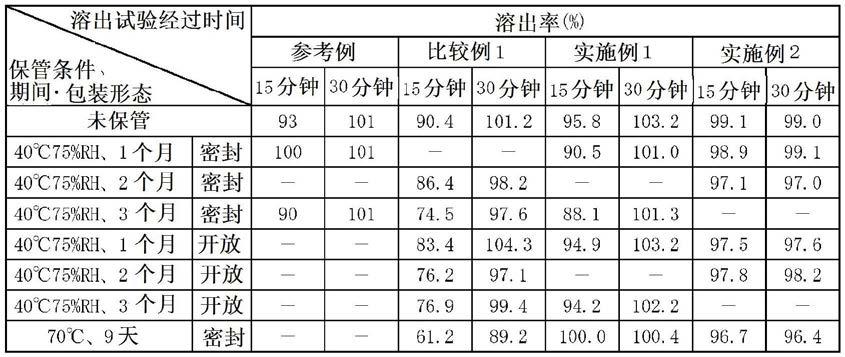
[0137][0138]
将参考例的片剂在40℃、75%rh且密封条件下保管了1个月及3个月的样品在试验开始15分钟后吉瑞替尼的溶出率为85%以上。另一方面,将比较例1的片剂在40℃、75%rh且密封条件下保管了3个月及在70℃且密封条件下保管了9天的样品在试验开始15分钟后吉瑞替尼的溶出率为75%以下。但是,以异麦芽酮糖醇水合物作为粘合剂的实施例1及实施例2在任一保管条件下在试验开始15分钟后吉瑞替尼的溶出率均为85%以上。
[0139]
《比较例2~3及实施例3~7的配方》
[0140]
将作为变更比较例1的薄膜包衣剂的种类后的配方的比较例2及作为未进行薄膜包衣的配方的比较例3示于表3。另外,将作为实施例1的甜味剂被替换为阿斯巴甜的配方的实施例3、作为实施例1的异麦芽酮糖醇水合物被替换为麦芽糖醇、山梨糖醇、蔗糖或海藻糖的配方的实施例3~7的配方示于表3。
[0141]
[表3]
[0142][0143]
单位:mg
[0144]
《比较例2及比较例3的片剂的制造》
[0145]
按照表3中记载的配方将吉瑞替尼半富马酸盐165.76g、甘露糖醇189.26g及三氯蔗糖119.98g使用gpcg
‑
1进行混合后,喷雾作为粘合液的hpc水溶液225.0g(固体成分:7重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品296.83g中称取196.35g,加入l
‑
hpc10.51g及mg
‑
st3.15g,通过与实施例2相同的方法进行混合、压片,得到比较例3的素片。对于得到的素片10.5152g,通过与实施例2相同的方法进行薄膜包衣,得到比较例2的薄膜衣片。
[0146]
《实施例3的片剂的制造》
[0147]
按照表3中记载的配方将吉瑞替尼半富马酸盐165.77g、甘露糖醇156.47g及阿斯巴甜126.02g使用gpcg
‑
1进行混合后,喷雾作为粘合液的异麦芽酮糖醇水合物水溶液270.0g(固体成分:20重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品442.52g中称取267.85g,加入l
‑
hpc14.43g及mg
‑
st5.76g,通过与实施例2相同的方法进行混合、压片,得到素片。对于得到的素片10.8147g,通过与实施例2相同的方法进行薄膜包衣,得到实施例3的薄膜衣片。
[0148]
《实施例4的片剂的制造》
[0149]
按照表3中记载的配方将吉瑞替尼半富马酸盐165.76g、甘露糖醇156.45g及三氯蔗糖126.02g使用gpcg
‑
1进行混合后,喷雾作为粘合液的麦芽糖醇水溶液270.0g(固体成分:20重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品459.84g中称取267.85g,加入l
‑
hpc14.40g及mg
‑
st5.76g,通过与实施例2相同的方法进行混合、压片,得到素片。对于得到的素片10.7941g,通过与实施例2相同的方法进行薄膜包衣,得到实施例4的薄膜衣片。
[0150]
《实施例5的片剂的制造》
[0151]
按照表3中记载的配方将吉瑞替尼半富马酸盐165.75g、甘露糖醇156.44g及三氯蔗糖126.02g使用gpcg
‑
1进行混合后,喷雾作为粘合液的山梨糖醇水溶液270.0g(固体成分:20重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品425.03g中称取267.84g,加入l
‑
hpc14.41g及mg
‑
st5.76g,通过与实施例2相同的方法进行混合,将得到的混合品用手动式台式片剂成型机(handtab
‑
200、市桥精机制)进行压片,得到素片。对于得到的素片870.8mg,通过与实施例2相同的方法进行薄膜包衣,得到实施例5的薄膜衣片。
[0152]
《实施例6的片剂的制造》
[0153]
按照表3中记载的配方将吉瑞替尼半富马酸盐165.74g、甘露糖醇156.45g及三氯蔗糖126.00g使用gpcg
‑
1进行混合后,喷雾作为粘合液的蔗糖水溶液270.2g(固体成分:20重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品458.3g中称取267.84g,加入l
‑
hpc14.41g及mg
‑
st5.76g,通过与实施例2相同的方法进行混合、压片,得到素片。对于得到的素片10.8116g,通过与实施例2相同的方法进行薄膜包衣,得到实施例6的薄膜衣片。
[0154]
《实施例7的片剂的制造》
[0155]
按照表3中记载的配方将吉瑞替尼半富马酸盐165.76g、甘露糖醇156.45g及三氯蔗糖126.03g使用gpcg
‑
1进行混合后,喷雾作为粘合液的海藻糖水溶液270.0g(固体成分:20重量%)并进行造粒,然后进行干燥,得到造粒品。为了除去团粒而过筛后,从得到的造粒品469.39g中称取267.84g,加入l
‑
hpc14.42g及mg
‑
st5.76g,通过与实施例2相同的方法进行混合、压片,得到素片。对于得到的素片10.8207g,通过与实施例2相同的方法进行薄膜包衣,得到实施例7的薄膜衣片。
[0156]
《试验例3》
[0157]
将比较例2~3及实施例3~7中制造的薄膜衣片或素片分别填充于高密度聚乙烯制的瓶中,在40℃、75%rh的条件下保管1个月、2个月或3个月,或者在70℃下保管9天,由此得到各保管样品。对于各保管样品,通过与试验例2相同的试验条件实施溶出试验,计算出溶出率。将未保管及各保管样品的吉瑞替尼的溶出率示于表4。
[0158]
[表4]
[0159][0160]
将比较例2~3的片剂在40℃、75%rh且密封条件或开放条件下保管了2个月及3个月的样品在试验开始15分钟后吉瑞替尼的溶出率为80%以下。但是,以糖类和/或糖醇作为粘合剂的实施例4~7在任一保管条件下在试验开始15分钟后吉瑞替尼的溶出率均为80%以上。另外,以糖类和/或糖醇作为粘合剂的实施例3的片剂在40℃、75%rh且密封条件或开放条件下保管了2个月及3个月的样品在试验开始15分钟后吉瑞替尼的溶出率为80%以上。
[0161]
根据以上结果,通过含有两种以上糖类和/或糖醇类,能够提供含有吉瑞替尼或其药学上可接受的盐及降低苦味的甜味剂的溶出稳定性优良的药物组合物。
[0162]
产业上的可利用性
[0163]
根据本发明,能够提供抑制了经时的溶出性稳定性下降的、含有吉瑞替尼或其药学上可接受的盐及降低苦味的甜味剂的、溶出稳定性优良的药物组合物。
[0164]
以上按照特定方式说明了本发明,但是对本领域技术人员而言显而易见的变更、改良包含在本发明的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。