脂肪来源干细胞的应用和一种组织蛋白酶f抑制剂
技术领域
1.本发明涉及脂肪干细胞应用领域,具体涉及脂肪来源干细胞的应用和一种组织蛋白酶f抑制剂。
背景技术:
2.细胞凋亡是辐射诱导的细胞死亡的主要途径。辐射可直接断裂dna骨架中的化学键,产生单链和双链断裂,从而引起受辐射细胞中的dna损伤。此外,电离辐射与水分子相互作用形成活性氧物质,活性氧物质能够激活几种信号传导途径,并通过损伤蛋白质和核酸诱导细胞损伤。损伤的细胞释放各种炎性趋化因子和细胞因子,并将炎性细胞吸引到损伤部位,从而促进生成更多促炎细胞因子,这些促炎细胞因子水平的增加激活促凋亡信号并诱导凋亡。组织蛋白酶f(ctsf)是最近报道的一种在细胞凋亡过程中起重要作用的木瓜蛋白酶样半胱氨酸蛋白酶。
3.脂肪来源干细胞(adsc)是一种来源于脂肪组织的间充质干细胞。它们容易粘附到塑料培养瓶上,在体外容易扩增,并且被认为具有广泛的临床应用潜力,如对急性和慢性辐射诱导的皮炎均具有保护作用,但其作用的潜在机制尚不清楚。
技术实现要素:
4.本发明的目的之一是提供一种能够抑制组织蛋白酶f表达的脂肪来源干细胞。
5.为了实现上述目的,本发明第一方面提供脂肪来源干细胞在制备用于抑制组织蛋白酶f表达的药物和/或制备用于抗细胞凋亡的药物中的应用。
6.本发明第二方面提供脂肪来源干细胞在制备用于预防、改善或治疗辐射性皮炎,抑制kufs病的药物中的应用。
7.本发明第三方面提供一种组织蛋白酶f抑制剂,该抑制剂中含有脂肪来源干细胞作为活性成分。
8.与现有技术相比,本发明提供的方案至少具有如下优势:
9.本发明提供的脂肪来源干细胞能够下调ctsf和下游促细胞凋亡蛋白表达,并上调抗细胞凋亡蛋白表达,显著减弱辐射诱导的细胞凋亡,进而能够预防、改善或治疗辐射性皮炎,抑制kufs病等。
10.本发明的其它特征和优点将通过随后的具体实施方式部分予以详细说明。
附图说明
11.图1为adscs的分离和表征;图1的a表示从雄性大鼠脂肪组织中分离的adscs在培养物中显示典型的纺锤形;研究了adscs的多谱系分化潜能:图1的b和c表示通过油红o染色证明脂肪生成;图1的d和e中表示通过茜素红s染色证明骨生成;以及图1的f表示通过阿尔新蓝染色证明软骨生成;图1的g表示通过流式细胞术评估adsc表面标志物的表达;
12.图2为对照组辐射后4周(具体见图2中的a、b、c、d、e和f)和adsc组辐射后4周(具体
见图2中的g、h、i、j、k和l)的皮肤组织或大鼠的超微结构的透射电子显微镜分析;在图2中,a和b中的黄色曲线表示不规则的桥粒;b和c中的绿色箭头表示线粒体受损,伴有嵴结构的损失;a、d、e中的红色“n”表示核固缩和溶解;f中的红色箭头表示血管内皮肿胀;g中的大的绿色曲线表示规则的桥粒,g、h、i、j、k中的黄色“n”表示adsc组在照射后4周的规则细胞核;i中的蓝色箭头表示线粒体很少嵴;j中的小的绿色曲线表示内质网;j中的红色圆圈表示形成良好的自噬液泡;l中的黄色箭头表示规则形状的血管内皮;
13.图3为adscs抑制经辐射的皮肤组织中的细胞凋亡;tunel染色细胞的代表性图像,dapi表示dapi对细胞核染色,merge表示tunel染色和dapi染色的合并图(图3的a);tunel阳性细胞的细胞核被染成绿色(原始放大倍数,200
×
);与对照组相比,在辐射后4周和12周,adsc组中凋亡细胞的百分比均显著降低;用于分析凋亡相关蛋白bax和bcl
‑
2表达的平均od(n=6/组)(图3的b);用bax和bcl
‑
2进行免疫组织化学染色的皮肤组织的代表性图像(图3的c);黑色箭头表示bax和bcl
‑
2的阳性表达;结果表示为平均值
±
sem;相对于对照组,*p<0.05,**p<0.01;
14.图4为adscs在体外抑制经辐射的表皮细胞中的细胞凋亡;nok和hacat细胞用adsc培养上清液处理72h,然后收获细胞,使用流式细胞术检测细胞凋亡;左上象限:坏死细胞;右上象限:晚期凋亡细胞;左下象限:活细胞;右下象限:早期凋亡细胞;显示了tunel阳性凋亡细胞的代表性荧光显微照片(图4的a和b,a1、a2、a3分别为nok细胞组、对照组和用adsc培养上清液处理组,b1、b2、b3分别为hacat细胞组、对照组和用adsc培养上清液处理组);结果表示为平均值
±
sem;相对于对照组,*p<0.05,**p<0.01,***p<0.001;
15.图5为adscs在体内下调ctsf、bax、bid和胱天蛋白酶9的表达,并上调bcl
‑
2和bcl
‑
xl的表达;用ctsf进行免疫组织化学染色的皮肤组织的代表性图像(图5的a);皮肤组织中ctsf、bax、bid、bcl
‑
2、bcl
‑
xl和胱天蛋白酶9水平的代表性印迹(图5的b);gapdh用作上样对照;ctsf的平均od(n=6/组)(图5的c);蛋白质表达水平分析(n=4/组)(图5的d);i:control
‑
4w组,ii:adscs
‑
4w组,iii:control
‑
12w组,iv:adscs
‑
12w组;结果表示为平均值
±
sem;相对于对照组,*p<0.05,**p<0.01,***p<0.001;
16.图6为adsc培养物上清液在体外辐射诱导的细胞凋亡细胞模型中下调ctsf、bax、bid和胱天蛋白酶9的表达,并上调bcl
‑
2和bcl
‑
xl的表达;ctsf、bax、bid、bcl
‑
2、bcl
‑
xl和胱天蛋白酶9水平的代表性印迹(图6的a和c);gapdh用作上样对照;蛋白质水平的定量分析(图6的b和d);图6的a中的i
‑
iii:i:nc
‑
sirna组,ii:ctsf
‑
sirna001组,iii:ctsf
‑
sirna002组;图6的c中的i
‑
vi:i:20gy
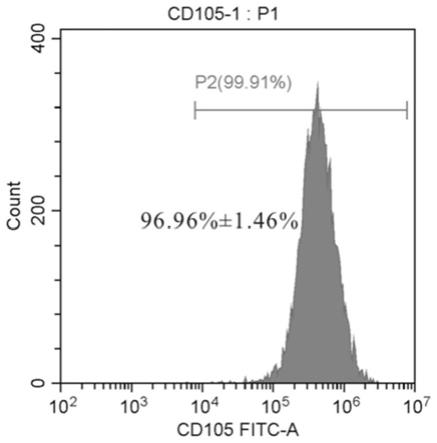
‑
hacat nc
‑
sirna组,ii:20gy
‑
hacat adsc培养上清液组,iii:20gy
‑
hacat ctsf
‑
sirna001组,iv:20gy
‑
hacat ctsf
‑
sirna002组,v:20gy
‑
hacat adsc
‑
培养上清液 ctsf
‑
sirna001组,vi:20gy
‑
hacat adsc
‑
培养上清液 ctsf
‑
sirna002组;结果表示为平均值
±
sem;相对于nc
‑
sirna组,*p<0.05,**p<0.01,***p<0.001。
具体实施方式
17.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
18.如前所述,本发明的第一方面提供了脂肪来源干细胞在制备用于抑制组织蛋白酶f表达的药物和/或制备用于抗细胞凋亡的药物中的应用。
19.如前所述,本发明的第二方面提供了脂肪来源干细胞在制备用于预防、改善或治疗辐射性皮炎,抑制kufs病的药物中的应用。
20.如前所述,本发明的第三方面提供了一种组织蛋白酶f抑制剂,该抑制剂中含有脂肪来源干细胞作为活性成分。
21.本发明中,所述脂肪来源干细胞来源于动物和/或人体的脂肪组织,示例性地,可以为动物和/或人体的腹股沟脂肪组织。同时,所述脂肪来源干细胞还可以为对动物和/或人体的脂肪组织中提取的脂肪来源干细胞进行商业化培养生产而获得的脂肪来源干细胞。
22.优选地,该抑制剂中还含有药用辅料。
23.优选地,所述药用辅料为生理盐水。
24.优选地,所述活性成分的含量为1
‑
99.9重量%。更优选地,所述活性成分的含量为5
‑
90重量%。进一步优选地,所述活性成分的含量为40
‑
60重量%。
25.优选地,该抑制剂的剂型选自皮下注射剂、肌肉注射剂中的至少一种。更优选地,该抑制剂的剂型为皮下注射剂。
26.以下将通过实例对本发明进行详细描述。
27.以下实例中,在没有特别说明的情况下,室温均为25
±
2℃。
28.以下实例中,在没有特别说明的情况下,百分比均表示质量体积比(g/100ml,如5%为5g/100ml)。
29.以下实例中的研究方法如下:
30.(1)实验动物
31.sprague
‑
dawley(sd)大鼠,体重220
‑
250g,购自湖南sja实验动物有限公司(中国湖南)。所有进行动物操作的研究人员都接受了中南大学的动物实验培训。伦理批准获得湖南省肿瘤医院动物伦理委员会和中南大学湘雅医学院附属肿瘤医院动物伦理委员会批准。
32.采用以下方法对sd大鼠进行照射:放射源:ir
‑
192;照射部位:将ir
‑
192后装治疗机(荷兰核通公司,18通道)的施源器管固定在sd大鼠左侧大腿内侧皮肤处;剂量归一点:离源中心皮下0.5cm处;单次照射剂量:90gy。
33.通过注射戊巴比妥钠(5%,50mg/kg)麻醉大鼠。将48只雌性sd大鼠随机分为对照组和adsc组(每组n=24)。对照组大鼠接受90gy的辐射并注射pbs,而adsc组大鼠接受90gy的辐射并在24h内注射107个adscs。
34.(2)大鼠adscs的分离、分化和表征
35.在雄性大鼠被安乐死后,收集腹股沟脂肪组织。去除皮下可见血管,用磷酸盐缓冲盐水(pbs)(hyclone,logan,ut,usa)冲洗组织,切片,在37℃的恒温水浴中,用1μg/ml的i型胶原酶(invitrogen,carlsbad,ca,usa)进行酶消化60min。
36.使用补充有10%胎牛血清(gibco,carlsbad,ca,usa)和1%青霉素/链霉素(gibco,grand island,ny,usa)的dulbecco改良eagle培养基(dmem,gibco,grand island,ny,usa)中和胶原酶后,将分散的组织在25℃下以1000
×
g离心10min。吸出漂浮的脂肪,将细胞悬液通过70
‑
μm的筛网进行过滤以去除组织碎片。然后将滤液以1000
×
g离心10min,弃去上清液,收集细胞,并在上述培养基中,在37℃和5体积%co2气氛下培养。
37.为了细胞分化和鉴定,使用来自第3代的adscs。
38.adscs的体外分化使用脂肪形成、软骨形成和成骨分化培养基(cyagen,chicago,il,usa)在六孔板中诱导。adsc分化为脂肪细胞诱导20天,分化为软骨细胞和成骨细胞诱导21天。
39.将分化的细胞固定并用油红o、阿尔新蓝或茜素红染色,并在显微镜(carl zeiss,oberkochen,germany)下观察。通过流式细胞术评估adsc免疫标记的表达,包括cd10、cd34、cd45、cd73、cd90和cd105(abcam,cambridge,uk)。
40.(3)细胞培养、辐射和处理
41.将人无限增殖角质细胞(hacat;中国武汉益普生物技术有限公司)和正常人口腔鳞状上皮细胞(nok;中国上海宾穗生物技术有限公司)在补充有10%胎牛血清和1%链霉素/青霉素的dmem培养基中培养。
42.采用以下方法对细胞进行照射:用5gy和20gy剂量的线性加速器(varian rapid arc,palo alto,ca,usa)分别照射hacat和nok细胞。剂量率为600mu/min。
43.收集adsc培养上清液并以1000
×
g离心5min以去除细胞碎片。立即用adsc培养上清液处理经辐照后的细胞。用正常培养基处理的辐射细胞作为对照。每24h更换培养基,在照射后72h收集细胞,用于细胞凋亡和蛋白质印迹分析。
44.(4)免疫组织化学染色
45.采用以下方法进行免疫组织化学染色:
46.将皮肤组织石蜡切片脱蜡后漂洗,将其置于柠檬酸抗原修复缓冲液(servicebio,g1202,ph值为6.0)中加热(于微波炉内中火8min至沸腾,停火8min保温再转中低火7min),修复抗原;在避光条件下,用3%过氧化氢溶液阻断内源性过氧化物酶;用免疫组化笔在玻片上根据组织轮廓画圈,滴加3%bsa溶液封闭;滴加一抗(bax、bcl
‑
2、ctsf按1∶200稀释)4℃孵育过夜;滴加二抗(hrp标记的山羊抗兔igg,赛维尔公司,gb23303,1:200稀释)室温孵育50min;滴加dab显色液(servicebio,g1211)显色;复染细胞核;脱水后中性树胶封片;在显微镜下观察,采集图像。
47.bax多克隆抗体(1∶200;50599
‑2‑
ig)、bcl2多克隆抗体(1∶200;26593
‑1‑
ap)和ctsf多克隆抗体(1∶200;11055
‑1‑
ap)均购自proteintech(chicago,il,usa)。为了定量蛋白质水平,使用image
‑
pro plus软件确定阳性染色的平均光密度(od)值。
48.(5)电子显微镜
49.用2.5%戊二醛的磷酸盐缓冲液固定皮肤组织,并切成50μm的切片。使用电子显微镜(fei,hillsboro,or,usa)评估皮肤细胞和细胞器的超微结构。
50.(6)末端脱氧核苷酸转移酶dutp颈端标记(tunel)染色
51.使用tunel细胞凋亡检测试剂盒(g1501;servicebio,武汉,中国)采用以下方法进行tunel染色:
52.将皮肤组织石蜡切片脱蜡,蛋白酶k(servicebio,g1205)修复组织,破膜液(servicebio,g1204)覆盖组织,室温孵育20min,pbs洗涤3次,每次5min;tunel试剂盒内tdt酶、dutp、buffer按1∶5∶50的比例混合,37℃恒温箱孵育2h;切片用pbs(ph7.4)洗涤3次,每次5min;去除pbs后滴加dapi染液(servicebio,g1012)复染细胞核,避光室温孵育10min;抗荧光淬灭封片剂(servicebio,g1401)封片。
53.在倒置荧光显微镜(carl zeiss)下手动计数tunel 细胞。
54.(7)细胞凋亡的流式细胞术检测
55.辐射和adsc培养上清液处理后的nok和hacat细胞的凋亡采用膜联蛋白v
‑
apc/pi细胞凋亡检测试剂盒(kg,南京)进行检测。
56.简而言之,收获细胞,用pbs洗涤两次,并重悬于结合缓冲液中。加入膜联蛋白v
‑
apc和pi,将细胞在室温下避光孵育10min,然后在1h内使用流式细胞仪(beckman,hialeah,fl,usa)进行分析。
57.(8)小干扰(si)rna转染
58.靶向ctsf的sirna和阴性对照sirna(表1)在genepharma(中国上海)合成。根据制造商的方案,使用gp
‑
transfect
‑
mate转染试剂(gene pharma,上海,中国)转染hacat细胞。
59.表1本实验中使用的sirna
‑
ctsf基因干扰位点序列
60.homo sapiens ctsf序列正义链(5
′‑3′
)序列反义链(5
′‑3′
)ctsf
‑
homo
‑
550ggcucagccaugauuucuuttaagaaaucauggcugagccttctsf
‑
homo
‑
1328ccaucaaugccuuuggcauttaugccaaaggcauugauggtt阴性对照uucuccgaacgugucacguttacgugacacguucggagaatt
61.(9)蛋白质印迹
62.使用ripa裂解缓冲液从皮肤组织和细胞中提取蛋白质,并使用二辛可宁酸法进行定量。将蛋白质进行十二烷基硫酸钠
‑
聚丙烯酰胺凝胶电泳并转移到硝酸纤维素膜上。在室温下在5%脱脂乳(cn7861
‑
500g,coolaber公司)中封闭该膜1h。
63.然后,将它们与抗ctsf(0.1μg/ml;r&d,af2075,minneapolis,mn,usa)、bid(1∶1000;10988
‑1‑
ap,proteintech,usa)、bax(1∶5000;50599
‑2‑
ig,proteintech,usa)、bcl
‑
2(1∶500;26593
‑1‑
ap,proteintech,usa)、bcl
‑
xl(1∶1000;10783
‑1‑
ap,proteintech,usa)、胱天蛋白酶9(1∶300;10380
‑1‑
ap,proteintech,usa)和gapdh(1∶5000;10494
‑1‑
ap,proteintech,usa)的抗体在4℃下孵育过夜。
64.洗涤后,将膜与辣根过氧化物酶标记的山羊抗兔igg(1∶6000;sa00001
‑
2,proteintech,usa)孵育2h。使用增强的化学发光显色印迹,并使用quantity one软件(bio
‑
rad,hercules,ca,usa)分析条带密度。
65.(10)统计分析
66.所有数据以平均值
±
平均值的标准误差表示,并使用spss(13.0版;spss,chicago,il,usa)进行分析。使用student
′
s t检验分析组间的差异;p<0.05被认为具有统计学意义。
67.实施例1
68.adscs的分离和表征
69.adscs是从雄性大鼠的腹股沟脂肪组织中分离出来的。从显微镜中观察可知,如图1所示,培养的adscs具有纺锤形(图1的a),以及adscs具有脂肪形成(图1的b和c)、成骨(图1的d和e)和软骨形成(图1的f)的分化潜能。
70.分析adscs的特异性表面标志物的表达;它们对cd10(97.02%
±
0.73%)、cd73(96.67%
±
1.38%)、cd90(97.24%
±
1.40%)和cd105(96.96%
±
1.46%)呈强阳性,但对cd34(0.36%
±
0.14%)和cd45(0.28%
±
0.08%)呈阴性(图1的g)。
71.实施例2
72.adscs抑制经辐射的皮肤组织中的细胞凋亡
73.透射电子显微镜显示,如图2所示,在辐射后4周对照组大鼠的皮肤组织中有具有不规则桥粒的鳞状细胞(图2的a和b中的黄色曲线)、伴有嵴损失的受损线粒体(图2的b和c中的绿色箭头)、核固缩和溶解(图2的a、d、e,用“n”表示)和血管内皮肿胀(图2的f中的红色箭头)。
74.然而在adsc组中,在辐射后4周,观察到具有规则桥粒的鳞状细胞(图2的g中的大的绿色曲线)、大的内质网(图2的j中的小的绿色曲线)、形成良好的自噬液泡(图2的j中的红色圆圈)、具有几个嵴的线粒体(图2的i中的蓝色箭头)、规则细胞核(图2的g、h、i、j、k,用“n”表示)和规则形状的血管内皮(图2的l中的黄色箭头)。
75.tunel阳性凋亡细胞的代表性荧光显微照片如图3的a所示,dapi表示dapi对细胞核染色,merge表示tunel染色和dapi染色的合并图。在辐射后4周和12周,adsc组中凋亡细胞的百分比显著低于对照组(图3的b)。代表性的免疫组织化学染色图像如图3的c所示。在辐射后4周和12周,adsc组中抗细胞凋亡蛋白bcl
‑
2的表达均显著高于对照组,而adsc组大鼠中的促细胞凋亡蛋白bax的表达在这两个时间点明显低于对照组。总之,这些发现表明adscs能够在体内抑制经辐射的皮肤组织中的细胞凋亡。
76.实施例3
77.adscs抑制经辐射的表皮细胞中的细胞凋亡
78.首先在hacat和nok细胞中建立了辐射诱导的细胞凋亡。然后,用adsc培养上清液处理照射的细胞。在照射后72h,通过流式细胞术和tunel染色分析细胞凋亡(图4的a和b)。流式细胞术数据显示,在adsc培养上清液处理组中,nok细胞在早期、晚期和总细胞凋亡中的比例低于对照组(图4的a1、a2、a3分别为nok细胞组、对照组和用adsc培养上清液处理组)。类似地,上清液处理组中hacat细胞的晚期和总细胞凋亡比例低于对照组,而早期凋亡细胞比例没有显著差异(图4的b1、b2、b3分别为hacat细胞组、对照组和用adsc培养上清液处理组)。流式细胞术定量结果显示adsc培养上清液能够显著降低总细胞凋亡率。每组中tunel阳性凋亡细胞的代表性荧光显微照片如图4的a1、a2、a3和b1、b2、b3所示。结果表明adscs能够在体外抑制经辐射的细胞中的细胞凋亡。
79.实施例4
80.adscs在体内和体外下调ctsf表达
81.通过体内免疫组织化学染色评估了皮肤组织中ctsf的表达(图5的a)。在照射后4周,对照组中的ctsf表达增加,而adsc组中这种增加显著减弱(图5的a中的红色箭头)。在照射后12周,对照组中的ctsf以低水平表达,而在adsc组中,ctsf表达恢复到接近正常水平。平均od值的分析证实,在照射后4周和12周,adsc组中ctsf表达均显著低于相同时间点的对照组(图5的c)。
82.然后,通过蛋白质印迹检测皮肤组织中ctsf和下游促凋亡蛋白(bid、bax和胱天蛋白酶9)和抗凋亡蛋白(bcl
‑
2和bcl
‑
xl)的表达(图5的b)。如图5的d所示,在照射后4周和12周,adsc组中ctsf、bid、bax和胱天蛋白酶9的表达均显著低于相同时间点的对照组。与此相反,在照射后4周和12周,adsc组中bcl
‑
2和bcl
‑
xl的表达均显著高于相同时间点的对照组。
83.为了证明adscs特异性靶向ctsf,使用sirnas敲减ctsf,用adsc培养上清液处理辐
射诱导的凋亡hacat细胞,并通过蛋白质印迹评估ctsf和下游蛋白的表达(图6的a和c)。如图6的b所示,与nc
‑
sirna组相比,ctsf
‑
sirna001组(即为表1中的ctsf
‑
homo
‑
550)和ctsf
‑
sirna002组(即为表1中的ctsf
‑
homo
‑
1328)中ctsf、bax、bid和胱天蛋白酶9的表达下调,而与nc
‑
sirna组相比,ctsf
‑
sirna001组和ctsf
‑
sirna002组中bcl
‑
2和bcl
‑
xl的表达上调。
84.如图6的d所示,在辐射诱导的细胞凋亡细胞模型中,与nc
‑
sirna组相比,在用adsc培养上清液、ctsf
‑
sirna001、ctsf
‑
sirna002、adsc培养上清液加ctsf
‑
sirna001或adsc培养上清液加ctsf
‑
sirna002处理的细胞中,ctsf、bax、bid和胱天蛋白酶9的表达下调。与nc
‑
sirna组相比,在用adsc培养上清液、ctsf
‑
sirna001、ctsf
‑
sirna002、adsc培养上清液加ctsf
‑
sirna001或adsc培养上清液加ctsf
‑
sirna002处理的细胞中,bcl
‑
2和bcl
‑
xl的表达上调。这些结果表明,adscs能够通过抑制ctsf表达而表现出抗细胞凋亡作用。
85.通过上述结果可以看出,本发明提供的adscs能够在体内和体外下调ctsf和下游促细胞凋亡蛋白(bid、bax和胱天蛋白酶9)表达,并上调下游抗细胞凋亡蛋白(bcl
‑
2和bcl
‑
xl)表达。adscs能够通过抑制ctsf表达而表现出抗细胞凋亡作用,进而能够预防、改善或治疗辐射性皮炎,抑制kufs病等。
86.以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。