1.本发明涉及异丙甲草胺于口鼻吸入染毒系统中的浓度的测定方法。
背景技术:
2.随着农业生产的发展,农药因其具有对防治农作物病虫害、去除杂草以及提高农产品的产量等显著作用而被广泛应用。异丙甲草胺是一种目前广泛应用于芽前酰胺类除草剂。毒理结果表明,异丙甲草胺经皮试验后对大鼠皮肤、眼睛有轻度刺激性,经口试验后存在致死性。因此,长期接触或者吸入异丙甲草胺农药可能会产生潜在的健康损害。为了更好地了解异丙甲草胺的健康风险,异丙甲草胺毒性试验的研究尤为重要。
3.目前,国内外报道了大量的异丙甲草胺毒性试验,其给药方式均为急性经口或经皮毒性试验。在异丙甲草胺的使用过程中,农药吸入无法避免。然而,有关异丙甲草胺通过吸入染毒的研究暂无相关研究,其可能造成的毒性特征尚不明确,亟待一种应用于吸入染毒系统的开发以及其分析方法的开发。
4.研究表明,吸入毒性研究的染毒方式主要有两种:气管滴注和动式吸入染毒。气管滴注方法简单,无需特殊设备,但滴注前需麻醉实验动物,且不能真实模拟人的暴露方式。因此,研究者多采用动式吸入染毒,主要包括口鼻吸入染毒和全身暴露吸入染毒。对于大鼠的研究多采用口鼻吸入染毒,可以防止实验动物舔食染毒物质,对结果造成影响。然而,口鼻吸入染毒需要特殊的气溶胶发生及相关的染毒装置,产生稳定气溶胶的难度大,而现有技术中难以准确测定染毒装置中的样品的实际浓度,也就难以获知大鼠在染毒装置中样品的实际暴露浓度。因此,为了保证异丙甲草胺口鼻吸入染毒试验的准确性和稳定性,有关异丙甲草胺于口鼻吸入染毒系统中的测定方法的开发迫在眉睫。
技术实现要素:
5.本发明为了解决现有技术中在口鼻吸入染毒系统中样品的实际浓度难以检测准确的缺陷,而提供了异丙甲草胺于口鼻吸入染毒系统中的浓度的测定方法。本发明的方法能够准确、稳定地检测得到在染毒装置中的样品的实际浓度,保证后续动物实验给药的准确性和稳定性,为异丙甲草胺吸入染毒毒性试验奠定基础。
6.本发明通过以下技术方案解决上述技术问题。
7.本发明提供了异丙甲草胺于口鼻吸入染毒系统中的浓度的测定方法,其步骤包括:
8.s1.将异丙甲草胺在口鼻吸入染毒系统下发生气溶胶,用滤膜于所述口鼻吸入染毒系统中进行采样,得到采样滤膜;使用滤膜称重法计算所述口鼻吸入染毒系统中气溶胶的实际浓度;
9.s2.将所述采样滤膜置于溶剂中,得到采样滤膜样品溶液;
10.s3.将所述采样滤膜样品溶液进行高效液相色谱分析,测定得到峰面积,对照异丙甲草胺峰面积-浓度标准曲线,得到所述采样滤膜样品溶液中异丙甲草胺的实际浓度;并计
算得到所述口鼻吸入染毒系统中异丙甲草胺的实际浓度。
11.滤膜称重法是颗粒物质量浓度测定的基本方法,以规定的流量采样,将空气中的颗粒物捕集于高性能滤膜上,称量滤膜采样前后的质量,由其质量差求得捕集的粉尘质量,其与采样空气量之比即为粉尘的质量浓度。
12.本发明中,采用滤膜称重法,按照一定的采样流量进行一定时间的采样得到采样滤膜,模拟大鼠在口鼻吸入染毒系统中的暴露染毒过程,经高效液相色谱分析可测量后计算得到所述采样滤膜样品溶液中异丙甲草胺的实际浓度(c1),而后可通过下式计算得到所述口鼻吸入染毒系统中异丙甲草胺的实际浓度(c2):
13.口鼻吸入染毒系统中异丙甲草胺的实际浓度c2=采样滤膜样品溶液中异丙甲草胺的实际浓度c1×
采样滤膜样品溶液中溶剂的用量
÷
(采样流量
×
采样时间)。
14.式中,所述采样滤膜样品溶液中溶剂的用量是指所述步骤s2中所述溶剂的用量(单位为体积单位);所述采样流量和所述采样时间为滤膜称重法的采样流量和采样时间。基于计算得到的口鼻吸入染毒系统中异丙甲草胺的实际浓度c2,可知大鼠在口鼻吸入染毒系统中时,异丙甲草胺的实际暴露浓度。
15.s1中,所述口鼻吸入染毒系统可为本领域常规,又称动物口鼻吸入暴露系统,例如为单浓度口鼻吸入染毒系统。本领域技术人员知晓,可通过调整所述口鼻吸入染毒系统中的仪器参数,设定所述口鼻吸入染毒系统中气溶胶的理论浓度(c3)。所述气溶胶的理论浓度(c3)较佳地为800~5000mg/m3,更佳地为2000mg/m3。
16.所述滤膜称重法中,根据所述滤膜在采样前的质量和采样后的质量,可计算得到所述气溶胶的实际浓度(c4),可用于验证设定的气溶胶的理论浓度c3是否稳定合格(c4需在c3的
±
10%以内,若满足此条件,则可按照所设定的气溶胶的理论浓度c3继续进行下一步操作)。经确认气溶胶的实际浓度(c4)合格后的采样滤膜,方可用于后续异丙甲草胺于口鼻吸入染毒系统中的浓度的测定。具体地,气溶胶的实际浓度(c4)可根据下式进行计算:
17.气溶胶的实际浓度c4(mg/m3)=(采样后滤膜重-采样前滤膜重)
÷
(采样流量
×
采样时间)。
18.s1中,所述口鼻吸入染毒系统中,所述采样的流量较佳地为1~10l/min,例如为4l/min。
19.s1中,所述口鼻吸入染毒系统中,所述采样的时间较佳地为1~10min,例如为4min。
20.s1中,所述滤膜的材料较佳地为玻璃纤维。
21.s1中,较佳地,将异丙甲草胺溶液在所述口鼻吸入染毒系统下发生气溶胶。所述异丙甲草胺溶液的配制过程可为本领域常规,一般将所述异丙甲草胺溶于溶媒后搅拌混匀,即可。
22.其中,所述异丙甲草胺溶液的浓度需要保证给药制剂的浓度的准确性(即生成的气溶胶的浓度的准确性),从而保证后续经气溶胶后采样滤膜的浓度。较佳地,异丙甲草胺溶液的目标含量(c6)为0.2%~60%;所述百分比为异丙甲草胺的体积占所述异丙甲草胺溶液的体积百分比。
23.其中,所述溶媒较佳地为植物油,更佳地为玉米油。
24.其中,所述搅拌的时间较佳地为30min以上。
25.s1中,当气溶胶实际浓度c4与气溶胶理论浓度c3之间的误差在可接受范围内时(c4需在c3的
±
10%以内),所述口鼻吸入染毒系统中异丙甲草胺的目标浓度(c5)(也可认为是大鼠暴露在口鼻吸入染毒系统中时,异丙甲草胺的目标暴露浓度)可通过下式计算得到:
26.口鼻吸入染毒系统中异丙甲草胺的目标浓度c5(mg/m3)=气溶胶的理论浓度c3×
异丙甲草胺溶液的目标含量c6。
27.其中,所述口鼻吸入染毒系统中异丙甲草胺的目标浓度(c5)较佳地为4~1200mg/m3。
28.通过本发明的检测方法,得到采样滤膜样品溶液中异丙甲草胺的实际浓度c1,即可获知口鼻吸入染毒系统中异丙甲草胺的实际浓度c2。并且,可将采样滤膜样品溶液中异丙甲草胺的实际浓度c1与采样滤膜样品溶液中异丙甲草胺的理论浓度c7进行比较,验证本发明检测方法的可行性和准确性。滤膜样品溶液中异丙甲草胺的理论浓度c7可通过下式进行计算:
29.滤膜样品溶液中异丙甲草胺的理论浓度c7=气溶胶的实际浓度c4×
异丙甲草胺溶液的目标含量c6×
异丙甲草胺原药含量
×
(100-异丙甲草胺原药水分)%。
30.式中,异丙甲草胺原药含量是指药品中异丙甲草胺的质量百分含量;异丙甲草胺原药水分是指药品中水分的质量百分含量。
31.s2中,一般可将所述采样滤膜置于容器中,较佳地为本领域常规的试剂容器,例如为试剂瓶;所述溶剂在所述采样滤膜放入容器后再加入。
32.s2中,所述采样滤膜样品溶液一般还需经过稀释、过滤后,进行高效液相色谱分析。
33.其中,所述稀释的稀释剂较佳地为60%~90%的甲醇,例如为75%的甲醇。所述稀释的操作可进行一次或多次。
34.其中,较佳地,将稀释后的溶液进行超声,冷却至室温,摇匀后过滤。
35.所述超声的时间较佳地为3~10min,例如为5min。
36.其中,稀释后的采样滤膜样品溶液的浓度较佳地为6.4μg/ml~76.8μg/ml。
37.其中,所述过滤的操作和条件可为本领域常规。较佳地,用孔径为0.22μm的滤头进行过滤;所述滤头例如为pvdf滤头;所述pvdf滤头例如为直径为33mm的厂家为millex的滤头。一般需弃去初滤液,弃去初滤液的量为1~5ml,例如为1ml。
38.s3中,较佳地,所述高效液相色谱分析方法(hplc)可为本领域常规。
39.其中,色谱柱较佳地为c18反相色谱柱;更佳地,所述反相色谱柱的规格为150
×
4.6mm(长度l
×
内径id),5μm;进一步更佳地,所述反相色谱柱为waters x-bridge c18色谱柱。
40.其中,洗脱方式较佳地为等度洗脱。
41.其中,流动相较佳地为甲醇与超纯水的体积比为75:25。
42.其中,检测波长较佳地为210~250nm,例如为230nm。
43.其中,柱温较佳地为25~30℃。
44.其中,进样器温度较佳地为2~8℃,例如为6℃。
45.其中,流速较佳地为0.8~1.2ml/min,例如为1.0ml/min。
46.其中,进样体积较佳地为5~20μl,例如为10μl。
47.其中,运行时间较佳地为5min以上,更佳地为8min以上。
48.s3中,所述异丙甲草胺峰面积-浓度标准曲线可为本领域常规方法测得。一般为将异丙甲草胺标准品溶解于适量溶剂中,配制一定浓度梯度的多个异丙甲草胺标准品溶液,分别进行高效液相色谱分析,以异丙甲草胺标准品溶液中测定的异丙甲草胺峰面积(y)与其相应的浓度(x)建立线性回归方程即可。本领域技术人员知晓,将所述采样滤膜样品溶液进行高效液相色谱分析后计算得到的峰面积对照所述异丙甲草胺峰面积-浓度标准曲线,可得到所述采样滤膜样品溶液中异丙甲草胺的实际浓度c1,并计算得到c2。若在进行高效液相色谱分析前进行过稀释处理,则再乘以稀释因子(所述的稀释因子为制剂浓度稀释至稀释后样品浓度的比值)即可。
49.其中,较佳地,所述异丙甲草胺标准品溶液为将异丙甲草胺标准品溶解于适量甲醇中配制得到。
50.其中,较佳地,所述异丙甲草胺标准品溶液的浓度为2~100μg/ml,例如为2μg/ml、10μg/ml、20μg/ml、50μg/ml或100μg/ml。
51.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
52.本发明所用试剂和原料均市售可得。
53.本发明的积极进步效果在于:
54.本发明的方法能够准确、稳定地检测得到在染毒装置中的样品的实际浓度,保证后续动物实验给药的准确性和稳定性,为异丙甲草胺吸入染毒毒性试验奠定基础。
55.本发明降低了辅料对样品检测的影响,保证了口鼻吸入染毒系统的可行性,能够准确、高效地检测毒理吸入给药试验时制剂的浓度,且成本较低,实验操作方便,准确性高,重复性好,结果判断客观、灵敏度高;对农药的毒性试验研究有十分重要的意义。
附图说明
56.图1为仅有稀释剂(75%的甲醇)的色谱图,排除稀释剂(75%的甲醇)对被试物测定的干扰作用。
57.图2为仅有溶媒(玉米油)的色谱图,排除溶媒对被试物测定的干扰作用。
58.图3为溶媒采样滤膜色谱图,排除采样滤膜及吸入染毒系统对被试物的干扰作用。
具体实施方式
59.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
60.以下实施例中,“被试物”是指异丙甲草胺原药供试品,其异丙甲草胺含量为98.4%,含水分0.1%(百分比均为质量百分含量);“溶媒”是指玉米油。
61.实施例1:hplc法检测异丙甲草胺标准曲线的建立
62.(1)标准曲线溶液(以下简称标曲溶液)的配制:精密移取25μl的异丙甲草胺标准品(纯度为98.543%)至25ml容量瓶中,并精密称定所移取体积的异丙甲草胺的重量,然后加入一定量的甲醇溶解并稀释至刻度,配制成异丙甲草胺浓度为0.1%(1.0mg/ml)的标曲
溶液储备液,在根据表1所示,稀释成一系列不同异丙甲草胺浓度的标曲溶液。
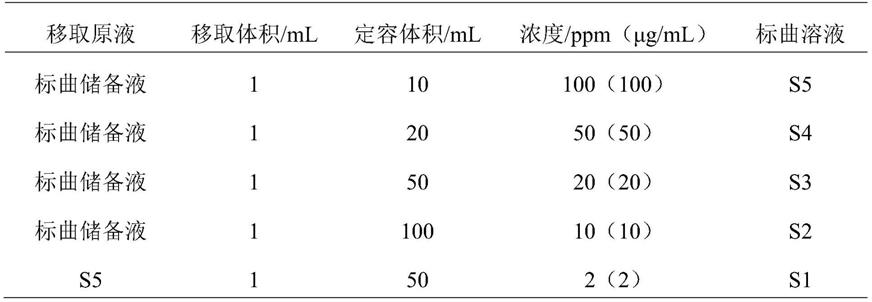
63.表1 标曲稀释配制方案
[0064][0065]
(2)标准曲线测定
[0066]
hplc分析方法如下:使用c18反相色谱柱(规格为150
×
4.6mm(l
×
id),5μm,waters x-bridge c18色谱柱),以甲醇:超纯水=75:25为流动相等度洗脱,检测波长230nm,柱温30℃,进样器温度6℃,流速1.0ml/min,进样体积10μl,运行时间8min。
[0067]
测定各个浓度样品(每个浓度样品分别测定一次),以标准溶液中测定的异丙甲草胺峰面积(y)为纵坐标,与其相应的浓度(x)为横坐标建立线性回归方程,结果如表2,可知异丙甲草胺在2ppm~100ppm(2μg/ml~100μg/ml)浓度范围内具有良好的线性,确定此范围为该方法的检测范围。
[0068]
表2 标准曲线结果
[0069][0070]
实施例2:异丙甲草胺给药制剂配制及验证分析
[0071]
(1)异丙甲草胺混悬液体制剂的配制
[0072]
按比例移取或者量取需要量的被试物(此处异丙甲草胺为供试品,含量为98.4%,含水分0.1%)和溶媒,随后搅拌至少30min,混匀。配制好的给药制剂用不同颜色的标签进行标识,溶媒色谱图见图2,给药制剂配制比例如表3所示。
[0073]
表3 给药制剂配制
[0074][0075]
(2)给药制剂样品处理
[0076]
移取步骤(1)中的适量高浓度和低浓度给药制剂至合适规格的容量瓶中,加入适量75%甲醇(仅有75%的甲醇的色谱图见图1)后超声5min,冷却至室温后定容至刻度,摇匀。高浓度仍需第二步稀释。将摇匀后的样品溶液用0.22μm的滤头,弃去1ml初滤液,即得hplc分析的样品溶液,平行处理6份。稀释后样品浓度如表4:
[0077]
表4 待测样品的制备
[0078][0079]
(3)将步骤(2)制得的待测样品按照中实施例1中的hplc检测方法进行检测,分别测得相应的峰面积,将峰面积带入回归方程计算后,获得相应的浓度,再乘以稀释因子,低浓度样品的稀释因子为100,高浓度样品的稀释因子为10000,可得到异丙甲草胺混悬液体制剂的浓度,接受标准为平均回收率为85%~115%,rsd在10%以内。具体数据如表5,结果给药制剂的批内精密度和准确度均在接受范围内:
[0080]
表5 被试物给药制剂批内精密度和准确度结果
[0081][0082][0083]
表5中:(x
i
为六组平行样品含量测得结果);
[0084]
平均回收率(%)=含量均值/理论含量
×
100%;
[0085]
给药制剂的理论含量c8(%)=给药制剂的目标含量c6×
被试物原药含量
×
(100-被试物原药水分)%。
[0086]
(4)根据上述步骤(1)(2)(3),测定异丙甲草胺给药制剂的稳定性,结果如表6,接受标准为rd在5%以内,回收率在85%~115%以内。结果证明异丙甲草胺给药制剂在室温24h,2~8℃8d内稳定。
[0087]
表6 被试物给药制剂稳定性结果
[0088][0089]
表6中:(x1为平行样品第一次测得结果,x2为平行样品第二次测得结果)。
[0090]
实施例3:异丙甲草胺吸入染毒气溶胶采样方法及其验证分析
[0091]
(1)异丙甲草胺混悬液体制剂的配制如实施例2
[0092]
(2)吸入染毒气溶胶采样滤膜的采集
[0093]
分装后的给药制剂,按照确定的浓度参数(气溶胶理论浓度c3=2000mg/m3),在单浓度口鼻吸入染毒系统下发生气溶胶。待系统达到设定值稳定后,用滤膜称重法(滤膜为玻璃纤维材质),按照4l/min的采样流量进行4min的采样,测定气溶胶浓度,实测值合格(需在设定值的
±
10%)后,滤膜放入合适的容器中,并用不同颜色的标签进行标识,溶媒采样滤膜色谱图如图3所示,设定参数及目标浓度如下表7所示:
[0094]
气溶胶实际浓度c4(mg/m3)=(采样后滤膜重-采样前滤膜重)
÷
(采样流量
×
采样时间)。
[0095]
其中,表7中,口鼻吸入染毒系统中异丙甲草胺的目标浓度c5=气溶胶理论浓度c3×
异丙甲草胺溶液的目标含量c6。
[0096]
表7 吸入染毒气溶胶参数设定
[0097][0098]
(3)吸入染毒气溶胶采样滤膜样品处理
[0099]
加入一定量的75%甲醇至装有滤膜的容器中,超声5min。冷却至室温后摇匀。若有第二步稀释,则移取适量第一步溶液至合适规格的容量瓶中,加75%甲醇稀释至定容至刻度,摇匀即得。将最终稀释混匀的样品溶液用0.22μm的滤头过滤,弃去1ml初滤液,即得供hplc分析的样品溶液。其中,采样滤膜中被试物的质量=口鼻吸入染毒系统中异丙甲草胺的目标浓度c5(被试物暴露浓度)
×
采样流量
×
采样时间。稀释倍数如表8。对于低浓度给药制剂采样滤膜,共加入10ml 75%甲醇得到稀释后采样滤膜中被试物;对于高浓度给药制剂采样滤膜,共加入250ml 75%甲醇得到稀释后采样滤膜中被试物。
[0100]
表8 采样滤膜样品处理稀释
[0101][0102]
(4)将步骤(3)制得的待测样品按照中实施例1中的hplc检测方法进行检测,分别测得相应的峰面积,将峰面积带入回归方程计算后,获得相应的采样滤膜中异丙甲草胺的实际浓度c1,再乘以采样滤膜样品溶液中溶剂的用量,低浓度样品的采样滤膜样品溶液中溶剂的用量为10ml,高浓度样品的采样滤膜样品溶液中溶剂的用量为250ml,可得到采样滤膜中异丙甲草胺的质量,再除以4l/min的采样流量,除以4min的采样时间,可得到异丙甲草胺于口鼻吸入染毒系统中的实际浓度c2。接受标准为平均回收率在70%~130%,rsd在
10%以内。具体数据如表9,结果给药制剂的批内精密度和准确度均在接受范围内:
[0103]
表9 被试物给药制剂采样滤膜批内精密度和准确度结果
[0104][0105][0106]
所述的采样滤膜中的异丙甲草胺理论浓度(即口鼻吸入染毒系统中异丙甲草胺的理论浓度c7)(mg/m3)=气溶胶的实际浓度c4×
给药制剂的理论含量c8。其中,给药制剂的理论含量c8=给药制剂的目标含量c6×
被试物原药含量
×
(100-被试物原药水分)%。
[0107]
(5)根据上述步骤(1)(2)(3)(4),测定异丙甲草胺吸入染毒采样滤膜的稳定性,结果如表10,接受标准为回收率在70%~130%以内,rd为5%以内。结果证明异丙甲草胺吸入染毒采样滤膜在室温24h,2~8℃2d内稳定。
[0108]
表10 被试物给药制剂采样滤膜稳定性结果
[0109]
[0110][0111]
以上所述具体实施例仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进或替换,这些改进或替换也应当视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。