1.本发明涉及医学领域,特别是肿瘤学。它涉及在用于标记和/或检测和/或靶向来自多细胞生物的真核细胞的方法中应用的修饰的单糖化合物。本发明还涉及在用于识别或分离癌细胞、诊断癌症或用于细胞疗法的方法中应用的此类修饰的单糖化合物。
背景技术:
2.碳水化合物作为信号传递分子和对于细胞识别事件是重要的。事实上,它们可以与碳水化合物识别蛋白(crp)产生多价相互作用,并可用作活生物体的探针。因此,碳水化合物在疾病诊断和治疗中提供了许多机会。因此,基于碳水化合物的生物活性化合物和传感器的开发已成为一个活跃的研究领域。制备功能性碳水化合物衍生物的一种有效且模块化的合成方法是点击化学。he等人的综述报道了一些由cuaac(cu催化的叠氮化物
‑
炔烃1,3
‑
偶极环加成)点击化学制备的用于治疗和诊断的碳水化合物衍生物(carbohydrate research 429(2016)1
‑
22)。使用应变促进(strain
‑
promoted)的叠氮化物
‑
炔烃环加成反应的无铜点击化学也已被描述用于癌细胞。存在可点击基团的特定糖类(例如,三乙酰n
‑
叠氮基乙酰甘露糖胺(ac3mannaz)类似物)由于特异性过度表达的酶可裂解糖类似物而被癌细胞代谢。所述糖由此被特异性地代谢并掺入到癌细胞膜中。
3.即使多种碳水化合物/单糖点击化学已被描述用于治疗和诊断,这些点击化学方法和其中使用的化合物似乎具有细胞毒性和/或对特定细胞没有选择性,例如对癌细胞的选择性。这些化合物的细胞毒性意味着使用低的无毒浓度,这使得它们不太有效。
4.wo2013/1077559描述了用于标记特定活微生物的方法中的修饰的单糖化合物,例如特定化合物8
‑
叠氮基
‑
3,8
‑
二脱氧
‑
d
‑
甘露
‑
辛酮糖酸(本文也称为“kdo
‑
n
3”)。该标记的活微生物仅限于单细胞原核微生物(细菌)。
5.wo2016/177712也描述了用于标记特定活微生物的方法中的修饰的单糖化合物,例如特定化合物5
‑
叠氮基
‑5‑
脱氧
‑
d
‑
阿拉伯呋喃糖(本文中也称为“ara
‑
n
3”)。该标记的活微生物仅限于单细胞原核微生物(细菌)和单细胞真核微生物(酵母、真菌和变形虫)。
6.然而,到目前为止,还不能解释所述单糖化合物如何以及在何处被所述微生物的细胞膜同化。
7.一直需要寻找和开发新的候选物,特别是用于标记和检测来自多细胞生物的真核细胞,以提供识别或分离癌细胞的方法,以及提供诊断或细胞疗法的方法,特别是在癌症领域。
技术实现要素:
8.本发明基于式(i)的单糖化合物或其前体:
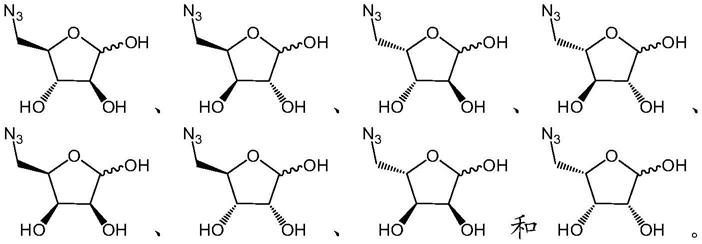
[0009][0010]
其中x为反应基团,其允许通过点击化学反应共价连接另外的化合物,例如标记或抗癌药物或包含抗癌药物的颗粒。形成的缀合物因此可以在用于标记或检测来自多细胞生物的真核细胞的方法、用于识别或分离癌细胞的方法、或用于治疗癌症的方法中应用。
[0011]
更具体地,本发明人已经发现式(i)的单糖化合物,尤其是ara
‑
n3与来自多细胞生物的真核细胞发生同化(assimilation)。他们还发现,肿瘤真核细胞中的这种同化与非肿瘤真核细胞不同,而且与非肿瘤细胞相比(特别是膀胱癌、血液癌、皮肤癌、胰腺癌、脑癌、肝癌、肾癌、肺癌、肌肉癌、淋巴细胞癌、前列腺癌、胃癌、乳腺癌与非癌细胞相比)也更重要。因此,式(i)的单糖化合物及其前体也可用作癌症探针和标志物,其可用于识别、分离或靶向癌细胞,和/或用于诊断受试者的癌症。
[0012]
因此,本发明的一个方面是用于标记或检测或靶向来自多细胞生物的真核细胞的方法,优选体外方法,该方法包括以下步骤:
[0013]
a)使包含真核细胞的样品与至少一种修饰的单糖化合物或其前体接触;
[0014]
b)使步骤(a)的样品与带有第一反应基团的化合物接触,任选地在铜的存在下;以及
[0015]
c)任选地检测步骤(b)的化合物与步骤(a)的单糖的键合,以检测真核细胞;
[0016]
其中所述至少一种修饰的单糖化合物具有下式(i):
[0017][0018]
其中x为第二反应基团,所述第一反应基团和所述第二反应基团能够在点击化学反应中一起反应,从而获得与所述单糖键合的步骤(b)的化合物。在优选的实施方案中,所述第一反应基团是炔基并且所述第二反应基团x是叠氮基(
‑
n3)。
[0019]
本发明的另一方面是用于实施标记、检测或靶向如本文定义的真核细胞的方法的试剂盒,其包括:
[0020]
‑
式(i)的修饰的单糖化合物或其前体,优选式(i’),和
[0021]
‑
带有第一反应基团的化合物。
[0022]
本发明的另一方面是用于在受试者中识别或分离癌细胞或诊断癌症的方法,其包括实施用于标记、检测或靶向来自所述受试者,优选在来自所述受试者的生物样品中的如本文所定义的来自多细胞生物的真核细胞的方法。
[0023]
本发明的另一方面是组合物,其包含在其表面上存在至少一种式(i)的修饰的单糖化合物或其前体(优选式(i'))的真核细胞,如本文所定义,该单糖化合物或其前体可操作地连接或不连接至抗癌药物或包含至少一种抗癌药物的颗粒。另一方面是包含这种细胞的药物组合物。另一方面是这种药物组合物用于治疗癌症,尤其是通过基于细胞的疗法。另一方面是这种药物组合物用于诊断癌症。
[0024]
本发明的另一方面是在有需要的受试者中治疗癌症的方法,其包括向所述受试者
施用有效量的如本文所定义的组合物,所述组合物包含在其表面上存在至少一种式(i)的修饰的单糖化合物或其前体(优选式(i'))的真核细胞,如本文所定义,该单糖化合物或其前体可操作地连接或不连接至抗癌药物或包含至少一种抗癌药物的颗粒。
[0025]
本发明的另一方面是本文定义的修饰的单糖化合物或其前体,任选地与带有第一反应基团的化合物一起,用于医学成像或诊断,优选用于诊断癌症的用途。
附图说明
[0026]
图1:使用或不使用ara
‑
n3和荧光团静脉内注射的panc
‑
1荷瘤小鼠获得的肿瘤和骨骼肌的离体荧光信号比(肿瘤/肌肉比)。
[0027]
发明详述
[0028]
定义
[0029]
根据本发明,下列术语具有以下含义:
[0030]“多细胞生物”包括包含多于一个细胞的任何生物。多细胞生物源自或者是,例如植物或动物,优选哺乳动物,更优选人。
[0031]
如本文所用,术语“患者”和“受试者”可以互换使用并且包括人和动物,更具体地是人。
[0032]“来自多细胞生物的真核细胞”不同于原核生物,是在膜内具有细胞核的细胞,并且来自多细胞生物,例如动物或植物细胞。动物和植物细胞是来自多细胞生物的最熟悉的真核细胞。在本发明的上下文中,“真核细胞”包括癌细胞或正常细胞(或非肿瘤细胞和肿瘤细胞)。
[0033]
癌细胞是无限分裂的细胞,其形成实体瘤或使血液充满异常细胞。因此,它可以是实体癌或造血系统癌,例如淋巴瘤或白血病。
[0034]
如本文所用,术语“癌症”或“肿瘤”是指存在这样的细胞,其具有致癌细胞典型特征,例如不受控制的增殖、永生性、转移潜能、快速生长和增殖率以及某些典型形态特征。该术语是指任何类型的恶性肿瘤(原发性或转移性)。典型的癌症是实体癌或造血系统癌,例如乳腺癌、脑癌、胃癌、肝癌、皮肤癌、前列腺癌、胰腺癌、食道癌、肉瘤、卵巢癌、子宫内膜癌、膀胱癌、子宫颈癌、直肠癌、结肠癌、肾癌、肺癌或orl癌、儿科肿瘤(神经母细胞瘤、多形性成胶质细胞瘤)、淋巴瘤、恶性上皮肿瘤(carcinoma)、胶质母细胞瘤、肝母细胞瘤、白血病、骨髓瘤、精原细胞瘤、霍奇金瘤或恶性血液病。
[0035]
本发明涉及用于标记或检测或靶向来自多细胞生物的真核细胞的方法,该方法包括以下步骤:
[0036]
a)使包含真核细胞的样品与至少一种修饰的单糖化合物或其前体接触;
[0037]
b)使步骤(a)的样品与带有第一反应基团的化合物接触,任选地在铜的存在下;以及
[0038]
c)任选地包括检测步骤(b)的化合物与步骤(a)的单糖的键合;
[0039]
其中所述至少一种修饰的单糖化合物具有下式(i):
[0040][0041]
其中x是第二反应基团,所述第一和第二反应基团可以在点击化学反应中一起反应。所述第一和第二反应基团之间的反应允许步骤(b)的化合物与式(i)的单糖键合。
[0042]
点击化学是技术人员熟知的用于将感兴趣的探针或底物连接到特定生物分子,例如根据本发明的修饰的单糖化合物的方法。叠氮炔烃环加成是众所周知的所谓点击化学反应,在铜催化剂存在或不存在的情况下,其中叠氮基团与炔基反应生成三唑。所述炔基可以是应变的(strained),也可以不是。
[0043]
这种叠氮炔烃环加成反应可以在配体,优选三
‑
三唑配体如tgta(三((1
‑
(
‑
d
‑
吡喃葡萄糖基)
‑
1[1,2,3]
‑
三唑
‑4‑
基)甲基)胺)或tbta(三
‑
[(1
‑
苄基
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)甲基]胺)的存在下在铜催化条件下进行。经常使用的其他合适的配体为:三(3
‑
羟丙基三唑基甲基)胺(thpta)、2
‑
(4
‑
((双((1
‑
叔丁基
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)甲基)氨基)甲基)
‑
lh
‑
l,2,3
‑
三唑
‑
l
‑
基)乙磺酸(bttes)、三((l
‑
(((乙基)羧甲基)
‑
(l,2,3
‑
三唑
‑4‑
基))甲基)胺、红菲咯啉二磺酸盐或三(2
‑
苯并咪唑基甲基)胺。
[0044]
或者,如果使用应变炔,例如氮杂二苯并环辛炔(adibo、dibac或dbco)或四甲氧基二苯并环辛炔(tmdibo),则可以在没有铜的情况下进行叠氮炔烃环加成。其他常用于无铜反应的合适的应变炔包括:环辛炔(oct)、无芳基环辛炔(alo)、单氟环辛炔(mofo)、二氟环辛炔(difo)、二苯并环辛炔(dibo)、二甲氧基氮杂环辛炔(dimac)、联芳氮杂环辛炔酮(barac)、双环壬炔(bcn)、四甲基硫杂环庚三烯鎓(tmti、tmth)、二氟苯并环辛炔(difbo)、氧杂二苯并环辛炔(odibo)、羧甲基单苯并环辛炔(combo)或苯并环壬炔。
[0045]
其他反应基团和其他反应也可用于点击化学,例如:施陶丁格连接(staudinger ligation,第一反应基团=叠氮化物,第二反应基团=膦)、无铜点击化学(第一反应基团=叠氮化物,第二反应基团=受限炔烃(环内炔烃))、羰基缩合(第一反应基团=醛或酮,第二反应基团=酰肼或氧胺)、巯基
‑
烯点击化学(第一反应基团=巯基和第二反应基团=烯烃)、腈
‑
氧化物
‑
烯点击化学(第一反应基团=腈氧化物或醛、肟或羟肟氯(hydroxymoyl chloride)或氯肟(chlororoxime),第二反应基团=烯烃或炔烃)、腈亚胺
‑
烯点击化学(第一反应基团=腈亚胺或醛、腙或腙酰氯(hydrazonoyl chloride)或氯腙,第二反应基团=烯烃或炔),反电子需求diels
‑
alder连接(第一反应基团=烯烃,第二反应基团=四嗪),异腈
‑
四嗪点击化学(第一反应基团=异腈,第二反应基团=四嗪),suzuki
‑
miyaura偶联(第一反应基团=芳基卤化物,第二反应基团=芳基硼酸酯),his
‑
tag(第一反应基团=寡聚组氨酸,第二反应基团=镍络合物或镍配体)。
[0046]
单糖化合物及其前体
[0047]
根据本发明,式(i)的修饰的单糖化合物包括适合在点击化学反应中,优选在叠氮炔烃环加成反应中反应的反应基团x(第二反应基团)。因此,x包括能够通过点击化学反应与另外的反应基团反应的任何反应基团,例如如上定义的反应基团。在特定的实施方案中,x包括由叠氮基(
‑
n3)组成或带有叠氮基(
‑
n3)的任何基团和由应变或非应变炔基(
‑
c≡c
‑
)组成或带有应变或非应变炔基(
‑
c≡c
‑
)的基团。在优选的实施方案中,x是叠氮基(
‑
n3)。
[0048]
在本发明的具体实施方案中,式(i)的修饰的单糖化合物包括其非对映异构体。在另一个特定的实施方案中,所述式(i)的修饰的单糖化合物选自由下式组成的组:
[0049][0050]
在优选的实施方案中,所述至少一种式(i)的修饰的单糖化合物为5
‑
叠氮基
‑5‑
脱氧
‑
d
‑
阿拉伯呋喃糖(ara
‑
n3),尤其具有下式:
[0051][0052]
在本发明的进一步的具体实施方案中,至少一种式(i)的修饰的单糖化合物是所述修饰的单糖化合物的前体。更具体地,所述前体具有式(i’):
[0053][0054]
其中x是如上定义的第二反应基团,优选叠氮基(
‑
n3),所述第一和第二反应基团可以在点击化学反应中一起反应。
[0055]
在进一步的具体实施方案中,所述式(i’)前体包括其非对映异构体。在进一步的具体实施方案中,所述式(i’)前体选自由下式组成的组:
[0056][0057]
在优选的实施方案中,所述式(i’)的前体是具有下式的5
‑
叠氮基
‑5‑
脱氧
‑
2:3
‑
异亚丙基
‑
d
‑
阿拉伯糖:
[0058][0059]
式(i)的修饰的单糖化合物或其前体可以根据本发明以任何浓度使用,因为它对细胞没有毒性。根据特定的实施方案,本发明的式(i)的单糖化合物或其前体的浓度可以在10μm至100mm,优选1mm至50mm,更优选1mm至20mm之间变化。
[0060]
带有第一反应基团的化合物
[0061]
带有第一反应基团的化合物包括或为可直接检测的部分,或包括或为可间接检测的部分。不受任何理论的束缚,由于在步骤(a)中与已被细胞膜同化的步骤(a)的单糖的第二反应基团发生点击反应,细胞与带有第一反应基团的化合物偶联。可检测部分(或标记),即能够通过本领域技术人员已知的技术例如荧光、比色法或发光检测的部分。因此,成像技术可以是荧光、磁共振或计算机断层扫描。
[0062]
根据一个实施方案,所述化合物可以包括或可以是可检测部分,即由可检测物质(或标记)组成或带有可检测物质(或标记)的部分,即能够通过本领域技术人员已知的技术,例如荧光、比色法或发光检测的物质。
[0063]
根据另一个实施方案,所述带有第一反应基团的化合物包括或者是间接可检测部分,其是第一配体(或更具体地,带有所述第一反应基团的第一结合蛋白)并且如下详述的步骤(c)中的检测和/或固定可以通过将偶联至所述第一配体(或更具体地第一结合蛋白)的所述真核细胞与第二配体(或第二结合蛋白)接触而发生,所述第二配体(或第二结合蛋白)与所述第一配体(或更具体地第一结合蛋白)特异性反应或结合。
[0064]
更具体地,所述化合物是带有所述第一反应基团的第一配体,优选生物素,并且在步骤c)中,通过所述真核细胞与抗体或另一种特异于所述第一配体的蛋白的反应来检测与所述第一配体偶联的所述真核细胞。所述抗体带有可检测的物质或部分,优选荧光染料或发光分子或酶。
[0065]
可检测的物质或部分可以从染料、放射性标记和亲和标签中选择。特别地,所述染料可选自荧光、发光或磷光染料,优选丹磺酰基、荧光素、吖啶、罗丹明、香豆素、bodipy和花青染料。更具体地,所述荧光染料可以选自thermo fisher销售的染料,例如alexa fluor染料、pacific染料或texas red或其他供应商提供的花青3、5和7的染料。特别地,带有用于cuaac的叠氮化物的染料是市售的alexa488、55、594和647以及tamra(四甲基罗丹明)。在第二个方面,所述可检测物质或部分(或标记)可以是亲和标签。这样的亲和标签可以例如选自生物素、his
‑
tag、flag
‑
tag、strep
‑
tag、糖、脂质、甾醇、peg
‑
连接子和辅助因子。在具体实施方案中,所述可检测物质是生物素化标记。与叠氮化物连接的生物素是可商购的(生物素叠氮化物)。在优选的实施方案中,所述标记是荧光标记。
[0066]
根据本发明,带有第一反应基团的化合物包括第一反应基团,该第一反应基团与如上定义的第二反应基团x互补,用于在点击化学反应,优选叠氮炔烃环加成反应中一起反应。在特定的实施方案中,所述化合物的第一反应基团包括由叠氮基(
‑
n3)组成或带有叠氮基(
‑
n3)的任何基团和由应变或非应变的炔基(
‑
c≡c
‑
)组成或带有应变或非应变的炔基(
‑
c≡c
‑
)的基团。
[0067]
在上述参与反应的基团列表中,第一反应基团和第二反应基团x可以置换。所有上述化学反应都会产生共价连接。例如,当x是叠氮基(
‑
n3)或带有叠氮基的基团时,则第一反应基团是炔或带有炔基的基团。当x是炔烃或带有炔基的基团时,第一反应基团是叠氮基(
‑
n3)或带有叠氮基的基团。在本发明的优选实施方案中,第二反应基团x是叠氮基(
‑
n3)并且第一反应基团是炔基(
‑
c≡c
‑
)。
[0068]
标记、检测或靶向的方法
[0069]
根据用于标记、检测或靶向来自多细胞生物的真核细胞的方法的步骤a)包括使包含真核细胞的样品与至少一种包含反应性或官能性基团x的式(i)的修饰的单糖化合物或其前体接触。这样的接触步骤a)允许将至少一种式(i)的修饰的单糖化合物或其前体掺入来自多细胞生物的所述真核细胞的膜中,更具体地在所述细胞的表面上。这样的过程可以对应于所述真核细胞对至少一种式(i)的修饰的单糖化合物的同化。因此,所述细胞在其表面或膜上存在至少一种式(i)的修饰的单糖化合物。
[0070]
步骤b)包括使步骤(a)的样品(其中至少一种式(i)的修饰的单糖化合物或其前体掺入真核细胞的膜中)与包含如上定义的第一反应基团的化合物接触。这样的步骤b)允许在化合物的第一反应基团和至少一种式(i)的修饰的单糖化合物或其前体(优选式(i'))的第二反应基团x之间产生点击化学反应,从而提供来自多细胞生物的偶联真核细胞,其被标记或靶向,或者之后可以被标记或靶向(如上文详述)。
[0071]
本发明的优选实施方案是标记、检测或靶向来自多细胞生物的真核细胞的方法,该方法包括以下步骤:
[0072]
a)将包含真核细胞的样品与ara
‑
n3接触;以及
[0073]
b)任选地在铜的存在下,使所述样品与包含第一反应基团的化合物接触。
[0074]
本领域技术人员知道如何实施步骤(a)或(b)。根据特定的实施方案,所述步骤(a)和/或(b)在允许包含真核细胞的样品生长的培养或培养基(优选对所述真核细胞的生长具有特异性)中进行。
[0075]
更具体地,步骤(a)或(b)的培养条件(包括时间和细胞培养基)适合待标记、检测或靶向的真核细胞。细胞培养基可以补充有任何化合物以增强或刺激细胞的倍增和/或式(i)的修饰的单糖化合物在细胞表面或细胞膜上的同化。
[0076]
根据特定的实施方案,步骤(a)的持续时间允许将至少一种式(i)的单糖化合物或其前体掺入所述真核细胞的膜中。更具体地,步骤(a)的持续时间至少是待标记、检测或靶向的真核细胞的倍增时间。更具体地,步骤(a)的持续时间小于待标记、检测或靶向的真核细胞倍增时间的五倍。根据特定的实施方案,步骤(a)的持续时间对应于待标记、检测或靶向的真核细胞的一个倍增时间或两个倍增时间。
[0077]
根据特定的实施方案,所述步骤(a)和/或(b)是用反应物和/或催化剂进行的,以产生所述第一反应基团与所述第二反应基团的反应。
[0078]
值得注意的是,式(i)的单糖化合物或其前体如实施例所示对细胞呈现低毒性或无毒性,因此其用量可在较大范围内变化。此类量将由本领域技术人员确定,使得该量足以标记、识别或检测真核细胞。
[0079]
该方法可以用任何样品实施,通常是受试者的生物样品,例如,流体,例如血液、血
浆、血清、尿液、脑脊液的样品或来自受试者或其部分的组织的样品。本发明可以用来自任何受试者的样品实施,包括任何患有或怀疑患有癌症的人类患者。该方法通常对血液、血清或血浆的样品或源自血液、血清或血浆的样品,例如预处理的血液样品进行。样品可在用于本发明之前进行处理(例如,稀释、浓缩、分离、部分纯化、冷冻等)。根据特定的实施方案,在该方法的步骤(a)中使用的每个样品包含细胞群或优选单个细胞,优选通过细胞分选获得,特别是通过流式细胞术获得。当该方法在体内实施时,该方法可以实施到受试者的全身或其一部分。在这种情况下,式(i)的单糖化合物或其前体和任选的带有第一反应基团的化合物可以肠内(包括口服)或肠胃外(包括静脉内或肌肉内)施用。
[0080]
为了检测来自多细胞生物的偶联真核细胞,该方法进一步包括步骤c),其包括检测步骤(b)的化合物与步骤(a)的单糖的键合。
[0081]
有利地,本发明包括另外的检测真核细胞的步骤(c),以检测所述真核细胞是否与带有步骤(b)的第一反应基团的化合物偶联和/或将与所述带有第一反应基团的化合物偶联的所述真核细胞固定在固体基质上,其中所述带有第一反应基团的化合物是包含可检测物质或能够与可检测物质反应或结合的部分或分子,或者优选所述带有第一反应基团的化合物是第一分子,其能够与第二分子反应或结合和/或结合至固体基质,优选所述第二分子包含可检测物质和/或所述第二分子结合或能够结合至所述固体基质。
[0082]
因此,本发明能够标记来自多细胞生物的真核细胞以及对真核细胞进行编号或检测以及浓缩和/或分离真核细胞,任选地固定在固体支持物上;尤其是由带有所述第一反应基团的磁珠构成的固体支持物。
[0083]
更特别地,所述带有第一反应基团的化合物是能够与第二分子反应或结合和/或结合至固体基质的第一分子,优选地,所述第二分子包含可检测物质,该方法包括检测真核细胞的步骤c)以检测所述真核细胞是否包含与所述真核细胞结合的所述可检测分子或部分。
[0084]
根据本发明的方法,在没有标记或检测的情况下,可以得出以下结论:实施的样品不包含来自多细胞生物的任何真核细胞。
[0085]
所述检测步骤c)可以在液体介质中或在固体基质上进行。
[0086]
优选地,用于标记或检测或靶向来自多细胞生物的真核细胞的方法是体外方法。
[0087]
根据特定实施方案,本发明的方法可进一步包括一个或多个洗涤步骤。
[0088]
根据特定的实施方案,根据本发明的方法可以使用例如微孔板对一个或多个样品同时进行。该微孔板通常具有6、12、24、48、96、384或1536个样品孔。根据所述特定实施方案,在该方法的步骤(a)中使用的每个样品孔优选地包含细胞群或优选地单个细胞,更优选地通过细胞分选获得,特别是通过流式细胞术获得。
[0089]
因此,本发明的进一步的目的是至少一种式(i)的修饰的单糖化合物或其前体(优选式(i’)),优选地与包含第一反应基团的化合物,和任选地与第二分子和/或结合至固体基质,用于标记或检测来自多细胞生物的真核细胞的体外用途,优选地,所述第二分子包含可检测物质。
[0090]
本发明的进一步的目的是用于实施标记或检测来自如本文定义的多细胞生物的真核细胞的方法的试剂盒,其包括:
[0091]
‑
式(i)的修饰的单糖化合物或其前体,优选式(i’),如上所定义,和
[0092]
‑
带有第一反应基团的化合物,如上所定义。
[0093]
根据特定的实施方案,该试剂盒可进一步包含如上定义的第二分子和/或固体基质,优选地,所述第二分子或固体基质包含可检测物质,所述带有第一反应基团的化合物为能够与所述第二分子反应或结合和/或结合至固体基质的第一分子。
[0094]
进一步的目的是如上定义的试剂盒用于实施标记或检测来自如本文定义的多细胞生物的真核细胞的方法的用途。
[0095]
根据特定的实施方案,来自多细胞生物的真核细胞是对癌症或肿瘤细胞敏感的细胞。因此,根据本发明的方法和试剂盒可用于通过检测标记来识别癌症或肿瘤细胞。
[0096]
识别或分离癌细胞或诊断癌症的方法
[0097]
本发明进一步涉及一种方法,优选体外或离体方法,其用于在受试者中识别或分离癌细胞或诊断癌症,所述方法包括实施用于标记或检测所述受试者或来自所述受试者的生物样品的本文定义的真核细胞。在优选的实施方案中,用于在受试者中识别或分离癌细胞或诊断癌症的方法进一步包括检测标记和任选地将标记与参考水平进行比较的步骤。
[0098]
来自受试者的生物样品如上所定义,并且优选地,所述样品是来自患有或怀疑患有癌症的人类患者的样品。根据特定的实施方案,在步骤(a)中使用的每个样品包含细胞群或优选单个细胞,优选通过细胞分选获得,特别是通过流式细胞术获得。
[0099]
更具体地怀疑所述样品包含癌细胞。
[0100]
此类样品的实例包括流体,例如血液、血浆、唾液、尿液和精液样品,以及活组织检查、器官、组织或细胞样品。所述样品可以在使用前进行处理。
[0101]
根据本发明识别或分离的癌细胞可以是任何类型。它们可能来自实体瘤或造血系统癌症。癌细胞包括循环或非循环肿瘤细胞。循环肿瘤细胞(ctc)是从原发肿瘤脱落到脉管系统或淋巴系统中并在血液循环中携带到全身的细胞。ctc构成远处器官中另外的肿瘤(转移)在之后生长的种子,其是造成绝大多数癌症相关死亡的机制。
[0102]
根据本发明的癌细胞的检测和分析可以帮助早期患者预后并确定合适的定制治疗。随时间监测疾病进展的能力可促进对患者治疗的适当修改,其有可能改善他们的预后和生活质量。在检测和分析循环肿瘤细胞的情况下,该方法可以允许早期检测癌症,特别是转移癌症。在这方面,根据本发明的样品是血液。血液检测既简单又安全,并且随着时间的推移可以采集多个样品。预测疾病未来进展能力的重要方面为在重复ctc计数低且不增加时消除(至少暂时)手术需要;避免手术的明显好处包括避免与癌症手术的先天致瘤性相关的风险。为此,作为本发明的具有检测患有转移性疾病的患者的ctc所需的灵敏度和可重复性的技术引起了极大的兴趣。
[0103]
如本文所用,表述“检测标记”可包括可视化或检测来自多细胞生物的标记的真核细胞的存在或还包括测量此类标记。此类标记(例如荧光)的测量允许检测、识别或分离癌细胞,任选地通过将标记与参考水平进行比较。
[0104]
在本文中已经发现,式(i)的修饰的单糖化合物或其前体,优选式(i'),在癌细胞中的同化与非癌细胞不同,并且更特别地与非癌细胞(例如参考水平或对照样品)相比更高。如实施例所示,与非癌细胞相比,癌细胞的荧光强度更高(例如,在一或两个细胞倍增时间后)。
[0105]
因此,本发明涉及用于在受试者中识别或分离癌细胞或用于诊断癌症的方法,其
包括:
[0106]
‑
实施用于标记来自所述受试者的样品的如本文所述的真核细胞的方法;
[0107]
‑
在实施所述标记方法之后检测标记,并且任选地将所述标记与参考水平进行比较;然后
[0108]
‑
基于标记的测量识别癌细胞或诊断癌症。
[0109]
识别或分离癌细胞或诊断癌症的方法可以有利地在一个细胞周期时间段内进行。标记的检测优选在实施所述标记方法后10小时至40小时,更优选16至24、25或至36小时,并且更具体地在实施如上文详述的步骤(a)之后进行。
[0110]
该方法可以任选地包括与参考水平,更具体地与对照样品或参考的比较。所述参考水平可以是在正常细胞(例如非癌细胞)和/或已知癌细胞中测量的标记(例如荧光)强度。优选地,参考细胞是与待研究细胞最接近的细胞,优选来自相同细胞系、相同器官和/或相同类型的细胞。该方法可以包括提供肿瘤样品和来自受试者的组织学匹配的正常组织的先前步骤。
[0111]
根据具体的实施方案,当样品的标记的测量值高于作为非癌症样品的对照样品的标记的测量值时,识别为癌细胞或诊断出癌症。“较高测量值”是指样品相对于非癌样品的标记比大于1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5或3.0。更具体地,样品相对于非癌样品的标记比大于1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5或3.0。
[0112]
根据特定的实施方案,待诊断的癌症选自直肠癌、结直肠癌、胃癌、头颈癌、甲状腺癌、宫颈癌、子宫癌、乳腺癌、卵巢癌、脑癌、肺癌、皮肤癌、膀胱癌、血癌、肾癌、肝癌、前列腺癌、多发性骨髓瘤和子宫内膜癌。更具体地,待诊断的癌症选自:膀胱癌、血液癌、皮肤癌、胰腺癌、脑癌、肝癌、肾癌、肺癌、肌肉癌、淋巴细胞癌、前列腺癌、胃癌和乳腺癌。根据更具体的实施方案,待诊断的癌症选自:膀胱癌、血液癌、结肠癌、胃癌、乳腺癌、肺癌、皮肤癌和胰腺癌。
[0113]
根据特定的实施方案,待识别或分离的癌细胞是源自上述癌症的癌细胞。
[0114]
药物组合物及其用途
[0115]
本发明涉及组合物,其包含在其表面上存在至少一种如上定义的式(i)的修饰的单糖化合物或其前体,优选式(i')的真核细胞,该式(i)的修饰的单糖化合物或其前体可操作地连接或不连接至抗癌药物或包含至少一种抗癌药物的颗粒。
[0116]
在一个特定方面,在其表面上存在至少一种如上定义的式(i)的修饰的单糖化合物或其前体(其与抗癌药物或包含至少一种抗癌药物的颗粒可操作地连接或不连接)的细胞可以按照本发明中的上述方法制备。
[0117]
根据本发明的组合物可以通过包括以下步骤的方法制备:
[0118]
a)使包含来自多细胞生物的真核细胞的组合物与至少一种如上定义的修饰的单糖化合物或其前体接触;
[0119]
b)使步骤(a)的组合物与带有第一反应基团并且任选地包含可操作地连接的抗癌药或包含至少一种抗癌药的颗粒的化合物接触,任选地在铜的存在下。
[0120]
所述步骤类似于上面详述的步骤。步骤a)允许所述细胞在其表面或膜上存在至少一种式(i)的修饰的单糖化合物或其前体。步骤b)允许在化合物的第一反应基团和至少一
种式(i)的修饰的单糖化合物或其前体,优选式(i’)的第二反应基团x之间产生点击化学反应。
[0121]
根据一个实施方案,具有第一反应基团的化合物还可以包含或可以是可操作连接的抗癌药物或包含至少一种与所述化合物连接的抗癌药物的颗粒,步骤(b)允许提供与抗癌药物或包含抗癌药物的颗粒偶联的来自多细胞生物的真核细胞。
[0122]
因此,该方法允许通过如上详述的点击化学反应制备缀合物,其中式(i)的修饰的单糖化合物或其式(i')的前体与抗癌药物或包含抗癌药物的颗粒可操作地连接,并且该真核细胞在其表面上存在所述缀合物。在具体实施方案中,通过包含炔基的抗癌药物或表面上存在炔基的颗粒与包含叠氮基的式(i)的修饰的单糖化合物或其前体式(i')之间的点击化学反应制备所述缀合物。
[0123]
根据另一个实施方案,具有第一反应基团的化合物是能够与作为抗癌剂的第二配体(或更具体地第二结合蛋白)反应或结合的第一配体(或更具体地第一结合蛋白)。根据这样的实施方案,该方法允许通过如上详述的点击化学反应制备缀合物,其中式(i)的修饰的单糖化合物或其前体式(i')连接至能够与作为抗癌剂的第二配体反应或结合的第一配体,并且真核细胞在其表面上存在所述缀合物。在特定的实施方案中,所述缀合物通过如上详述的点击化学反应制备。
[0124]
如本文所用,“抗癌药”对应于目前用于癌症治疗的任何药物,例如抗肿瘤药。在优选的实施方案中,所述抗癌药选自化疗剂、抗癌抗体、激素疗法、免疫疗法和激酶抑制剂。
[0125]
术语“可操作地连接的抗癌药”是指连接的,优选共价连接的,同时能够呈现其治疗效果的抗癌药。
[0126]
包含至少一种抗癌药物的颗粒是含有抗癌药物的颗粒,优选纳米颗粒,其具有如上定义的第一反应基团。例如,所述颗粒可以是双环[6.1.0]壬炔修饰的乙二醇壳聚糖纳米颗粒(bcn
‑
cnps)。众所周知,cnps能够以高相容性包封龋齿(carious)药物,并广泛用于药物输送。
[0127]
化学疗法可包括拓扑异构酶i或ii抑制剂、dna交联剂、dna烷化剂、抗代谢剂和/或有丝分裂纺锤体抑制剂。
[0128]
拓扑异构酶i和/或ii的抑制剂包括但不限于依托泊苷、拓扑替康、喜树碱、伊立替康、安吖啶、茚托利辛、蒽环类药物如多柔比星、表柔比星、柔红霉素、idanrubicine和米托蒽醌。拓扑异构酶i和ii的抑制剂包括但不限于茚托利辛(intoplecin)。
[0129]
dna交联剂包括但不限于顺铂、卡铂和奥沙利铂。
[0130]
抗代谢剂阻断负责核酸合成的酶或被掺入到dna中,从而产生不正确的遗传密码并导致细胞凋亡。其非穷举性实例包括但不限于叶酸拮抗剂、嘧啶类似物、嘌呤类似物和腺苷脱氨酶抑制剂,更特别地甲氨蝶呤、氟尿苷、阿糖胞苷、6
‑
巯基嘌呤、6
‑
硫鸟嘌呤、磷酸氟达拉滨、喷司他汀、5
‑
氟尿嘧啶、吉西他滨和卡培他滨。
[0131]
烷基化剂包括但不限于氮芥、乙烯亚胺衍生物、烷基磺酸盐(酯)、亚硝基脲、金属盐和三氮烯。其非穷举性实例包括尿嘧啶氮芥、双氯乙基甲胺(chlormethine)、环磷酰胺(cytoxan(r))、异环磷酰胺、美法仑、苯丁酸氮芥、哌泊溴烷、三亚乙基三聚氰胺、三亚乙基硫代磷胺(triethylenethiophosphoramine)、白消安、卡莫司汀、洛莫司汀、福莫司汀、顺铂、卡铂、奥沙利铂、噻替哌、链脲佐菌素、达卡巴嗪和替莫唑胺。
[0132]
有丝分裂纺锤体的抑制剂包括但不限于紫杉醇、多西他赛、长春瑞滨、拉洛他赛(也称为xrp9881;sanofi
‑
aventis)、xrp6258(sanofi
‑
aventis)、bms
‑
184476(bristol
‑
meyer
‑
squibb)、bms
‑
188797(bristol
‑
meyer
‑
squibb)、bms
‑
275183(bristol
‑
meyer
‑
squibb)、奥他赛(也称为idn 5109、bay 59
‑
8862或sb
‑
t
‑
101131;bristol
‑
meyer
‑
squibb)、rpr 109881a(bristol
‑
meyer
‑
squibb)、rpr116258(bristol
‑
meyer
‑
squibb)、nbt
‑
287(tapestry)、pg
‑
紫杉醇(也称为ct
‑
2103、ppx、聚谷氨酸紫杉醇(paclitaxel poliglumex)、paclitaxel polyglutamate或xyotax
tm
)、(也称为nab
‑
紫杉醇;abraxis bioscience)、替司他赛(tesetaxel)(也称为dj
‑
927)、idn 5390(indena)、taxoprexin(也称为二十二碳六烯酸(docosahexanoic acid)
‑
紫杉醇;protarga)、dha
‑
紫杉醇(也称为)和mac
‑
321(wyeth)。另见hennenfent&govindan的综述(2006,annals of oncology,17,735
‑
749)。
[0133]
免疫检查点抑制剂可选自抗ctla
‑
4(细胞毒性t淋巴细胞相关蛋白4)疗法如易普利姆玛、pd
‑
1(程序性细胞死亡蛋白1)抑制剂如纳武单抗、派姆单抗或bgb
‑
a317、pdl1(程序性细胞死亡配体)抑制剂,例如阿特朱单抗、阿维单抗或度伐鲁单抗、lag
‑
3(淋巴细胞激活基因3)抑制剂,例如bms
‑
986016、tim
‑
3(t细胞免疫球蛋白和含粘蛋白结构域
‑
3)抑制剂、tigit(具有ig和itim结构域的t细胞免疫受体)抑制剂、blta(b和t淋巴细胞弱化子)抑制剂、ido1抑制剂如艾卡哚司他(epacadostat),或其组合。
[0134]
激素疗法包括例如他莫昔芬、fareston、arimidex、aromasin、femara、zoladex/lupron、megace和halotestin。
[0135]
来自本发明组合物的多细胞生物的真核细胞优选是分离的非癌细胞。所述细胞优选为分离的多能干细胞。所述细胞优选地为间充质干细胞(msc)。msc存在于全身,优选存在于脂肪组织、骨髓、支持器官的组织中,也存在于骨骼、软骨和肌肉等中。根据本发明的真核细胞可以是t细胞。
[0136]
所述细胞为同种异体细胞或优选地为自体细胞(即来自受试者或患者本人)。
[0137]
根据特定的实施方案,该组合物包含在其表面上存在至少一种如上定义的式(i)的修饰的单糖化合物或其前体的msc。此类组合物可用于例如通过使用待由包含第一反应基团的化合物直接或间接检测的单糖的性质来识别癌细胞或肿瘤或诊断癌症,如上文详述。这种组合物还可用于治疗以监测造血移植。
[0138]
根据另一个特定的实施方案,该组合物包含在其表面上存在至少一种如上定义的式(i)的修饰的单糖化合物或其前体的msc,该式(i)的修饰的单糖化合物或其前体可操作地连接至抗癌药物或连接至包含至少一种抗癌药物并连接至所述化合物的颗粒。这种组合物还可用于治疗,特别是用于治疗癌症。
[0139]
本发明的组合物优选为药物组合物。
[0140]
除了如上详述的存在抗癌药物的细胞之外,本文所考虑的药物组合物还包括药学上可接受的载体。术语“药学上可接受的载体”意在包括不干扰细胞生物活性的有效性并且对它所施用的宿主无毒的任何载体(例如,支持物、物质、溶剂等)。例如,对于肠胃外施用,活性化合物可以配制成单位剂型,用于在媒介物,例如盐水、右旋糖溶液、血清白蛋白和林格氏溶液中注射。药物组合物可以配制成药学相容溶剂中的溶液,或配制成合适的药用溶剂或媒介物中的乳液、悬浮液或分散液,或以本领域已知的方式配制成含有固体媒介物的
丸剂、片剂或胶囊。适用于肠胃外施用的制剂方便地包含活性成分的无菌油性或水性制剂,其优选与接受者的血液等渗。
[0141]
在与制剂的其他成分相容并且对其接受者无害的意义上,载体必须是“可接受的”。药物组合物有利地通过注射或静脉内输注合适的无菌溶液来施用。大多数这些化学治疗剂的安全有效施用方法是本领域技术人员已知的。此外,它们的施用方法在标准文献中有所描述。
[0142]
本发明的药物组合物可用于癌症疗法,更具体地用于癌细胞疗法。
[0143]
本发明的优选实施方案是如本文定义的药物组合物用于治疗如上定义的癌症。
[0144]
进一步优选的实施方案是在有需要的受试者中治疗癌症的方法,其包括施用有效量的如本文定义的药物组合物。
[0145]
进一步优选的实施方案是如本文所定义的药物组合物在制备用于治疗癌症的药物中的用途。
[0146]
成像和诊断
[0147]
如上详述,式(i)的修饰的单糖化合物或其前体式(i’)适用于形成具有标记,优选荧光标记的可检测实体,特别是通过点击化学反应。
[0148]
因此,本发明涉及本文公开的式(i)的修饰的单糖化合物或其前体式(i’)作为用于检测来自多细胞生物的真核细胞的研究工具的用途,并且更具体地涉及用于识别或分离癌细胞。本发明进一步涉及如本文公开的式(i)的修饰的单糖化合物或其前体式(i’),用于医学成像或诊断,优选用于诊断癌症。
[0149]
本发明的进一步的方面和优点将在以下实施例中描述,这些实施例应被视为说明性的而非限制性的。
实施例
[0150]
实施例1:化合物的合成
[0151]
材料和方法:
[0152]
薄层色谱在merck 60f254上进行,通过uv,和/或通过用硫酸或kmno4或磷钼酸溶液进行炭化来检测。硅胶60 40
‑
63mm用于快速柱色谱。
[0153]
nmr光谱是在bruker avance 300或500mhz光谱仪上获取的,使用残留的质子化溶剂作为内标。化学位移δ以百万分之几(ppm)给出,耦合常数以赫兹(hz)报告。分裂模式被指定为单峰(s)、双峰(d)、三重峰(t)、双重的双峰(dd)、双重的双重的双峰(ddd)。无法解释或易于可视化的分裂模式被指定为多重峰(m)。
[0154]
在waters lct premier xe(tof)上采集质谱,在正(esi )或负(esi
‑
)检测模式进行电喷雾电离。
[0155]
ir
‑
ft光谱在perkin elmer spectrum 100光谱仪上记录。特征吸收以cm
‑1为单位报告。
[0156]
比旋光度是在20℃用anton paar mcp 300旋光仪在10
‑
cm池中在20℃和589nm测量的。
[0157]
所有生物和化学试剂均为分析级或细胞培养级,从商业来源获得,无需进一步纯化即可使用。
[0158]
ara
‑
n3及其前体vi已根据以下步骤合成:
[0159][0160]
其中r1、r2和r3为甲基。
[0161]
2:3,4:5
‑
二亚异丙基
‑
d
‑
阿拉伯糖o
‑
甲基肟(化合物ii)
[0162]
向d
‑
(
‑
)
‑
阿拉伯糖(4.00g,26.6mmol,1.0eq.)在无水吡啶(90ml)中的溶液中加入甲氧基胺盐酸盐(2.72g,32.0mmol,1.2eq.)并在室温搅拌混合物15小时。减压除去溶剂,残余物与甲苯共蒸发3次。将残余物重新悬浮在2,2
‑
二甲氧基丙烷(100ml)中并加入7
‑
甲苯磺酸(1.01g,5.33mmol,0.2eq.)并将悬浮液加热回流4小时,然后在室温搅拌另外的15小时。反应混合物经过滤并蒸发溶剂。将残余物溶解在乙酸乙酯(200ml)中并用饱和nacl水溶液(2x 150ml)洗涤。通过硅胶快速柱色谱(环己烷/乙酸乙酯9:1)纯化,得到异构体2:3,4:5
‑
二亚异丙基
‑
d
‑
阿拉伯糖o
‑
甲基肟(iie/iiz)和未知杂质(nmr比例6:1:0.4,5.83g)的混合物,为无色油状物。该混合物无需进一步纯化即可用于下一步。通过第二次快速柱色谱(二氯甲烷/mtbe 98:2)获得纯(2e)的等分试样并进行表征。
[0163]
异构体(iie):
[0164]
rf(ch2cl2/mtbe 98:2):0.35。
[0165]
ir(cm
‑1):2987,2939,2900,2821,1631,1456,1381,1371,1241,1212,1150,1065,1038,887,842。
[0166]1h
‑
nmr(500mhz,cdcl3)δ:7.35(d,1h,j
1,2 6.3hz,h
‑
l);4.46(dd,1h,j
2,3 7.1,j
1,2 6.3hz,h
‑
2);4.13(ddd,1h,j
3,4 6.9,j
4,5a 6.1,j
4,5b 4.8hz,h
‑
4);4.08(dd,1h,j
5a,5b 8.5,j
4,5a 6.1hz,h
‑
5a);3.97(d,1h,j
2,3 7.1,j
3,4 6.9hz,h
‑
3);3.94(dd,1h,j
5a,5b 8.5,j
4,5b 4.8hz,h
‑
5b);3.85(s,3h,ch3‑
o);1.40(s,3h,ch3‑
c);1.38(s,6h,2ch3‑
c);1.32(s,3h,ch3‑
c)。
[0167]
13
c
‑
nmr(125mhz,cdcl3)δ:147.8(c
‑
l);110.8(c
‑
6);110.0(c
‑
7);79.4(c
‑
3);76.7(c
‑
2);76.6(c
‑
4);67.1(c
‑
5);62.1(ch3
‑
o);27.1,27.0,26.9,25.4(4ch3
‑
c)。
[0168]
hrms(esi
):[m h]
(c
12
h
22
no
5
)计算值m/z:260.1492,测量值:260.1502。
[0169]
2:3
‑
亚异丙基
‑
d
‑
阿拉伯糖o
‑
甲基肟(化合物iii)
[0170]
2:3,4:5
‑
二亚异丙基
‑
d
‑
阿拉伯糖o
‑
甲基肟(ii)(iie/iiz)和杂质(1.50g)在80%(v/v)醋酸水溶液(30ml)中的溶液在旋转蒸发仪上在200毫巴的压力下加热至40℃。2.5小时后减压除去溶剂,残余物与甲苯共蒸发。硅胶快速柱色谱(环己烷/乙酸乙酯1:1)后得到异构体2:3
‑
亚异丙基
‑
d
‑
阿拉伯糖o
‑
甲基肟(iiie/iiiz)(nmr比4:1,876mg,3步58%)的混合物,为无色油状物。核磁共振纯度大于95%。
5.9hz,h
‑
2);4.45(dd,1h,j
5a,5b 11.4,j
4,5a 2.4hz,h
‑
5a);4.29(dd,1h,j
5a,5b 11.4,j
4,5b 7.9hz,h
‑
5b);3.98(ddd,1h,j
4,5b 7.9,j
4,3 7.5,j
4,5a 2.4hz,h
‑
4);3.93(s,3h,ch3‑
o);3.84(dd,1h,j
3,4 7.5,j
3,2 7.3hz,h
‑
3);3.06(s,3h,ch3‑
s);1.40(s,3h,ch3‑
c);1.39(s,3h,ch3‑
c)。
[0191]
13
c
‑
nmr(75mhz,cdcl3)δ:150.7(c
‑
1);111.2(c
‑
6);79.1(c
‑
3);72.9(c
‑
2);71.3(c
‑
5);70.9(c
‑
4);62.9(ch3‑
o);37.9(ch3‑
s);27.0,26.6(2ch3‑
c)。
[0192]5‑
叠氮基
‑5‑
脱氧
‑
2:3
‑
亚异丙基
‑
d
‑
阿拉伯糖o
‑
甲基肟(化合物v):
[0193]
向(ive/ivz)(810mg,2.72mmol,1.0eq.)在n,n
‑
二甲基甲酰胺(30.0ml,0.10m)中的溶液中加入叠氮化钠(531mg,8.17mmol,3.0eq.)并将反应混合物在80℃加热15小时。减压除去溶剂并将残余物用快速柱色谱(环己烷/乙酸乙酯9:1)纯化,得到5
‑
叠氮基
‑5‑
脱氧
‑
2:3
‑
亚异丙基
‑
d
‑
阿拉伯糖o
‑
甲基肟的混合物(ve/vz)(nmr比率7:3,637mg,96%),为淡黄色油状。一部分(ve)通过快速柱色谱(二氯甲烷/mtbe97:3)分离以进行表征。核磁共振纯度大于95%。
[0194]
rf(环己烷/乙酸乙酯8:2):0.30。
[0195]
ir(cm
‑1):3458,2989,2939,2823,2100,1630,1443,1373,1213,1164,1066,1036,885,865。
[0196]
hrms(esi
):[m h]
(c9h
17
n4o
4
)计算值m/z:245.1245,测量值:245.1250。
[0197]
异构体(ve):
[0198]
rf(二氯甲烷/mtbe 97:3):0.23。
[0199]1h
‑
nmr(500mhz,cdcl3)δ:7.42(d,1h,j
1,2 5.8hz,h
‑
l);4.54(dd,1h,j
2,3 7.2,j
1,2 5.8hz,h
‑
2);3.98(dd,1h,j
2,3 7.2,j
3,4 6.4hz,h
‑
3);3.92(dddd,1h,j
3,4 6.4,j
4,5b 6.2,j
4,oh 3.9,j
4,5a 3.8hz,h
‑
4);3.85(s,3h,ch3‑
o);3.46(dd,1h,j
5a,5b
12.5,j
4,5a 3.8hz,h
‑
5a);3.42(dd,1h,j
5a,5b 12.5,j
4,5b 6.2hz,h
‑
5b);2.61(d,1h,j
4,oh 3.9hz,oh);1.41(s,3h,ch3‑
c);1.39(s,3h,ch3‑
c)。
[0200]
13
c
‑
nmr(125mhz,cdcl3)δ:148.4(c
‑
l);110.6(c
‑
6);78.8(c
‑
3);75.8(c
‑
2);71.5(c
‑
4);62.3(ch3‑
o);53.7(c
‑
5);27.0,26.8(2ch3‑
c)。
[0201]
异构体(vz):
[0202]1h
‑
nmr(500mhz,cdcl3)δ:6.86(d,1h,j
1,2 6.1hz,h
‑
l);4.94(dd,1h,j
2,3 7.2,j
1,2 6.1hz,h
‑
2);3.93(s,3h,ch3‑
o);3.87(ddd,1h,j
3,4 7.5,j
4,5b 6.4,j
4,5a
2.8hz,h
‑
4);3.82(dd,1h,j
3,4 7.5,j
2,3 7.2hz,h
‑
3);3.47(dd,1h,j
5a,5b 12.8,j
4,5a
2.8hz,h
‑
5a);3.39(dd,1h,j
5a,5b 12.8,j
4,5b 6.4hz,h
‑
5b);1.40(s,3h,ch3‑
c);1.38(s,3h,ch3‑
c)。
[0203]
13
c
‑
nmr(75mhz,cdcl3)δ:150.8(c
‑
l);111.0(c
‑
6);80.0(c
‑
3);72.9(c
‑
2);72.5(c
‑
4);62.8(ch3‑
0);53.5(c
‑
5);26.9,26.5(2ch3‑
c)。
[0204]5‑
叠氮基
‑5‑
脱氧
‑
2:3
‑
亚异丙基
‑
d
‑
阿拉伯糖(化合物vi)
[0205]
向(ve/vz)(820mg,3.36mmol,1.0eq.)在80%(v/v)乙酸水溶液(120ml)中的溶液中加入甲醛(0.8ml)并将反应混合物室温搅拌1小时。在减压下除去溶剂并与甲苯共蒸发以确保完全消除乙酸。得到粗品化合物5
‑
叠氮基
‑5‑
脱氧
‑
2:3
‑
亚异丙基
‑
d
‑
阿拉伯糖(vi)(682mg)。
[0206]
无色油
biowhittaker)洗涤贴壁细胞两次,然后暴露于ara
‑
n3探针(10mm)。将探针添加到具有不同fbs浓度(3%和10%)的培养基中。然后,将细胞在37℃、5%的co2中再次温育24小时。对照细胞使用补充了5%或10%fbs的培养基进行培养,不添加ara
‑
n3。
[0228]
用抗生物素抗体标记:
[0229]
ara
‑
n3探针的荧光同化通过无铜点击化学使用磺基
‑
dbco
‑
生物素(1mm)进行可视化,然后用小鼠抗生物素alexa fluor 488抗体缀合物(0.62mg/ml原液,jackson immunoresearch,稀释1/10)标记。点击反应如下进行:在24小时温育时间,去除培养基,并用pbs洗涤贴壁细胞两次。用tryp
‑
le分离细胞,用pbs洗涤两次,并以13000g离心2分钟。细胞沉淀用10μl磺基
‑
dbco
‑
生物素重悬浮,并在黑暗中在37℃温育30分钟。然后,细胞用pbs洗涤两次,离心,细胞沉淀用10μl小鼠抗生物素抗体溶液重悬浮,然后在室温避光温育。此后,将细胞用pbs洗涤两次,并将小细胞悬液点(5μl)放入粘附载玻片(vwr international s.a.s),在暗室中,直至干燥(20分钟)。在黑暗和室温,用4%多聚甲醛固定所述点20分钟。然后用pbs洗涤载玻片两次,然后用方形盖玻片(vwr国际s.a.s)使用甘油封固介质(dako)回收并储存在4℃的暗室中。
[0230]
荧光显微镜:
[0231]
使用配备60x/1.3数字开口/1.4sri(硅酮折射率)物镜的olympus microscopy ix83(olympus life science)和具有109nm/像素校准像素尺寸的hamamatsu oreca flash 4lt相机记录荧光采集。通过x
‑
cite 120led使用at180/30x激发滤光片发射激发光,并使用at535/40m发射滤光片监测信号。绿光曝光时间为600毫秒,白光曝光时间通过dic方法确定为340毫秒。cellsens dimension v1.16软件分析的采集面积大小因点中包含的细胞数而异。
[0232]
图像处理和荧光定量:
[0233]
使用cellsens dimension v1.16软件的计数和测量单元处理图像。如下删除背景噪声:首先在图像的背景上定义roi并计算平均像素强度。从图像的所有像素中减去由此获得的值。每个细胞的荧光强度由设置为3030的阈值确定。强度低于3030的所有像素均不计数。
[0234]
结果:
[0235]
表1:24小时时标记细胞%的评估
‑
fbs浓度3%
[0236]
强度/μm2sv
‑
huc1%(n=239)t24%(n=226)0
‑
5000062.342.2150,000
‑
100,0002.512.65100,000
‑
150,0002.092.65150,000
‑
200,0001.265.75200,000
‑
250,0001.673.98250,000
‑
300,0003.773.54300,000
‑
350,0000.422.21350,000
‑
400,0000.423.98400,000
‑
450,0000.842.65
450,000
‑
500,0002.933.54>500,00021.7666.81
[0237]
表2:24小时时标记细胞%的评估
‑
fbs浓度10%
[0238][0239][0240]
表1和表2的结果显示,与sv
‑
huc1细胞相比,24小时后t24细胞的标记细胞百分比更大,从而证明肿瘤膀胱细胞中ara
‑
n3探针的同化更高。更具体地说,在高于500,000的强度/μm2时,在fbs浓度为3%时sv
‑
huc1%为21.76和t24%为66.81,在fbs浓度为10%时sv
‑
huc1%为14.62和t24%为79.42,而在低强度时获得的标记细胞%则相反。强度的总体分布在正常细胞和癌细胞之间有所不同。
[0241]
实施例3:标记非癌症和癌症真核细胞
[0242]
材料与方法:
[0243]
对其他癌症和相应的非癌细胞进行了与实施例2相同的实验。培养基适应被测细胞并补充10%胎牛血清(fbs)。将ara
‑
n3探针(10mm)添加到fbs浓度(10%)的培养基中。温育时间对应于测试细胞的一个倍增时间或两倍倍增时间(见下表)。
[0244]
荧光信号癌症/非癌症比率是基于用ara
‑
n3在癌症和相应的非癌细胞上测试获得的荧光强度计算的。
[0245]
结果:
[0246]
结果如下所示(表3),与相应的非癌细胞系相比,测试的癌细胞系显示出更高的荧光强度(比率高于1)。
[0247]
[0248][0249][0250]
对其他人类癌细胞进行了相同的实验,与匹配的非癌细胞相比,更具体地包括以
下细胞(表4):
[0251]
表4
[0252]
人癌细胞系器官疾病u87脑胶质母细胞瘤huh6肝脏肝母细胞瘤huh7肝脏肝癌786
‑
o肾肾细胞癌nci
‑
h28肺胸膜肉瘤样间皮瘤sw 684肌肉纤维肉瘤imr
‑
32脑成神经细胞瘤mda pca 2b前列腺腺癌ags胃胃腺癌kato iii胃胃癌nci
‑
n87胃胃癌
[0253]
预期获得与表3相同的结果,即与相应的非癌细胞系相比,测试的癌细胞系具有更高的荧光强度(特别是高于1的比率)。
[0254]
实施例4
‑
:ara
‑
n3和kdo
‑
n3的标记比较
[0255]
专利申请wo2013/107759中描述了kdo
‑
n3(8
‑
叠氮基
‑
3,8
‑
二脱氧
‑
d
‑
甘露
‑
辛酮糖酸)作为标记细菌的有用工具。
[0256]
ara
‑
n3和kdo
‑
n3在与实施例2相同的条件下用其他人细胞系:hela、raw和巨噬细胞进行测定。
[0257]
所述细胞系未用kdo
‑
n3标记(未观察到荧光强度)而所述细胞系用ara
‑
n3标记。
[0258]
实施例5:ara
‑
n3探针对细胞的无毒性(体外/体内)
[0259]
a
‑
体外实验
[0260]
材料和方法
[0261]
ara
‑
n3探针如上详述制备。
[0262]
细胞系(如下表详述)由inserm/aquiderm transfer cell提供。细胞系的细胞培养和细胞毒性测试也在inserm u1035实验室中通过aquiderm transfer cell进行。
[0263]
外周血单核细胞(单核细胞/淋巴细胞)的分离
[0264]
按照与etablissementdu sang d’aquitaine建立的惯例,从来自2个不同健康供体的外周血中分离出人类单核细胞。使用的技术是ficoll梯度分离。简而言之,将在磷酸盐缓冲盐水溶液(pbs)中稀释的血液沉积在蔗糖溶液(ficoll,eurobio)上并离心以分离不同的血液成分。在ficoll和血浆之间建立由单核细胞和淋巴细胞组成的细胞环。将其回收并在pbs中洗涤以在malassez cell上计数。
[0265]
通过与抗cd14抗体(miltenyi biotech)偶联的磁珠从淋巴细胞中分离人cd14 单核细胞。单核细胞在pbs缓冲液中,根据细胞数量在确定浓度的珠子存在下温育15分钟。然后将细胞在pbs中洗涤,然后放置在安装在强磁铁上的柱子上。附着在抗cd14磁球上的cd14 细胞可以保持附着在柱上。洗涤后,将柱子从磁性支持物上取下,并通过在pbs缓冲液中洗涤柱子使细胞分离。
[0266]
通过在malassez cell上计数来确定单核细胞的数量。
[0267]
细胞培养
[0268]
细胞在37℃、5%co2和95%湿度的烘箱中在不同培养基中培养:
[0269]
‑
对于单核细胞/thp1对,在补充有10%的去补体的fcs(胎牛血清)和抗生素青霉素(100iu/ml)和链霉亲和素(100μg/ml)的rpmi 1640培养基中。
[0270]
‑
对于hacat/a431对,在补充有10%的去补体的fcs和抗生素青霉素(100iu/ml)和链霉亲和素(100μg/ml)的dmem培养基中。
[0271]
在整个研究过程中每2天更换一次培养基。
[0272]
当培养物达到70
‑
80%汇合时,用10%胰蛋白酶
‑
edta分离贴壁细胞。通过台盼蓝排除试验评估细胞活力。
[0273]
与ara
‑
n3探针接触
[0274]
将所有细胞接种在培养板中,对于mts增殖测试以1*104个细胞/孔的密度在96孔中,对于膜联蛋白v测试/ip测试以5*104个细胞/孔的密度在24个孔中。然后将细胞在37℃和5%co2温育24小时。24小时后,更换所有孔中的培养基,将粘附在孔底部的细胞在pbs(eurobio)中冲洗两次或离心并在pbs中洗涤两次以用于悬浮细胞,然后暴露于以下不同浓度的ara
‑
n3探针:1、10、50和100mm。细胞在37℃和5%co2温育48小时。
[0275]
对照细胞用补充培养基培养,不添加ara
‑
n3探针。
[0276]
膜联蛋白v/ip细胞毒性试验
[0277]
该测试需要使用膜联蛋白v
‑
apc试剂盒(biolegend)来检测细胞凋亡/坏死。该测试利用膜联蛋白v与膜磷脂酰丝氨酸(ps)结合的能力以及碘化丙啶(pi)在dna上的嵌入特性。
[0278]
具体而言,活细胞在其膜双层的内层表达ps。因此ps对膜联蛋白v
‑
apc来说难以接近,同样,细胞在远离细胞核的地方保持其dna的完整性,使ip也无法接近dna。当细胞进入细胞凋亡(程序性细胞死亡)时,会发生一系列事件。其中,有细胞质膜层的倒置。暴露在内膜上的ps存在于脂质双层降解形成的囊泡的外膜上。因此,它们可以固定膜联蛋白v
‑
apc分子并在660nm处发出荧光,可通过流式细胞术检测。
[0279]
在细胞凋亡过程中,细胞随后会发生坏死。核膜降解,dna释放到培养基中。pi可以插入dna的碱基之间,并在370
‑
550nm处发出第二荧光,也可通过流式细胞术检测。
[0280]
简而言之,在不同浓度和不同时间(24小时和48小时)将细胞用ara
‑
n3探针孵育后,回收细胞,胰蛋白酶消化(对于贴壁细胞)并在pbs中洗涤。在malassez cell上用台盼蓝计数后,在膜联蛋白v
‑
apc(5μl)和ip(10μl)存在的情况下,将细胞在标记缓冲液(100μl)中室温黑暗中温育15分钟。加入100μl标记缓冲液后,直接通过细胞仪进行分析。
[0281]
下表5收集了ara
‑
n3相对于测试细胞的无毒浓度。
[0282]
b
‑
体内实验
[0283]
材料和方法
[0284]
ara
‑
n3探针如上详述制备。
[0285]
10只雌性nmri裸鼠(6周龄,janvier,le genest
‑
saint isle,france)被纳入该测定。三只小鼠以50mg/小鼠/注射的ara
‑
n3每隔一天静脉注射,持续8天(4次注射),累积剂量为200mg,另外三只小鼠以每天消耗8ml水中的50mg的ara
‑
n3来处理,持续8天,累积剂量为
400mg。作为对照组,四只荷瘤小鼠未进行处理。
[0286]
在治疗结束时对小鼠实施安乐死并解剖。获得心、肺、脑、子宫、卵巢、肾、骨骼肌、脾脏、胰腺、腹部脂肪、肝脏、皮肤、胃、结肠、盲肠、小肠、肠系膜淋巴结、腋窝淋巴结、肱淋巴结和全血并冷冻用于分析。
[0287]
结果
[0288]
在饮用水中引入ara
‑
n3(高达6.25mg/ml)并没有改变小鼠的饮水量。
[0289]
用ara
‑
n3治疗,无论是在饮用水中还是通过静脉注射,都不会引起任何体重减轻。
[0290]
表5(体外/体内)
[0291][0292]
实施例6:ara
‑
n3探针针对肿瘤细胞系(体内)的特异性标记
[0293]
材料和方法
[0294]
所有动物实验均按照欧洲经济共同体实验室动物使用制度指南(欧盟指令2010/63/eu)进行,并获得法国高等教育和研究部授权,参考apafis#8854
‑
2017031314338357。
[0295]
皮下肿瘤异种移植物
[0296]
对雌性nmri裸小鼠(6周龄,janvier,le genest
‑
saint isle,france)在侧腹皮下注射1x pbs中的8x10 6
panc
‑
1细胞。
[0297]
通过静脉注射的ara
‑
n3处理:评估了20mg ara
‑
n3的累积剂量。
[0298]
肿瘤细胞植入后10天,panc
‑
1荷瘤小鼠每隔一天用1.8mg/小鼠/注射ara
‑
n3处理21天(11次注射),累积剂量分别为20mg(n=3只小鼠每剂)。
[0299]
未处理:作为对照组,每个细胞系的三只荷瘤小鼠未处理(ctr)。
[0300]
造影剂施用
[0301]
·
dbco
‑
irdye800cw
[0302]
静脉注射处理小鼠
[0303]
‑
在最后一次处理注射(ara
‑
n3 fluo)后24小时,每种处理条件下的两只panc
‑
1荷瘤小鼠静脉注射100μg的dbco
‑
irdye800cw。
[0304]
对照小鼠
[0305]
‑
一只未经处理的panc
‑
1荷瘤小鼠静脉注射100μg的dbco
‑
irdye800cw(ctr fluo)。
[0306]
荧光成像数据分析(离体)
[0307]
在注射dbco
‑
irdye800cw后48小时对小鼠实施安乐死并解剖。对骨骼肌和肿瘤进行离体荧光成像。
[0308]
通过手动绘制在要量化的肿瘤区域上调整的感兴趣区域(roi),从荧光图像中获得半定量数据。在roi中测量的总荧光信号除以roi中的像素数。因此,数据表示为骨骼肌和肿瘤上每像素的相对荧光单位(rlu)。然后计算肿瘤和骨骼肌的荧光信号比(肿瘤/肌肉比)。
[0309]
结果如图1所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。