用于治疗肝脏疾病的ghrh或其类似物
1.相关专利申请的交叉引用
2.本技术要求2019年3月29日提交的美国临时申请第62/826,284号和2019年6月13日提交的美国临时申请第62/861,187号的权益,其通过引用并入本文。
3.关于联邦政府资助的研发的声明
4.本发明是根据由美国国立卫生研究院、国家过敏和传染病研究所授予的授权号u01 ai115711在美国政府支持下完成的。政府享有本发明的一定权利。
5.序列表
6.本技术包含一个名为“11718_360_seqlist.txt”的计算机可读形式的序列表,其创建于2020年3月25日,大小约为5kb。该计算机可读形式通过引用并入本文。
技术领域
7.本公开整体上涉及对肝脏疾病的治疗,例如非酒精性脂肪肝(nafl)、非酒精性脂肪性肝炎(nash)和肝纤维化。
背景技术:
8.nafl被定义为肝细胞中甘油三酯的过量储存(脂肪变性),其特征通常是由此产生的炎症、细胞膨胀和损伤以及纤维化。该方面的显著变化导致了nash。非酒精性脂肪性肝病(nafld)可能会发展为纤维化并最终发展为肝硬化,成为导致普通人群终末期肝病的一个越来越重要的原因,并且其也在hiv感染者中进行了研究(plwh;rockstroh jk.《当前hiv/aids报告(curr hiv/aids rep)》2017;14:47
‑
53;vodkin i等人,《营养药理学与治疗学(aliment pharmacol ther)》2015;41:368
‑
78)。nafl/nash在hiv患者中的患病率较高,而且往往比普通人群发展得更快。与许多随着hiv疾病严重程度增加而恶化的hiv相关合并症相比,nafld在cd4
t细胞计数较高且发胖的hiv患者中可能更常见,并且与中心性肥胖有关(guaraldi g等人,《临床感染性疾病(clin infect dis)》2008;47:250
‑
7;van der poorten d等人,《肝脏病学(hepatology)》2008;48:449
‑
57;maurice jb等人,《艾滋病(aids)》2017;31:1621
‑
32)。在plwh中,发胖、腹部脂肪堆积和内脏脂肪增加很常见,即使使用较新的抗逆转录病毒药物也是如此(lake je等人,《临床感染性疾病》2017;64:1422
‑
9)。尽管维生素e(sanyal aj.《新英格兰医学杂志(n engl j med)》2010;362:1675
‑
85;lavine je等人,《美国医学会杂志(jama)》2011;305:1659
‑
68;sato k等人,《营养学(nutrition)》2015;31:923
‑
30)和吡格列酮7已被证明可以用于改善普通人群中nash的组织学特征,但对于hiv感染者的nafld或nash,尚无经过验证的药物疗法。对一种产品aramchol(一种已知可降低原发性nafld患者的肝脂肪含量的口服硬脂酰辅酶a
‑
去饱和酶1抑制剂)在hiv相关的nafld患者中进行了评估,其对这一特定患者群体没有显着影响(ajmera等人,《肝脏病学》,2019年4月23日,doi:10.1002/hep.30674.[印刷前电子出版])。
[0009]
肝纤维化是由肝脏的慢性损伤以及细胞外基质(ecm)蛋白的积累引起的,这是大多数类型慢性肝脏疾病的特征。晚期肝纤维化会导致肝硬化、肝功能衰竭和门脉高压,通常
需要肝移植。目前没有有效的治疗方法能够有效地靶向与nafl/nash相关的肝纤维化。
[0010]
因此需要用于治疗特别是在hiv感染患者中的nafld、nash和/或肝纤维化的新疗法。
[0011]
本说明书参考了许多文献,这些文献的内容通过引用整体并入本文。
技术实现要素:
[0012]
本公开整体上涉及对肝脏疾病的治疗,例如非酒精性脂肪性肝病(nafld)。nafld是指与饮酒无关的脂肪肝,进一步分为伴有或不伴有纤维化的非酒精性脂肪肝(nafl)和非酒精性脂肪性肝炎(nash),在一个方面涉及生长激素(gh)促分泌素的使用,并且更具体地涉及用于治疗(包括预防和/或治疗)此类肝病或相关病症的生长激素释放激素(ghrh)或其类似物。
[0013]
在各个方面和实施例中,本公开提供以下项目:
[0014]
1.一种用于在有需要的受试者中预防或治疗非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)的方法,包括:向所述受试者施用有效量的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者具有:(i)通过质子磁共振波谱(1h mrs)(或任何其他合适的方法)所测的至少约5%或10%的肝脏脂肪分数(hff);(ii)至少约25或30u/l的血清丙氨酸转氨酶(alt)水平;(iii)由nas临床研究网络(nas crn)评分系统测得的分数至少为3、4或5的nafld活动性评分(nas);(iv)肝纤维化;或(iv)(i)至(iv)的任意组合。
[0015]
2.根据项目1所述的方法,其中所述受试者的hff至少为约5%或10%。
[0016]
3.根据项目1所述的方法,其中所述受试者的hff至少为约15%。
[0017]
4.根据项目1所述的方法,其中所述受试者的hff至少为约20%。
[0018]
5.根据项目1至4中任一项所述的方法,其中所述受试者的血清alt水平至少为约25或30u/l。
[0019]
6.根据项目1至4中任一项所述的方法,其中所述受试者的血清alt水平至少为约35u/l。
[0020]
7.根据项目1至6中任一项所述的方法,其中所述受试者的nas至少为6。
[0021]
8.根据项目7所述的方法,其中所述受试者的nas至少为7。
[0022]
9.根据项目1至8中任一项所述的方法,其中所述受试者患有肝纤维化,例如1a期肝纤维化或更严重的肝纤维化,优选1c期或2期肝纤维化或更严重的肝纤维化。
[0023]
10.根据项目1至9中任一项所述的方法,其中所述受试者患有人类免疫缺陷病毒(hiv)感染。
[0024]
11.根据项目1至10中任一项所述的方法,其中所述受试者的体质指数(bmi)至少为约25。
[0025]
12.根据项目11所述的方法,其中所述受试者的bmi至少为约30。
[0026]
13.根据项目1至12中任一项所述的方法,其中所述方法包括向所述受试者施用有效量的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0027]
14.根据项目13所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0028]
15.根据项目1至14中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0029]
16.根据项目15所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0030]
17.根据项目1至16中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮下注射施用。
[0031]
18.根据项目1至17中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0032]
19.根据项目18所述的方法,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0033]
20.根据项目18所述的方法,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0034]
21.用于预防或治疗受试者中非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者具有:(i)通过质子磁共振波谱(1h mrs)所测的至少约5%或10%的肝脏脂肪分数(hff);(ii)至少约25或30u/l的血清丙氨酸转氨酶(alt)水平;(iii)由nas临床研究网络(nas crn)评分系统测得的分数至少为5的nafld活动性评分(nas);或(iv)(i)至(iii)的任意组合。
[0035]
22.根据项目21所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的hff至少为约5%或10%。
[0036]
23.根据项目21所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的hff至少为约15%。
[0037]
24.根据项目21所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的hff至少为约20%。
[0038]
25.根据项目21至24中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的血清alt水平至少为约25或30u/l。
[0039]
26.根据项目21至24中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的血清alt水平至少为约35u/l。
[0040]
27.根据项目21至26中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的nas至少为6。
[0041]
28.根据项目27所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的nas至少为7。
[0042]
29.根据项目21至28中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者患有肝纤维化,例如1a期肝纤维化或更严重的肝纤维化,优选1c期或2期肝纤维化或更严重的肝纤维化。
[0043]
30.根据项目21至29中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者患有人类免疫缺陷(hiv)感染。
[0044]
31.根据项目21至31中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的体质指数(bmi)至少为约25。
[0045]
32.根据项目31所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的bmi至少为约30。
[0046]
33.根据项目21至33中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中使用反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0047]
34.根据项目33所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0048]
35.根据项目21至34中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0049]
36.根据项目37所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0050]
37.根据项目21至36中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮下注射施用。
[0051]
38.根据项目21至37中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0052]
39.根据项目38所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0053]
40.根据项目38所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0054]
41.一种用于在受试者中(i)预防或减缓肝纤维化的发展或进展或(ii)减少肝纤维化的方法,包括:向所述受试者施用有效量的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐。
[0055]
42.根据项目41所述的方法,其中所述受试者在治疗前具有分数至少为1c的纤维化评分。
[0056]
43.根据项目41所述的方法,其中所述受试者在治疗前具有分数至少为2的纤维化评分。
[0057]
44.根据项目41至43中任一项所述的方法,其中所述受试者的hff至少为约10%。
[0058]
45.根据项目44所述的方法,其中所述受试者的hff至少为约15%。
[0059]
46.根据项目45所述的方法,其中所述受试者的hff至少为约20%。
[0060]
47.根据项目41至46中任一项所述的方法,其中所述受试者的血清alt水平至少为约30u/l。
[0061]
48.根据项目41至46中任一项所述的方法,其中所述受试者的血清alt水平至少为约35u/l。
[0062]
49.根据项目41至48中任一项所述的方法,其中所述受试者通过nas临床研究网络(nas crn)评分系统所测的nafld活动性评分(nas)至少为2。
[0063]
50.根据项目49所述的方法,其中所述受试者的nas至少为3。
[0064]
51.根据项目41至50中任一项所述的方法,其中所述受试者患有人类免疫缺陷病毒(hiv)感染。
[0065]
52.根据项目41至51中任一项所述的方法,其中所述受试者的体质指数(bmi)至少为约25。
[0066]
53.根据项目52所述的方法,其中所述受试者的bmi至少为约30。
[0067]
54.根据项目41至53中任一项所述的方法,其中所述方法包括向所述受试者施用有效量的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0068]
55.根据项目54所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0069]
56.根据项目41至55中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0070]
57.根据项目56所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0071]
58.根据项目41至57中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮下注射施用。
[0072]
59.根据项目41至58中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0073]
60.根据项目59所述的方法,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0074]
61.根据项目59所述的方法,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0075]
62.反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其用于在受试者中(i)预防或减缓肝纤维化的发展或进展或(ii)减少肝纤维化。
[0076]
63.根据项目62所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者在治疗前具有分数至少为1c的纤维化评分。
[0077]
64.根据项目62所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者在治疗前具有分数至少为2的纤维化评分。
[0078]
65.根据项目62至64中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的hff至少为约10%。
[0079]
66.根据项目65所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的hff至少为约15%。
[0080]
67.根据项目65所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的hff至少为约20%。
[0081]
68.根据项目62至67中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的血清alt水平至少为约30u/l。
[0082]
69.根据项目62至67中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的血清alt水平至少为约35u/l。
[0083]
70.根据项目62至69中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者通过nas临床研究网络(nas crn)评分系统所测的nafld活
动性评分(nas)至少为2。
[0084]
71.根据项目70所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的nas至少为3。
[0085]
72.根据项目62至71中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者患有人类免疫缺陷(hiv)感染。
[0086]
73.根据项目62至72中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的体质指数(bmi)至少为约25。
[0087]
74.根据项目73所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者的bmi至少为约30。
[0088]
75.根据项目62至74中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中使用反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0089]
76.根据项目75所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0090]
77.根据项目62至76中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0091]
78.根据项目77所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0092]
79.根据项目62至78中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮下注射施用。
[0093]
80.根据项目62至79中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0094]
81.根据项目80所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0095]
82.根据项目80所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0096]
83.根据项目1至20和项目41至61中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为3、6或9个月。
[0097]
84.根据项目83所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为12个月。
[0098]
85.根据项目21至40和项目62至82中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为3、6或9个月。
[0099]
86.根据项目85所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的
盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为12个月。
[0100]
87.一种用于降低患有非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)的受试者患肝癌风险的方法,包括:向所述受试者施用有效量的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐。
[0101]
88.根据项目87所述的方法,其中所述方法包括向所述受试者施用有效量的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0102]
89.根据项目88所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0103]
90.根据项目87至89中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0104]
91.根据项目90所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0105]
92.根据项目87至91中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮下注射施用。
[0106]
93.根据项目87至92中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0107]
94.根据项目93所述的方法,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0108]
95.根据项目93所述的方法,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0109]
96.根据项目87至95中任一项所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为3、6或9个月。
[0110]
97.根据项目96所述的方法,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为12个月。
[0111]
98.反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其用于降低患有非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)的受试者患肝癌的风险。
[0112]
99.根据项目98所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中使用反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0113]
100.根据项目99所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0114]
101.根据项目98至100中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0115]
102.根据项目101所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0116]
103.根据项目98至102中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮
下注射施用。
[0117]
104.根据项目98至103中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0118]
105.根据项目104所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0119]
106.根据项目105所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0120]
107.根据项目98至106中任一项所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为3、6或9个月。
[0121]
108.根据项目107所使用的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为12个月。
[0122]
109.反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在制备用于预防或治疗受试者的非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)的药物中的用途,其中所述受试者具有:(i)通过质子磁共振波谱(1h mrs)所测的至少约5%或10%的肝脏脂肪分数(hff);(ii)至少约25或30u/l的血清丙氨酸转氨酶(alt)水平;(iii)由nas临床研究网络(nas crn)评分系统测得的分数至少为5的nafld活动性评分(nas);或(iv)(i)至(iii)的任意组合。
[0123]
110.反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在预防或治疗受试者的非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)中的用途,其中所述受试者具有:(i)通过质子磁共振波谱(1h mrs)所测的至少约5%或10%的肝脏脂肪分数(hff);(ii)至少约25或30u/l的血清丙氨酸转氨酶(alt)水平;(iii)由nas临床研究网络(nas crn)评分系统测得的分数至少为5的nafld活动性评分(nas);或(iv)(i)至(iii)的任意组合。
[0124]
111.根据项目109或110所述的用途,其中所述受试者的hff至少为约5%或10%。
[0125]
112.根据项目109或110所述的用途,其中所述受试者的hff至少为约15%。
[0126]
113.根据项目109或110所述的用途,其中所述受试者的hff至少为约20%。
[0127]
114.根据项目109至113中任一项所述的用途,其中所述受试者的血清alt水平至少为约25或30u/l。
[0128]
115.根据项目109至114中任一项所述的用途,其中所述受试者的血清alt水平至少为约35u/l。
[0129]
116.根据项目109至115中任一项所述的用途,其中所述受试者的nas至少为6。
[0130]
117.根据项目116所述的用途,其中所述受试者的nas至少为7。
[0131]
118.根据项目109至117中任一项所述的用途,其中所述受试者患有肝纤维化,例如1a期肝纤维化或更严重的肝纤维化,优选1c期或2期肝纤维化或更严重的肝纤维化。
[0132]
119.根据项目109至118中任一项所述的用途,其中所述受试者患有人类免疫缺陷
(hiv)感染。
[0133]
120.根据项目109至119中任一项所述的用途,其中所述受试者的体质指数(bmi)至少为约25。
[0134]
121.根据项目120所述的用途,其中所述受试者的bmi至少为约30。
[0135]
122.根据项目109至121中任一项所述的用途,其中使用反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0136]
123.根据项目122所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0137]
124.根据项目109至123中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0138]
125.根据项目124所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0139]
126.根据项目109至125中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮下注射施用。
[0140]
127.根据项目109至126中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0141]
128.根据项目127所述的用途,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0142]
129.根据项目127或128所述的用途,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0143]
130.反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐用于在受试者中(i)预防或减缓肝纤维化的发展或进展或(ii)减少肝纤维化的用途。
[0144]
131.反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在制备用于在受试者中(i)预防或减缓肝纤维化的发展或进展或(ii)减少肝纤维化的药物中的用途。
[0145]
132.根据项目130或131所述的用途,其中所述受试者在治疗前具有分数至少为1c的纤维化评分。
[0146]
133.根据项目130或131所述的用途,其中所述受试者在治疗前具有分数至少为2的纤维化评分。
[0147]
134.根据项目130至133中任一项所述的用途,其中所述受试者的hff至少为约10%。
[0148]
135.根据项目134所述的用途,其中所述受试者的hff至少为约15%。
[0149]
136.根据项目135所述的用途,其中所述受试者的hff至少为约20%。
[0150]
137.根据项目130至136中任一项所述的用途,其中所述受试者的血清alt水平至少为约30u/l。
[0151]
138.根据项目130至137中任一项所述的用途,其中所述受试者的血清alt水平至少为约35u/l。
[0152]
139.根据项目130至138中任一项所述的用途,其中所述受试者通过nas临床研究网络(nas crn)评分系统所测的nafld活动性评分(nas)至少为2。
[0153]
140.根据项目139所述的用途,其中所述受试者的nas至少为3。
[0154]
141.根据项目130至140中任一项所述的用途,其中所述受试者患有人类免疫缺陷(hiv)感染。
[0155]
142.根据项目130至141中任一项所述的用途,其中所述受试者的体质指数(bmi)至少为约25。
[0156]
143.根据项目142所述的用途,其中所述受试者的bmi至少为约30。
[0157]
144.根据项目130至143中任一项所述的用途,其中使用反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0158]
145.根据项目144所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0159]
146.根据项目130至145中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0160]
147.根据项目146所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0161]
148.根据项目130至147中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮下注射施用。
[0162]
149.根据项目130至148中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0163]
150.根据项目149所述的用途,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0164]
151.根据项目149或150所述的用途,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0165]
152.反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在降低患有非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)的受试者患肝癌的风险中的用途。
[0166]
153.反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在制备用于降低患有非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)的受试者患肝癌的风险的药物中的用途。
[0167]
154.根据项目152或153所述的用途,其中使用反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐。
[0168]
155.根据项目154所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0169]
156.根据项目152至155中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg的日剂量施用。
[0170]
157.根据项目156所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约2mg的日剂量施用。
[0171]
158.根据项目152至157中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐通过皮下注射施用。
[0172]
159.根据项目152至158中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含至少一种药学上可接受的赋形剂的药物组合物中。
[0173]
160.根据项目159所述的用途,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约10mg/ml。
[0174]
161.根据项目159或160所述的用途,其中所述药物组合物中的所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的浓度为约1mg/ml至约8mg/ml。
[0175]
162.根据项目109至161中任一项所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为3、6或9个月。
[0176]
163.根据项目162所述的用途,其中所述反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用时间至少为12个月。
[0177]
本公开的其他目的、优点和特征将在阅读以下对其特定实施例的非限制性描述后变得更加显而易见,所述特定实施例通过参考附图仅作为示例给出。
附图说明
[0178]
在附图中:
[0179]
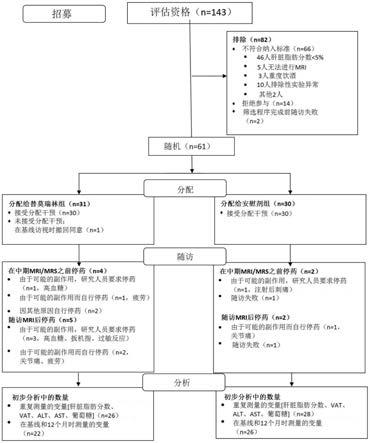
图1是示出了参与者流程和将患者排除在研究之外的原因的图示。
[0180]
图2是示出了替莫瑞林(tesamorelin)对肝脏脂肪、代谢和免疫学指标的影响的表。
[0181]
图3a和3b是描绘了基线和12个月之间绝对(图3a)和相对(图3b)肝脏脂肪含量的变化的图示,具有用于t检验进行组间变化比较的p值。
[0182]
图3c是描绘了脂肪变性的百分比分辨率的图示,定义为12个月肝脏脂肪分数<5%,具有用于皮尔逊卡方(pearson chi
‑
square)的p值。
[0183]
图3d是描绘了在基线处alt≥30u/l的丙氨酸转氨酶(alt)在基线和12个月之间的变化的图示,具有用于t检验进行组间变化比较的p值。
[0184]
图4a是描绘了在12个月时具有纤维化进展的患者百分比的图示,具有用于皮尔逊卡方的p值。
[0185]
图4b是描绘了在12个月时纤维化变化和nas评分变化之间的关系的图示,具有用于anova的p值。
[0186]
图5示出了替莫瑞林(反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2;seq id no:1)的结构。
具体实施方式
[0187]
在描述的主题的上下文中(尤其是在以下权利要求的上下文中),术语“一”、“一个”和“所述”以及类似指代物的使用应被解释为涵盖单数和复数两者,除非本文中另有说明或与上下文明显矛盾。
[0188]
除非另有说明,否则术语“包含”、“具有”、“包括”和“含有”应被解释为开放式术语(即,意味着“包括但不限于”)。
[0189]
除非本文中另有说明,否则本文中数值范围的叙述仅旨在作为单独提及落入该范围内的每个单独数值的简写方法,并且每个单独数值被并入说明书中,如同其在本文中被单独叙述一样。这些范围内的值的所有子集也被并入到说明书中,如同它们在本文中被单
独叙述一样。
[0190]
类似地,本文中具有各种取代基和针对这些取代基列举的各种基团的一般化学结构旨在作为单独提及通过任何取代基的任何基团的组合获得的每个分子的简写方法。每个单独的分子都被并入说明书中,如同其在本文中被单独叙述一样。而且,这些一般化学结构内的分子的所有子集也被并入到说明书中,如同它们在本文中被单独叙述一样。
[0191]
本文描述的所有方法都可以以任何合适的顺序执行,除非本文另有说明或者上下文明显矛盾。
[0192]
除非另有声明,否则本文提供的任何和所有示例或示例性语言(“例如”、“诸如”)的使用仅旨在更好地说明本公开而不构成对本公开范围的限制。
[0193]
在本文中,术语“大约”具有其普通含义。术语“大约”用于表示某值包括用于确定该值的装置或方法的固有误差变化,或包含接近所述值的值,例如在所述值(或值范围)的10%以内的值。
[0194]
除非另有定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同的含义。
[0195]
在本文所述的研究中,表明替莫瑞林(反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2,乙酸盐)的施用显着降低了肝脏脂肪含量和/或使肝脏脂肪含量正常化,并阻止患有伴有或不伴有纤维化的nafl/nash的hiv感染受试者的肝纤维化进展。结果提供的证据表明,在治疗前具有较高nafld活动性评分(nas)的受试者,即患有更晚期或更严重疾病的受试者中,替莫瑞林治疗的有益效果更为突出。鉴于纤维化阶段是nafld患者死亡率的最强预测因素,而且很大比例的患有nafld的hiv患者显示纤维化进展超过1年,所以本研究中示出的较高nas患者通过替莫瑞林治疗来预防肝纤维化具有临床意义。此外,与内脏脂肪相比,替莫瑞林出人意料地对减少肝脏脂肪的作用更显着。基因表达分析显示,替莫瑞林的施用与氧化磷酸化相关的基因和与肝细胞癌(hcc)良好预后相关的基因的上调以及与肝脏炎症、组织修复、细胞更新和hcc不良预后相关的基因的下调有关。
[0196]
在一个方面,本公开提供了一种用于在有需要的受试者中治疗伴有或不伴有纤维化的非酒精性脂肪肝(nafl)或非酒精性脂肪性肝炎(nash)的方法,包括:向所述受试者施用有效量的ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其中所述受试者具有:(i)至少为5%、6%、7%、8%、9%或10%的肝脏脂肪分数(hff)(例如通过质子磁共振波谱(1h mrs)所测);(ii)至少为25、26、27、28、29或30u/l的血清丙氨酸转氨酶(alt)水平;(iii)由nas临床研究网络(nas crn)评分系统测得的分数为至少1、2、3、4或5,优选为至少3、4或5的nas;(iv)肝纤维化,例如1a、1b、1c、2、3期肝纤维化或更严重的纤维化;或(v)(i)至(iv)的任意组合。
[0197]
在另一方面,本公开提供了一种用于治疗肝脏脂肪分数(hff)至少为约5%或10%(例如通过质子磁共振波谱(1h mrs)所测)的受试者的nafl或nash的方法,所述方法包括:向所述受试者施用有效量的ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在治疗hff至少为约5%或10%(例如通过1h mrs所测)的受试者的nafl或nash中的用途。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在制备
用于治疗hff至少为约5%或10%(例如通过1h mrs所测)的受试者的nafl或nash的药物中的用途。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,在治疗hff至少为约5%或10%(例如通过质子磁共振波谱(1h mrs)所测)的受试者的nafl或nash中的用途。
[0198]
在另一方面,本公开提供了一种用于治疗血清alt水平至少为约25或30u/l的受试者的nafl或nash的方法,所述方法包括:向所述受试者施用有效量的ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在治疗血清alt水平至少为约25或30u/l的受试者的nafl或nash中的用途。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在制备用于治疗血清alt水平至少为约25或30u/l的受试者的nafl或nash的药物中的用途。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其用于治疗血清alt水平至少为约25或30u/l的受试者的nafl或nash。
[0199]
在另一方面,本公开提供了一种用于在患有伴有或不伴有纤维化的nafl或nash的受试者中(i)预防或减缓肝纤维化的发展或进展或(ii)减少肝纤维化的方法,所述方法包括:向所述受试者施用有效量的ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐用于在患有伴有或不伴有纤维化的nafl或nash的受试者中(i)预防或减缓肝纤维化的发展或进展或(ii)减少肝纤维化的用途。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在制备用于在患有伴有或不伴有纤维化的nafl或nash的受试者中(i)预防或减缓肝纤维化的发展或进展或(ii)减少肝纤维化的药物中的用途。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其用于在患有伴有或不伴有纤维化的nafl或nash的受试者中(i)预防或减缓肝纤维化的发展或进展或(ii)减少肝纤维化。
[0200]
在另一方面,本公开提供了一种用于维持或降低患有nafl或nash并且通过nas crn评分系统测得的nas至少为1、2、3、4或5,优选至少3、4或5的受试者的nas的方法,所述方法包括:向所述受试者施用有效量的ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在维持或降低患有nafl或nash并且通过nas crn评分系统测得的nas至少为1、2、3、4或5,优选至少3、4或5的受试者的nas中的用途。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在制备用于维持或降低患有nafl或nash并且通过nas crn评分系统测得的nas至少为1、2、3、4或5,优选至少3、4或5的受试者的nas的药物中的用途。本公开还提供了ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其用于维持或降低患有伴有或不伴有纤维化的nafl或nash并且通过nas crn评分系统测得的nas至少为1、2、3、4或5,优选至少3、4或5的受试者的nas的用途。
[0201]
在另一方面,本公开提供了一种用于降低患有nafl或nash的受试者患肝癌的风险或可能性的方法,所述方法包括:向所述受试者施用有效量的反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐。本公开还提供了反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐,其用于降低患有nafl或nash的受试者患肝癌的风险或可能性。本公开还提供了反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐在降低患有nafl或nash的受试者发生肝癌的风险或可能性中的用途,或在制备用于降低患有nafl或nash的受试者患肝癌的风险或可能性的药物中的用途。在一个实施例中,肝癌是肝细胞癌(hcc)。
[0202]
在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约5%、6%、7%、8%、9%或10%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约11%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约12%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约13%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约14%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约15%。在一个实施例中,上述受试者例如通过1hmrs所测的hff为至少约16%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约17%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约18%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约19%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约20%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约21%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约22%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约23%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约24%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约25%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约30%。在一个实施例中,上述受试者例如通过1h mrs所测的hff为至少约35%。
[0203]
在一个实施例中,上述方法或用途包括鉴定例如通过1h mrs所测的hff为至少约10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、30%或35%的受试者。
[0204]
在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用没有导致hff的显着变化(即稳定化或正常化)或降低。
[0205]
在另一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少约35%(相对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少约40%(相对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少约45%(相对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少约50%(相对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少两倍。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少三倍。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少四倍。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少五倍。
[0206]
在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少4%或5%(绝对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少6%(绝对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少7%(绝对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少8%(绝对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少9%(绝对降低)。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使hff降低至少10%(绝对降低)。
[0207]
在一个实施例中,上述受试者通过nas crn评分系统所测的nas至少为1。在一个实施例中,上述受试者通过nas crn评分系统所测的nas至少为2。在一个实施例中,上述受试者通过nas crn评分系统所测的nas至少为3。在一个实施例中,上述受试者通过nas crn评分系统所测的nas至少为4。在一个实施例中,上述受试者通过nas crn评分系统所测的nas至少为5。在一个实施例中,上述受试者例如通过nas crn评分系统所测的nas至少为6。在一个实施例中,上述受试者例如通过nas crn评分系统所测的nas至少为7。在一个实施例中,上述受试者例如通过nas crn评分系统所测的nas为8。根据nas crn评分系统计算的nas包括脂肪变性(0
‑
3级)、肝细胞膨胀(0
‑
2级)和小叶炎症(0
‑
3级)的等级总和(kleiner de等人,《肝脏病学》2005;41:1313
‑
21)。在一个实施例中,通过治疗降低了脂肪变性评分。在一个实施例中,通过治疗降低了肝细胞膨胀评分。在一个实施例中,通过治疗降低了小叶炎症评分。在一个实施例中,通过治疗降低了脂肪变性评分、肝细胞膨胀评分和小叶炎症评分中的至少两者。
[0208]
在一个实施例中,上述方法或用途包括鉴定通过nas crn评分系统所测的nas为至少1、2、3、4、5、6、7或8的受试者。
[0209]
在另一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用没有导致nas随时间的显着变化(即稳定化或正常化)或降低。在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用导致nas分数的降低。在一个实施例中,nas分数降低了至少0.2。在另一个实施例中,nas分数降低了至少0.3。在另一个实施例中,nas分数降低了至少0.4。在另一个实施例中,nas分数降低了至少0.5。在另一个实施例中,nas分数降低了至少0.6。在另一个实施例中,nas分数降低了至少0.7。在另一个实施例中,nas分数降低了至少0.8。在另一个实施例中,nas分数降低了至少0.9。在另一个实施例中,nas分数降低了至少1.0。在另一个实施例中,nas分数降低了至少2.0。
[0210]
在一个实施例中,上述受试者的血清alt水平至少为约30u/l。在一个实施例中,上述受试者的血清alt水平至少为约35u/l。在另一个实施例中,ghrh分子或其药学上可接受
的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用使受试者的血清alt水平降低至少约10%、15%、20%、25%或30%。
[0211]
在一个实施例中,上述方法或用途包括鉴定血清alt水平至少为约25u/l、30u/l或35u/l的受试者。
[0212]
在另一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用降低了受试者的血清c反应蛋白(crp)水平。
[0213]
在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用降低了受试者的肝脏中的炎症和/或氧化应激(例如,活性氧(ros)物质的水平)。在一个实施例中,炎症的减少包括炎症通路(例如,tnf
‑
α、il
‑
6和/或il
‑
2通路)或炎症相关基因的活性的减少。
[0214]
在一个实施例中,ghrh分子或其药学上可接受的盐,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐的施用减少了肝脏中的组织修复,例如减少了参与组织修复、细胞凋亡和/或上皮间质转化(emt)的基因(例如tgf
‑
β通路的基因)的表达。
[0215]
在一个实施例中,受试者患有人类免疫缺陷病毒(hiv)感染。在一个实施例中,受试者正在接受抗逆转录病毒疗法。
[0216]
在一个实施例中,本文所述的治疗或用途对受试者的低密度脂蛋白胆固醇(ldl
‑
c)、高密度脂蛋白胆固醇(hdl
‑
c)或甘油三酯没有或基本上没有影响。在一个实施例中,本文所述的治疗或用途对受试者的空腹血糖或血红蛋白a1c没有影响或基本上没有影响。
[0217]
在一个实施例中,受试者的体质指数(bmi)至少为约25。在一个实施例中,受试者的bmi至少为约26。在一个实施例中,受试者的bmi至少为约27。在一个实施例中,受试者的bmi至少为约28。在一个实施例中,受试者的bmi至少为约29。在一个实施例中,受试者的bmi至少为约30。在一个实施例中,受试者的bmi至少为约31。在一个实施例中,受试者的bmi至少为约32。
[0218]
在一个实施例中,上述受试者患有肝纤维化。在一个实施例中,上述方法或用途包括鉴定患有肝纤维化的受试者。在一个实施例中,上述受试者患有1期(在另一个实施例,患有1a、1b或1c期)肝纤维化。在一个实施例中,上述受试者患有2期肝纤维化。在一个实施例中,上述受试者患有3期肝纤维化。使用nash临床研究网络病理学委员会设计的评分系统来确定纤维化阶段(kleiner de等人,《肝脏病学》2005;41:1313
‑
21):
[0219]
0期=无纤维化;
[0220]
1期=窦周或门静脉周纤维化;
[0221]
1a期:轻度纤维化,3区,窦周;
[0222]
1b期:中度纤维化,3区,窦周;
[0223]
1c期:仅限门静脉/门静脉周纤维化;
[0224]
2期=窦周和门静脉/门静脉周纤维化;
[0225]
3期=桥接纤维化;
[0226]
4期=肝硬化。
[0227]
在一个实施例中,上述受试者具有以下特征(1)至(3)中的至少两个特征:(1)hff至少为15%,优选至少为20%、25%或30%;(2)nas分数至少为3,最好至少为4、5或6;以及(3)肝纤维化,优选1c或2期肝纤维化或更严重的肝纤维化。在一个实施例中,上述受试者具
有上述特征(1)至(3)。在一个实施例中,上述方法或用途包括鉴别具有至少两个或所有上述特征(1)至(3)的受试者。
[0228]
如本文所用,关于预防肝纤维化的进展是指在用ghrh分子治疗后相对于未进行此类治疗时没有或基本上没有肝纤维化进展。如本文所用,关于减缓肝纤维化的进展是指以下情况:用ghrh分子治疗后,肝纤维化的进展可能会继续,但与未进行此类治疗的情况相比,进展速度会降低。
[0229]
在一个实施例中,本文所述的治疗或用途降低了受试者发展成肝癌例如肝细胞癌(hcc)的风险或可能性。
[0230]
在本公开的上下文中使用的术语“ghrh分子”包括但不限于:人天然ghrh
(1
‑
44)
及其片段(例如,ghrh
(1
‑
40)
、ghrh
(1
‑
29)
、1
‑
29和1
‑
44序列之间的片段),以及任何其他片段;来自其他物种的ghrh及其片段;含有氨基酸取代、添加和/或缺失的ghrh变体;ghrh的衍生物或类似物或其片段或变体,其具有例如在n末端、c末端或侧链上与ghrh氨基酸序列偶联的有机基团或部分;和ghrh(人或来自其他物种)的药学上可接受的盐,以及ghrh片段、变体、类似物和衍生物的药学上可接受的盐。本公开的ghrh分子还包括本领域目前已知的ghrh分子,包括但不限于:与白蛋白结合的ghrh(美国专利第7,268,113号);聚乙二醇化的ghrh肽(美国专利第7,256,258号和第6,528,485号);猪ghrh(1
‑
40)(美国专利第6,551,996号);犬ghrh(美国专利申请第2005/0064554号);1
‑
29至1
‑
44个氨基酸长度的ghrh变体(美国专利第5,846,936号、第5,696,089号、第5,756,458号和第5,416,073号,以及美国专利申请第2006/0128615号和第2004/0192593号);和pro0‑
ghrh肽及其变体(美国专利第5,137,872号)。
[0231]
ghrh类似物包括美国专利第5,681,379号和第5,939,386号中描述的那些,其中也描述了它们的合成方法。更具体地说,这些ghrh类似物由下式a定义:
[0232]
x
‑
ghrh肽
ꢀꢀ
(a)
[0233]
其中ghrh肽是下式b中的肽(seq id no:2):
[0234]
a1
‑
a2
‑
asp
‑
ala
‑
ile
‑
phe
‑
thr
‑
a8
‑
ser
‑
tyr
‑
arg
‑
lys
‑
a13
‑
leu
‑
a15
‑
gln
‑
leu
‑
a18
‑
ala
‑
arg
‑
lys
‑
leu
‑
leu
‑
a24
‑
a25
‑
ile
‑
a27
‑
a28
‑
arg
‑
a30
‑
a31
‑
a32
‑
a33
‑
a34
‑
a35
‑
a36
‑
a37
‑
a38
‑
a39
‑
a40
‑
a41
‑
a42
‑
a43
‑
a44
‑
r0
ꢀꢀ
(b)
[0235]
其中,
[0236]
a1是tyr或his;
[0237]
a2是val或ala;
[0238]
a8是asn或ser;
[0239]
a13是val或ile;
[0240]
a15是ala或gly;
[0241]
a18是ser或tyr;
[0242]
a24是gln或his;
[0243]
a25是asp或glu;
[0244]
a27是met、ile或nle
[0245]
a28是ser或asn;
[0246]
a30不存在或为任何氨基酸,优选gln;
[0247]
a31不存在或为任何氨基酸,优选gln;
[0248]
a32不存在或为任何氨基酸,优选gly;
[0249]
a33不存在或为任何氨基酸,优选glu;
[0250]
a34不存在或为任何氨基酸,优选ser;
[0251]
a35不存在或为任何氨基酸,优选asn;
[0252]
a36不存在或为任何氨基酸,优选gln;
[0253]
a37不存在或为任何氨基酸,优选glu;
[0254]
a38不存在或为任何氨基酸,优选arg;
[0255]
a39不存在或为任何氨基酸,优选gly;
[0256]
a40不存在或为任何氨基酸,优选ala;
[0257]
a41不存在或为任何氨基酸,优选arg;
[0258]
a42不存在或为任何氨基酸,优选ala;
[0259]
a43不存在或为任何氨基酸,优选arg;
[0260]
a44不存在或为任何氨基酸,优选leu;并且
[0261]
r0为nh2或nh
‑
(ch2)n
‑
conh2,n=1至12。
[0262]
x基团是一个疏水尾,其通过酰胺键锚定在肽的n末端,疏水尾定义了5到7个原子的主链。该主链可以被c1‑6烷基、c3‑6环烷基或c6‑
12
芳基取代,并且主链包含至少一个与该主链的至少两个原子连接的刚性部分。所述刚性部分是双键、三键、饱和或不饱和c3‑9环烷基或c6‑
12
芳基。
[0263]
在一个实施例中,x基团是:
[0264]
[0265][0266]
在一个实施例中,在式b中,a30
‑
a44是:(a)缺失;(b)对应于天然ghrh肽(seq id no:3)的30
‑
44位的氨基酸序列;或(c)从其末c端缺失1
‑
14个氨基酸的(b)中的氨基酸序列。
[0267]
在一个实施例中,ghrh肽是包含seq id no:4的氨基酸序列的多肽。
[0268]
在一个实施例中,ghrh分子是(己烯酰基反式
‑
3)hghrh
(1
‑
44)
nh2(seq id no:1)或其药学上可接受的盐。[反式
‑3‑
己烯酰基]hghrh
(1
‑
44)
酰胺(也称为替莫瑞林和(己烯酰基反式
‑
3)hghrh
(1
‑
44)
nh2)是一种合成的人ghrh(hghrh)类似物,其包含hghrh的44氨基酸序列,在该序列上,己烯酰基部分(c6侧链)已锚定在氨基末端酪氨酸残基上。[反式
‑3‑
己烯酰基]hghrh
(1
‑
44)
酰胺的结构如图5所示。
[0269]
术语“药学上可接受的盐”是指ghrh分子(例如反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2)的盐,其在药理学上是可接受的并且对施用其的受试者基本上无毒。更具体地说,这些盐保留了ghrh分子(例如反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2)的生物学有效性和特性,并且由合适的无毒有机或无机酸或碱形成。
[0270]
例如,这些盐包括ghrh分子(例如反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2)酸加成盐,其碱性足以形成此类盐。此类酸加成盐包括乙酸盐、己二酸盐、藻酸盐、低级链烷磺酸盐(如甲磺酸盐、三氟甲磺酸盐或乙磺酸盐)、芳基磺酸盐(如苯磺酸盐、2
‑
萘磺酸盐或甲苯磺酸盐(也称为甲苯磺酸酯))、抗坏血酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、硼酸盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、肉桂酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、甘油磺酸盐、半硫酸盐、庚酸盐、己酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、硫酸氢盐、2
‑
羟基乙磺酸盐、衣康酸盐、乳酸盐、马来酸盐、扁桃酸盐、
甲磺酸盐、烟酸盐、硝酸盐、草酸盐、双羟萘酸盐、果胶酸盐、高氯酸盐、过硫酸盐、3
‑
苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、水杨酸盐、琥珀酸盐、硫酸盐、磺酸盐、酒石酸盐、硫氰酸盐、十一烷酸盐等。
[0271]
此外,例如,p.stahl等人讨论了通常被认为适用于由碱性药物化合物形成药学上有用的盐的酸(camille g.(编辑)《药用盐手册,属性、选择和使用(handbook of pharmaceutical salts.properties,selection and use)》(2002)苏黎世:wiley
‑
vch;s.berge等人,《药物科学杂志(journal of pharmaceutical sciences)》(1977)66(1)1
‑
19;p.gould,《国际药剂学杂志(international j.of pharmaceutics)》(1986)33 201
–
217;anderson等人,《药物化学实践(the practice of medicinal chemistry)》(1996),美国学术出版社,纽约;和《橙皮书(the orange book)》(食品和药物管理局,华盛顿特区,参见其网站)。
[0272]
本领域技术人员使用标准技术可以很容易地形成此类盐。事实上,将药物化合物(即药物)化学改性成盐是药物化学家众所周知的技术(参见,例如,h.ansel等人,《药物剂型和给药系统(pharmaceutical dosage forms and drug delivery systems)》(第6版,1995),第196页和第1456
‑
1457页)。反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的盐可以例如通过使反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2与一定量(例如等量)的酸或碱在诸如其中有盐沉淀的介质中或在水介质中反应然后冻干来形成。
[0273]
在一个实施例中,ghrh分子,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2的药学上可接受的盐是乙酸盐。
[0274]
在一个实施例中,ghrh分子,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg/ml至约10mg/ml的剂量存在于药物组合物中。在另一个实施例中,ghrh分子,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg/ml至10mg/ml,优选约1mg/ml至约8mg/ml或约4mg/ml至约8mg/ml,例如约1mg/ml、约2mg/ml、约3mg/ml、约4mg/ml、约5mg/ml、约6mg/ml、约7mg/ml或约8mg/ml的剂量存在于药物组合物中。
[0275]
在一个实施例中,ghrh分子,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐存在于包含一种或多种药学上可接受的赋形剂的药物组合物中。
[0276]
如本文所用,术语“药学上可接受的赋形剂”具有其在本领域中的通常含义并且是指其本身为非活性成分(药物)的任何成分。赋形剂包括例如粘合剂、润滑剂、稀释剂、膨松剂(填充剂)、增稠剂、崩解剂、增塑剂、包衣、阻隔层制剂、润滑剂、稳定剂、缓释剂和其他组分。如本文所用,“药学上可接受的赋形剂”是指不干扰活性成分的生物活性的有效性并且对受试者无毒的任何赋形剂,即,是一类赋形剂和/或以对受试者无毒的量使用。赋形剂是本领域公知的,并且本组合物在这些方面不受限制。在某些实施例中,药物组合物包含一种或多种赋形剂,包括例如但不限于:一种或多种粘合剂(粘结剂)、增稠剂、表面活性剂、稀释剂、缓释剂、着色剂、调味剂、填充剂、崩解剂/溶解促进剂、润滑剂、增塑剂、二氧化硅流动调节剂、助流剂、抗结块剂、抗粘剂、稳定剂、抗静电剂、溶胀剂及其任意组合。本领域技术人员会认识到,单一赋形剂可以同时完成两种以上的功能,例如,可以同时充当粘结剂和增稠剂。技术人员也将认识到,这些术语不一定是相互排斥的。利用本领域已知的标准方法通过将具有所需纯度的活性成分与一种或多种任选的药学上可接受的载体、赋形剂和/或稳定剂混合来制备治疗制剂。赋形剂可以适用于例如静脉内、肠胃外、皮下、肌肉内、颅内、眶内、
眼动脉、心室内、囊内、脊柱内、鞘内、硬膜外、脑池内、腹膜内、鼻内或肺部(例如气雾剂形式)给药(参见,remington:《药学科学与实践(the science and practice of pharmacy)》,由loyd v allen,jr编写,2012年第22版,英国医药出版社;《药用辅料手册(handbook of pharmaceutical excipients)》,由rowe等人编写,2012年第7版,英国医药出版社)。在一个实施例中,药物组合物是可注射组合物。在一个实施例中,药物组合物包含一种或多种用于皮下给药/注射的赋形剂。
[0277]
在一个实施例中,药物组合物包含膨松剂。如本文所用,术语“膨松剂”是指用于提供由冻干制剂重构产生的溶液的足够或所需张度的化合物。优选地,溶液的足够或所需张度等于或接近于施用该溶液的受试者的生理流体的等张度。例如,一种或多种糖可用作膨松剂。如本文所用,糖包括但不限于单糖、寡糖和多糖。合适的糖的实例包括但不限于甘露糖、山梨糖、木糖、麦芽糖、乳糖、蔗糖和葡聚糖。糖还包括糖醇,例如甘露醇、肌醇、半乳糖醇、木糖醇和阿拉伯糖醇。根据本公开也可以使用糖的混合物。在一个实施例中,膨松剂是甘露醇。例如,一种或多种氨基酸,例如甘氨酸,可以用作膨松剂。膨松剂在药物组合物中的浓度为约1%至约10%(w/w)或约2%至约8%(w/w)。在一个实施例中,膨松剂在药物组合物中的浓度为约3%至约5%(w/w)。在另一个实施例中,膨松剂在药物组合物中的浓度为约4%(w/w)。
[0278]
在一个实施例中,本公开的药物组合物还可包含表面活性剂。表面活性剂的典型实例包括:山梨糖醇脂肪酸酯,诸如山梨糖醇单辛酸酯、山梨糖醇单月桂酸酯、山梨糖醇单棕榈酸酯;甘油脂肪酸酯,诸如单辛酸甘油酯、单肉豆蔻酸甘油酯、单硬脂酸甘油酯;聚甘油脂肪酸酯,诸如单硬脂酸十甘油酯、二硬脂酸十甘油酯、单亚油酸十甘油酯;聚氧乙烯山梨糖醇酐脂肪酸酯,诸如聚氧乙烯山梨糖醇酐单月桂酸酯、聚氧乙烯山梨糖醇酐单油酸酯、聚氧乙烯山梨糖醇酐单硬脂酸酯、聚氧乙烯山梨糖醇酐单棕榈酸酯、聚氧乙烯山梨糖醇酐三油酸酯、聚氧乙烯山梨糖醇酐三硬脂酸酯;聚氧乙烯山梨糖醇脂肪酸酯,诸如聚氧乙烯山梨糖醇四硬脂酸酯、聚氧乙烯山梨糖醇四油酸酯;聚氧乙烯甘油脂肪酸酯,诸如聚氧乙烯甘油单硬脂酸酯;聚乙二醇脂肪酸酯,诸如聚乙二醇二硬脂酸酯;聚氧乙烯烷基醚,诸如聚氧乙烯月桂基醚;聚氧乙烯聚氧丙烯烷基醚,诸如聚氧乙烯聚氧丙烯乙二醇醚、聚氧乙烯聚氧丙烯丙醚、聚氧乙烯聚氧丙烯十六烷基醚;聚氧乙烯烷基苯基醚,诸如聚氧乙烯壬基苯基醚;聚氧乙烯硬化蓖麻油,诸如聚氧乙烯蓖麻油、聚氧乙烯硬化蓖麻油(聚氧乙烯氢化蓖麻油);聚氧乙烯蜂蜡衍生物,诸如聚氧乙烯山梨糖醇蜂蜡;聚氧乙烯羊毛脂衍生物,诸如聚氧乙烯羊毛脂;聚氧乙烯脂肪酸酰胺,诸如聚氧乙烯硬脂酸酰胺;具有c
10
‑
18
烷基的烷基硫酸盐,诸如十六烷基硫酸钠、十二烷基硫酸钠、油烯基硫酸钠;具有平均eo摩尔数为2
‑
4和c
10
‑
18
烷基的聚氧乙烯烷基醚硫酸盐,诸如聚氧乙烯十二烷基硫酸钠;具有c8‑
18
烷基的烷基磺基琥珀酸酯盐,诸如月桂基磺基琥珀酸钠;卵磷脂;甘油磷脂;磷酸鞘酯,诸如鞘磷脂;c
12
‑
18
脂肪酸的蔗糖脂肪酸酯。
[0279]
在一个实施例中,表面活性剂是非离子表面活性剂。在另一个实施例中,表面活性剂是聚氧乙烯山梨糖醇酐烷基酯。在又一个实施例中,表面活性剂是聚山梨酯
‑
20(t20或吐温20
tm
)。
[0280]
在一个实施例中,本公开的药物组合物还可包含一种或多种稳定剂。如本文所用,术语“稳定剂”旨在表示一种用于使治疗剂稳定化以防止会降低该治疗剂的治疗活性的物
理、化学或生物化学过程的化合物。合适的稳定剂是非还原糖,包括例如但不限于:蔗糖(或甘蔗糖)和海藻糖;和非还原性多元醇,包括例如但不限于:山梨糖醇、甘露糖醇、麦芽糖醇、木糖醇、甘醇、甘油和乙二醇。在一个实施例中,药物组合物包含约2%至约10%(w/v)的甘露醇。在另一个实施例中,药物组合物包含约2%至约8%(w/v)、约3%至约7%(w/v)、约4%至约6%(w/v)或约5%(w/v)的甘露醇。
[0281]
在一个实施例中,本公开的药物组合物包含非还原糖。如本文所用,“非还原糖”是指不含半缩醛的糖,例如特征在于在糖单元的还原端之间形成糖苷键,而不是在一个糖单元的还原端和另一个糖单元的非还原端之间形成糖苷键的碳水化合物或糖。在另一个实施例中,上述非还原糖为海藻糖或蔗糖。在另一个实施例中,上述非还原糖为蔗糖。在一个实施例中,非还原糖在本公开的药物组合物中的浓度为约0.1%至约5%(w/w)。在一个实施例中,非还原糖的浓度为约1%至约3%(w/w)。在另一个实施例中,非还原糖的浓度为约2%(w/w)。
[0282]
在一个实施例中,本公开的药物组合物包含缓冲剂,即保持药物组合物的ph值接近选定值的试剂。缓冲剂的实例包括乙酸盐缓冲液、琥珀酸盐缓冲液、柠檬酸盐缓冲液、磷酸盐缓冲液和组氨酸缓冲液。在一个实施例中,缓冲剂是组氨酸缓冲液。在一个实施例中,药物组合物中组氨酸的浓度为约0.01%至约1%,例如约0.05%至约0.5%或约0.1%至约0.3%。在另一个实施例中,组氨酸糖的浓度为约0.15%。
[0283]
在另一个实施例中,本公开的药物组合物中表面活性剂的量为约0.0001%至约10%(w/w)。在另一个实施例中,本公开的药物组合物中表面活性剂的量为约0.001%至约5%、1%或0.1%(w/w)或约0.005%至约0.05%。在又一个实施例中,本公开的药物组合物中表面活性剂的量为约0.01%(w/w)。
[0284]
在一个实施例中,本公开的药物组合物包含寡糖,例如环状寡糖,如环糊精。如本文所用,术语“环糊精”是指环状寡糖家族,其包含通过α
‑
1,4糖苷键连接的吡喃葡萄糖苷亚基(5个或更多个)的大环。环糊精的实例包括α
‑
环糊精、β
‑
环糊精和γ
‑
环糊精,它们分别包含6、7和8个吡喃葡萄糖苷亚基,以及它们的类似物(例如,改性环糊精)。在一个实施例中,环糊精是β
‑
环糊精或改性的β
‑
环糊精。如本文所用,改性的β
‑
环糊精是指其中一个或多个糖单位的一个或多个羟基可被改性(例如用烷基、烯基或炔基,或用取代的烷基、烯基或炔基改性)的β
‑
环糊精分子。因此,在实施例中,β
‑
环糊精可以是未改性的或未取代的,或者可以是改性的或取代的。因此,在另一个实施例中,β
‑
环糊精是改性的β
‑
环糊精。如本文所用,“改性的β
‑
环糊精”是指在β
‑
环糊精的一个或多个糖单位的一个或多个羟基处包含改性的β
‑
环糊精,即与β
‑
环糊精的一个或多个糖单位的一个或多个羟基相连的基团或部分。因此,在实施例中,改性的β
‑
环糊精是烷基
‑
、烯基
‑
、炔基、取代的烷基
‑
、取代的烯基或取代的炔基
‑
β
‑
环糊精(例如,具有羟基取代)。在实施例中,烷基、烯基或炔基是(c1‑
c6)烷基、(c1‑
c6)烯基或(c1‑
c6)炔基。在另一个实施例中,改性的β
‑
环糊精是(c1‑
c6)烷基β
‑
环糊精,在另一个实施例中是甲基
‑
β
‑
环糊精(m
‑
β
‑
cd)。在另一个实施例中,改性的β
‑
环糊精是羟基(c1‑
c6)烷基β
‑
环糊精,在另一个实施例中是羟丙基
‑
β
‑
环糊精(hp
‑
β
‑
cd)。在一个实施例中,环糊精以约2%至约15%(w/v)的浓度存在于药物组合物中,在另一个实施例中以约2%至约12.5%(w/v),例如约2%至约10%(w/v)、约2.5%至约15%(w/v)、约2.5%至约12.5%(w/v)、约2.5%至约10%(w/v)、约5%至约15%(w/v)、约5%至约12.5%(w/v)、约5%至约10%
(w/v)、约7.5%至约12.5%(w/v)、约7.5%至约10%(w/v)、约5%、7.5%、10%、12.5%或15%(w/v),或约10%(w/v)的浓度存在于药物组合物中。
[0285]
在一个实施例中,本公开的药物组合物的ph为约4.5至约6.5,例如约5.0至约6.0。根据另一个实施例,药物组合物的ph为约5.0。根据另一个实施例,药物组合物的ph为约5.5。根据另一个实施例,药物组合物的ph为约6.0。
[0286]
在一个实施例中,本公开的药物组合物包含稀释剂,例如水溶液。在另一个实施例中,药物组合物包含水(通常是无菌水)。
[0287]
如果需要,本公开的药物组合物还可包含其他稀释剂、增溶剂、赋形剂、ph调节剂、舒缓剂、缓冲剂、含硫还原剂、抗氧化剂等。例如,含硫还原剂包括n
‑
乙酰半胱氨酸、n
‑
乙酰高半胱氨酸、硫辛酸、硫二甘醇、硫代乙醇胺、硫代甘油、硫代山梨糖醇、巯基乙酸及其盐、硫代硫酸钠、谷胱甘肽、甲硫氨酸和含巯基的化合物,诸如具有1到7个碳原子的硫代链烷酸。抗氧化剂包括甲硫氨酸、异抗坏血酸、二丁基羟基甲苯、丁基羟基茴香醚、α
‑
生育酚、生育酚乙酸酯、l
‑
抗坏血酸及其盐、l
‑
抗坏血酸棕榈酸酯、l
‑
抗坏血酸硬脂酸酯、亚硫酸氢钠、亚硫酸钠、没食子酸三戊酯、没食子酸丙酯或螯合剂如乙二胺四乙酸二钠(edta)、焦磷酸钠、偏磷酸钠。也可以含有其他常用的成分,例如,诸如氯化钠、氯化钾、氯化钙、磷酸钠、磷酸钾、碳酸氢钠等的无机盐类;以及诸如柠檬酸钠、柠檬酸钾、醋酸钠等的有机盐类。
[0288]
在一个实施例中,ghrh分子,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约8mg的日剂量施用。在另一个实施例中,ghrh分子,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1mg至约4mg、约1mg至约3mg或约1mg至约2mg的日剂量施用。在另一个实施例中,ghrh分子,优选反式
‑3‑
己烯酰基
‑
ghrh
(1
‑
44)
‑
nh2或其药学上可接受的盐以约1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0mg的日剂量施用。
[0289]
在其他方面,本公开提供了上述ghrh分子或组合物在实现本文指出的一种或多种生物/治疗效果中的用途,例如,用于改善、减缓本文所述的症状、疾病或病症的进展、使其稳定化、降低其严重性、对其进行预防和/或治疗,或用于制备/制造用于改善、减缓本文所述的症状、疾病或病症的进展、使其稳定化、降低其严重性、对其进行预防和/或治疗的药物。在其他方面,本公开提供了上述组合物用于改善、减缓本文所述的症状、疾病或病症的进展、使其稳定化、降低其严重性、对其进行预防和/或治疗,或用于制备/制造用于改善、减缓本文所述的症状、疾病或病症的进展、使其稳定化、降低其严重性、对其进行预防和/或治疗的药物。
[0290]
如本文所用,术语“治疗”被定义为向受试者应用或施用治疗剂,或向患有病症、疾病、病症或疾病的症状、或病症或疾病的倾向的受试者的分离的组织或细胞系中应用或施用治疗剂,目的是治疗、治愈、缓解、延迟、减轻、改变、补救、改善、改进或影响病症/疾病、病症/疾病的症状或病症/疾病的倾向。
[0291]
在一个实施例中,治疗持续至少3、6、9或12个月的时间。在另一个实施例中,治疗持续至少12个月的时间。
[0292]
在实施例中,ghrh分子以有效量施用,例如以治疗有效量或预防有效量施用。“治疗有效量”是指在必要的剂量和时间段内有效实现所需治疗结果的量,例如实现上述改变和减缓上述症状的进展的量。ghrh分子的治疗有效量可根据诸如个体的疾病状态、年龄、性
别和体重以及化合物在个体中引发所需反应的能力等因素而变化。可以通过调整剂量方案来提供最佳治疗反应。治疗有效量也是指其中化合物的任何毒性或有害作用被治疗有益作用超过的量。“预防有效量”是指在必要的剂量和时间段内有效实现所需预防结果的量,例如预防或抑制上述症状的发作或进展速度的量。预防有效量可以如上文针对治疗有效量所描述的那样确定。对于任意特定受试者来说,可以根据个体需要和通过施用或监督组合物施用的人员的专业判断来随时间调整具体的剂量方案。
[0293]
根据本公开的另一方面,包含gh促分泌素的本公开的治疗组合物可以提供在容器、试剂盒或包装(例如商业包装)中,其中进一步包含其用于预防或治疗本文所述症状的使用说明书。
[0294]
因此,本公开进一步提供了包含ghrh分子或上述组合物的试剂盒或包装,任选地连同预防或治疗本文所述症状的说明书一起。
[0295]
如本文所用,术语“受试者”或“患者”是指温血动物,诸如哺乳动物,例如猫、狗、小鼠、豚鼠、马、牛、羊或人。在一个实施例中,受试者是哺乳动物。在另一个实施例中,受试者是人。
[0296]
实例
[0297]
通过以下非限制性实例进一步详细说明了本公开。
[0298]
实例1:材料和方法
[0299]
参与者选择
[0300]
参与者是在马萨诸塞州总医院(mgh,波士顿,马萨诸塞州)和美国国立卫生研究院(nih,贝塞斯达,马里兰州)招募的。潜在符合条件的参与者是通过当地医生的推荐、向参与mgh研究对象志愿者计划的参与者发送通知、以及nih的hiv和nafld患者人群来确定的。61名感染hiv的男性和女性符合资格标准并参与了基线评估。
[0301]
如果参与者的年龄在18
‑
70岁之间并且已确诊hiv感染以及肝脂肪变性,并且已证明磁共振波谱(mrs)所测的肝脏脂肪分数≥5%,则这些参与者有资格参与该研究。大量饮酒的参与者(女性每天>20g或男性每天>30g)被排除在外,患有乙型肝炎、活动性丙型肝炎、α
‑
1抗胰蛋白酶缺乏症、威尔逊病、血色病或自身免疫性肝炎的参与者也被排除在外。那些具有丙型肝炎病史的患者只有在成功治疗后才符合资格,即在进入研究前至少一年丙型肝炎已消退,并且在筛选访视时没有检测到hcv病毒载量。已知肝硬化、活检显示为4期纤维化或其他严重慢性疾病的参与者也被排除在外。只要血红蛋白a1c≤7%,抗糖尿病药物维持稳定时间≥6个月,并且未使用胰岛素或噻唑二酮类药物,则轻度糖尿病参与者也符合条件。参与者还需要有≥3个月的稳定抗病毒治疗方案,稳定使用任意抗高血压或降脂药物的时间≥3个月,以及,若可以,在进入研究前稳定使用维生素e的时间≥6个月。使用慢性全身性皮质类固醇、甲氨蝶呤、胺碘酮、他莫昔芬或gh的参与者被排除在外,患有任何活动性恶性肿瘤的参与者也被排除在外。要求50岁或以上的女性在基线访视后1年内进行阴性乳房x光检查,并且排除有前列腺癌病史的男性。有垂体功能减退病史或其他已知会影响gh轴的疾病的参与者也不符合资格。出于安全原因,其他排除实验条件如下:血红蛋白<11g/dl;cd4
计数<100个细胞/mm3;hiv病毒载量>400拷贝/ml;前列腺特异性抗原<5ng/ml。
[0302]
研究规划
[0303]
该研究包括一个为期12个月的双盲治疗阶段,在此期间参与者以1:1的比例随机
接受替莫瑞林每日2mg或同等安慰剂治疗,然后是一个为期6个月的开放性阶段,在此期间所有参与者都接受替莫瑞林治疗。此处报告了预先指定的初步分析,比较了替莫瑞林与安慰剂治疗在12个月中的变化。随机性按研究机构(nih和mgh)和维生素e的使用量进行分级,维生素e的使用量定义为每天持续使用≥400国际单位。随机列表由研究统计学家在每个分级中使用置换块算法准备,其中块大小随机变化。替莫瑞林以fda批准的2mg剂量每日皮下给药;参与者在基线访视时接受了药物配置和自我注射的培训,并在家中进行注射,将用过的小瓶返回以评估依从性。igf
‑
1的分数z在整个研究过程中由mgh的独立内分泌学家监测,否则视为与该研究无关。方案中包含了预先指定的igf
‑
1的分数z≥3阈值,作为将替莫瑞林剂量降低至1mg以及安慰剂组中的虚拟剂量减少的触发因素,但在研究的双盲阶段,任何患者都不需要这样做。
[0304]
所有受试者在基线、6个月和12个月时都接受了临床研究营养师的营养咨询。访视是在空腹状态下进行的。筛选访视包括病史和体格检查、资格实验室检查、mrs和磁共振成像(mri),后者用于评估l4椎骨处内脏脂肪组织(vat)的横截面积。筛选访视的mri/mrs、hba1c、cd4
计数和hiv病毒载量用作基线测量。基线评估包括肝活检;全身双能x射线吸收测定法(dxa);空腹评估肝功能检查、血脂、血清炎症标志物、igf
‑
1和hba1c;以及生物营养评估,包括4天的食物记录、可变活动问卷(kriska am等人,《糖尿病护理(diabetes care)》1990;13:401
‑
11),以及以一式三份进行的人体测量。在12个月时重复基线评估以及重复mri/mrs、hba1c和免疫学参数的评估。在6个月的访视中进行了中期mri/mrs。
[0305]
结果测量
[0306]
主要结果是使用1h mrs测量的hff,在8小时禁食后的早晨进行。脂肪分数通过将光谱脂质峰下的面积除以水和脂质峰下的总面积来计算。图像采集遵循mgh和nih的标准协议。肝脏脂肪含量利用nih的jmrui半自动软件和mgh的自动lc
‑
model软件进行量化。mgh使用lc
‑
model重新读取nih扫描件,测量值之间的相关系数为0.97,相当于重新定位前后在同一台机器上执行的两次扫描之间的相关性,并使用lc
‑
model进行分析(bredella ma等人,《计算机辅助断层扫描杂志(j comput assist tomogr)》2010;34:372
‑
6)。与经验丰富的病理学家对肝活检的评估相比,mrs对肝脂肪变性的诊断准确率在受试者工作特征曲线下的面积为0.94(95%ci 0.88
‑
1.0)(georgoff p等人,《美国放射学杂志(ajr am j roentgenol)》2012;199:2
‑
7)。如果hff≥5%,则受试者符合条件。
[0307]
由不知情的中央病理学家(dek)利用nas crn评分系统对所有肝活检样本进行组织学评分(kleiner de等人,《肝脏病学》2005;41:1313
‑
21)。脂肪变性(0
‑
3级)、肝细胞膨胀(0
‑
2级)和小叶炎症(0
‑
3级)的等级总和构成nas,纤维化在0
‑
4之间独立分级(kleiner de等人,《肝脏病学》2005;41:1313
‑
21)。通过组织学审查(dek)确定是否存在脂肪性肝炎。纤维化的进展被认为是基线和12个月之间纤维化阶段的任何增加。l4椎骨的腹部横断面mri被集中读取并用于量化vat和皮下脂肪组织(sat)区域。
[0308]
mgh的参与者还接受了正常血糖高胰岛素钳夹手术以评估胰岛素敏感性。如前所述,禁食14小时后,进行低剂量(胰岛素20mu/m2/min)钳夹2小时,然后进行高剂量(胰岛素80mu/m2/min)钳夹2小时(braun lr等人,“匹伐他汀对胰岛素敏感性和肝脂肪的影响:一项随机临床试验(effects of pitavastatin on insulin sensitivity and liver fat:a randomized clinical trial.)”《临床内分泌代谢杂志(j clin endocrinol metab)》
2018;103:4176
‑
86)。在低剂量和高剂量钳夹的最后20分钟内,使用defronzo方法(defronzo ra,tobin jd,andres r,《美国生理学杂志(am j physiol)》1979;237:e214
‑
23)计算胰岛素刺激的葡萄糖处置(m),分别作为肝脏和全身胰岛素敏感性的主要指标。
[0309]
使用标准方法进行实验室分析。临床实验在nih临床实验室进行测量,mgh在labcorp和quest进行测量。igf
‑
1在quest实验室集中测量。使用电化学发光(meso scale discovery,罗克维尔市,马里兰州)测量c反应蛋白,使用elisa(r&d systems,明尼阿波利斯,明尼苏达州)测量脂联素。
[0310]
统计分析
[0311]
预先指定的主要研究终点是基线和12个月之间hff的变化。次要研究终点包括肝脏病理、alt、血脂、葡萄糖代谢指标和全身炎症标志物的变化。根据80%的功效选择60个样本量,以检测12个月内肝脏脂肪分数变化≥0.85标准差的治疗差异,假设停药率为25%(即45名可评估患者停药),双侧α为0.05。mgh中心的一名患者在基线访视结束时停药后,irb获得了招募第61名参与者的许可。
[0312]
根据预先指定的分析计划,hff的变化通过随机截距混合效应模型来评估,该模型使用受限最大似然来评估时间
×
随机化交互作用的效应估值。分析中使用了所有可用数据,该分析基于意向治疗进行。对双盲期间多个时间点测量的其他研究终点使用相同的分析,包括vat、sat、alt、bmi和葡萄糖。对于仅在基线和12个月时测量的次要研究终点,使用所有可用数据进行配对t检验。这些数据表示为平均值
±
标准偏差,或者对于分类变量而言,表示为数字和百分比。使用连续变量的学生t检验和分类变量的皮尔逊卡方统计来评估基线处的组间比较。皮尔逊相关系数用于评估连续变量之间的关系。两个数据点—一个基线alt值和一个基线crp值由于比样本平均值高5个以上标准偏差而被排除在外。0.05的双侧α是统计显着性的预定义阈值。研究数据是使用合作医疗公司托管的研究电子数据捕获(redcap)工具收集和管理的(harris pa等人,《生物医学信息学杂志(j biomed inform)》2009;42:377
‑
81)。敏感性分析是利用缺失数据的多重插补进行100次(丢弃前10次)迭代进行的。所有数据分析均由研究统计学家(hl)监督。
[0313]
实例2:结果
[0314]
患者特征、依从性
[0315]
在筛选的143名参与者中,61人进入了试验的随机治疗部分。nih招募了15名参与者,mgh招募了46名参与者。参与者流程和患者排除的原因如图1所示。如图1所示,替莫瑞林组的4名参与者和安慰剂组的2名参与者在任意随访影像之前停药。替莫瑞林组的5名参与者和安慰剂组的2名参与者在获得用于初步分析的随访影像后停药。组间总体停药率无显着差异,p=0.12。
[0316]
基线处各组之间的临床特征(表1)和身体组成和代谢的测量值(图2)相似(图2)。在基线处,33%的人群进行了nash的组织学诊断。43%的人群患有1期或更高期的纤维化;根据协议,没有人在基线处出现第4期纤维化。这些比率在治疗组中相似(表1)。art方案在组间相似(表1)。
[0317]
表1:基线人口统计特征和临床特征
[0318][0319][0320]
对于上面显示的任何变量,基线处组之间在统计学上没有显着差异。
[0321]
连续变量表示为平均值
±
标准偏差。
[0322]
*目前吸烟者也属于“曾经吸烟者”类别。
[0323]
**维生素e的使用定义为每天定期摄入≥400国际单位的维生素e。
[0324]
缩略语:g,克;hiv,人类免疫缺陷病毒;kcal,千卡;nash,非
[0325]
酒精性脂肪性肝炎;nrti,核苷逆转录酶抑制剂;pi,蛋白酶抑制剂;
[0326]
nnrti,非核苷逆转录酶抑制剂。
[0327]
治疗组之间通过返回的空瓶计数对每日注射的依从性是相近的:安慰剂为87
±
16%,替莫瑞林为80
±
15%(p=0.11)。如图2所示,igf
‑
1值的变化证明了替莫瑞林增加igf
‑
1的预期效果,效果量为117ng/ml(95%ci[76,157],p<0.0001)。受试者的igf
‑
1分数z均未超过预先指定的剂量减少阈值(z分数>3),但一名受试者因可能与生长激素相关的症状而导致接受剂量减少至1mg。该受试者在剂量减少不久后退出研究。
[0328]
肝脏脂肪分数、肝脏病理和炎症标志物
[0329]
表2a示出了完成该研究的替莫瑞林和安慰剂治疗受试者在基线处和1年治疗结束时的肝脏脂肪分数(hff)。表2b示出了完成该研究的替莫瑞林和安慰剂治疗受试者在基线处和1年治疗结束时的nash评分、脂肪变性评分、肝细胞膨胀评分和小叶炎症评分。表2c示出了完成该研究的替莫瑞林和安慰剂治疗受试者在基线处和1年治疗结束时的纤维化阶段。
[0330]
表2a
[0331]
[0332][0333]
表2b
[0334]
[0335][0336]
表2c
[0337]
[0338][0339]
与安慰剂相比,替莫瑞林显着降低了hff(效应量为
‑
4.1%(95%ci
‑
7.5,
‑
0.7),p=0.02)。如图3a所示,基线和12个月之间的变化对应于肝脏脂肪的
‑
37%(95%ci
‑
67,
‑
7)的相对变化(图3b)。在替莫瑞林组中,35%的个体的hff降低至<5%,而安慰剂组中4%的个体发生这种情况(图3c,p=0.007用于比较)。此外,替莫瑞林可有效降低最受折磨的受试者(即基线hff升高幅度最大的受试者,例如≥15%)的hff,一些患者显示hff绝对降低超过10%:7号患者从16.97减少到2.87;24号患者从33.19减少到17.4;26号患者从15.03减少到2.14;55号患者从33.3减少到21(表2a)。
[0340]
在整个人群中,替莫瑞林在治疗期间阻止了纤维化的进展,在替莫瑞林组中有2人表现出进展,而在安慰剂组中有9人表现出进展(p=0.04)(图4a)。研究期间纤维化的变化与nas评分的变化呈正相关(方差分析的p值=0.0003,图4b)。在整个人群中,相对于安慰
剂,替莫瑞林没有显着改变nas评分(效应量为
‑
0.3,95%ci
‑
1.0,0.5)。然而,在随机给药替莫瑞林的个体中,基线nas评分较高的患者在治疗期间的评分下降幅度更大(r=
‑
0.48,p=0.04),而在安慰剂组中未观察到类似的关系(r=
‑
0.14,p=0.52)。值得注意的是,接受替莫瑞林治疗的55号患者的nas评分从7分降至4分,这与纤维化的改善(从2期到1a期)有关(表2b和2c)。同样,在替莫瑞林治疗的人群中,治疗期间nas评分的变化与hff的变化呈正相关(r=0.51,p=0.03),而在安慰剂治疗的患者中未观察到类似的关系(r=0.14,p=0.52)。
[0341]
相对于安慰剂,替莫瑞林在治疗期间没有显着降低alt或ggt,尽管两种效应量都表现出了适度降低(图2)。通过将人群限制为在基线处alt升高(>30u/l)的患者,替莫瑞林相对于安慰剂在12个月后确实显着降低了alt(效应量为
‑
29u/l[95%ci
‑
3,
‑
55],p=0.03,图3d)。替莫瑞林相对于安慰剂降低了crp(图2),但对脂联素没有任何影响。
[0342]
脂质和葡萄糖代谢和身体成分
[0343]
在本研究中未观察到替莫瑞林对低密度脂蛋白胆固醇(ldl
‑
c)、高密度脂蛋白胆固醇(hdl
‑
c)或甘油三酯(图2)的影响。替莫瑞林在治疗期间对空腹血糖或血红蛋白a1c没有显着影响(图2)。在接受正常血糖高胰岛素钳夹的患者亚组中,替莫瑞林不影响低剂量钳夹期间所需的葡萄糖输注速率(低剂量m 0.0mg/kg/min[95%ci
‑
1.1,1.1],p=0.996)的治疗效果,也不影响高剂量钳夹期间胰岛素刺激的葡萄糖摄取(高剂量m
‑
0.9mg/kg/min[95%ci
‑
2.4,0.7)的治疗效果。
[0344]
表3示出了完成该研究的替莫瑞林和安慰剂治疗的受试者在基线处和1年治疗结束时的内脏肥胖状况。
[0345]
表3
[0346]
[0347][0348]
[0349]
相对于安慰剂,替莫瑞林显着降低了vat面积,而对sat面积没有影响(图2)。替莫瑞林通过dxa适度增加了去脂体重,对全身脂肪量没有显着影响(图2)。体质指数和腰围没有变化。
[0350]
营养和体能活动
[0351]
根据可修改活动问卷的评估,在基线到12个月期间,四天食物记录的每日热量和常量营养素摄入量、每周自我报告的饮酒次数和每周活动小时数均没有显着变化。
[0352]
敏感性分析
[0353]
主要研究终点的敏感性分析是使用缺失数据的多重插补进行的。该数据证实了主要结果,hff减少的估计效应量为
‑
3.8%(95%覆盖率
‑
5.4,
‑
2.2)。
[0354]
不利影响
[0355]
各研究组的不良事件见表4。观察到的严重不良事件(sae)数量有限,在治疗组之间没有差异。没有一项被判断为与研究药物有关。在安慰剂组中,有2人出现sae并住院:一名因企图自杀而住院,另一名因肝活检后出现血肿。在替莫瑞林组中,有4人出现sae并住院:1人有中风病史,暂时性偏瘫,原因不明;1人有自杀意念;1人因尿毒症;1人仅因为流感而导致肺炎。
[0356]
安慰剂组中的1人和替莫瑞林组中的4人发生的事件符合研究者停药的先验方案标准(p=0.17,包括替莫瑞林组中的两次高血糖停药(第2周和第6个月访视)。1人在基线时已知患有糖尿病。其他停药原因在图1中概述。
[0357]
表4:不良事件
[0358][0359][0360]
数字是指发生事件的患者人数。
[0361]
*通过皮尔逊卡方检验法按组比较事件数的p值。该研究无法检测不良事件的差异,并且仅显示汇总事件的p值。
[0362]
实例3:对来自替莫瑞林组和安慰剂组的样本进行基因集富集分析(gsea)
[0363]
使用hallmark和精选基因集对来自替莫瑞林组和安慰剂组的rnaseq数据生成肝组织生成进行基因集富集分析(gsea)(subramanian,tamayo等人,2005,《美国国家科学院
院刊(pnas)》102,15545
‑
15550;mootha,lindgren等人,2003,《自然遗传(nat genet)》34,267
‑
273),以确定替莫瑞林给药是否与特定基因集或通路的过度表达和/或下调有关。在使用rnalater
tm
制备后,利用该研究中的配对肝活检标本(替莫瑞林,n=19;安慰剂,n=24)。对替莫瑞林组的18名患者和安慰剂组的21名患者的基因表达的变化进行了成功评估。illumina truseq
tm
标准mrna样本制备试剂盒的自动化变体用于提供成对对齐的50m读数。每次运行都是一个101bp双端,读取一个八碱基索引条码。使用broad picard pipeline分析数据,其中包括解复用和数据聚合。使用star对齐算法完成对齐。tru
‑
seq链特异性大插入片段rna测序包括铺板、poly
‑
a选择和链特异性cdna合成、文库制备(450
‑
550bp插入片段大小)、测序(101bp配对读数)、样本鉴定qc检查(当选择匹配dna样本的样本鉴定时)。该产品使用特定于链的illumina truseq
tm
方案提供文库构建,序列覆盖达50m配对读数或50m总读数。使用标准化的基因集富集方法来比较每个治疗组中特定基因集随时间的变化。使用热图、富集图和单个基因的点图分析数据。在相关途径中检查前沿基因,并检查与肝活检表型变化的关系,包括纤维化阶段。
[0364]
这些研究的结果总结如下:
[0365]
细胞代谢
[0366]
·
用替莫瑞林治疗上调氧化磷酸化;
[0367]
·
前沿基因对应于主要编码的基因:
[0368]
ο电子传递链的成分;
[0369]
ο组装电子传递链所需的伴侣蛋白;
[0370]
·
线粒体活性的增强可以降低活性氧(ros)水平,防止肝脏炎症和纤维化。
[0371]
炎症
[0372]
·
替莫瑞林导致多个炎症通路的大幅下调。(例如,tnf
‑
α、il
‑
6和il
‑
2);
[0373]
·
炎症是nafld进展(例如nash)的重要过程;
[0374]
·
基因分析似乎对检测未在组织病理学分析中公开反映的炎症变化更敏感;
[0375]
·
前沿基因对应于主要编码的基因:
[0376]
ο先天性和适应性免疫细胞的成分;
[0377]
ο细胞因子。
[0378]
组织修复
[0379]
·
替莫瑞林导致参与组织修复的基因下调;
[0380]
·
纤维化是慢性/失调的伤口愈合反应的表现。值得注意的是,在接受替莫瑞林治疗的参与者中,发现参与组织修复的基因通路的下调对应于与纤维化阶段相关的基因的减少;
[0381]
·
替莫瑞林治疗参与者的凋亡基因下调;
[0382]
·
替莫瑞林治疗参与者的紫外线反应基因下调;
[0383]
·
替莫瑞林治疗参与者的上皮间质转化(emt)基因下调;
[0384]
·
转化生长因子
‑
β(tgf
‑
β)是纤维化、emt和肿瘤发生的关键介质,在接受替莫瑞林治疗的参与者中被下调。
[0385]
细胞更新
[0386]
·
替莫瑞林导致参与细胞更新的基因下调;
[0387]
·
nafld的最早事件,甚至在脂肪变性之前,已被证明是肝脏增殖;并且
[0388]
已被认为是肝损伤的重要步骤;
[0389]
·
肝细胞凋亡和增殖的重复循环增加了某些个体异常修复的风险,最终导致肿瘤发生。
[0390]
癌症预后基因集
[0391]
·
替莫瑞林导致hcc良好预后的上调和hcc不良预后基因集的下调;参与纤维化和肿瘤发生的yap taz通路基因集的下调;
[0392]
·
与其对炎症、纤维化和细胞更新通路的下调一致,这些通路可能最终降低恶性肿瘤风险。
[0393]
·
替莫瑞林似乎可以降低肝脏恶性肿瘤的可能性,即使在刺激gh通路和增加全身igf
‑
1通路的同时也是如此。
[0394]
特定通路与纤维化基因变化的关系(替莫瑞林组内)
[0395]
·
参与氧化磷酸化的基因集与纤维化基因的变化呈负相关;
[0396]
·
参与炎症、组织修复、细胞更新的基因集与纤维化基因的变化呈正相关。
[0397]
尽管本公开已经通过其特定实施例的方式在上文中进行了描述,但是在不脱离所附权利要求中限定的本公开的精神和性质的情况下可以对其进行修改。在权利要求中,词语“包含”用作开放式术语,基本上等同于短语“包括但不限于”。除非上下文另有明确规定,否则单数形式“一”、“一个”和“所述”包括相应的复数参考。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。