molecule immunoassays,lab chip 2013,13,2902
‑
2911;和kingsmore,s.f.,multiplexed protein measurement:technologies and applications of protein and antibody arrays,nat.rev.drug discovery 2006,5,310
‑
320。这在生物测试应用(例如临床和重点照护检验(poc)诊断)中是尤其有价值的,其中可以在单个测试中筛选一组疾病生物标记物。参见,nie等,an automated integrated platform for rapid and sensitive multiplexed protein profiling using human saliva samples,lab chip 2014,14,1087
‑
1098;shen等,multiplexed quantification of nucleic acids with large dynamic range using multivolume digital rt
‑
pcr on a rotational slipchip tested with hiv and hepatitis c viral load,journal of the american chemical society 2011,133,17705
‑
17712;和chin等commercialization of microfluidic point
‑
of
‑
care diagnostic devices,lab chip 2012,12,2118
‑
2134。
10.典型的基于小珠的多路诊断方法用不同强度水平的染料的不同组合来编码多种类型的亲和小珠。参见,manesse等,dynamic microbead arrays for biosensing applications.lab chip 2013,13,2153
‑
2160;和nie等,multiplexed salivary protein profiling for patients with respiratory diseases using fiber
‑
optic bundles and fluorescent antibody
‑
based microarrays.anal.chem.(washington,dc,u.s.)2013,85,9272
‑
9280。
11.可以通过以适用于所用的各编码染料的激发/发射波长获取图像对小珠进行解码。参见,rissin等,multiplexed single molecule immunoassays.lab chip 2013,13,2902
‑
2911。然后基于预先确定的荧光发射强度阈值将小珠分配至一个群体。参见,例如,nie等,multiplexed salivary protein profiling for patients with respiratory diseases using fiber
‑
optic bundles and fluorescent antibody
‑
based microarrays,anal.chem.(washington,dc,u.s.)2013,85,9272
‑
9280。虽然该方法可以产生编码的小珠的若干群体,其可能需要不同编码染料的光谱性质和各强度水平被很好地分辨以保证各小珠群体可以彼此区分。因此,在该方法的情况下,可以使用的多路水平的数目具有实际的上限,即使在利用专门设备如流式细胞仪的情况下。仍然需要可以允许增加的多路和/或检测速度的备选的编码/解码系统。
12.本技术在以上背景部分中引用的文献的内容通过引用完整地结合于此。
13.发明实施方案概述
14.本发明的实施方案提供编码的设备的解码测量,其可以提供据信通过常规编码方法无法实现的额外的多路水平。
15.相对于仅使用单时间点编码测量(如常规解码测量通常所为的),本技术的实施方案提供的方法采用时间域以获得在不同时间取得的多个解码测量从而区分和/或鉴别(解码)不同的群体。解码测量可以基于编码介质(例如,染料),如,例如,具有相似光谱性质的编码介质。
16.编码介质可以具有相似的光谱性质以致其在第一图像中是不可区分的(例如,在限定事件前),并且可以包括稳定的编码介质(例如,在限定事件前后的不同时间点产生相同的荧光强度)和响应于限定事件而在物理上和/或在化学上产生变化的编码介质(例如,与限定事件前的荧光强度相比在限定事件后在不同的时间点显示增加或减小的荧光强度
并且/或被选择性地激活)。
17.编码介质可以包括稳定的,部分稳定的,相对稳定的和不稳定的介质。
18.编码介质中的一些或全部可以包含相似的光谱性质以致其在第一图像中可以是不可区分的并且不稳定的编码介质可以产生由于物理和/或化学变化所致的下降或增强的荧光强度,所述变化可以是由暴露于限定事件(例如,热,光,化学,磁和/或电化学事件)引起的。
19.解码测量可以在不同时间点进行,包括在引起与相应固体支持物(可以是其中全部或部分)相关的物理和/或化学变化的限定事件之前、期间和/或之后,所述变化可以导致相应固体支持物(可以是其中全部或部分)的编码信号发生变化(例如,由具有至少一种编码介质的各固体基质(可以是其中全部或部分)产生的发光强度可能变化)。在一些实施方案中,可以测量发光强度,其可以包括荧光和/或磷光强度。固体支持物的其他解码测量包括检测磁行为,ph,光散射,物理尺寸,形状,折射率,溶解度,光吸收和/或发射强度或最大波长迁移,传导率,介电常数,粘度和放射性衰减事件的变化以及以上的组合。
20.例如,在一些实施方案中,固体支持物如,但不限于,小珠,可以利用编码介质(例如,染料或染料)来编码,并且在使用超过一种编码介质的情况下,编码介质可以具有相似的光谱性质(例如,相似的初始光谱性质),但是不同的稳定性。虽然提供常规解码方法是不可区分的,本发明的方法可以允许分辨固体支持物的不同群体。在一些实施方案中,为了鉴别至少两种不同的群体,可以使用至少两种不同的编码介质。备选地或此外,在一些实施方案中,一种编码介质(例如相同的染料和/或活性部分)可用于鉴别至少两种不同的群体,但是对于至少一个群体,所述编码介质,响应于限定事件,提供与其他不同的编码信号以致可以鉴别所述群体,其可以例如是,编码介质包括在其他中不存在以及响应于限定事件而被选择性地激活或改变的元件。例如,用于两个不同群体的编码介质可以包括相同的染料,但是其可以不同方法连接至固体支持物并且一种连接方法可以包括被限定事件破坏的结合,这改变编码介质或固体支持物的荧光强度。
21.本发明的固体支持物可以产生比利用静态单时间点测量所能够实现的多得多的不同编码状态。
22.利用与固体支持物相关的物理和/或化学变化所提供的额外的编码信号,本发明的方法可以鉴别增加的群体,所述变化可以导致相应固体支持物和/或其部分的编码信号随时间变化,典型地基于限定事件,如,例如,导致编码介质和/或固体基质的化学和/或物理性质变化的限定事件。
23.增加的多路能力可以不需要额外的滤波器组或其他昂贵的光学仪器,这可以提供低成本的、相对简单的分析平台。
24.虽然存在许多方式来在固体基质(例如,小珠)中和/或上执行时间依赖性测量,光稳定性和/或热稳定性可以是尤其适合开发以鉴别多路小珠的参数。
25.在一些实施方案中,可以获得并分析相应固体支持物(可以是其中全部或部分)的第一和第二编码信号以鉴别不同的群体。在一些实施方案中,第一编码信号可以基于和/或获得自第一图像,其中不同的固体支持物在不同位置。第二编码信号可以基于和/或获得自第二图像,其中不同的固体支持物在相应(相同)位置。在一些实施方案中,第一编码信号可以基于和/或获得自第一图像,其中编码的分子识别元件在固体支持物上的样品上和/或中
的不同位置,并且第二编码信号可以基于和/或获得自第二图像,其中不同的编码的分子识别元件在相应(相同)位置。第一和第二图像中的不同的编码信号的实际数目可以是相同的。然而,相应固体支持物的编码信号可以随时间变化(例如,从一个水平迁移至另一个水平,如高至低,或反之亦然),这可以增加可检测的编码状态的数目。
26.例如,在一些实施方案中,分析系统可以被配置成检测在第一和第二图像之间的相同数目的限定强度水平,如,例如,三个(3)强度水平(低,中,高)。然而,由于群体中的至少一些的第一和第二图像之间强度水平的变化,可以基于保持不变的群体和变化的群体来限定额外的群体(1.初始低强度并且保持在低强度,2.初始中等强度并且退至低强度,3.初始中等强度并且保持在中等强度,4.初始高强度并且退至低强度,5.初始高强度并且退至中等强度,6.初始高强度并且保持在高强度)。
27.此外,利用在猝灭剂被消除或隔离的染料被释放时变得更亮的能力,分析系统可以被配置成检测以上全部的1
‑
6,加上7.初始低强度增加至中等强度,8.初始低强度增加至高强度,9.初始中等强度增加至高强度。即,仅由3个强度水平产生9个群体。如果使用第二染料组(例如,编码介质),则可以产生81个群体。
28.可以使用其他编码信号,包括以下将进一步讨论的固体基质的物理和/或化学变化。
29.在一些实施方案中,提供解码固体支持物的方法,所述方法包括:检测多个固体支持物(例如,多路小珠组)中的固体支持物的第一编码信号和第二编码信号;比较多个固体支持物中的相应固体支持物的第一编码信号和第二编码信号,其中在与固体支持物相关的至少一种化学和/或物理变化期间或之后检测相应固体支持物的第二编码信号并且相应固体支持物的第一和第二编码信号是不同的;以及至少部分基于所述第一和第二编码信号的比较解码多个固体支持物。
30.在一些实施方案中,提供解码固体支持物的方法,所述方法包括提供多个分子识别元件(如,例如,抗体,适体,和/或核酸探针),其中多个分子识别元件中的至少一些包括一种或多种编码介质;将多个分子识别元件中的至少部分结合至固体支持物上的样品中的至少部分;检测多个分子识别元件中的分子识别元件的第一编码信号和第二编码信号;比较多个分子识别元件中的相应分子识别元件的第一编码信号和第二编码信号,其中在与分子识别元件相关的至少一种化学和/或物理变化期间或之后检测第二编码信号并且相应分子识别元件的第一和第二编码信号是不同的;以及至少部分基于所述第一和第二编码信号的比较解码多个分子识别元件。固体支持物可以是载有生物样品(如,例如,组织切片)的显微镜载玻片。在一些实施方案中,固体支持物可以是直接或夹心型测定中涉及的载有蛋白和/或核酸的阵列的玻璃,硅或塑料载玻片。
31.一些实施方案包括解码样品的方法,所述方法包括检测多个编码的元件中的编码的元件(例如,编码的固体支持物和/或编码的分子识别元件)的第一编码信号和第二编码信号;比较多个编码的元件中的相应编码的元件的第一编码信号和第二编码信号,其中在与编码的元件相关的至少一种化学和/或物理变化期间或之后检测相应编码的元件的第二编码信号并且相应编码的元件的第一和第二编码信号是不同的;以及至少部分基于所述第一和第二编码信号的比较解码多个编码的元件。
32.其他实施方案涉及分析系统。可以提供测定解码系统,其包括包含至少一个处理
器的回路;包含多个固体支持物(例如,多路小珠组)的流体分析芯片;和与多个固体支持物连通的源,其中回路激活所述源以引起与多个固体支持物中的至少一些相关的至少一种可检测的物理和/或化学变化并且比较多个固体支持物中的相应固体支持物的第一和第二编码信号以解码多个固体支持物中的不同的群体的固体支持物。所述源可以包括与多个固体支持物连通的热源或光源中的至少一个,其中回路激活热源或光源中的至少一个以引起与多个固体支持物中的至少一些相关的至少一种可检测的物理和/或化学变化。
33.在一些实施方案中,系统可以包括控制器,与控制器连通的检测器,具有被配置成鉴别单个样品的不同时间点的具有反应孔的设备的反应孔的信号检测区段中存在的信号的模块的图像处理器,以及动态解码模块。
34.反应孔可以具有至少一个小珠保留区段。
35.模块可以被配置成在反应后以及之后在至少一个限定事件前后鉴别阳性测定信号。
36.模块可以被配置成基于反应事件后和限定事件前后的鉴别的阳性测定信号进行多路小珠解码。
37.载有各小珠的小珠孔的中心线可以相隔以0.2至1000μm的距离。
38.本发明的进一步的方面包括多个固体支持物(例如,多路小珠组),所述多个固体支持物包括第一群体的固体支持物,所述第一群体的固体支持物包括第一浓度和/或比率的至少一种编码介质;以及,第二群体的固体支持物,所述第二群体的固体支持物包括第二浓度和/或比率的所述至少一种编码介质和至少一种另外的编码介质,其中至少一种编码介质和至少一种另外的编码介质的荧光激发和发射波长重叠,并且其中至少一种编码介质的第一和第二浓度是不同的并且第一和第二群体中的相应固体支持物上的不同浓度和/或比率的至少一种编码介质提供多种编码状态。
39.本发明的另一方面包括多个编码的分子识别元件,其中多个编码的分子识别元件包括第一群体的分子识别元件,所述第一群体的分子识别元件包含第一浓度和/或比率的至少一种编码介质;以及第二群体的分子识别元件,所述第二群体的分子识别元件包含第二浓度和/或比率的至少一种编码介质和至少一种另外的编码介质,其中至少一种编码介质和至少一种另外的编码介质的荧光激发和发射波长重叠,并且其中至少一种编码介质的第一和第二浓度是不同的并且第一和第二群体中的相应分子识别元件上的不同浓度和/或比率的至少一种编码介质提供多种编码状态。
40.在一些实施方案中,编码的分子识别元件包括两种以上(例如,2,3,4种以上)编码介质。
41.本发明的另一方面涉及包含如本文中所述的多个固体支持物的试剂盒。
42.要注意的是,虽然没有对其进行专门描述,但关于一个实施方案所述的本发明的方面可以结合在不同的实施方案中。即,所有实施方案和/或任何实施方案的特征可以任意方式和/或组合结合。申请人保留改变任何原始递交的权利要求和/或递交任何新的权利要求的权利,并且因此包括修改任何原始递交的权利要求以使其从属于任何其他的权利要求和/或结合任何其他的权利要求的任意特征(虽然初始并未以所述方式主张)的权利。本发明的这些及其他目标和/或方面在以下的说明书中被详细说明。本领域技术人员在阅读了随后的附图和优选实施方案详述(此种描述仅是对本发明的说明)之后将理解本发明的另
外的特征,优点和细节。
43.附图简述
44.结合在申请文件中并且作为申请文件的部分的附图图示了本发明的实施方案并且与说明书一起用于解释本发明的原理。
45.图1a是根据本发明的实施方案的分析系统的示意图。
46.图1b是根据本发明的实施方案的另一个分析系统的示意图。
47.图1c是根据本发明的实施方案的获得图像的计时图的示意图,其显示为在限定事件("de")前在第一时间的图像i1和在限定事件(de)后在第二时间t2的图像i2。
48.图1d是根据本发明的实施方案的获得图像的计时图的另一个示意图,其显示为在限定事件("de")前在第一时间的图像i1和在限定事件(de)后在第二时间t2的图像i2。
49.图2a是根据本发明的实施方案的固体支持物随时间的温度的图,其显示关于至少一个限定事件(de)(涉及合适时间的光漂白)的可以获得第一,第二和第三图像i1,i2和i3的时间点。
50.图2b是根据本发明的实施方案的固体支持物随时间的温度的图,其显示关于至少一个限定事件(de)(涉及热猝灭)的可以获得第一,第二和第三图像i1,i2和i3的时间点。
51.图3a
‑
c显示不同的编码的小珠群体的三个图像(即,图3a,3b和3c),所述小珠群体被加载到单个流体设备中并且通过作为限定事件的光漂白引起的荧光变化在获得的图像中以电子方式/光学方式区分。图3a显示各小珠群体的初始荧光强度是相似的。图3b显示在延长的光暴露后群体是容易分辨的。图3a和3b以相同的相机亮度/对比度设定显示。图3c图示定位图,所述定位图描绘了阵列孔中个体藻红蛋白pe(实心),量子点qd(小点)和混合物(条纹)的位置和身份。
52.图4是用pe,qd或pe和qd染料的混合物编码的小珠群体的光漂白特征曲线(归一化的荧光相对于时间/秒)的图。描绘了加载有各小珠群体的五个重复微芯片。
53.图5是光漂白后分选到直方图中的各小珠群体的频率(%)相对于端点归一化的荧光强度的图。各小珠组(pe,qd和mix)很好地区别于邻近的群体,这可以允许高的鉴别准确度。
54.图6是被加热至热限定事件的指定温度的流体设备的微孔阵列内密封的编码的小珠的归一化的荧光(%)相对于温度(摄氏度)的图。升高的温度在80℃以上优先猝灭来自藻红蛋白(pe)的荧光。
55.图7是这样的图,其显示加热后各小珠群体的频率(%)相对于归一化的荧光强度。热解码允许将具有相似初始荧光的不同的小珠群体彼此区分。
56.图8是根据本发明的实施方案的具有示例的珠孔阵列的微流体设备的顶视图。
57.图9a是具有常规珠孔阵列的微流体设备的顶视图。
58.图9b是图9a中显示的常规小珠孔的侧透视图。
59.图10a是根据本发明的实施方案的示例珠孔阵列的顶视图。
60.图10b是图10a中显示的小珠孔的侧透视图。
61.图11a是根据本发明的实施方案的另一个示例珠孔阵列的顶视图。
62.图11b是图11a中显示的小珠孔的侧透视图。
63.图12a是根据本发明的实施方案的另一个珠孔阵列的顶视图。
64.图12b是图12a中显示的小珠孔的侧透视图。
65.图13a
‑
13c是根据本发明的实施方案的示例分析系统的示意图。
66.图14a是根据本发明的实施方案的示例微流体芯片的顶视图。
67.图14b和14c是根据本发明的实施方案的图14a中显示的微流体芯片的示例可连接基底的顶视图。
68.图14d是根据本发明的实施方案的显示任选的间隔的微流体芯片的剖面图。
69.图14e是根据本发明的实施方案的显示相邻的反应孔之间的密封剂的使用的示例微流体芯片的剖面图。
70.图15是根据本发明的实施方案的分析系统的示意图。
71.图16
‑
18是流程图,其表示本发明的实施方案的示例方法。
72.图19显示根据本发明的实施方案的试剂盒的包装。
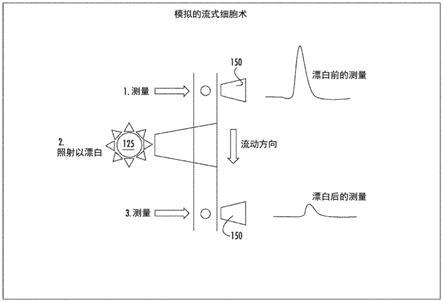
73.图20是根据本发明的实施方案的实例流式细胞术系统的示意图。
74.图21是根据本发明的实施方案的实例流式细胞术系统的另一个示意图。
75.图22是各群体的随时间的平均荧光值的图,其中使用虚线对顶部和底部5%的荧光值进行作图。
76.图23是来自六个编码的小珠群体的随时间的原始荧光强度数据的图。初始荧光值使“高”和“低”群体彼此区分,而光漂白确定使用的具体编码染料。
77.发明实施方案详述
78.现在在下文中将关于其中显示本发明的实施方案的附图和实施例来描述本发明。然而,本发明可以多种不同形式实施并且不应当被视为受限于本文中所述的实施方案。相反,提供这些实施方案以使本公开是充分和完全的,并且将向本领域技术人员全面地传达本发明的范围。
79.相似的数字始终是指相似的元件。在附图中,为了清楚,可以将某些线、层、组件、元件或特征的厚度放大。在文字和附图中,针对“图”的缩写“fig.”和“fig.”可以可互换地使用。
80.仅出于描述具体实施方案的目的而在本文中使用的术语并非意在限制本发明。如在本文中所使用的,单数形式“一个”、“一种”和“所述”也意在包括复数形式,除非上下文明确地另外指出。要进一步理解的是,当在本说明书中使用时,术语“包含”和/或“包括”规定所述的特征、步骤、操作、元件、和/或组件的存在,但是不排除存在或添加一个或多个其他特征、步骤、操作、元件、组件、和/或它们的组。如在本文中所使用的,术语“和/或”包括一个或多个相关列举项的任何一个和全部组合。如在本文中所使用的,短语如“在x至y之间”和“在约x至y之间”应当被解释为包括x和y。如在本文中所使用的,短语如“在约x至y之间”意指“在约x至约y之间”。如在本文中所使用的,短语如“从约x至y”意指“从约x至约y”。
81.除非另外定义,在本文中使用的全部术语(包括技术和科学术语)具有与本发明所属领域的普通技术人员所通常理解的相同的含义。要进一步理解的是,术语,如在常用词典中所定义的那些,应当被解释为具有与它们在说明书的上下文和相关领域中的含义一致的含义,并且不应以理想化或过度正式的意义来解释,除非在本文中明确地那样定义。为了简洁和/或清楚,可以不对公知的功能或结构详细描述。
82.应理解的是,当提到元件在另一个元件“上”、与另一个元件“附连”、与另一个元件
“
连接”、与另一个元件“偶联”、与另一个元件“接触”等时,其可以直接在另一个元件上、与另一个元件附连、与另一个元件连接、与另一个元件偶联或与另一个元件接触,或者也可以存在介于中间的元件。相反,当例如提到元件“直接在”另一个元件“上”、与另一个元件“直接附连”、与另一个元件“直接连接”、与另一个元件“直接偶联”或与另一个元件“直接接触”时,不存在介于中间的元件。本领域技术人员还要理解的是,提及与另一个特征“相邻”设置的结构或特征可以具有与所述相邻特征重叠或位于所述相邻特征以下的部分。
83.为了方便描述可以在本文中使用空间相关术语如“在......以下”、“在......下方”、“下部”、“在......之上”、“上部”等,以描述如在附图中所示的一个元件或特征与另外一个或多个元件或一个或多个特征的关系。应理解的是,除了在附图中描绘的方向之外,空间相关术语意在包括装置在使用或操作中的不同方向。例如,如果将在附图中的装置倒置,则被描述为在其他元件或特征“以下”或“之下”的元件之后定向在另外的元件或特征“之上”。因此,示例性的术语“在......以下”可以包括“在......之上”和“在......以下”的方向二者。可以将装置另外定向(旋转90度或在其他取向上)并且相应地解释空间相关的描述符。类似地,在本文中仅出于解释目的而使用术语“向上”、“向下”、“竖直”、“水平”等,除非具体地另外指出。
84.应理解的是,尽管可以在本文中使用术语“第一”、“第二”等以描述多种元件,这些元件不应被这些术语限制。这些术语仅用于将一个元件与另一个元件进行区分。因此,以下讨论的“第一”元件也可以被称为“第二”元件,而不违背本发明的教导。操作(或步骤)的顺序不限于在权利要求或附图中给出的顺序,除非具体地另外指出。
85.术语“微芯片”和“微流体芯片”可互换使用并且是指基本上平面的、薄的装置。微流体芯片可以是刚性的、半刚性的或柔性的。术语“薄”是指10mm以下如在10mm至0.1mm之间、并且可以是约3mm、约2.5mm、约2mm、约1.5mm、约1mm、或约0.5mm的厚度尺寸。微芯片典型具有小于约6英寸、更典型在约1英寸至6英寸之间的宽度和长度。微芯片可以具有小于长度尺寸的宽度尺寸。在一些实施方案中,微流体芯片可以具有约2.13英寸(54mm)的宽度尺寸和约3.4英寸(85.5mm)的长度尺寸。微芯片可以包括微米尺寸和/或纳米尺寸的流体通道。
86.术语“基本尺寸”是指流体通道的宽度和/或深度尺寸。
87.就流体通道而言,术语“微米尺寸”和“微流体”是指具有亚毫米或更小尺寸的宽度和/或深度的流体流动通道(例如,术语包括微米和纳米尺寸通道)并且包括具有至少一个宽度和/或深度在数百微米以下、典型小于900微米且大于1nm的尺寸范围内的区段的通道。流体通道或其部分可以包括基本尺寸为1nm至约900nm,更典型地约10nm至500nm的纳米通道。
88.珠孔阵列的珠孔的通道可以具有侧壁和形成为一个或多个基底的底板,从而具有开放的上表面和封闭的下表面以及在它们之间延伸的侧壁。可以使用一个或多个间隔体、顶部基底、膜或盖。顶部基底、膜或覆盖可以密封、覆盖或封闭反应孔的一个或多个流体通道和/或阵列的上表面。
89.术语“约”是指可以在 /
‑
20%以下如 /
‑
10%或5%之间变化的参数。
90.术语"固体支持物"包括一种或多种物体如,例如,微珠,芯片,平板,载玻片,针,平板孔,小珠,微球,纳米粒,微孔或其他可用于提供探针和/或引物的成员和/或可以与编码介质(如,例如,荧光化合物,化学发光化合物,放射性元件,和/或酶)和/或动态元件连接或
用其标记的成员。编码介质和/或动态元件可以直接或间接连接至固体支持物,如,例如,通过共价连接,非共价连接,和/或物理结合。在一些实施方案中,固体支持物可以是固体表面上打印的阵列。在一些实施方案中,固体支持物可以是微球。在一些实施方案中,固体支持物可以是固体表面,其上设置有样品,如,例如,化学和/或生物学组分(例如,组织样品),并且包含一种或多种编码介质的分子识别元件可以与样品的部分连接。分子识别元件可以包含或可以是抗体,适体,dna杂交探针,寡核苷酸,肽,蛋白,和/或其组合。在一些实施方案中,固体支持物可以包含易变的试剂和/或支持结合,其中的每个都可以允许自固体支持物分开。在一些实施方案中,一种或多种编码介质可以连接至固体支持物(例如,小珠或微球)以提供编码的固体支持物(例如,编码的小珠或编码的微球)。在一些实施方案中,一种或多种编码介质可以连接至分子识别元件(例如,抗体)以提供编码的分子识别元件(例如,编码的抗体)。在一些实施方案中,编码的分子识别元件可以被连接至颗粒和/或可以连接颗粒,如,例如,纳米粒。在一些实施方案中,编码的分子识别元件可以连接至固体表面,所述固体表面上设置有样品,这是由于编码的分子识别元件与固体表面上的样品中和/或上的元件样品的结合亲和力所致。因此,在一些实施方案中,编码介质可以不连接至固体支持物直至测定开始或完成或除非编码的分子识别元件结合至固体支持物上的样品上和/或中的元件。因此,本发明的方法可以包括在固体支持物上提供或结合一种或多种编码介质。在一些实施方案中,本发明的方法包括提供多个编码的分子识别元件并且使至少部分的编码的分子识别元件结合至固体支持物上的样品。在一些实施方案中,本发明的方法可以用于荧光显微术应用,包括例如组织,细胞和/或受体的免疫荧光定位和/或荧光原位杂交(fish)。
91.术语"小珠"或"珠"是指固相元件如颗粒,细粒或微球,典型地是磁性微球,其可以是多孔的,表面多孔的或非多孔的材料,如例如聚合物,塑料,玻璃,二氧化硅,金属或半金属氧化物(包括但不限于氧化铝,氧化钛,氧化锆或其他氧化物),量子点,金属颗粒等等,其可以适合于在反应孔中使用。在一些实施方案中,可以提供包含多个小珠(例如,微球)的多路小珠组,所述小珠被独特地编码以使小珠群体彼此区分。
92.术语"回路"是指完全的硬件实施方案或将软件和硬件相结合的实施方案。
93.样品中的分析物可以是来自样品的任何目标分析物,包括,例如,包含合成和/或生物大分子,纳米粒,小分子,dna,核酸/聚核酸,肽,蛋白等的多种混合物。分析物可以是一种或多种分析物分子。样品或样品的分析物可以包括一种或多种极性代谢物,如,例如,氨基酸和/或带电荷的分子,肽和/或蛋白。样品和/或分析物还可以或备选地包括提取自生物液体,血液,血清,尿液,干血,细胞生长培养基,裂解的细胞,饮料和/或食品的分子。样品还可以或备选地包括环境样品如水,空气和/或土壤。
94.术语"寡核苷酸"是指至少约五个核苷酸至约500个核苷酸(例如,5,6,7,8,9,10,12,15,18,20,21,22,25,30,35,40,45,50,55,60,65,70,75,80,85,90,100,125,150,175,200,250,300,350,400,450或500个核苷酸)的核酸序列。在一些实施方案中,例如,寡核苷酸可以为约15个核苷酸至约50个核苷酸,或约20个核苷酸至约25个核苷酸,其可以例如用作聚合酶链反应(pcr)扩增测定中的引物和/或杂交测定或微阵列中的探针。本发明的寡核苷酸可以是天然的或合成的,例如,dna,rna,pna,lna,修饰的主链等,或其任意组合,如本领域中已知的。
95.探针和引物(包括用于扩增和/或检测的那些)可以包含寡核苷酸(包括天然存在
的寡核苷酸如dna和合成的和/或修饰的寡核苷酸),所述寡核苷酸具有任意合适的长度,但是典型地为5,6或8个核苷酸的长度至40,50或60个核苷酸的长度,或更长。
96.探针和/或引物可以被固定或连接至固体支持物如,例如,小珠,芯片,针或微量滴定板孔,和/或与编码介质如,例如,荧光化合物,化学发光化合物,放射性元件,和/或酶连接或用其标记。
97.术语"编码介质"是指与固体支持物和/或固体支持物的材料和/或与固体支持物接触的材料相结合(例如,被应用于其上,附着至其上,与其结合,与其化合,用于制造或产生其等)的一种或多种介质(例如,化学品,蛋白等),所述介质提供和/或将产生相应固体支持物(可以是其中全部或部分)的编码信号。在一些实施方案中,一种或多种编码介质提供和/或产生可检测的编码信号,其允许区分固体支持物(例如,小珠)群体或亚群。例如,在一些实施方案中,一种或多种编码介质可以提供和/或产生与一种或多种编码介质连接的个体固体支持物(例如,小珠)的可检测的编码信号和/或一种或多种编码介质可以提供和/或产生与一种或多种编码介质连接的固体支持物的特定部分(例如,与包含一种或多种编码介质的分子识别元件结合的固体支持物的部分)的可检测的编码信号。
98.可以通过与固体支持物结合的一种或多种编码介质和/或通过固体支持物自身和/或与固体支持物结合的材料(例如,化合物)来提供和/或产生编码信号。在一些实施方案中,编码信号是由与固体支持物相结合(例如,被应用于其上,附着至其上,与其结合,与其化合,用于制造或产生其等)的一种或多种编码介质(例如,化学品,蛋白等)或由固体支持物产生的信号(例如,光信号和/或电信号)。可检测的编码信号可以是光学和/或电学可检测的,其可以利用人眼进行肉眼观察和/或被电子读取,检测和/或获得。可检测的编码信号可以包含强度,典型地处于限定的阈值或在限定的阈值之上,颜色(例如,颜色色调,颜色强度,和/或颜色值),颜色和强度,和/或尺寸,形状和/或放射性的变化。在一些实施方案中,可检测的编码信号包含发光强度,其可以包括荧光,磷光和/或化学发光强度。
99.相应固体支持物(可以是其中全部或部分)的编码信号可以是可检测的(例如,光可检测的,电子可检测的,电化学可检测的,静电可检测的,磁可检测的等)或可以不是可检测的。在一些实施方案中,相应固体支持物(可以是其中全部或部分)的编码信号可以变化。例如,相应固体支持物的编码信号可以由可检测的变化为不可检测的,由不可检测的变为可检测的,由更大的值变为更低的值(例如,由更大的信号振幅,荧光强度值,直径等),和/或由更低的值变为更高的值。相应固体支持物的编码信号的变化可以随时间发生和/或可以由于与固体支持物相关的至少一种化学和/或物理变化而发生。在一些实施方案中,固体基质的编码信号可以变化和/或可以由固体支持物存在于其中的环境的变化(例如,固体支持物和/或编码介质接触的溶液的变化)提供和/或产生。例如,固体支持物的编码信号可以变化和/或可以由磁行为,ph,光散射,物理尺寸(增加或减小),形状,折射率,溶解度,光吸收和/或发射强度或最大波长迁移,传导率,介电常数,粘度,和来自同位素衰减的放射发射,及以上的组合的变化提供和/或产生。
100."编码状态"是指多个固体支持物中的相应固体支持物的编码信号(可检测的或不可检测的)的特定组合,如,例如在两个以上时间点的特定固体支持物的两个以上编码信号,和/或固体支持物的特定部分的编码信号(可检测的或不可检测的)的特定组合(例如,固体支持物上的样品的特定区域或部分提供编码信号的特定组合)。对于相应固体支持物,
两个以上时间点的特定编码信号可以允许分别和/或鉴别特定群体或亚群体(例如,特定固体支持物(例如,小珠)群体或亚群)。在一些实施方案中,相应固体支持物在两个以上时间点的特定编码信号可以相同的和/或可以是不同的。各编码状态可以是彼此独特的和/或是彼此可检测的(例如,光和/或电可检测)和可区分的以提供可区分的群体。然而,各群体在第一时间点的编码信号可以与不同的群体在第一时间点的编码信号相同,而在第二时间点两个群体的编码信号可以是不同的,以致两个群体可以被区分和/或鉴别。在一些实施方案中,第一群体和第二群体的编码信号可以不同水平开始(例如,具有不同的信号振幅或值)但以相同水平结束。
101.术语"解码"是指至少部分基于来自编码的固体支持物和/或编码的分子识别元件的编码信号(典型地电子/程序)鉴别各样品(包括例如,固体支持物的样品和/或包含多个编码的分子识别元件的样品)的不同的群体。在一些实施方案中,解码至少部分基于比较与相应固体支持物相关的至少一种化学和/或物理变化之前、期间和/或之后的相应固体支持物(可以是其中全部或部分)的两个以上编码信号和/或是通过比较不同时间点的两个以上编码信号。在一些实施方案中,解码至少部分基于比较与个体固体支持物相关的至少一种化学和/或物理变化之前、期间和/或之后的个体固体支持物的两个以上编码信号和/或是通过比较个体固体支持物在不同时间点的两个以上编码信号。例如,包含多个固体支持物的样品可以包含6个不同的群体,并且因此包含6种不同的编码状态。检测和/或鉴别一个或多个编码信号可以允许解码样品以确定特定固体支持物群体的身份。在一些实施方案中,解码至少部分基于比较与固体支持物的特定部分(例如,固体支持物上的样品的特定区域或部分)相关的至少一种化学和/或物理变化之前、期间和/或之后的固体支持物的所述部分的两个以上编码信号和/或是通过比较固体支持物的所述部分在不同时间点的两个以上编码信号。不同的编码的分子识别元件可以提供多种编码状态并且检测和/或鉴别一个或多个编码信号可以允许解码样品以确定特定群体的身份和/或位置,如,例如,结合特定群体的编码的分子识别元件的元件的身份和/或位置。
102.在本文中被可互换地提及的术语"动态解码"或"时间域编码"是指基于多个(例如,2个以上)测量(典型地来自图像)(典型地自动)分析样品(包括例如,固体支持物和/或编码的分子识别元件的的样品)的编码信号以获得固体支持物随时间的编码信号。样品中的不同的群体(例如,固体支持物或分子识别元件的群体)可以具有可以随时间变化的各编码信号。所述变化可用于鉴别群体。例如,在一些实施方案中,时间域编码可以结合光漂白动力学以解码不同的群体。通过结合时间域,时间域编码可以解锁通过常规解码方法不可获得的额外的多路水平。
103.可以进行两个以上测量(例如,2,3,4,5,6等)以获得包含多个固体支持物的样品中的相应固体支持物和/或其中至少一部分的固体支持物提供两个以上编码信号的相应固体支持物的两个以上编码信号(例如,2,3,4,5,6等)。在一些实施方案中,第一编码信号测量可以在第一时间点进行并且第二编码信号测量可以在第二时间点进行。第一编码信号测量可以基于在第一时间点(例如,在进行测定之前、期间或之后,例如,在杂交反应之后)取得的第一图像和/或基于检测在第一时间点获得的光学或电信号。第二编码信号测量可以在第一时间点之后或晚于第一时间点获得。在一些实施方案中,第二编码信号测量以及一个或多个随后的测量可以在与固体支持物结合的化合物(例如,编码介质)的任何退出状态
寿命之后和/或在之前的测量后立即在大于1ms(例如,10ms,100ms,或1,2,3,4,5秒)的时间进行。第二编码信号测量可以基于在第二时间点取得的第二图像和/或基于检测在第二时间点获得的光学或电信号。可以进行和/或获得两个以上编码信号测量以检测固体支持物的样品中的特定固体支持物的特定时间点(例如,第一和第二时间点)的编码信号。
104.在一些实施方案中,可以在限定事件之前、之后和/或期间进行和/或获得编码信号测量。术语"限定事件"表示可以引起或导致与固体支持物相关的物理和/或化学变化的计划的事件。限定事件可以是被动的或动态的。在一些实施方案中,限定事件可以引起或导致动态元件的物理和/或化学变化。在一些实施方案中,限定事件可以引起或导致编码介质(例如染料,蛋白等)和/或固体支持物(例如,微球)的物理和/或化学变化。
105.如本文中使用的,"动态元件"是指响应于限定事件提供或显示物理和/或化学变化的化学和/或生物学化合物。物理和/或化学变化可以使相应固体支持物(可以是其中全部或部分)在一个时间点的编码信号相比于不同(例如,较早的)时间点的编码信号改变并且可以是可检测的(例如,光和/或电可检测的)。"动态元件"可以包括编码介质(例如染料,蛋白等)和/或固体支持物(例如,微球)。物理和/或化学变化可以是影响固体支持物的物理和/或化学变化(例如,所述变化可以是固体支持物的电荷和/或颜色的变化和/或可以是固体支持物的尺寸和/或形状的变化)。因此,动态元件可以是固体支持物和/或与固体支持物连接和/或结合的化合物。在一些实施方案中,物理和/或化学变化是影响与固体支持物结合的编码介质的物理和/或化学变化(例如,所述变化可以在于将编码介质结合至固体支持物的接头的稳定性,编码介质的溶剂可及性,和/或猝灭剂的存在和/或不存在)。因此,动态元件可以是编码介质和/或与编码介质(例如,猝灭剂)连接和/或结合的化合物。物理和/或化学变化可以是可逆的或不可逆的。在一些实施方案中,动态元件可以是编码介质。在一些实施方案中,限定事件可以选择性地激活编码介质或使其失活。实例限定事件提供在表1中。
106.表1.实例限定事件.
[0107][0108][0109]
可以使用一个或多个限定事件来解码一个固体支持物和/或多个固体支持物,并且相应固体支持物(可以是其中全部或部分)的编码信号可以也可以不响应于一个或多个
限定事件中的每个而变化。限定事件可以不是在使用固体支持物的测定和/或分析中典型地发生的事件。在一些实施方案中,限定事件是在使用固体支持物的测定期间发生的事件(例如,加热或光暴露)。限定事件可以导致部分的固体支持物(例如,任选地,与固体支持物连接和/或结合的编码介质)的化学和/或物理变化,其可以导致与特定编码状态相关的所述部分的固体支持物的编码信号的变化。实例静态编码信号和时间域编码信号提供在表2中。在一些实施方案中,除了一个或多个时间域编码信号以外,还可以使用静态编码信号来解码样品中的至少一个群体。
[0110]
表2.实例静态编码信号和时间域编码信号.
[0111][0112][0113]
不要将编码信号与测定染料信号(如果存在)弄混,并且动态元件,编码介质,和限定事件应当被配置和/或选择以致其不干扰测定。在一些实施方案中,如果染料被用于使用动态解码的测定,则测定染料可以是与用于动态解码的一种或多种动态元件和/或编码介质可区分的。例如,测定染料信号可以在光谱上距与动态元件的信号和/或编码介质的信号相关的信号有位移和/或测定染料可以使用与编码介质和/或动态元件不同的可检测的参数。备选地,编码介质和/或动态元件可以与测定染料在光谱上相似和/或具有与测定染料相同的幅度和/或强度;然而,在此情形中,限定事件可以引起编码介质信号和/或动态元件信号的变化以致其不再与测定染料在光谱上相似和/或具有与测定染料相同的幅度和/或强度并且因此与测定染料是可区分的和/或不再干扰测定。
[0114]
相同设备(例如,流体设备,典型地相同的小珠,其可以在相同的反应孔或虚拟阵列中)中的相同固体支持物可以用于第一和第二图像或用于检测第一和第二光和/或电信号。不同的图像的编码介质和/或动态元件可以具有相似的光谱性质。
[0115]
限定事件可以引起和/或导致与固体支持物相关的一种或多种物理和/或化学变化。在一些实施方案中,限定事件可以引起和/或导致固体支持物的环境的变化,其又可以
引起或诱发动态元件(例如,编码介质和/或固体支持物)的物理和/或化学变化以提供固体支持物的编码信号的变化(例如,多个固体支持物中的特定固体支持物的编码信号的变化或固体支持物的特定部分的编码信号的变化,所述固体支持物在所述固体支持物的不同部分包含多个编码信号),所述变化可以是视觉和/或电子可检测的(如果之后,检测可以经由光学或电检测器)。
[0116]
时间域编码可以包括将在特定时间点(例如,在限定事件之前)的相应固体支持物的编码信号与在不同的时间点(例如,在限定事件之后)的相应固体支持物的编码信号比较以鉴别编码信号和/或固体支持物所属的特定群体。在一些实施方案中,相应固体支持物的第一编码信号在限定事件之前或期间的第一读取(reading)(例如,检测光学或电信号)和/或第一图像中获得并且至少一个第二读取和/或第二图像在第一图像之后获得从而获得相应固体支持物的第二编码信号。第一和/或第二读取和/或图像可以包含多个不同的编码信号,其对应于不连续的固体支持物或固体支持物上的样品上和/或中的不连续的位置和/或实体。不同的编码信号测量和/或图像可以获得自普通的检测器,例如,当在样品分析期间流体设备和/或流体设备的固体支持物被保持在相同温度并且检测器以相同波长运行时。不同的编码信号测量和/或图像可以彼此在约1微秒至约50小时内获得,并且在一些实施方案中,彼此在约1ms至约10分钟内获得(例如,彼此在1秒至1分钟或1秒至约10分钟内获得)。
[0117]
可以在一种或多种限定事件和/或与固体支持物相关的一种或多种物理和/或化学变化之前,期间和/或之后获得两个以上(例如,2,3,4,5,6等)编码信号测量和/或图像。编码信号测量和/或图像可以使用一种或多种波长带(例如,1,2,3,4,5等)获得。在一些实施方案中,两个以上编码信号测量和/或图像可以在限定事件和/或与固体支持物相关的至少一种物理和/或化学变化之前获得。例如,第一图像可以在蓝色激发波长带中获得,第二图像可以在绿色激发波长带中获得,并且第三图像可以在红色激发波长带中获得,第一,第二和第三图像中的每个在限定事件和/或与固体支持物相关的至少一种物理和/或化学变化之前获得。在一些实施方案中,可以在限定事件和/或与固体支持物相关的至少一种物理和/或化学变化期间和/或之后获得两个以上编码信号测量和/或图像。例如,图像可以在各个以下中获得:蓝色激发波长带,绿色激发波长带,和红色激发波长带,三个图像中的每个在限定事件和/或与固体支持物相关的至少一种物理和/或化学变化期间和/或之后获得。因此,本发明的实施方案可以包括获得多个编码信号测量和/或图像,其可以在多个波长带中获得。在一些实施方案中,两个以上编码信号测量和/或图像可以在两种以上限定事件和/或与固体支持物相关的两种以上物理和/或化学变化之前,期间和/或之后获得。例如,第一图像可以在第一限定事件和/或与固体支持物相关的第一物理和/或化学变化之前取得,第二图像可以在第一限定事件和/或与固体支持物相关的第一物理和/或化学变化之后取得,并且第三图像可以在第二图像后并且在第二限定事件和/或与固体支持物相关的第二物理和/或化学变化(任选地相同或不同的固体支持物)之后取得。
[0118]
限定事件可以提供动态元件的物理和/或化学变化,所述变化是,例如,热诱导的变化(其也可以用于测定),压力诱导的变化,光诱导的变化,自然放射性同位素衰减,化学诱导的变化,或任意以上的组合。时间域编码可以开发各编码介质的限定的稳定的,部分稳定的,选择性激活的,和/或不稳定的性质(例如,有机蛋白染料的变性和/或由于例如ph,热或光敏易变结合所致的化学结构的改变)以导致编码信号(如,例如,与各编码介质连接的
固体支持物的编码信号或与各编码介质连接的分子识别元件的编码信号)的变化。例如,当编码信号是强度值时,物理和/或化学变化可以导致强度值在第一和第二图像和/或读取之间增加或减小例如至少0.01%,更典型地在第一和第二图像和/或读取之间增加或减小至少1
‑
20%。增加或减小可以足以使强度水平例如从高到低,从低到高,从中等到低,从低到中等,从高至中等或从中等到高,从零到低,从高或中等或高,低或中等到零。术语高,中等和低分别是指第一,第二和第三水平,其中第一大于第二和第三,第二介于第一和第三,第三小于第一和第二。在一些实施方案中,在高低水平之间可以设置两种以上不同的水平(即,在高低水平之间存在超过一种水平)。
[0119]
编码介质可以包含封装的染料,所述染料是光敏性的并且在足量的光暴露后被选择性地激活从而增加强度。
[0120]
当在本文中使用时,术语"相似的光谱性质"或"在光谱上相似"是指这样的编码介质(例如,染料)和/或动态元件,其具有相似的激发和/或发射波长并且响应于以单个波长或单个波长范围或通带运行的光源产生可检测的荧光强度以致其在图像和/或读取中是不可区分的。
[0121]
术语"猝灭"是指通过外部环境影响(如猝灭剂)分子间地或通过非放射性方法通过取代分子内地使激发的分子实体(例如,编码介质)失活。猝灭剂是这样的分子实体,其使编码介质的激发态失活(猝灭),通过能量传递,电子传递或通过化学机制。
[0122]
至少一种编码介质和/或动态元件的荧光强度可以在作为限定事件的猝灭事件后减小。备选地,至少一种编码介质和/或动态元件的荧光强度可以在限定事件后增加。
[0123]
术语"漂白"是指吸收或发射强度的损失。
[0124]
聚合酶链式反应(pcr)可以根据已知技术进行。参见,例如,美国专利号4,683,195;4,683,202;4,800,159;和4,965,188。通常,pcr包括,首先,将核酸样品(例如,在热稳定dna聚合酶的存在下)与针对待检测的特定序列的每条链的一个寡核苷酸引物在杂交条件下进行处理,从而合成与每个核酸链互补的每个引物的延伸产物,并且引物与特定序列的每条链充分互补以与其杂交,从而由每个引物合成的延伸产物当与其互补序列分离时可以充当用于另一个引物的延伸产物的合成的模板,并且之后这些变性条件下处理样品以在存在待检测的一个或多个序列的情况下将引物延伸产物与其模板分离。循环重复这些步骤直到得到所需的扩增程度。通过向反应产物中加入能够与反应产物杂交的寡核苷酸探针(例如,本发明的寡核苷酸探针),所述探针携带可检测标记物,并且之后根据已知技术检测标记物,或者通过在凝胶上的直接可视化,可以进行扩增的序列的检测。也可以通过将嵌入染料加入至反应混合物中并且监测将会与双链dna的总质量成比例的荧光信号强度来检测扩增的序列。尽管针对pcr反应或核酸和蛋白elisa描述了根据本发明的实施方案,但应理解的是,可以使用其他核酸扩增方法,如逆转录pcr(rt
‑
pcr),包括等温扩增技术如滚环扩增或环介导的等温扩增(lamp)。
[0125]
dna扩增技术,如前述的,可以包括使用探针、一对探针、或两对探针,所述探针与含有目标多态性或突变的dna特异性结合,但是在相同杂交条件下不与不含有目标多态性的dna结合,并且所述探针充当用于在扩增反应中的dna或其一部分的扩增的一个或多个引物。这样的探针在本文中有时被称为扩增探针或引物。
[0126]
术语“试剂”是指加入至系统中从而产生化学反应或者加入以查看是否发生反应
的任何物质或化合物,包括引物、核酸模板和扩增酶。扩增试剂是指除了引物、核酸模板和扩增酶之外的通常用于扩增的那些试剂(脱氧核糖核苷三磷酸、缓冲液等)。通常,扩增试剂连同其他反应组分一起放置并且容纳在反应容器(试管、微孔等)中。
[0127]
如在本文中所使用的术语“磁性”包括铁磁性、顺磁性和超级顺磁性性质。
[0128]
通常,用于检测含有目标多态性或突变的dna的寡核苷酸探针是与编码所述突变或多态性的dna结合、但是在相同杂交条件下不与不含有突变或多态性的dna结合的寡核苷酸探针。寡核苷酸探针用适合的可检测基团如以下给出的那些可检测基团标记。这样的探针在本文中有时被称为检测探针或引物。
[0129]
图1a是流体分析系统100的示意图,流体分析系统100具有包含控制器12的控制回路100c,具有至少一个光学滤镜组18的检测器150和解码模块40,解码模块40被配置成分析与使用微流体设备20的测定相关的来自固体支持物10的编码信号。图1b是另一个流体分析系统100的示例实施方案,所述流体分析系统100具有包含控制器12的控制回路100c,具有至少一个光学滤镜组18的检测器150和解码模块40,其中检测器150可以产生限定事件(例如,光学激发,光漂白等)。该实施方案显示相对于其他实施方案与常规测定系统相比不需要额外的硬件组件。至少一个光学滤镜组18可以被配置成以所需发射波长运行,如,但不限于,单个不连续的波长和/或通带范围,如约10nm至1000nm用于激发和成像,并且在特定实施方案中对于激发约545/30nm并且对于成像约620/60nm。在一些实施方案中,光学滤镜组18可以被配置成以在紫外(uv)范围中(例如,以在400nm至10nm的范围中的波长),在红外(ir)范围中(例如,以在700nm至1mm的范围中的波长),和/或在可见光范围中(例如,以在390nm至700nm的范围中的波长)和/或任何范围和/或其中的个体值的波长运行。在一些实施方案中,光学滤镜组18可以不是基于荧光的并且可以是光学的,如,例如,偏振滤镜,用以检测光散射的变化。如果变化是基于尺寸的,则可以不需要滤镜,而是需要成像和测量尺寸的能力。
[0130]
微流体设备20可以具有珠孔阵列30,珠孔阵列30布置有容纳各小珠25的小珠孔10。控制器12也与能够产生限定事件的至少一个设备125(例如,热源和/或光源)连通,所述限定事件可以改变小珠孔10中的小珠25的环境以用于动态解码和/或可以引起动态元件的物理和/或化学变化。
[0131]
解码模块40可以包括与限定的小珠群体的不同的编码介质相关的不同的群体的相关表和/或数据库或与其连通。
[0132]
设备125可以包括光源和/或热源和/或液体源用以改变孔环境等,所述光源被配置成发射限定波长的光达限定的时间以选择性地激活,光猝灭和/或光漂白具有响应于所述光源的一种或多种动态元件(例如,编码介质)的小珠25,所述热源被配置成使小珠25升至临界温度,所述液体源与小珠孔10中的小珠25液体连通。系统100可以被配置成评估光漂白后至少一种可检测的参数的恢复。此恢复对于在不同环境中的不同材料/荧光团可以是不同的并且差异可被开发用于解码。
[0133]
如图1c所示,限定事件(de)可以在通过检测器150获得第一图像i1后并且在获得第二图像i2前发生。备选地,如图1d所示,获取第一图像i1的动作可以处于限定事件中并且自身是限定事件,所述限定事件导致可测量的变化以用于在第一图像i1后获得第二图像i2。
[0134]
在一些实施方案中,限定事件de可以使珠孔阵列30产生限定的环境变化,在珠孔
阵列30中产生限定的环境变化和/或产生关于珠孔阵列30的限定的环境变化,如至少一个主动引起或施加的热变化t(其可以是温度上升或下降,虽然通常是上升并且,例如,开发动态元件(例如,编码介质)在限定的温度的热不稳定性),化学变化c,(例如,可以多种方式引入的ph变化),和/或光学变化o,如引入光,任选地以限定的光波长和/或强度,例如,用于充分暴露以提供猝灭作用从而开发光不稳定性。第二图像i2可以在限定事件de后获得。系统100可以比较来自第一和第二图像i1、i2的强度值32s以鉴别固体支持物(例如,小珠)群体/亚群。如所示,第二图像i2可以包括稳定的(基本不变的编码信号32s
s
)和变化的强度值32s
c
并且该"指纹"或编码信号可用于使测定多路化。第一图像i1,第二图像i2和/或随后响应于另一限定事件de获得的另外的图像可用于多路分析以鉴别各单个样品的靶标。另外的限定事件可以是相同类型的,例如,如果是温度,则可以使用比第一限定事件时的温度更高的温度。另外的限定事件可以是与第一或之前的限定事件不同类型的限定事件,例如光漂白后的温度变化。另外的限定事件可以引起与之前的限定事件相同性质的变化,例如导致一些群体荧光强度下降的温度变化可以跟着导致相同和/或不同群体的固体支持物的荧光强度下降的光漂白事件。备选地或此外,另外的限定事件可以引起与之前的限定事件不同的固体支持物性质的变化,例如通过膨胀或溶解导致一些群体的固体支持物尺寸改变的温度变化可以跟着导致相同和/或不同群体的固体支持物的荧光强度下降的光漂白事件。
[0135]
在一些实施方案中,量子点(qd)和荧光有机染料和/或荧光蛋白之间的光稳定性差异可用于编码固体支持物,例如,小珠,特别是如果二者具有相似的光谱性质。例如,光漂白动力学可用于解码固体支持物。有机染料可以产生高荧光强度但是在延长的光暴露后可能易于发生光漂白。然而,量子点在额外的光暴露后通常不发生光漂白而是倾向于保持或增加荧光发射。参见,例如,bouzigues等,biological applications of rare
‑
earth based nanoparticles.acs nano 2011,5,8488
‑
8505;和wang等,luminescent nanomaterials for biological labelling.nanotechnology 2006,17,r1
‑
r13。这些文献的内容通过引用完整地结合于此。
[0136]
如本领域技术人员已知的,量子点是半导体材料的纳米级别的颗粒,其可用于多种实验目的,如在常规使用中标记蛋白。在一些实施方案中,限定波长(例如,约605nm)的qd可与有机染料(od)和/或荧光蛋白(fp)一起用作编码介质。有机染料(od)可以是小分子。qd,有机染料和/或荧光蛋白可以具有不同的热稳定性。qd,od和/或fp可以具有相似的荧光激发/发射波长。激发/发射波长的非限制性实例包括545/30nm和620/60nm并且可以利用单个滤镜组成像。本发明的实施方案预期任何可用于发光(例如,荧光)或其他用于时间域编码的可检测参数的量子点,荧光蛋白和/或有机染料。可用于本发明的方法的量子点的实例包括但不限于,包含镉,铟,铅,硫,硒,碲,锌和/或磷的那些,如,例如,cds,cdse,cdte,inp,pbs,pbse和zns。可用于本发明的方法的有机染料的实例包括,但不限于,荧光素,cy3(cy3.18),tamra,texas red(sulforhod
‑
amine 101),nile red,cy5(cy5.18),atto740,cy7,alexa fluor 750,ir125(icg)。参见,例如,http://www.fluorophores.tugraz.at/substance。荧光蛋白(fp)的实例包括,但不限于,藻红蛋白,别藻蓝蛋白和绿色荧光蛋白(gfp)。
[0137]
小珠或其他固体支持物可以用有机染料,荧光蛋白(或蛋白染料),qd或两种以上相同或不同类型的混合物(mix)编码以产生可比较的初始荧光信号。然后可以将小珠或其
他固体支持物用于测定,如,例如,小珠可以被加载到微流体微孔阵列设备中,用油封以将个体小珠孔与其相邻孔分离,并且在限定事件之前,之后和/或期间成功地成像。例如,参见图2a,固体支持物(例如,小珠)的温度可以被保持在限定的温度,并且第一图像i1可以在限定事件de1前(例如,在1微秒
‑
50小时光漂白(典型地约1秒至约3分钟光漂白)之前)取得并且第二和第三图像i2和i3可以在限定事件后,如,例如,在de1和/或de2后取得。光漂白可以基于光能,所述光能可以在任何相关或实际时间尺度上递送,这取决于测定。
[0138]
图2b显示示例热猝灭和成像顺序的另一个实施方案,其中固体支持物(例如,小珠)的温度至少一次增加至限定事件的限定阈(临界温度)值,并且第一图像i1可以在限定事件(例如,温度的第一次提高)之前取得而第二图像i2可以在温度回到设定值后取得(从而具有对于检测器的相同的相关运行参数)。术语"临界温度"是指动态元件(例如,编码介质)发生物理和/或化学变化的温度。图2b也显示更高阈值温度的第二限定事件,其后可以获得第三图像i3。在一些实施方案中,限定事件可以包括光暴露(例如,光漂白)编码的固体支持物达指定的时间,如,例如,1微秒以上,典型地约1秒至10分钟,如5秒以上,如,例如,1,5,10,15,20,25,30,35,40,45秒或1,2,3,4,5分钟以上。
[0139]
在一些实施方案中,获得第一图像,读出,和/或可以包括第一图像i1的固体支持物(例如,多个固体支持物)的光学或电信号的检测,可以在测定之前取得并且测定本身可以产生限定事件(例如,测定期间的热和/或光暴露)。在一些实施方案中,第一图像,读出,和/或检测固体支持物的光学或电信号可以在测定完成后并且在限定事件前取得,并且所述图像,读出和/或检测可用于确定初始荧光强度和/或充当数据归一化的参比。比较限定事件之前(包括参比图像)和之后的图像,读出和/或信号可以显示在限定事件后是否发生了与固体支持物相关的化学和/或物理变化(图3a
‑
c)。
[0140]
如图3a中所示,在光暴露之前,在图像中,用fp,qd或两者的混合物编码的小珠产生相当的初始荧光信号,所述初始荧光信号是不可区分的,因为其具有相似的光谱性质。相比之下,如图3b中所示,在光暴露后,用fp编码的小珠在3min的过程里经历显著的漂白而qd编码的小珠不受延长的光照影响,如其在相同时间里稳定的荧光所证明的。图3b还显示用两种染料的混合物标记的小珠显示中等的漂白,不如fp编码的群体的范围大。因此,两种染料的不同混合物可以提供显示不同水平漂白的小珠从而提供多种不同的荧光编码状态,其可用于鉴别各小珠群体(图3c)。将荧光衰减特征曲线作图显示各小珠组彼此很好区分(图4)。考虑到在各小珠群体(n=各自5个重复微芯片,总计>50k小珠)内观察到的相似的漂白率,还证明此种动态解码方法的精度是高的。
[0141]
当在本文中关于编码介质,动态元件和/或信号(例如,荧光信号)使用时,"不可区分"是指在对于给定测量系统的支持物群体的标准偏差,置信区间,和/或标准误差内的信号和/或参数(例如,颜色,尺寸,和/或在给定波长的强度值(例如,荧光强度值))。因此,当两种编码介质和/或动态元件不可区分(例如,两种编码介质和/或动态元件的荧光信号是不可区分的)时,两种编码介质和/或动态元件的信号或参数(例如,荧光信号的强度值)不可用于鉴别和/或分别信号或参数对应于哪个编码介质和/或动态元件。因此,无法确定信号(例如,荧光信号)是来自两种编码介质和/或动态元件中的哪一个。可以存在一个分布范围,特定群体中的编码的元件(例如,编码的小珠或编码的分子识别元件)的编码信号可以落在所述分布范围内。只要另一编码的元件的分布范围不与另一群体的分布范围重叠或落
在其内,则可以确定两个群体的编码状态以致其可以被区分。在一些实施方案中,由于单个群体中的编码的元件的测量的变化,每种编码状态可以由一个范围的值来限定。该范围可以不是单个编码的元件的测量的标准偏差。
[0142]
在一些实施方案中,在包含多个固体支持物的样品中,部分的固体支持物可以具有不可区分的初始强度而另一部分的固体支持物可以具有可区分的初始强度。在一些实施方案中,即使两个固体支持物可以具有可区分的强度,如果强度值落在固体支持物群体内,则固体支持物可以编码相同的固体支持物群体。一些实施方案包括两种以上不同的群体,其中亚群体具有不连续且可区分的不同的强度水平,但是这些亚群体可以含有仅在限定事件后可区分的另外的亚群体。
[0143]
可以测量各个体小珠群体的终点荧光衰减值。例如,测量用fp,od,qd或试剂混合物编码的小珠的终点荧光衰减值,并且然后将这些值对初始小珠强度进行归一化并且分选到直方图中。图5显示小珠类型的强度分布。在该实例中测量的三个不同的群体彼此被很好地区分,产生>99.98%的鉴别准确度。此种高分辨率将允许在被加载到阵列中并被动态解码后容易地明确地鉴别在单个样品中合并在一起的小珠。
[0144]
在一些实施方案中,固体支持物和/或分子识别元件可以包括一种、两种或更多种编码介质以便提供两种以上,典型地约2至约10,000种(或更多)代表可以使用一种以上限定事件区分和/或鉴别的不同群体(例如,约2,3,4,5,6,7,8,9,10,20,50,100,200,500,1,000,2,000,3,000,4,000,5,000,6,000,7,000,8,000,9,000,10,000或更多)的不同编码信号。一些实施方案包括使用一种以上限定事件相对于彼此处于或能够产生不同荧光水平的不同群体(例如,不同的固体支持物群体和/或不同的分子识别元件群体)。例如,固体支持物可以包括对应于第一群体的第一编码介质和对应于第二群体的第二编码介质,第一和第二编码介质可以相同或不同并且各自可以具有初始荧光强度水平。在一些实施方案中,第一和第二编码介质的初始荧光强度水平相同或基本相同。在其他实施方案中,第一编码介质的初始荧光强度水平不同于第二编码介质的初始荧光强度水平。不需要所有的固体基质都具有编码介质或者一些群体可以具有单一染料。染料可以是稳定的并且对于一些固体基质群体可以不产生和/或显示物理和/或化学变化。
[0145]
第一和第二群体中的每个可以包括一种以上的亚群,如以上所述,其中各亚群体可以具有相同或基本相同初始荧光强度水平。认识到不同的系统将以不同的分辨率和能力运行,在一些特定实施方案中,关于荧光强度水平的术语"相同或基本相同"在一些实施方案中可以是指归一化的荧光强度值和/或一个值的
±
0.15以下(例如,
±
0.1或0.05)的变化以致其保留在限定水平(例如,高,中,低)的限定范围内。例如(并且不受限制),具有编码介质的小珠可以具有0.7的归一化的荧光强度值并且具有相同或基本相同荧光强度水平的小珠可以具有0.55至0.85的归一化的荧光强度值。
[0146]
如上所述,使用用fp或qd或混合物编码的小珠,产生彼此基本相似(不能可靠或准确地区分)但是不同于图3a中所示初始荧光强度水平(亮度/强度较低)的初始荧光强度水平。据显示,这些小珠相似地光漂白成较亮的小珠,产生三个更加漂白可区分的亚群体或编码状态,与图3a
‑
c中所示的那些类似。这最终提供额外的多路能力,其中单个波长鉴别三种可区分的强度变化(fp,qd和混合物)。
[0147]
因此,将时间域结合到解码和/或多路测定(例如,基于多路小珠的生物测定)中可
以极大地提高不同多路编码状态的数量。利用常规方法仅可以实现两种编码水平,而动态解码方法产生至少两个可分辨的群体或编码状态。这些益处可以显著增强基于小珠的poc测定的多路能力同时还使所需的分析仪器的成本和复杂性最小化。
[0148]
在一些实施方案中,可以提供在单一初始荧光强度水平的另外的固体支持物(例如,小珠)群体。在一些实施方案中,通过对编码的小珠进行预分选可以提供在单一初始荧光强度水平的更多的小珠群体。在一些实施方案中,所述方法可以在不使用用于所述分析的单一、共有的检测波长的情况下推广至其他波长(例如,1,2,3,4,5,6,7,8,9,10或更多不同的波长或光谱带或范围)以增加可以实现的多路水平的量。
[0149]
将时间域结合到固体支持物解码策略中可以使用不同于不同编码染料的光稳定性差异的策略进行。在一些实施方案中,备选的或另外的动态编码策略是利用编码介质的热稳定性。例如,蛋白和/或有机染料可以在升高的温度对热变性敏感。然而,qd是在升高的温度稳定的半导体材料。这些染料的这些性质可用于动态解码实施方案中。
[0150]
用fp或qd标记微球以致各群体显示不可区分的初始荧光。然后将各小珠群体加载到微芯片用于成像,如前所述。图像首先在25℃获取以确定初始荧光强度并且还充当数据归一化的参比。然后将芯片加热至升高的温度以使fp变性,然后冷却回25℃并且再次成像。加热前和加热后的图像之间的荧光强度的损失允许确定小珠群体的身份。图6显示在加热小珠后归一化的荧光信号的减小。由于在≥70℃的温度破坏了链霉亲和素
‑
生物素结合,随温度增加观察到信号减小。fp和qd都经由链霉亲和素
‑
生物素化学缀合至小珠。然而,在更高的温度,fp开始变性并且其荧光显著下降。该差异性猝灭可用于以良好的分辨率鉴别不同编码的小珠(图7)。
[0151]
如图6和7所示,结合动态元件(即,在温度随时间变化时变性的荧光蛋白(fp))允许在不使成像系统复杂化的情况下获得之前无法获得的多路编码水平。在一些实施方案中,在时间域中结合温度变化可用于基于pcr的测定,其中加热元件已经就位以用于热循环,因此不需要额外的组件用于热分辨多路化。在一些实施方案中,可以改变固体支持物(例如,小珠)和/或缓冲剂组合物上的染料的浓度以增强和/或增加固体支持物群体之间的分辨率和/或允许产生并鉴别额外的可区分的群体。
[0152]
根据一些实施方案,时间域测量可用于解码编码的固体支持物(例如,小珠组),其中一种以上化合物(例如,动态元件如编码介质)已被添加至部分的固体支持物(例如,小珠的亚组)。所述一种以上化合物可以是响应于限定事件提供物理和/或化学变化的动态元件。在一些实施方案中,所述物理和/或化学变化可以是可观察的变化。例如,在一些实施方案中,所述一种以上化合物可以提供在由一种以上的化合物(例如,编码染料)的量子效率的变化引起的温度变化期间观察到的荧光信号变化。在一些实施方案中,在激活后向一个或多个部分的固体支持物添加热易变的或光激活的化合物(例如光激活的酸如三芳基锍/六氟锑酸盐)可以导致固体支持物的化学性质(例如ph)的变化,所述化学性质的变化影响编码介质(例如荧光素)的荧光性质的变化。备选地,具有或构成对ph或传导率变化敏感的传感器或电极或电极阵列的反应孔(例如ion torrent platform,https://www.thermofisher.com/us/en/home/brands/ion
‑
torrent.html)中所含的固体支持物可以直接测量这些变化。
[0153]
在一些实施方案中,部分的多个固体支持物可以包括易变的针对一种以上动态元
件的连接化学,其在激活(例如,温度变化,ph变化,溶剂添加/去除等)后提供物理和/或化学变化,所述变化在一种以上编码化合物消失于周围溶液时产生结果(例如fitc
‑
生物素,在加热后自链霉亲和素包被的小珠释放,并且在测定孔内含有的液体中被检测)。在一些实施方案中,可以使用易变的和非易变的(分别例如热易变的或可光分解的链霉亲和素
‑
生物素结合以及稳定的共价化学结合)编码介质的混合物。
[0154]
一些实施方案包括使用编码介质(例如,染料)作为对猝灭剂(氧,dabsyl,black hole quenchers,iowa black等)具有变化的敏感程度的动态元件以致在添加或去除所述猝灭剂后,可以鉴别不同的群体(例如,小珠群体)。在一些实施方案中,动态元件可以包括猝灭剂并且可以保护一种以上化合物避免猝灭剂作用(例如,通过囊封,与蛋白结合等)并且这可用于增强染料间的差异并且允许鉴别不同的群体。在一些实施方案中,这可以流式细胞术形式实现,通过在初始读数后在系统的上游在护套流(sheath flow)液中添加猝灭剂。实例流式细胞术系统显示在图20中,其中描绘了光漂白前后的测量。另一个实例流式细胞术系统显示在图21中,其中描绘了ph转变前后的测量。备选地,可以通过添加护套流来改变ph,有机溶剂强度,离子强度或其他此种性质从而实现固体支持物的编码性质的可检测的变化。
[0155]
在一些实施方案中,用于动态解码固体支持物群体的方法可以在化学和/或生物化学测定中采用时间域。实例测定包括,但不限于,免疫测定,核酸杂交阵列,pcr,rt
‑
pcr,rt
‑
qpcr等。
[0156]
本发明的方法可以与固体支持物(如,例如,小珠和非小珠的基质,如固体表面上打印的阵列)一起使用。在一些实施方案中,本发明的方法可以包括光致抗蚀剂(photoresist)或“打印的”条形码试剂,其中各颗粒的条带或截面可以变化并且因此产生不同的群体。可用于本发明的方法的化合物包括,但不限于,荧光团,发色团,可光分解的或光激活的化合物,热激活的或可热分解的化合物或官能团,和/或结合放射性同位素或磁性或导电元件的化合物。固体支持物也可以被改变成响应于限定事件而改变构象,形状,和/或其他物理性质,通过方法如,但不限于,使用具有不同的物理和热性质或针对特定群体的聚合物链间变化的交联程度的不同聚合物。
[0157]
在一些实施方案中,本发明的方法被用于在pcr后检测两个以上不同的核酸群体。pcr具有很多应用,例如检测痕量核酸以确定致病生物,基因表达,基因型,遗传改造或修饰的存在,以及法医科学应用。pcr扩增在大的分析物浓度范围内提供出色的靶标鉴定和量化。然而,通过pcr同时和量化分析多种分析物被证明是有挑战性的。基于插入染料荧光的检测仅能够确定总dsdna浓度并且因此使用该检测方法同时分析单个反应容器中的多个模板是不可能的。荧光探针技术(例如,taqman,分子信标或其他化学)可用于反应的低水平多路化,因为可以使用不同颜色荧光探针作为信号报告物来扩增各靶标。探针也是序列特异性的,这减少来自引物二聚体形成或非特异性扩增的假阳性。利用常规微量滴定板或微流体实时pcr(rt
‑
pcr)的典型多路化方法是使用少量的反应孔,所述反应孔各自含三种不同的颜色探针。然而,通常认为设计多路引物和探针组是有挑战性的,引物其需要额外水平的细心设计和优化以保证彼此的相容性。通过该方法进行多路化最终受限于仪器使用和染料间的光谱重叠,受限于四色检测,其中一种颜色典型地被保留为内标染料。然而,本发明可以提供增加测定多路化的方法。
[0158]
图8显示根据本发明的实施方案的具有珠孔阵列30的微流体设备20。设备20可以包括冻融阀22,冻融阀22具有与珠孔阵列30流体连通的微流体通道20ch。
[0159]
参见图9a,9b,10a,10b,11a,11b,12a和12b,显示具有用于改进的信号检测的几何结构的小珠孔10的实例。如图9a和9b中所示,固体基质25可以结合有具有圆形周长的常规小珠孔10(典型地圆柱形或圆锥形孔),所述孔被配置成容纳小珠。在其他实施方案中,如图10a,10b,11a,11b,12a和12b中所示,例如,根据本发明的实施方案的小珠孔10具有这样的几何结构,其中小珠保留区段11和与其相邻的信号检测区段15流体连通。
[0160]
小珠孔10可以被设置在相对密集的阵列30中,所述阵列具有紧密隔开的小珠孔10。小珠孔10可以被布置在行和列中或彼此偏移。可以规律重复图样,不规律重复图样或以其他图样设置小珠孔10。术语"密集"表示流体分析设备的足迹可以具有约100
‑
6000个孔10/mm2和/或10,000至5,000,000个孔10/cm2,典型地约6,000至约2,000,000个孔10/cm2,更典型地约500,000至约2,000,000个孔10/cm2。
[0161]
相邻的孔10中的一些或全部可以具有以下间隔距离:0.11
‑
1,000μm如约1μm,2μm,3μm,4μm,5μm,6μm,7μm,8μm,9μm,10μm,11μm,12μm,13μm,14μm,15μm,16μm,17μm,18μm,19μm,20μm,100μm,200μm,300μm,400μm,500μm,600μm,700μm,800μm,900μm,1000μm或其间的任何分数(以相邻的小珠保留区段11的中线至中线测量)。
[0162]
孔10中的一些或全部可以都是结合有扩增试剂的反应孔10。孔10中的一些或全部可以处理亚pl反应体积。
[0163]
信号检测区段15可以任选地包含短的和/或长的流体通道15ch,所述流体通道将信号检测区段的末端15e与小珠保留区段11相连。信号检测区段15可以包括与小珠保留区段11以距离"l"隔开的末端15e,典型地l为靶标小珠直径的30%至约10,000%(.3x至约100x),更典型地为靶标小珠直径的约.3x至约10x。在一些实施方案中,l可以为靶标小珠直径的1x至5x。例如,对于3.2μm直径小珠,长度l可以为约1至约320μm,更典型地为1至32μm,并且在特定实施方案中可以为约3.2至16μm。为了清楚,带有字母"x"的数目是指乘数,一倍(1x),十倍(10x)等。
[0164]
在一些实施方案中,l可以为约1μm至约100μm,更典型地为1至20μm,如约1μm,约2μm,约3μm,约4μm,约5μm,约6μm,约7μm,约8μm,约9μm,约10μm,约11μm,约12μm,约13μm,约14μm,约15μm,约16μm,约17μm,约18μm,约19μm,和约20μm。长度l可以从小珠保留区段11的中线开始测量或从在将小珠保留区段11与信号检测区段的末端15e相连的通道15c上绘制的使小珠保留区段的直径完整的线开始测量。
[0165]
图10a和10b显示信号检测区段15可以任选地被配置成窄的通道或"细缝",典型地具有比小珠保留区段11的宽度小25%
‑
75%的宽度。
[0166]
图11a和11b显示信号检测区段15可以具有弧形末端部分15a,其具有小于小珠保留区段11的曲率半径的曲率半径。小珠保留区段中线至弧形末端15e的距离"d"可以与上述长度"l"相同。
[0167]
图12a和12b显示信号检测区段15可以具有末端,所述末端具有包围着内部向上突出元件19的环形通道17。突出元件19具有的高度可以足以延伸高于信号检测区段15的环形通道17中的液体。此结构可以限定包含具有环形形状的部分的可检测信号。
[0168]
据信,小珠孔10的新的几何结构改善了基于微珠阵列的技术中的检测。这些孔几
何结构可以被配置成使得孔11的一个区域是用于磁性加载和小珠保留,而孔15的另一个区域可以用于(主要或仅仅)检测信号。在一些实施方案中,在将小珠25(在图10a,11a和12a中的每个中,示例性地显示为一个孔中的实心圆)加载到孔10的小珠区域11中后,可以使用如本领域技术人员已知的方法如不互溶流体密封或对着另一个表面如衬垫或其他基质按压在孔10中分离小体积的试剂液。
[0169]
虽然一些示例实施方案显示在图10a,10b,11a,11b,12a和12b中,其他实施方案可以包括其他几何结构,典型地配置成使得小珠保留区11具有口袋或容器,所述口袋或容器具有的开口直径为小珠25的直径的约101
‑
195%,并且在一些实施方案中可以为约105%至150%。小珠保留区11中的孔的深度可以为小珠直径的约50%至185%。
[0170]
信号检测区15中的一些或全部处的孔10的深度可以与小珠保留区段11处的孔相同,比其更深或比其更浅。深度可以随通道15ch远离小珠保留区段11延伸而减小。深度可以随通道15ch远离小珠保留区段11并向信号检测区段15的末端延伸而增加。孔10的壁可以是在进入孔10的方向上向外或向内渐细的。
[0171]
不同的孔10可以具有不同的体积容量,几何形状样式和/或尺寸。
[0172]
在一些实施方案中,信号检测区段或区域15可以具有靶标小珠在物理上无法进入的通道15ch如口袋或细缝或其他几何形状。区域11,15都是流体连接的以致由小珠25释放的试剂和/或分析物可以扩散或以其他方式混合到孔10的整个共同溶液体积中。通过在空间上将小珠25与检测区11分离,可以降低或消除小珠荧光对信号的贡献,提高信噪比。
[0173]
孔10的几何结构可以允许反应孔10的高的单次占用加载同时增加相应的反应体积,从而可能提高反应效率。
[0174]
图13a显示分析系统100,分析系统100具有限定事件设备125,限定事件设备125包含至少一个加热器输入125h作为动态事件应用器。加热器125h可以是位于阵列30的之下和/或之上的加热元件,烘箱或热枪或其他合适的加热器。热限定事件输入可以被配置成将温度升高至高于环境温度,典型地升高至比25℃至少高1度,典型地约35℃至200℃。加热器125h可以将临界温度施用至阵列30达1微秒
‑
50小时,典型地在一些实施方案中为约1秒至约5分钟。固体支持物10可以回到环境温度或室温和/或约25℃或其他温度,典型地回到与用于在限定事件前在检测器150取得限定事件后图像前取得的解码图像的温度大致相同的温度。在除去热输入后,可以使用强制冷却或被动冷却。
[0175]
图13b显示分析系统100,其具有包含至少一个光源125l作为动态事件应用器的限定事件设备125。光源125l可以是以限定的波长或波长范围发射光的单个发射器或可以包含多个不同波长、波长范围的发射器或多个相同波长或波长范围的发射器以例如覆盖更大的面积。限定事件输入125l可以被配置成主动将光发射至固体支持物10达合适的时间,如约1微秒至50小时,典型地1秒至5分钟,如上所述。
[0176]
图13c显示具有回路100c的分析系统100,其中检测器150是限定事件设备,其包括如本领域技术人员已知的相关的光发射源。
[0177]
如图14a
‑
14e中所示,微流体设备20可以包括具有多个孔10的孔阵列30。孔10可以将小珠25保持在小珠保留区段11中。小珠25可以任选地包含与其连接的引物并且可以任选地被预加载到孔10的小珠保留区段11中。设备20可以包含连接在一起的上部和下部基质50u,50b(图14b,14c)。上部基质50u可以与下部基质50b相同或不同。基质50u中的一个或两
者可以是刚性的并且包括例如玻璃,石英,硅或合适的金属。基质50b中的一个或两者可以是聚合物的,如硅酮或其他聚合材料(尤其如pmma,coc,cop,pdms,pp,pe,ptfe或kapton(聚酰胺)),并且其可以提供小珠孔10的阵列。上部或下部基质50u可以具有与孔10流体连通的至少一个端口50p。在试剂填充和/或油封期间,反应孔10可以任选地与通过具有孔阵列30的阵列室的流垂直,例如:然而,可以使用其他排列结构。
[0178]
图14a显示微流体芯片20可以被配置成使得小珠孔阵列30用密集的阵列孔占据足迹"f"(典型地1mm至10cm)。流体微芯片20可以包括可以与阵列30流体连通的用于样品和试剂或其他化学添加的运输通道,如本领域技术人员已知的。
[0179]
图14d显示任选的间隔物50s,其可以位于上部和下部基质50u,50b之间。间隔物50s可以限定各孔10中的一些或全部的侧壁。间隔物50s可以包含用作衬垫和间隔物两者的光致抗蚀剂。
[0180]
图14e显示密封剂75如密封油可以将相邻的具有小珠25的孔10分开,如本领域技术人员已知的。也可以或可以备选地使用疏水膜。密封剂75(例如,油)可以在底部基质50b的顶部上延伸。密封剂75可以具有与间隔物/衬垫50s相关的厚度或深度。密封剂75和可以覆盖所有除了小珠/反应孔10。密封剂75可以包含矿物,硅酮,烃或基于碳氟化合物的油和/或蜡。反应溶液23,例如,水溶液,通常不接触顶部基质50u。
[0181]
该技术对于涉及在模拟或数字检测模式中使用荧光信号读出的扩增方法如聚合酶链反应(pcr)或酶联免疫吸附测定(elisa)的基于小珠的测定可以是尤其有利的。在这些测定中,零,一个或多个分析物分子被固体支持物捕获,固体支持物可以任选地包含小珠如磁珠。固体支持物然后可以被加载到微孔阵列30中,微孔阵列30的几何结构将固体支持物25的加载限制为一个或零个/孔10。小体积的扩增试剂可以被密封在具有固体支持物25的各反应孔10中,并且可以进行化学反应以产生荧光信号(如果存在分析物分子)。然后测定荧光信号可以被测量,处理并用于确定样品中的分析物浓度。
[0182]
致密阵列中的单路反应(sirca)是利用微珠
‑
阵列形式的大规模平行扩增和检测方法,其可能同时进行多种不同靶标序列的数百,数千,数百万或数十亿个分离的单路rt
‑
pcr反应。参见,例如,美国专利申请序号14/402,565,其描述了,例如,用于在多路空间内(multiplexed
‑
in
‑
space)微流体设备上的平行测定的试剂的基于小珠的递送;该文献的内容通过引用完整地结合于此。
[0183]
进行低分析物浓度的单拷贝数字量化和高分析物浓度的多拷贝模拟rt
‑
pcr量化的能力在am lod的情况下给出大的动态范围。在一些实施方案中,阵列30可以与连接至染料编码的,链霉亲和素标记的,磁性微球或小珠的生物素化的引物的个体组一起使用。可以制备含多至数十至数百种小珠类型的小珠组文库,其各自具有针对不同靶序列的不同的引物组,并且可以随意将新的小珠组添加至小珠混合物。当将小珠混合物与分析物dna或rna一起孵育时,连接至小珠的引物充当杂交探针,捕获并纯化对所述小珠特异的核酸序列。通过对小珠进行磁性分离和洗涤可以除去样品矩阵干扰物(外源dna,rna,细胞膜成分等)。在清除后,添加聚合酶,dntp和嵌入染料,并将小珠加载到个体孔10中并使用不可混溶的油或疏水膜彼此密封。将个体编码的引物小珠随机加载到分开的微反应孔中可以在数秒至数分钟内完成,不同于手工移液或试剂打印。将小珠磁力加载到优化的几何结构中可以比通过稀释到不含被设计成用于小珠捕获的区域和/或用于孔10的单独的检测区的小滴或反应孔
中的随机分离更有效。链霉亲和素/生物素相互作用在低于50℃的温度是非常稳定的;然而,pcr期间用于变性的升高的温度可以允许随后在开始扩增靶dna的第一个rt
‑
pct循环期间释放引物。
[0184]
为了评估sirca在亚pl反应中的表现,在通过在硅中的深度反应性离子蚀刻(drie)制备的硅流体芯片中在没有小珠的情况下进行使用引物和gdna的初步测试,所述硅流体芯片具有孔(直径3.7μm,深度5μm(圆柱形,体积≈50fl),中心
‑
中心间隔为10μm)的阵列。因此,在具有在溶液中游离的引物和gdna而没有小珠的≈50fl圆柱形反应孔中进行rt
‑
pcr。芯片用在庚烷中的辛基三氯甲硅烷预处理以使表面疏水。将芯片用乙醇弄湿,然后用水弄湿,然后用上样缓冲液(20mm trizma,50mm kcl,2.5mm mgcl2,1%bsa,和0.1%tween 20)封闭。将主混合物(1xplatinum quantitative pcr supermix
‑
udg,具有0.0625单位/μl额外的platinum taq dna聚合酶,0.5%bsa,2.7μm引物,来自s.mutans的gdna,以及3x sybr green)添加至芯片然后将krytox gpl104全氟化的油拖拉通过芯片以使反应体积彼此密封。
[0185]
本发明的实施方案包含反应孔10,反应孔10具有的几何结构被配置成含有超过一个小珠以使得释放自一个以上小珠并且在溶液中或在一个以上小珠的表面上或其任意组合反应的的试剂间的反应可以在如所示的指定的检测区或备选地在小珠表面上研究。珠孔阵列30可以包括变化,其中在单个基质或流体设备上或在单独的基质或设备上,一些孔10容纳一个小珠25,一些孔10容纳两个小珠25,并且一些孔10容纳超过两个小珠25。当孔10包括超过一个小珠保留区段11时,多个(典型地每个)小珠保留区段11可以经由信号检测区段如流体通道15ch彼此流体连通。可用于进行本发明的方法的试剂盒通常可以包含一组以上的具有编码介质的小珠和任选的与其连接的用于进行如上所述的方法的试剂,如限制性酶,任选地与用于进行所述方法的使用说明一起包装。所述试剂盒还可以包含用于容纳包含在其中的元件的容器。此种容器包括,但不限于小瓶,具有珠孔阵列和盒(cartridge)的微流体芯片,包括预加载的小珠设备。图19显示具有适合于动态解码方案的编码的小珠25的试剂盒500的包装。试剂盒500可以包括一个类型/群体的编码的小珠25(即,都具有相同编码信号或"指纹"的小珠)或可以包括两种以上不同的类型/群体的编码的小珠25(即,至少两种不同的小珠群体,一个具有第一编码信号,一个具有不同于第一编码信号的第二编码信号)。当试剂盒500包括两种以上不同类型的编码的小珠25时,试剂盒500可以在单个包装中包括作为混合物的编码的小珠25或可以单独地包装各编码的小珠群体(例如,单独地包装具有第一编码信号的小珠群体并且单独地包装具有第二编码信号的小珠群体)。
[0186]
在一些实施方案中,小珠25可以具有与其连接的引物。引物可以是生物素化的引物对,并且小珠25可以是链霉亲和素标记的以致发生生物素化的引物与小珠的结合。在一些实施方案中,小珠25可以包括标志物,如光学标志物,其可以在分析期间使用以鉴别锚定至各小珠25的引物。例如,可以标记具有相同或不同尺寸的不同的编码的小珠以用于在分析期间鉴定不同的连接的引物组。可以使用多种预编码方法以在小珠25上提供标志物,包括预限定的尺寸,形状,磁性质和/或荧光掺杂,其可以单独使用也可以与其他编码方法组合使用。定制序列生物素化的引物和链霉亲和素标记的顺磁性磁珠都可以容易地购买自商业卖家或在具有合适设备的实验室中以合适的量制备。
[0187]
如上所述,虽然本文中也关于pcr反应描述了根据本发明的实施方案,应当理解的
是,本文中所述的微流体设备,小珠和反应方法可以用于多种其他反应,例如,当试剂与小珠分离进入孔以参与反应时。例如,任何核酸转录和/或扩增相关反应都在本发明的范围内,包括但不限于pcr反应,实时pcr(rt
‑
pcr),数字pcr(dpcr),rna反转录成cdna(rt),来自之前的rt步骤(rt
‑
pcr)的cdna的pcr,使用实时或数字量化的rt
‑
pcr,免疫
‑
pcr(ipcr)及其变体,环介导的等温扩增(lamp),滚动循环复制,和/或非酶促核酸扩增方法(例如,"dna回路")。包括在本发明范围内的其他反应包括但不限于酶联免疫吸附测定(elisa),单分子阵列(simoa)或数字elisa,其中在某些点荧光底物与待分解的支持物表面结合以用于随后的反应的elisa,其中将多个小珠用于递送不同试剂以用于组合化学的反应,其中小珠递送催化试剂的反应,和/或其中以随机小珠载量确定的化学计量递送“点击(click)”化学试剂的反应。
[0188]
图15是分析系统100的示意图。系统100可以包括与信号检测器150如照相机或其他成像设备连通的至少一个控制器12(典型地包括至少一个处理器)。信号检测器150可以被配置成检测具有孔阵列30的各微流体芯片20的珠孔阵列30中的固体基质如小珠25的信号(例如,测定信号和/或编码信号)。控制器12可以与输入设备125连通。虽然显示为单独的设备,但输入设备125可以作为系统设备的部分存在。例如,输入设备125可以是光学系统,成像设备,热设备等和/或是其部分。控制器12可以与图像处理器211连通,图像处理器211具有利用分析模块221(例如,计算机程序)和解码模块40的信号检测,分析模块221被配置成鉴别在反应孔的信号检测区段中是否存在测定信号,解码模块40被配置成获得编码信号。图像处理器模块211可以全部或部分是机载的或可以远离控制器和/或信号检测器150。图像处理器模块211可以被配置成合并孔的多个测定后图像以评估孔是否具有正读出。图像处理器模块211可以去除来自各孔的小珠保留区段的背景噪音。模块211可以被配置成鉴别来自各孔的检测区段的信号的存在从而基于测定读出222鉴别是否发生阳性测定反应。检测器150也可以使用解码读出40r检测编码信号。
[0189]
图16是可用于进行根据本发明的实施方案的分析方法的实例运行的流程图。提供具有小珠孔的流体设备(框250)。在小珠被保持在小珠孔中的同时自孔获得编码信号,其可以包括获得被保持在小珠孔中的小珠的第一图像(框260)。然后至少一些小珠发生物理和/或化学变化(框272)。然后获得第二图像(框274)。通过在第一和第二图像中比较来自各小珠的编码信号来区别不同的小珠群体(框276)。
[0190]
在这些和/或其他实施方案中,编码信号可以读取自含小珠的区段(即直接自小珠读取)以确定小珠可以含有何种试剂和/或分析物。以此方式,可以将阵列解码以确定正或负测定信号的含义。可以通过本领域技术人员已知的方式给小珠编码,包括通过一种以上强度水平的一种以上染料的荧光染料染色,小珠直径,小珠形状,或限定的和/或可观察的或可检测的性质的任意组合。还可以通过本文中所述的任何方法给小珠编码。
[0191]
小珠孔可以被布置成限定反应孔的小珠孔的致密阵列(框252)。小珠孔可以具有小珠保留区段可以具有几何结构和等于或大于小珠直径的直径,并且信号检测区段,在使用时,具有的几何结构的宽度小于小珠直径(框254)。
[0192]
信号检测区段可以包含窄于小珠直径的细长的通道并且珠孔几何结构可以被配置成具有以下中的一种以上:(a)细缝,(b)由细长的通道隔开的不对称圆形周长,(c)牛眼形式(即,并入环形通道中的细长的通道),(d)通过在其间延伸的至少一个细长的通道合在
一起的多个隔开的圆形和/或曲线周长(框256)。
[0193]
小珠保留区段可以被定尺寸和配置成仅容纳单个磁珠(框257)。
[0194]
小珠孔可以含有一种以上扩增试剂(框258)。
[0195]
小珠孔可以具有检测区段可以与相应的小珠保留区段隔开距离l,距离l为靶小珠直径的.3x至100x,例如,1至1000μm(框259)。
[0196]
如果存在分析物分子,信号可以包括荧光信号(具有尾部)(框261)。
[0197]
图17是制备根据本发明的实施方案的示例设备的方法的流程图。孔阵列在基质中布置(例如,形成);孔具有的体积容量为1al至100μl,更典型地为1fl至1μl,并且具有在限定的足迹中的一种以上限定的几何结构,其中线尺寸为1mm至10cm,所述限定的几何结构包括与在空间上与小珠保留区段隔开的信号检测区段流体连通的小珠保留区段(框300)。
[0198]
孔阵列可以通过在基质中蚀刻形成(框302)。
[0199]
孔阵列可以被塑造在基质中(框304)。预期其他制备方法,例如,影印石版术,fib研磨,压纹,冲压等。
[0200]
小珠孔具有的小珠保留区段的直径可以为约10nm至5,000μm,典型地并入通道中约3.1
‑
3300μm,其宽度为约2
‑
3μm,长度l为靶标小珠直径的.3x和100x,例如,1
‑
100μm和/或1
‑
10μm,在一些实施方案中,形成任选的信号检测区段(框306)。
[0201]
将基质灭菌并提供在用于利用与孔结合的磁珠对靶分析物进行流体分析的包装和/或试剂盒中(框308)。
[0202]
所述孔可以是具有一种以上扩增试剂的反应孔。
[0203]
孔阵列可以6000/mm2至约10,000/mm2,典型地约6,000/mm2的密度布置(框312)。
[0204]
可以6,000/cm2至约5,000,000/cm2,更典型地6,000/cm2至约2,000,000/cm2的密度提供孔阵列(框314)。
[0205]
小珠保留区段具有的周长的宽度可以与靶标(例如,磁性)小珠的直径相同或在所述直径的约195%内,例如,靶标小珠直径的101%至195%或150%(框316)。
[0206]
在小珠体积为20fl的情况下,所述孔具有的反应体积可以为100
‑
150fl(框318)。
[0207]
图18是根据本发明的实施方案的评估测定的方法的流程图。测定信号由多个具有小珠的反应孔电子检测(框350)。术语"电子"是指所有形式的基于机器的检测(非人眼)如照相机,例如,ccd照相机,cmos照相机,电极阵列,sem等。信号可以是强度增加,荧光,一种以上限定的颜色,限定的像素参数等,包括光散射性质(透明度)的变化,透射或吸收的变化,化学发光或不同参数的组合。在测定之前,期间和/或完成之后,获得多个图像,包括第一图像,并且在限定事件后获得随后的图像以鉴别编码信号以解码所述测定从而鉴别测定样品中的小珠群体(框370)。
[0208]
反应孔可以任选地具有信号读出区段,并且在反应已经发生后所述方法可以电子检测来自小珠孔的阵列的测定信号以鉴别阳性,所述小珠孔各自具有在空间上与小珠保留区段隔开的信号读出区段(框352)。
[0209]
信号读出区段包含细长的通道,所述通道的宽度和/或深度小于小珠保留区段的直径(框354)。
[0210]
信号读出区段包含与小珠保留区段流体连通的环形流体通道(框356)。
[0211]
测定信号是基于pcr或elisa的测定的(框358)。
[0212]
可以使用相同尺寸小珠或不同尺寸小珠相对于彼此或相对于不同的参比基因组筛选多个引物组,至少两个小珠由具有两个(任选地不同尺寸)小珠保留区段和至少一个单独的读出区段的单个反应孔容纳(框360)。这些小珠可以通过任何本文中或本文参考的那些来源中列出的方法编码。
[0213]
测定信号可以是使用限定的小珠组的临床或实验室样品的核酸表征的(框362)。
[0214]
预示例1
‑
10
[0215]
关于可以使用本发明的方法解码以鉴别不同的小珠群体的多个小珠来描述以下预示例实施方案。然而,可以使用其他类型的固体支持物。此外,以下各预示例实施方案可以与利用关于相同和/或不同限定事件的时间域的一个以上实施方案组合。例如,多个小珠可以包括一个以上的小珠群体,所述一个以上的小珠群体可以使用编码介质鉴定,所述编码介质响应于特定波长的光暴露而在物理上和/或在化学上产生变化,并且多个小珠可以包括一个以上的小珠群体,所述一个以上的小珠群体可以使用编码介质鉴定,所述编码介质响应于相同和/或不同波长的光暴露而在物理上和/或在化学上产生变化和/或响应于温度和/或化学环境而产生变化。例如,在物理和/或化学变化之前各小珠的由编码介质产生的编码信号可以不同于在物理和/或化学变化之后各小珠的由编码介质产生的编码信号。
[0216]
在实施例1
‑
10的每个中,可以提供多个编码的小珠,所述多个编码的小珠包括不同的小珠群体/亚组,所述不同的小珠群体/亚组可以通过比较在限定事件之前的第一时间点和在限定事件期间和/或之后的另外的时间点来自与各小珠连接的第一和/或第二编码介质的荧光强度来鉴定。第一小珠群体可以包括与其连接的第一编码介质(例如,fp,有机染料和/或量子点)并且第二小珠群体可以包括与其连接的第二编码介质(例如,fp,有机染料和/或量子点)。另外的小珠群体可以不同比率包括与其连接的第一和第二编码介质两者(例如,第一编码介质:第二编码介质之比为25:75,50:50,或75:25)。例如,第三群体可以具有30:70的比率,第四群体可以50:50的比率等。第一和第二编码介质可以具有相同和/或相似的荧光激发/发射性质和/或强度以致第一,第二和另外的小珠群体在限定事件前的第一时间点是不可区分的。然而,编码介质中的至少一种相对于限定事件可以不是稳定的。因此,在暴露于限定事件期间和/或之后,第一和第二编码介质可以显示不同的荧光强度,这允许区分两种编码介质。因此,可以通过比较限定事件之前的荧光强度和限定事件期间和/或之后的荧光强度来鉴别第一和第二小珠群体。也可以通过限定事件后的荧光强度或荧光强度的变化来鉴别另外的小珠群体,因为所述比率提供在第一和第二编码介质的强度之间的不同的荧光强度水平或梯度。可以提供的另外的小珠群体的数目可以取决于在限定事件期间和/或之后的时间点可以鉴别的(即,可区分的)另外的荧光强度的数目。
[0217]
在这些实例中,应当注意的是,有利的是具有可以基于其性质的初始读数或测量而被区分的多个基质群体,但是在各初始可区分的群体内存在初始不可鉴别的不同亚群体。在限定事件(或一系列限定事件或多个同时发生的限定事件)后,通过比较不同的亚群体的初始信号测量和限定事件之后和/或期间发生的信号测量,不同的亚群体将是可区分和可鉴别的。以此方式,通过解码使所有多路群体彼此区分。虽然在下文中可以将群体描述为是不可区分的,应当理解,其可以描述可以具有一些允许初始分类的可区分的性质的较大基质组的初始不可区分的亚群体。虽然在下文中可以将限定事件描述为引起针对给定的亚群体产生不同的强度水平的物理和/或化学变化,应当理解,这些所得的强度水平与在限
定事件前针对所述特定亚群体测量的强度水平相比是“不同的”,并且在某些情况中可以对应于与在限定事件之前,之后或期间通过另一种可区分的性质与给定的亚群体相区别的其他亚群体的初始强度水平或最终强度水平相似或相同的强度水平。因此,比较特定小珠在不同时间点(其可以包括在限定事件之前,之后或期间的时间点)的编码信号可用于将小珠彼此区分。
[0218]
实施例1
[0219]
有机染料在时间域中的光稳定性可用于解码多个编码的小珠。第一小珠群体可以包括与其连接的第一有机染料并且第二小珠群体可以包括与其连接的第二有机染料。另外的小珠群体可以不同比率包括与其连接的第一和第二有机染料两者,如上所述。第一和第二有机染料可以具有相同和/或相似的荧光激发/发射性质和/或强度以致第一,第二和另外的小珠群体在限定事件前的第一时间点是不可区分的。在暴露于光达限定的时间,典型地约30秒至5分钟,如约1分钟,约2分钟,约3分钟或更长后,第一和第二有机染料可以易感于不同水平的光漂白。因此,在光漂白达限定的时间(例如,至少一微秒)后,不同的小珠群体具有不同的荧光强度。例如,相比于第二有机染料(即,动态元件),第一有机染料可以较不易感于光漂白(即,更稳定),并且第一有机染料的荧光强度在1分钟后可以仅减小10%,而第二有机染料的荧光强度在1分钟后可以减小90%。因此,可以通过限定事件(即,光漂白)后的荧光强度来鉴别第一和第二小珠群体。也可以通过限定事件后的荧光强度来鉴别另外的小珠群体,因为所述比率提供在第一和第二有机染料的强度之间的荧光强度的不同水平或梯度。
[0220]
实施例2
[0221]
有机染料和量子点在时间域中的光稳定性可用于解码多个编码的小珠。第一小珠群体可以包括与其连接的有机染料并且第二小珠群体可以包括与其连接的量子点。另外的小珠群体可以不同比率包括与其连接的第一有机染料和有机点两者,如上所述。第一有机染料和量子点可以具有相同和/或相似的荧光激发/发射性质和/或强度以致第一,第二和另外的小珠群体在限定事件前的第一时间点是不可区分的。第一有机染料(即,动态元件)在暴露于光达1分钟以上后可以易感于光漂白,而量子点不易感于光漂白。因此,在光漂白达至少一分钟后,不同的小珠群体具有不同的荧光强度。例如,仅具有第一有机染料的小珠的荧光强度在限定时间(例如,1分钟)后可以显著减小,而仅具有量子点的小珠的荧光强度在1分钟后可以不减小。因此,通过限定事件(即,光漂白)后的荧光强度可以鉴别第一和第二小珠群体。也可以通过限定事件后的荧光强度来鉴别另外的小珠群体,因为所述比率提供在第一有机染料和量子点的强度之间的荧光强度的不同水平或梯度。
[0222]
实施例3
[0223]
编码介质的热稳定性可用于解码多个编码的小珠,这是通过比较在热限定事件前的第一时间点和在热限定事件期间和/或之后的另外的时间点来自与各小珠连接的第一和/或第二编码介质的荧光强度。第一小珠群体可以包括与其连接的第一编码介质(例如,有机染料和/或量子点)并且第二小珠群体可以包括与其连接的第二编码介质(例如,有机染料和/或量子点)。另外的小珠群体可以不同比率包括与其连接的第一和第二编码介质两者,如上所述。编码介质中的至少一种对于温度的增加或下降可以不是稳定的。例如,编码介质(即,动态元件)响应于限定的热事件可以发生结构和/或电荷变化,这可以提供编码介
质的荧光强度的变化。在一些实施方案中,热限定事件可以引起与编码介质和/或小珠相关的变化和/或破坏与编码介质和/或小珠相关的化学键,如,例如,将编码介质与小珠连接的结合对(例如,链霉亲和素
‑
生物素)的化学键。因此,在暴露于温度变化期间和/或之后,第一和第二编码介质可以显示不同的荧光强度,这允许区分两种编码介质。因此,可以通过限定事件(即,温度的升高或下降)后的荧光强度来鉴别第一和第二小珠群体。也可以通过限定事件后的荧光强度来鉴别另外的小珠群体,因为所述比率提供在第一和第二编码介质的强度之间的荧光强度的不同的水平或梯度。
[0224]
实施例4
[0225]
热限定事件可以激活影响至少一种编码介质(即,动态元件)的荧光强度的试剂(例如,猝灭剂)或使其失活。例如,温度上升的热限定事件可以激活热易变的化合物。所述试剂响应于热限定事件可以与编码介质相互作用,不再与编码介质相互作用,和/或可以影响编码介质存在于其中的环境的化学性质(例如,改变ph),这可以提供编码介质的荧光强度的变化。因此,在暴露于热限定事件期间和/或之后,第一和第二编码介质可以显示不同的荧光强度,这允许区分两种编码介质。因此,通过限定事件(即,温度的升高或下降)后的荧光强度可以鉴别第一和第二小珠群体。也可以通过限定事件后的荧光强度来鉴别另外的小珠群体,因为所述比率提供在第一和第二编码介质的强度之间的荧光强度的不同的水平或梯度。
[0226]
实施例5
[0227]
光学限定事件可以激活影响至少一种编码介质(即,动态元件)的荧光强度的试剂(例如,猝灭剂)或使其失活。例如,光激活的化合物可以与编码的小珠一起存在并且可以被将编码的小珠和试剂暴露于光的光学限定事件激活。所述试剂响应于所述限定事件可以与编码介质相互作用,不再与编码介质相互作用,和/或可以影响编码介质存在于其中的环境的化学性质(例如,改变ph),这可以提供编码介质的荧光强度的变化。因此,在暴露于光学限定事件期间和/或之后,第一和第二编码介质可以显示不同的荧光强度,这允许区别两种编码介质。因此,可以通过限定的光学事件(例如,暴露于给定波长和/或波长范围的光)后的荧光强度来鉴别第一和第二小珠群体。也可以通过限定事件后的荧光强度来鉴别另外的小珠群体,因为所述比率提供在第一和第二编码介质的强度之间的荧光强度的不同的水平或梯度。
[0228]
实施例6
[0229]
化学限定事件可用于鉴别不同的小珠群体/亚组。化学环境的变化可以引起至少一种编码介质的荧光强度的变化。例如,化学限定事件可以引起和/或提供小珠环境的ph的变化,改变组成(例如,去除和/或添加化学品/成分和/或改变溶剂),激活影响至少一种编码介质的荧光强度的试剂(例如,猝灭剂)或使其失活,和/或改变结合复合物的稳定性(其可以引起编码介质的荧光强度的变化)。因此,在限定事件期间和/或之后,第一和第二编码介质可以显示不同的荧光强度,这允许区分两种编码介质。因此,可以通过限定事件后的荧光强度来鉴别第一和第二小珠群体。也可以通过限定事件后的荧光强度来鉴别另外的小珠群体,因为所述比率提供在第一和第二编码介质的强度之间的荧光强度的不同的水平或梯度。
[0230]
实施例7
[0231]
在一些实施方案中,如果限定事件提供在限定事件前不存在的在限定事件后显示的并且不同于其他小珠群体的荧光强度的荧光强度,则对于以上实施例1
‑
6中所述的那些可以鉴别另外的群体(例如,第三群体)。例如,第三小珠群体可以包括在限定事件前的第一时间点不显示荧光的编码介质。因此,第一,第二和第三小珠群体在第一时间点使用荧光强度是不可区分的。然而,所述限定事件可以激活编码介质的荧光以致在限定事件后,通过与第一和第二小珠群体的荧光强度不同的第三荧光强度。
[0232]
实施例8
[0233]
表3显示常规荧光编码方案,其中将两种不同的颜色染料(红色和蓝色)的三种强度水平(低,中,高)用于编码九个群体的固体支持物。
[0234]
表3.
[0235] 低蓝(lb)中蓝(mb)高蓝(hb)低红(lr)lr(lb)lr(mb)lr(hb)中红(mr)mr(lb)mr(mb)mr(hb)高红(hr)hr(lb)hr(mb)hr(hb)
[0236]
表4显示利用四种染料(红色稳定,红色不稳定,蓝色稳定,蓝色不稳定,即总共仅两种颜色)使用获得各颜色的6种不同的动态性质(低的保持低,中等的保持中等,中等的漂白至低,高的保持高,高的漂白至中等,高的漂白至低)的混合物的编码如何导致36个可以使用限定事件之前和之后的仅两种颜色(红色和蓝色)和三种强度(低,中,高)的测量来区分的不同群体。
[0237]
表4.
[0238][0239]
[0240]
实施例9
[0241]
表5显示常规编码方案,其中将两种颜色(红和蓝),三种强度(低,中,高)和两种尺寸(小和大)用于编码18个基质群体。应当注意的是,表5中的群体与表3中的那些相似,但是通过加入具有两个水平(小和大)的小珠尺寸维度,可获得的常规编码水平由9种翻倍为18种。
[0242]
表5.
[0243][0244]
表6显示如何通过加入两个与小珠尺寸相关的动态维度(膨胀导致尺寸增加或溶解导致尺寸减小)使本文中所述的动态解码方法可用于进一步增加可区分群体或编码状态的数目。这导致可以基于在限定事件后观察到(或未观察到发生)的变化区分的54个不同的群体。此种潜在多路化的增加可通过仅测量处于三种强度(低,中,高)的两种颜色(红和蓝)和四种尺寸(大,更大,小,溶解/未检测到)实现。该编码方案可以通过结合本文中所述的任何其他方法进一步扩展。
[0245]
表6.
[0246]
[0247][0248]
实施例10
[0249]
图20和21显示并非基于阵列而是利用流式细胞仪来进行限定事件之前或之后的小珠测量的设备的实例。在图20中,在光照光漂白一种或多种编码介质之前和之后测量固体支持物。图21显示这样的实施例,其中在将护套流或另外的试剂流混合到含小珠的流中之前和之后测量固体支持物。该流可以含有试剂如(但不限于)不同ph的缓冲剂,溶剂或配体,其影响至少一种编码介质或固体支持物结构以引起物理和/或化学变化。限定事件之前和之后的固体支持物的光学性质的比较可用于使群体或亚群体彼此区分。
[0250]
实施例11
[0251]
基于多路小珠的生物测定典型地需要各种类型的微球被唯一地编码以使类型彼此区别。典型地使用具有不同光谱性质和变化的浓度的荧光染料来编码微球。然而,关于可
在光谱上分辨的染料的数目或每种染料的可区分的强度水平存在实际限制。为了扩大编码水平的数目,开发了这样的方法,所述方法将光漂白动力学结合到小珠解码中,从而解锁了通过常规解码方法无法获得的额外的多路水平。为了证明该技术,将小珠用具有重叠的荧光激发和发射波长和不同的光稳定性的两种染料编码。所有小珠开始都显示相似的荧光强度;然而,在适当的光暴露后,光稳定性较低的染料由于光漂白而具有减小的发射强度。通过将原来的荧光发射强度与在光漂白后获得的荧光强度比较,能够可靠地鉴别多个不同的群体。仅使用单一激发/发射带,优化了两种不同的初始强度水平从而产生六个可唯一鉴定的小珠群体,而利用常规解码方法仅能够获得两个。将该编码策略结合到基于小珠的微孔阵列测定中显著增加了可用于多路测定的编码水平的数目而不增加成像设备的复杂性。
[0252]
所述方法将动态元件结合到解码方法中。不同于使用单一时间点编码测量,本文中所述的方法采用光漂白动力学以区分小珠群体。将具有重叠的光谱性质和不同的光稳定性的两种染料用于编码小珠,之后可以基于简单的光漂白率测量来区分所述小珠。此处报道的方法监测光漂白,对于这些实验,光漂白以秒为时间尺度发生,从而显著增加了基于小珠的测定的多路容量而不增加分析平台的复杂性。
[0253]
材料和方法
[0254]
小珠编码方法
[0255]
直径通常为3μm的链霉亲和素功能化的promag磁性微球购自bangs laboratories(fishers,in)。r
‑
藻红蛋白(pe)生物素缀合物和605qdot(qd)生物素缀合物(life technologies;carlsbad,ca)用作该研究中的编码染料。“高”水平小珠被标记以5nm pe,250nm qd,或18nm pe/22nm qd混合物。“低”水平小珠被标记以0.6nm pe,4nm qd,或0.45nm pe/2nm qd混合物。该编码方法中使用的缓冲剂由以下组成:1x tris缓冲盐水,ph 7.2(thermo scientific;waltham,ma)和0.1%tween 20(sigma aldrich;st.louis,mo)。
[0256]
10μl等分部分的小珠储液(2.6%固体)被用于各标记反应。首先将小珠用100μl等分部分的缓冲液洗涤3x,磁力收集,然后重悬在10μl中。通过将15μl染料溶液添加至小珠并在环境温度孵育1h来进行编码。使染料标记小珠溶液避光并且置于旋转器(labnet international;edison,nj)中以保证在标记反应期间小珠保持悬浮。在功能化后,将小珠洗涤3x然后重悬在20μl缓冲液中并存储在4℃。
[0257]
微孔阵列制备
[0258]
使用硅和玻璃来制备用于这些研究的微孔阵列芯片。硅晶片购自university wafer(south boston,ma)并通过nanofilm(westlake village,ca)涂覆以铬和阳性光致抗蚀剂。使用heidelberg instruments dwl fs66激光打字机(heidelberg,germany)在晶片上光刻形成含3.5μm直径小珠孔的阵列。在光致抗蚀剂显影并且去除暴露的铬后,在alcatel ams 100深度反应离子蚀刻机中将晶片蚀刻至≈5μm的深度。23在蚀刻后,从晶片上去除剩余的光致抗蚀剂和铬。然后使su
‑
8 2050(microchem;westborough,ma)在晶片上成形以形成设备的外部流体边界。为了完成微芯片,将用于流体的含玻璃基质的小瓶和小珠入口在硅阵列上对齐并且用环氧树脂胶(loctite 120hp)粘在适当位置。在粘合后,将芯片用在庚烷(fisher scientific;pittsburgh,pa)中的1%三氯(辛基)甲硅烷(sigma aldrich)处理以使表面疏水。
[0259]
编码实验
[0260]
将微芯片用含20mm tris,ph 8.0(life technologies),50mm kcl(life technologies),2.5mm mgcl2(fluka;st.louis,mo),0.1%tween 20,和1%胎牛血清(thermo scientific)的缓冲液处理。将小珠移液至小瓶中并且通过磁力置于阵列上,其中在整个芯片上实现均匀的加载。在加载后,将芯片用krytox油(dupont;wilmington,de)密封以使个体孔彼此分离。将密封的芯片保持在黑暗中直至用于成像。
[0261]
这些实验中使用的成像系统由以下组成:nikon az100荧光显微镜(melville,ny),prior scientific lumen 200pro荧光照明系统(rockland,ma)和hamamatsu orcaflash 4.0cmos照相机(middlesex,nj)。将加载的芯片置于显微镜平台上并且使用micro
‑
manager软件每2.5s获得2s曝光。激发源快门仅在曝光期间完全打开。该图稿中随后的数据点显示实时的x轴时间点(即2.5s/图像)而非曝光时间(即2s/图像)。使用单一滤镜组(545/30nm激发,620/60nm发射)获得pe编码的和qd编码的小珠的图像。
[0262]
为了评估漂白表现,用单一小珠类型加载重复芯片并且重复成像。这对所有小珠群体进行。将所得的图像用fiji软件处理。26在确定了各小珠在阵列孔中的位置后,确定整组图像的荧光信号。将荧光强度作为光学发光暴露时间的函数作图以比较群体衰减特征曲线。对于直方图分析,将来自在给定时间点终止的最后三个图像的归一化的强度值(例如当评估90s的曝光时,使用t=80s,85s,90s图像)平均以最小化信号波动并减少噪声。然后将这些终点衰减值分选以确定对各小珠群体特异的适当的直方图箱(bin)范围。
[0263]
结果和讨论
[0264]
光漂白率
[0265]
当其具有充分重叠的激发或发射最大值时,量子点和有机染料的光稳定性的差异为编码微球提供了吸引人的机会。荧光蛋白藻红蛋白具有高的荧光量子产率但是在延长的光暴露后易感于光漂白。相对地,量子点通常耐受光漂白并且在额外的曝光后保持(或甚至增加)其观察到的发射。通过用pe编码一个小珠组并用qd编码另一个小珠组,假定的是两个群体之间的初始荧光将显示相同,但是其在延长的曝光后可以被区分。将光漂白动力学引入到此种编码测量中将因此使得能够实现通过常规的单一图像解码方法所不能获得的额外的编码水平以用于增加的多路化。
[0266]
将用pe,qd或两种染料的混合物编码的小珠组加载到微孔阵列芯片中并重复成像。检查所得的图像显示在延长的成像后小珠经历不同的变化(参见,例如,图3a,3b和3c)。如预测的,在将染料漂白3min的时间时,用pe编码的小珠经历荧光信号的显著减弱,而相同时间的光暴露基本上不影响来自qd编码的小珠的荧光信号。用两种染料的混合物标记的小珠显示荧光信号的中等下降,其不如pe编码的群体严重。荧光衰减特征曲线图显示各小珠组之间良好的分辨率。在各小珠群体内观察到非常相似的漂白率,说明该动态解码方法具有高的准确度。
[0267]
漂白持续时间和群体重叠
[0268]
虽然各小珠组的平均荧光衰减特征曲线彼此相当不同,各群体显示光漂白的变化。因此,检查各群体的边界以检验其彼此不重叠以避免小珠错误识别。图22显示来自各群体中的顶部和底部5%的小珠的光漂白特征曲线。这些迹线显示不仅各小珠群体的平均衰减可以彼此很好地区分,而且各组内的范围也可以被区分。图22还暗示在这些条件下的3min的光漂白是有些过多的,因为各群体表现为可在更短的时间内被鉴别。
[0269]
已知生物测定的通量和表现都将受益于解码时间的减少,在我们的实验设定的参数内寻求获得可接受的群体间分辨率所需的最小光漂白持续时间。在不同长度的光漂白后将个体小珠的终点荧光值放入直方图中,其中漂白被表征为“快速”(pe小珠),“中等”(混合小珠),和“缓慢”(qd小珠)(表7)。在数据组中各群体具有>50k小珠(n=5芯片)以提供足够大的样品尺寸以准确表示群体分布。解码数据显示,不同的小珠组在30s内被相当好的分辨,虽然在混合小珠和其他群体之间仍然观察到些许重叠。漂白30s后的最大错误识别为1.7%,发生在pe和混合小珠之间。虽然该误差对于可忍受少量错误识别的某些应用是可接受的,其对于许多数字的低lod测定来说是过高的。通常,小珠错误识别的百分比应当小于生物测定的噪声以保证其不显著影响测量精度。此外,此种短的漂白时间需要从数据组中排除2.5%的pe和混合小珠,因为其显示在邻近的小珠群体之间的重叠区域中的荧光。发现去除此相当小的百分比的小珠显著提高鉴定准确度并且从分析中去除了模糊性。
[0270]
延长光漂白持续时间提高小珠群体之间的分辨率(表7)。在1.5min的漂白后,鉴定准确度增加至>99.9%,其中<0.8%的小珠由于模糊性被排除。然而,当进一步延长漂白时间时观察到递减回报。3min漂白后的鉴定准确度为>99.98%而排除率为<0.3%。额外的分辨率虽然更好但是被认为对于非特异性结合引起0.1
‑
1%的背景信号的大多数生物测定来说是多余的。7由于将高编码准确度,低排除率和更快的通量结合,1.5min的光暴露时间被认为是在这些实验参数下对于小珠解码最优的。具有更高强度灯,更宽的带通滤镜组等的其他系统可用于进一步减少该时间。
[0271]
表7:基于终点荧光衰减分选到三个光漂白组(“快速”,“中等”,“缓慢”)中的各群体中的小珠的百分比。随着漂白时间增加错误识别的小珠的百分比减小。显示的衰减值在群体间的模糊的重叠区域中的小珠被从数据组中省略(“排除”)。
[0272][0273]
另外的编码状态
[0274]
为了利用该动态解码技术进一步增加编码状态的数目,利用较低的染料浓度开发处于较低的初始强度水平的新的小珠组(“低”小珠)。优化各染料的量以使获得的三种漂白可区分的小珠类型(pe,qd和混合物,如前所述)的初始荧光值相似,同时还保证其进行可分辨程度的光漂白衰减。在优化染料浓度后,测量三个群体的漂白特征曲线。各小珠群体以高的精度显示与之前的部分中描述的“高”强度小珠相应的特征曲线)相似的归一化的光漂白。构建直方图以测量在漂白后这些“低”强度小珠群体之间的重叠。三个小珠组之间的重叠指示“低”强度水平小珠的表现与“高”强度小珠一样好,并且两者都可以被容易地执行到多路小珠测定中。
[0275]
在优化染料浓度的同时,要注意保证“低”强度群体的初始强度不与“高”编码群体
重叠。这是重要的,因为归一化的衰减无法用于区分用相同染料编码的小珠。将数据分选到直方图中确认了“高”和“低”强度水平显示无重叠。还可见的是,“高”群体的荧光值的宽的范围使得难以实现中间的编码水平(在常规小珠编码方法的情况下妨碍高的多路化程度的常见限制)。然而,在结合时间域的情况下,获得多个额外的编码水平,尽管初始强度的差异大。
[0276]
最后,将具有两种强度水平(“高”和“低”)(各自具有三个可区分的亚群体(pe,qd和混合)的小珠组合,使得能够利用单一波长检测实现总计六种不同的编码状态。首先基于t=0荧光将个体小珠分配至“高”或“低”组,然后重复成像以鉴别使用的特殊编码染料(图23)。与常规编码方法相比,该方法被证明显著增加基于小珠的poc测定的多路容量同时还使测定光学系统的成本和复杂性最小化。
[0277]
理论考量
[0278]
标准编码典型地基于波长和强度的单一时间点观察。可获得的编码状态的数目由各激发/发射带的可区分群体的数目确定并且对于三个带可以根据以下等式表示:
[0279]
t
conventional
=(n
i
1)*(n
i
1)*(n
k
1)
[0280]
其中t
conventional
是编码状态的总数,n
i
,n
j
和n
k
分别是激发/发射带i,j和k中编码的强度水平的数目。荧光的最低水平是水平0,或无编码,其中无法检测编码染料的存在。
[0281]
将具有相似的光谱性质和不同的稳定性的两种以上染料混合在可区分的荧光强度水平内提供额外的编码状态。图s3显示以不同比率将两种光谱相似的染料混合在一起以实现0
‑
5编码水平的方法的图。最低水平(0)不使用染料。下个水平,1,可以使用一当量的稳定的或易变的染料。水平2可以使用两个当量的任一染料或一个当量的各染料的混合物。可以观察到的是,对于带i,对于各强度水平i,存在i 1种染料组合,其对光暴露的反应不同。可获得的编码状态的总数(t
dynmnic
)可以表示为可区分的荧光水平的数目的函数:
[0282][0283]
其中i,j和k表示激发/发射带i,j和k中的强度水平。对于五种不同的编码水平和三个激发/发射带,常规的单一时间点测量将产生216种独特的编码状态。使用时间域方法在五个不同强度水平的情况下产生21种不同类型的具有唯一编码的小珠并且对于三个激发/发射带的唯一编码状态的理论数目为9,261。
[0284]
预示例12
[0285]
有机染料在时间域中的光稳定性可用于解码生物学样品。第一抗体可以包括与其连接的第一有机染料并且第二抗体可以包括与其连接的第二有机染料。第三抗体可以不同比率包括与其连接的第一和第二有机染料两者,如上所述。第一和第二有机染料可以具有相同和/或相似的荧光激发/发射性质和/或强度以致第一,第二和另外的抗体在限定事件前的第一时间点是不可区分的。第一和第二有机染料可以在暴露于光达限定时间(典型地约30秒至五分钟,如约1分钟,约2分钟,约3分钟以上)后易感于不同水平的光漂白。因此,在限定时间(例如,至少一微秒)的光漂白后,不同的抗体具有不同的荧光强度。例如,与第二有机染料(即,动态元件)相比,第一有机染料可以不易感于光漂白(即,更稳定)并且第一有机染料的荧光强度在1分钟后可以仅减小10%,而第二有机染料的荧光强度在1分钟后可以减小90%。因此,通过限定事件(即,光漂白)后的荧光强度可以鉴别第一和第二抗体群体。
也可以通过限定事件后的荧光强度来鉴别第三抗体群体,因为所述比率提供在第一和第二有机染料的强度之间的荧光强度的不同水平或梯度。可以将生物学样品(例如,组织)与第一,第二和第三抗体接触。各编码的抗体可以结合部分的样品。可以在不同时间点比较样品上不同位置处的荧光强度以鉴别各抗体在样品中和/或上的位置,并且可用于鉴别样品中存在哪种元件和/或在样品中元件在哪里。
[0286]
前述是说明本发明而不应被解释为对其进行限制。尽管已经描述了本发明的一些示例性实施方案,但是本领域技术人员将会容易理解的是,在本质上不背离本发明的新的教导和优点的情况下,在示例性的实施方案中许多修改是可行的。因此,所有这样的修改均意图包括在如在权利要求中所限定的本发明的范围内。因此,应该理解的是,前述是说明本发明而不应被解释为限于所公开的具体实施方案,并且对公开的实施方案的修改以及其他实施方案均意图包括在所附权利要求的范围内。本发明由以下权利要求以及包括在其中的权利要求的等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。